15
3. Technologia wytwarzania półprzewodnikowych struktur
optoelektronicznych
3.2 Podłoże – wymagania
Z definicji epitaksji wynika, że powinny być spełnione poniższe warunki:
•
Struktura krystalograficzna podłoża i warstwy należą do tej samej
grupy przestrzennej, czyli oba materiały krystalizują w tej samej
strukturze.
•
Wymiary komórek elementarnych podłoża i warstwy są do siebie
zbliżone. Dopuszczalna różnica parametrów komórek zależy od
właściwości materiałów (odporności na stres, współczynniki
rozszerzalności termicznej itp.).
Przyjmuje się jednak pewne graniczne wartości różnic zwanych
niedopasowaniem sieciowym , które definiowane jest jako stosunek
różnicy parametru sieci warstwy i parametru sieci podłoża do średniego
parametru warstwy i podłoża:
gdzie:
a
L
- parametr sieci warstwy,
a
S
- parametr sieci podłoża,
a
av
- wartość średnia parametru sieci, a
av
=(a
L
+a
S
)/2.

16
W technice epitaksji z fazy ciekłej LPE:
o
dla ε nie większe niż 10
-3
osadzanie nie powoduje powstawania
nowych defektów w rosnącej warstwie,
o
dla ε nie mniejsze niż 10
-3
w warstwie przejściowej między
podłożem a osadzaną warstwą generowane są dyslokacje lub
utrudnione jest zarodkowanie.
W technikach MOVPE i MBE, w których możliwe jest uzyskanie dużo
wyższych przesyceń niż w LPE, granicą jest ε nie większe niż 10
-1
.
•
Zarodki najchętniej lokują się w miejscach energetycznie najbardziej
korzystnych, tzn. na defektach sieci i zanieczyszczeniach. Mogą to być
zerwane wiązania w krysztale np. stopnie atomowe na powierzchni,
defekty sieci. Ogólnie rzecz biorąc, defekty są odtwarzane przez
rosnąca warstwę. Podłoże powinno być więc możliwie bezdefektowe i
mieć czystą powierzchnię.
•
Konieczna jest stabilność temperaturowa podłoża w temperaturach
epitaksji.
•
Możliwie zbliżone współczynniki liniowej rozszerzalności termicznej
podłoża i warstwy.
•
Stabilność chemiczna podłoża w obecności reagentów.
Odwzorowywane są defekty, a w szczególności defekty śrubowe, na
których proces zarodkowania zachodzi szczególnie chętnie, ze względu na
najniższą potrzebną energię formowania zarodka. Praktycznie rzecz
biorąc zawsze obserwuje się w warstwach epitaksjalnych defekty
śrubowe. Rosną one aż do powierzchni warstwy.
W technikach osadzanie z fazy gazowej często stosowanym zabiegiem
jest użycie podłoży skośnych, tzn. pochylonych. Powierzchnia podłoża
nie ma dokładnej orientacji np. (100) dla GaAs, ale orientację (100) z
odchyłką o 2-4 stopni kątowych w stronę osi [110].
17
Co to daje? Przy takim cięciu monokryształu na powierzchni podłoża
uwidaczniają się stopnie atomowe. Charakteryzują się one zerwanymi,
niewysyconymi wiązaniami chemiczno-krystalicznymi. Osiadające na
powierzchni podłoża aglomeraty np. GaAs czy też pojedyncze atomy galu
lub arsenu migrują po powierzchni (przy sprzyjających warunkach -
odpowiednia temperatura i czas) w stronę krawędzi stopni atomowych i
tam podłączają się do kryształu podłoża. Zarodziowanie, które odbywa się
w ten sposób, przyspiesza wzrost warstwy nawet o rząd.
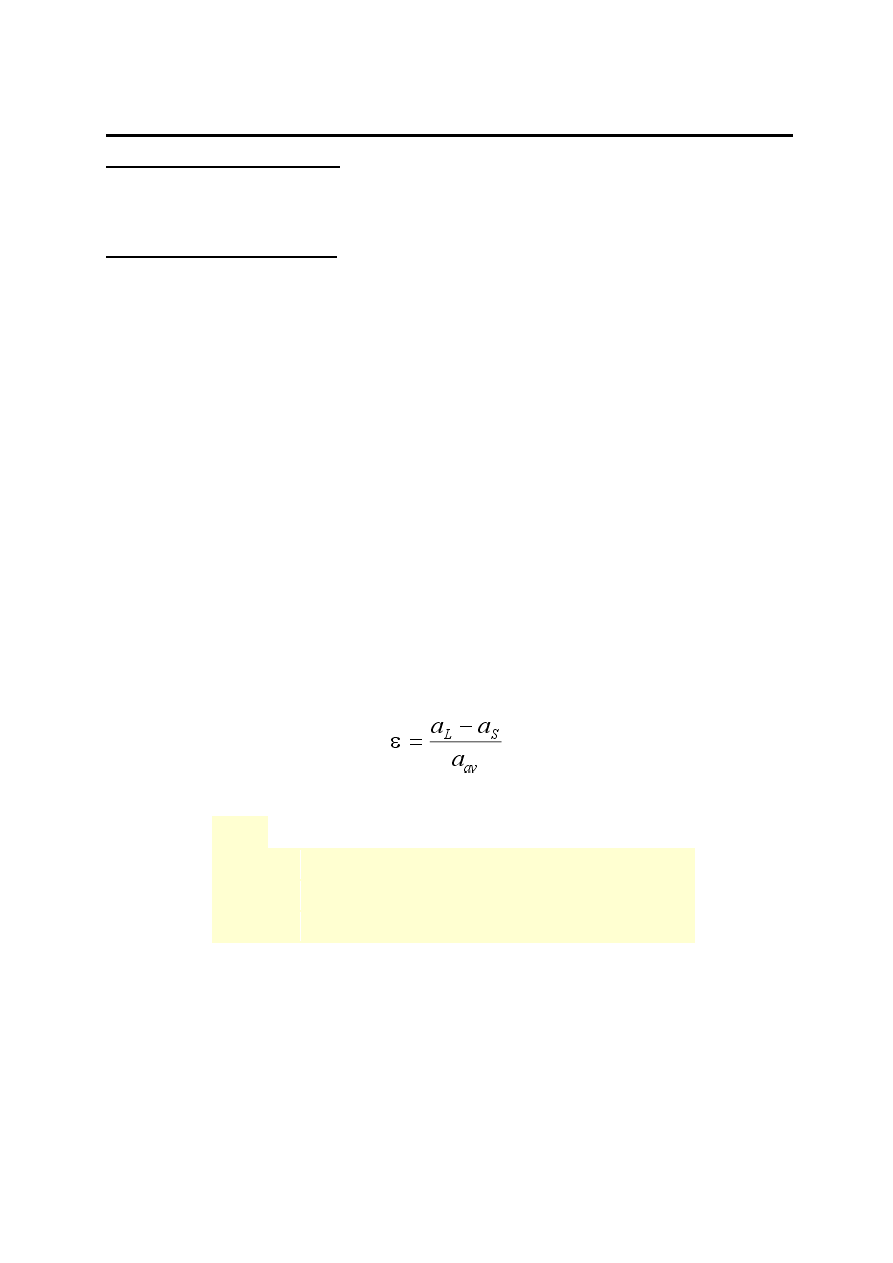
3.5 Epitaksja selektywna oraz epitaksja na profilowanym podłożu
Dla szeregu zastosowań (mikrosystemy, optoelektronika, układy scalone)
potrzebne jest wytworzenie struktur przestrzennych, takich jak np. rowki
(V- i U-rowki), wyspy mesa czy światłowody planarne. Robi się to po to,
aby można było sprzęgać układy mikroelektroniczne z
optoelektronicznymi i mikromechanicznymi, a także z czujnikami
różnego rodzaju.
Na rys. 1 przedstawiono schematycznie procesy selektywnej epitaksji i
epitaksji na profilowanym podłożu. Różnica między tymi technikami
polega na tym, że epitaksja selektywna odbywa się na podłożu
zamaskowanym dielektrykiem i warstwa osadzana jest w oknach, zaś w
przypadku epitaksji na profilowanym podłożu wytrawiane są różne
kształty w podłożu (najczęściej prostokąty). Następnie usuwana jest
maska i warstwa osadzana jest na dnie zagłębienia, na zboczach i na
powierzchni podłoża.
Rys.1. Schematyczne przedstawienie procesu epitaksji selektywnej a) i epitaksji na podłożu
profilowanym b).
18
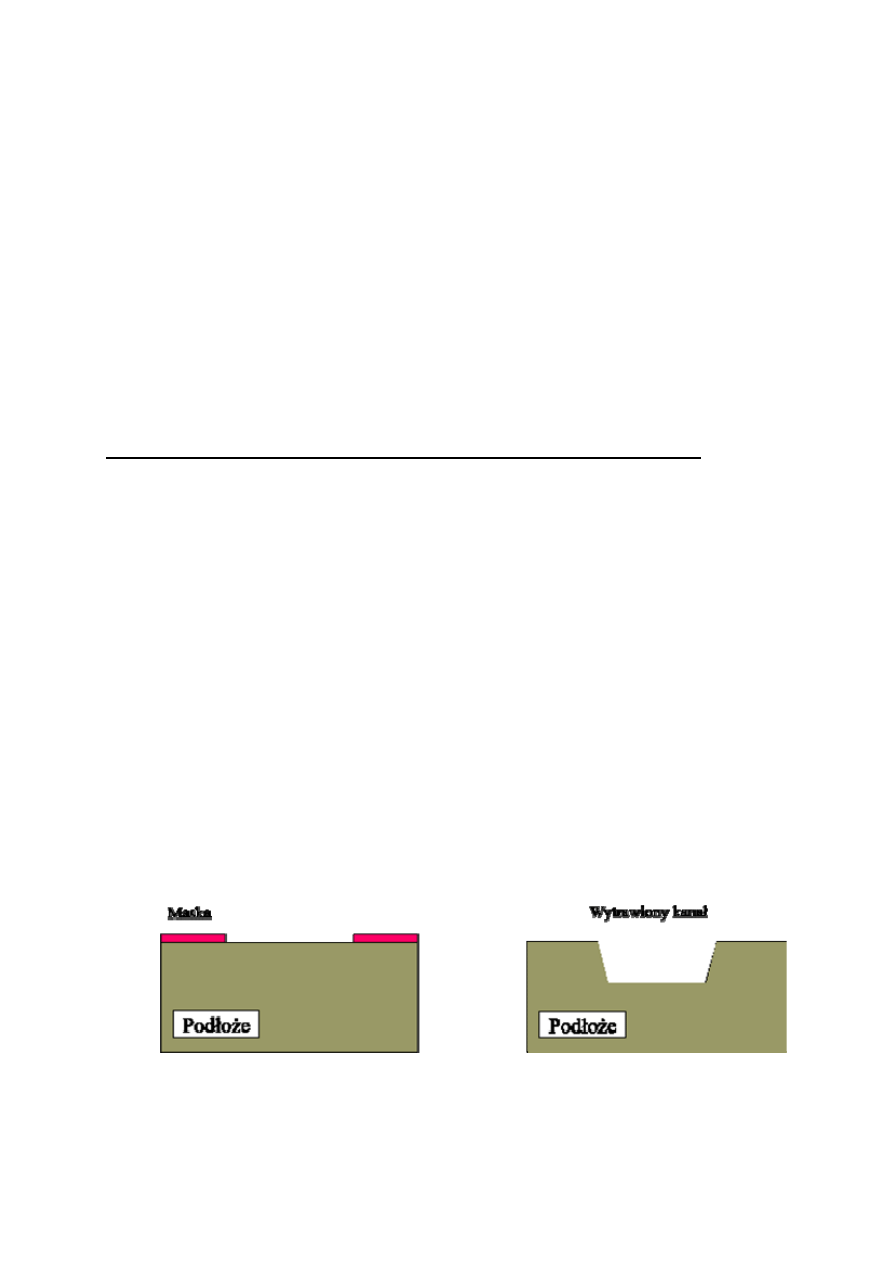
W technice heteroepitaksji stosuje się czasem pewien rodzaj epitaksji
selektywnej - metodę ELOG (Epitaxy Lateral OverGrowth), której zasada
pokazana została na rys. 2. Stosowana ona jest przy osadzaniu warstw
heteroepitaksjalnych o dużym niedopasowaniu do podłoża (duże różnice
stałych sieciowych, inna struktura krystaliczna - typ komórki
elementarnej) i pozwala na zmniejszenie wpływu podłoża na osadzane
warstwy oraz obniżenie koncentracji defektów i dyslokacji śrubowych,
które propagują się od warstwy przejściowej do powierzchni.
Metody osadzania selektywnego lub na podłożu profilowanym
umożliwiają otrzymywanie różnych struktur. Na rys. 3 pokazano metodę
otrzymywania ostrzy z azotku galu do zastosowań w elektronice
próżniowej (zimna emisja polowa - płaskie panele wyświetlaczy). Można
też wytworzyć różnego rodzaju struktury przedstawione na rys. 4 i 5,
które mogą być wykorzystane przy konstrukcjach mikromechanicznych.
Rys.2 Schemat technologii ELOG z zastosowaniem epitaksji selektywnej do wytwarzania
wysokiej jakości warstw epitaksjalnych azotku galu.
Rys.3 Wytwarzanie ostrzy z GaN: schemat procesu wzrostu ostrzy a) i matryca ostrzy b).
19
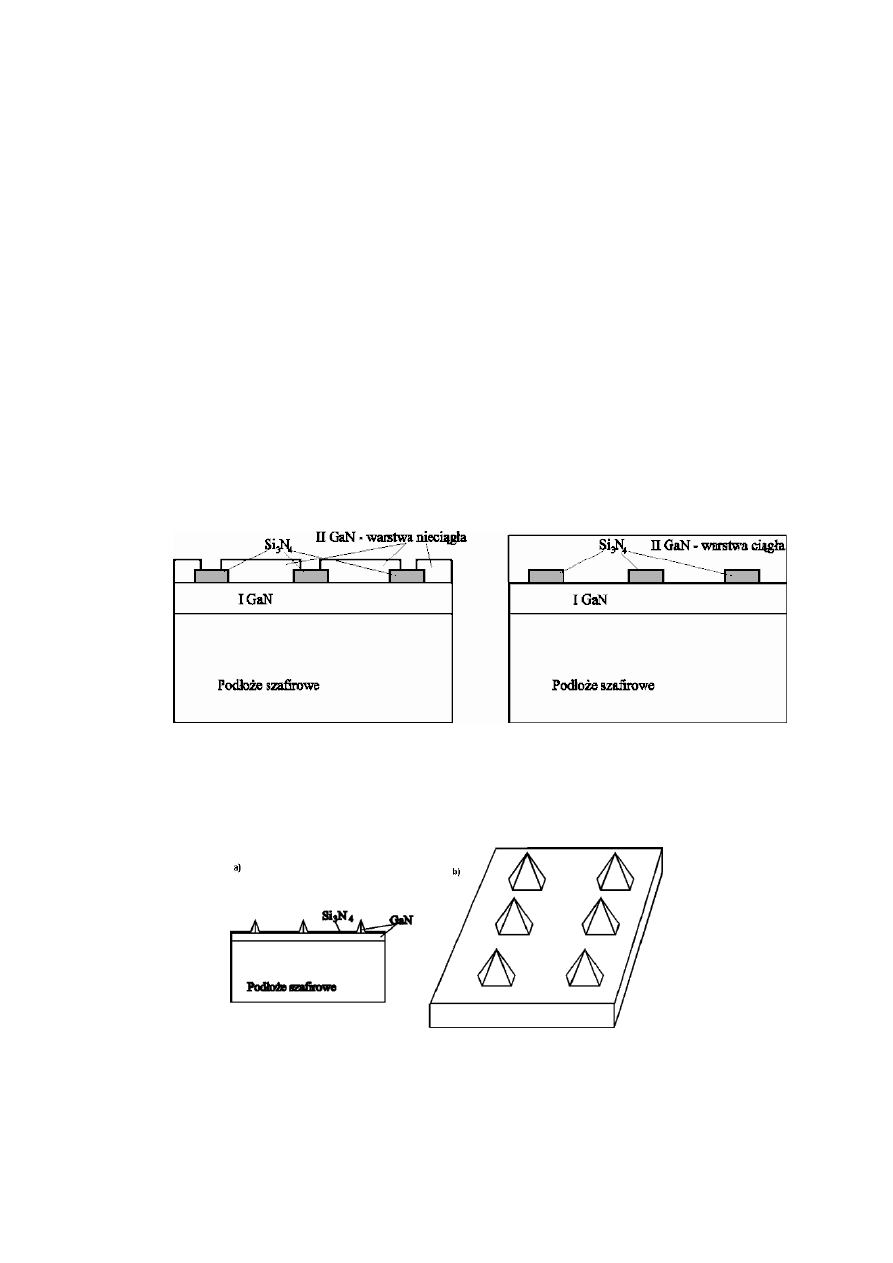
Struktury przedstawione na rys. 4b-e uzyskuje się w następujący sposób:
na podłożu Si osadza się warstwę GaAs, na niej zaś warstwę Al
x
Ga
1-x
As
(0,4<x<1) i znowu GaAs. Za pomocą fotolitografii otwiera się okna w
warstwie GaAs i trawi selektywnie (Al,Ga)As aż do powierzchni krzemu
(rys. 5a). Następnie osadza się dalej GaAs. Można też wykorzystać
właściwości trawionego selektywnie krzemu w układzie jak na rys. 5b.
Uzyskuje się w ten sposób obszary o wymiarach 200x250μm.
Rys.4. Przykłady heterostruktur GaAs/Si osadzanych selektywnie: a) pasek mesa, b) pasek
mesa z podtrawianiem, c) wisząca płaszczyzna z jednym wspornikiem, d) wisząca płaszczyzna
z dwoma wspornikami, e) wisząca płaszczyzna z czterema wspornikami.
Rys.5. Propozycja kroków technologicznych w wytwarzaniu wiszących płaszczyzn.

20
3.6 Techniki epitaksji
Technologie osadzania warstw epitaksjalnych krzemu i związków AIIIBV
są drogie i wymagają stosowania skomplikowanej aparatury. Jednakże w
wielu przypadkach epitaksja jest jedyną metodą umożliwiającą uzyskanie
struktury, w której można wytworzyć przyrządy półprzewodnikowe o
żądanych parametrach.
Większość przyrządów półprzewodnikowych wykonywana jest z krzemu.
Są jednak takie dziedziny elektroniki, w których niezbędne jest
stosowanie półprzewodników AIIIBV np.: mikrofalowe systemy
komunikacyjne, systemy radarowe i nawigacji mikrofalowej, mikrofalowe
urządzenia pomiarowe i kontrolne, źródła promieniowania świetlnego (w
tym również pasmo podczerwieni i ultrafioletu) - LED-y i lasery, oraz
detektory promieniowania.
Przez pojęcie techniki epitaksjalnej rozumieć należy proces wzrostu
monokrystalicznej warstwy półprzewodnika na monokrystalicznym
podłożu, w kierunku krystalograficznym, zgodnym z orientacją podłoża.
Wzrastająca warstwa przedłuża strukturę kryształu podłoża - stąd termin
epitaksjalny, który wywodzi się z greckiego epi - na i taksis -
uporządkowanie. Odwzorowywana jest struktura podłoża - orientacja
przestrzenna podłoża, kształt i wielkość komórki elementarnej
(homoepitaksja). Przy krystalizacji innego materiału niż materiał podłoża
(przypadek heteroepitaksji) może zachodzić przejściowa deformacja
komórki - na obszarze od kilku do kilkudziesięciu stałych sieciowych.
Materiał epitaksjalny osadzany jest w temperaturze znacznie niższej niż
temperatura topnienia tego materiału. Zmniejsza to ilość zanieczyszczeń
w warstwie epitaksjalnej.
Ogólnie rzecz biorąc wyróżnia się 4 główne techniki epitaksjalne (istnieje
ich więcej, ale są to raczej modyfikacje tych czterech):
•
LPE - Liquid Phase Epitaxy - epitaksja z fazy ciekłej,
•
VPE - Vapor Phase Epitaxy - epitaksja z fazy gazowej,
•
MBE - Molecular Beam Epitaxy - epitaksja z wykorzystaniem
wiązek molekularnych,
•
MOVPE - Metal Organic Vapor Phase Epitaxy - epitaksja z fazy
gazowej z wykorzystaniem związków metaloorganicznych.
21
3.6.1 LPE
Metoda epitaksji z fazy ciekłej polega w skrócie na:
•
wytworzeniu roztworu osadzanego materiału w rozpuszczalniku
(np. GaAs w galu),
•
homogenizacji roztworu (od 7-8 godzin do kilkudziesięciu godzin),
•
zalaniu podłoża nasyconym roztworem (stopem),
a następnie
•
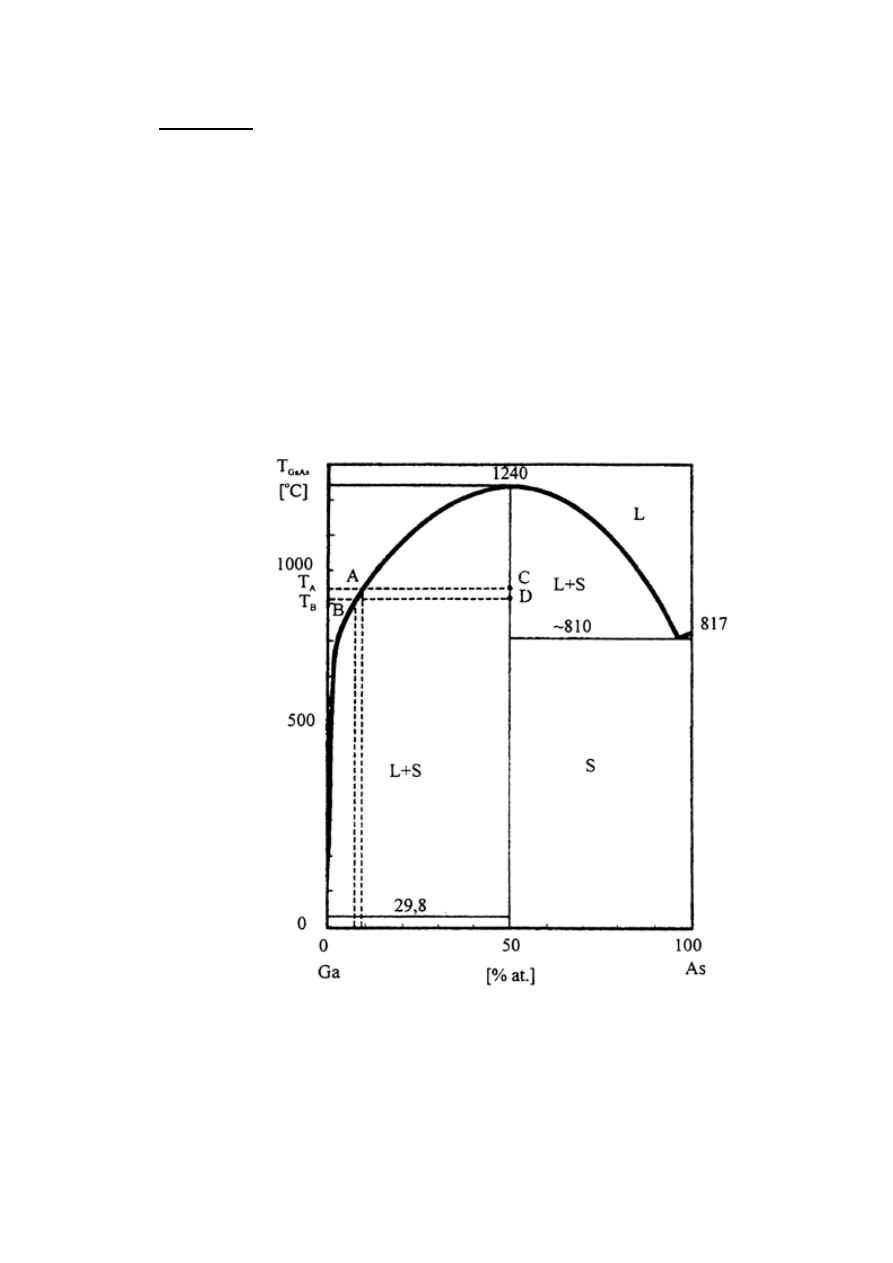
osiągnięciu przesycenia.
Rys. 1: Diagram fazowy układu podwójnego Ga-As.
22
Przesycenie osiąga się poprzez wytworzenie gradientu temperatury.
Powolne obniżanie temperatury (rzędu 0,1K/min.) powoduje zmniejszenie
rozpuszczalności materiału rozpuszczonego w rozpuszczalniku. Dzięki
temu następuje zmiana fazy - część substancji rozpuszczonej przechodzi z
roztworu do fazy stałej i np. krystalizuje na podłożu.
W technice LPE występuje zjawisko segregacji materiału, dzięki któremu
zanieczyszczenia wbudowują się w dużo mniejszym stopniu niż w innych
technikach.
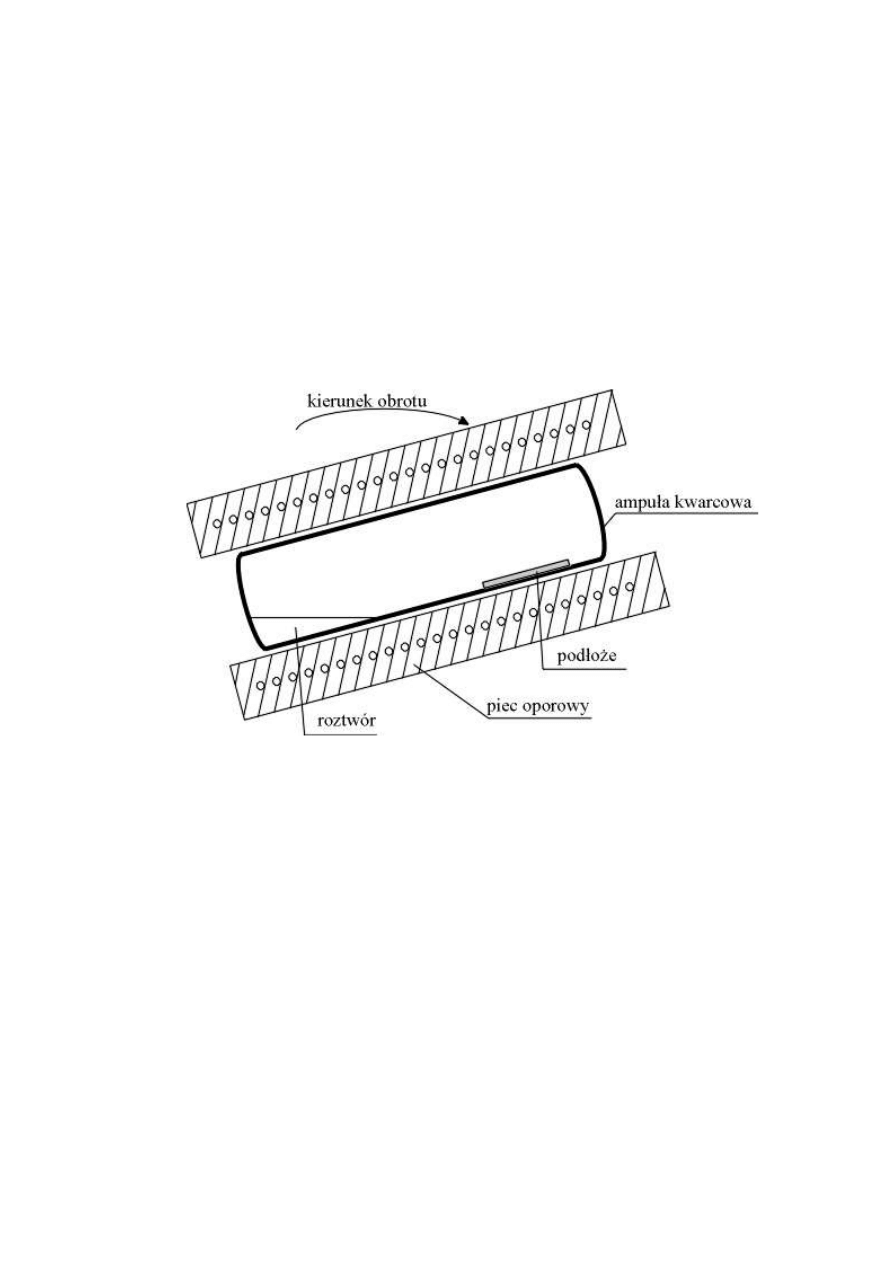
Rys.2. Prosty układ poziomy (przechylany) osadzania warstw epitaksjalnych w technice LPE.
W technice tej uzyskuje się bardzo wysokiej jakości warstwy epitaksjalne:
mała ilości defektów strukturalnych i zanieczyszczeń, ostra granica
metalurgiczna. Proces osadzania zachodzi w warunkach zbliżonych do
równowagowych. Ograniczeniem tej techniki osadzania jest mała
powierzchnia efektywna związana z efektem krawędziowym wzrostu i
niemożliwość uzyskania warstw supersieci i studni kwantowych. Metoda
czuła termicznie. Jest to metoda fizyczna otrzymywania struktur
epitaksjalnych.
Technika ta jest obecnie rzadko stosowana. (Szersze omówienie w [1]).
23
3.6.2 VPE
Do wytwarzania struktur epitaksjalnych AIIIBV stosuje się metodę
wodorkową i
chlorkową (halogenkową). Technikę tę stosuje się
praktycznie tylko do otrzymywania związków galu. W technice tej jako
źródło galu stosuje się metaliczny gal.
Metoda wodorkowa HVPE.
Nazwa metody wywodzi się ze stosowania jako źródła pierwiastków V
grupy układu okresowego wodorków (np. arsenu AsH
3
czy fosforu PH
3
lub amoniaku NH
3
) [2].
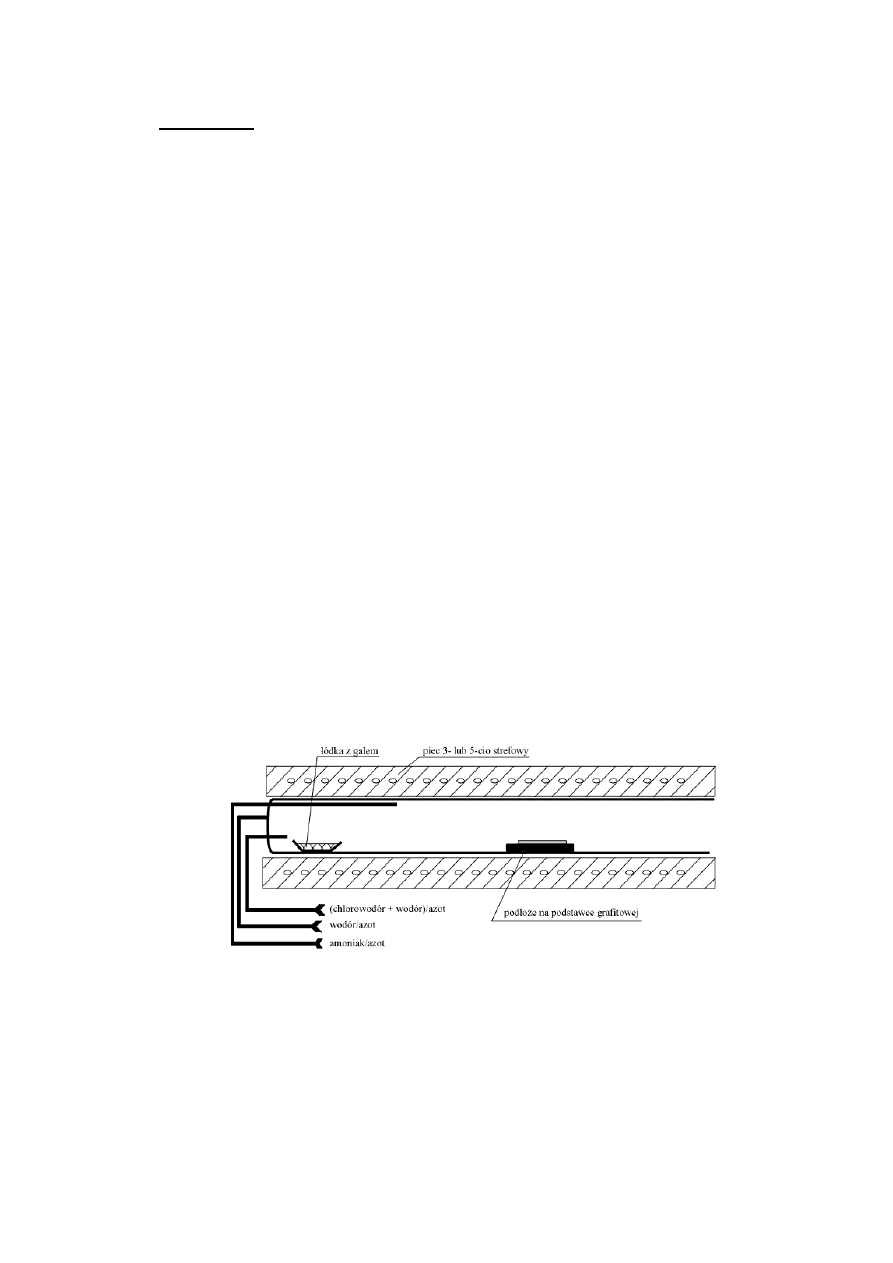
Technika ta zostanie omówiona na przykładzie stanowiska do
otrzymywania warstw GaN (rys.3). Stosowane są stosunkowo proste
stanowiska technologiczne - 3- lub 5-cio strefowy piec oporowy, trzy linie
gazowe. Łódka kwarcowa zawierająca metaliczny gal (chlorator) znajduje
się w strefie co najmniej 850°C - po przepuszczeniu nad galem gazowego
HCl rozcieńczonego wodorem powstaje lotny monochlorek galu, który
transportowany jest do strefy osadzania. Po drodze miesza się on z
amoniakiem. W wysokich temperaturach monochlorek galu i amoniak
ulegają rozpadowi. W strefie osadzania (temperatura ok. 1000-1050°C)
atomowy azot i atomowy gal łączą się i osadzają m.in. na podłożu (np.
szafirowym).
Rys.3. Schemat stanowiska HVPE do otrzymywania warstw GaN. Azot używany jest jako gaz
płuczący w czasie postoju, załadunku i rozładunku reaktora. Wodór jest gazem nośnym
używanym w czasie procesu.
24
Metoda chlorkowa.
Główna różnica między metodą wodorkową a chlorkową polega na
stosowaniu w metodzie chlorkowej jako źródła pierwiastków V grupy
układu okresowego gazowych związków arsenu lub fosforu: AsCl
3
i PCl
3
.
Metoda ta była rzadziej stosowana niż metoda wodorkowa.
Jest to metoda chemiczna otrzymywania warstw epitaksjalnych. Metoda
czuła termicznie. Występują tu stosunkowo duże szybkości osadzania.
Osadzać można tylko te pierwiastki, których związki udało się
przeprowadzić w stan gazowy - otrzymuje się proste związki
półprzewodnikowe typu GaAs czy GaP.
Technika VPE po latach zapomnienia przeżywa renesans związany z
możliwością stosunkowo łatwego otrzymywanie grubych warstw azotku
galu (10 - 500 m), które używane są (na razie na skalę laboratoryjną)
jako podłoża do epitaksji struktur związków azotków grupy III układu
okresowego o stosunkowo małej ilości defektów.
3.6.3 MBE
MBE (Molecular Beam Epitaxy - epitaksja z wiązek molekularnych) jest
bardzo wyrafinowaną techniką osadzania cienkich warstw [3, 4].
Umożliwia ona osadzanie bardzo cienkich warstw rzędu nm o ściśle
określonym składzie chemicznym i precyzyjnym rozkładzie profilu
koncentracji domieszki. Możliwe jest to dzięki doprowadzaniu do podłoża
składników warstwy oddzielnymi wiązkami molekularnymi. Całość
procesu odbywa się w komorze ultrawysokiej próżni (Ultra High Vacuum
- UHV) - ciśnienie rzędu 10
-9
Pa. Typowe stanowisko MBE wyposażone
jest w efuzyjne komórki Knudsena ze źródłami pierwiastków i związków
z indywidualnymi mechanicznymi przesłonami oraz w RHEED.
W metodzie tej wykorzystuje się głównie zjawiska fizyczne w celu
otrzymania warstw epitaksjalnych.
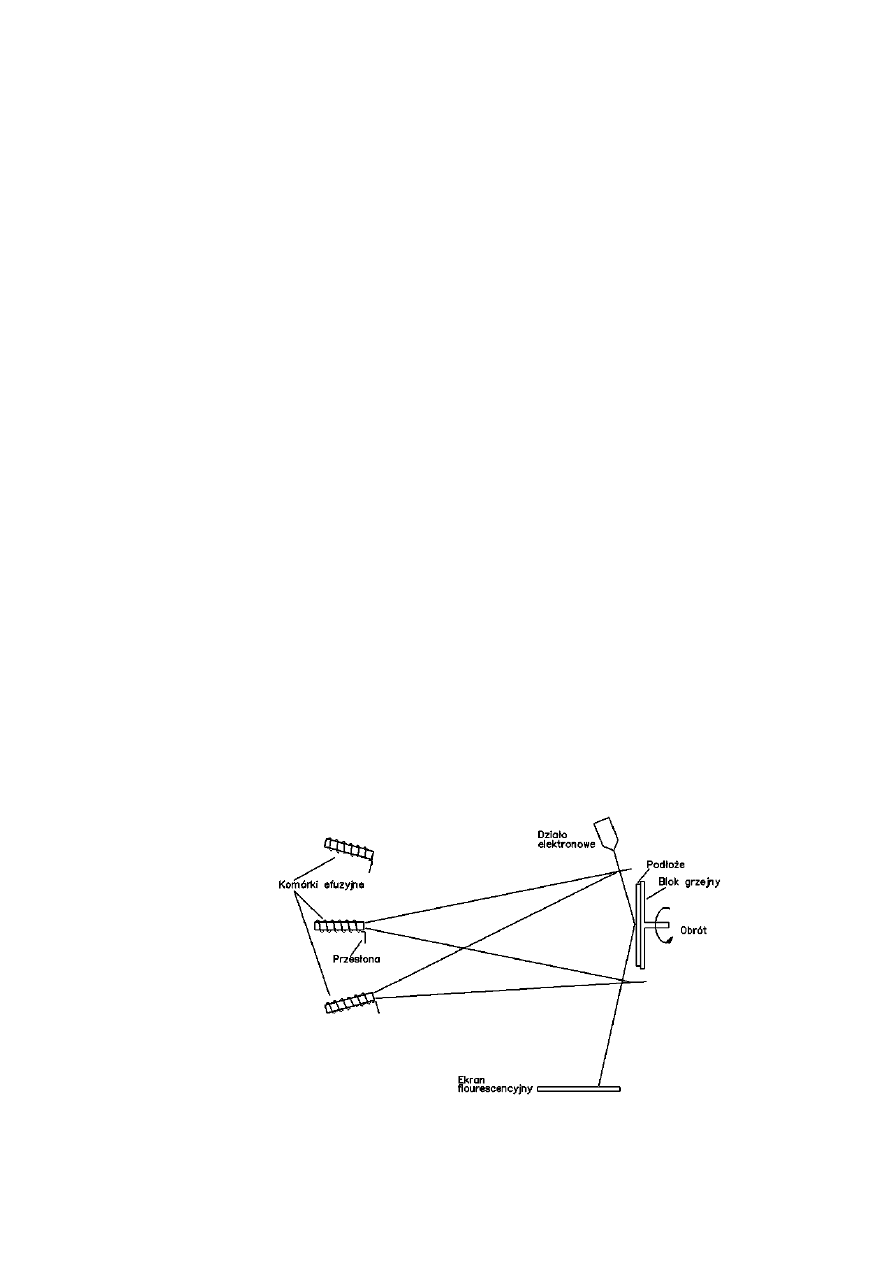
25
Blok grzejny podłoża.
Blok grzejny podłoża spełnia dwie ważne funkcje: pozycjonuje podłoże
na przecięciu się różnych wiązek molekuł i atomów oraz ogrzewa go do
temperatury wzrostu warstw. Blok może być obracany i pochylany. W
typowych zastosowaniach blok grzejny ma temperaturę rzędu 200÷700°C.
Temperatura podłoża jest parametrem, za pomocą którego sterujemy
kinetyką wzrostu warstw. Właściwa temperatura powoduje, że docierające
do podłoża atomy mają wystarczającą energię do dyfuzji po jego
powierzchni i znalezienia odpowiedniego miejsca w krystalizującej
warstwie. Bloki wykonywane są z molibdenu lub tantalu. Podłoże jest
dostarczane do bloku zdalnie poprzez śluzę w celu uniknięcia
zanieczyszczenia bloku.
Komórki efuzyjne źródeł.
Komórki efuzyjne, wykonane najczęściej z pirolitycznego azotku boru
(PBN), umożliwiają otrzymywanie atomowych lub molekularnych wiązek
składników osadzanej warstwy, które są kierowane na grzane podłoże.
Komórki są grzane radiacyjnie przez grzejniki elektryczne z regulacją
temperatury z dokładnością lepszą niż ± 0,1K. Są one termicznie
odizolowane od reszty aparatury dyszami chłodzonymi ciekłym azotem,
które poza tym kolimują wiązkę. Jednocześnie kriopompowanie i
termiczna izolacja od reszty urządzenia minimalizuje odgazowanie.
Każda komórka ma własną przesłonę mechaniczną umożliwiającą jej
otwarcie lub zamknięcie. Typowe komórki mogą osiągnąć temperaturę
rzędu 1600°C, a w wykonaniach specjalnych do 2000°C.
Schematyczne przedstawienie systemu MBE [3].

26
Temperatura źródła zależy od rodzaju materiału i żądanego stężenia
reagentu. Komórki efuzyjne zapewniają stabilną szybkość parowania
(rzędu 1%) przez okres wielu godzin. Stabilność ta jest wymagana ze
względu na skład i grubość warstw.
Metale trudno topliwe (np. wolfram, tantal czy niob) parowane są przy
pomocy działa elektronowego.
Przesłony mechaniczne.
Indywidualne przesłony mechaniczne pozwalają na sterowanie
transportem masy do podłoża. Wykonywane są one z materiałów trudno
topliwych, muszą jednocześnie być lekkie, aby możliwe było szybkie i
dokładne odsłonięcie lub zasłonięcie wylotu źródła oraz odporne
mechanicznie - przy wzroście złożonych struktur konieczne jest częste
(nawet setki razy w jednym procesie osadzania) cykliczne otwieranie i
zamykanie przesłon.
System pompowy UHV.
System pompowy UHV jest niezbędny w celu uzyskania wysokiej próżni
w komorze reakcyjnej, m.in. aby zminimalizować ilość zanieczyszczeń
tła. Typowe ciśnienie przy podłożu podczas parowanie jest rzędu 10
-3
÷10
-
2
Pa. Przy osadzaniu warstw półprzewodnikowych konieczne jest
zachowanie poziomu elektrycznie aktywnych zanieczyszczeń poniżej 0,1
ppm (tzn. ~10
16
cm
-3
), a powinno być poniżej 1 ppb (tzn. ~10
14
cm
-3
). Aby
spowodować takie odpompowanie zanieczyszczeń tła gazowego w
komorze roboczej MBE, konieczne jest uzyskanie próżni rzędu 10
-9
Pa
(poziom ppm) i rzędu 10
-12
Pa (poziom ppb). Poziom koncentracji
zanieczyszczeń w warstwach rzędu 10
14
cm
-3
jest granicznym osiągalnym
poziomem w nowoczesnych stanowiskach MBE.
Tzw. "czystą próżnię" uzyskuje się dzięki pompom turbomolekularnym i
jonowym. Wspomagające pompowanie odbywa się dzięki chłodzonym
ciekłym azotem sublimatorom tytanowym i kriopanelom.

27
RHEED.
Piątym, dosyć ważnym i często stosowanym, elementem stanowiska MBE
jest urządzenie do dyfrakcji odbiciowej elektronów o dużych energiach
(RHEED). Umożliwia ono kontrolę in-situ szybkości wzrostu i jakości
krystalicznej warstwy. Można śledzić rekonstrukcję powierzchni podczas
wzrostu (in situ).
RHEED jest często sprzężony z komputerem sterującym otwieraniem i
zamykaniem przesłon komórek efuzyjnych. Uzyskuje się wtedy bardzo
płaskie powierzchnie warstw epitaksjalnych.
Typowe szybkości osadzania warstwy nie przekraczają 20 nm/min., a z
reguły są dużo mniejsze - rzędu kilku nm/min.
Rozwijają się też nowe techniki takie jak np. MOMBE (Metalorganic
MBE), GSMBE (Gas Source MBE). Główna różnica polega na
zastąpieniu wszystkich (lub części) źródeł tradycyjnych źródłami
zawierającymi związki metaloorganiczne. Dodatkowo wprowadza się
czasem niskoenergetyczną implantację jonową (podczas wzrostu
warstwy), atmosferę zjonizowanego wodoru (uzyskiwanie warstw typu p)
czy promieniowanie świetlne (stymulacja rozpadu reagentów - nie ma
wtedy potrzeby przełączania zaworów czy otwierania lub zamykania
przesłony) [3,4,5].
28
3.6.4 MOVPE
MOVPE (Metal Organic Vapor Phase Epitaxy - epitaksja z fazy gazowej
z użyciem związków metaloorganicznych) zwane również MOCVD
(Metal Organic Chemical Vapor Deposition - osadzanie z par
chemicznych związków metaloorganicznych) jest techniką epitaksjalną,
polegającą na osadzaniu warstw ze związków metaloorganicznych, przy
czym reagenty znajdują się w fazie gazowej. Osadzanie zachodzi przy
ciśnieniu atmosferycznym lub obniżonym (LPMOVPE) do 70 ÷ 100 Tr
(w obu przypadkach w systemie rury otwartej). Minimalne szybkości
wzrostu warstw są rzędu kilku nm/min., zaś najczęściej stosowane to 15 ÷
25 nm/min.
MOVPE jest w odróżnieniu od MBE metodą chemicznego wytwarzania s
truktur
epitaksjalnych.
W przypadku epitaksji związków AIIIBV źródłami pierwiastków III
grupy układu okresowego są związki metaloorganiczne (związki
alkilowe), a pierwiastków V grupy - halogenki pierwiastków tej grupy
(najczęściej wodorki) bądź ich mieszaniny z analogicznymi związkami
metaloorganicznymi. Czasami stosowane są także samodzielnie
występujące związki metaloorganiczne pierwiastków grupy V.
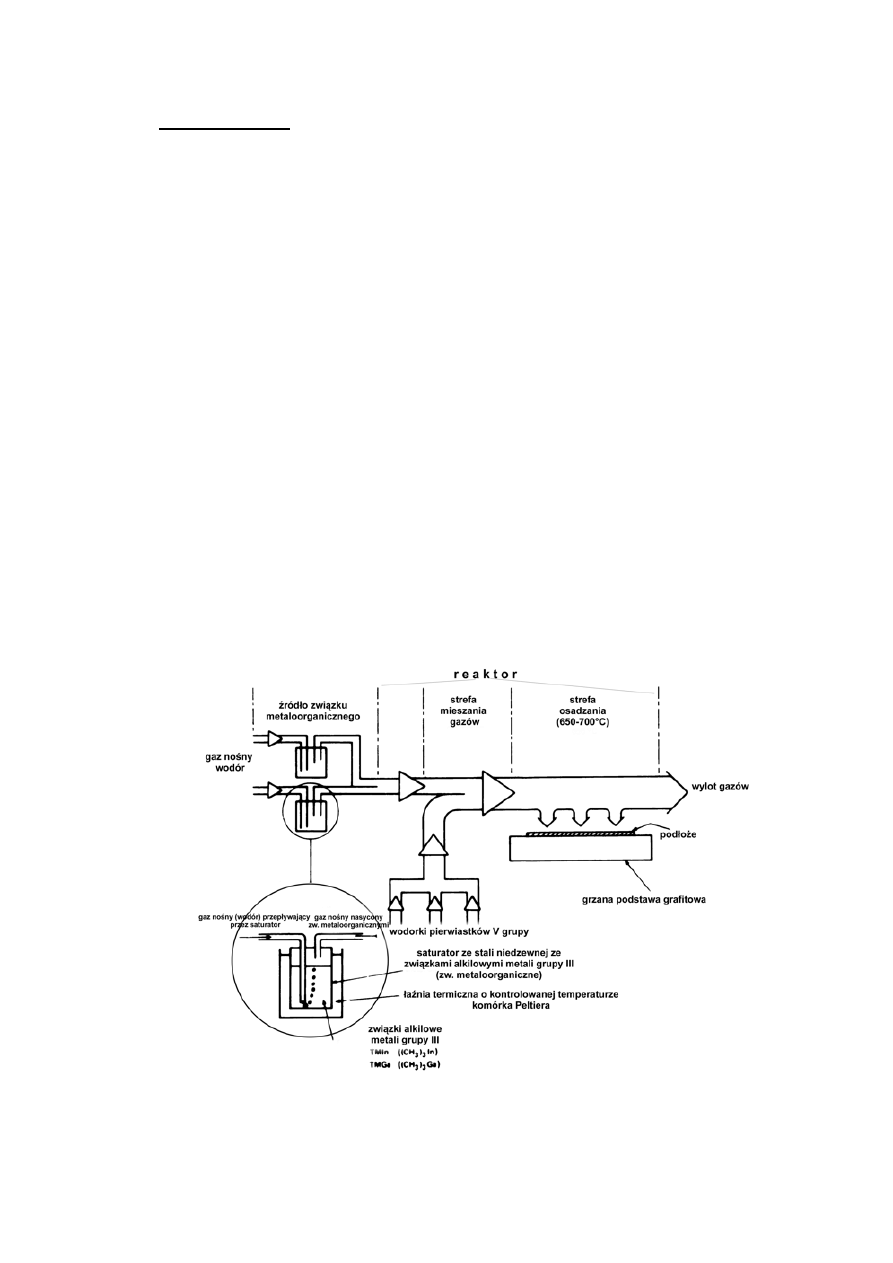
Schematyczne przedstawienie systemu MOVPE.

29
Gaz nośny (najczęściej wodór) przepływając przez saturator nasyca się
parami związku metaloorganicznego, których stężenie określone jest
temperaturą saturatora i transportuje te opary do reaktora. Tu dostarczane
są także wodorki V grupy oraz (ewentualnie) domieszki. Jednorodna
mieszanina gazów ulega w wysokiej temperaturze pirolizie i dochodzi do
grzanego podłoża w postaci atomów lub cząsteczek osadzanej substancji,
które są wiązane na jego powierzchni.
Reakcję chemiczną, opisującą proces osadzania warstwy można
przedstawić ogólnie w następujący sposób:
AR
3(g)
+ BH
3(g)
AB
(s)
+ 3RH
(g)
(1)
gdzie:
AR
3
- związek metaloorganiczny pierwiastka III grupy,
BH
3
- wodorek pierwiastka V grupy.
Związki metaloorganiczne grupy III układu okresowego to najczęściej
metylki lub etylki, np.:
TMGa - trójmetylek galu, TEGa - trójetylek gal.
W reaktorze proces przebiega zgodnie z reakcją (1) w warunkach dalekich
od równowagi chemicznej, to znaczy, że dla typowych jego parametrów
może zachodzić jedynie osadzanie.
Jest to bardzo istotna różnica w porównaniu z LPE - techniką quasi-
równowagową, gdzie zachodzi równocześnie osadzanie i rozpuszczanie
warstwy, a wynikowy kierunek i szybkość procesu silnie zależą od
temperatury. Kinetyką wzrostu w technice MOVPE jest stosunkowo łatwo
sterować. Jest ona względnie mało czuła na zmiany temperatury procesu
(dopuszczalne wahania ± 5K).
Skład fazy stałej, w stosowanych powszechnie warunkach wzrostu,
makroskopowo regulowany jest przez sterowanie stosunkami ciśnień
cząstkowych związków metaloorganicznych i wodorków w reaktorze.
Mikroskopowo, od strony zjawisk fizykochemicznych zachodzących w
otoczeniu podłoża, skład osadzanej warstwy jest określony dyfuzją
cząstek przez przygraniczny obszar fazy gazowej. Tak więc współczynnik
segregacji większości stosowanych składników jest zbliżony do jedności
i jest praktycznie niezależny, w stosowanym zakresie parametrów, od
temperatury. Fakt ten umożliwia w prosty sposób osadzanie i sterowanie
składem związków potrójnych i poczwórnych AIIIBV, podczas gdy np. w

30
LPE współczynnik segregacji Al jest tak duży, że niemożliwe jest
uzyskanie jednorodnych pod względem składu warstw (Al,Ga)As.
Technika MOVPE jest mniej skomplikowana pod względem realizacji
aparaturowej od klasycznej VPE. Wymagany jest przede wszystkim
szczelny reaktor i grzanie indukcyjne lub radiacyjne (lampy halogenowe)
grafitowej podstawy podłoża. Mała czułość na zmiany temperatury
procesu, łatwość sterowania składem osadzanej warstwy oraz możliwość
otrzymywania jednorodnych struktur na dużych powierzchniach,
zadecydowały o tym, że w technologii MOVPE stosunkowo prosto można
otrzymać wielowarstwowe heterostruktury o pożądanych parametrach, aż
do wielokrotnych studni kwantowych włącznie.
Powyższe zalety MOVPE oraz jakość warstw niewiele ustępująca w wielu
przypadkach jakości warstw otrzymywanych w urządzeniach MBE,
spowodowały znaczny wzrost nakładów na badania związków
metaloorganicznych, które są stosowane do otrzymywania warstw
epitaksjalnych. Wadą MOVPE jest toksyczność i wybuchowość
związków chemicznych i gazów oraz możliwość niezamierzonego
domieszkowania warstw węglem.
Mechanizm wzrostu warstw epitaksjalnych.
Proces epitaksjalnego nanoszenia warstw techniką MOVPE opisany
zostanie na przykładzie grupy związków najczęściej stosowanych
do otrzymywania GaAs. Zjawiska tam występujące są
charakterystyczne również dla innych reagentów [6,7,8].
Mechanizm rozpadu związków metaloorganicznych w obecności
podłoża w wysokiej temperaturze nie został dotąd do końca
wyjaśniony. W celu jego poznania prowadzone są badania kinetyki
procesu [np. 4-6], które umożliwiają określenie kolejności
następujących po sobie reakcji oraz wyznaczenie stałych szybkości
reakcji, zachodzących pomiędzy związkami wyjściowymi w danym
procesie. Stężenia reagentów i produktów reakcji są określane
liczbowo metodą spektroskopii mas lub spektroskopii w
podczerwieni.

31
Na podstawie wielokrotnie powtarzanych doświadczeń wyznacza
się stałą szybkości reakcji k z prawa Arrheniusa:
k = A·exp(-E
a
/RT)
gdzie:
E
a
-energia aktywacji reakcji,
A -współczynnik reakcji.
Na rysunku poniżej przedstawiono rezultaty badań stabilności różnych
cząsteczek, wykorzystywanych w MOVPE jako związki wyjściowe [6]. Z
przedstawionej zależności widać, że:
•
związki etylu pierwiastków grupy III są mniej stabilne niż związki
metylu,
•
wodorki rozpadają się przy stosunkowo wysokich temperaturach.
Konwersja w funkcji temperatury dla kilku związków źródłowych stosowanych w MOVPE.
Doświadczenie prowadzono z każdym związkiem osobno w atmosferze wodoru [6].
W cząsteczkach metal-grupa metylowa pierwszy etap procesu rozpadu
polega na oderwaniu całej grupy metylowej. Zerwaniu wiązania metal-
alkil towarzyszy powstanie wolnych rodników (tj. cząsteczek z jednym
niesparowanym elektronem). Rodniki takie są, oczywiście, wysoko
reaktywne i biorą udział w dalszych reakcjach łańcuchowych. Na
przykład w przypadku TMGa, reakcja rozkładu cząsteczki metal-grupa
organiczna przebiega kilkuetapowo:
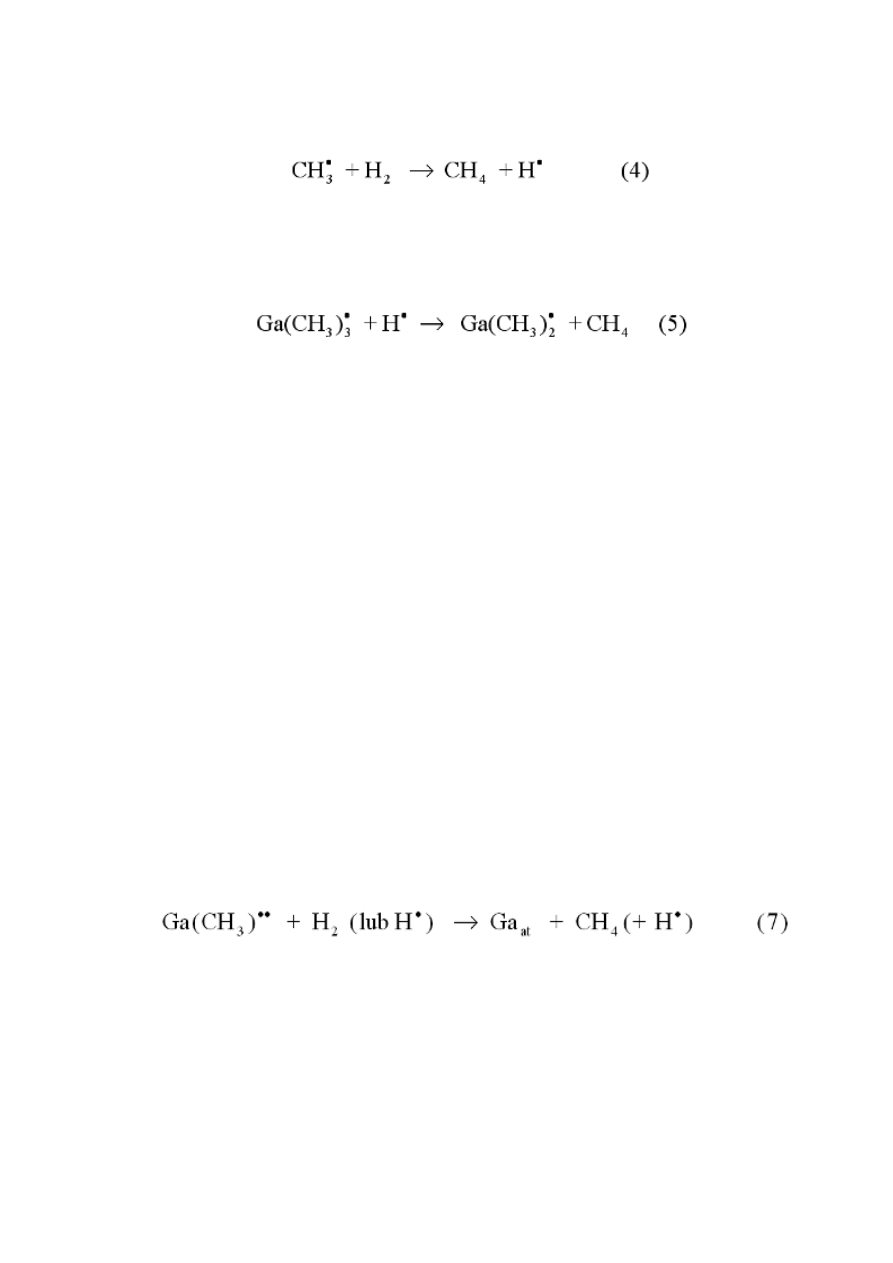
32
Jeśli gazem nośnym jest wodór zachodzi reakcja (4):
W wyniku jej powstają cząsteczki metanu i rodniki wodoru.
Zaobserwowano, że rodniki wodorowe powstające w wyniku reakcji (4)
są odpowiedzialne także za rozpad TMGa zgodnie z reakcją:
Reakcja (5) zachodzi równolegle z (2), co powoduje zwiększoną szybkość
rozpadu TMGa w obecności wodoru. Tak więc rozpad ten następuje przy
niższych temperaturach (pomiędzy 380°C a 450°C). W atmosferze azotu
rozkład TMGa obserwuje się tylko w temperaturach powyżej 500°C.
Z badań wynika także, że ze wzrostem temperatury rośnie stosunek CH
4
/
TMGa (CH
4
/ TMGa ≥ 3 w temperaturach wyższych niż 465°C).
Reakcję rozpadu TMGa w wodorze można zatem zapisać w następujący
sposób:
2Ga(CH
3
)
3
+ 3H
2
→ 2Ga + 6CH
4
(6)
Oznacza to, że reakcja (4) jest niezbędna do uwolnienia galu z ostatniej
grupy metylowej. Wynika stąd, że wodór, stosowany jako gaz nośny,
odpowiada również za końcowy etap rozpadu TMGa.
Okazuje się, że całkowita energia aktywacji rozpadu TMGa jest mniejsza
niż energia dysocjacji monometylku galu (ok. 82 kcal/mol). Dlatego
ostatni etap rozpadu (demetylacji) TMGa powinien być zapisany w
postaci:
Energia aktywacji rozpadu w tym przypadku jest mniejsza niż 60
kcal/mol. Czynnikiem ograniczającym szybkość przebiegu reakcji
rozpadu TMGa pozostaje reakcja (2) - odpowiedzialna za oderwanie
pierwszej grupy metylowej.

33
Spektroskopia absorpcyjna nie wykazała w fazie gazowej produktów
rozpadu TMGa obecności atomów galu. Nie wiadomo zatem, czy
pojawienie się atomów Ga z TMGa na drodze homogenicznej ma
faktycznie miejsce w fazie gazowej czy na powierzchni wzrostu. Nie
stwierdzono wzrostu szybkości reakcji przy zwiększeniu powierzchni
wzrostu. Oznacza to, że katalityczna reakcja powierzchniowa nie stanowi
również decydującego czynnika w procesach rozkładu.
Stwierdzono jednoznacznie, że stosowanie małych wartości stosunków
V/III (mniejszych niż 40) powoduje wbudowywanie się węgla w warstwę
epitaksjalną i otrzymanie domieszki typu p na poziomie do k·10
16
cm
-3
.
Znaczące zanieczyszczenia mogą wnosić do warstw epitaksjalnych
(otrzymywanych tą metodą): krzem, german, cynk i tlen.
W publikacjach np. Stringfellowa [7] stwierdzono, że:
•
Szybkość wzrostu warstwy epitaksjalnej GaAs jest liniowo zależna od
stężenia TMGa (AsH
3
powinien występować w nadmiarze).
•
Szybkość wzrostu jest niezależna od temperatury, jeśli jej wartość
mieści się w zakresie od 650 do 775°C. Przy wyższych temperaturach
obserwuje się spadek tej szybkości.
•
Gdy ciśnienie w reaktorze wynosi około 100 Tr, to proces wzrostu nie
zależy od temperatury i koncentracji stosowanego w nadmiarze AsH
3
.
Na podstawie powyższych danych oraz analizy termodynamicznej
zbudowano model epitaksjalnego wzrostu warstwy uwzględniający
mechanizm Langmuira-Rideala [6]. Zakłada on, że wolne rodniki metylku
galu docierają do powierzchni narastającego materiału i dopiero tam
wchodzą w reakcję z zaadsorbowanym w warstwie przypowierzchniowej
arsenem.
Większość obserwowanych reakcji miała charakter heterogeniczny,
zachodziła zgodnie z mechanizmem Langmuira-Hinshelwooda. Całości
towarzyszyło stopniowe uwalnianie się cząsteczek metanu. Zauważono
także, że produkty pośrednie Ga(CH
3
)
2
i AsH
3
katalizują dalsze procesy
rozkładu TMGa i AsH
3
. Dalsze badania wykazały, że TMGa rozpada się
w temperaturze powyżej 500°C i jego obecność przyśpiesza rozkład
AsH
3
.

34
Zależność szybkości wzrostu od temperatury procesu [6].
Badania mechanizmu wzrostu GaAs wykonano w zakresie temperatur od 450
do 1050°C. Na rys. 7 przedstawiono zależność szybkości wzrostu GaAs od
temperatury podłoża GaAs o orientacji (100). Wyróżnić można tu trzy
podzakresy:
•
podzakres T < 600°C.
W zakresie niskotemperaturowym szybkość osadzania silnie zależny
od temperatury (energia aktywacji wynosi około 80 kJ/mol).
Stwierdzono, że:
o
w temperaturach niższych niż 600°C szybkość osadzania rośnie
wolniej niż liniowo wraz ze wzrostem stężeń TMGa i AsH
3
.
Zjawisko to tłumaczy model Langmuira-Hinshelwooda
(adsorpcja obu rodzajów cząsteczek zachodzi w większym
stopniu niż ich reakcja na podłożu),
o
energia aktywacji procesu wzrostu nie zależy od właściwości
chemicznych atomów grupy III i V. Natomiast jej wartość
wyznaczona doświadczalnie odpowiada energii aktywacji
desorpcji H
2
z powierzchni GaAs. Można więc założyć, że
desorpcja wodoru z powierzchni GaAs ogranicza szybkość
wzrostu,
o
jeżeli proces prowadzony jest w zakresie 450 - 500°C i stosunek
ilości arsenu do TMGa jest mniejszy od jedności, to ma miejsce
mechanizm wzrostu VLS (Vapor Liquid Solid). Prowadzi to do

35
powstania kryształków włoskowych (whiskers). W tych
warunkach TMGa rozkłada się przeważnie na powierzchni, a
ponieważ odbywa się to w atmosferze H
2
, to zaczynają się
tworzyć kropelki ciekłego Ga, z których następnie
wykrystalizowują kryształki GaAs.
•
podzakres T > 800°C.
Zmniejszenie szybkości wzrostu warstwy w tym zakresie tłumaczy się
tym, że wzrost temperatury powoduje duże stężenie aktywnych
chemicznie atomów na powierzchni. Sprzyja to homogenicznemu
zarodkowaniu i niepożądanemu, pasożytniczemu, osadzaniu się
warstw. Przy mniejszych wartościach stężeń składników gazowych i
bardziej opływowych kształtach komory reakcyjnej przeważać będą
procesy heterogeniczne.
•
podzakres 600°C < T < 800°C.
W zakresie średnich temperatur, najbardziej interesującym ze
względów technologicznych, wzrost epitaksjalny zależy od szybkości
dyfuzji cząsteczek o mniejszym stężeniu (składników zawierających
Ga) do powierzchni podłoża, a więc ograniczony jest transportem
masy do podłoża. Szybkość wzrostu jest zależna od ciśnienia
cząstkowego TMGa.
Skład chemiczny chmury cząsteczek zmierzających do powierzchni
narastającej warstwy będzie określony przez warunki jakie panują we
wnętrzu reaktora:
o
niskie koncentracje cząsteczek i szybki ich transport powodują
przybywanie do podłoża pojedynczych cząstek Ga i AsH
3
,
o
wyższe stężenia reagentów i zaburzenia przepływu gazu
nośnego sprzyjają tworzeniu kompleksów Ga-As (zarodków
GaAs) w fazie gazowej.
36
W typowych warunkach wzrostu GaAs w technice MOVPE, tzn.
przy T=700°C, p
TMGa
=10
-4
atm, p
AsH3
=2·10
-3
atm, najprostszy opis
polega na stwierdzeniu, że etapem ograniczającym szybkość
wzrostu jest dyfuzja związków galu ze strumienia gazu poprzez
warstwę przygraniczną do powierzchni podłoża. Podczas dyfuzji
cząsteczki TMGa częściowo rozpadają się do monometylku galu i
w takiej formie docierają do podłoża, na którym znajdują się
zaadsorbowane cząstki AsH
3
. Oderwanie grupy metylowej
następuje za pośrednictwem wodoru pochodzącego
z zaadsorbowanej cząstki AsH
3
.
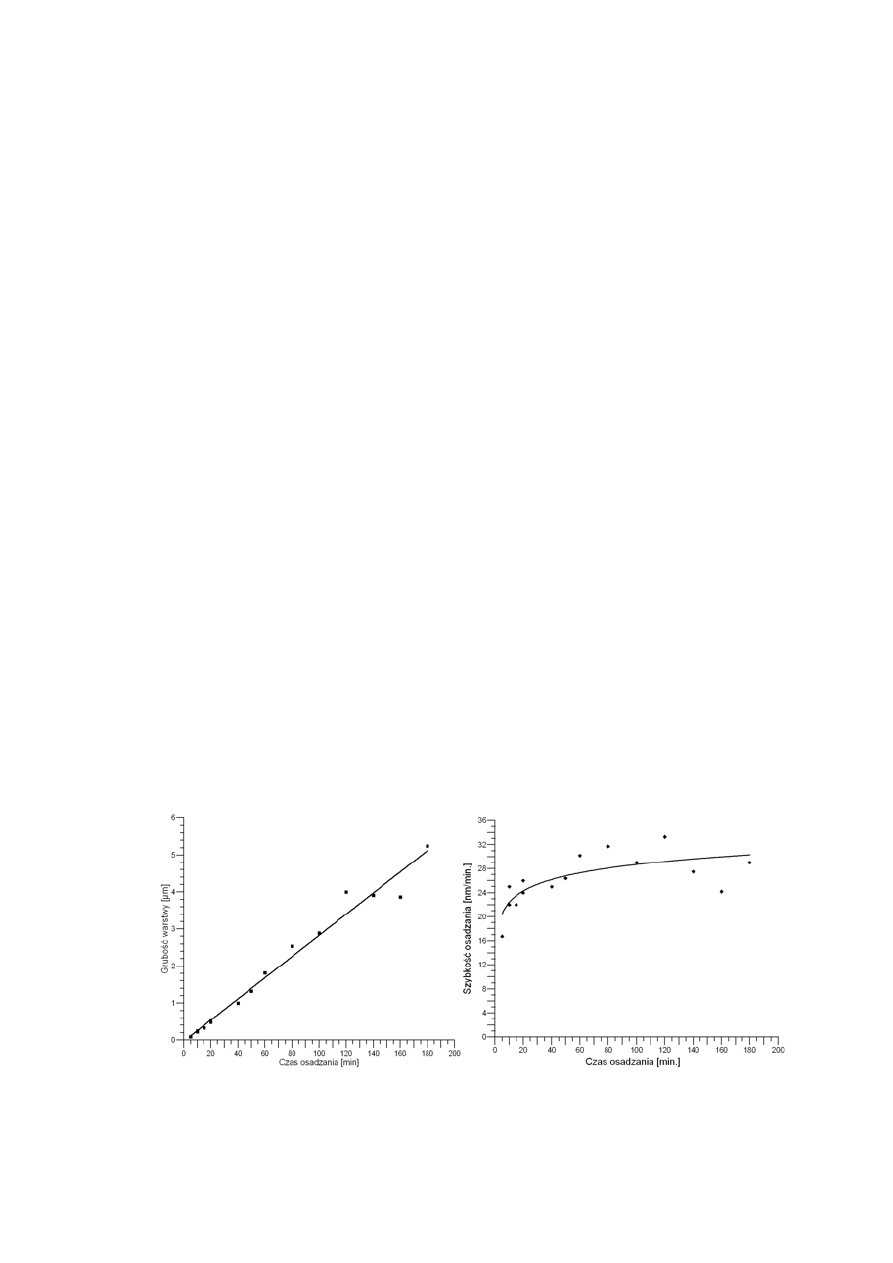
Zależność szybkości wzrostu od czasu osadzania warstwy v=f(t)
Opanowanie technologii MOVPE i określenie korelacji między
warunkami wzrostu a parametrami otrzymywanych warstw jest niezbędne
dla opracowania technologii przyrządów półprzewodnikowych.
W Laboratorium Przyrządów Półprzewodnikowych I-25 PWr. wykonano
szereg eksperymentów w celu określenia zależności szybkości wzrostu
(lub grubości warstwy) od czasu osadzania. Jako stałe parametry przyjęto:
•
temperaturę osadzania: T
e
= 700°C,
•
temperaturę źródła z TMGa: T
TMGa
= -14°C,
•
wartość przepływu wodoru (gaz nośny): V
H2
= 6000 ml/min.,
•
wartość przepływu wodoru przez źródło z TMGa: V
H2/TMGa
= 7
ml/min.,
•
wartość przepływu arsenowodoru: V
AsH3
= 300 ml/min.,
Zależność grubości i szybkości osadzania warstwy GaAs na GaAs w zależności od czasu
osadzania.

37
Otrzymano dwie równoważne charakterystyki: grubości warstwy d w
funkcji czasu osadzania oraz szybkości wzrostu warstwy v
p
w funkcji
czasu osadzania. Stwierdzono, że grubość warstwy zwiększa się,
praktycznie rzecz biorąc, liniowo wraz z czasem osadzania. Zauważyć
można też, że prosta przybliżająca zależność d=f(t) nie przechodzi przez
początek układu współrzędnych. Szybkość osadzania zwiększa się w tym
okresie bardzo ostro osiągając nasycenie w ciągu ok. dwudziestu minut.
Wyjaśnić to można następująco: w początkowym okresie wzrostu
warstwy osadzanie zachodzi chaotycznie, w sposób nieuporządkowany.
Powierzchnia podłoża GaAs pokryta jest głównie atomami arsenu.
Szybkość osadzenia warstwy atomów galu zależy w dużej mierze od
czasu dekompozycji i desorpcji adsorbowanych alkili. Zaadsorbowane
atomu galu i arsenu łączą się ze sobą tworząc klastery GaAs, które
migrują po powierzchni podłoża GaAs (w odpowiednio wysokiej
temperaturze). Klastery te obracają się, dopasowując do orientacji
krystalograficznej.
Z rozważań Doi i in. [9] wynika, że szybkość wzrostu silnie zależy od
okresu wzrostu, przy czym dla czasów osadzania spełniających warunek:
t / τ
e
~ 1
gdzie τ
e
dane jest zależnością:
τ
s
- stała czasowa zależna od przepływu gazu (reagentów),
gęstości obsadzenia sieci krystalicznej oraz efektywności
transportu alkili grupy III do powierzchni,
τ
dep
- stała czasowa dekompozycji alkili,
τ
dsp
- stała czasowa desorpcji alkili.
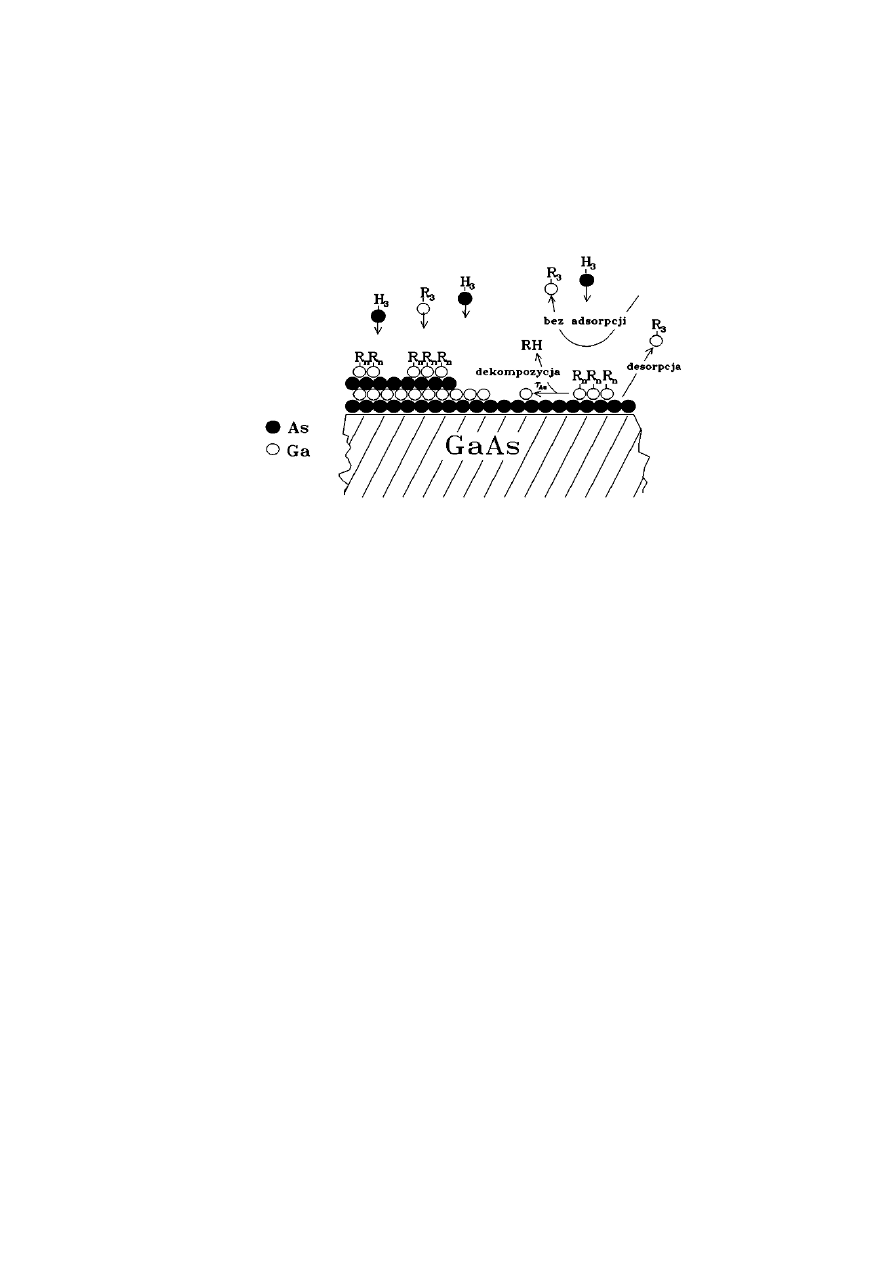
38
Można przyjąć, że średnia szybkość wzrostu warstwy jest szybkością
wzrostu. Przy wystarczająco dużych koncentracjach alkili można
stwierdzić, że szybkość wzrostu ograniczona jest głównie przez τ
s
i τ
As
(τ
As
jest stałą czasową dekompozycji alkili na powierzchni pokrytej
atomami arsenu).
Model wzrostu warstwy w MOVPE. R
3
- CH
3
, R
n
- CH
3
, lub (CH
3
)
2
lub (CH
3
)
3
[9]
Domieszki
Domieszki typu p można otrzymać np. z: dwumetylku cynku
(DMZn), dwumetylku kadmu (DMCd), dwuetylku cynku (DEZn),
dwucyklopentadienylu magnezu (CpMg)
2
. Domieszki typu n dają
wodorki: silan SiH
4
, dwusilan (Si
2
H
6
), czy rzadko już stosowane
związki H
2
Se, H
2
S.
Wyszukiwarka
Podobne podstrony:
Korbutowicz,optoelektronika,Emitery
Korbutowicz,optoelektronika,Mat Nieznany
Korbutowicz,optoelektronika,Cha Nieznany
Struktura procesu technologicznego wytwarzania produktów spożywczych i gastronomicznych, Studia - ma
Rozdział 02 Metody wytwarzania materiałów i struktur półprzewodnikowych
cw 3 lab, Imir imim, Semestr 3, Technologie wytwarzania
Wykonywanie otworow, Technologie wytwarzania, Obróbka skrawaniem, Wiercenie
lab2(v2), Semestr III, Technologie wytwarzania
Dobór technologii wytwarzania zadanie
Nowoczesne technologie wytwarzania biopaliw Prof Koltuniewicz
kiossdobry, PW Transport, Gadżety i pomoce PW CD2, płytki, Technologia wytwarzania
Spawanie, PW Transport, Gadżety i pomoce PW CD2, płytki, Technologia wytwarzania
Technologie wytwarzania, Technologie wytwarzania
TECHNOLOGIA WYTWARZANIA, Szlifowanie i ostrzenie - gotowa sciaga, Szlifowanie - jest obróbką ze skra
więcej podobnych podstron