
http://www.if.pwr.wroc.pl/~wozniak/
fizyka1.html
Dr hab. inż. Władysław Artur Woźniak
Instytut Fizyki Politechniki Wrocławskiej
Dr hab. inż. Władysław Artur Woźniak
Wykład FIZYKA I
14. Termodynamika fenomenologiczna cz.II

GAZY DOSKONAŁE
Przez gaz
doskonały rozumiemy gaz, który spełnia następujące
warunki:
-
objętość cząsteczek jest o wiele mniejsza niż objętość, zajmowana
przez gaz;
-
zasięg sił, działających między dwiema cząsteczkami, jest o wiele
mniejszy,
niż średnia odległość między nimi.
Gaz
doskonały jest to więc zbiór „małych, twardych kulek”, które
sprężyście zderzają się ze sobą i ze ściankami ograniczającego go
naczynia.
Dr hab. inż. Władysław Artur Woźniak

PRAWO GAZÓW DOSKONAŁYCH
W termodynamice podstawowym prawem,
rządzącym zachowaniem
gazu
doskonałego, jest równanie stanu gazów doskonałych (prawo
Clapyerona):
gdzie p jest
ciśnieniem, V – objętością gazu, T – jego temperaturą, N –
liczbą cząsteczek gazu w jednostce objętości, k=1,38·10
-23
J/K
– stałą
Boltzmanna, n
– liczbą moli gazu a R=8,31J/(mol·K) – stałą gazową.
Dr hab. inż. Władysław Artur Woźniak
nRT
NkT
pV
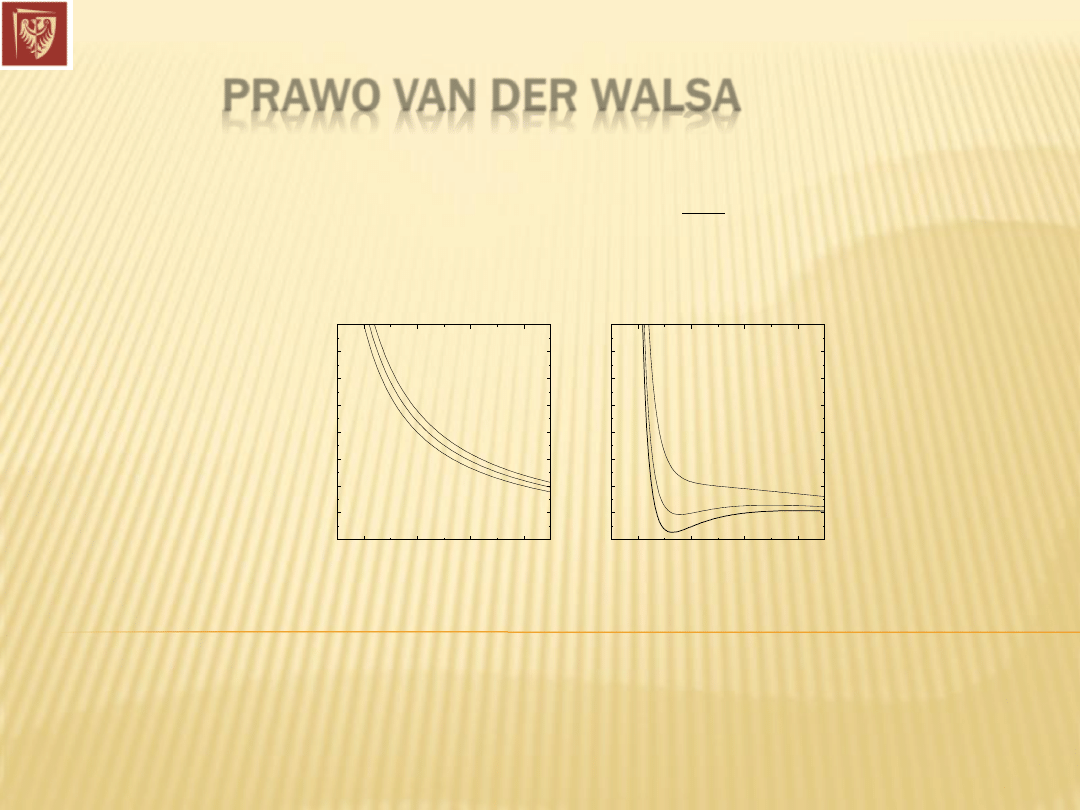
PRAWO VAN DER WALSA
Dla
gazów rzeczywistych:
gdzie
stałe a i b wyznaczamy doświadczalnie.
Dr hab. inż. Władysław Artur Woźniak
RT
b
a
p
)
v
(
v
2
0.05
0.10
0.15
0.20
0
50
100
150
200
250
300
350
400
P
V
0.05
0.10
0.15
0.20
0
50
100
150
200
250
300
350
400
P
V
Wykres p=f(V) przy T=const. dla gazów doskonałych i rzeczywistych
Równanie Van der Waalsa też bywa zawodne, ale nie jest znana prosta
formuła, która stosowałaby się do różnych gazów w różnych warunkach.
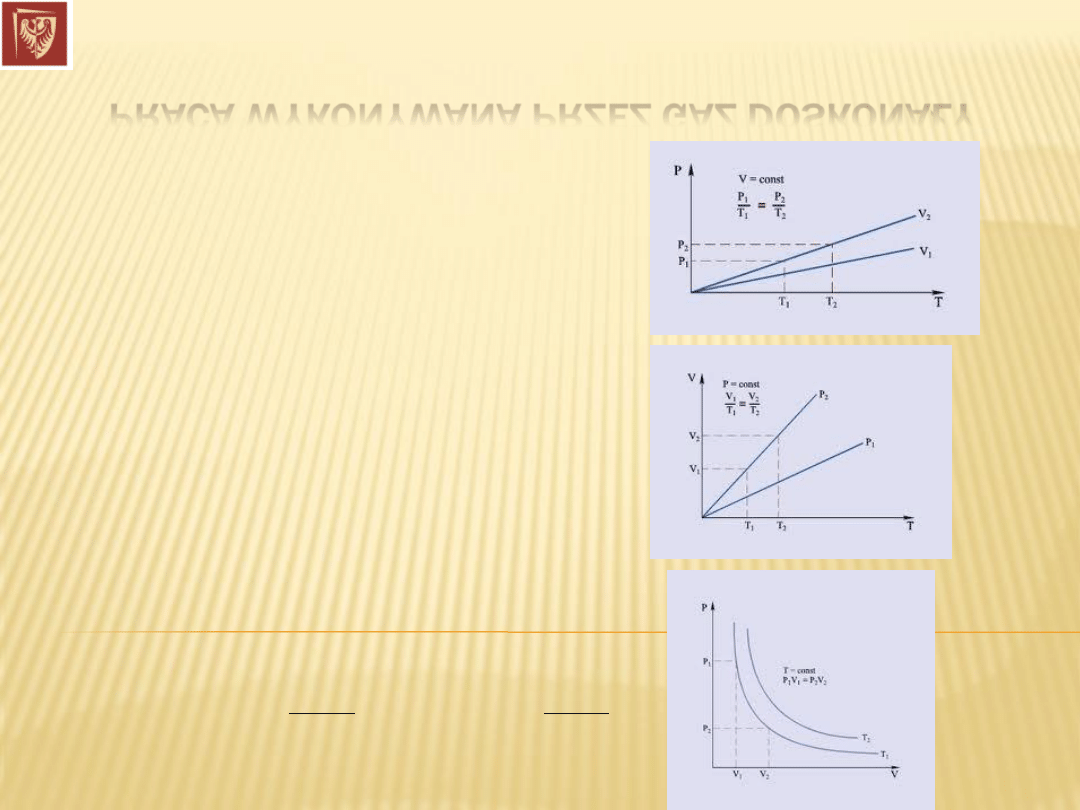
PRACA WYKONYWANA PRZEZ GAZ DOSKONAŁY
Proces izochoryczny:
Prawo Charlesa:
Praca:
Dr hab. inż. Władysław Artur Woźniak
const
V
T
p
0
pdV
W
Proces izobaryczny:
Prawo Gay-Lussaca:
Praca:
const
p
T
V
V
p
W
Proces izotermiczny:
Prawo Boyle’a-Mariotte’a:
Praca:
const
T
const
pV
pocz
konc
V
V
nRT
dV
V
nRT
pdV
W
ln

PRZEMIANY ADIABATYCZNE
Przemiana adiabatyczna = nie zachodzi wymiana
ciepła z
otoczeniem.
Dr hab. inż. Władysław Artur Woźniak
Równanie adiabaty:
gdzie:
a C
p
, C
V
są ciepłami molowymi przy stałym ciśnieniu i objętości.
const
pV
1
V
p
C
C
Inne postaci równania adiabaty:
lub wersja z p, T (nieużywana; ćwiczenia).
(Praca w przemianie adiabatycznej – ćwiczenia rachunkowe.)
const
TV
1
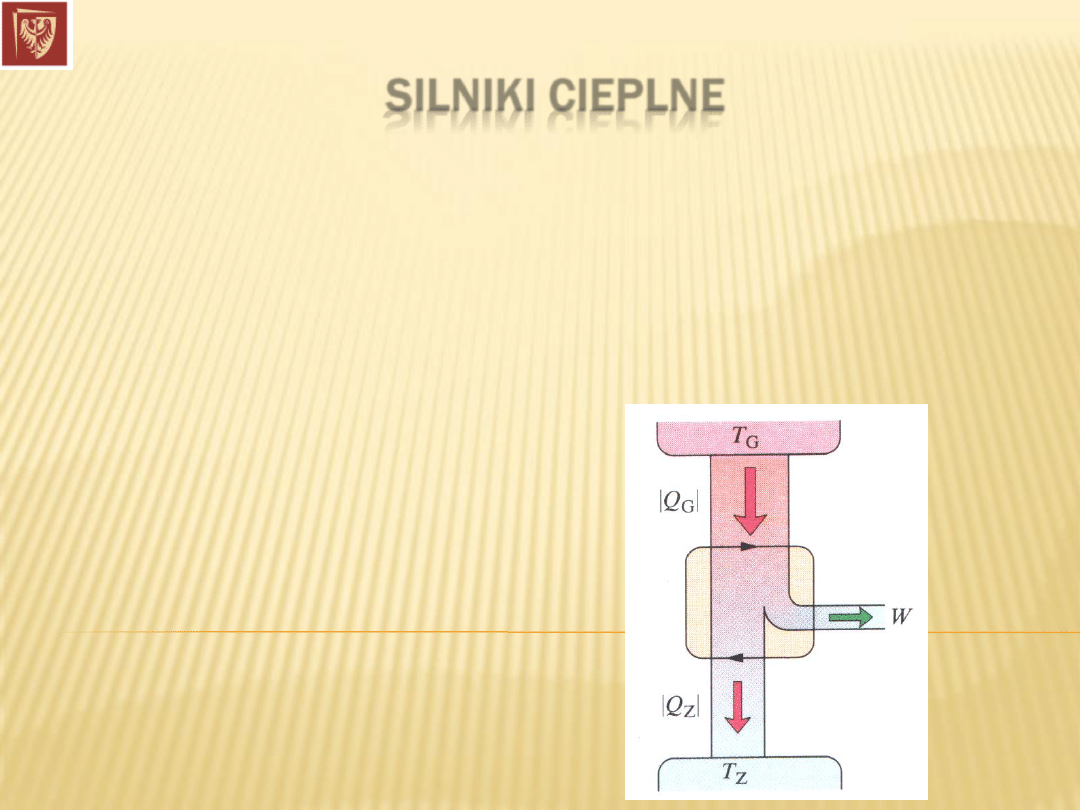
SILNIKI CIEPLNE
Silnik cieplny to
urządzenie, które ze swego otoczenia pobiera
energie w postaci
ciepła i wykonuje użyteczną pracę.
Substancją roboczą w silnikach może być: woda (w postaci pary i
cieczy), benzyna, inne.
Dr hab. inż. Władysław Artur Woźniak
Silnik idealny: wszystkie procesy są odwracalne i nie ma strat energii
związanych z tarciem bądź turbulencjami.
Silnik Carnota
(N. L. Sadi Carnot, 1842r.):
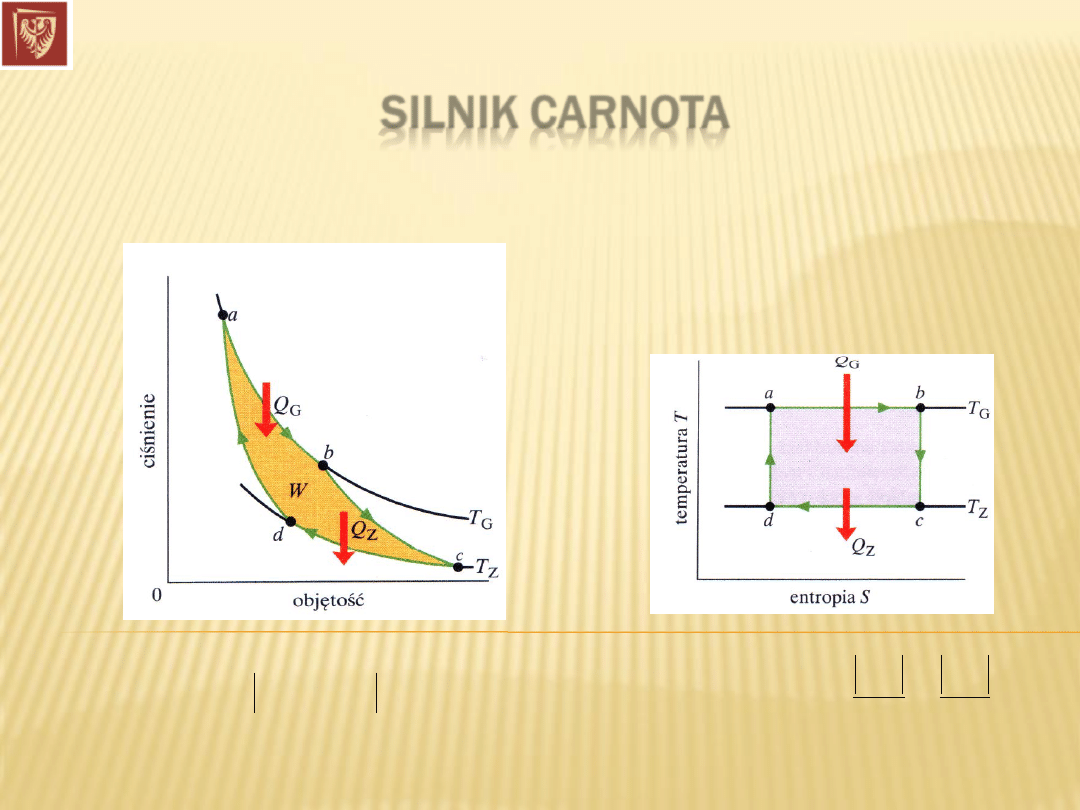
SILNIK CARNOTA
Cykl przemian substancji roboczej: dwie izotermy i dwie adiabaty.
Dr hab. inż. Władysław Artur Woźniak
Z
G
Q
Q
W
0
T
Q
T
Q
S
S
S
Z
G
Z
G
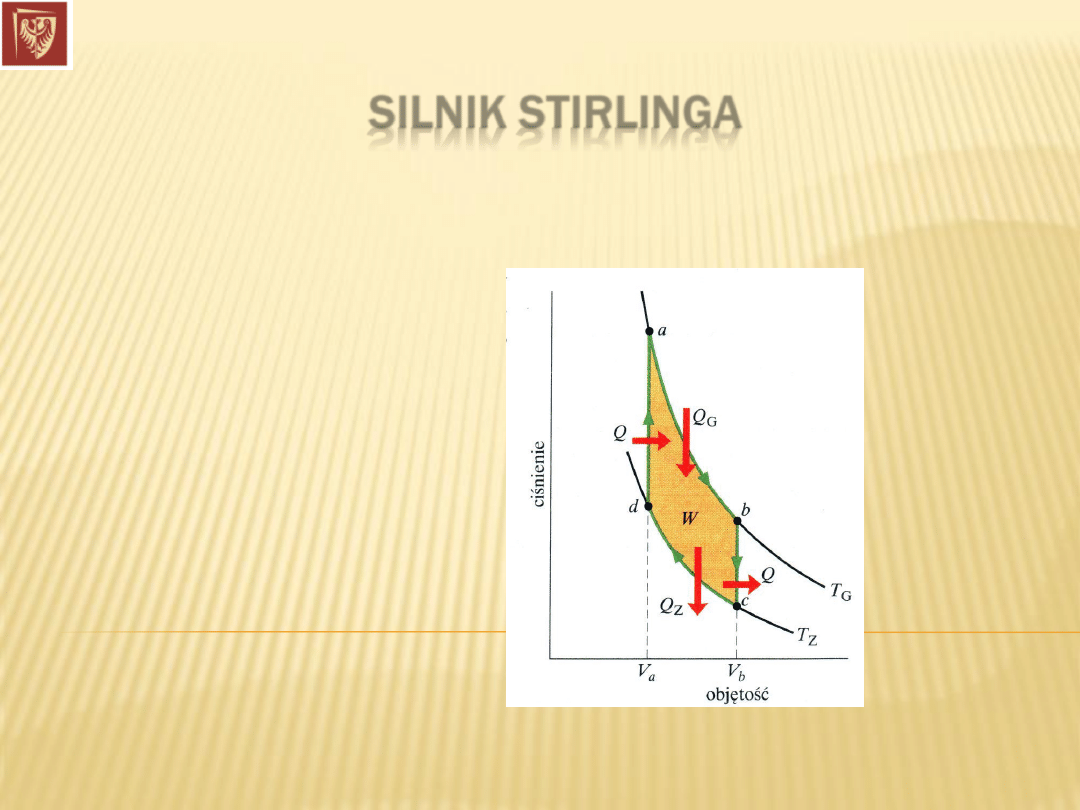
SILNIK STIRLINGA
Cykl przemian substancji roboczej: dwie izotermy i dwie izochory.
Dr hab. inż. Władysław Artur Woźniak
1816 r. Robert Stirling

SPRAWNOŚĆ SILNIKÓW CIEPLNYCH
Sprawność silnika cieplnego:
Dr hab. inż. Władysław Artur Woźniak
a
dostarczon
energia
uzyskana
energia
Sprawność silnika Carnota:
(ostatnia równość dotyczy TYLKO silnika Carnota!)
G
Z
G
Z
G
Z
G
G
T
T
Q
Q
Q
Q
Q
Q
W
1
1
Sprawność silnika doskonałego:
(nie istnieje)
1
Silniki rzeczywiste: sprawność pomniejszona ze względu na straty.
Przykład:
– samochodowy silnik spalinowy: η
teoretyczne
=55%; η
praktyczne
≈25%.

DRUGA ZASADA TERMODYNAMIKI
Czy
można skonstruować urządzenie, które pobierałoby ciepło i w
całości zamieniałoby je na pracę?
Dr hab. inż. Władysław Artur Woźniak
T
1
(gor¹ cy zbiornik)
Q
1
=4
Q
1
'
=6
Silnik
Carnota
=0.5
Super
silnik
S
=0.75
W=3
Q
2
=1
Q
2
'
=3
T
2
(zimny zbiornik)
• Nie można zbudować perpetuum
mobile drugiego rodzaju.
• Gdy
dwa
ciała
o
różnych
temperaturach
znajdą się w kontakcie
termicznym,
wówczas ciepło będzie
przepływało
z
cieplejszego
do
chłodniejszego.
• Żadna
cykliczna
maszyna
cieplna
pracująca pomiędzy temperaturami T
1
i
T
2
nie
może mieć sprawności większej
niż (T
1
- T
2
)/T
1
.
• W układzie zamkniętym entropia nie
może maleć.

ENTROPIA
Entropia jest
miarą nieuporządkowania układu cząstek. Im
większy jest stan nieporządku położeń i prędkości w układzie
tym
większe prawdopodobieństwo, że układ będzie w tym
stanie.
Dr hab. inż. Władysław Artur Woźniak
Przykłady sytuacji, gdy nieuporządkowanie rośnie, bo tracimy część
zdolności do klasyfikacji cząstek:
r
ozprężanie swobodne
p
rzepływ ciepła do wyrównania temperatur

ENTROPIA
Statystyczne spojrzenie na
entropię:
(termodynamika statystyczna za
tydzień , ale...)
-
prawdopodobieństwo
wystąpienia
danej
konfiguracji
cząstek
to
liczba
mikrostanów
odpowiadających takiej konfiguracji podzielona przez
całkowita liczbę możliwych stanów = wszystkie
mikrostany
są jednakowo prawdopodobne.
-
Przykład:
-
A)
-
B)
-
Całkowita liczba mikrostanów: 64
(suma kombinacji: 6+0, 5+1, 4+2 i 3+3)
Dr hab. inż. Władysław Artur Woźniak
15
!
2
!
4
!
6
W
20
!
3
!
3
!
6
W

ENTROPIA
Definicja entropii (1877 Ludwig Boltzmann):
to
stała Boltzmanna,
to
prawdopodobieństwo, że układ jest w
danym stanie (w odniesieniu do wszystkich
pozostałych stanów).
Dr hab. inż. Władysław Artur Woźniak
ln
k
S
k
Zgodnie z definicją prawdopodobieństwa układ częściej będzie w stanie o
większym
prawdopodobieństwie
niż
w
stanie
o
mniejszym
prawdopodobieństwie.
Układ
więc
"poszukuje"
stanów
o
większym
prawdopodobieństwie, a w miarę wzrostu
rośnie również S. Stąd:
0
S

ENTROPIA
Powyższa definicja entropii wiąże ją z prawdopodobieństwem. Jak
wyrazić (związać) entropię z innymi funkcjami stanu?
Dr hab. inż. Władysław Artur Woźniak
Przemiany nieodwracalne: w układzie zamkniętym powodują zawsze
wzrost entropii.
Ciśnienie, objętość, temperatura, energia – to parametry stanu –
zależą tylko od stanu gazu, a nie od tego, w jaki sposób stan ten został
osiągnięty.
Entropia: kolejny parametr stanu, ale opisujący raczej zmianę stanu
układu, stąd sens ma raczej pojęcie zmiany entropii.
1
2
1
2
1
2
ln
ln
ln
k
k
k
S
S
S

ENTROPIA
Aby
wyznaczyć zmianę entropii w przemianie nieodwracalnej
zachodzącej w układzie zamkniętym należy te przemianę zastąpić
dowolna
przemianą odwracalną, która ma taki sam stan
początkowy i końcowy.
Dr hab. inż. Władysław Artur Woźniak
Rozpatrzmy (jako dowolną przemianę odwracalną) swobodne
rozprężanie gazu od objętości V
1
do objętości końcowej V
2
:
2
1
.
1
2
1
V
V
cz
Dla N cząstek:
1
2
2
1
.
2
1
ln
V
V
Nk
S
V
V
N
Ncz
T
Q
T
V
V
NkT
S
1
2
ln
I dalej:
Q
oznacza
energię
pobieraną
lub
oddawaną w postaci ciepła przez układ w
trakcie procesu a T
– temperaturę układu
w kelwinach.

ENTROPIA
Entropia jest
funkcją stanu – jej wartość zależy tylko od stanu
układu (w porównaniu ze stanem poprzednim).
Dr hab. inż. Władysław Artur Woźniak
konc
pocz
pocz
konc
T
dQ
S
S
S
Dla dowolnej przemiany odwracalnej można pokazać, że:
pocz
konc
V
pocz
konc
pocz
konc
T
T
nC
V
V
nR
S
S
S
ln
ln

DRUGA ZASADA TERMODYNAMIKI
Entropia
układu
zamkniętego
wzrasta
w
przemianach
nieodwracalnych i nie zmienia
się w przemianach odwracalnych.
Entropia nigdy nie maleje.
Dr hab. inż. Władysław Artur Woźniak
0
S
(Uwaga na
pojęcie układu zamkniętego – trzeba wyraźnie podkreślić, co w
danej przemianie jest
układem zamkniętym, a kiedy rozpatrujemy tylko
część większego układu!)
Wyszukiwarka
Podobne podstrony:
14 Termodynamika fenomenologiczna B
13 Termodynamika fenomenologiczna A
Fizyka 1 26 termodynamika fenomenologiczna S1E
13 Termodynamika fenomenologiczna A
14 Proces termodyfuzji
14 Proces termodyfuzji
termodynamika cw 14 wnioski
Termodynamika 14
Wyklad 14 druga zasada termodynamiki
wyklad 14
Vol 14 Podst wiedza na temat przeg okr 1
Metoda magnetyczna MT 14
wyklad 14 15 2010
Termodynamika 2
więcej podobnych podstron