
1
FLUOROWCE
OGÓLNA CHARAKTERYSTYKA FLUOROWCÓW
•
Do grupy fluorowców, zwanych także halogenami, a niekiedy chlo-
rowcami, należą:
fluor,
chlor,
brom,
jod
oraz astat
.
•
Atomy tych pierwiastków zawierają po 7 elektronów walencyjnych,
tworzących w stanie podstawowym konfigurację
s
2
p
5
, w której
brakuje tylko jednego elektronu do pełnego oktetu odpowiadające-
go konfiguracji gazów szlachetnych
s
2
p
6
.
•
Atomy fluorowców wykazują wyraźną tendencję do przyjęcia do-
datkowego elektronu i przejścia w jon
X
−
lub też - gdy różnica elek-
troujemności halogenu i łączącego się z nim pierwiastka jest mała -
do utworzenia wiązania kowalencyjnego.
•
Tendencja do przyjęcia dodatkowego elektronu wiąże się ze znacz-
nym powinowactwem elektronowym halogenów, w przypadku któ-
rych, podobnie jak w przypadku tlenu, przyłączenie elektronu do
wolnego atomu wiąże się z wydzieleniem energii.
2
•
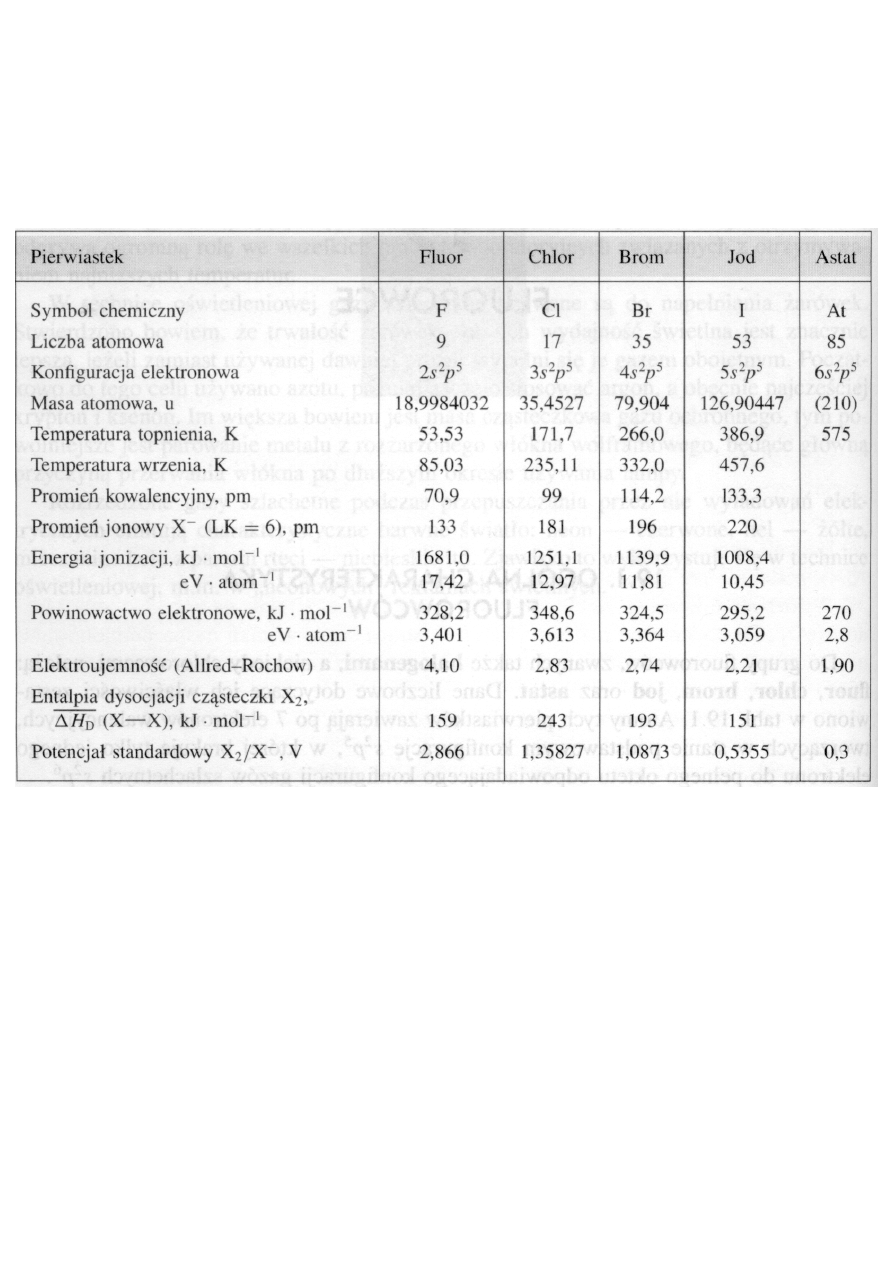
Dane liczbowe dotyczące ich właściwości zestawiono w tabeli.
Właściwości fizyczne fluorowców
•
Oderwanie elektronu od obojętnego atomu fluorowca i utworzenie
jonu
X
+
wymaga znacznego nakładu energii. Energie jonizacji flu-
orowców są wysokie w porównaniu z energiami jonizacji innych
pierwiastków występujących w tych samych okresach układu okre-
sowego.
•
Jak wskazują dane zawarte w tabeli,
wartości energii jonizacji ma-
leją
dość szybko ze wzrostem liczby atomowej halogenów. W tym

3
samym kierunku wzrasta bowiem liczba powłok elektronowych i
promień atomowy, co decyduje o osłabieniu przyciągania elektro-
nów walencyjnych przez jądro. Duże, w porównaniu z innymi
pierwiastkami danego okresu, wartości powinowactwa elektrono-
wego oraz energii jonizacji powodują, że fluorowce mają
najwięk-
sze elektroujemności
w poszczególnych okresach układu okresowe-
go, a
fluor
wykazuje w ogóle największą elektroujemność spośród
wszystkich pierwiastków.
•
Drugą ważną cechą fluorowców jest ich
duża reaktywność
. Pier-
wiastki te należą do substancji najbardziej aktywnych pod wzglę-
dem chemicznym. Łączą się gwałtownie z wieloma innymi pier-
wiastkami i reagują z licznymi związkami już w temperaturze po-
kojowej. Aktywność
ta maleje
w szeregu
od fluoru do jodu
i jest
konsekwencją faktu, że wiązania chemiczne w dwuatomowych czą-
steczkach fluorowców ulegają łatwo zerwaniu, gdyż odpowiada im
stosunkowo mała energia.
•
Trzecią istotną cechą fluorowców jest to, że należą one
do najsil-
niejszych środków utleniających
. Jak wskazują wartości potencja-
łów standardowych elektrod halogenowych, fluor o potencjale
+2,866 V jest najsilniejszym utleniaczem w całej grupie. Stanowi on
zresztą najsilniejszy utleniacz spośród wszystkich pierwiastków.
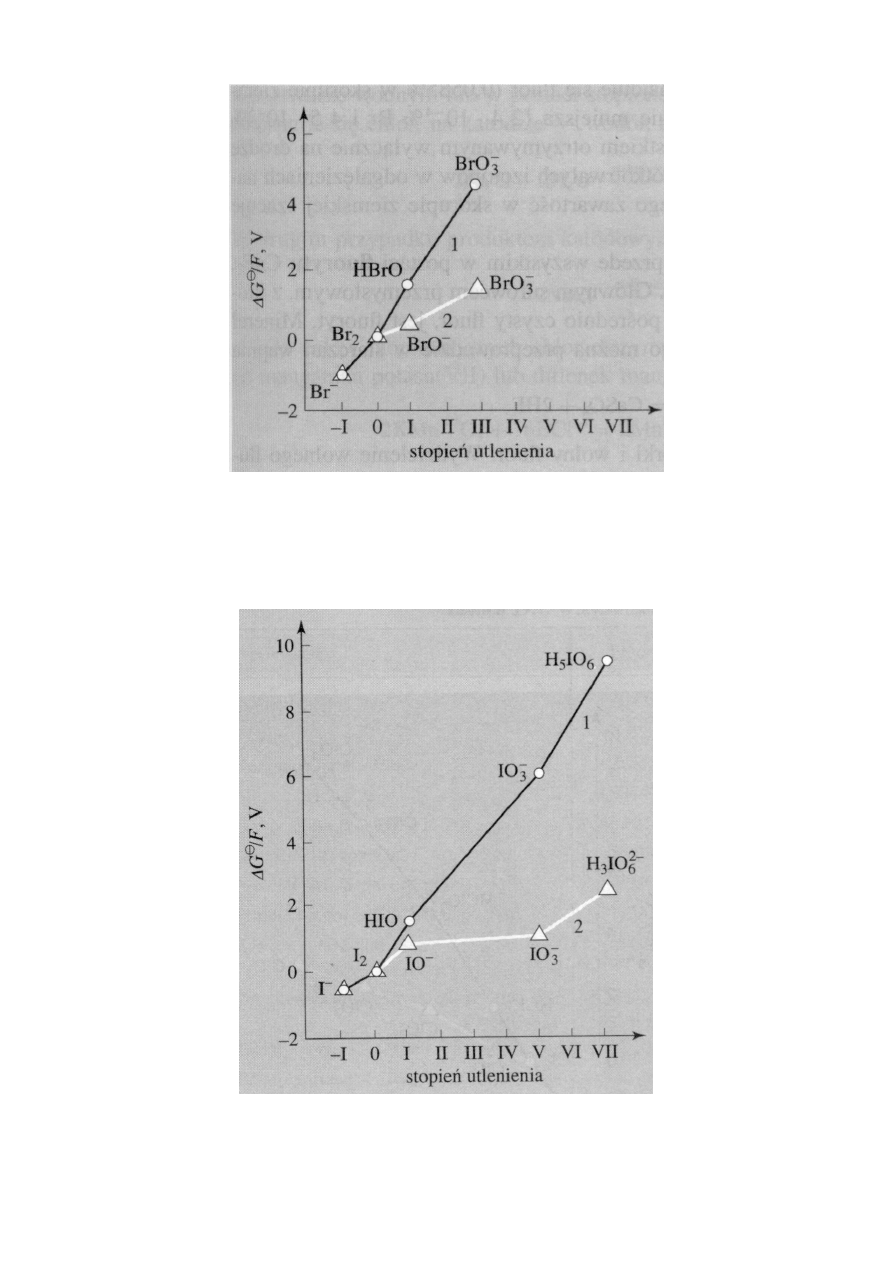
•
Z diagramów stanów utlenienia Frosta i Ebswortha, przedstawio-
nych na rysunkach, wynika, że zarówno w roztworach kwaśnych,
jak i w zasadowych najtrwalszym stopniem utlenienia chloru,
bromu i jodu
jest stopień utlenienia 1
−
. W przypadku fluoru jest to
jedyny stopień utlenienia, jaki ten pierwiastek przyjmuje w swoich
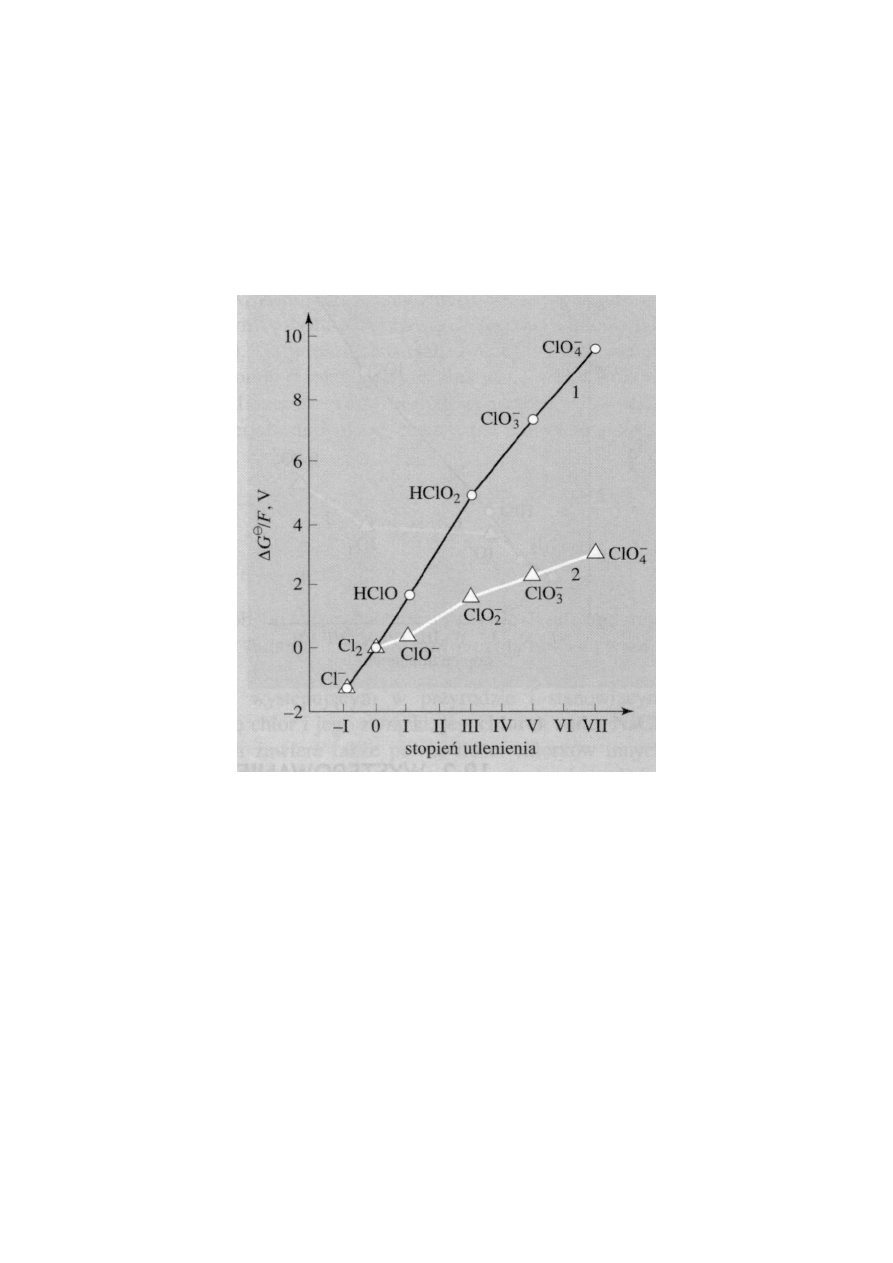
4
związkach. Pozostałe pierwiastki tej grupy mogą tworzyć wiązania
przy udziale orbitali d i przechodzić na dodatnie stopnie utlenienia,
przede wszystkim na
1+, 3+, 5+ i 7+
w związkach międzyhalogeno-
wych, tlenkach i oksokwasach.
Diagram stanów utlenienia chloru: 1) roztwory kwaśne (pH = 0),
2) roztwory zasadowe (pH = 14)
5
Diagram stanów utlenienia bromu: 1 ) roztwory kwaśne (pH = 0),
2) roztwory zasadowe (pH = 14)
Diagram stanów utlenienia jodu: 1) roztwory kwaśne (pH = 0),
2) roztwory zasadowe (pH = 14)

6
• Chlor, brom i jod
osiągają najwyższy stopień utlenienia, 7+, równy
zmniejszonemu o 10 numerowi grupy układu okresowego, do któ-
rej należą.
•
Fluorowce na zerowym i na dodatnich stopniach utlenienia wyka-
zują wyraźne
właściwości utleniające
. Z diagramów na rysunkach
wynika, że właściwości te zaznaczają się silniej w roztworach kwa-
śnych niż w zasadowych.

7
WYSTĘPOWANIE W PRZYRODZIE I OTRZYMYWANIE
FLUOROWCÓW
• Fluorowce
występują w przyrodzie wyłącznie w stanie związanym.
Najbardziej spośród nich rozpowszechniony jest
chlor
, którego
zawartość w skorupie ziemskiej jest szacowana na
0,145%
mas
. Woda morska zawiera średnio
1,94% mas.
chloru w po-
staci chlorku sodu. W rezultacie zawartość chloru w dostęp-
nych badaniom warstwach naszego globu jest rzędu 0,1% mas.
Na drugim miejscu znajduje się
fluor
(
0,0585% mas.
w skoru-
pie ziemskiej).
Zawartość
bromu i jodu
jest znacznie mniejsza (
2,4
∗10
−4
%
mas. Br
i
4,5
∗10
−5
% mas. I
w skorupie ziemskiej).
Astat
jest pierwiastkiem otrzymywanym wyłącznie na drodze
sztucznej. Stwierdzono jednak kilka jego krótkotrwałych izo-
topów w odgałęzieniach naturalnych szeregów promieniotwór-
czych. Jego zawartość w skorupie ziemskiej szacuje się na
3
∗10
−24
% mas
.
• Fluor
w skorupie ziemskiej występuje przede wszystkim w postaci
fluorytu
CaF
2
,
apatytu
Ca
5
(PO
4
)
2
F oraz
kriolitu
Na
3
AlF
6
. Głów-
nym surowcem przemysłowym, z którego otrzymuje się związki
fluoru, a także pośrednio czysty fluor, jest fluoryt. Minerał ten
działaniem stężonego kwasu siarkowego można przeprowadzić w
siarczan wapnia i fluorowodór:
CaF
2
+ H
2
SO
4
⎯→ CaSO
4
+ 2HF

8
• Fluorowodór
przerabia się dalej na fluorki i wolny fluor. Wydzie-
lenie wolnego fluoru jest możliwe tylko metodą
elektrolityczną
. Ze
względu na to, że fluor energicznie działa na wodę, wydzielając z
niej tlen, elektrolizy nie przeprowadza się w roztworach wodnych,
lecz w mieszaninie
stopionego wodorofluorku potasu
, KHF
2
, z bez-
wodnym
fluorowodorem
w temp. ok. 380 K.
•
Wyjątkowo duża aktywność chemiczna fluoru ogranicza bardzo
znacznie liczbę materiałów, z których można skonstruować apara-
turę do elektrolizy.
•
Dawniej budowano ją z platyny. Obecnie używa się do tego celu
miedzi
lub metalu
Monela
(stopu miedzi z niklem). Na powierzchni
tych dwóch ostatnich metali wytwarza się bowiem w zetknięciu z
fluorem cienka, lecz szczelna warstewka fluorków, chroniąca sku-
tecznie powierzchnię przed dalszą korozją.
•
Katodę sporządza się ze stali, anoda wykonana jest z węgla. Jako
materiału na izolacje elektryczne używa się teflonu. Na
anodzie
wydziela się fluor:
2F
−
⎯→ F
2
+ 2e
−
na
katodzie
- wodór:
2H
+
+ 2e
−
⎯→ H
2

9
•
Aparatura konstruowana jest w taki sposób, by uniknąć zanie-
czyszczenia fluoru wodorem lub odwrotnie, zanieczyszczenia wo-
doru fluorem. Obydwa gazy reagują bowiem z sobą wybuchowo.
•
Najważniejszym związkiem
chloru
występującym w przyrodzie i
stanowiącym główny surowiec, z którego wytwarza się chlor i jego
związki, jest
chlorek sodu
,
NaCl
. Występuje on w wodzie morskiej,
która zawiera także pewne ilości chlorków innych metali grup 1 i 2
układu okresowego. Chlorek sodu tworzy także rozległe złoża, któ-
re powstały na skutek wysychania mórz pozbawionych połączenia z
oceanami.
•
Do minerałów zawierających chlor należą również:
sylwin
KCl,
karnalit
KMgCl
3
∗6H
2
O (KCl
∗MgCl
2
∗6H
2
O)
oraz
kainit KMgCl(SO
4
)
∗3H
2
O (KCl
∗MgSO
4
∗3H
2
O)
,
występujące w niektórych złożach solnych powstałych w czasie wy-
sychania zamkniętych obszarów morskich.
• Chlor
otrzymuje się obecnie na skalę techniczną na drodze elektro-
lizy chlorku sodu w roztworze wodnym lub w postaci stopionej soli.
W pierwszym przypadku na
anodzie
otrzymuje się
chlor
, na
ka-
todzie
-
wodór
, a w roztworze -
wodorotlenek sodu
:
elektroliza
2NaCl + 2H
2
O
⎯⎯→ Cl
2
+ 2NaOH + H
2
W drugim przypadku produktem
katodowym
jest metaliczny
sód

10
elektroliza
2NaCl
⎯⎯→ 2Na + Cl
2
•
Do celów laboratoryjnych
chlor
otrzymuje się działając stężonym
kwasem solnym na manganian(VII) potasu lub ditlenek manganu:
2KMn
7+
O
4
+ 16HCl
1
−
⎯→ 2Mn
2+
Cl
2
+ 2KCl
1
−
+ 5Cl
2
0
+ 8H
2
O
4HCl
1
−
+ Mn
4+
O
2
⎯→ Mn
2+
Cl
2
+ Cl
2
0
+ 2H
2
O
• Brom
może być w zasadzie wydzielony z bromków za pomocą któ-
rejkolwiek z metod stosowanych do otrzymywania chloru. Najczę-
ściej jednak wypiera się go działaniem chloru:
2Br
−
+ Cl
2
⎯→ Br
2
+ 2Cl
−
Metodę tę stosuje się m.in. w celu otrzymania bromu
z wody mor-
skiej
. Chlor wprowadza się do wody zakwaszonej do pH = 3,5, a
wydzielony w bardzo małym stężeniu brom usuwa się przedmuchu-
jąc roztwór strumieniem powietrza. Pary bromu pochłaniane są
następnie w roztworze Na
2
CO
3
, w którym zachodzi reakcja:
3Na
2
CO
3
+ 3Br
2
0
⎯→ 5NaBr
1
−
+ NaBr
5+
O
3
+ 3CO
2

11
Uzyskuje się wówczas roztwór o stężeniu bromu kilka tysięcy razy
większym niż w wodzie morskiej. Po zakwaszeniu wydziela się
brom elementarny:
HBr
5+
O
3
+ 5HBr
1
−
⎯→ 3H
2
O + 3Br
2
0
który oddzielany jest za pomocą destylacji.
• Jod
występuje w niewielkich ilościach w wodzie morskiej głównie w
postaci połączeń organicznych. Dawniej był otrzymywany z popio-
łu niektórych wodorostów morskich.
•
Obecnie głównym jego źródłem są złoża
saletry sodowej
w Chile i
w Boliwii, w których pierwiastek ten występuje w postaci
joda-
nów(V)
lub
jodanów(VII)
, przechodzących do ługów pokrystaliza-
cyjnych. Związki jodu występują w organizmie człowieka w
gru-
czole tarczycowym
.
•
Brak jodu wywołuje objawy chorobowe i z tego względu w wielu
krajach do soli kuchennej przeznaczonej do celów spożywczych
dodaje się drobne ilości jodków.
• Jod z jodków
można łatwo wydzielić działaniem chloru w reakcji
analogicznej do reakcji wydzielania bromu z bromków.
Jodany
uzyskane z saletry chilijskiej przerabia się na jod, poddając je re-
dukcji wodorosiarczanami(IV)
2I
5+
O
3
−
+ 5HS
4+
O
3
−
⎯→ 3HS
6+
O
4
−
+ 2S
6+
O
4
2
−
+ H
2
O + I
2
0

12
• Astat
otrzymywany jest wyłącznie w sposób sztuczny. Jeden z jego
najtrwalszych izotopów,
211
85
At
, otrzymuje się przez bombardowa-
nie jąder bizmutu,
209
83
Bi
, cząstkami
α
209
83
Bi +
4
2
He
⎯→ 2
1
0
n +
211
85
At
Astat można następnie wydzielić ogrzewając „tarczę" bizmutową
w temp. 600
−900 K w strumieniu azotu lub próżni. Sublimujący
pierwiastek kondensuje na zimnej ścianie naczynia.
•
Znane są obecnie
34
izotopy i izomery
(jądra o tych samych warto-
ściach Z i A, lecz różniących się energią) tego pierwiastka, spośród
których żaden nie jest trwały.
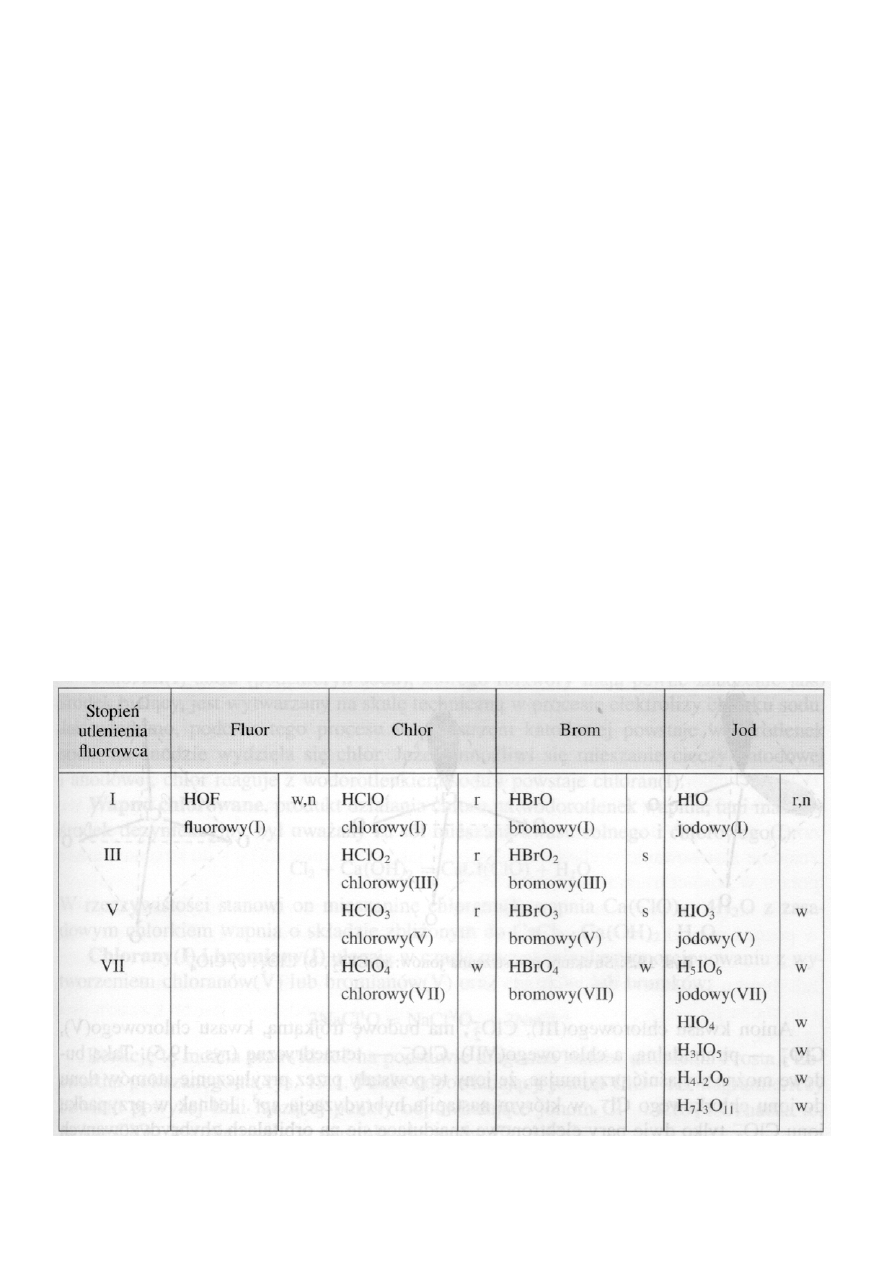
WŁAŚCIWOŚCI FIZYCZNE I CHEMICZNE FLUOROWCÓW
Fluor i chlor
są w warunkach normalnych gazami,
brom
jest cieczą o dość znacznej prężności pary,
a
jod
- ciałem stałym wykazującym już poniżej temperatury top-
nienia (386,9 K) tak znaczną prężność pary, że podczas ostrożnego
ogrzewania udaje się go w tych warunkach w całości przesublimo-
wać. Proces ten stosuje się często do oczyszczania jodu.
•
Ze wzrostem masy atomowej zmienia się barwa pierwiastków.
Fluor
wykazuje słabe zabarwienie żółtozielone,
chlor
jest zielonożóty,

13
pary
bromu
są czerwonobrunatne,
a
jodu
- fioletowe.
Ciekły brom ma barwę ciemnobrunatną, jod w stanie stałym
tworzy szaroczarne kryształy o metalicznym połysku.
•
W stanie gazowym fluorowce mają ostry zapach i silnie drażnią
drogi oddechowe. Szczególnie duża ostrożność konieczna jest przy
wszystkich pracach z fluorem, chlorem i bromem, ponieważ działa-
ją one gwałtownie na organizm ludzki. Jod jest również toksyczny,
lecz mała w temperaturze pokojowej prężność pary tego pierwiast-
ka ułatwia operowanie jego preparatami.
• Chlor i brom
rozpuszczają się w wodzie dość dobrze (w temp. 298
K w 1 obj. wody rozpuszcza się 2,26 obj. Cl
2
, w 100 cz. mas. wody
rozpuszcza się 3,55 cz. mas. Br
2
), tworząc bezbarwną
wodę chloro-
wą
i brunatną
wodę bromową
, używane w laboratorium jako środ-
ki utleniające. W czasie krzepnięcia tych roztworów wydzielają się
kryształy hydratów Cl
2
∗8H
2
O i Br
2
∗10H
2
O. Rozpuszczalność
jodu
w czystej wodzie jest mała, zwiększa się bardzo w obecności jodku
potasu dzięki tworzeniu się jonów trijodkowych I
3
−
I
2
+ I
−
⎯→ I
3
−
•
Niezależnie od fizycznego procesu rozpuszczania się w wodzie, flu-
orowce wchodzą z nią w reakcję chemiczną.

14
Fluor
gwałtownie rozkłada wodę z wytworzeniem HF i wydziele-
niem wolnego tlenu, zawierającego także pewne ilości ozonu, po-
wstałego w ubocznych reakcjach.
Chlor i brom
reagują powoli w myśl reakcji:
X
2
+ H
2
O
⎯→ HX + HXO
prowadzącej do utworzenia
chlorowodoru oraz kwasu chlorowe-
go(I) lub bromowodoru i kwasu bromowego(I)
. Pod wpływem
światła następuje rozkład oksokwasu z wydzieleniem tlenu:
2HXO
⎯→ 2HX + O
2
Z tego względu wodę chlorową i bromową przechowuje się
w ciem-
nych naczyniach
.
Znacznie lepiej niż w wodzie brom i jod rozpuszczają się w niektó-
rych
rozpuszczalnikach organicznych
, np. eterze, chloroformie, te-
trachlorku i disiarczku węgla. Dzięki temu cieczy tych można użyć
do ekstrakcji bromu i jodu z rozcieńczonych roztworów wodnych.
Ciekawą właściwością jodu jest to, że w pewnych rozpuszczalni-
kach (CCl
4
, CHCl
3
, CS
2
) rozpuszcza się z zabarwieniem
fioletowym
właściwym dla pary tego pierwiastka, w innych (wodzie, alkoholu,
eterze) - z zabarwieniem
brunatnym
. W pierwszym przypadku roz-
twór zawiera nie zmienione cząsteczki I
2
, w drugim tworzą się bli-

15
żej nieokreślone luźne połączenia jodu z cząsteczkami rozpuszczal-
nika, tzw.
solwaty
.
• Fluorowce
wykazują bardzo znaczną aktywność chemiczną, male-
jącą w szeregu od fluoru do jodu.
Fluor
, najbardziej aktywny ze wszystkich niemetali, łączy się
niemal z wszystkimi innymi pierwiastkami, nawet z gazami
szlachetnymi (z wyjątkiem helu i neonu).
Z
wodorem
elementarnym reaguje wybuchowo nawet w ciem-
ności. Odbiera również wodór z jego związków. W temperatu-
rze pokojowej reaguje gwałtownie z licznymi
pierwiastkami
niemetalicznymi
(Br, I, S, As, B, Si, węglem drzewnym) i z wielu
metalami
.
Najodporniejsze spośród metali -
złoto i platynowce
- ulegają
działaniu fluoru w temp. 800
−900 K. Niektóre spośród metali,
jak już wspomniano, pokrywają się na powierzchni cienką war-
stewką fluorków, chroniącą je przed dalszym działaniem gazu.
Dzięki temu możliwe jest przechowywanie i transportowanie
skroplonego fluoru w butlach stalowych oraz używanie stopu
Monela i niklu do wyrobu zaworów i armatury, przez które
płynie fluor w instalacjach przemysłowych.
Całkowicie czysty fluor nie działa na szkło. Wystarcza jednak
wprowadzenie małych ilości fluorowodoru, wodoru lub pary
wodnej, by zapoczątkować gwałtowną reakcję, której produk-
tami są
SiF
4
i tlen
.
Szczególnie duża aktywność chemiczna fluoru wynika z jednej
strony ze stosunkowo małej entalpii wiązania F
−F w cząsteczce
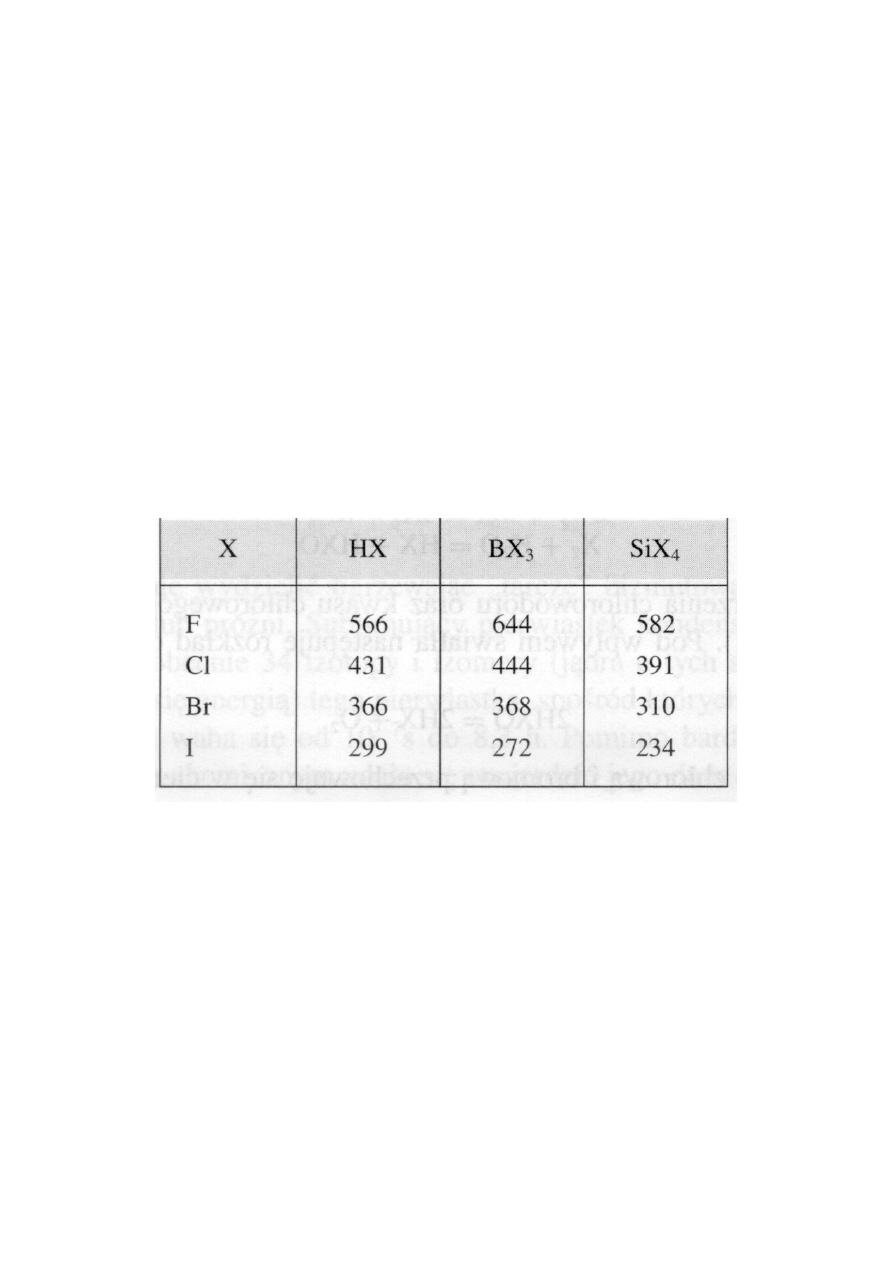
16
F
2
(159 kJ/mol), a z drugiej z faktu, że atomy fluoru tworzą z
atomami innych pierwiastków na ogół bardzo silne wiązania, co
z kolei jest spowodowane małymi rozmiarami atomu fluoru i
małą długością wiązań przez niego tworzonych. Świadczą o tym
dane liczbowe, zestawione w tabeli, dotyczące entalpii wiązań
kowalencyjnvch tworzonych przez fluorowce z wodorem, borem
i krzemem.
Entalpie wiązań fluorowców
z wodorem, borem i krzemem
∆H
o
(kJ/mol)
•
Mała entalpia wiązania F
−F i duża stosunkowo entalpia wiązań flu-
oru z innymi pierwiastkami powoduje, że reakcje fluoru są silnie
egzotermiczne, co pociąga za sobą na ogół szybki wzrost tempera-
tury, a więc przyczynia się do przyspieszenia reakcji.
• Chlor
jest również pierwiastkiem o bardzo dużej, mniejszej jednak
niż fluor, aktywności chemicznej.
Łączy się bezpośrednio z większością niemetali.

17
W atmosferze chloru spala się siarka, fosfor i arsen.
Połączenia z tlenem, azotem i węglem otrzymuje się jednak tyl-
ko w sposób pośredni.
W temperaturze pokojowej reakcja między
chlorem i wodorem
nie zachodzi, jeżeli mieszanina gazów znajduje się w ciemności.
Pod wpływem rozproszonego światła dziennego reakcja prze-
biega z dostrzegalną szybkością. W jasnym świetle słonecznym
łączenie się obu pierwiastków ma przebieg wybuchowy. Jest to
przykład łańcuchowej reakcji fotochemicznej.
Węglowodory
ulegają łatwo działaniu chloru, który łączy się z
zawartym w nich wodorem. Niektóre, jak np. terpentyna, zapa-
lają się w atmosferze chloru, dając chlorowodór i węgiel. Inne
zachowują się w analogiczny sposób dopiero po podgrzaniu
CH
4
+ 2Cl
2
⎯→ C + 4HCl
• Brom
ma właściwości chemiczne bardzo zbliżone do właściwości
chloru, jest jednak mniej aktywny.
Z wodorem łączy się dopiero w silnym świetle słonecznym lub po
podgrzaniu.
Reaguje z siarką, fosforem i arsenem podobnie jak chlor.
•
Wyraźne podobieństwa do pozostałych fluorowców wykazuje rów-
nież
jod
, najmniej spośród nich aktywny.
Spośród niemetali bezpośrednio łączą się z nim tylko fosfor, fluor
i chlor.
Z większością metali reaguje jednak dość żywo.

18
Wolny jod barwi
skrobię
rozpuszczalną i nierozpuszczalną na
fioletowoniebiesko
. Reakcja ta jest bardzo czuła i służy do wy-
krywania śladów jodu. Natura barwnego produktu nie jest do-
kładnie znana. Najprawdopodobniej mamy tu do czynienia z nie-
trwałymi połączeniami adsorpcyjnymi.
• Fluorowce
są silnymi środkami utleniającymi; ich potencjały stan-
dardowe maleją w szeregu od fluoru do jodu, a w konsekwencji
pierwiastek o mniejszej liczbie atomowej wypiera ze związków
pierwiastek o większej liczbie atomowej.
• Fluor
jako najenergiczniejszy środek utleniający ma tendencję do
przeprowadzania reagujących z nim pierwiastków na najwyższy
dopuszczalny stopień utlenienia. Z
siarką
daje więc SF
6
, z
fosforem
PF
5
, a z
tlenem
OF
2
. Połączenia fluorowców z metalami 1 i 2 grupy
układu periodycznego, a także z lantanowcami i aktynowcami na
stopniu utlenienia 2+ i 3+ są najczęściej halogenkami jonowymi.
Halogenki niemetali i metali na stopniu utlenienia wyższym od 3+
mają natomiast dominujący charakter kowalencyjny.
ZASTOSOWANIE FLUOROWCÓW
• Fluor
miał dawniej bardzo ograniczone zastosowanie praktyczne.
Obecnie wytwarza się go na skalę przemysłową. Używa się go do
produkcji UF
6
stosowanego przy rozdzielaniu izotopów uranu oraz
do produkcji UF
4
, z którego otrzymuje się uran metaliczny.

19
•
Coraz większe znaczenie mają produkty fluorowania węglowodo-
rów. W związkach tych wodór zostaje całkowicie podstawiony flu-
orem. Pod względem fizycznym mają one podobne właściwości do
odpowiednich węglowodorów, są jednak niepalne i nie ulegają
utlenieniu.
•
Spolimeryzowany
tetrafluoroetylen
, C
2
F
4
, o nazwie handlowej
te-
flon
, jest masą plastyczną o dużej odporności chemicznej, nie ule-
gającą działaniu fluoru. Do tej grupy związków należy również
fre-
on - difluorodichlorometan
, CF
2
Cl
2
, mający zastosowanie w techni-
ce chłodniczej.
•
Obecnie freony są jednak wycofywane z użycia, gdyż - jak się sądzi
- kumulowanie się tych substancji (nie ulegających naturalnej
degradacji) w atmosferze przyczynia się do
niszczenia ochronnej
warstwy ozonu w stratosferze
.
• Freony
przedostające się do stratosfery odszczepiają pod wpływem
promieniowania nadfioletowego wolne atomy chloru, zapoczątko-
wujące łańcuchową reakcję rozkładu ozonu na O
2
CCl
2
F
2
⎯→ Cl + CClF
2
Cl + O
3
⎯→ ClO + O
2
ClO
⎯→ Cl + O
ClO + O
⎯→ Cl + O
2

20
Łańcuch przerywają reakcje
2Cl
⎯→ Cl
2
2O
⎯→ O
2
• Chlor
elementarny stosuje się jako środek bielący w przemyśle
włókienniczym i celulozowym, jako środek dezynfekcyjny do odka-
żania wody do picia oraz jako materiał wyjściowy w produkcji
licznych związków nieorganicznych, m.in.
chloranów(I) (wapno
chlorowane), chloranów(V), tetrachlorku węgla i chloroformu
.
Używa się go także w niektórych przemysłowych syntezach związ-
ków organicznych.
• Brom
znajduje zastosowanie w produkcji leków i barwników syn-
tetycznych. Największych jego ilości używa się jednak obecnie do
otrzymywania
dibromoetylenu
, ważnego środka dodawanego do
benzyn samochodowych zawierających Pb(C
2
H
5
)
4
jako środek
przeciwstukowy.
•
Duże znaczenie praktyczne mają liczne bromki, np. bromek srebra
w technice fotograficznej. Bromek potasu jest znanym środkiem
uspokajającym, a bromek metylu CH
3
Br środkiem chwastobój-
czym. W laboratorium brom jest używany najczęściej w postaci
wody bromowej - jako dogodny i energiczny środek utleniający.
•
Najmniej szerokie są zastosowania
jodu
. Jod wykorzystuje się w
medycynie do otrzymywania środków dezynfekcyjnych (
jodyna
−
alkoholowy roztwór jodu
,
jodoform CHI
3
) i w przemyśle barwni-

21
ków syntetycznych. Ważne są zastosowania jodu w chemii anali-
tycznej (
jodometria
).
ZWIĄZKI FLUOROWCÓW Z WODOREM
• Fluorowce
łączą się z wodorem dając
fluorowcowodory
, HX, czę-
ściej zwane
chlorowcowodorami
. Fluorowodór i chlorowodór
otrzymuje się działając stężonym kwasem siarkowym na odpo-
wiednie sole. Do otrzymania fluorowodoru służy
fluoryt
, CaF
2
:
CaF
2
+ H
2
SO
4
⎯→ CaSO
4
+ 2HF
• Chlorowodór
do celów laboratoryjnych najdogodniej jest otrzy-
mywać z
salmiaku
, NH
4
Cl, gdyż powstający wodorosiarczan amo-
nu, NH
4
HSO
4
, jest dobrze rozpuszczalny i wywiązywanie HCl
przebiega dzięki temu bardziej równomiernie. Do celów prze-
mysłowych jako surowiec do otrzymywania chlorowodoru służy
chlorek sodu, NaCl. Produktem reakcji zachodzącej na zimno jest
wodorosiarczan sodu, NaHSO
4
i HCl:
NaCl + H
2
SO
4
⎯→ NaHSO
4
+ HCl
W temperaturze ciemnego żaru reakcja postępuje dalej:
NaCl + NaHSO
4
⎯→ Na
2
SO
4
+ HCl

22
•
W zakładach przemysłowych rozporządzających nadmiarem chlo-
ru otrzymuje się także chlorowodór, przeprowadzając bezpośred-
nią syntezę z pierwiastków, czyli spalanie wodoru w chlorze.
•
Metody otrzymywania
związków z wodorem
, polegającej na dzia-
łaniu kwasem siarkowym na odpowiednie halogenki, nie można
stosować w celu otrzymania bromowodoru i jodowodoru, ponieważ
związki te mogą się utleniać pod wpływem stężonego H
2
SO
4
.
•
Do otrzymywania HBr kwas siarkowy można zastąpić kwasem fos-
forowym. Najczęściej jednak HBr i HI otrzymuje się w wyniku hy-
drolizy tribromku lub trijodku fosforu. W przypadku syntezy
bromowodoru wkrapla się brom do mieszaniny czerwonego fosforu
i wody:
3P + 3Br
2
⎯→ 2PBr
3
PBr
3
+ 3H
2
O
⎯→ H
3
PO
3
+ 3HBr
•
W analogicznym procesie otrzymywania jodowodoru wkrapla się
wodę do mieszaniny fosforu i jodu.
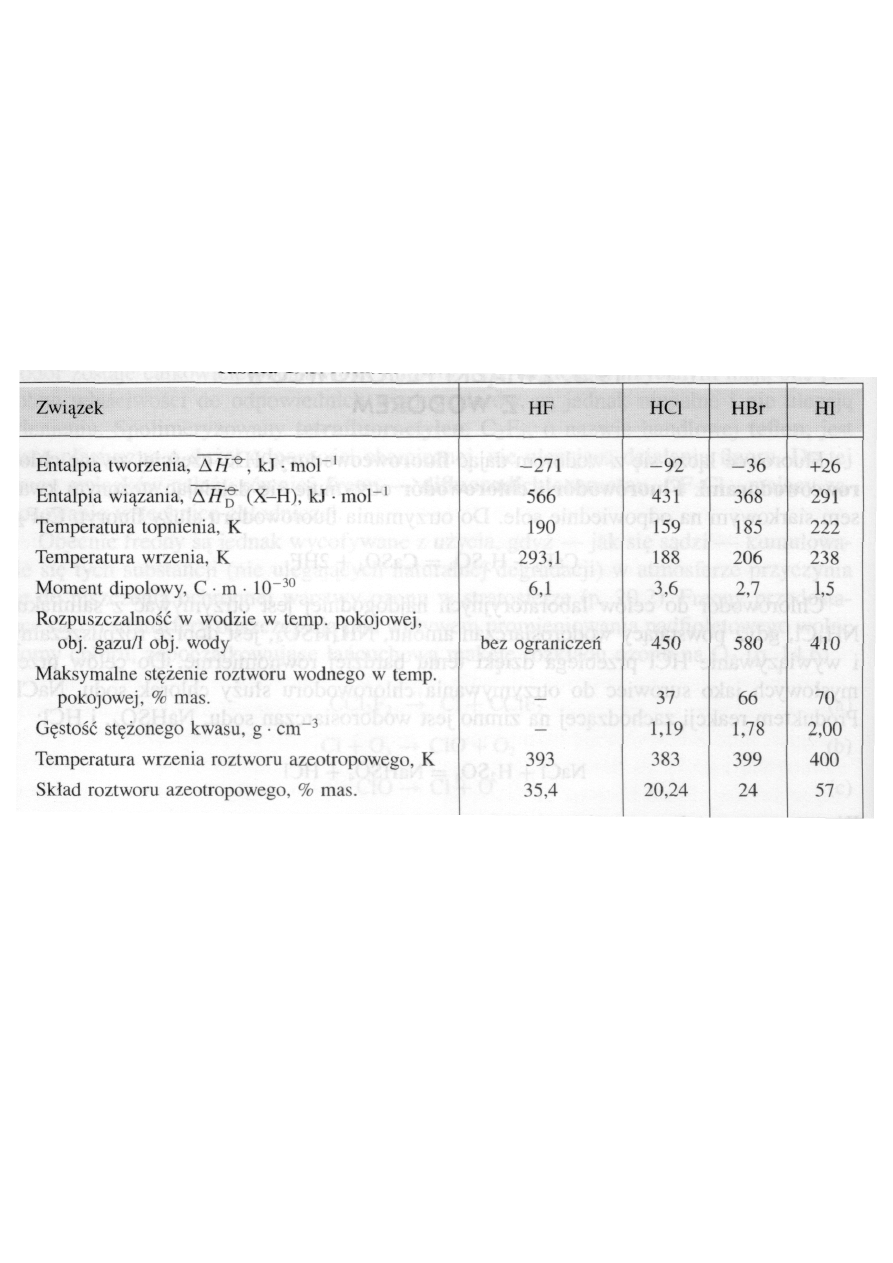
•
Wiązania chemiczne w cząsteczkach
fluorowcowodorów
, mają w
przeważającym stopniu
charakter kowalencyjny
. Udział charakte-
ru jonowego jest największy (ok. 45%) w przypadku fluorowodoru,
związku zawierającego pierwiastek najbardziej elektroujemny spo-
śród halogenów.
23
•
W dalszych fluorowcowodorach udział charakteru jonowego szyb-
ko spada, a dla jodowodoru wynosi już tylko 5%. Odpowiednio do
tego zmieniają się momenty dipolowe, malejące w tym samym kie-
runku.
Niektóre właściwości fluorowcowodorów
•
Z dużą elektroujemnością fluoru i momentem dipolowym fluoro-
wodoru, znacznie większym niż momenty dipolowe pozostałych
chlorowcowodorów, wiąże się zdolność cząsteczek fluorowodoru do
asocjacji na skutek tworzenia wiązań wodorowych.
•
Asocjacja fluorowodoru prowadzi do powstania
zygzakowatych
łańcuchów
obecnych w zestalonym fluorowodorze. W fazie gazowej
w temperaturze wrzenia pojawiają się cząsteczki spolimeryzowane
24
o średniej masie cząsteczkowej odpowiadającej wzorowi (HF)
3
. W
miarę ogrzewania ulegają one dysocjacji, a w temp. ponad 360 K
gęstość pary fluorowodoru odpowiada cząsteczkom monomerycz-
nym, HF.
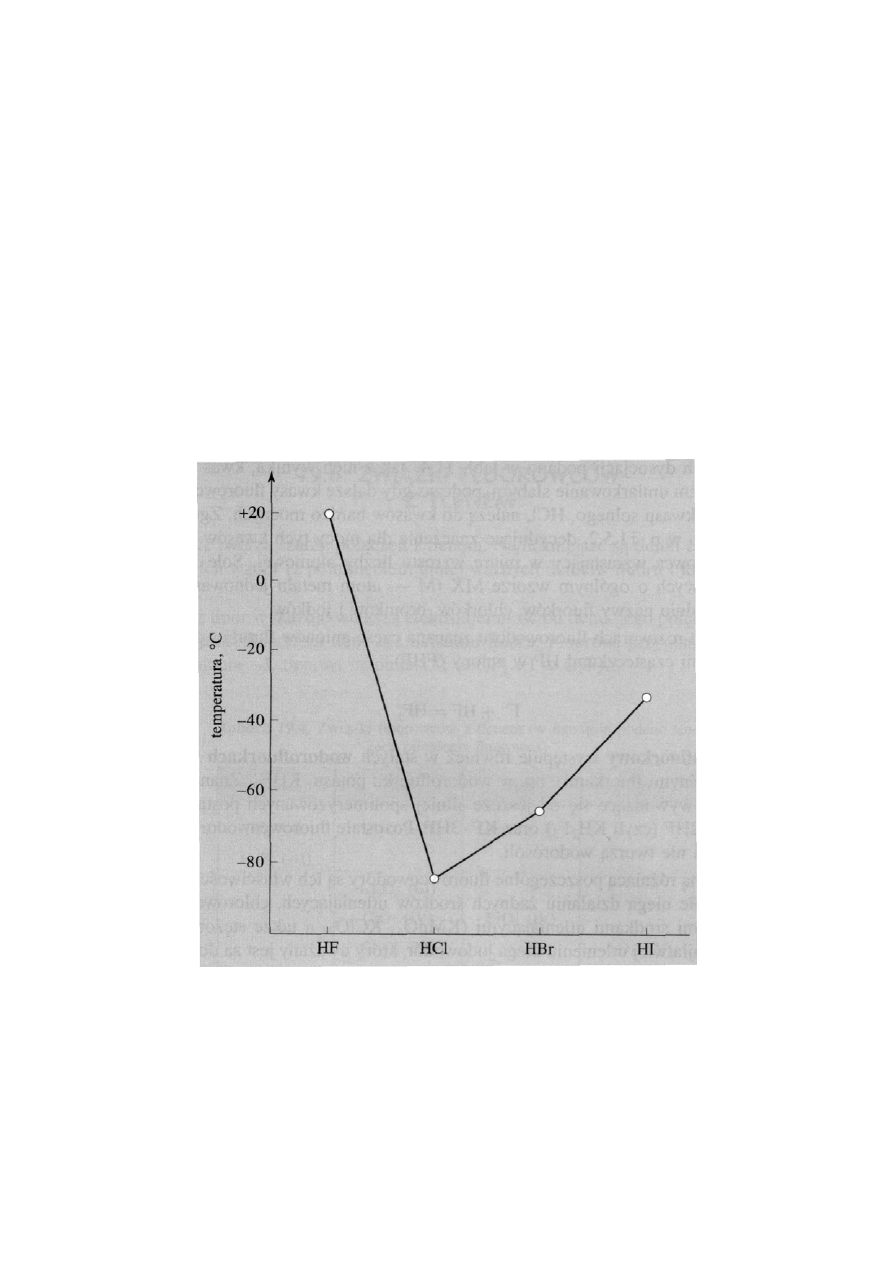
• Fluorowodór
ma najwyższą temperaturę wrzenia (293,1 K) spo-
śród wszystkich halogenowodorów. Jest to spowodowane asocjacją
fluorowodoru. W warunkach normalnych tylko fluorowodór jest
cieczą, a reszta halogenowodorów gazami.
Temperatury wrzenia fluorowcowodorów

25
•
Ciekły bezwodny fluorowodór, podobnie do wody, jest doskonałym
rozpuszczalnikiem licznych substancji nieorganicznych i organicz-
nych. Ulega on
autodysocjacji
przebiegającej według równania
2HF
⎯→ H
2
F
+
+ F
−
lub
3HF
⎯→ H
2
F
+
+ HF
2
−
•
Wartość iloczynu jonowego, 10
−10
, ciekłego fluorowodoru w pobliżu
temperatury wrzenia (293,1 K = 19,9°C) wskazuje, że autodysocja-
cja tej cieczy jest silniejsza niż autodysocjacja wody (iloczyn jono-
wy 10
−14
w temp. 298 K) w tej samej temperaturze.
•
Wszystkie cztery
halogenowodory
rozpuszczają się bardzo obficie
w wodzie. Fluorowodór miesza się z nią w każdym stosunku, pozo-
stałe dają natomiast roztwory, które po nasyceniu, pod ciśnieniem
gazu 10
5
Pa, mają stężenia podane w tabeli.
•
Podczas destylacji rozcieńczonych roztworów fluorowcowodorów
otrzymuje się destylat bogatszy w wodę niż wrząca ciecz, kwas w
cieczy ulega zatem zagęszczeniu. W trakcie destylacji roztworów
stężonych obserwuje się zjawisko odwrotne, pary są bogatsze we
fluorowcowodór, a kwas ulega rozcieńczeniu.
•
Dla każdego z roztworów istnieje jednak stężenie, zwane
stężeniem
azeotropowym
, przy którym skład destylatu i cieczy jest jednako-
wy. Skład azeotropów tworzonych przez poszczególne fluorowco-
wodory podano również w tabeli. Roztwór fluorowcowodoru o do-

26
wolnym stężeniu w czasie destylacji zmienia swoje stężenie dopóty,
dopóki nie osiągnie ono stężenia azeotropowego. Wówczas dalsza
destylacja odbywa się już bez zmiany składu.
•
W roztworach wodnych
fluorowcowodory
ulegają dysocjacji elek-
trolitycznej w myśl równania
HX + H
2
O
⎯→ H
3
O
+
+ X
−
•
Kwas fluorowodorowy
jest kwasem umiarkowanie słabym, podczas
gdy dalsze kwasy fluorowcowodorowe, poczynając od kwasu solne-
go, HCl, należą do kwasów bardzo mocnych.
•
Sole kwasów fluorowcowodorowych
o ogólnym wzorze MeX (Me -
atom metalu jednowartościowego) noszą odpowiednio nazwy
flu-
orków, chlorków, bromków i jodków
.
•
W wodnych roztworach fluorowodoru znaczna część anionów flu-
orkowch, F
−
, łączy się z obojętnymi cząsteczkami HF w aniony
(FHF)
−
F
−
+ HF
⎯→ HF
2
−
•
Anion wodorofluorkowy
występuje również w stałych wodorofluor-
kach (dawniej nazywanych kwaśnymi fluorkami), np. w
wodoroflu-
orku potasu
, KHF
2
. Znane są ponadto wodorofluorki wywodzące się
od jeszcze silniej spolimeryzowanych postaci fluorowodoru, jak
KF
∗2HF (czyli KH
2
F
3
) oraz KF
∗3HF. Pozostałe fluorowcowodory
nie ulegają polimeryzacji i nie tworzą wodorosoli.

27
•
Ważną cechą różniącą poszczególne fluorowcowodory są ich wła-
ściwości
redukujące
.
Fluorowodór
nie ulega działaniu żadnych
środków utleniających,
chlorowodór
daje się utlenić mocnymi środ-
kami utleniającymi (KMnO
4
, KClO
3
, a także stężonym kwasem azo-
towym). Najłatwiej utlenieniu ulega
jodowodór
, który uważany jest
za dość skuteczny środek redukujący.
•
Spośród związków fluorowców z wodorem najwięcej zastosowań
praktycznych ma
roztwór chlorowodoru
, który jako kwas solny na-
leży do najważniejszych kwasów mineralnych używanych w prze-
myśle chemicznym i spożywczym oraz w laboratorium chemicznym.
•
Zastosowania
fluorowodoru
wiążą się przede wszystkim z jego zdol-
nością trawienia szkła. Pod wpływem fluorowodoru, zarówno gazo-
wego, jak i w postaci wodnego roztworu, krzemionka – SiO
2
, wolna i
związana (krzemiany), ulega przemianie w łatwo lotny
tetrafluorek
krzemu
, SiF
4
:
SiO
2
+ 4HF
⎯→ SiF
4
+ 2H
2
O
•
Trawienie szkła przez fluorowodór powoduje, że jego roztworów
nie można przechowywać w naczyniach szklanych. Używa się do
tego celu naczyń sporządzonych z parafiny lub z organicznych mas
plastycznych. Działanie fluorowodoru na SiO
2
wykorzystuje się w
analizie krzemianów.
•
Kwas fluorowodorowy
jest silnie toksyczny, a jego roztwory wywo-
łują przykre i trudno gojące się oparzenia ciała. Fluorowodór ma
właściwości bakteriobójcze i dlatego używa się jego rozcieńczonych
28
roztworów do celów dezynfekcyjnych w przemyśle drożdżowym.
Fluorki stosuje się ponadto do impregnacji drewna.
ZWIĄZKI FLUOROWCÓW Z TLENEM
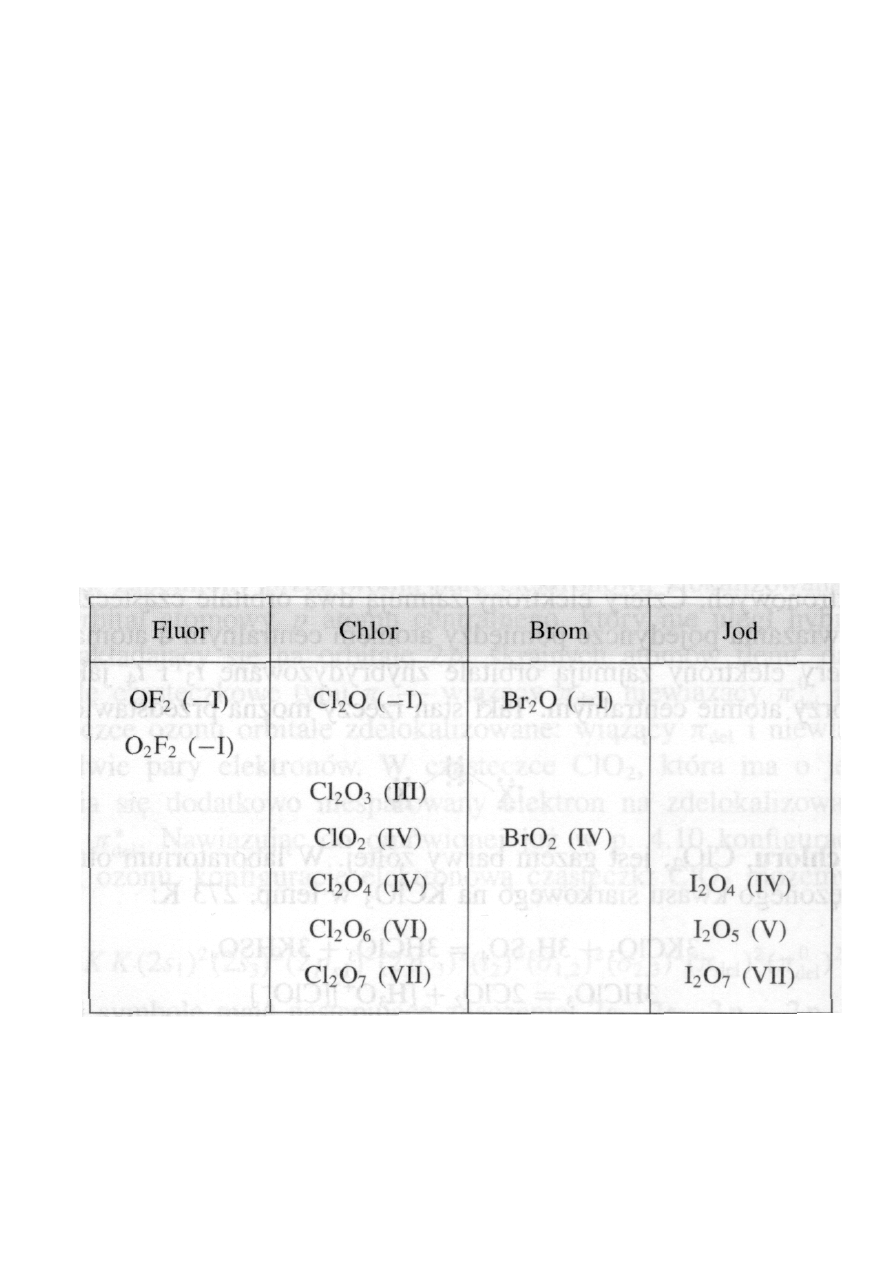
•
Fluorowce
tworzą szereg połączeń z tlenem. Najliczniejsze są tlenki
chloru, najmniej liczne jodu. Ich wzory (z pominięciem mniej waż-
nych tlenków fluoru i jodu) zestawiono w tabeli.
Związki fluorowców z tlenem (w nawiasie podano stopień utlenienia
fluorowca)

29
•
Ponieważ fluor wykazuje większą elektroujemność od tlenu, jego
połączenia z tlenem nazywamy raczej
fluorkami tlenu
niż tlenkami
fluoru.
Fluorowi
przypisujemy przy tym stopień utlenienia
1
−
, tle-
nowi natomiast
2+
w OF
2
i
1+
w O
2
F
2
.
•
Difluorek tlenu
otrzymuje się działając gazowym fluorem na roz-
cieńczony roztwór wodorotlenku sodu:
2F
2
+ 2NaOH
⎯→ 2NaF + H
2
O + OF
2
Jest on bezbarwnym gazem, reaguje gwałtownie z metalami, fosfo-
rem i siarką. Z zasadami tworzy fluorki i wydziela tlen. Nie wyka-
zuje zatem właściwości bezwodnika kwasowego.
•
Cl
2
O
jest żółtobrązowym gazem,
Br
2
O
- ciemnobrunatną cieczą.
Otrzymuje się je przepuszczając chlor lub pary bromu nad tlenkiem
rtęci(II):
2Cl
2
+ 2HgO
⎯→ HgCl
2
+ HgO + Cl
2
O
Obydwa tlenki łatwo eksplodują w obecności substancji redukują-
cych. Z zasadami tworzą
chlorany(I)
i
bromiany(I)
, są zatem
bezwodnikami kwasowymi
Cl
2
O + 2NaOH
⎯→ 2NaClO + H
2
O

30
•
Ditlenek chloru
, ClO
2
, jest gazem barwy żółtej. W laboratorium
otrzymuje się go działaniem stężonego kwasu siarkowego na KClO
3
w temp. 273 K:
3KClO
3
+ 3H
2
SO
4
⎯→ 3HClO
3
+ 3KHSO
4
3HClO
3
⎯→ 2ClO
2
+ [H
3
O
+
][ClO
4
−
]
Jest to substancja o silnych właściwościach utleniających, ulegająca
rozpadowi nawet pod wpływem słabego ogrzania. Wszelkie czynno-
ści z ditlenkiem chloru można jednak wykonać w sposób bezpieczny,
przeprowadzając go w
addukt z pirydyną
C
6
H
5
N
∗ClO
2
. Z roztwo-
rami zasad ClO
2
daje mieszaninę chloranów(III) i chloranów(V):
2ClO
2
+ 2NaOH
⎯→ NaCl
3+
O
2
+ NaCl
5+
O
3
+ H
2
O
Jak z tego wynika, chlor występujący w ditlenku chloru na stopniu
utlenienia
4+
przechodzi w połowie na stopień utlenienia
3+
, w po-
łowie na stopień utlenienia
5+
. Mamy tutaj przeto do czynienia z
równoczesną redukcją i utlenianiem się chloru. Chlor w ClO
2
speł-
nia częściowo funkcję reduktora, częściowo utleniacza. Reakcje tego
rodzaju - nazywamy
reakcjami dysproporcjonowania
.
•
Tlenek chloru
o wzorze Cl
2
O
6
, zwany
heksatlenkiem dichloru
lub
tlenkiem chloru(VI), powstaje w reakcji między ozonem i ClO
2
w
temp. 273 K. Jest to ciecz o barwie ciemnoczerwonej. Wykazuje sil-

31
ne właściwości utleniające. Z alkaliami ulega dysproporcjonowaniu
na chlorany(V) i chlorany(VII):
Cl
2
O
6
+ 2NaOH
⎯→ NaClO
3
+ NaClO
4
+ H
2
O
•
Heptatlenek dichloru
– Cl
2
O
7
, bezbarwna ciecz, powstaje przez od-
wadnianie kwasu chlorowego(VII), HClO
4
, pentatlenkiem fosforu,
P
4
O
10
. Jest to reakcja odwracalna:
2HClO
4
⎯→ Cl
2
O
7
+ H
2
O
•
Pentatlenek dijodu
, I
2
O
5
, można otrzymać przez utlenianie jodu
kwasem azotowym. Jest to białe ciało stałe, rozkładające się po
ogrzaniu do temp. 600 K. Znajduje zastosowanie w chemii anali-
tycznej do wykrywania i oznaczania
tlenku węgla
, ponieważ utlenia
CO do CO
2
, przy czym powstaje jod elementarny:
I
2
O
5
+ 5CO
⎯→ 5CO
2
+ I
2
32
TLENOWE KWASY FLUOROWCÓW
•
Wzory i nazwy
oksokwasów
tworzonych przez halogeny zestawio-
no w tabeli. Umieszczono w niej również nietrwały
kwas fluoro-
wy(I)
, HOF, powstający jako jeden z produktów (obok HF, O
2
i
OF
2
) w czasie działania wolnego fluoru pod zmniejszonym ciśnie-
niem na wodę w temp. 373 K.
•
Rozkłada się on w temperaturze pokojowej, a okres półtrwania jest
krótszy niż 1 h. Wobec większej elektroujemności fluoru niż tlenu
związek ten określić można jako fluorek hydroksylu, co sugeruje
obecność fluoru na stopniu utlenienia 1
− (oraz tlenu na stopniu
utlenienia zerowym).
Oksokwasy fluorowców
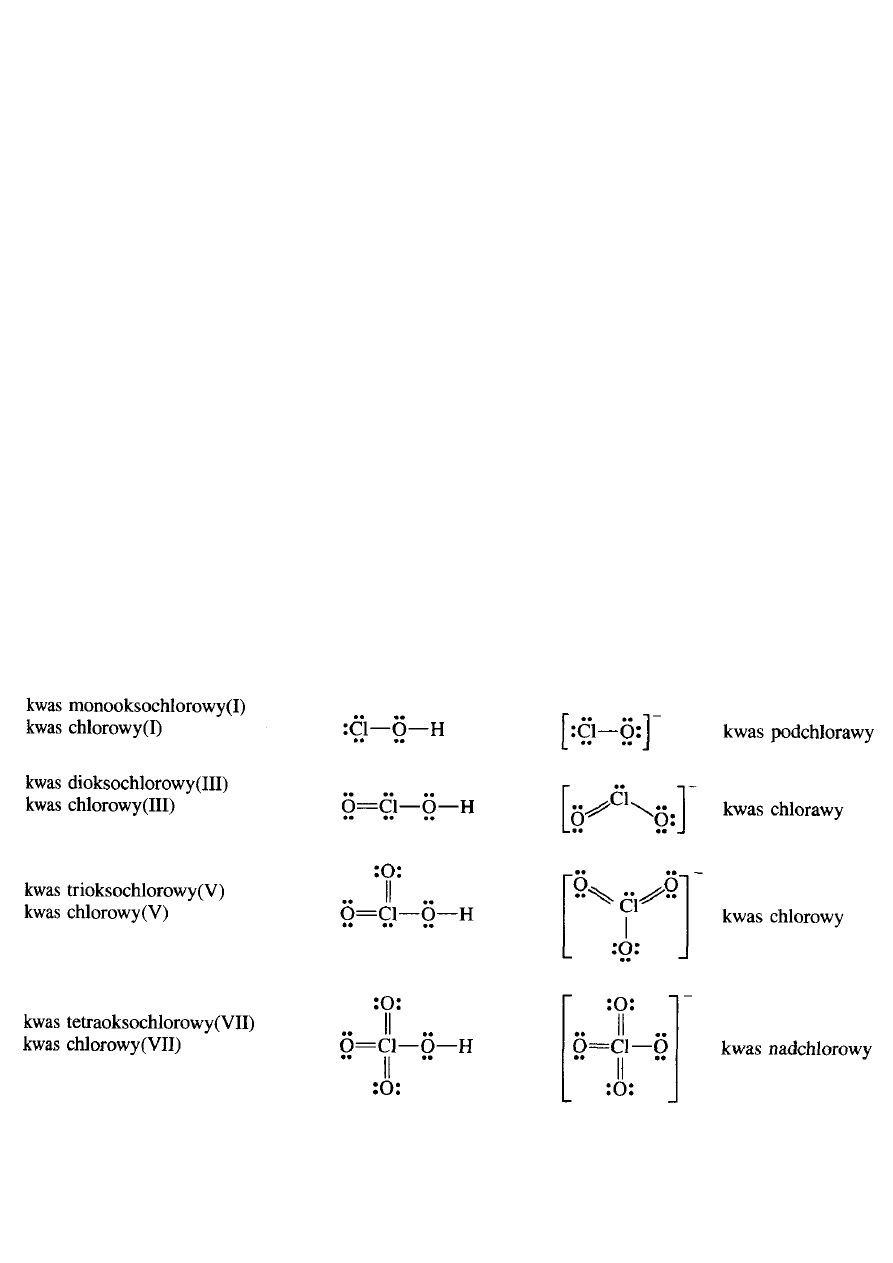
33
•
Większości
tlenowych kwasów fluorowców
nie udaje się wydzielić
w stanie czystym i znane są tylko w postaci roztworów lub soli.
Trwałość ich wzrasta ze wzrostem stopnia utlenienia chlorowca.
•
Dzięki temu
kwas jodowy(V)
, HIO
3
,
chlorowy(VII)
, HClO
4
, i
hek-
sa-oksojodowy(VII)
, H
5
IO
6
, można otrzymać w stanie czystym.
Wszystkie kwasy wykazują silne właściwości utleniające, słabnące
jednak w pewnym stopniu ze wzrostem stopnia utlenienia. Ze
wzrostem stopnia utlenienia wzrasta bardzo wyraźnie moc okso-
kwasów halogenowych.
•
Wzory strukturalne kwasów i odpowiadających im anionów przed-
stawiono na przykładzie
oksokwasów chloru
(w przypadku anio-
nów uwzględniono tylko po jednej z możliwych struktur mezome-
rycznych).

34
•
Kwasy:
chlorowy(I)
HClO,
bromowy(I)
HBrO i
jodowy(I)
HIO
można otrzymać tylko w postaci rozcieńczonych roztworów,
wprowadzając odpowiedni fluorowiec do wodnej zawiesiny tlenku
rtęci(II):
2X
2
+ 2HgO + H
2
O
⎯→ HgO∗HgX
2
+ 2HXO
•
Są to związki nietrwałe, które podczas zagęszczania roztworów
ulegają rozkładowi. Szczególnie małą trwałość wykazuje kwas jo-
dowy(I), HIO, który rozkłada się szybko nawet w roztworach roz-
cieńczonych.
• Sole
tych kwasów są trwalsze. Otrzymuje się je wprowadzając od-
powiedni halogen do roztworu alkaliów:
X
2
+ 2NaOH
⎯→ NaXO + NaX + H
2
O
• Chloran(I) sodu
(podchloryn sodu), którego roztwory mają pewne
znaczenie jako środek bielący, jest wytwarzany na skalę techniczną
w procesie elektrolizy chlorku sodu. Jak wiadomo, podczas tego
procesu w przestrzeni katodowej powstaje wodorotlenek sodu, na
anodzie wydziela się chlor. Jeżeli umożliwi się mieszanie cieczy ka-
todowej i anodowej, chlor reaguje z wodorotlenkiem sodu i powsta-
je chloran(I).
• Wapno chlorowane
, produkt działania chloru na wodorotlenek
wapnia, tani masowy środek dezynfekcyjny, był uważany za sól
mieszaną kwasu solnego i chlorowego(I):

35
Cl
2
+ Ca(OH)
2
⎯→ CaCl(ClO) + H
2
O
W rzeczywistości stanowi on mieszaninę
chloranu(I)
wapnia
Ca(ClO)
2
∗4H
2
O z
zasadowym chlorkiem wapnia
o składzie zbliżo-
nym do
CaCl
2
∗Ca(OH)
2
∗H
2
O
.
• Chlorany(I)
i
bromiany(I)
ulegają w czasie ogrzewania dyspropor-
cjonowaniu z wytworzeniem
chloranów(V)
lub
bromianów(V)
oraz
chlorków
lub
bromków
:
3NaClO
⎯→ NaClO
3
+ 2NaCl
• Jodany(I)
są tak nietrwałe, że w roztworach ulegają analogicznej
reakcji już w temperaturze pokojowej.
• Kwas chlorowy(III)
, HClO
2
, zawierający chlor na stopniu utlenie-
nia 3+, znany jest tylko w postaci roztworów. Jest on kwasem moc-
niejszym od HClO, bardzo nietrwałym. Podobnie do soli,
chlora-
nów(III)
, jest silnym środkiem utleniającym.
• Kwasy: chlorowy(V)
HClO
3
i
bromowy(V)
HBrO
3
można otrzymać
tylko w postaci roztworów.
Kwas jodowy(V)
HIO
3
udaje się nato-
miast wydzielić w postaci białego ciała stałego. Wszystkie trzy są
mocnymi kwasami i silnymi środkami utleniającymi. Silne właści-
wości utleniające wykazują również ich sole.

36
• Chlorany, bromiany i jodany(V)
otrzymuje się najdogodniej w wy-
niku wspomnianego już dysproporcjonowania chloranów i bro-
mianów(I).
• Chloran(V) potasu
otrzymuje się na skalę przemysłową w procesie
elektrolizy gorącego roztworu KCl. W trakcie mieszania roztworu
produkt katodowy, KOH, i produkt anodowy, Cl
2
, tworzą najpierw
KClO, który następnie rozkłada się z utworzeniem KCl i KCO
3
.
•
Pod wpływem ogrzewania
chloran(V) potasu
ulega rozkładowi,
który może przebiegać zależnie od warunków z wydzieleniem róż-
nych produktów. W obecności MnO
2
jako katalizatora KClO
3
roz-
kłada się już w temp. niższej od 600 K na KCl i tlen:
2KClO
3
⎯→ 2KCl + 3O
2
•
Ogrzewany bez dodatków ulega głównie dysproporcjonowaniu:
4KClO
3
⎯→ 3KClO
4
+ KCl
•
Mieszanina chloranów(V) z łatwo utleniającymi się substancjami,
np. z siarką lub substancjami organicznymi, wybucha podczas
ogrzewania.
• Kwas chlorowy(VII)
, HClO
4
, należy do najmocniejszych znanych
kwasów. Jest on również bardzo silnym środkiem utleniającym. W
temperaturze pokojowej stanowi w stanie czystym bezbarwną ole-
istą ciecz, łatwo wybuchającą w czasie ogrzewania w obecności śla-
dów substancji organicznych. Otrzymuje się go w wyniku działania

37
stężonego H
2
SO
4
na chlorany(VII), które, jak już wspomniano,
powstają w czasie ogrzewania chloranów(V).
• Chlorany(VII)
są na ogół bardzo dobrze rozpuszczalne w wodzie.
Wyjątek stanowią chlorany(VII): potasu, rubidu, cezu i amonu. Z
tego względu kwas chlorowy(VII) znajduje zastosowanie w chemii
analitycznej jako odczynnik służący do strącania jonów potasu w
postaci trudno rozpuszczalnego związku.
•
Na stopniu
utlenienia VII
również
brom i jod
tworzą oksokwasy,
znane zarówno w postaci soli jak i w postaci wolnej. Sole
kwasu
bromowego(VII)
, HBrO
4
, powstają w czasie utleniania bromia-
nów(V) za pomocą szczególnie silnych utleniaczy, np. fluoru lub
fluorku ksenonu, XeF
2
.
• Kwas jodowy(VII)
, H
5
IO
6
, różni się od kwasu chlorowego i bro-
mowego(VII) wyższym stopniem uwodnienia, co powoduje, że jest
on kwasem dość słabym.
Wyszukiwarka
Podobne podstrony:
zjawisko fluoroscencji, MiBM UWM 1 i 2 semestr
~$ ANTYBIOTYKI RÓŻNE FLUOROCHINOLONY
KWAS FLUOROWODOROWY, BHP KARTA CHARAKTERYSTYKI SUBSTANCJI NIEBEZPIECZNEJ
Amonu fluoroboran
Magnezu fluorokrzemian r r
Cynku fluoroboran r r@
Polimery fluorowe, Chemia, Prace, Prace
Zw fluorowców z wodorem
Fluorowcopochodne weglowodorow
Fluorowcopochodne weglowodorow
Fluorowce
Fluorowce 3
Metody profilaktyki fluorowej
2 Otrzymywanie fluorowców
5.Związki węgla z fluorowcami1, charakterystyka poszczególnych grup układu okresowego
Kwas fluorowodorowy min p techn
więcej podobnych podstron