
ROLA ENZYMÓW
ROLA ENZYMÓW
W REGULACJI
W REGULACJI
METABOLIZMU CZŁOWIEKA
METABOLIZMU CZŁOWIEKA

W żywym organizmie zachodzą
W żywym organizmie zachodzą
wszystkie procesy fizjologiczne z
wszystkie procesy fizjologiczne z
odpowiednią szybkością, którą
odpowiednią szybkością, którą
regulują katalizatory biologiczne
regulują katalizatory biologiczne
(biokatalizatory) –
(biokatalizatory) –
enzymy
enzymy
, które
, które
mają charakter białkowy.
mają charakter białkowy.

Enzymy
Enzymy
są biokatalizatorami
są biokatalizatorami
wytwarzanymi przez żywe
wytwarzanymi przez żywe
organizmy.
organizmy.
Przyspieszają szybkość reakcji
Przyspieszają szybkość reakcji
zachodzących w organizmie, poprzez
zachodzących w organizmie, poprzez
obniżanie energii aktywacji.
obniżanie energii aktywacji.

PODZIAŁ ENZYMÓW
PODZIAŁ ENZYMÓW
Zgodnie z zaleceniami Międzynarodowej Unii Biochemicznej
Zgodnie z zaleceniami Międzynarodowej Unii Biochemicznej
enzymy dzielimy na sześć głównych klas:
enzymy dzielimy na sześć głównych klas:
1)
1)
oksydoreduktazy - katalizujące reakcje
oksydoreduktazy - katalizujące reakcje
oksydoredukcyjne,
oksydoredukcyjne,
2) transferazy - katalizujące przenoszenie określonych grup
2) transferazy - katalizujące przenoszenie określonych grup
pomiędzy poszczególnymi związkami,
pomiędzy poszczególnymi związkami,
3) hydrolazy - katalizujące rozkład różnych wiązań z
3) hydrolazy - katalizujące rozkład różnych wiązań z
udziałem cząsteczek wody,
udziałem cząsteczek wody,
4) liazy - katalizujące odłączenie grup od substratu bez
4) liazy - katalizujące odłączenie grup od substratu bez
udziału cząsteczek wody,
udziału cząsteczek wody,
5) izomerazy - katalizujące reakcje izomeryzacji,
5) izomerazy - katalizujące reakcje izomeryzacji,
6) ligazy (syntetazy) - katalizujące wytwarzanie wiązań
6) ligazy (syntetazy) - katalizujące wytwarzanie wiązań
pomiędzy atomami w cząsteczkach substratów.
pomiędzy atomami w cząsteczkach substratów.

Ze względu na
Ze względu na
budowę
budowę
enzymy dzielimy
enzymy dzielimy
na:
na:
a)
a)
proste
proste
- zbudowane jedynie z
- zbudowane jedynie z
aminokwasów
aminokwasów
(np. amylaza, ureaza, aldolaza,
(np. amylaza, ureaza, aldolaza,
enzymy proteolityczne),
enzymy proteolityczne),
b)
b)
złożone
złożone
- zbudowane z komponentu
- zbudowane z komponentu
białkowego i niebiałkowego, którym
białkowego i niebiałkowego, którym
może być:
może być:
- grupa prostetyczna (np. porfiryny w
- grupa prostetyczna (np. porfiryny w
oksydazie cytochromowej,
oksydazie cytochromowej,
katalazie, peroksydazie);
katalazie, peroksydazie);
- koenzym (np. NAD w
- koenzym (np. NAD w
dehydrogenazie mleczanowej).
dehydrogenazie mleczanowej).

Kolejną klasyfikacją jest
Kolejną klasyfikacją jest
podział
podział
diagnostyczny
diagnostyczny
, obejmujący
, obejmujący
trzy grupy enzymów:
trzy grupy enzymów:
- sekrecyjne (wydzielnicze),
- sekrecyjne (wydzielnicze),
- indykatorowe (wskaźnikowe),
- indykatorowe (wskaźnikowe),
- ekskrecyjne (wydalnicze).
- ekskrecyjne (wydalnicze).

Enzymy sekrecyjne
Enzymy sekrecyjne
(pozakomórkowe)
(pozakomórkowe)
są wydzielane do krwi z komórek,
są wydzielane do krwi z komórek,
będąc potwierdzeniem prawidłowo
będąc potwierdzeniem prawidłowo
zachodzących procesów
zachodzących procesów
anabolicznych.
anabolicznych.
Procesy doprowadzające do
Procesy doprowadzające do
uszkodzenia komórek przyczyniają
uszkodzenia komórek przyczyniają
się do spadku aktywności tych
się do spadku aktywności tych
enzymów.
enzymów.

Enzymy indykatorowe
Enzymy indykatorowe
w warunkach
w warunkach
fizjologicznych charakteryzują się niewielką
fizjologicznych charakteryzują się niewielką
aktywnością w osoczu, będąc przejawem
aktywnością w osoczu, będąc przejawem
ciągłego obumierania komórek.
ciągłego obumierania komórek.
Są to enzymy struktur komórkowych, do których
Są to enzymy struktur komórkowych, do których
zaliczają się:
zaliczają się:
•
najłatwiej przenikające do krwi enzymy
najłatwiej przenikające do krwi enzymy
cytoplazmatyczne, związane z przemianą cukrów
cytoplazmatyczne, związane z przemianą cukrów
(aldolaza, dehydrogenaza mleczanowa) lub
(aldolaza, dehydrogenaza mleczanowa) lub
aminokwasów (aminotransferazy),
aminokwasów (aminotransferazy),
•
enzymy mitochondrialne związane z utlenianiem
enzymy mitochondrialne związane z utlenianiem
w cyklu Krebsa (dehydrogenaza izocytrynianowa i
w cyklu Krebsa (dehydrogenaza izocytrynianowa i
jabłczanowa), cyklu kwasów tłuszczowych i
jabłczanowa), cyklu kwasów tłuszczowych i
łańcucha oddechowego.
łańcucha oddechowego.

Wzrost aktywności enzymów
Wzrost aktywności enzymów
indykatorowych jest proporcjonalny
indykatorowych jest proporcjonalny
do stopnia uszkodzenia narządów.
do stopnia uszkodzenia narządów.

Enzymy ekskrecyjne (komórkowe)
Enzymy ekskrecyjne (komórkowe)
są
są
wydzielane z wydalinami ustrojowymi.
wydzielane z wydalinami ustrojowymi.
Wydzielające je komórki przekazują niewielką
Wydzielające je komórki przekazują niewielką
ich ilość również do krwi.
ich ilość również do krwi.
Są to enzymy wydzielane z gruczołów
Są to enzymy wydzielane z gruczołów
wydzielniczych ze śliną (alfa-amylaza), z żółcią
wydzielniczych ze śliną (alfa-amylaza), z żółcią
(fosfataza zasadowa), enzymy trzustkowe
(fosfataza zasadowa), enzymy trzustkowe
(trypsyna, chymotrypsyna, alfa-amylaza,
(trypsyna, chymotrypsyna, alfa-amylaza,
lipaza).
lipaza).
W przypadku utrudnionego odpływu wydzielin
W przypadku utrudnionego odpływu wydzielin
(np. zaczopowanie przewodów wydzielniczych
(np. zaczopowanie przewodów wydzielniczych
kamieniem lub guzem nowotworowym),
kamieniem lub guzem nowotworowym),
obserwuje się wzrost ich aktywności we krwi.
obserwuje się wzrost ich aktywności we krwi.

Diagnostyka enzymologiczna daje
Diagnostyka enzymologiczna daje
nam możliwość diagnozy:
nam możliwość diagnozy:
»
marskości wątroby,
marskości wątroby,
»
stanów zapalnych wątroby,
stanów zapalnych wątroby,
»
zawału mięśnia sercowego,
zawału mięśnia sercowego,
»
zapalenia dróg żółciowych,
zapalenia dróg żółciowych,
»
chorób trzustki,
chorób trzustki,
»
gruczołu krokowego,
gruczołu krokowego,
»
chorób kości,
chorób kości,
»
niedokrwistości,
niedokrwistości,
»
dystrofii mięśni.
dystrofii mięśni.


TROPONINA
TROPONINA
Nowym i swoistym markerem zawału serca jest
Nowym i swoistym markerem zawału serca jest
zwiększenie stężenia troponiny T
zwiększenie stężenia troponiny T
, stanowiącej
, stanowiącej
składnik kompleksu białek kurczliwych,
składnik kompleksu białek kurczliwych,
odpowiedzialnych za skurcz mięśni poprzecznie
odpowiedzialnych za skurcz mięśni poprzecznie
prążkowanych.
prążkowanych.
Zwiększenie stężenia, przekraczające nawet 100-
Zwiększenie stężenia, przekraczające nawet 100-
krotnie wartości prawidłowe, obserwuje się już w
krotnie wartości prawidłowe, obserwuje się już w
pierwszej dobie zawału
pierwszej dobie zawału
.
.
Dynamika i wielkość wzrostu
Dynamika i wielkość wzrostu
dodatnio koreluje
dodatnio koreluje
z
z
reperfuzją niedokrwiennego obszaru mięśnia
reperfuzją niedokrwiennego obszaru mięśnia
sercowego.
sercowego.
Wartości prawidłowe cTnI < 0,03 ng/ml.
Wartości prawidłowe cTnI < 0,03 ng/ml.
Wartości powyżej > 0,5 ng/ml wskazuje na zawał
Wartości powyżej > 0,5 ng/ml wskazuje na zawał
serca.
serca.

Oznaczając aktywność kilku enzymów można
Oznaczając aktywność kilku enzymów można
określić czas jaki upłynął od powstała zawału i
określić czas jaki upłynął od powstała zawału i
śledzić przebieg choroby.
śledzić przebieg choroby.
W zawale mięśnia sercowego:
W zawale mięśnia sercowego:
- z transaminaz
- z transaminaz
rośnie AspAT
rośnie AspAT
,
,
-
aktywność
aktywność
ALAT
ALAT
jest
jest
mniejsza
mniejsza
, obserwuje
, obserwuje
się
się
nieznaczny wzrost, ale później.
nieznaczny wzrost, ale później.
Jeżeli dochodzi do znacznego wzrostu
Jeżeli dochodzi do znacznego wzrostu
ALAT
ALAT
, to
, to
świadczy to o współistnieniu choroby wątroby.
świadczy to o współistnieniu choroby wątroby.

Cennym badaniem jest
Cennym badaniem jest
oznaczanie CPK.
oznaczanie CPK.
Niedogodnością jest to, że wzrost tego enzymu
Niedogodnością jest to, że wzrost tego enzymu
obserwuje się nie tylko przy zawale, lecz także przy
obserwuje się nie tylko przy zawale, lecz także przy
uszkodzeniu mięśni szkieletowych w pewnym
uszkodzeniu mięśni szkieletowych w pewnym
rodzaju dystrofii mięśni i po bardzo intensywnym
rodzaju dystrofii mięśni i po bardzo intensywnym
wysiłku fizycznym.
wysiłku fizycznym.
CPK występuje pod postacią trzech izoenzymów:
CPK występuje pod postacią trzech izoenzymów:
CPK MM - typ mięśniowy,
CPK MM - typ mięśniowy,
CPK MB - typ sercowy,
CPK MB - typ sercowy,
CPK BB -typ mózgowy.
CPK BB -typ mózgowy.
U pacjentów z zawałem wzrasta MB. Poziom tego
U pacjentów z zawałem wzrasta MB. Poziom tego
izoenzymu powraca szybciej do normy, niż całkowita
izoenzymu powraca szybciej do normy, niż całkowita
aktywność. Oznaczając ten izoenzym w celu
aktywność. Oznaczając ten izoenzym w celu
monitorowania choroby można uchwycić ewentualny
monitorowania choroby można uchwycić ewentualny
drugi zawał.
drugi zawał.

Aktywność LDH (dehydrogenaza mleczanowa)
Aktywność LDH (dehydrogenaza mleczanowa)
wzrasta nie tylko przy zawale, ale też w
wzrasta nie tylko przy zawale, ale też w
schorzeniach wątroby, mięśni, nerek, dlatego też
schorzeniach wątroby, mięśni, nerek, dlatego też
do diagnostyki wykorzystuje się izoenzymy.
do diagnostyki wykorzystuje się izoenzymy.
LDH ma 5 izoenzymów.
LDH ma 5 izoenzymów.
LDH
LDH
1
1
występuje w tkankach z przewagą przemian
występuje w tkankach z przewagą przemian
tlenowych - serce, mózg, kora nerki.
tlenowych - serce, mózg, kora nerki.
W tkankach, w których są przemiany beztlenowe -
W tkankach, w których są przemiany beztlenowe -
m. szkieletowe, wątroba, rdzeń nerki - występuje
m. szkieletowe, wątroba, rdzeń nerki - występuje
LDH
LDH
5
5
.
.

AMYLAZA
AMYLAZA
Amylazy są enzymami hydrolizującymi wiązania
Amylazy są enzymami hydrolizującymi wiązania
α-1,4-glikozydowe i β-1,6 glikozydowe
α-1,4-glikozydowe i β-1,6 glikozydowe
w α-glikanach (skrobia, glikogen).
w α-glikanach (skrobia, glikogen).
Znane są trzy rodzaje amylaz:
Znane są trzy rodzaje amylaz:
-
α-amylaza (endoamylaza),
α-amylaza (endoamylaza),
-
β-amylaza (egzoamylaza)
β-amylaza (egzoamylaza)
-
γ-amylaza, zwana również
γ-amylaza, zwana również
glukoamylazą
glukoamylazą
(egzoamylaza).
(egzoamylaza).

U człowieka i zwierząt występują
U człowieka i zwierząt występują
α-amylaza i γ-
α-amylaza i γ-
amylaza
amylaza
.
.
Pierwszą z nich stwierdza się w:
Pierwszą z nich stwierdza się w:
-
trzustce,
trzustce,
-
gruczołach ślinowych,
gruczołach ślinowych,
-
wątrobie,
wątrobie,
- nerkach,
- nerkach,
-
płucach,
płucach,
-
mniejszych ilościach w śledzionie,
mniejszych ilościach w śledzionie,
-
mięśniach szkieletowych,
mięśniach szkieletowych,
-
sercu,
sercu,
-
mózgu.
mózgu.
Z płynów ustrojowych największą aktywność
Z płynów ustrojowych największą aktywność
amylazy wykazują
amylazy wykazują
sok trzustkowy i ślina
sok trzustkowy i ślina
, mniejszą -
, mniejszą -
osocze i mocz
osocze i mocz
.
.
Z kolei
Z kolei
γ-amylaza
γ-amylaza
pochodzi z komórek
pochodzi z komórek
nabłonkowych jelita cienkiego
nabłonkowych jelita cienkiego
.
.

Największe znaczenie kliniczne ma
Największe znaczenie kliniczne ma
oznaczanie aktywności amylazy w
oznaczanie aktywności amylazy w
przypadku
przypadku
schorzeń trzustki i ślinianek.
schorzeń trzustki i ślinianek.
W praktyce przeprowadza się
W praktyce przeprowadza się
równolegle oznaczanie aktywności
równolegle oznaczanie aktywności
enzymu w surowicy i w moczu.
enzymu w surowicy i w moczu.
Oznaczanie aktywności amylazy w wielu
Oznaczanie aktywności amylazy w wielu
innych ostrych stanach zapalnych jamy
innych ostrych stanach zapalnych jamy
brzusznej może być wykorzystywane do
brzusznej może być wykorzystywane do
ich różnicowania.
ich różnicowania.

Wzrost aktywności α-amylazy w
Wzrost aktywności α-amylazy w
surowicy krwi obserwuje się w:
surowicy krwi obserwuje się w:
1. Chorobach trzustki
1. Chorobach trzustki
2. Chorobach ślinianek
2. Chorobach ślinianek
3. Chorobach przewodu pokarmowego
3. Chorobach przewodu pokarmowego
4. Inne -
4. Inne -
radioterapia, chemioterapia
radioterapia, chemioterapia

Spadek aktywności α-amylazy
Spadek aktywności α-amylazy
występuje w:
występuje w:
- martwicy trzustki,
- martwicy trzustki,
-
zatruciach: barbituranami,
zatruciach: barbituranami,
tetrachlorkiem
tetrachlorkiem
węgla, metalami ciężkimi.
węgla, metalami ciężkimi.

TRANSFERAZY -
TRANSFERAZY -
AMINOTRANSFERAZY
AMINOTRANSFERAZY

Aminotransferazy
Aminotransferazy
są to enzymy
są to enzymy
transaminujące (przenoszące grupy –NH
transaminujące (przenoszące grupy –NH
2
2
) z
) z
aminokwasów na
aminokwasów na
α-ketokwasy.
α-ketokwasy.
W diagnostyce klinicznej największe
W diagnostyce klinicznej największe
znaczenie ma oznaczanie aktywności dwóch
znaczenie ma oznaczanie aktywności dwóch
aminotransferaz: aminotransferazy
aminotransferaz: aminotransferazy
asparaginowej - AspAT katalizującej
asparaginowej - AspAT katalizującej
odwracalną reakcję:
odwracalną reakcję:

Najwyższą aktywność AspAT i AlAT
Najwyższą aktywność AspAT i AlAT
wykazują:
wykazują:
- wątroba,
- wątroba,
- serce,
- serce,
- mięśnie szkieletowe,
- mięśnie szkieletowe,
- nerki.
- nerki.

Wątroba i serce zawierają obie
Wątroba i serce zawierają obie
aminotransferazy, z tym że w
aminotransferazy, z tym że w
sercu przeważa aktywność
sercu przeważa aktywność
AspAT
AspAT
,
,
natomiast w wątrobie
natomiast w wątrobie
AlAT
AlAT
.
.
Ponieważ AspAT i AlAT zaliczane są
Ponieważ AspAT i AlAT zaliczane są
do
do
enzymów wskaźnikowych
enzymów wskaźnikowych
,
,
wzrost ich aktywności w surowicy
wzrost ich aktywności w surowicy
świadczy o stopniu uszkodzenia
świadczy o stopniu uszkodzenia
narządu.
narządu.

ZNACZENIE KLINICZNE
ZNACZENIE KLINICZNE
-
Oznaczania aktywności AspAT i AlAT
Oznaczania aktywności AspAT i AlAT
ogranicza się głównie do
ogranicza się głównie do
rozpoznawania chorób wątroby i serca.
rozpoznawania chorób wątroby i serca.
-
Można obliczyć tzw. współczynnik De
Można obliczyć tzw. współczynnik De
Rittisa, czyli stosunek aktywności
Rittisa, czyli stosunek aktywności
AspAT do AlAT. Prawidłowo powinien
AspAT do AlAT. Prawidłowo powinien
przyjmować wartość około 1.
przyjmować wartość około 1.

Aktywność aminotransferaz oznacza się
Aktywność aminotransferaz oznacza się
również w schorzeniach mięśnia
również w schorzeniach mięśnia
sercowego, szczególnie przy zawale.
sercowego, szczególnie przy zawale.
W 6-12 godzin po dokonaniu się zawału
W 6-12 godzin po dokonaniu się zawału
aktywność AspAT w surowicy zaczyna
aktywność AspAT w surowicy zaczyna
wzrastać.
wzrastać.
Aktywność AlAT nie zmienia się lub wzrasta
Aktywność AlAT nie zmienia się lub wzrasta
nieznacznie.
nieznacznie.
Doprowadza to do wzrostu wartości
Doprowadza to do wzrostu wartości
współczynnika De Rittisa.
współczynnika De Rittisa.

TRANSFERAZY -
TRANSFERAZY -
Kinaza fosfokreatynowa
Kinaza fosfokreatynowa
Kinaza fosfokreatynowa (CPK) jest
Kinaza fosfokreatynowa (CPK) jest
biokatalizatorem reakcji:
biokatalizatorem reakcji:

Enzym ten występuje szczególnie
Enzym ten występuje szczególnie
obficie w mięśniach szkieletowych,
obficie w mięśniach szkieletowych,
mięśniu sercowym i w mózgu.
mięśniu sercowym i w mózgu.
Oznaczanie aktywności tego enzymu
Oznaczanie aktywności tego enzymu
ma istotne znaczenie kliniczne przede
ma istotne znaczenie kliniczne przede
wszystkim w chorobach serca, a
wszystkim w chorobach serca, a
zwłaszcza w badaniu zawału mięśnia
zwłaszcza w badaniu zawału mięśnia
sercowego.
sercowego.
Wzrost powyżej 5% świadczy o zawale
Wzrost powyżej 5% świadczy o zawale
mięśnia sercowego.
mięśnia sercowego.

TRANSFERAZY -
TRANSFERAZY -
Gamma-Glutamylotranspeptydaza
Gamma-Glutamylotranspeptydaza
Gamma-glutamylotranspeptydaza (GGTP) katalizuje
Gamma-glutamylotranspeptydaza (GGTP) katalizuje
przeniesienie reszty γ-glutamylowej z donora na
przeniesienie reszty γ-glutamylowej z donora na
odpowiedni akceptor.
odpowiedni akceptor.
Reakcje te można przedstawić schematycznie:
Reakcje te można przedstawić schematycznie:

Enzym występuje w wielu tkankach,
Enzym występuje w wielu tkankach,
w największym stężeniu w tkankach
w największym stężeniu w tkankach
aktywnie transportujących
aktywnie transportujących
aminokwasy (nerki).
aminokwasy (nerki).
Znacznie niższą aktywnością
Znacznie niższą aktywnością
charakteryzują się wątroba,
charakteryzują się wątroba,
trzustka, mózg oraz mięsień
trzustka, mózg oraz mięsień
sercowy.
sercowy.

Zasadniczym źródłem GGTP w surowicy
Zasadniczym źródłem GGTP w surowicy
krwi jest
krwi jest
wątroba
wątroba
, a wzrost jego aktywności
, a wzrost jego aktywności
w surowicy zwykle wynika z chorób tego
w surowicy zwykle wynika z chorób tego
narządu.
narządu.
Aktywność GGTP rośnie w ostrym
Aktywność GGTP rośnie w ostrym
zapaleniu wątroby, ale występuje to
zapaleniu wątroby, ale występuje to
stosunkowo późno i utrzymuje się wiele
stosunkowo późno i utrzymuje się wiele
tygodni także wtedy, gdy aktywność
tygodni także wtedy, gdy aktywność
innych enzymów, np. aminotransferaz,
innych enzymów, np. aminotransferaz,
powróciła do wartości prawidłowych.
powróciła do wartości prawidłowych.

Podobnie zachowuje się aktywność GGTP w przebiegu
Podobnie zachowuje się aktywność GGTP w przebiegu
zawału mięśnia sercowego. Zwiększa się nie
zawału mięśnia sercowego. Zwiększa się nie
wcześniej niż po 4-5 dniach, wartości maksymalne
wcześniej niż po 4-5 dniach, wartości maksymalne
osiąga w 2-3 tygodniu choroby, powracając do normy
osiąga w 2-3 tygodniu choroby, powracając do normy
pomiędzy 4 a 6 tygodniem po zawale.
pomiędzy 4 a 6 tygodniem po zawale.
Oznaczanie aktywności GGTP w surowicy jest zatem
Oznaczanie aktywności GGTP w surowicy jest zatem
tzw. późnym wskaźnikiem zawału mięśnia sercowego.
tzw. późnym wskaźnikiem zawału mięśnia sercowego.
Badania biochemiczne, służące do diagnostyki
Badania biochemiczne, służące do diagnostyki
zawału mięśnia sercowego, są badaniami
zawału mięśnia sercowego, są badaniami
obowiązkowymi, ponieważ nie zawsze zawał daje
obowiązkowymi, ponieważ nie zawsze zawał daje
zmiany w zapisie EKG (tzw. zawały „nieme").
zmiany w zapisie EKG (tzw. zawały „nieme").
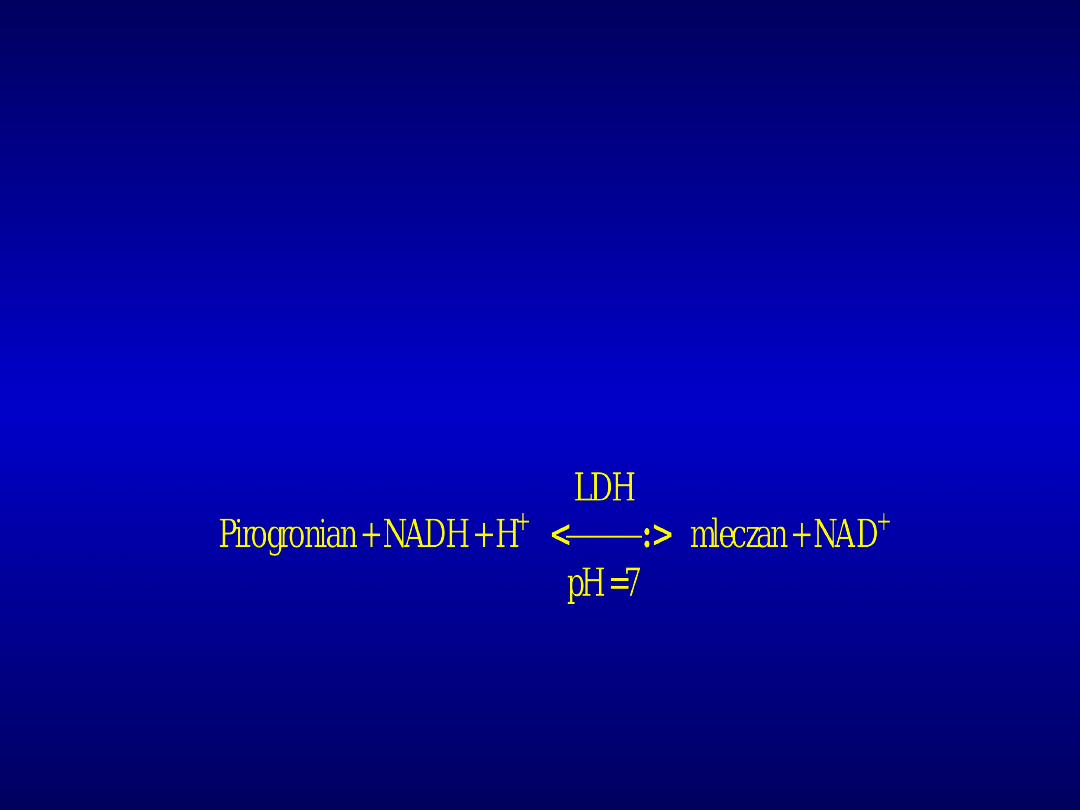
DEHYDROGENAZA MLECZANOWA
DEHYDROGENAZA MLECZANOWA
Dehydrogenaza mleczanowa (LDH) jest enzymem
Dehydrogenaza mleczanowa (LDH) jest enzymem
cytoplazmatycznym katalizującym końcowy etap
cytoplazmatycznym katalizującym końcowy etap
glikolizy:
glikolizy:

Enzym ten jest obecny niemal we
Enzym ten jest obecny niemal we
wszystkich komórkach i płynach
wszystkich komórkach i płynach
ustrojowych człowieka.
ustrojowych człowieka.
Największą aktywność stwierdza się
Największą aktywność stwierdza się
w wątrobie, mięśniach
w wątrobie, mięśniach
szkieletowych, nerkach, mięśniu
szkieletowych, nerkach, mięśniu
sercowym i płucach.
sercowym i płucach.
Wzrost aktywności LDH w surowicy
Wzrost aktywności LDH w surowicy
obserwuje się zatem we wszystkich
obserwuje się zatem we wszystkich
stanach przebiegających z martwicą
stanach przebiegających z martwicą
tkanek.
tkanek.

FOSFATAZY
FOSFATAZY
Fosfatazy należą do hydrolaz i
Fosfatazy należą do hydrolaz i
katalizują reakcje odszczepiania
katalizują reakcje odszczepiania
reszt kwasu ortofosforowego z jego
reszt kwasu ortofosforowego z jego
organicznych połączeń zgodnie z
organicznych połączeń zgodnie z
reakcją:
reakcją:
R-O-PO
R-O-PO
3
3
H
H
2
2
+ H
+ H
2
2
O ——> R-OH +
O ——> R-OH +
H
H
3
3
PO
PO
4
4

Fosfataza zasadowa
Fosfataza zasadowa
Fosfataza zasadowa (AP)
Fosfataza zasadowa (AP)
w surowicy
w surowicy
krwi pochodzi z komórek kości, nabłonka
krwi pochodzi z komórek kości, nabłonka
wyścielającego kanaliki żółciowe, z błony
wyścielającego kanaliki żółciowe, z błony
śluzowej jelit, wytwarzana jest także przez
śluzowej jelit, wytwarzana jest także przez
łożysko, niektóre tkanki nowotworowe i
łożysko, niektóre tkanki nowotworowe i
nerki.
nerki.
Optimum pH dla tego enzymu waha się w
Optimum pH dla tego enzymu waha się w
granicach
granicach
8,5-10.
8,5-10.

Fosfataza zasadowa
Fosfataza zasadowa
aktywowana jest
aktywowana jest
przez jony manganu, magnezu i kobaltu,
przez jony manganu, magnezu i kobaltu,
hamowana natomiast przez związki mające
hamowana natomiast przez związki mające
zdolność tworzenia kompleksów z
zdolność tworzenia kompleksów z
metalami oraz przez związki reagujące z
metalami oraz przez związki reagujące z
grupami aminowymi, fosforany i grupy
grupami aminowymi, fosforany i grupy
alkoholowe.
alkoholowe.
Wzrost aktywności
Wzrost aktywności
fosfatazy zasadowej
fosfatazy zasadowej
w
w
surowicy spotyka się przede wszystkim w:
surowicy spotyka się przede wszystkim w:
- chorobach kości (np. krzywica,
- chorobach kości (np. krzywica,
nowotwory kości),
nowotwory kości),
- niedrożności dróg żółciowych,
- niedrożności dróg żółciowych,
- nadczynności przytarczyc.
- nadczynności przytarczyc.

Fosfataza kwaśna
Fosfataza kwaśna
Fosfataza kwaśna (ACP)
Fosfataza kwaśna (ACP)
jest enzymem
jest enzymem
heterogennym i równie mało swoistym
heterogennym i równie mało swoistym
względem substratów jak fosfataza
względem substratów jak fosfataza
zasadowa.
zasadowa.
Optimum pH dla tego enzymu waha się w
Optimum pH dla tego enzymu waha się w
granicach 3,8-6,0.
granicach 3,8-6,0.
Występuje w wątrobie, śledzionie,
Występuje w wątrobie, śledzionie,
nerkach, płytkach krwi, krwinkach
nerkach, płytkach krwi, krwinkach
czerwonych, tkance kostnej, łożysku oraz
czerwonych, tkance kostnej, łożysku oraz
gruczole krokowym.
gruczole krokowym.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
Wyszukiwarka
Podobne podstrony:
Rola glonów w przyrodzie, a gospodarce czlowieka
regulacja metabolizmu wd10
regulacja stosunków człowieka ze światem zewnętrznym (3 str)
regulacja metabolizmu wd2
Wykład 4 Regulacja metabolizmu drobnoustrojów
regulacja metabolizmu weglowodanow
13 Biochemia Hormonalna regulacja metabolizmu
regulacja metabolizmu wd9
regulacja metabolizmu wd6
I. Taranowicz Rola rodziny w opiece nad człowiekiem przewlekle chorym, socjologia rodziny
regulacja metabolizmu wd8
Regulacja metabolizmu glukozy i cukrzyca - P.Barker 2010, Lekarski, Diabetologia
regulacja metabolizmu wd5
Regulacja metabolizmu glukozy i cukrzyca - P.Barker 2007, Okulistyka-Optometria, Podstawy przedklini
ROLA WITAMIN I MINERAŁÓW w organizmie człowieka, Pielęgniarstwo Studia
Rola grup społecznych w życiu człowieka
regulacja metabolizmu wd3i4
TŁUSZCZE rola i znaczenie dla zdrowia człowieka
Rola aktywności fizycznej w życiu człowieka jako istoty ruchowej
więcej podobnych podstron