Regulacja metabolizmu
drobnoustrojów

Metabolity wtórne
• Metabolity ( specyficzne, wtórne,
specjalne, idolity) charakteryzują się
ograniczonym występowaniem w
przyrodzie i brakiem ogólnej,
zasadniczej funkcji biologicznej
wytwarzających je organizmów.

Procesy komórkowe
• Optymalna gospodarka energią
• Regulowana , oszczędna gospodarka
materiałem niezbędnym w procesach
syntez komórkowych
• Optymalna gospodarka produktami
syntez komórkowych

Sterowanie procesem
powstawania
• Selekcja rodzaju mikroorganizmów
• Selekcja gatunków
mikroorganizmów,uwarunkowania
genetyczne
• Warunki środowiskowe
• Skład podłoża
• Proces hodowli mikroorganizmów
• Trudności:
zmienność szlaków metabolicznych
mała specyficzność szlaków metabolicznych

Koordynacja metabolizmu
• Regulacja transkrypcji informacji
genetycznej
• Regulacja aktywności enzymów
• Transport przez błony komórkowe
• Sprzężenie energetyczne
metabolizmu

Mechanizmy komórkowe
• Regulacja szybkości procesów
komórkowych uwarunkowana
czynnikami środowiskowymi
• Równowaga w ilości wytwarzanych i
zużywanych metabolitów
• Energetyczne sprzężenie metabolizmu
• Równowaga w procesach
egzoergicznych i endoergicznych

Sposoby regulacji
• Informacje sygnalne zależne od środowiska określające
syntezę i aktywność enzymów
• Nośniki informacji :
metabolity- efektory wewnątrzkomórkowe
substraty, produkty szlaków metabolicznych
związki wysokoenergetyczne ( np. ATP)
hormony
witaminy
białka receptorowe ( indukcja vs represja procesu
transkrypcji)
indukcja substratowa
represja kataboliczna

Kontrola biosyntezy
metabolitów wtórnych
Represja:
metabolity ( podstawowe i wtórne)
hamowanie kataboliczne
hamowanie w sprzężeniu zwrotnym
Indukcja:
substratowa
efektory metaboliczne

Kontrola biosyntezy
metabolitów wtórnych
Regulacja:
związki N
związki P
regulacja energetyczna
regulacja tlenowa
pierwiastki śladowe
warunki ( temperatura, pH)

Prekursory
• Glu-1-P: nukleozydocukry
• Glu-6-P: pentozy
• Rybozo-5-P: nukleotydy, dezoksynukleotydy
• Fosfoglicerynian: aminokwasy Ser, Gly, Cys
• PEP: aminokwasy aromatyczne
• Pirogronian: aminokwasy Ala, Val, Leu
• Acetylo-CoA: kwasy tłuszczowe,Lys, Arg, Pro
• 2-oksoglutaran: Glu, Arg,Pro, Lys
• Szczawiooctan: Asp, Lys,Thr, Met, Ile

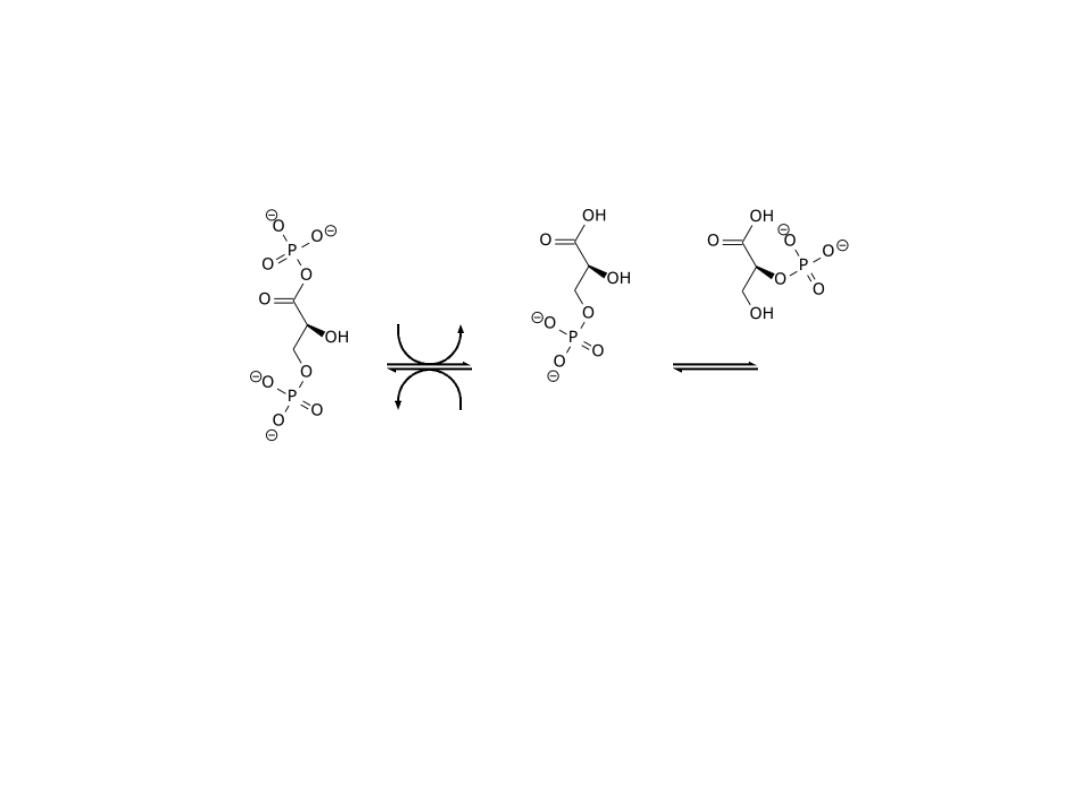
Indukcja substratowa-represja kataboliczna
• Substrat warunkuje syntezę enzymu:
represja kataboliczna ( glukoza i
laktoza, fruktoza i laktoza, octan i
glukoza, cytrynian i glukoza)
• Indukcyjny charakter cAMP i białka
receptorowego CRP
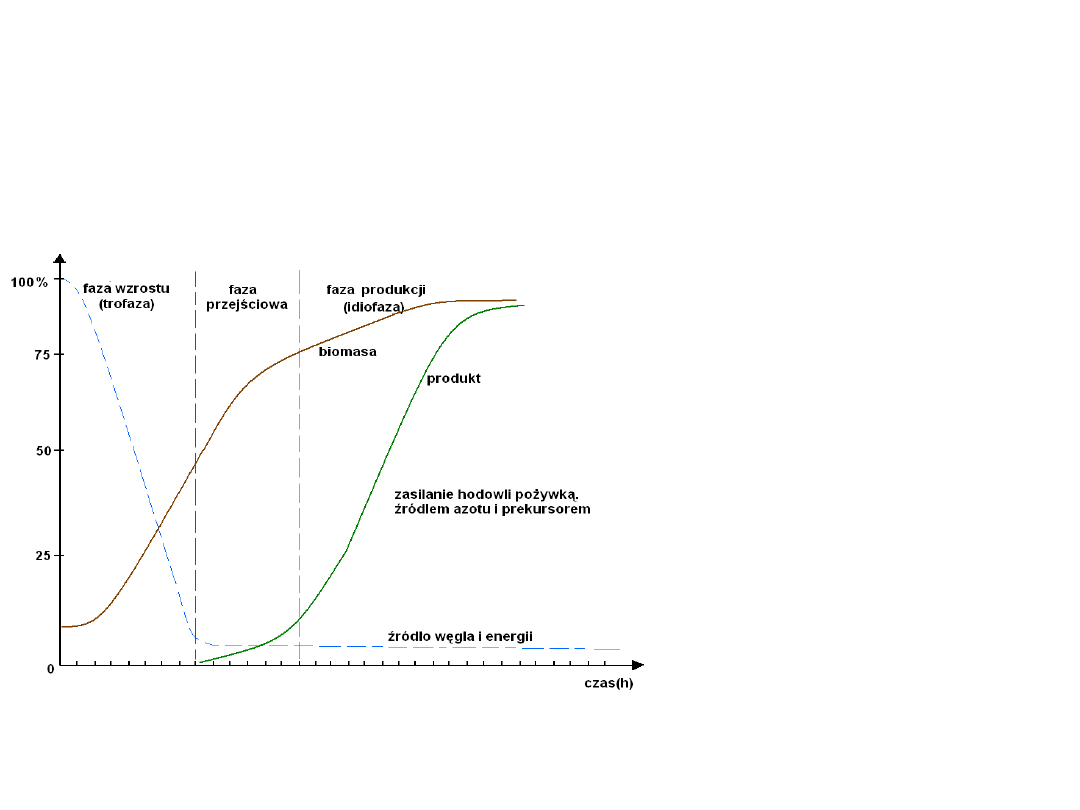
Biosynteza penicyliny
Fazy
produkcji

Represja azotowa (NH4 +)
• Synteza białek nośnikowych
• Hamowanie transportu związków azotowych
• Synteza reduktazy azotanowej, azotynowej
• Synteza proteaz
• Synteza enzymów katabolizmu
aminokwasów, puryn
• Mechanizm: regulator ( efektor
metaboliczny) to kompleks dehydrogenaza
glutaminianowa- jon amoniowy

Represja przez produkty końcowe
szlaku metabolicznego
• Nadmiar aminokwasu ( kontrola
negatywna)
• Nadmiar ATP
• Nadmiar metabolitu wtórnego
• Mechanizm: gen regulatorowy- kompleks
białko represorowe + korepresor
( aminokwas)…. Blokada regionu
operatorowego operonu

Efektory energetyczne
• Trójfosforany nukleozydów: ATP, UTP,
CTP, GTP, PEP, polifosforany)
ATP: hamowanie glikolizy ( modulator
fosfofruktokinazy)
hamowanie cyklu Krebsa( inhibicja
dehydrogenazy izocytrynianowej)
AMP, ADP: stymulacja fruktokinazy(szlak glikolityczny),
stymulacja dehydrogenazy pirogronianowej
( oksydacja pirogronian- acetylo –CoA
Tlen: (Efekt Pasteura) represja fosfofruktokinazy,
aldolazy,kinazy pirogronianowej

Kwas cytrynowy
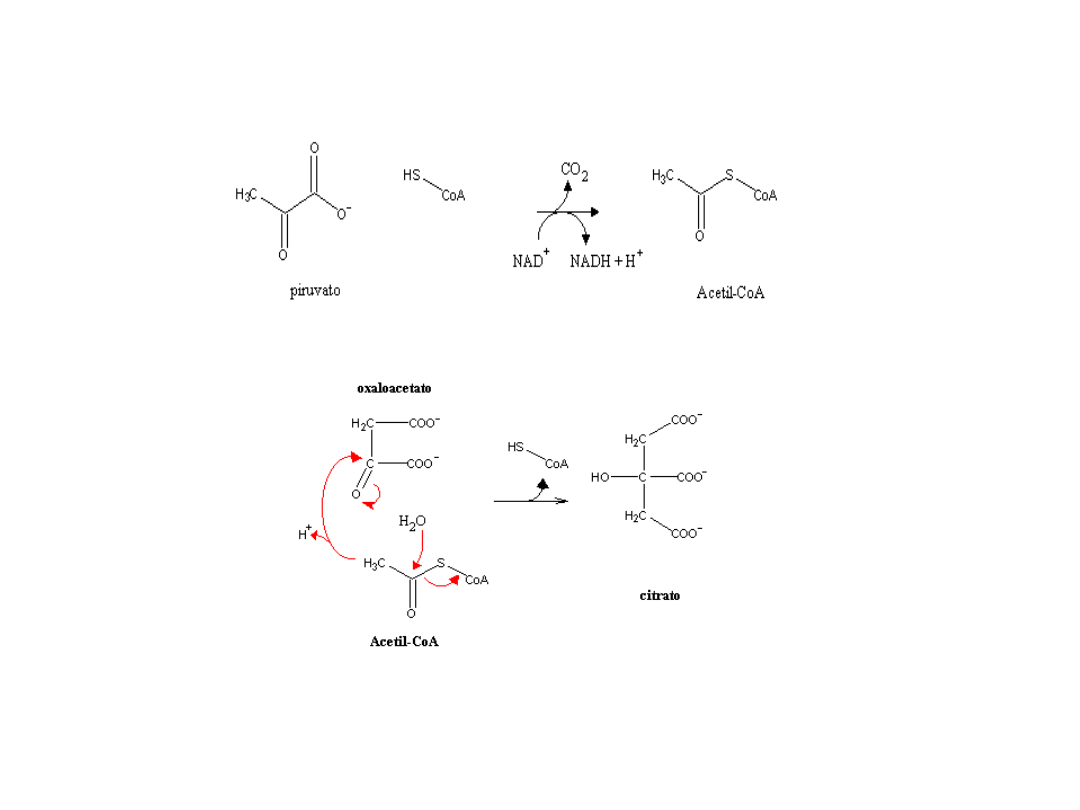
Biosynteza cytrynianu
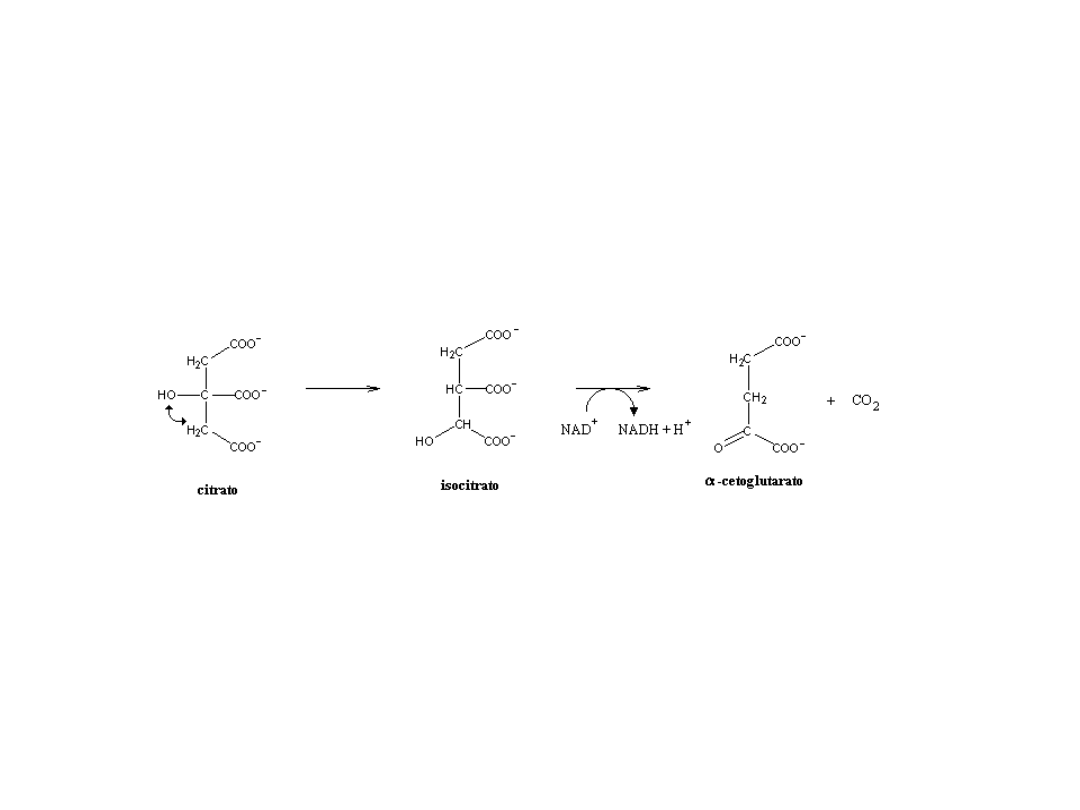
Przemiany cytrynianu

Kwas cytrynowy
Warunki procesu
Blokada cyklu Krebsa: hamowanie procesu oksydacji izocytrynianu
i 2-oksoglutaranu
Zniesienie mechanizmu sprzężenia zwrotnego glikoliza—metabolity
Kwas cytrynowy, ATP, PEP. Aktywność fosfofruktokinazy zachowana

Nadprodukcja kwasu cytrynowego
Aspergillus niger
• Efektywny proces glikolizy
• Aktywna dehydrogenaza pirogronianowa
• ( synteza acetylo-CoA)
• Hamowanie następczych przemian kwasu w cyklu Krebsa
( niska aktywność hydratazy akonitanowej,liazy
izocytrynianowej,dehydrogenazy
izocytrynianowej,dehydrogenazy 2-oksoglutaranowej.
• Zniesienie mechanizmu sprzężenia zwrotnego cytrynian-
glikoliza
• Warunki:
• wysokie stężenie cukru w podłożu i jonu amoniowego, tlenu
• deficyt fosforanu, jonów Mn, Zn, Fe,
• Genetycznie uwarunkowany słaby efekt inhibitora
(cytrynian) na aktywność fosfofruktokinazy

Glikoliza
• Fosfofruktokinaza:
aktywatory: AMP, ADP, NH4+,cAMP,
Pi
inhibitory: ATP, PEP,cytrynian
Kinaza pirogronianowa
aktywatory: fruktozo-
1,6bisfosforan,AMP, ADP.
inhibitory: ATP, PEP, cytrynian

Wytwarzanie
szczawiooctanu
• PEP + pirogronian= szczawiooctan
Inhibicja: asparaginian
Stymulacja: fruktozo-1,6-bisfosforan,
acetylo-CoA
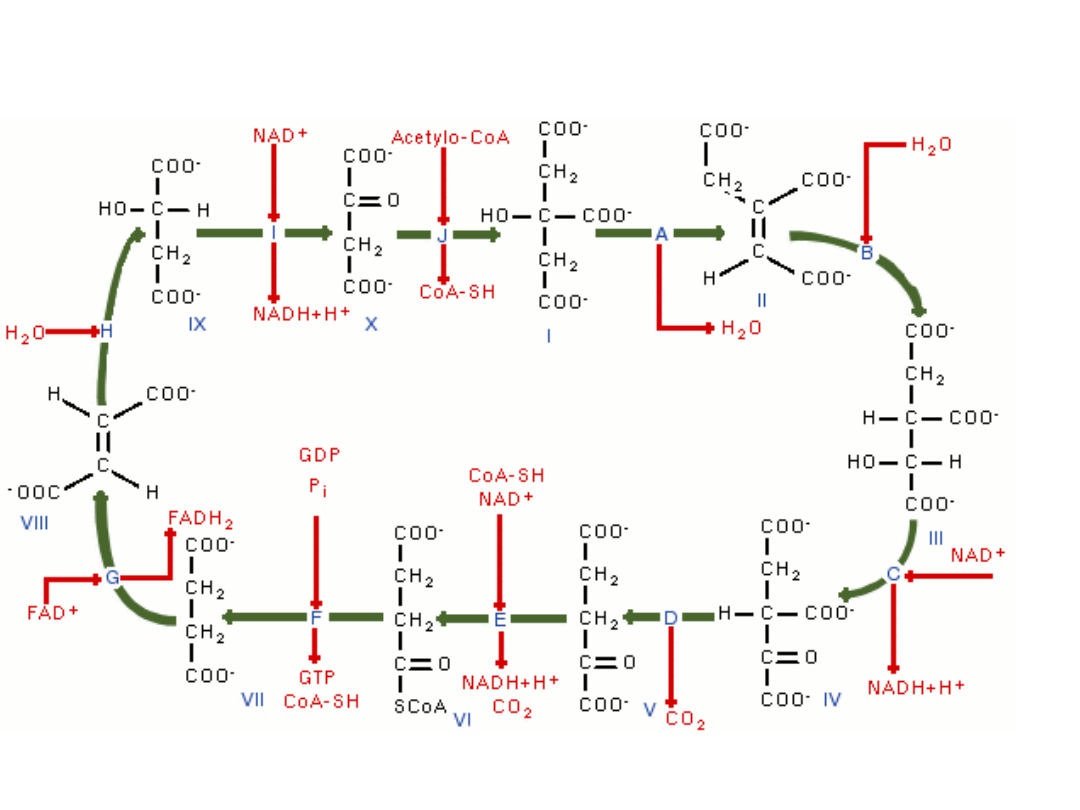
Cykl
Krebsa

Substr
ates
Product
s
Enzyme
Reaction
type
Comment
1
+
CoA +
H
2
O
+
rate limiting stage,
extends the 4C
oxaloacetate to a 6C
molecule
2 Citrate
+
H
2
O
reversible isomerisation
3 cis-
Aconita
te +
H
2
O
4 Isocitra
te +
+
+
generates NADH
(equivalent of 2.5 ATP)
5 Oxalos
uccinat
e
α-
+
CO
2
irreversible stage,
generates a 5C
molecule

The regulation of the TCA cycle is largely determined by substrate
availability and product inhibition. NADH, a product of all dehydrogenases
in the TCA cycle with the exception of
, inhibits
,
and
, and also
inhibits
, while succinyl-CoA inhibits succinyl-CoA synthase and
citrate synthase. When tested in vitro with TCA enzymes, ATP inhibits
citrate synthase and α-ketoglutarate dehydrogenase; however, ATP levels
do not change more than 10% in vivo between rest and vigorous exercise.
There is no known allosteric mechanism that can account for large
changes in reaction rate from an allosteric effector whose concentration
changes less than 10% [6].
Calcium is used as a regulator. It activates pyruvate dehydrogenase,
isocitrate dehydrogenase and α-ketoglutarate dehydrogenase.[7] This
increases the reaction rate of many of the steps in the cycle, and
therefore increases flux throughout the pathway.
Citrate is used for feedback inhibition, as it inhibits phosphofructokinase,
an enzyme involved in glycolysis that catalyses formation of fructose 1,6-
bisphosphate, a precursor of pyruvate. This prevents a constant high rate
of flux when there is an accumulation of citrate and a decrease in
substrate for the enzyme
Regulacja cyklu Krebsa

Cykl Krebsa
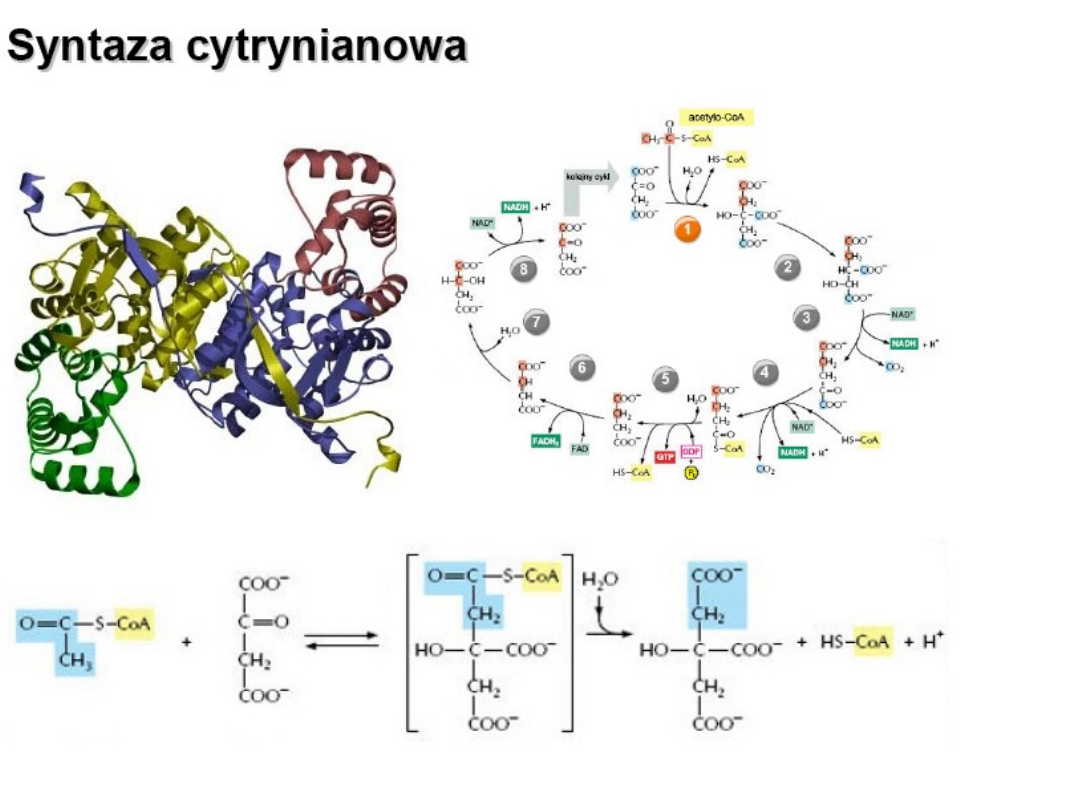
• Syntaza cytrynianowa
• inhibicja ATP, NADH+ H+,2-okso-
glutaran
• Dehydrogenaza izocytrynianowa
• inhibicja ATP, NADH+ H+
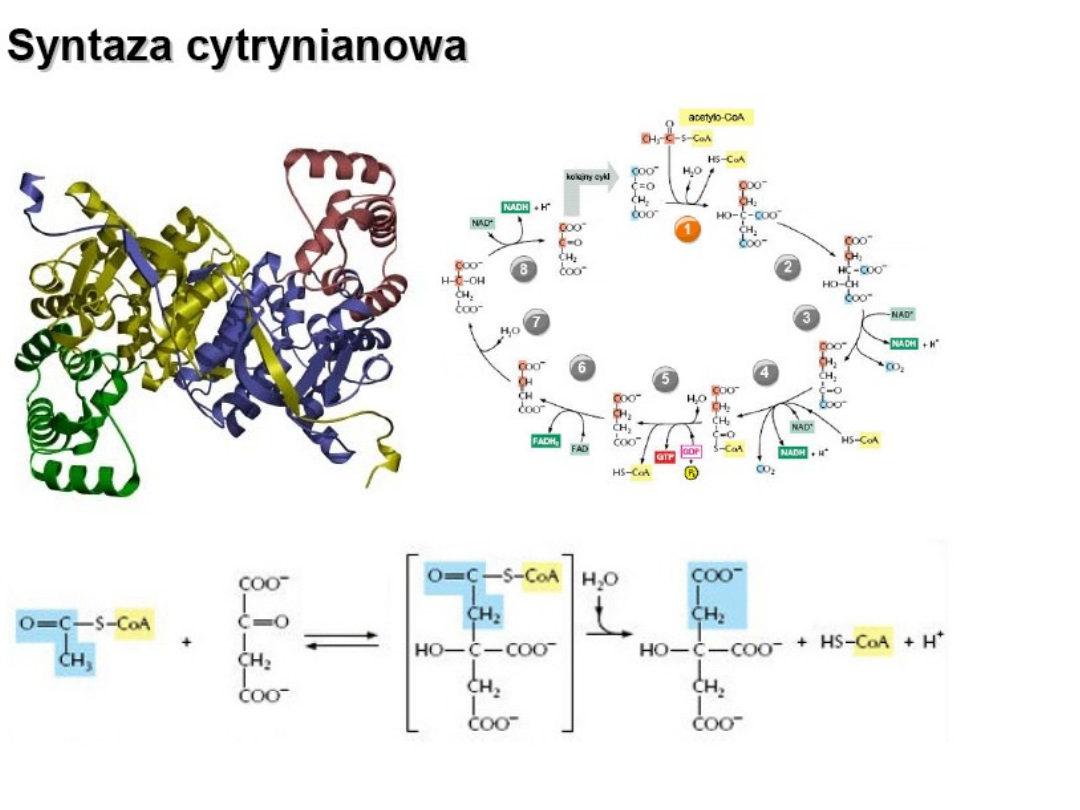
Inhibitor: L-Lys, ATP, NADH + H+; 2-oksoglutaran ( allosterycznie)

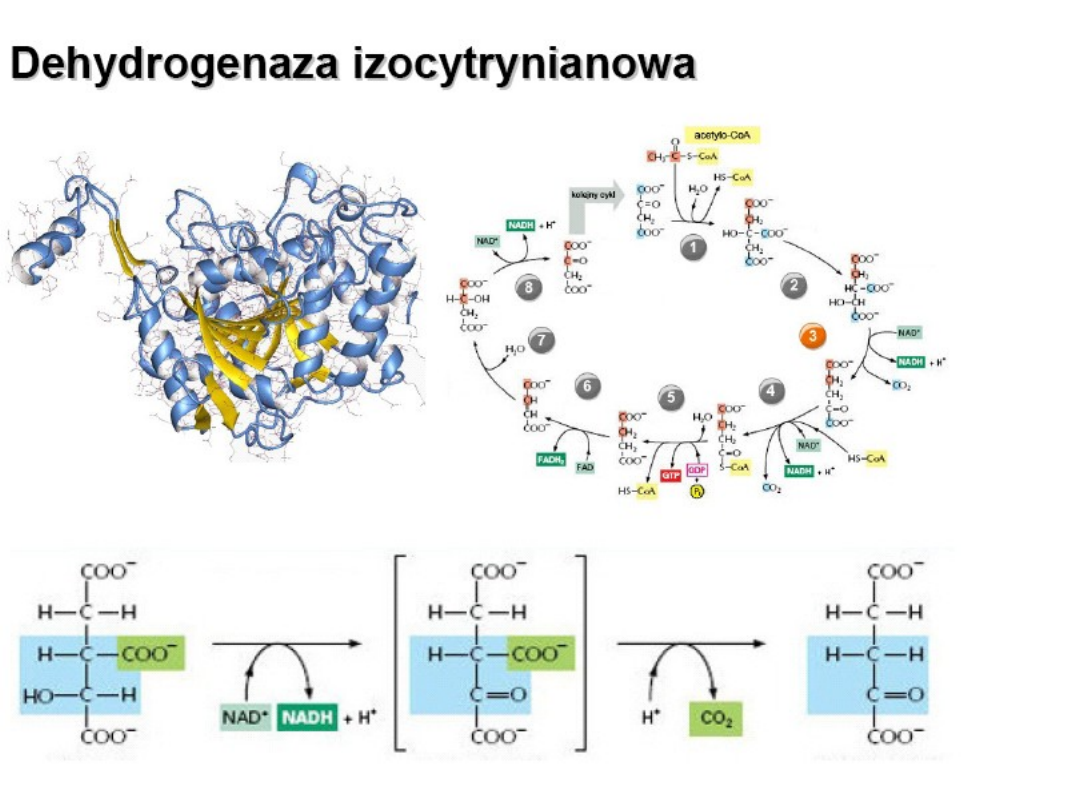
Dehydrogeneza
izocytrynianowa – katalizuje
dekarboksylację oksydacyjną
izocytrynianu , produktem
pośrednim tej reakci jest
szczawiobursztynian
(niestabilny β-ketokwas).
Podczas połączenia z
enzymem traci dwutlenku
węgla i powstaje α-
ketoglutaran
.
Cykl Krebsa
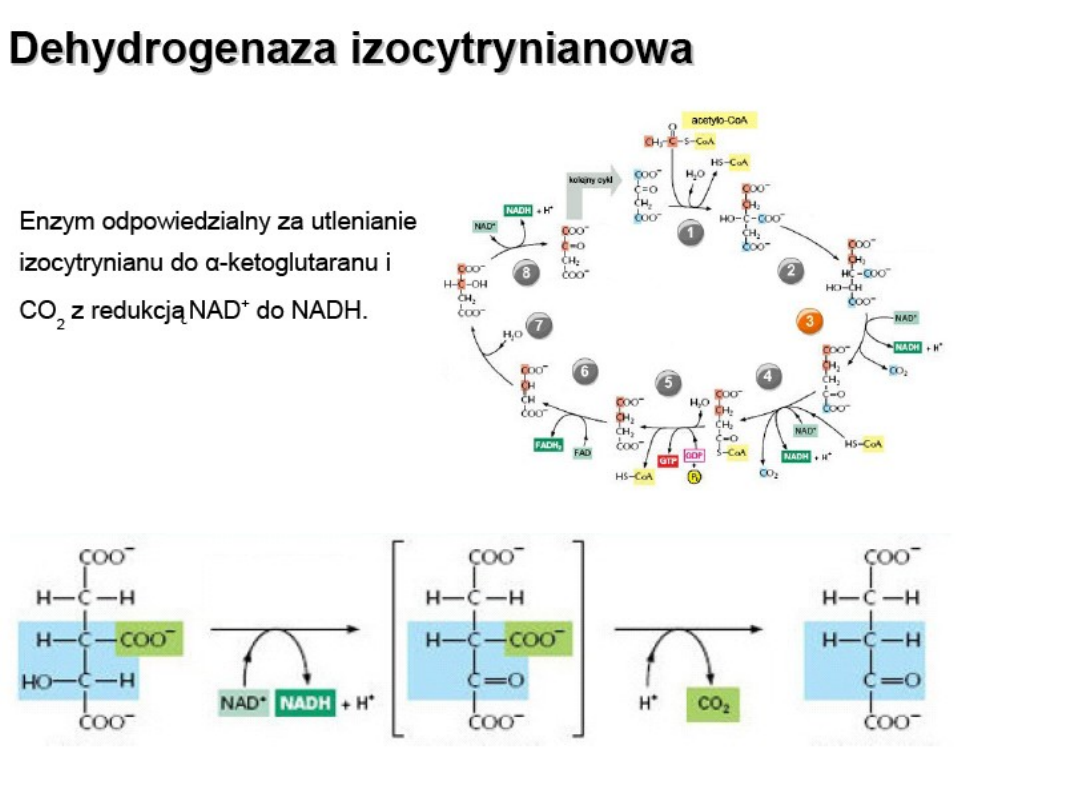
Inhibitor: ATP, NADH + H+; 2-oksoglutaran ( allosterycznie)

Antybiotyki
• Węglowodany
Acetylo-CoA
• Cykl Krebsa
PEP, pirogronian, szczawiooctan
• Aminokwasy alifatyczne
Kwas α-aminoadypinowy(, α-AA),
Cys,
Val
• Penicyliny, Cyklosporyny
Szczawiooctan,
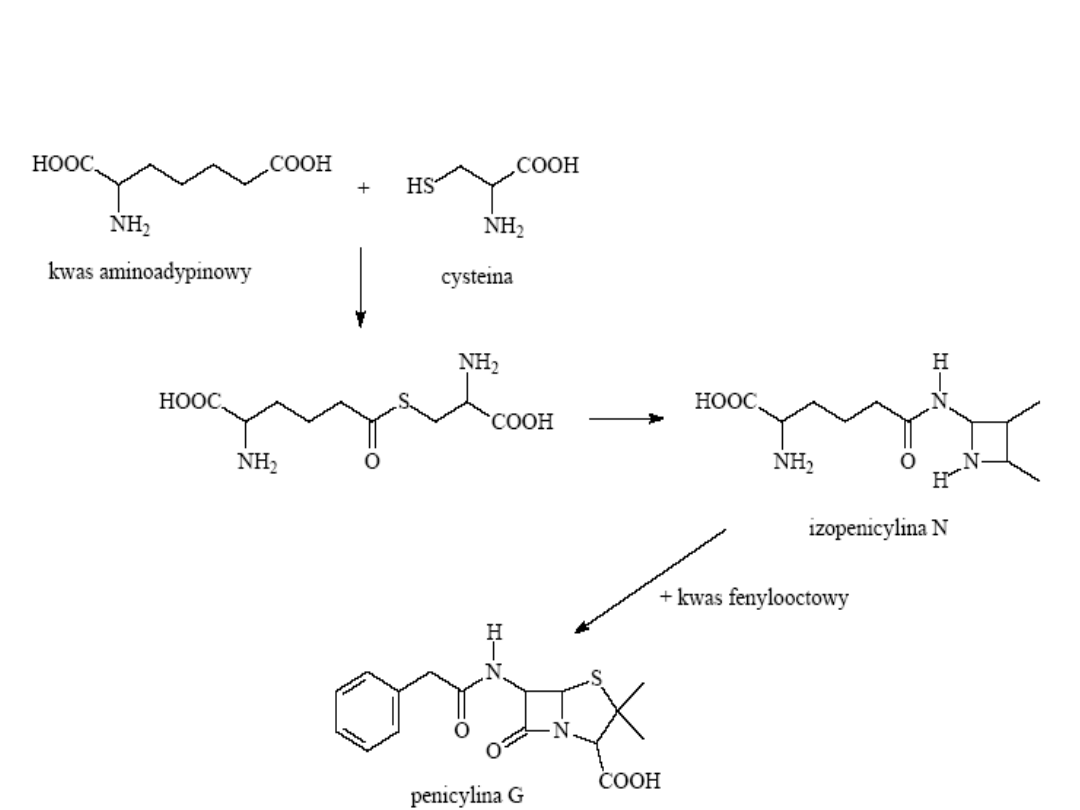
Schemat biosyntezy penicyliny
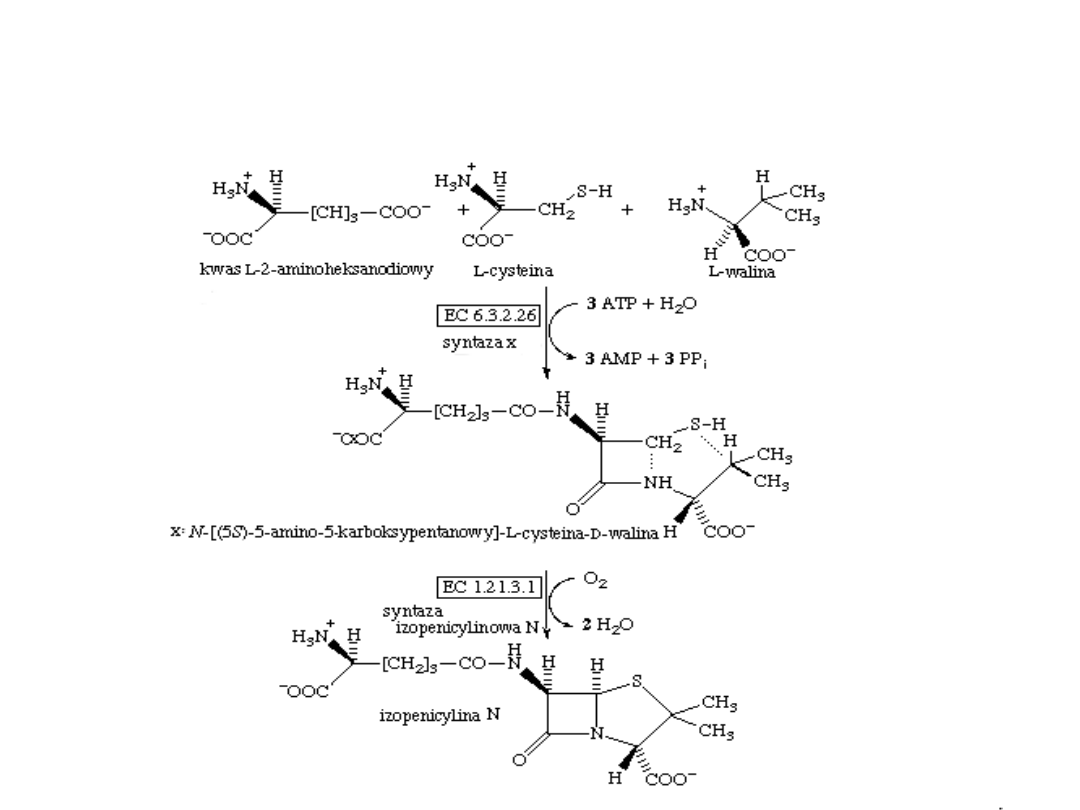
Biosynteza penicyliny
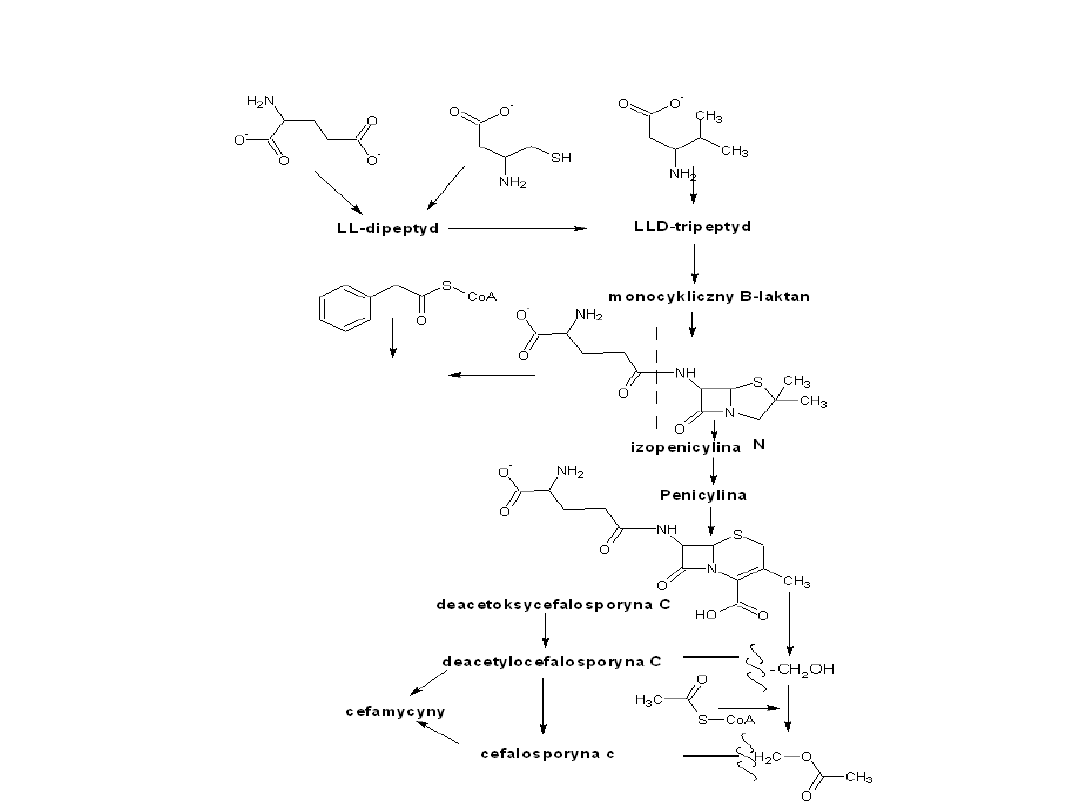
Mechanizm biosyntezy
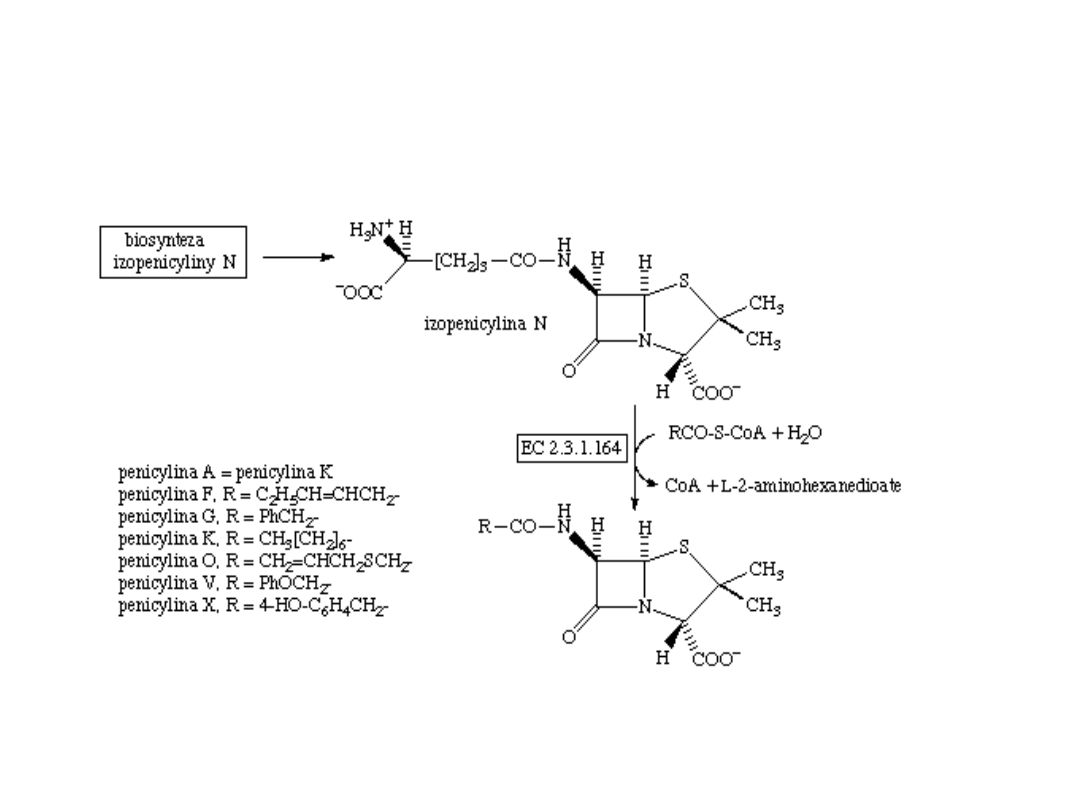
Biosynteza penicyliny
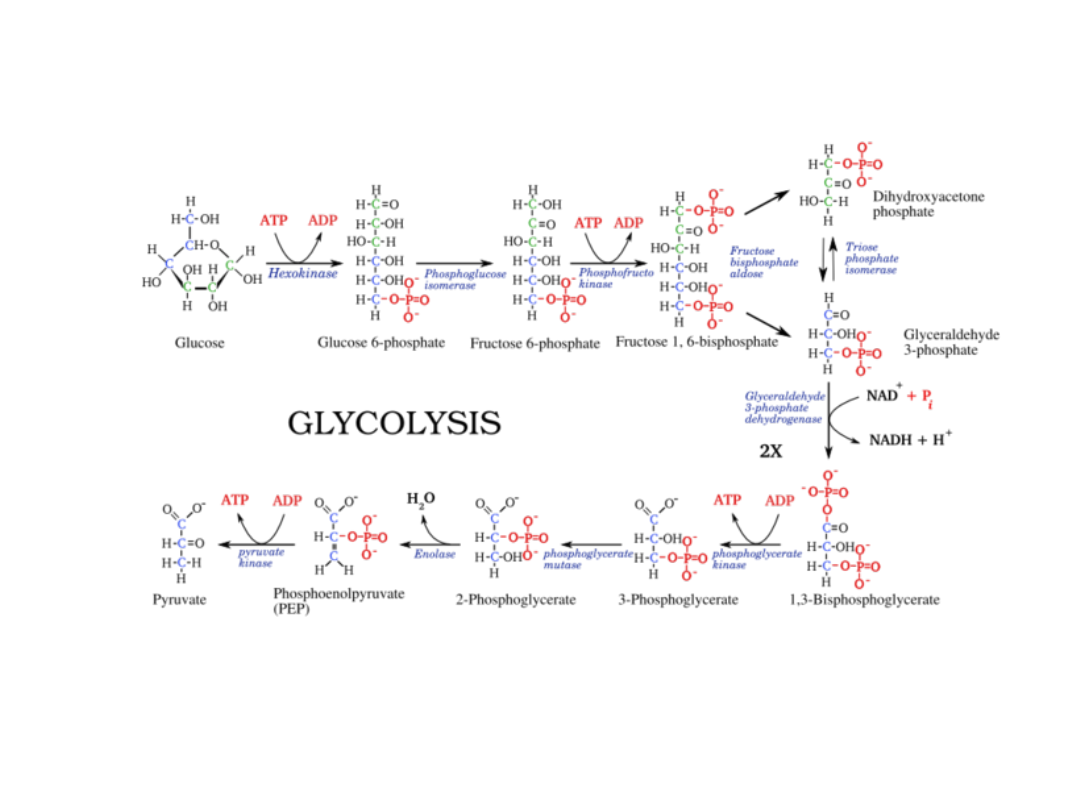
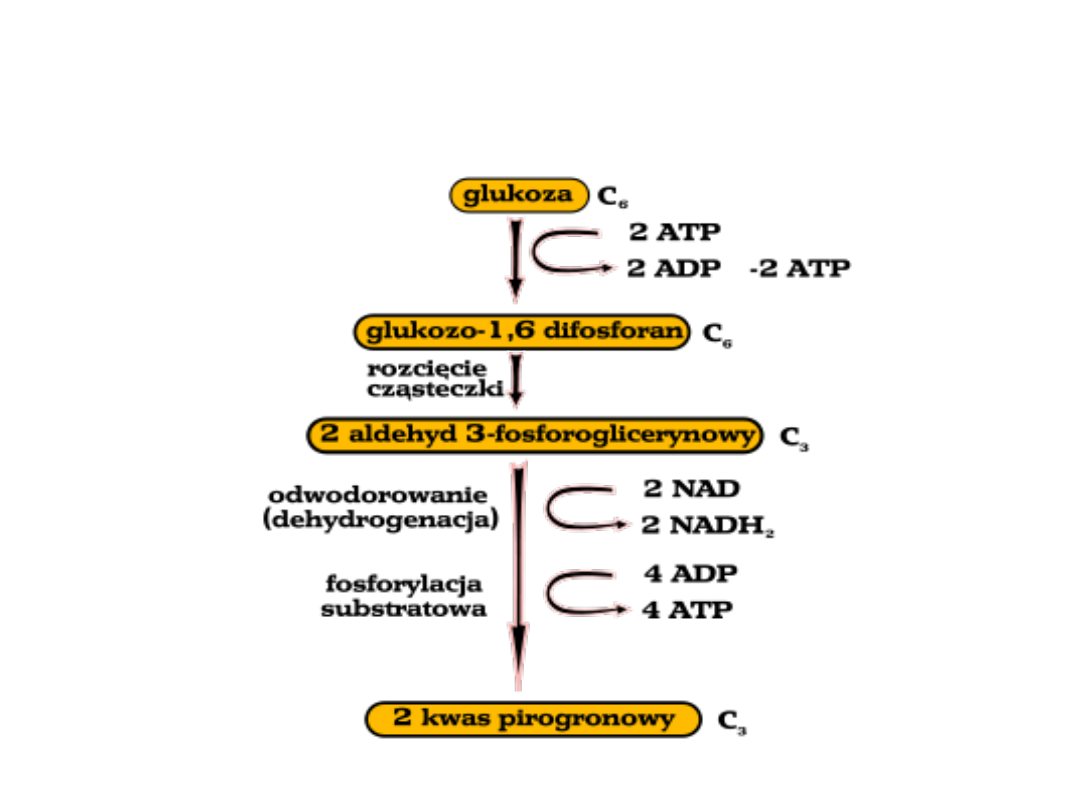
Glikoliza

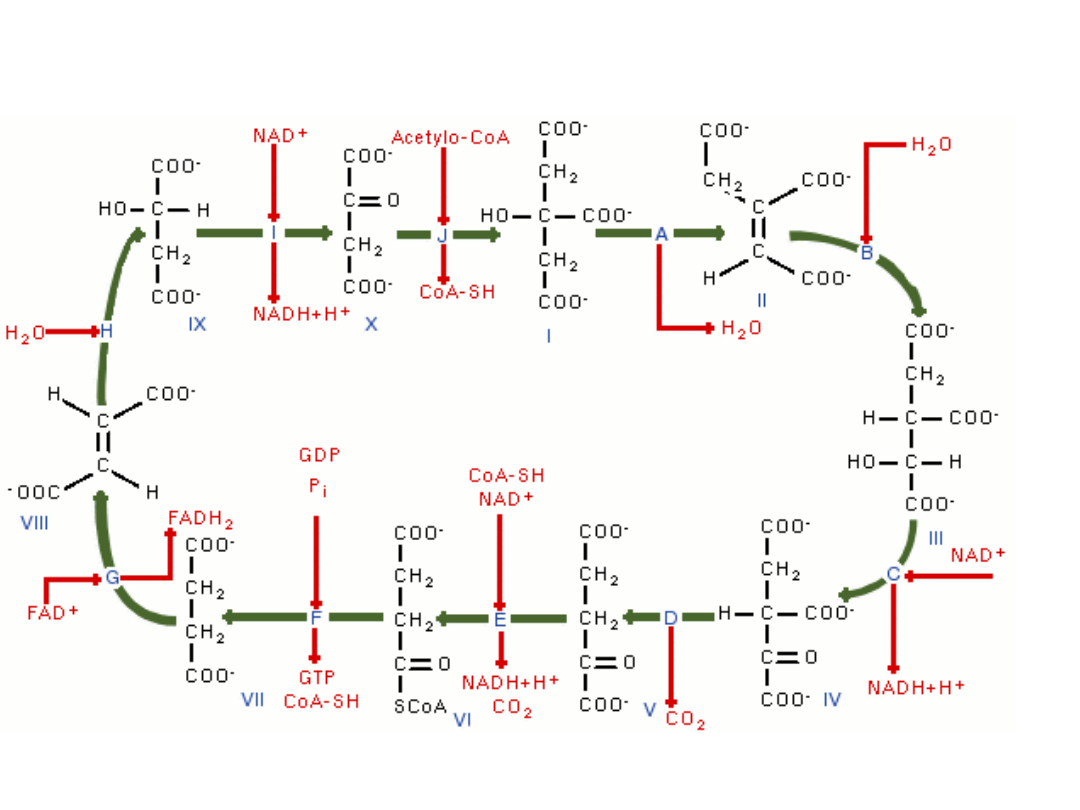
Cykl
Krebsa

Indukcja substratowa-represja kataboliczna
• Substrat warunkuje syntezę enzymu:
represja kataboliczna ( glukoza i
laktoza, fruktoza i laktoza, octan i
glukoza, cytrynian i glukoza)
• Indukcyjny charakter cAMP i białka
receptorowego CRP

Indukcja substratowa
Otrzymywanie penicyliny
• Aminokwasy alifatyczne: Cys, Ser,
Val
• Kwas fenylooctowy, kwas
fenoksyoctowy, kwas glutarowy
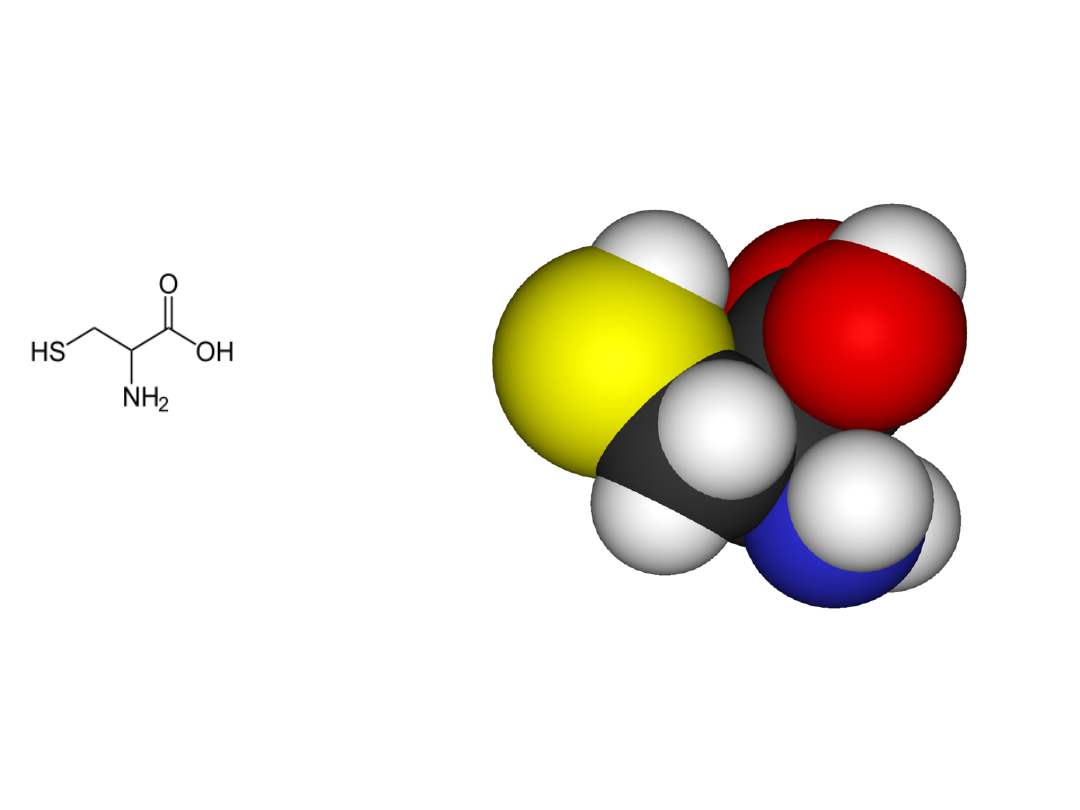
Cysteina

L-cysteina
L-seryna O-acetyloseryna L-cysteina + AcOH
Serine transacylase
O-acetylserine(thiol)-Lyase

[
] Biochemistry
A step in the biosynthesis of many α-
is the reductive
amination of an α-ketoacid. The process is catalyzed by
and the ammonia source is
. The initial step entails
formation of an imine, but the hydride equivalents are supplied by a
reduced pyridine to give an aldimine, which hydrolyzes to the amine.
The sequence from keto-acid to amino acid can be summarized as
follows:
HO2CC(O)R → HO2CC(=NCH-X)R → HO2CCH(N=CH-X)R →
HO2CCH(NH2)R
L-seryna
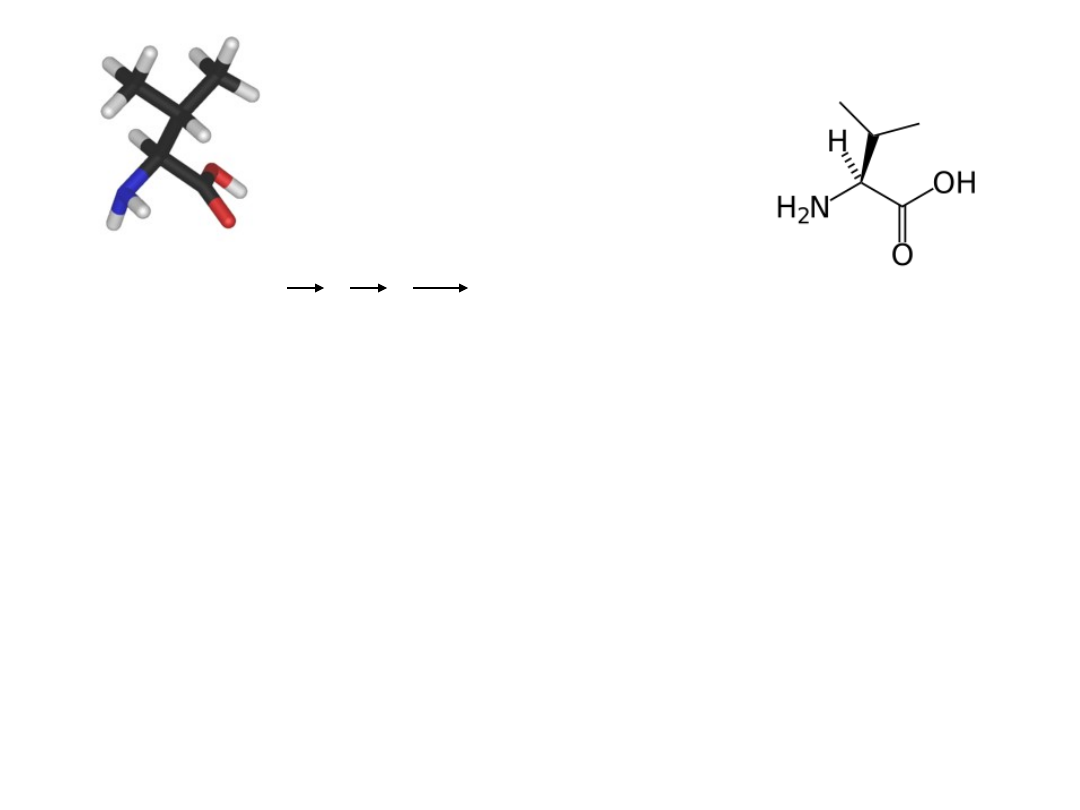
L-Walina
pirogronian
L-Val + L-Ileu
Syntaza acetohydroksykwasu
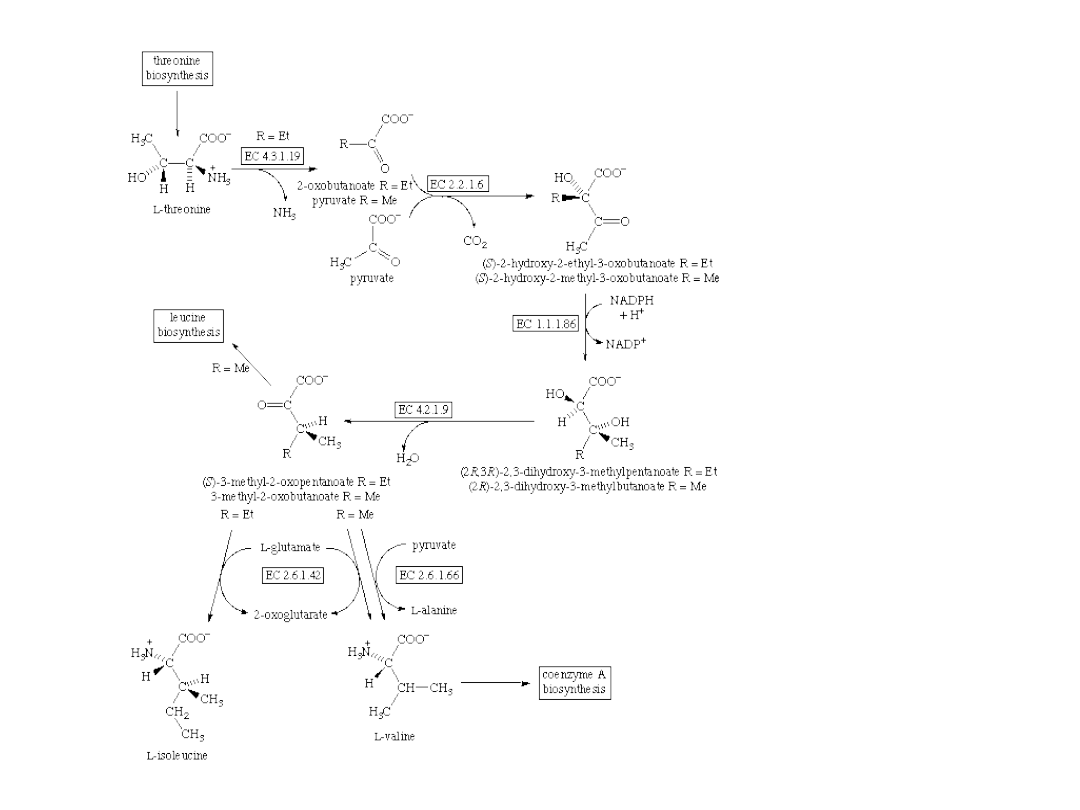
Synteza Waliny i Izoleucyny
ketol-acid
reductoisomerase
acetolactate synthase
branched-
chain-amino-acid
transaminase
valine—
pyruvate
transaminase
dihydroxy-
acid dehydratase
threonine
ammonia-lyase
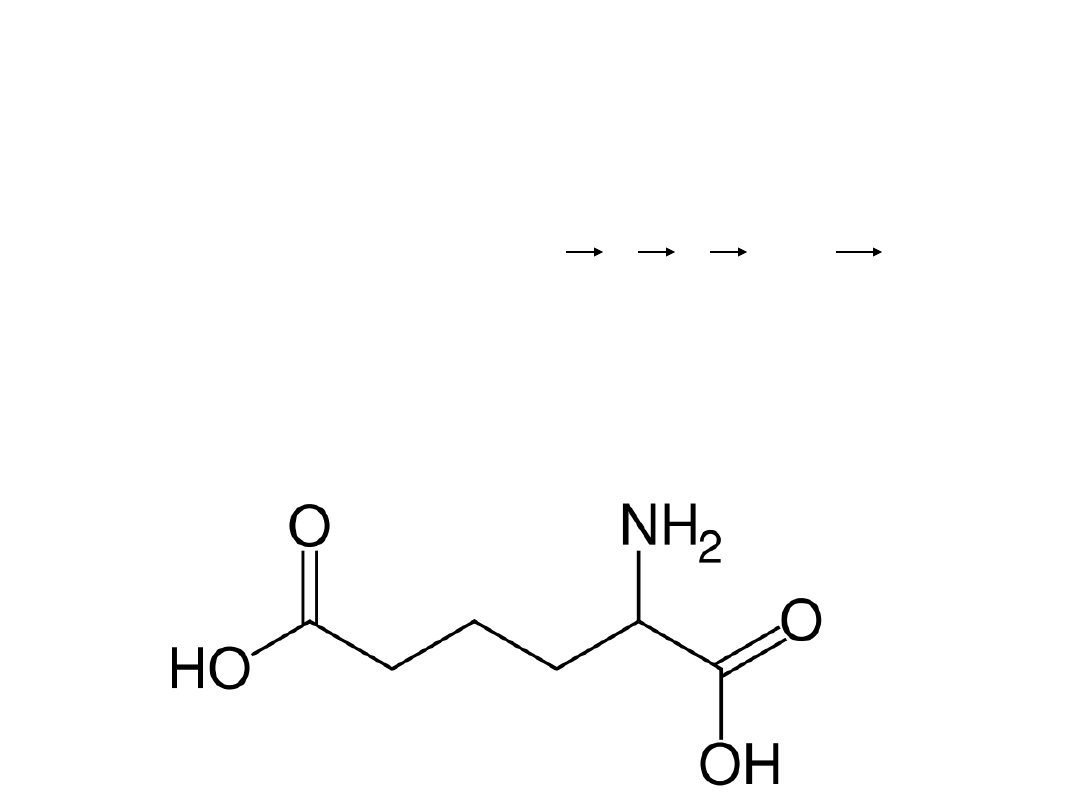
Kwas α-aminoadypinowy
α-AA
Acetylo –CoA + 2-oksoglutaran
Syntaza cytrynianowa
Modyfikacja genetyczna
α-AA
Lys
Inhibitor: L-Lys
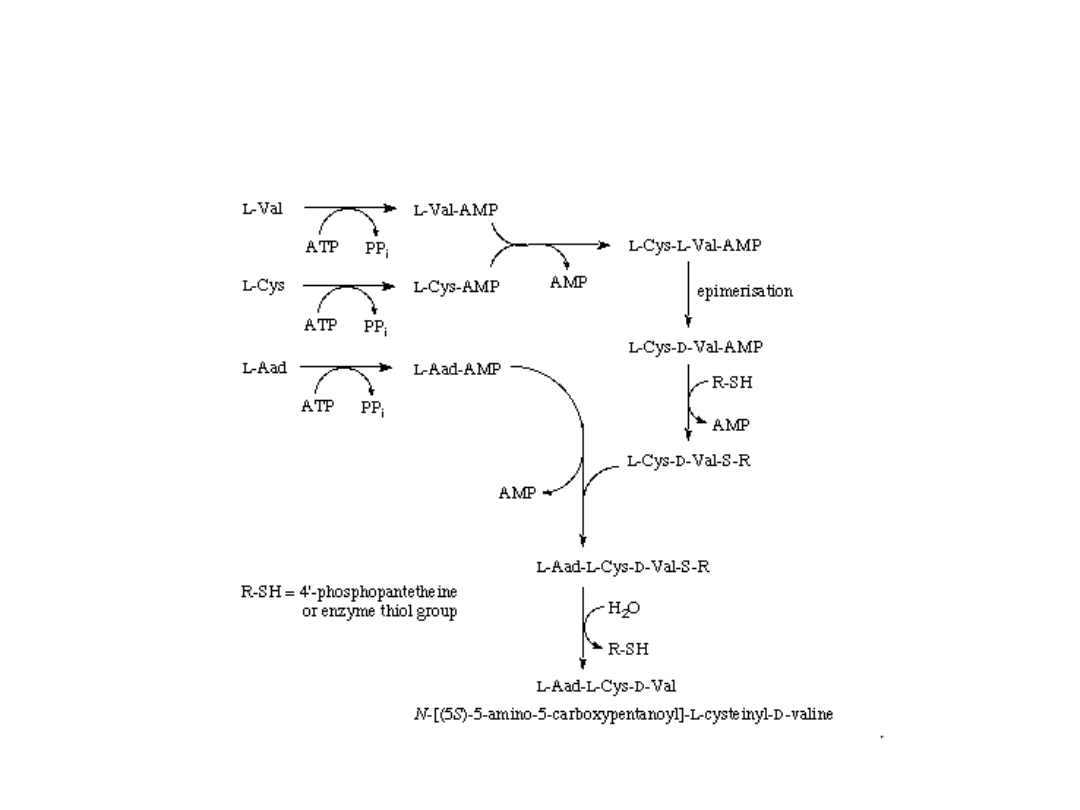
Mechanizm EC 6.3.2.26
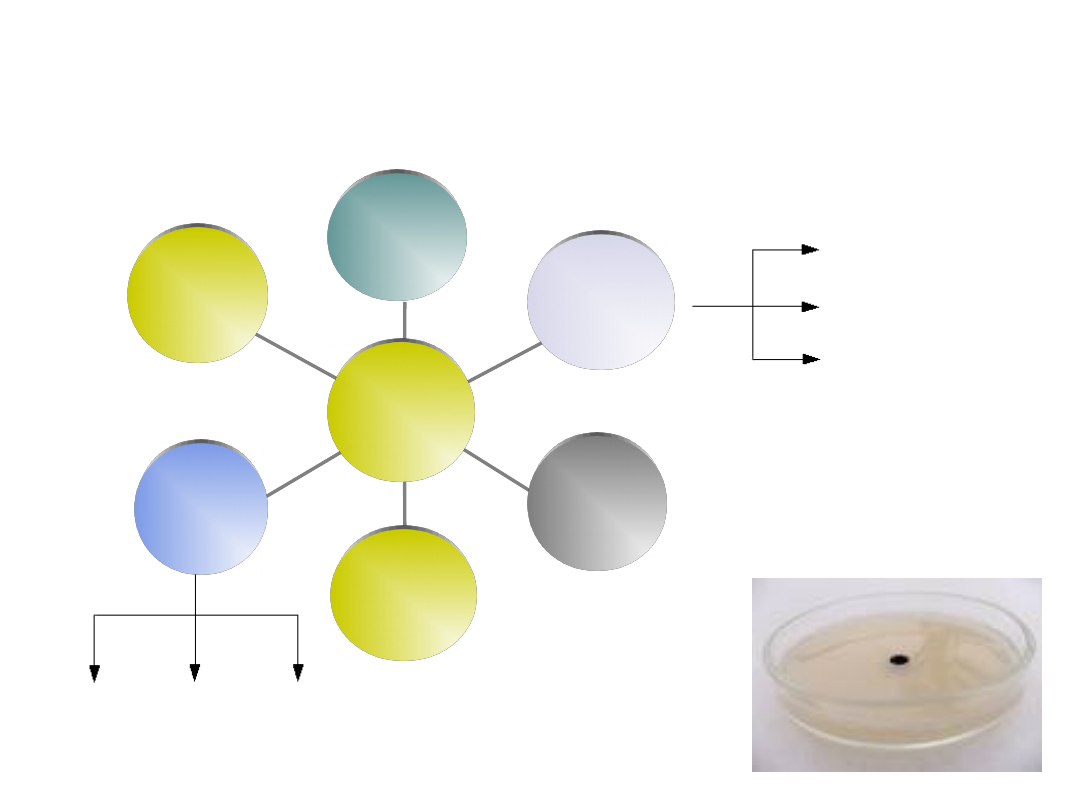
Warunki procesu: POŻYWKA
fruktoza
(glukoza,
laktoza)
aminokwasy
witaminy
prekursor
(kwas fenylooctowy)
sole mineralne
bulion mięsny
Pożywka
azotany(V)
fosforany
chlorki
sodu i
potasu
Lizyna Cysteina Walina
Dobór głównego składnika pożywki
- przebieg szlaków degradacji
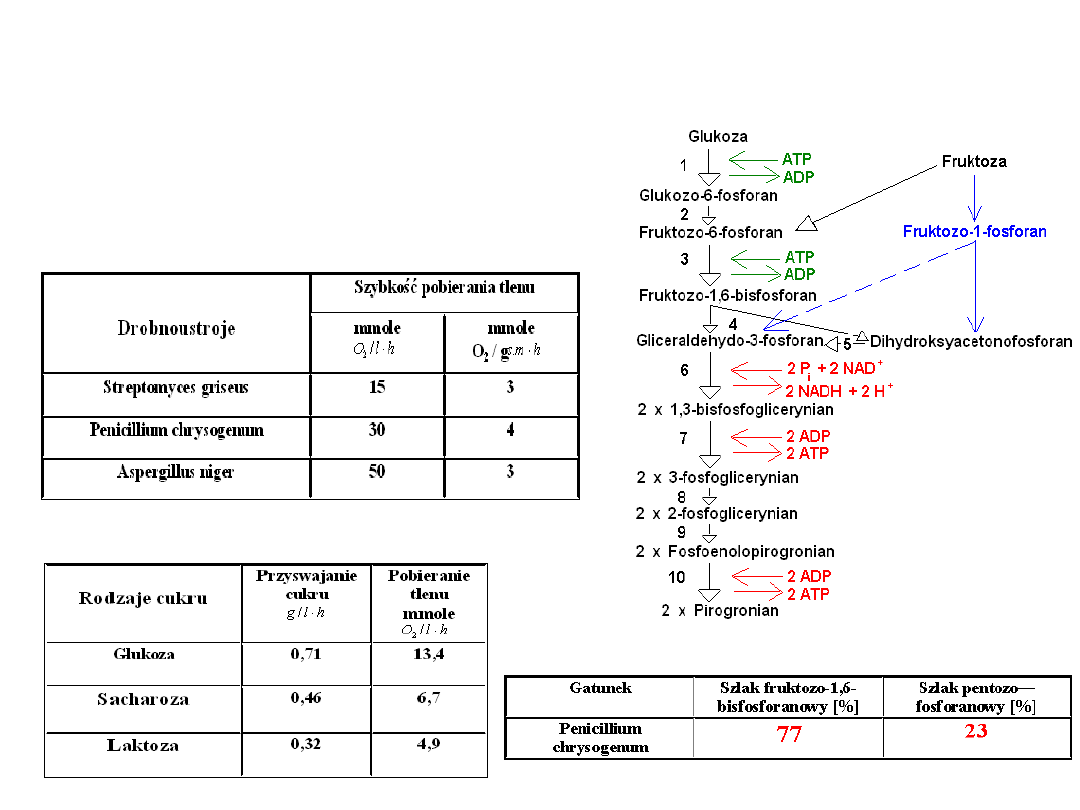
Przykłady maksymalnych wartości szybkości
przyswajania
cukru i tlenu w hodowli Penicillium
chrysogenum
Przykłady maksymalnych wartości szybkości
pobierania tlenu przez drobnoustroje w fazie
intensywnego namnażania komórek
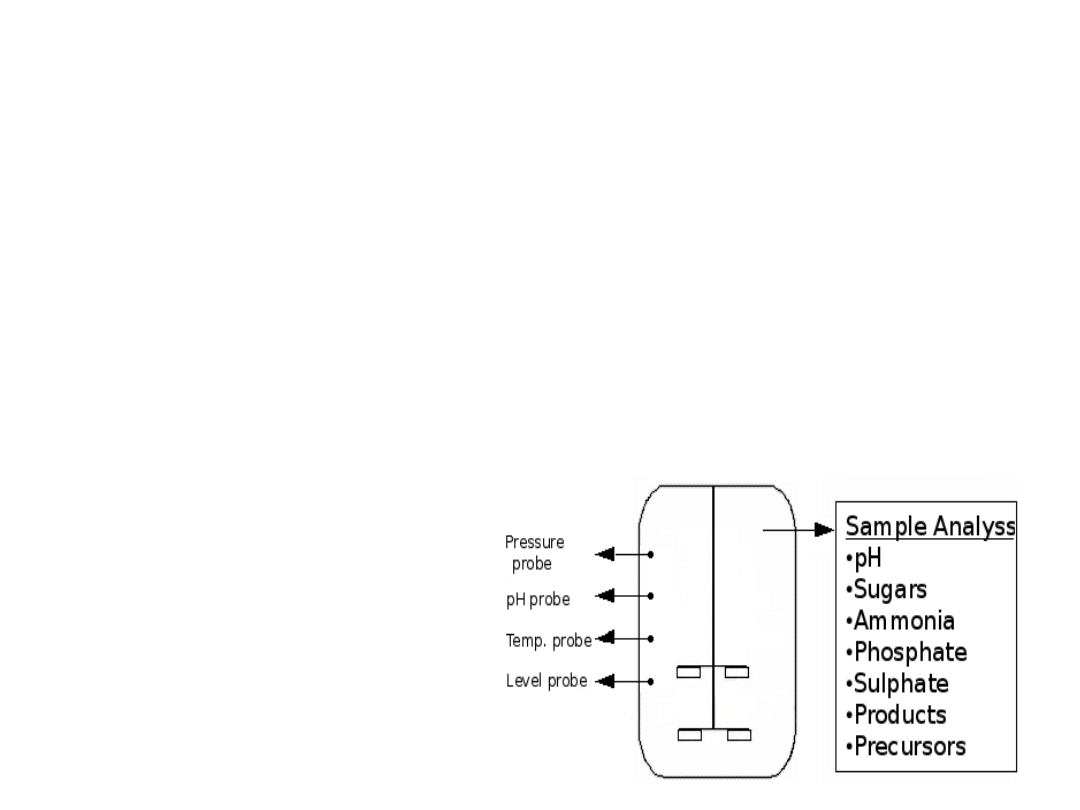
Warunki procesu: PARAMETRY
• Temperatura (zmienna 20°C – 30°C):
– 30°C – wzrost grzybów,
– 25°C – optymalna dla wydzielania
penicyliny,
– 20°C - ograniczenie rozkładu penicyliny.
• pH pożywki 6.8-7.4.
• Czynnik limitujący
wzrost - O2.
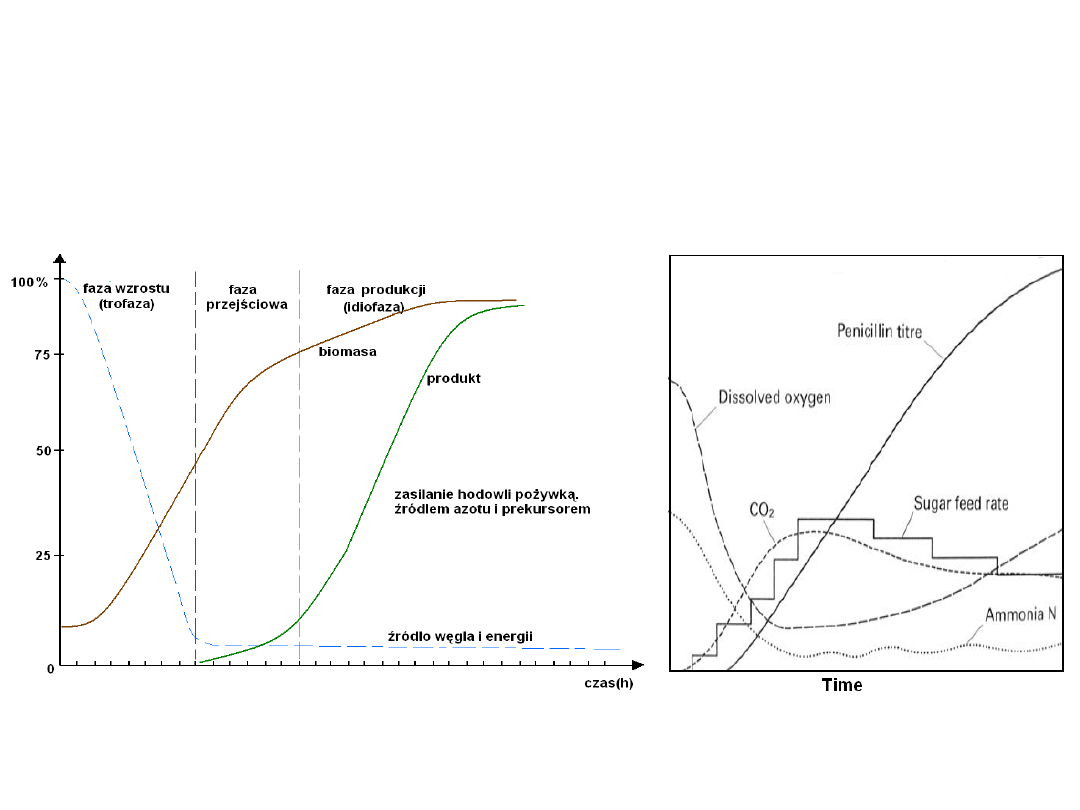
Fazy produkcji
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
Wyszukiwarka
Podobne podstrony:
Metabolizm drobnoustrojow 2 id Nieznany
regulacja metabolizmu wd10
Biochemia wykład 13 Metabolizm węglowodanów
regulacja metabolizmu wd2
Metabolizm drobnoustrojów
B molekularna wykład regulacja translacji i stabilności mRNA Kopia
Wykład 5 Regulacja prędkości obrotowej silników trakcyjnych
regulacja metabolizmu weglowodanow
13 Biochemia Hormonalna regulacja metabolizmu
regulacja metabolizmu wd9
Metabolizm drobnoustrojów, Mikrobiologia
regulacja metabolizmu wd6
Wykład 7 Regulatory (2013)
ROLA ENZYMÓW W REGULACJI METABOLIZMU CZŁOWIEKA
Wykład 6 Regulacja emocji
regulacja metabolizmu wd8
Regulacja metabolizmu glukozy i cukrzyca - P.Barker 2010, Lekarski, Diabetologia
regulacja metabolizmu wd5
więcej podobnych podstron