
1
METABOLIZM BIAŁEK
I
AMINOKWASÓW

2
Znaczenie
zużywa 15-20% energii potrzebnej do podtrzymania
podstawowej przemiany materii
usuwanie
nieprawidłowych
białek
usuwanie białek
niepotrzebnych
, które spełniły już
swoje
zadanie np. przeciwciał lub enzymów
wyindukowanych przez substraty
reguluje stężenie poszczególnych białek;
dostosowywuje do
potrzeb tkanki czy narządu
bardzo
szybkim
obrót mają
enzymy
o znaczeniu
regulacyjnym
zapewnia regulację zaopatrzenia tkanek w
aminokwasy;
szczególnie w okresie
poresorpcyjnym
, gdy nie ma
podaży z
białek pokarmowych
TURNOVER BIAŁEK - OBRÓT METABOLICZNY
ciągła synteza i rozpad

3
TURNOVER BIAŁEK - OBRÓT METABOLICZNY
OKRES PÓŁTRWANIA BIAŁEK
duże różnice dla poszczególnych białek
krótki
dla białek enzymatycznych (minuty, godziny,
dni)
długi
- dla białek strukturalnych (mięśni, tkanki
łącznej i
tkanki nerwowej) (miesiące, lata)
decyduje o tym podatność białka na działanie
proteaz
rozróżnia się
białka o szybkim obrocie i małej
puli
tkankowej
oraz
powolnej przemianie i
dużej puli
tkankowej

4
TURNOVER BIAŁEK - OBRÓT METABOLICZNY
REGULACJA WIELKOŚCI PULI BIAŁEK TKANKOWYCH
skutki
syntezy
białek
de novo
widoczne są dopiero po
kilkunastu
godzinach - taki mechanizm regulacji w
odniesieniu do białek o
długim okresie półtrwania
czynnikiem
regulującym
syntezę
-
zmiany stężenia
hormonów
stany nasilonego anabolizmu lub katabolizmu
ogólnoustrojowego
odbijają się na przemianie białek
wolno się odnawiających
dla białek o krótkim okresie półtrwania (enzymy) zmiany
szybkości
rozpadu
czynniki regulujące szybkość rozpadu - hormony oraz zmiany
stężenia
aminokwasów oraz substratów dla enzymów; taka
regulacja w
narządach miąższowych; wątroba
stężenie aminokwasów napływających do wątroby jest
głównym
czynnikiem regulującym rozpad białek
wątrobowych

5
TURNOVER BIAŁEK - OBRÓT METABOLICZNY
OBRÓT BIAŁEK WĄTROBY
większość to szybko się odnawiające - około 10%
całej puli
białek wątroby; białka o wolnym obrocie -
24%
w ciągu doby wątroba odnawia 50% puli swoich
białek; tj.
50g/dobę czyli 1/3 obrotu białek
całego organizmu
okresy półtrwania niektórych białek
:
dekarboksylaza ornitynowa - 11 minut
syntetaza ALA - 60 minut
dehydrogenaza glutaminianowa - 6 godzin
-glukuronidaza - 30 dni

6
TURNOVER BIAŁEK - OBRÓT METABOLICZNY
OBRÓT BIAŁEK WĄTROBY
obrót białek dotyczy także białek wydzielniczych;
na dobę
prawie połowa białka narządu
; połowa
ulega
natychmiast wydzieleniu i
rozpadowi; reszta to białka o średnim okresie
półtrwania 2-3 dni
znaczny udział
albuminy
; dlatego gdy dochodzi
do
wzmożonej syntezy innych białek
zmniejsza się ilość
albuminy dla
zrównoważenia ogólnej puli
syntetyzowanych białek przez wątrobę
szybkość obrotu białek wątrobowych jest
regulowana przez
zmiany stężenia aminokwasów
dopływających;
działanie hormonów pośrednie
wątroba reguluje zaopatrzenie tkanek w
aminokwasy w okresie poresorpcyjnym

7
TURNOVER BIAŁEK - OBRÓT METABOLICZNY
NIETRWAŁE BIAŁKO TKANKOWE - łatwo
podlegające rozpadowi
• gdy ograniczona jest podaż aminokwasów (okres
poresorpcyjny,
głód
)
• białka osocza, wątroby, białka komórek
nabłonka błon śluzowych gruczołów przewodu
pokarmowego(krypty)
utrata białka nietrwałego
utrata białek osocza
(albumina i transferyna),
spłaszczenie krypt błony
śluzowej oraz
zmniejszenie błon siateczki
śródplazmatycznej w komórkach wątroby i trzustki,
częściowy zanik błon śluzowych
mało podatne są białka odpornościowe; ale
długotrwały
głód obniża także ilość
wytwarzanych przeciwciał

8
TURNOVER BIAŁEK - OBRÓT METABOLICZNY
BIAŁKA MIĘŚNI
obrót wolniejszy niż białek wątroby; większy w
czerwonych;
najmniejszy obrót aktyna
w stanach zwiększonego metabolizmu zwiększa się
obrót
białek mięśni
zwiększony
w stanach patologicznych, dieta
bezbiałkowa
lub ubogo białkowa, głód, cukrzyca,
po pobudzeniu
hormonami kory nadnerczy, w
przebiegu ostrych
zakażeń, bezczynności
9
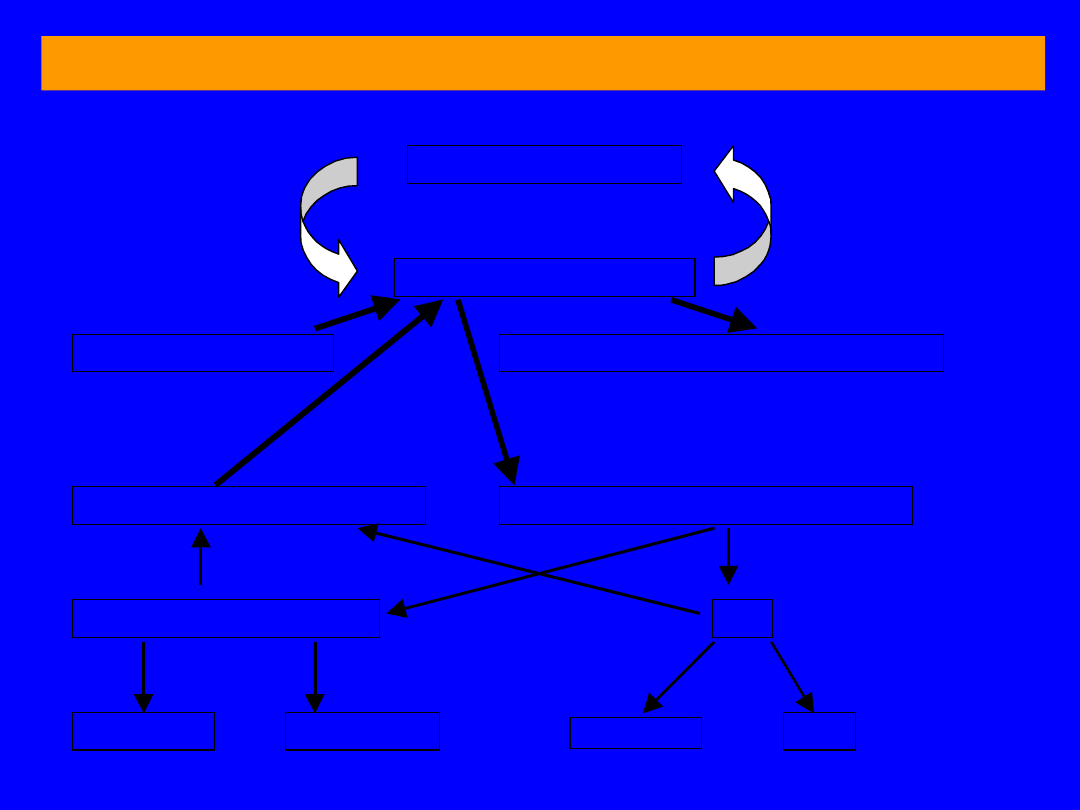
BILANS PRZEMIANY BIAŁEK I AMINOKWASÓW
B
IAŁKA TKANKOWE
P
ULA AMINOKWASÓW
Białka pokarmowe
Azotowe substancje niebiałkowe
Porfiryny, puryny, pirymidyny, ami-
nocukry, fosfolipidy, aminy
S
YNTEZA AMINOKWASÓW
K
ATABOLIZM AMINOKWASÓW
Ł
AŃCUCHY WĘGLOWE
NH
3
G
LUKOZA
CO
2
+ H
2
O
MOCZNIK
NH
4
+

10
BILANS PRZEMIANY BIAŁEK I AMINOKWASÓW
W osoczu: 1,0-1,5 g wolnych (1/50 ogólnej puli);
najwięcej
glutaminy;
najmniej tryptofanu,
aromatycznych,
dwukarboksylowych, argininy,
cytruliny, ornityny
50% z puli w mięśniach szkieletowych
BILANS AZOTOWY
Różnica między ilością azotu dostarczonego
organizmowi, a ilością wydalanego azotu (mocz, kał,
pot, złuszczony nabłonek)
Dorosły, zdrowy, prawidłowo odżywiający się człowiek –
bilans azotowy zerowy
(wyrównany), jest w stanie
równowagi azotowej

11
BILANS PRZEMIANY BIAŁEK I AMINOKWASÓW
Ujemny
bilans azotowy
• głód, dieta bezbiałkowa, niedostatek białka w diecie
lub
niewłaściwy jego skład, w chorobach
wyniszczających, w wieku starczym (upośledzone
wchłanianie, rozpad białka, upośledzone jego
wykorzystanie)
Dodatni
bilans azotowy:
• w okresie wzrostu (niemowlęta, dzieci),
rekonwalescenci,
kobiety w ciąży, kobiety
karmiące

12
BILANS PRZEMIANY BIAŁEK I AMINOKWASÓW
Pożywienie ubogie
w węglowodany i tłuszcze może
spowodować zachwianie równowagi azotowej nawet
wtedy, gdy pokrycie zapotrzebowania białkowego jest
wystarczające.
Nie dostarczenie odpowiedniej ilości
węglowodanów i tłuszczów w diecie wymaga
znaczniejszej ilości białka, którego aminokwasy stają
się surowcem energetycznym

13
Prawo minimum
Przebieg procesów metabolicznych zależy od
najmniejszej ilości niezbędnego czynnika pokarmowego
• wykorzystanie białka zależy od najmniejszej ilości
aminokwasu niezbędnego obecnego w
spożywanym
białku
Minimum białkowe
(zabezpiecza pokrycie strat azotu)
=
0.5 g/kg/dobę
Norma żywieniowa 0,9-1,0 g/kg/dobę
3:2 stosunek białek zwierzęcych do roślinnych
BILANS PRZEMIANY BIAŁEK I AMINOKWASÓW

14
Wartość biologiczna białek
•
Pełnowartościowe
•
Częściowo niepełnowartościowe
(zawierają
wszystkie
aminokwasy niezbędne, ale
przynajmniej jeden w ilości niewystarczającej (mąka,
kasze)
•
Niepełnowartościowe
(kolagen, żelatyna - brak
TRP, brak lizyny w kukurydzy)
BILANS PRZEMIANY BIAŁEK I AMINOKWASÓW

15
TRAWIENIE BIAŁEK W PRZEWODZIE POKARMOWYM
•
Wchłaniane tylko aminokwasy wolne
• wchłanianie białek i peptydów
patologia
reakcja
immunologiczna
żołądek
- pepsyna (proenzym)
• aktywacja - ograniczona proteoliza
• pH 1-2; aktywacja maksymalna
• endopeptydaza
dwunastnica
- trypsyna, chymotrypsyna
• proenzymy - najpierw enterokinaza potem autokataliza
• optimum pH lekko zasadowe
• elastaza trzustkowa - proteaza serynowa elastyna
• kolagenaza kolagen żelatyna
powstają drobne peptydy
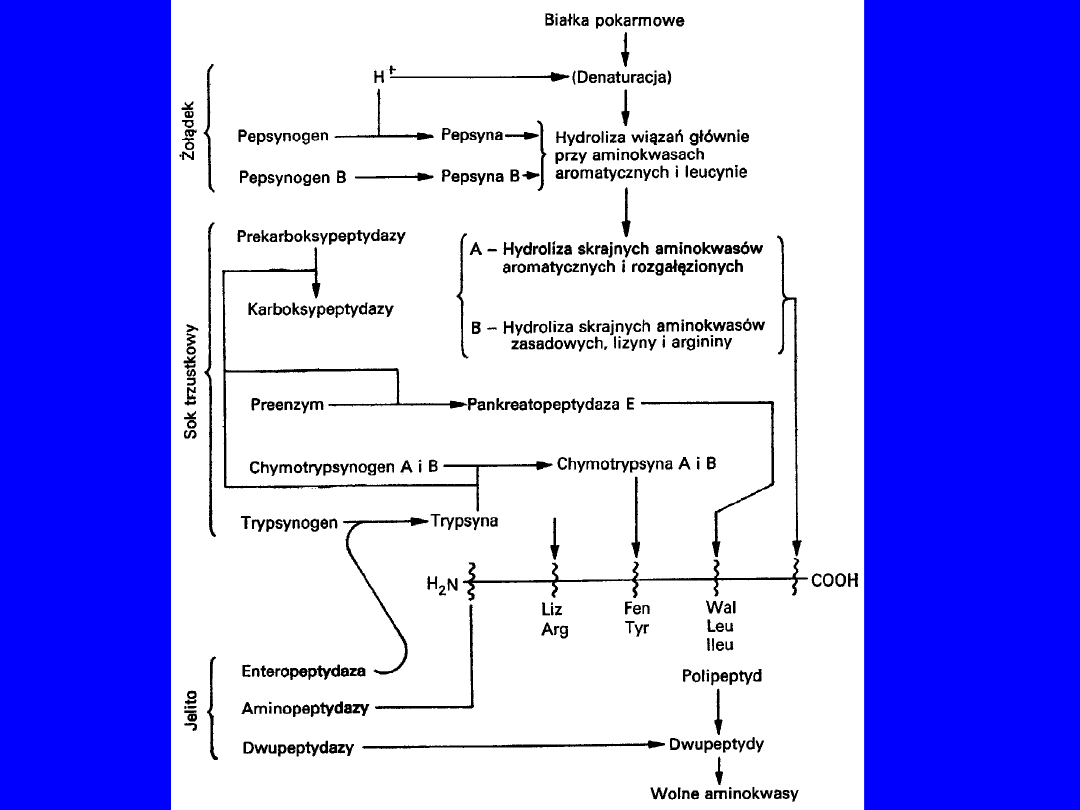
16

17
TRAWIENIE BIAŁEK W PRZEWODZIE POKARMOWYM
Sok jelitowy
• karboksypeptydaza A
• karboksypeptydaza B
• aminopeptydazy
• dipeptydazy
wolne aminokwasy transport do
krwi

18
ENZYMY PROTEOLITYCZNE
Podział hydrolaz peptydowych
• Endopeptydazy
• egzopeptydazy
• aminopeptydazy
• karboksypeptydazy
• dwupeptydazy
Denaturacja - zabiegi kulinarne dostępność
enzymów proteolitycznych do białek

19
ENZYMY PROTEOLITYCZNE
PODZIAŁ
ze względu na lokalizację:
trawienne
pozakomórkowe (krzepnięcie, fibrynoliza,
aktywacja dopełniacza); wewnątrzkomórkowe
(lizosomy, katepsyny)
WG MECHANIZMU KATALIZY
1.
serynowe
; blokowane diizopropylofluorofosforanem
chymotrypsyna A; opt. pH 7,8; jelito cienkie
Tyr Trp Phe Leu
trypsyna; opt. pH 7,5-8,5; jelito cienkie
Arg Lys
trombina; opt. pH 7,4; osocze
Arg fibrynogen
elastaza monocytów >
w makrofagach metaloproteaza

20
ENZYMY PROTEOLITYCZNE
2.
tiolowe
(SH) Cys
• wrażliwe na utlenianie i metale ciężkie
• potrzebna ochrona przed wolnymi rodnikami
katepsyna B; opt. pH 5,0-6,0; wewnątrzkomórkowy
Arg Lys Phe - X
papaina; opt. pH 5,0-5,5; drzewo malonowe
Arg Lys Phe - X

21
ENZYMY PROTEOLITYCZNE
3.
karboksylowe
; kwasowa grupa COOH bierze udział w katalizie
pepsyna A; opt. pH 1,3-3,0; żołądek
(Tyr; Phe)
pepsyna C (gastryksyna); opt. pH 3,0-4,5; żołądek
(Tyr; Phe)
podpuszczka (renina); opt. pH 3,0-4,5; żołądek kazeinogen
katepsyna D; opt. pH 3,0-4,5; wewnątrzkomórkowy
jak pepsyna
4.
metaloproteinazy
(Zn
2+
, Ca
2+
, Mn
2+
); hamowane
EDTA;
TIMP (tissue inhibitor of
metalloproteinases)
termolizyna
kolagenazy
żelatynazy
elastaza makrofagów

22
ENZYMY PROTEOLITYCZNE
PODPUSZCZKA = CHYMOZYNA
• W żołądku młodych ssaków, ścina mleko, przez co
dłużej
zatrzymywane jest w żołądku
• Substrat:
KAZEINA
, hydrolizowana do
parakazeiny
,
która
w obecności jonów Ca tworzy
nierozpuszczalny
parakazeinian
wapnia
•Wytwarzana w śluzówce jako proenzym,aktywacja w
niskim pH
•
Podpuszczka stosowana w serowarstwie do otrzymywania skrzepu
podpuszczkowego, który zawiera dużo łatwo
przyswajalnego wapnia.

23
ENZYMY PROTEOLITYCZNE
TRYPSYNA
• Trzustka, 240000, 223 AA
• Centrum aktywne: -GLI-ASP-SER-GLI-
• Opt. pH 7-9
• Aktywacja: enteropeptydaza (enterokinaza),
potem
autokatalityczna aktywacja przez
trypsynę
• Specyficzność substratowa: wiązania
peptydowe
utworzone przez grupy
karboksylowe AA
zasadowych : LIZ, ARG

24
ENZYMY PROTEOLITYCZNE
ENTEROPEPTYDAZA = ENTEROKINAZA
• Glikoproteid soku jelitowego
• odrywa inhibitor od N-końca trypsynogenu
• opt. pH 5-8
CHYMOTRYPSYNA
• Podobieńswo do trypsyny - identyczne centrum
katalityczne
• opt. pH ok. 8,0
• aktywacja przez trypsynę, potem autokataliza
• Specyficzność substratowa: wiązania peptydowe
utworzone przez grupy karboksylowe AA
aromatycznych

25
ENZYMY PROTEOLITYCZNE
PANKREATOPEPTYDAZA (ELASTAZA)
• Trzustka, aktywacja
proelastazy
w
dwunatnicy
przez
trypsynę
• Centum aktywne identyczne jak w trypsynie
i chymotrypsynie
• Specyficzność substratowa: wiązania peptydowe
utworzone przez małe AA: GLI, ALA, SER,
różnych
białek, również elastyny
• Elastaza granulocytów należy do
metaloproteinaz

26
ENZYMY PROTEOLITYCZNE
KARBOKSYPEPTYDAZY: A i B
• Trzustka, aktywacja w dwunastnicy przez trypsynę
• Zawierają
Zn
• Swoistość substratowa dla A: C-końcowy AA
rozgałęziony
(LEU, ILU, WAL) lub aromatyczny
(FEN, TYR)
• Swoistość substratowa dla B: odszczepia AA
zasadowe:
LIZ, ARG

27
AMINOPEPTYDAZY
• Wymagają obecności jonów Mg lub manganu,
uczestniczą
w wytwarzaniu kompleksu
enzym- substrat
• Wytwarzane w błonie śluzowej soku jelitowego
• Najlepiej poznana z tej grupy jest LAP
(leucyloaminopeptydaza)
• Odszczepia wszystkie AA od N-końca, ale
szczególnie
LEU
ENZYMY PROTEOLITYCZNE

28
ENZYMY PROTEOLITYCZNE
DWUPEPTYDAZY
• W błonie śluzowej jelit
• Wymagają obecności jonów Co lub Mn
• Największa aktywność w jelicie krętym
• Przykłady dwupeptydaz:
glicylo-glicynowa, glicylo leucynowa,
glicylo-
prolinowa (
prolidaza
), prolilo-
glicynowa (
prolinaza
), glicylo-alaninowa, glicylo-
walinowa

29
Wchłanianie
aminokwasów
• wolne aminokwasy-wchłaniane do krwi przy
udziale
nośników
• oligopeptydy
zawarte w treści jelitowej;
a/
ulegają hydrolizie w świetle jelita,a następnie absorpcji
b/ oligopeptydy przenoszone ze światła jelita do cytoplazmy-
gdzie ulegają rozpadowi do wolnych aminokwasów pod
wpływem peptydaz cytoplazmatycznych
c/ oligopeptydy łączą się rąbkiem szczoteczkowym , poczym
dopiero poddawane są działaniu peptydaz
zlokalizowanych w samej blonie komórkowej

30
Wchłanianie
aminokwasów
Szybkość wchłaniania aminokwasu z
przewodu pokarmowego zależy od
:
• stężenia w świetle jelita
• struktury chemicznej
• odcinka jelita cienkiego
• stężenia innych aminokwasów przenoszonych
tym samym układem transportującym
• regulacji nerwowej, hormonalnej,obecności
witamin (B
6
)

31
Wchłanianie
aminokwasów
• najszybciej wchłania się: izoleucyna, metionina,
najwolniej- kwas glutaminowy
prawidłowe stężenie aminokwasów w
surowicy krwi
1,44- 3,5 mmol/l (2-5 mg%)
wyrażone jako azot aminokwasowy tzw.
-
aminowy

32
TRANSPORT
DOKOMÓRKOWY
• uwarunkowany charakterem chemicznym aminokwasów;
-
aminokwasy hydrofobowe
(leucyna, izoleucyna, walina,
fenyloalanina)
-
zasadowe
- lizyna, arginina
dyfuzja
ułatwiona
- aminokwasy kwaśne oraz obojętne (alanina,seryna,
cysteina, glicyna, histydyna)
transport aktywny
TRANSPORT AMINOKWASÓW PRZEZ BŁONY KOMÓRKOWE

33
UKŁAD PRZENOSZĄCY AMINOKWASY
-
nie zależy od komórki, zależy od budowy
chemicznej aminokwasów
- transporter nie jest specyficzny dla
transportowanej substancji, możliwy jest transport
substancji o zbliżonej budowie chemicznej
- wraz ze wzrostem stężenia substancji przenoszonej
ulega wysyceniu
- odbywa się zgodnie z gradientem stężenia
- nie wymaga dostarczania energii
TRANSPORT AMINOKWASÓW PRZEZ BŁONY KOMÓRKOWE

34
UKŁADY PRZENOŚNIKOWE
Układ A
Większość obojętnych z wyjątkiem
hydrofobowych
sprzężony z transportem
Na
+
;
aktywny wtórny
wszystkie tkanki; zależy od
wewnątrzkomórkowego stężenia
aminokwasów
Układ ASC
Dla obojętnych ale bardzo wybiórczy; ala, ser,
cys
Układ Gly
Dla glicyny
Układ N
Dla his, glutaminy i asp
Układ L
(od leucyny) dla hydrofobowych (leu, ileu, wal,
phe); tylko dyfuzja ułatwiona
w nerce i jelicie ; układ dla (glu i asp); aktywny
TRANSPORT AMINOKWASÓW PRZEZ BŁONY KOMÓRKOWE

35
JEDYNY HORMONO ZALEŻNY TO UKŁAD A
hormony anaboliczne – insulina, hormon
wzrostu dla
wszystkich tkanek
hormony adrenergiczne
anabolicznie – wątroba
katabolicznie – mięśnie, tkanka tłuszczowa
TRANSPORT AMINOKWASÓW PRZEZ BŁONY KOMÓRKOWE

36
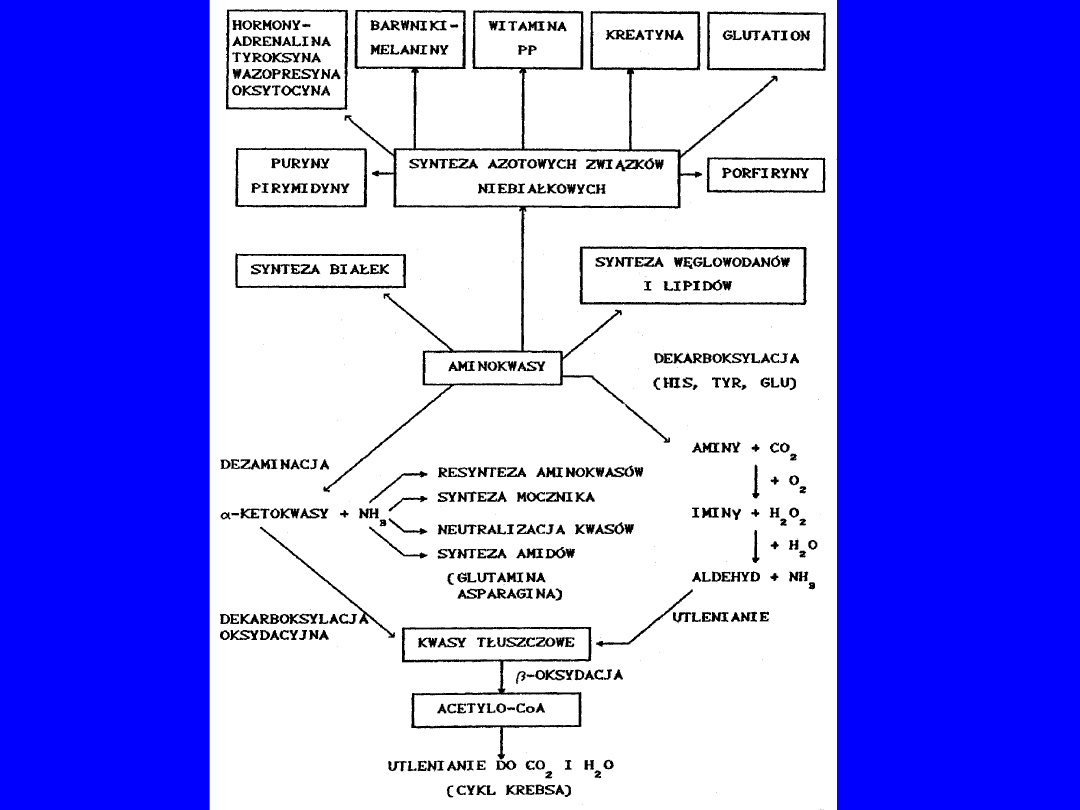
REAKCJE UWALNIAJĄCE AMONIAK
Mięśnie szkieletowe jelita
nerka
Deaminacja AMP
z glutaminy
z glutaminy
IMP AMP
glutaminaza
glutaminaza
Bakterie
NH
3
H
2
O
Główny źródłem - mięśnie pracujące - cykl purynowy
• opuszcza mięśnie jako glutamina
Jelito NH
3
żyłą wrotna - wysokie stężenie fizjologiczne
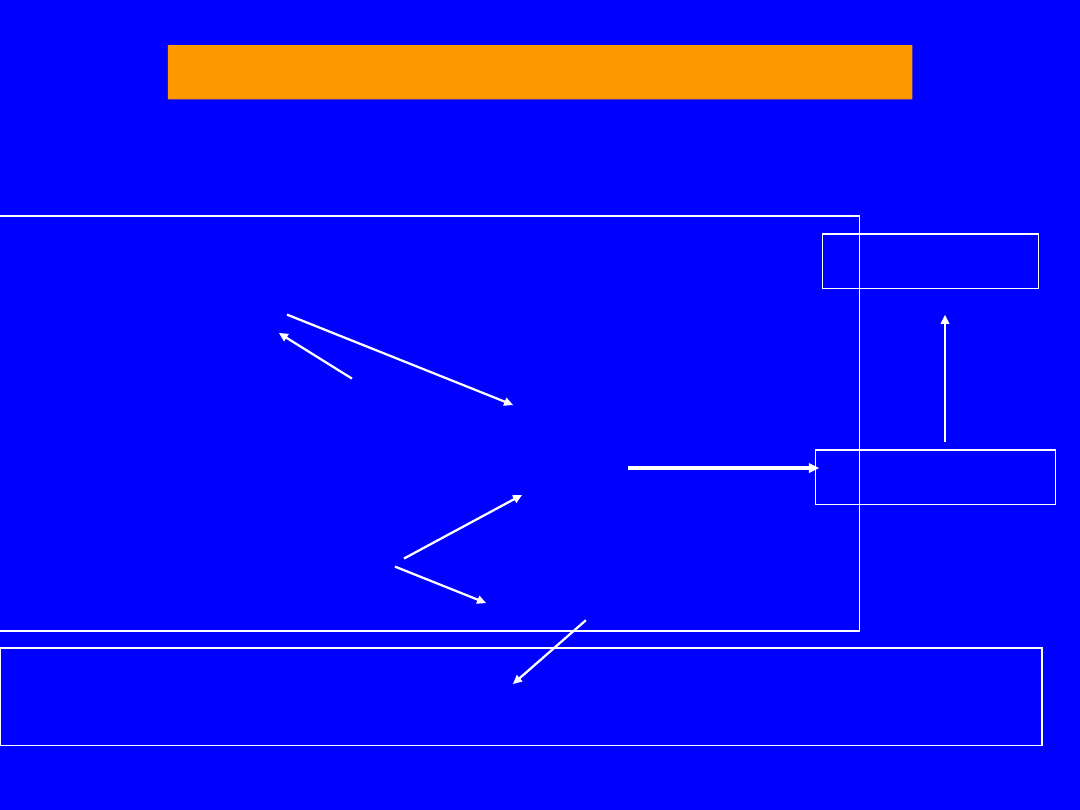
37
REAKCJE UWALNIAJĄCE AMONIAK
•
światło jelita
aminokwasy
kwas
moczowy
mocznik
bakterie
NH
3
•
enterocyty
degradacja glutaminy
glutaminaza
kwas glutaminowy
Żyła wrotna
ROLA JELITA W PRZEMIANIE NH
3
WĄTROBA
Krążenie
• dodatkowa pula np. dla mięśni do wiązania amoniaku

38
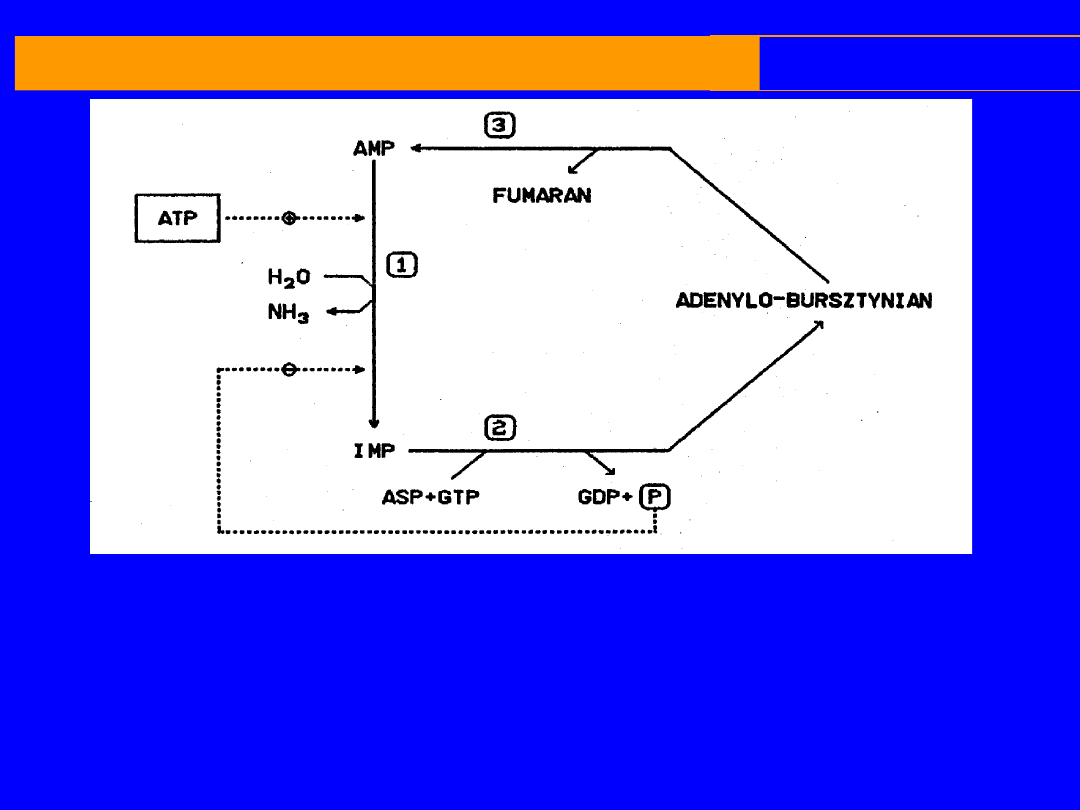
REAKCJE UWALNIAJĄCE AMONIAK
CYKL PURYNOWY
cytoplazma
Pracy mięśniowej towarzyszy wytwarzanie
amoniaku i szybki metabolizm nukleotydów
adenylowych
Po wysiłku AMP oraz IMP i NH
3
Amoniak pochodzi z deaminacji AMP
Reaminacja IMP katalizowana jest przez 2 enzymy
syntetazę
i
liazę
adenylobursztynianową
,
hydroliza GTP oraz asparaginian jako donor NH
3

39
BIOCHEMIA MIĘŚNI
Źródła energii dla mięśni
zawsze hydroliza ATP
w spoczynku zawartość ATP = 5x10
-6
mol/g
intensywny wysiłek zużywa 10
-3
mol/min/g tkanki
WARUNKI TLENOWE
mitochondrialne utlenianie substratów:
• pirogronian,
• kwasy tłuszczowe,
• związki ketonowe
oksydacyjna fosforylacja

40
BIOCHEMIA MIĘŚNI
WARUNKI BEZTLENOWE
• fosfokreatyna (nagromadzona w sarkoplazmie);
“bufor”
łagodzący zmiany ATP w następstwie
gwałtownego
zużycia;
transport energii z miejsca uwalniania
(mitochondria) do miejsca wykorzystania
(mikrofobryle)
Kinaza kreatynowa CPK
ADP + fosfokreatyna ATP + kreatyna
Reakcja dysproporcjonowania ADP
Kinaza adenylowa (miokinaza)
2ADP ATP + AMP
reakcja przesunięta w kierunku syntezy ATP gdy
AMP usuwane i powstaje IMP
Beztlenowa glikoliza
glukoza 2 mleczan + 2ATP
41
REAKCJE UWALNIAJĄCE AMONIAK
CYKL PURYNOWY
I. AMP + H
2
O IMP + NH
3
II. IMP + asparaginian + GTP adenylobursztynian + GDP + P
i
III. Adenylobursztynian AMP + fumaran
Sumarycznie jeden obrót cyklu można napisać następująco
:
Asparaginain + GTP + H
2
0
Fumaran + GDP + P
i
+ NH
3
liaza adenylobursztynianowa
deaminaza AMP
syntetaza adenylobursztynianowa

42
REAKCJE UWALNIAJĄCE AMONIAK
CYKL PURYNOWY
ZNACZENIE:
UTRZYMANIE WŁAŚCIWEGO ZASOBU
TKANKOWEJ PULI NUKLEOTYDÓW
ADENYLOWYCH
Wzajemny stosunek zależy od
kinazy adenylowej
(miokinazy)
2 ADP ATP + AMP
stan równowagi zależy od aktywności
deaminazy
AMP
; przesuwa równowagę reakcji miokinazowej w
kierunku syntezy ATP; ważne w czasie intensywnej
pracy mięśni
deaminaza AMP
; allosteryczny [+] K
+
, Na
+
; [-]
ortofosforan
•oraz na funkcji anaplerotycznej
WSPÓŁZALEŻNOŚĆ MIĘDZY GLIKOLIZĄ A CYKLEM
PURYNOWYM
syntaza adenylobursztynianowa
;
hamowana przez
fruktozo 1,6P
syntezy AMP aktywności fosfofruktokinazy

43
REAKCJE UWALNIAJĄCE AMONIAK
CYKL PURYNOWY
ZABURZENIA ENZYMATYCZNE:
Brak deaminazy AMP zwiększona męczliwość;
kurcze powysiłkowe i bolesność mięśni; zwiększone
wytwarzanie adenozyny i jej metabolitów i ucieczka
przez błonę poza przestrzeń komórkowa
zmęczone mięśnie wolniej regenerują swoje zasoby
energetyczne
diagnostyka
– histochemia na aktywność enzymu w
mięśniach
test obciążeniowy
w warunkach niedotlenienia i
oznaczanie NH
3
i mleczanu we krwi żylnej odpływającej z
mięśnia;
prawidłowe stężenie mleczanu przy braku wzrostu NH
3
wskazuje na defekt enzymatyczny.

44
Właściwości enzymów katalizujących reakcje
cyklu nukleotydów purynowych
Deaminaza AMP
• enzym cytoplazmatyczny
• wysoka aktywność w mięśniu szkieletowym
• ściśle związany z układem kurczliwym komórki
mięśniowej 2 :1
• enzym regulatorowy, oddziaływania allosteryczne
• w wątrobie izoenzym L, mięśniu szkieletowym
izoenzym M ,erytrocyty E
CYKL PURYNOWY

45
Syntetaza adenylobursztynianowa
• wysoka aktywność w mięśniach szkieletowych
• hamowana przez produkty reakcji jak i
nukleotydy purynowe i pirymidynowe
• nukleozydy i wolne zasady nie wywierają
wpływu hamującego
• enzym nie przejawia własciwosci enzymu
allosterycznego
• hamowana przez fruktozo- 1,6 difosforan
CYKL PURYNOWY

46
Liaza adenylobursztynianowa
katalizuje
• reakcje rozszczepienia kwasu adenyloburszty-
nianowego do AMP i kwasu fumarowego
• rozszczepia rybonukleotyd 4-N-sukcynylokarboksy-
amido-5-aminoimidazolowego do rybonukleotydu 4-
karboksy-5- aminoimdazolowego i kwasu
fumarowego
• wysoka aktywność - mięśnie szkieletowe
• enzym hamowany kompetycyjnie przez AMP
CYKL PURYNOWY

47
REAKCJE WIĄZANIA AMONIAKU
1. wątroba – synteza
mocznika
2. we wszystkich tkankach synteza
glutaminy
nieodwracalna; syntaza glutaminowa (ATP) w mięśniu wiąże
NH
3
z cyklu purynowego
ilościowo istotna w mięśniach - aminotransferaza
glutaminowa
w wątrobie, nerkach, mózgu aminacja redukcyjna -
ketoglutaranu
3.
Amoniogeneza
- nerka - komórki cewek -
glutaminaza
glutamina kwas glutaminowy + NH
3
+ H
+
NH
4
+
+ Cl
-
NH
4
Cl
sposób na pozbycie się jonów wodorowych

48
TOKSYCZNOŚĆ AMONIAKU
wyciąganie -ketoglutaranu z cyklu Krebsa zaburzenia
energetyczne
, szczególnie w
mózgu
kwas glutaminowy wiąże NH
3
glutamina
ubywa kwasu glutaminowego neuroprzekaźnik nie
powstaje
GABA
(kwas -aminomasłowy)
encefalopatia wątrobowa
pH płynów komórkowych
hamuje metabolizm aminokwasów i gromadzenie energii w
komórce
reakcja katalizowana przez dehydrogenazę
glutaminową
przesunięta w kierunku tworzenia
glutaminianu
interferuje z wieloma funkcjami błon, szczególnie z aktywnym
transportem jednowartościowych kationów

49
LOSY GRUPY AMINOWEJ
TRANSAMINACJA
TRANSAMINACJA
: aminotransferazy
Donorem a-aminokwas; akceptorem a-ketokwas
Reakcja odwracalna
Koenzymem
fosfopirydoksal
(wit. B
6
)
Uniwersalnym akceptorem – -ketoglutaran
AspAT i AlAT - synteza kwasu glutaminowego,
alaniny,
kwasu asparaginowego
najważniejsza aminotransferaza glutaminianowa
NH
2
-AA + -ketoglutaran glutaminian + a-
keto-AA
Transaminacji
nie
ulega
lizyna, treonina, prolina
Pośrednio
-aminoadypinowy glicyna glutaminian

50
LOSY GRUPY AMINOWEJ
TRANSAMINACJA
TRANSAMINACJA
AspAT
• aktywna w większości tkanek
• mitochondria i cytozol
• szczególnie wątroba
• przenosi N między glutaminianem i
szczawiooctanem oraz
• jeden z elementów wahadła jabłczanowego >
oksydacyjny
metabolizm cukrów i
glukoneogeneza
AlAT
• pozawątrobowe dostarczają alaninę do wątroby
tzw.
cykl
alaninowy
• w wątrobie -ketoglutaran ostateczny akceptor N
z
różnych aminokwasów z obwodu

51
LOSY GRUPY AMINOWEJ
OKSYDACYJNA
OKSYDACYJNA
DEZAMINACJA
DEZAMINACJA
GLUTAMINIANU
GLUTAMINIANU
ograniczone znaczenie kataboliczne; istnieje tylko
1 enzym
u człowieka głównie jest to
aminacja redukcyjna
dehydrogenaza glutamininowa
wewnątrzmitochondrialnie
duża aktywność
wątroba, nerka, mózg
100% 10-20% 5%
oksydacyjna dezaminacja połączona jest w ciąg
reakcji z
transaminacją; rola w syntezie
mocznika

52
LOSY GRUPY AMINOWEJ
• Równowaga reakcji przesunięta w kierunku syntezy glutaminianu
• u ssaków dominuje reakcja uwalniania amoniaku wymuszana przez:
usuwanie produktu końcowego
-
wątroba
-ketoglutaran cykl Krebsa
NADH łańcuch H
2
O + ATP
NH
3
wątroba mocznik
w
innych
tkankach
; gdy NH
3
wysokie
• redukcyjna aminacja -ketoglutaranu glutaminian
• obniża to
-ketoglutaran mechanizm toksyczności NH
3
(OUN)
dehydrogenaza glutamininowa
53
LOSY GRUPY AMINOWEJ
dehydrogenaza glutamininowa
COOH
COOH
CH-NH
2
C=O
CH
2
+ NAD
+
+ H
2
O
CH
2
+ NADH+H
+
+ NH
4
+
CH
2
lub (NADP
+
)
CH
2
lub NADPH+H
+
COOH
COOH
glutaminian
-ketoglutaran
regulowany
allosterycznie
(-) GTP, ATP
(+) GDP, ADP
Obniżenie zawartości związków wysokoenergetycznych
przyśpiesza utlenianie aminokwasów
-aminokwas
-ketoglutaran NADH + NH
4
+
H
2
N-
CO-NH
2
-ketokwas glutaminian NAD
+
+ H
2
O

54
LOSY GRUPY AMINOWEJ
OKSYDAZY
Tlenowa przemiana – w wątrobie i nerkach
Oksydaza
D i L aminokwasów
Samoutleniające się flawoproteiny
R-CH-NH
2
-COOH
FMN (D)
H
2
O
2
H
2
O = ½ O
2
FAD (L)
R – C – COOH
FMNH
2
FADH
2
O
2
NH
H
2
O
iminokwas
+H
+
R – C – COOH
NH
3
NH
4
+
O
-ketokwas

55
LOSY GRUPY AMINOWEJ
DEZAMINACJA SERYNY I TREONINY
bezpośrednio (fosforan pirydoksalu)
dehydrataza serynowa i treoninowa
COOH
COOH
COOH
¦
H
2
O
¦
H
2
O
¦
CHNH
2
CNH
2
C=O
+NH
4
+
¦
¦
¦
CH
2
OH
CH
2
CH
3
Seryna
aminoakrylan
pirogronian
Treonina
-ketomaślan + NH
4
+

56
ROLA ALANINY I GLUTAMINY W TRANSPORCIE AMINOKWASÓW
ALANINA
źródłem
Mięśnie i jelito (30% aminokwasów uwalnianych przez mięśnie)
Transaminacja pirogronianu z glikolizy (70% z glukozy)
Przeniesienie do wątroby
Główny aminokwas glukogenny w wątrobie
“cykl alaninowy”
N z aminokwasów pokarmowych;
aminokwasów mięśni
z jelita z glutaminy + pirogronian
z glukozy

57
CYKL GLUKOZA - ALANINA
GLUKOZA
MOCZNIK
PIROGRONIAN
NH
3
ALANINA
GLUKOZA
PIROGRONIAN
NH
2
ALANINA
AMINOKWASY
WĄTROBA
MIĘŚNIE
K
R
E
W

58
ROLA ALANINY I GLUTAMINY W TRANSPORCIE AMINOKWASÓW
GLUTAMINA
• podstawowa droga wiązania NH
3
w tkankach
obwodowych
• głównie mięśnie szkieletowe
• drenaż substratów z cyklu Krebsa, które są
uzupełniane
przez łańcuchy węglowe
aminokwasów: izoleu, wal,
asp, NH
2
asp,
NH
2
glu
donor N do syntez
substrat amniogenezy nerkowej

59
DEKARBOKSYLACJA AMINOKWASÓW
fosforan pirydoksalu
powstaje CO
2
+ amina I rzędowa;
AMINY
BIOGENNE
;
działanie farmakologiczne;
prekursorzy hormonów;
składniki koenzymów
lizyna
kadaweryna
ornityna
putrescyna
metionina
spermidyna
arginina
agmatyna
seryna
etanolamina
fosfatydy

60
DEKARBOKSYLACJA AMINOKWASÓW
treoniana
propanolamina
witamina B
12
cysteina
cysteamina
koenzym A
kwas asparaginowy
-alanina
CoA, kwas pantotenowy
kwas glutaminowy
kwas -aminomasłowy
(GABA)
mózg
histydyna
histamina
mediator
tyrozyna
tyramina
3,4 diOH fenyloalanina
dopamina
adrenalina
tryptofan
tryptamina
3-OH-tryptofan
serotonina
melantoina

61
AMINOOKSYDAZY
Inaktywacja amin biogennych
Flawoproteiny
aminy -2H iminy
O
2
H
2
O
2
MAO – monoaminooksydaza
DAO – dwuaminooksydaza

62
SYNTEZA MOCZNIKA
Wątroba
• ostateczna detoksykacja NH
3
NH
3
+ CO
2
+ 2ATP
KARBAMOILOFOSFORAN
Jelito: bakterie
Deaminacja
glutaminy
Mięśnie; cykl
purynowy
Wątroba:
Deaminacja
glutaminy
Deaminacja
glutaminianu
Mitochondrialny izoenzym
Syntetaza karbamoilofosforanowa
CPS-I
• swoista dla wątroby
• występuje także w nabłonku jelit
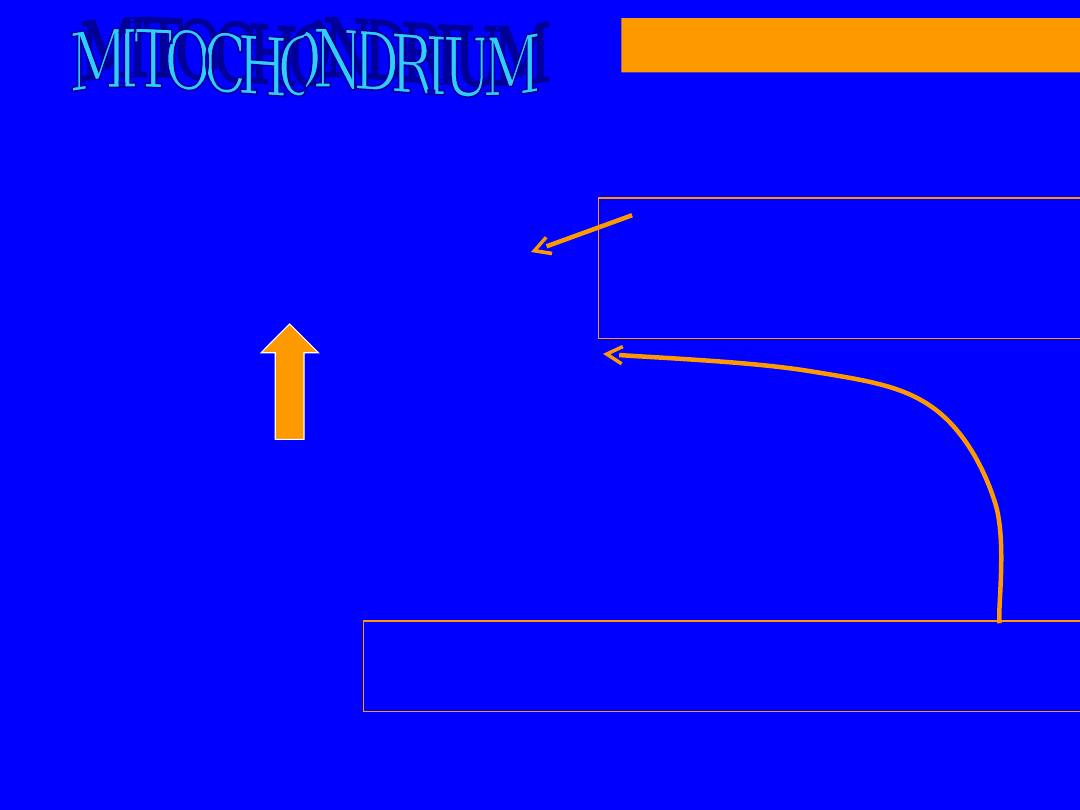
63
SYNTEZA MOCZNIKA
Syntetaza karbamoilofosforanowa
- CPS-I
(+) allosterycznie
N-ACETYLOGLUTAMINIAN
syntetaza
N-acetyloglutaminianu
GLUTAMINIAN + ACETYLO-CoA
• działanie lecznicze argininy w zatruciu NH
3
(+) arginina !!! Endogenna
• arginaza w wątrobie ma b.wysoką aktywność
ze wzrostem stężenia
glutaminianu
jako skutek
• większej dostępności AA
• intensywności transaminacji
64
SYNTEZA MOCZNIKA
KARBAMOILOFOSFORAN
Karbamolilotransferaza
ornitynowa
CYTRULINA
ORNITYNA

65
SYNTEZA MOCZNIKA
CYTRULINA
ATP
syntetaza
argininobursztynianowa
ASPARAGINIAN NH
3
PP + AMP
Pirofosfataza
ARGININOBURSZTYNIAN
jabłczan
P
i
+ P
i
Liaza
fumaran
szczawiooctan
ARGININA
+ NH
3
AspAT
arginaza
asparaginian
ORNITYNA
MOCZNIK
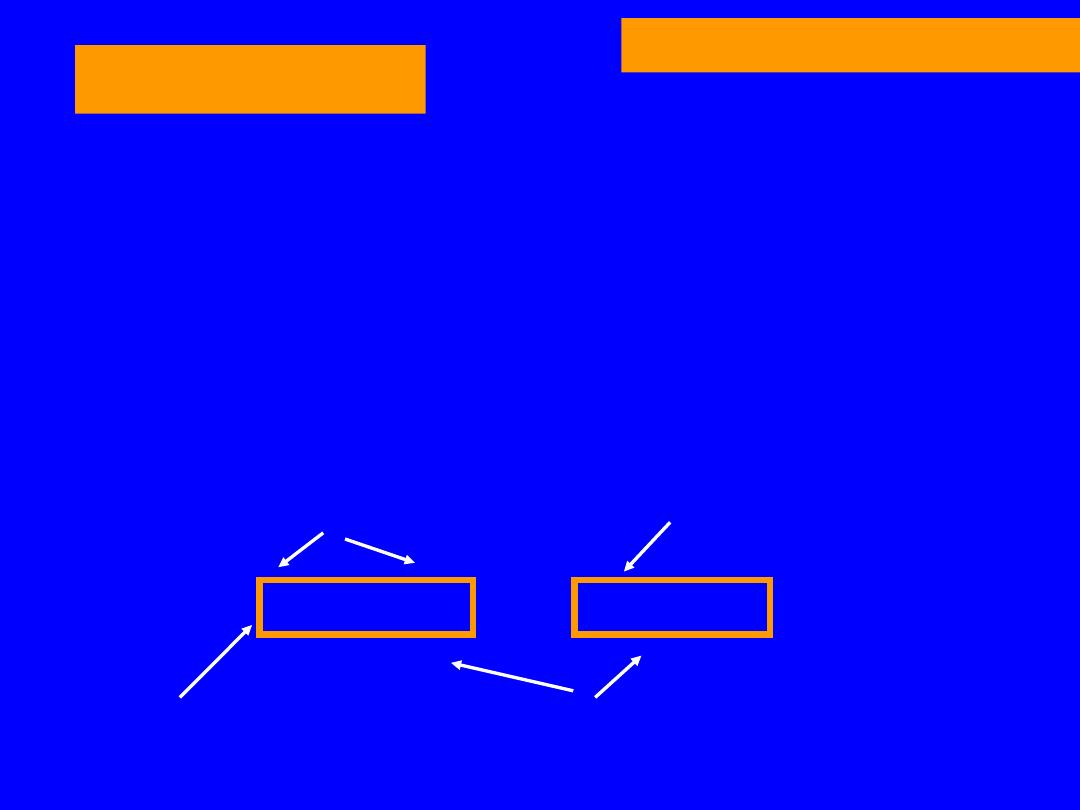
66
SYNTEZA MOCZNIKA
REGULACJA
regulowany adaptacyjnie
w zależności od stężenia białka w diecie
• Dieta bogatobiałkowa (+)
• Glukokortykosterydy (+)
• Głód (+)
Łączy je
zwiększony
wychwyt aminokwasów przez wątrobę
WATROBA
MIĘŚNIE
INSULINA
TYROKSYNA
GLUKAGON
GLUKOKORTYKOSTERYDY

67
SYNTEZA MOCZNIKA
REGULACJA
INSULINA
• w mięśniach
transport dokomórkowy
biosyntezę białek
brak zanik mięśni
• w wątrobie
utylizacja glukozy
oszczędza białka - degradację i wychwyt z krążenia
wpływa
(+)
na bilans azotowy

68
SYNTEZA MOCZNIKA
REGULACJA
GLUKOKORTYKOSTERYDY
• w mięśniach
katabolicznie
rozpad białek AA wątroba glukoneogeneza
synteza białek
• w wątrobie
anabolicznie
GLUKAGON
przez cAMP glikogenoliza
glukoneogeneza
w watrobie AA Glukoneogeneza
!! w mięśniach nie ma receptorów dla glukagonu
TYROKSYNA
• zależy od ilości
• fizjologicznie - anabolicznie w mięśniach
• w nadczynności - katabolicznie
69
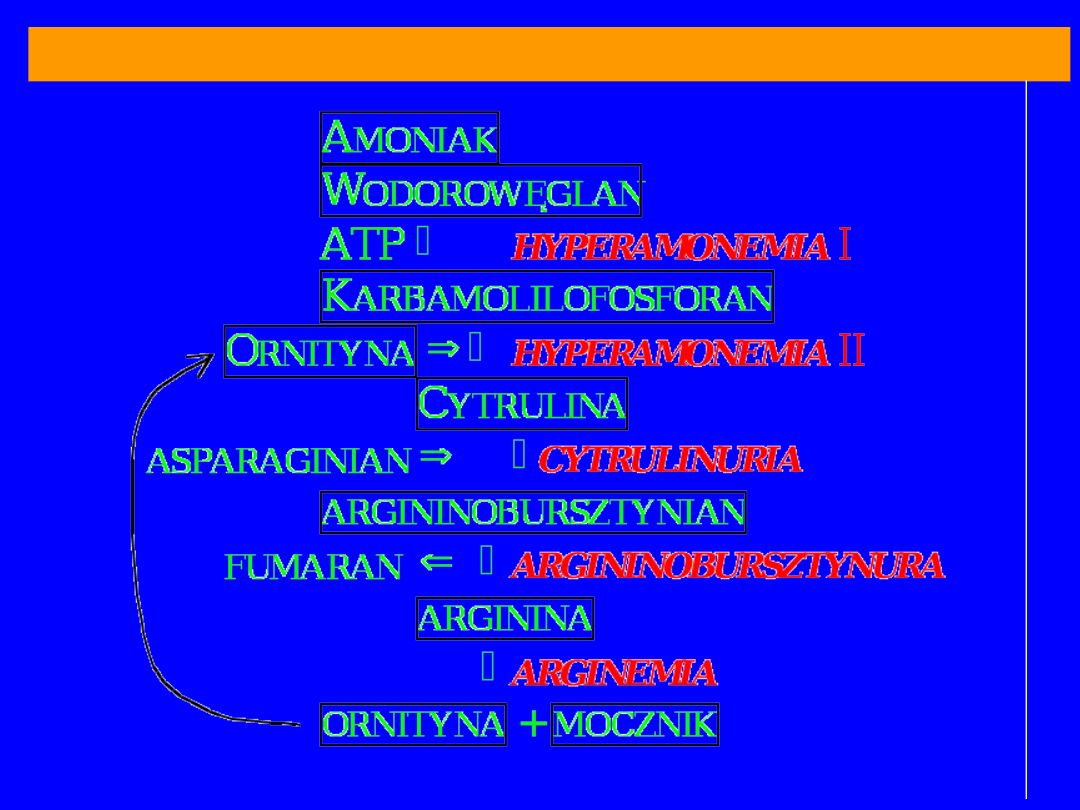
BLOKI METABOLICZNE CYKLU MOCZNIKOWEGO

70
BLOKI METABOLICZNE CYKLU MOCZNIKOWEGO
HYPERAMONEMIA typu I
-
syntetaza
karbamolilofosforanowa
HYPERAMONEMIA typu II
–
karbamoilotransferaza
ornitynowa
Postać ostra; kilka godzin po urodzenie; brak
łaknienia; zaburzenia oddechowe; NH
3
we krwi
1000-2000 g% (norma 100g%)
pH krwi;
zasadowica
metaboliczna; przeżycie
kilkadziesiąt dni
mechanizm: obniżone stężenie cytruliny i argininy
obniżona
synteza N-acetyloglutamininu;
zahamowanie syntetazy
karbamoilofosforanowej NH
3
najbardziej wrażliwe na NH
3
są miejsca wiążące
NH
3
– głównie
aminacja -ketoglutaranu przez
dehydrogenazę
glutaminianową; optimum
pH zasadowe przesuwa reakcję w stronę syntezy
glutaminanu; aktywowana przez ADP a
hamowana przez ATP; a takie warunki dominują w tym
bloku

71
BLOKI METABOLICZNE CYKLU MOCZNIKOWEGO
w redukcyjnej dezaminacji zużywa się także NADH
2
obniżenie
przemian
oksydacyjnych
występuje także
niedobór
szczawiooctanu
z -
ketoglutaranu
w wątrobie w warunkach fizjologicznych szczawioctan
jest
regenerowany z asparaginianu z cyklu
ornitynowego
brak szczawioctanu zahamowanie cyklu Krebsa;
oksydacyjna
fosforylacja; ATP
w tkankach obwodowych podobnie
zaburzenia obu enzymów prowadzą do
zwiększenia
syntezy
glicyny
i
glutaminy
, w których jest
akumulowany nadmiar azotu; ten nadmiar musi być
usuwany z organizmu

72
BLOKI METABOLICZNE CYKLU MOCZNIKOWEGO
leczenie:
dieta uboga w białko wzbogacona benzoesanem i
fenylooctanem;
benzoesan benzoiloCoA + glicyna hipuran;
fenyloacetylo-CoA + glutamina
fenyloacetyloglutamina:
azot jest teraz usuwany jako hipuran i
fenyloacetyloglutamina

73
BLOKI METABOLICZNE CYKLU MOCZNIKOWEGO
CYTRULINEMIA
–
syntetaza
argininobursztynianowa
klasyczny defekt z
obniżonym
powinowactwem
enzymu do
substratu (cytruliny) – bezpośrednia
przyczyna
cytruliny we krwi i moczu
HYPERARGININEMIA
–
arginaza
w moczu arg, liz, cys

74
BLOKI METABOLICZNE CYKLU MOCZNIKOWEGO
Acyduria argininobursztynianowa
–
liaza
argininobursztynianowa
śmiertelna u dzieci
skutki wady można złagodzić podając w diecie
nadmiar argininy
oraz ograniczając zawartość
białka;
arginina w watrobie ulega przekształceniu do
mocznika i ornityny;
ornityna reaguje z
karabamoilofosforanem i powstaje
cytrulina;
łączy się z asparaginianem dając
argininobursztynian; azot jest wydalany jako
argininobursztynian
75
76
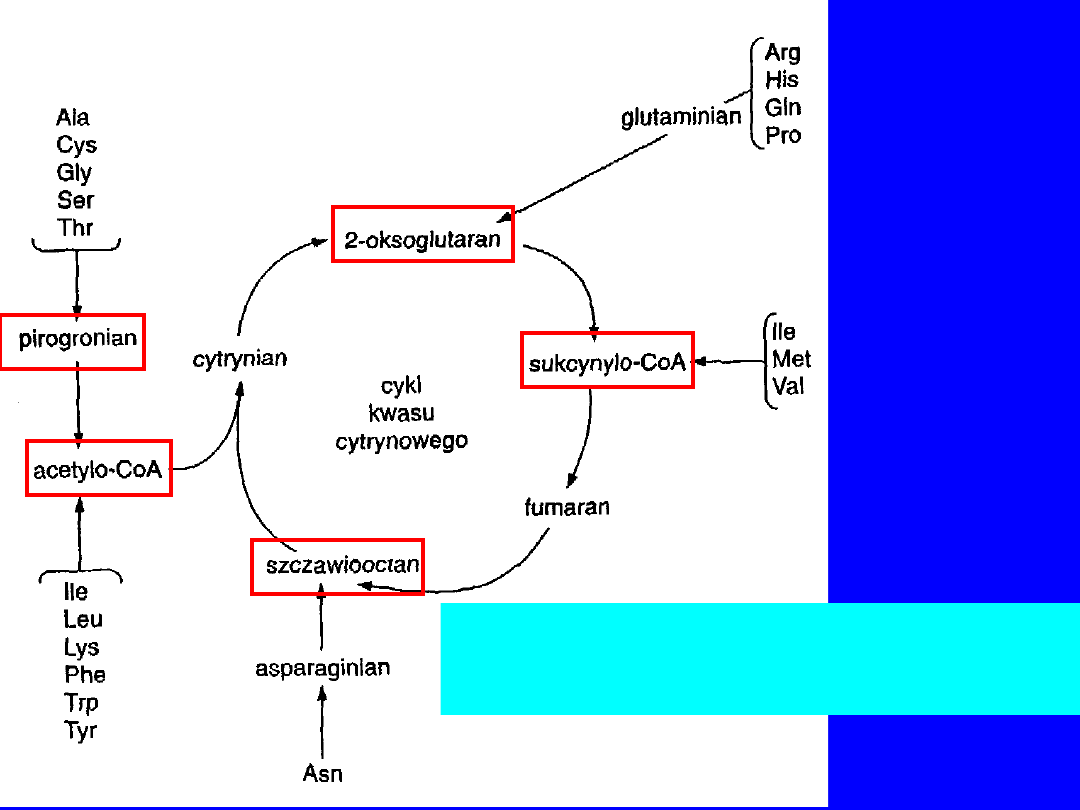
Losy szkieletów węglowych
aminokwasów białkowych

77
ARGININA
Aminokwas
częściowo egzogenny
– w okresie
wzrostu
SYNTEZA
Wątroba?: cykl mocznikowy; ale arginaza
szybko ją
rozkłada; wątroba prawie nic nie
uwalnia do
krwi
Synteza na potrzeby organizmu w 2 tkankach:
jelita i
rdzeń
nerki
W enterocytach dwa pierwsze enzymy cyklu
mocznikowego:
• syntetaza karbamoilofosforanowa
• karbamoilotransferaza ornitynowa
synteza
cytruliny
W rdzeniu nerki aktywność
• syntetazy i liazy argininobursztynianowej

78
ARGININA
JELITA
• z glutaminy napływającej z krwi synteza ornityny
GLUTAMINA
glutaminaza
NH
3
CO
2
+ NH
3
+ ATP
KWAS GLUTAMINOWY
syntetaza karbamoilofosforanowa
karbamoilofosforan
-SEMIALDEHYD GLUTAMINOWY
karbamoilotransferaza
ornitynowa
cytrulina
ORNITYNA
krążenie

79
ARGININA
NERKA
(rdzeń)
kwas asparaginowy [NH
2
]
CYTRULINA
syntetaza argininobursztynianowa
ARGININOBURSZTYNIAN
fumaran
liaza argininobursztynianowa
ARGININA
krążenie
tkanki
synteza kreatyny (wątroba i trzustka)
synteza białek (histony)

80
ARGININA
MÓZG (OUN)
kwas asparaginowy [NH
2
]
CYTRULINA
syntetaza argininobursztynianowa
ARGININOBURSZTYNIAN
fumaran
liaza argininobursztynianowa
ARGININA
SYNTAZA NO
NO/EDRF
neuroprzekaźnik
pamięć krótkoterminowa

81
ARGININA
Względna aktywność
WĄTROBA JELITO NERKI
karbamolilotransferaza ornitynowa
wysoka wysoka niska
syntetaza argininobursztynianowa
niska
wysoka wysoka
arginaza
wysoka niska niska

82
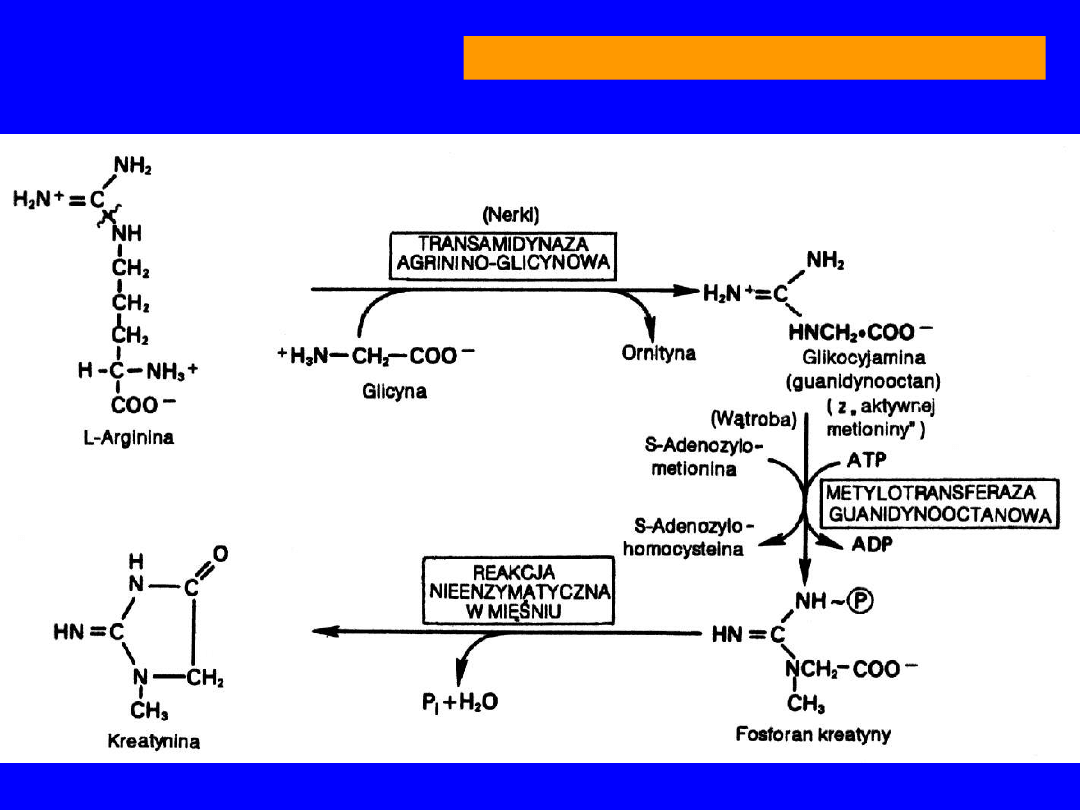
•
Dekarboksylacja
oligoamina -
agmatyna
wpływa na podziały mitotyczne
•
transamidynacja
przeniesienie reszty
guanidynowej na
glicynę transamidynaza
argininoglicynowa
guanidynooctan (nerka)
+CH
3
(S-adenozylometionina)
metylotransferaza
guanidynooctanowa
kreatyna
(wątroba)
ARGININA
83
SYNTEZA KREATYNY I KREATYNINY
NERKI
WĄTROBA
MIĘŚNIE

84
ORNITYNA
• Aminokwas niebiałkowy
•
transaminacja
semialdehyd kwasu
glutaminowego
utlenienie kwas
glutaminowy
•
dekarboksylacja
dekarboksylaza ornitynowe
tetrametylenodiamina - putrescyna
(
1,4-diaminobutan)
• powstawanie
poliamin
- spermina i
spermidyna
część putrescynowa poliamin pochodzi z
ornityny
, a diaminopropanowa ze
zdekarboksylowanej S-
adenozylometioniny
• u eukariotów głównie spermidyna i spermina;
prokaryota - putrescyna i
spermidyna
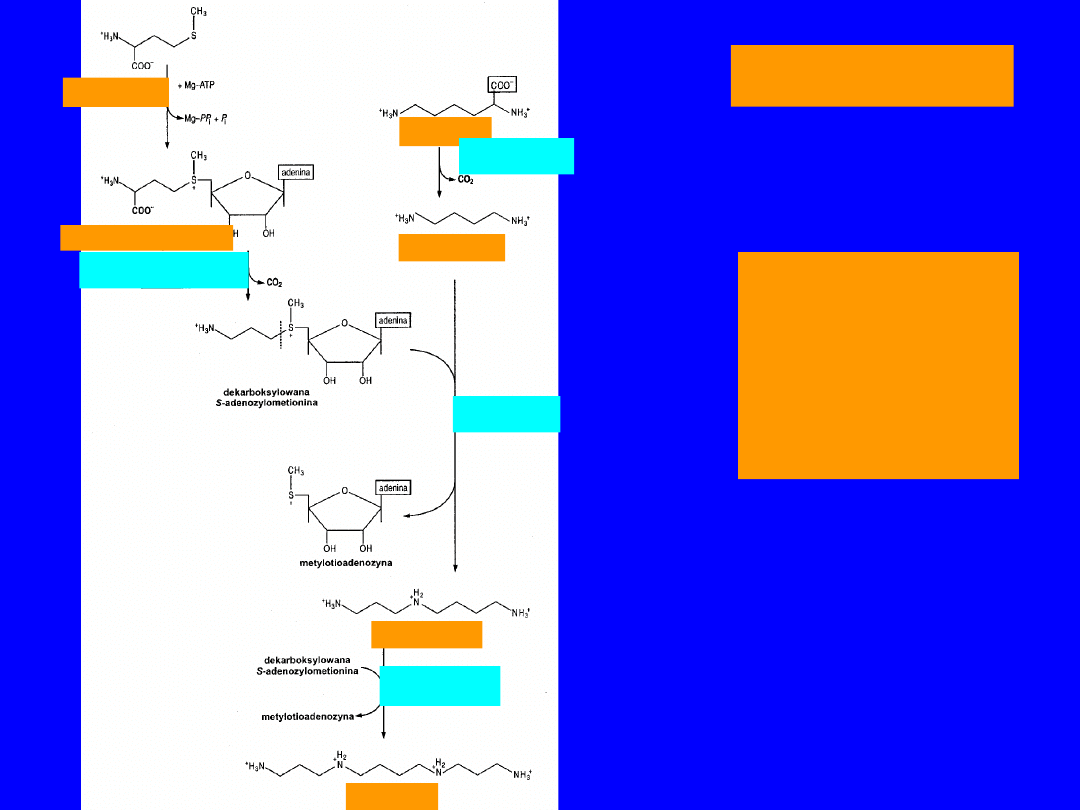
85
ORNITYNA
BIOSYNTEZ
A
SPERMINY I
SPERMIDYN
Y
metionina
S-adenozylometionina
Dekarboksylaza
S-adenozylometioninowa
ornityna
Dekarboksylaza
ornitynowa
putrescyna
syntaza
spermidynowa
spermidyna
syntaza
spermidynowa
spermina
86
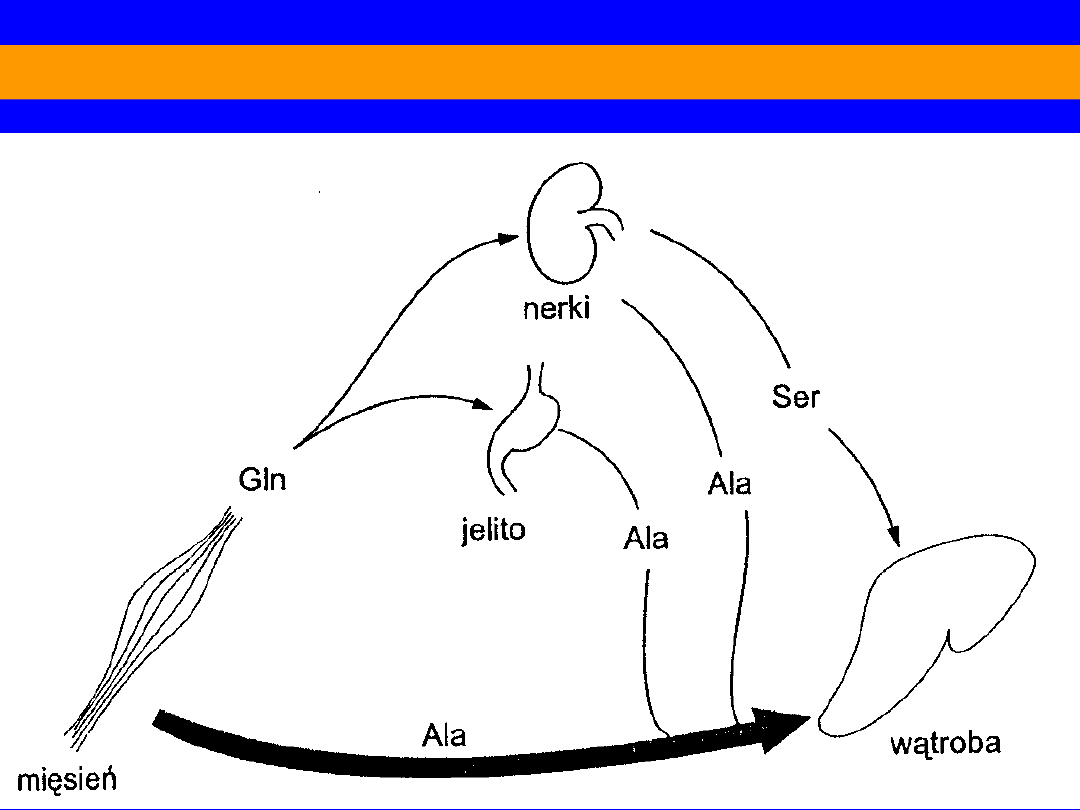
Miedzynarządowa wymiana aminokwasów w stanie poresorbcyjnym
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
- Slide 72
- Slide 73
- Slide 74
- Slide 75
- Slide 76
- Slide 77
- Slide 78
- Slide 79
- Slide 80
- Slide 81
- Slide 82
- Slide 83
- Slide 84
- Slide 85
- Slide 86
Wyszukiwarka
Podobne podstrony:
metabolizm bialek i aminokwasow TEST
metabolizm bialek i aminokwasow TEST
metabolizm białek, pula?, itp
2011.10.28 - Metabolizm bialek, Fizjologia człowieka, wykłady
Przemiany białek i aminokwasów
Fizykochemiczne właściwości białek i aminokwasów sprawozdanie
Wykład VIII Metabolizm białek
Metabolizm biaek i aminokwaswa
Katabolizm białek i aminokwasów(1)
(), biochemia L, sprawozdanie Amfoteryczny charakter białek i aminokwasów (ćw I)
BIOCHEMIA Metabolizm aminokwasów i białek
metabolizm aminokwasów i białek, Biologia, Biochemia
więcej podobnych podstron