Sposoby regulacji aktywności enzymatycznej
tzw. enzymów regulatorowych:
1. poprzez odwracalną modyfikację kowalencyjną
2. przez aktywację proteolityczną
3. na drodze oddziaływań allosterycznych
4. wiązanie białek regulatorowych
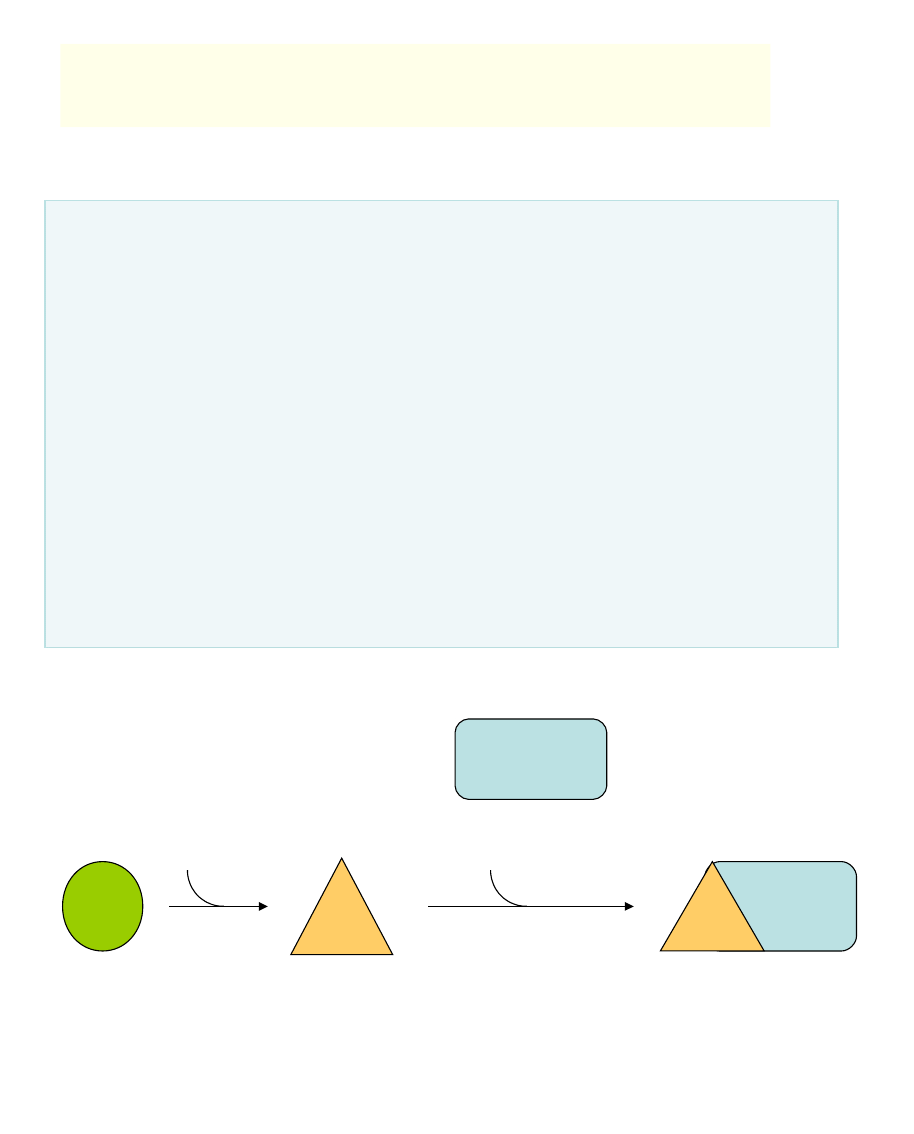
np.: kalmoduliny (białko o masie cząst.
17kDa aktywuje liczne enzymy w
odpowiedzi na wysokie stężenie Ca
2+
kalmodulina
aktywny enzym
kompleks
Ca
2+
-kalmodulina
nieaktywny enzym
Ca
2+
Ca
2+
Ca
2+

Nomenklatura i systematyka enzymów
1961r pierwsze podstawowe zasady nomenklatury i klasyfikacji
enzymów
przez
Komisję Enzymatyczną
powołaną przez Międzynarodową
Unię Biochemiczną i Biologii Molekularnej (
IUBMB -
I
nternational
U
nion of
B
iochemistry and
M
olecular
B
iology) powołaną
w
1955r.
1992 r
Nomenklatura enzymów
wydana przez
Komitet Enzymowy
(
NC- N
omenclature
C
ommittee)
IUBMB
– pozycja
książkowa
Aktualny wykaz enzymów oraz informacje o nazewnictwie można
odnaleźć na stronach internetowych Komitetu Enzymowego
IUBMB:
www.chem.qmw.ac.uk/iubmb/enzyme
Informacje o enzymach można także odnaleźć przeszukując bazy
danych opierających się na zasobach NCIUB MB:
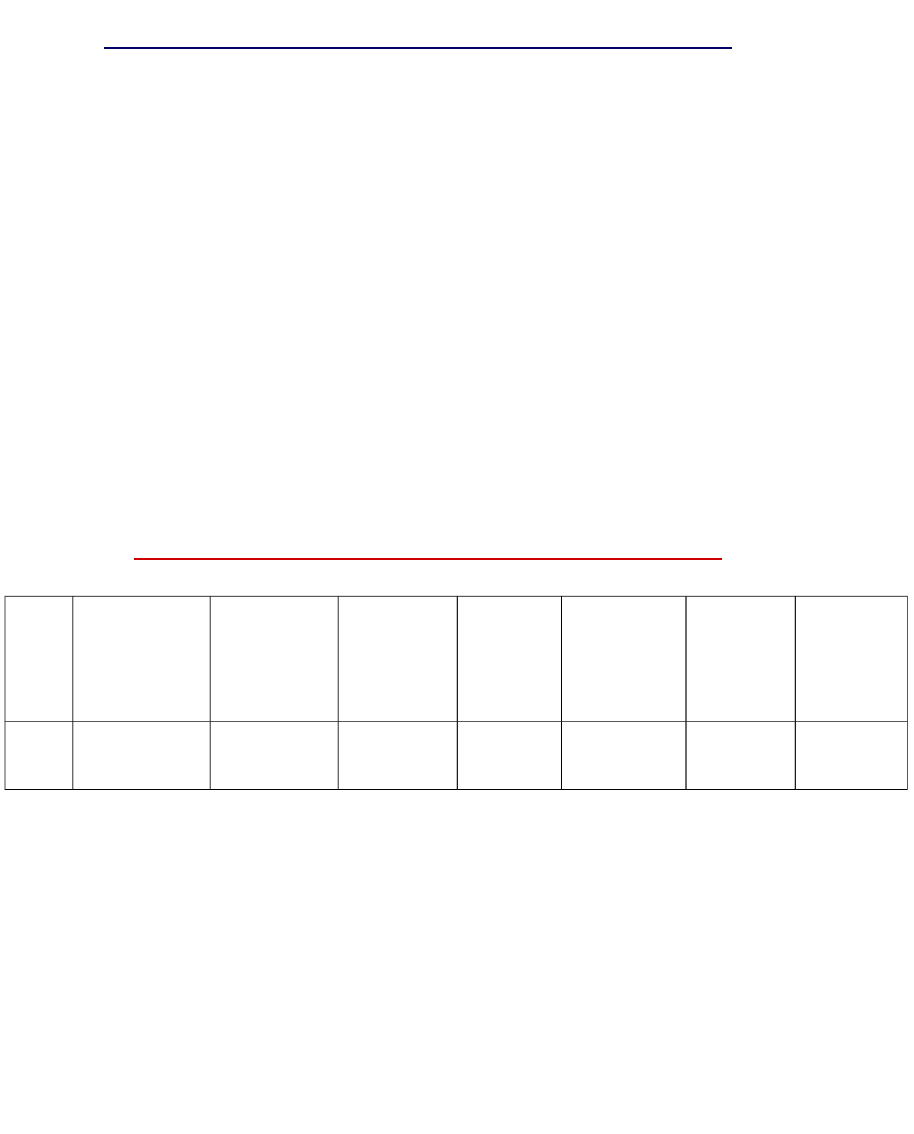
Klasa 1
Oksydo-
reduktaz
y
Klasa 2
Transfe
-
razy
Klasa
3
Hydro-
lazy
Klasa
4
Liazy
Klasa 5
Izomera
zy
Klasa
6
Ligazy
Wszyst
kie
klasy
Lic
zba
1125
1180
1129
371
Aktualna liczba sklasyfikowanych enzymów
1.
Klasyfikacja
enzymów opiera się na
typie
katalizowanej reakcji
2.
Każdy
enzym
ma
nazwę systematyczną i potoczną.
Nazwa systematyczna
jest dwuczłonowa:
-> część pierwsza o końcówce
– aza
mówi o typie katalizowanej
reakcji,
-> część druga wskazuje na substrat(y)
3. W klasyfikacji systematycznej enzymy oznacza się
wg. kodu
liczbowego
4 liczbami arabskimi oddzielonymi kropkami,
poprzedzonymi literami EC (Enzyme Commission)
Podstawowe zasady klasyfikacji i nazewnictwa

1. Oksydoreduktazy
Enzymy katalizujące reakcje oksydoredukcyjne, polegające na
przenoszeniu elektronów i protonów (at. H), samych elektronów lub
polegające na bezpośrednim włączaniu tlenu do substratu.
Klasa ta obejmuje następujące grupy enzymów:
AH
2
+ B <-> A + BH
2
A - substrat, B - koenzymy
np.: NAD
+
, FAD
A + BH
2
<-> AH
2
+ B
A – substrat, B – koenzymy np: NADP
+
,FAD
2AH
2
+ O
2
<-> A + 2H
2
O
A - substrat
AH
2
+ O
2
<-> A + H
2
O
2
AH
2
+ H
2
O
2
<-> 2A + 2H
2
O
A - substrat
a) A + O
2
<-> AO
2
A - substrat
b) AH + BH
2
+
O
2
<-> AOH + B + H
2
O
A, B - substraty
- dehydrogenazy – utlenienie
- reduktazy – redukcja
- oksydazy
- peroksydazy
- oksygenazy (a) i hydroksylazy(b)
oksydaza glukozy
– nazwa potoczna
oksydoreduktaza -D-glukoza : tlen –
nazwa
systematyczna
EC 1. 1. 3. 4
numer klasyfikacyjny
kolejność w podpodklasie
akceptor: tlen
utleniana grupa w donorze: CH-OH
klasa enzymu
1. Oksydoreduktazy
O
OH
H
OH
H
HO
H
H
H
OH
CH
2
OH
-D-glukoza
O
OH
OH
H
HO
H
H
H
CH
2
OH
O
D-glukonolakton
+ O
2
+ H
2
O
2
FAD
- do
usuwania tlenu z paczkowanej żywności
(ochrona przed
utlenienien -> przed niekorzystnymi zmianami barwy, zapachu) np.
stabilizacja piwa, soków, ochrona majonezu przed jełczeniem
- do
usuwania glukozy
z żywności np.: do odcukrzania masy jajowej
przed suszeniem
- do
oznaczania ilościowego glukozy
w żywności
- H
2
O
2
działa bakteriobójczo – paczkowana żywność, miód

heksokinaza
- nazwa potoczna
6-fosfotransferaza ATP : D-heksoza
-
nazwa systematyczna
EC 2. 7. 1. 1 -
numer klasyfikacyjny
kolejność w podpodklasie
grupa akceptorowa: grupa alkoholowa
przenoszona grupa: grupa zawierająca fosfor
klasa enzymu
+ ATP
OH
OH
OH
OH
H
H
H
H
H
CH
2
OH
OH
OH
OH
OH
H
H
H
H
H
CH
2
OPO
3
2-
+ ADP
+ H+
glukoza
glukozo-6-fosforan
O
O
2. Transferazy
Klasa ta obejmuje enzymy katalizujące przeniesienie grup chem. pomiędzy
poszczególnymi związkami i to zwykle przy udziale specyficznych koenzymów.
W zależności od rodzaju przenoszonych grup lub rodników wyróżniamy min.:
przenoszą grupę aminową –NH
2
przenoszą grupy fosforanowe z udziałem ATP
przenoszą grupę –CH
3
przenoszą grupy cukrowe
- aminotransferazy:
- fosfotransferazy (kinazy):
- metylotransferazy:
- glikozylotransferazy:
- acylotransferazy:
przenoszą grupy acylowe 2,4,6-węglowe

3. Hydrolazy
Enzymy katalizujące reakcje hydrolizy, czyli rozkładu wiązań z udziałem
cząsteczki wody.
Jest to jedyna klasa enzymów, która nie wymaga obecności koenzymów.
esterazy
- glikozydazy
(np. amylazy, celulaza)
- peptydazy
- amidazy i deaminazy
W zależności od rodzaju atakowanych wiązań rozróżniamy hydrolazy min. :
- rozkładające wiązanie estrowe:
- lipazy
(hydrolazy estrów karboksylowych),
- fosfatazy
(hydrolazy monoestrów fosforanowych)
- hydrolizujące wiązania glikozydowe
- hydrolizujące wiązania peptydowe
(np. trypsyna, pepsyna,
chymotrypsyna)
- rozkładające wiązanie C- N inne niż peptydowe np. w amidach
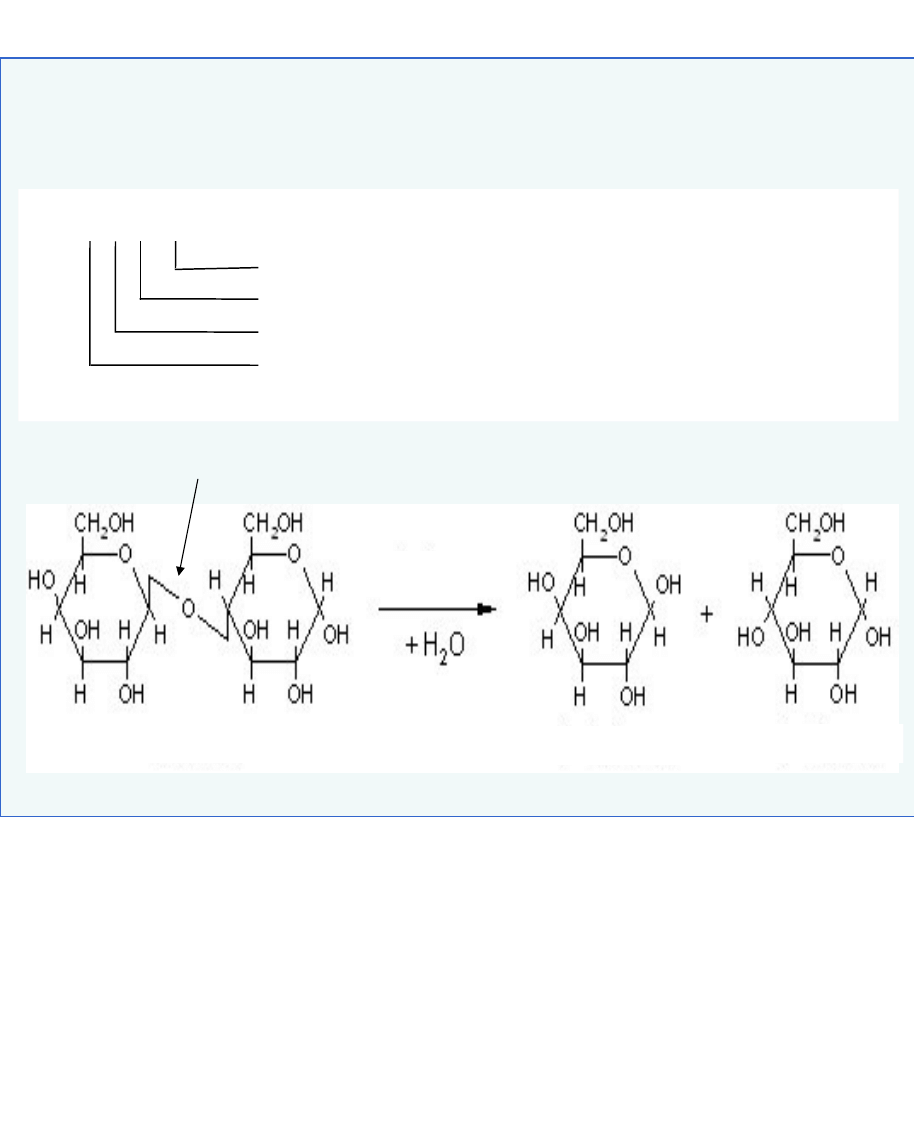
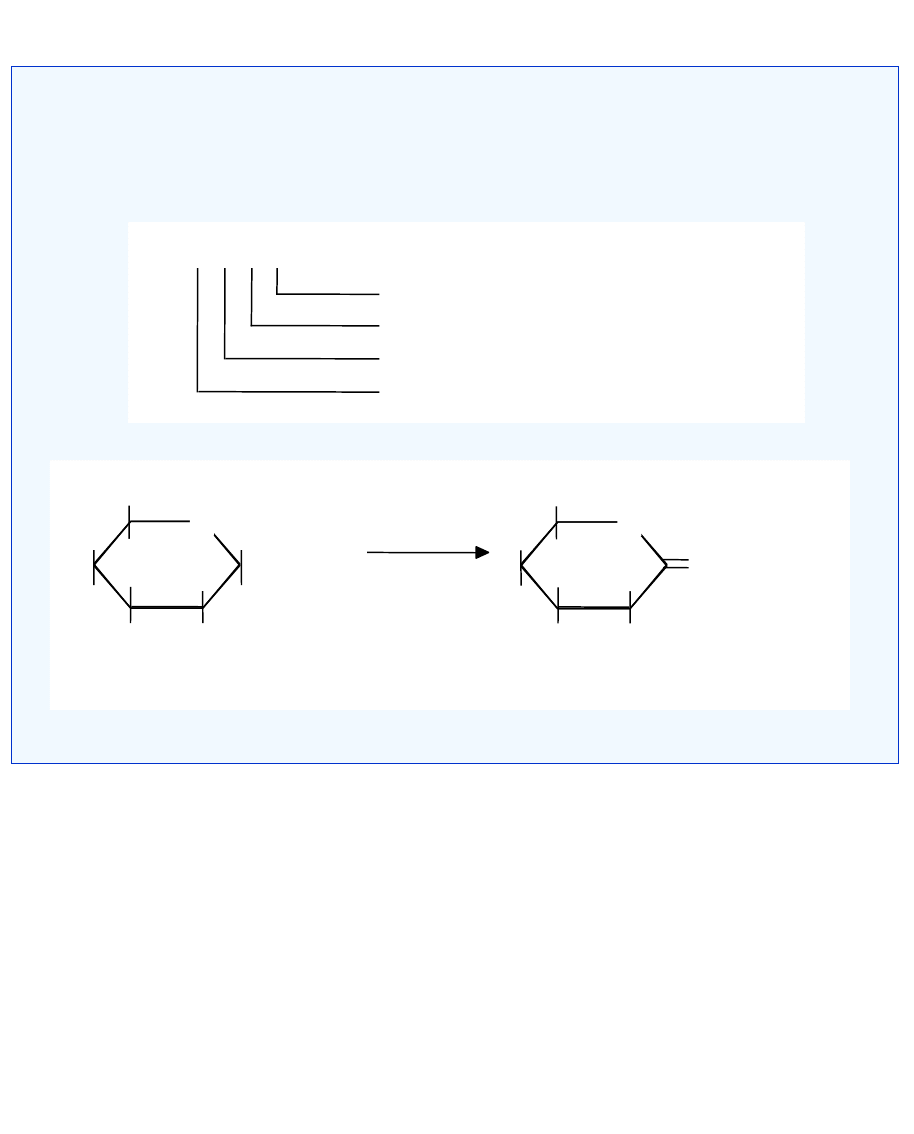
wiązanie
-1,4-glikozydowe
laktoza
-D-glukoza
-D-galaktoza
3. Hydrolazy
-D-galaktozydaza, laktaza
- nazwa potoczna
galaktohydrolaza -D-galaktozydu
- nazwa systematyczna
EC 3. 2. 1. 23 – numer klasyfikacyjny
kolejność w podpodklasie
hydrolizowane wiązanie: wiąz. glikozydowe
klasa enzymu
hydrolizowane wiązanie dokładniej: 0- lub S-glikozylowe
laktaza
-
produkcja bezlaktozowego mleka i serwatki
-
produkcja koncentratów z mleka
(np.mleka w proszku),
lodów,
kremów
:
●
glukoza i galaktoza słodsze oraz lepiej rozpuszczalne od laktozy ->
możliwe przygotowanie roztworów o wyższym stężeniu cukrów i z
mniejszą tendencja do krystalizacji podczas zatężania
-
przyspiesza fermentację mlekową
w technologii fermentowanych
napojów mlecznych i serów dojrzewających, skracając czas produkcji
Chymozyna
- nazwa potoczna
Przykład:
Brak
- nazwa systematyczna
EC 3. 4. 23. 4 – numer klasyfikacyjny
kolejność w podpodklasie
hydrolizowane wiązanie: wiązanie C-N peptydowe
klasa enzymu
endopeptydazy aspartylowe
-kazeina
para--kazeina
glikomakropeptyd
3. Hydrolazy

Ze względu na rodzaj rozszczepianych wiązań wyróżniamy min. liazy:
- rozrywające wiązanie C-C
- dekarboksylazy
- uwalniają CO
2
z substratów
- aldolazy
- uwalniają aldehydy z substratu
- działające na wiązania C-O
- odłączają cząsteczkę wody
4. Liazy
Syntazy –
ogólnie gdy równowaga reakcji przesunięta w kierunku
syntezy,
nie wymagają nakładu energii do syntezy wiązań
- dehydratazy / hydratazy
- amoniakoliazy -
odłączają NH
3
dekarboksylaza pirogronianowa
- nazwa potoczna
karboksyliaza 2-oksokwasów
-
nazwa systematyczna
EC 4. 1. 1. 1
numer klasyfikacyjny
kolejność w podpodklasie
rozszczepiane wiązanie : wiązanie C-C
klasa enzymu
odszczepiana grupa: grupa COO
-
CO
2
COOH
O
C
CH
3
H
O
C
CH
3
DPT
+
kwas pirogronowy aldehyd octowy
DPT - difosforan tiaminy
- rozszczepiające wiązanie C-N
Enzymy katalizujące odwracalne lub nieodwracalne rozerwanie różnych
wiązań bez udziału wody, przy czym z substratu na który działa enzym
odłączane są pewne grupy chem. i uwalniane w postaci zw.
drobnocząsteczkowych (np.. CO
2
, H
2
O, NH
3
, aldehydy).
- rozszczepiające wiązanie C-S -
desulfhydrazy
(odszczepiają H
2
S)
5. Izomerazy
Należą tutaj enzymy katalizujące różne reakcje izomeryzacji min.:
- odpowiedzialne za zmianę konfiguracji przy węglu
asymetrycznym (wzajemne przekształcenia
konfiguracji L i D lub formy i )
- racemazy i epimerazy
- izomerazy cis - trans
- izomeria geometryczna (cis-trans)
-
mutazy
(wew.cząst transferazy) - przemieszczenie grup wew. cząsteczki
Klasa enzymów katalizujących przekształcenia wewnątrzcząsteczkowe:
przegrupowania atomów bądź grup chem. Skład chemiczny związku nie
ulega zmianie
- izomerazy odpowiedzialne za wewnątrzcząsteczkowe przemiany
oksydoredukcyjne (przesunięcie atomów H
+
)
izomeraza ksylozowa (glukozowa)
- nazwa potoczna
Przykład:
ketolo-izomeraza D-ksylozy
- nazwa systematyczna
EC 5. 3. 1. 5 numer klasyfikacyjny
kolejność w podpodklasie
typ przekształcenia : przegrupowanie atomów H
+
klasa enzymu
dokładniej przekształcenie: przemiana aldoza - ketoza
D-glukoza
CH
2
OH
C OH
H
C H
HO
C OH
H
HC
C
O
O H
H
C O
CH
2
OH
CH
2
OH
C OH
H
C H
HO
C OH
H
D-fruktoza
D-glukoza
CH
2
OH
C OH
H
C H
HO
C OH
H
HC
C
O
O H
H
C
O
CH
2
OH
CH
2
OH
C OH
H
C H
HO
C OH
H
D-fruktoza
Izomeraza glukozowa
Izomeraza glukozowa -
EC 5. 3. 1. 5
- do
produkcji syropów wysokofruktozowych
stos. jako
środek
słodzący,
gdyż:
● fruktoza słodsza od sacharozy i glukozy
● fruktoza najlepiej rozpuszczalny sacharyd -> ułatwia przyg.
syropów
o wyższym stężeniu cukrów i zmniejszonej tendencji do krystalizacji
-do
otrzym. fruktozy
, fruktoza ma wysoką zdolność wiązania wody,
zapobiega utracie wilgoci w przechowywanych produktach
żywnościowych np. owoców kandyzowanych, w produkcji pieczywa

6. Ligazy, zwane potocznie syntetazami
Są to enzymy katalizujące syntezę - powstanie nowych wiązań:
C-O, C-S, C-N, C-C.
Wszystkie reakcje katalizowane przez ligazy zachodzą z
udziałem ATP lub innego związku makroergicznego
Syntetazy katalizujące dołączenie do substratu CO
2
– nazywamy
potocznie
karboksylazami
syntetaza acetylo-CoA
nazwa potoczna
Przykład:
ligaza octan : CoA (AMP)
nazwa systematyczna
EC 6. 2. 1. 1 numer klasyfikacyjny
kolejność w podpodklasie
klasa enzymu
substraty syntezy: kwas - tiol
powstające wiązanie: C-S
CH
3
COOH + HS-CoA
ATP AMP + PP
i
CH
3
-C
O
S-CoA
acetylo-CoA
CoA
kwas octowy

Zastosowanie eznymów w przemyśle rolno-spożywczym
1.
Enzymy amylolityczne (rozkładające wiąz. glikozydowe w
skrobii) - gł. amylazy, glukoamylazy
-
p. browarniczy i gorzelniczy - przekształcenie skrobi w sacharydy
fermentujące, gł. w glukozę ulegającą fermentacji alkoholowej
-
p. piekarski - j.w. - spulchnianie ciasta przez CO
2
, który powstaje
podczas fermentacji alkoholowej
-
p. farmaceutyczny - otrzymywanie glukozy
-
p. cukierniczy - scukrzanie skrobi, produkcja glukozy
2.
Enzymy proteolityczne (rozkładające wiązania peptydowe)
-
p. mięsny i rybny - zmiękczanie, kruszenie mięsa (katepsyny,
papaina)
-
p. piwowarski - zapobieganie zmętnieniom białkowym piwa
-
p. serowarski - koagulacja mleka, dojrzewanie serów (chymozyna)
3.
Enzymy pektynolityczne (rozkładające wiąz. glikozydowe w
pektynach)
-
p. owocowo - warzywny - klarowanie soków,
-
- zwiększenie wydajności przy tłoczeniu i ekstrakcji
składników z miazgi owocowej
- przeciwdziałanie żelowaniu zagęszczonych soków
4. Enzymy z klasy oksydoreduktaz np. oksydaza glukozy lub
izomeraz np.izomeraza glukozowa

Koenzymy
- niskocząsteczkowe związki organiczne
- niebiałkowa część enzymu, która łącząc się z białkiem enzymu i
substratem umożliwia przemianę substratu w produkt
- przenośniki elektronów, protonów bądź określonych grup funkcyjnych
- syntetyzowane na bazie witamin rozpuszczalnych w wodzie (głównie
witamin z grupy B)
Witaminy
- składniki mające istotne znaczenie w prawidłowym metabolizmie
- konieczne do życia substancje o charakterze regulacyjnym
- muszą być dostarczone wraz z pożywieniem
- działają w małych stężeniach
- ich brak lub niedobór powoduje awitaminozę
Dinukleotyd nikotynamidoadeninowy (NAD
+
)
i jego fosforan (NADP
+
)
OH
OH
CH
2
C
O
NH
2
+
O
-O P
O
amid kwasu
nikotynowego
(wit. PP)
D-ryboza
NAD
+
:
R
= H
NADP
+
:
R
=
PO
3
2-
NH
2
O
R
OH
CH
2
O
O
-O P
O
adenina
D-ryboza
AMP
N
O
N
N
N
N
O
C
O
NH
2
+
H
R
C
O
NH
2
H
R
H
+
H
+
2
H
+
+
2e-
-
2
H
+
-
2e
-
Amid kwasu nikotynowego
utleniony
(NAD+
, NADP
+)
zredukowany
(NADH + H+
, NADPH + H+)
N
N
..
+
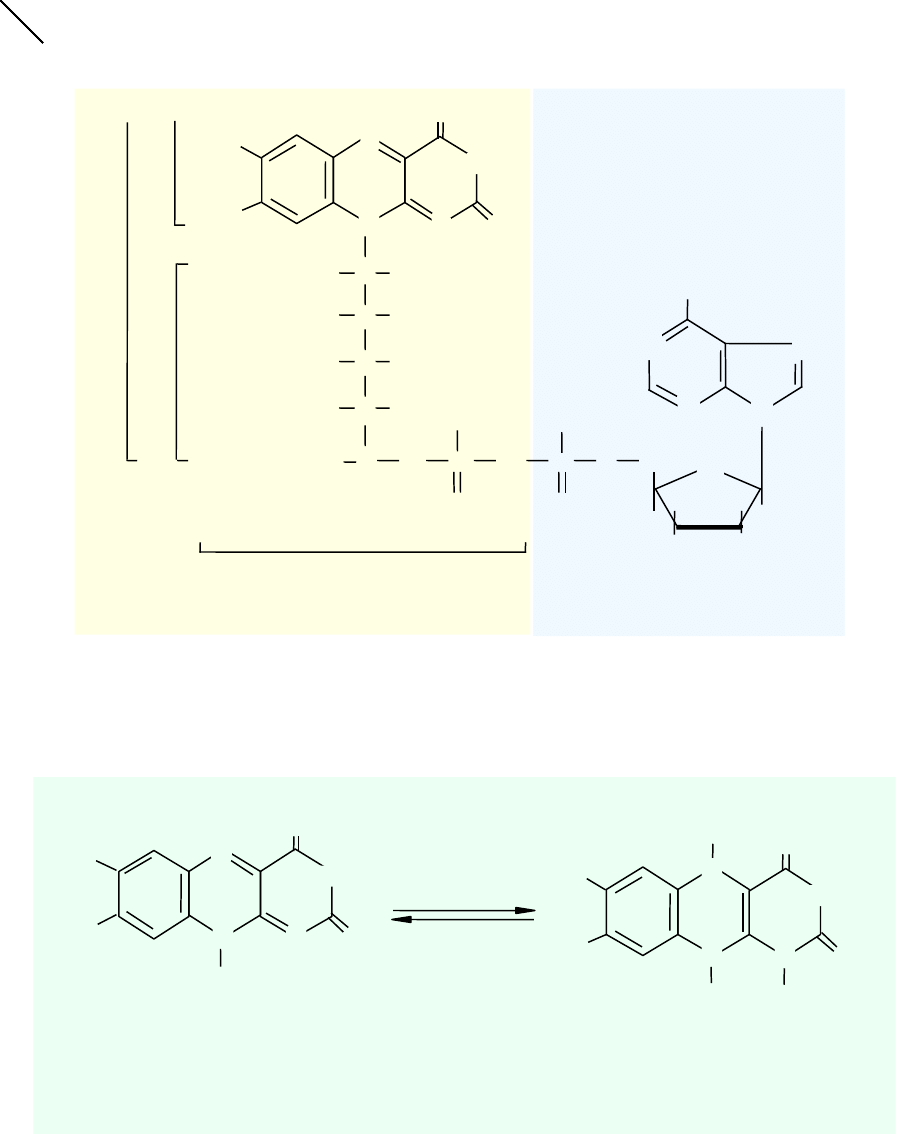
Flawina - dimetyloizoaloksazyna
O
O
+
2H
+
+
2e-
-
2H
+
-
2e
-
N
O
O
R
R
H
H
H
3
C
H
3
C
H
3
C
H
3
C
N
N
NH
NH
N
N
N
forma utleniona
(FAD, FMN)
forma zredukowana
(
FADH
2
,
FMNH
2
)
NH
N
N
N
O
H
3
C
H
3
C
O
C
C
C
H
H
OH
OH
H
H
ry
b
it
o
l
ry
b
o
f
a
w
in
a
(
w
it
.
B
2
)
f
a
w
in
a
AMP
O-
C
C OH
H
H
2
O
O
P
O
O
P
O
O-
FMN
- mononukleotyd fawinowy
- fosforan rybofawiny
Dinukleotyd fawinoadeninowy - FAD
OH
CH
2
O
NH
2
OH
N
N
N
N
żółta
bezbarwna
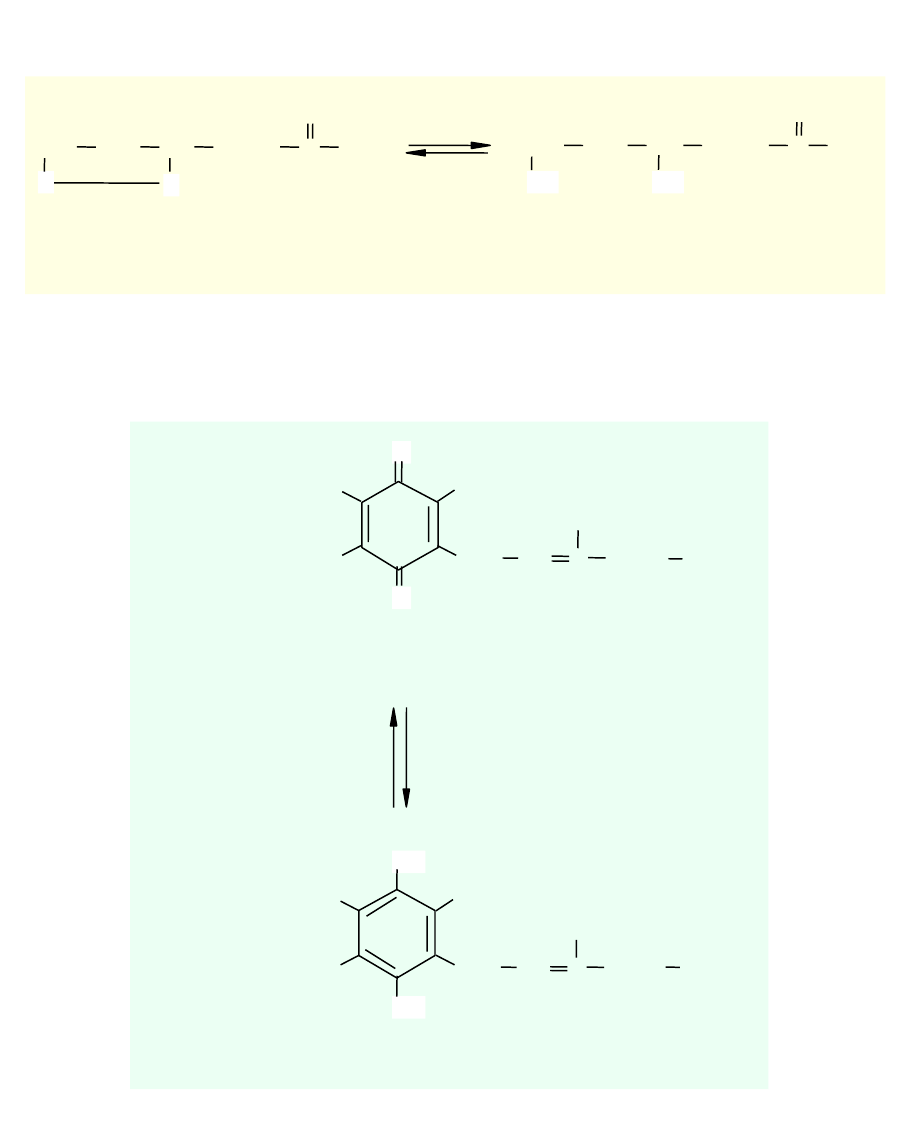
Amid kwasu liponowego
CH
2
CH
CH
2
S
(CH
2
)
4
C
NH
2
O
CH
2
CH
CH
2
S
H
S
H
(CH
2
)
4
C NH
2
O
+
2H
+
+
2e
-
-
2H
+
-
2e
-
forma utleniona
forma zredukowana
S
CH
3
CH
(
CH
2
CH
3
CH
2
)
C
H
H
3
CO
H
3
CO
O
O
n
CH
3
CH
(
CH
2
CH
3
CH
2
)
C
H
H
3
CO
H
3
CO
O
H
O
H
n
+
2
H
+
+
2e-
-
2H
+
-
2e-
forma utleniona
(Q, ubichinon)
forma zredukowana
(QH
2
, ubichinol)
Koenzym Q (ubichinon)
n= 6-10
izopentenol
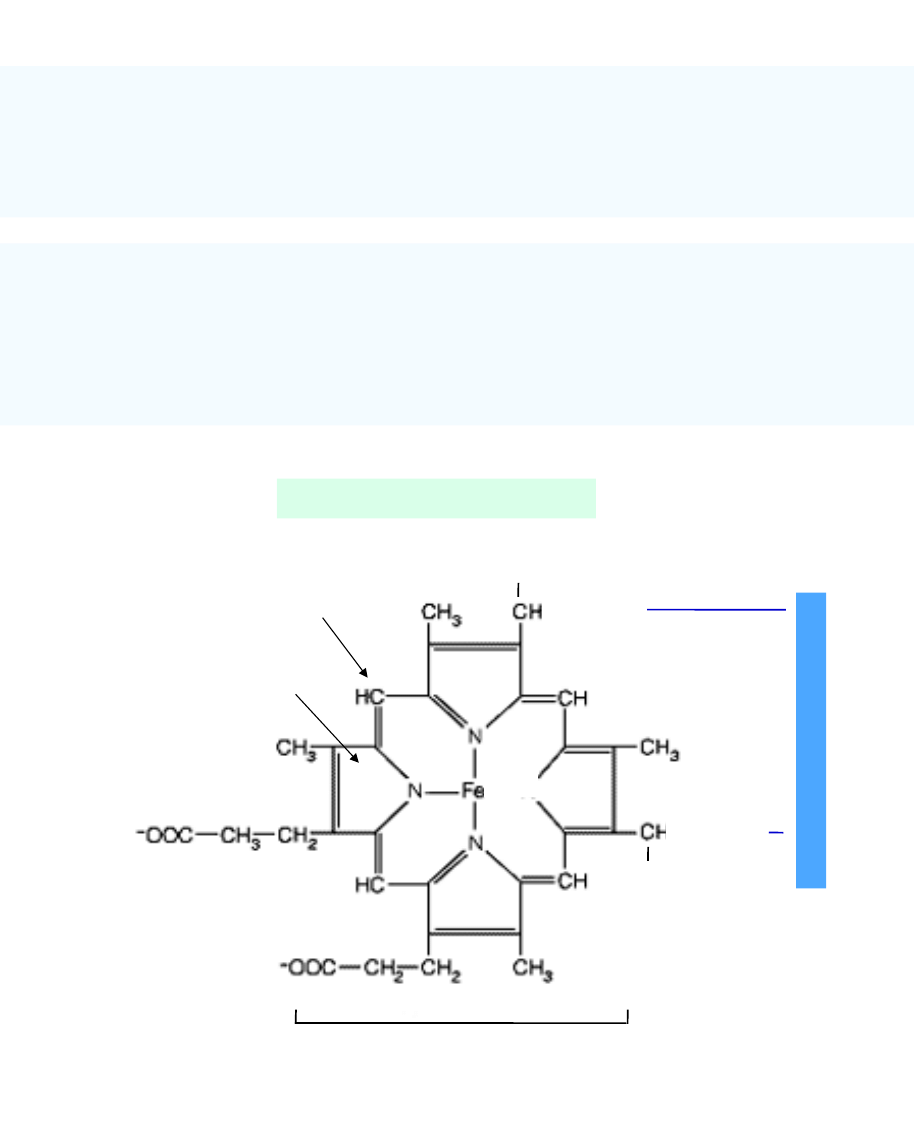
Budowa cytochromu c
Heminy komórkowe
- związki o charakterze żelazoporfiryn
- uczestniczą w transporcie elektronów
- stanowią grupę prostetyczną:
- wielu enzymów: peroksydaza, katalaza, oksydaza cytochromowa c
- białek o charakterze nieenzymatycznym np. cytochromów
Cytochromy
- hemoproteiny o charakterze nieenzymatycznym
- biorą udział w transporcie pojedynczych elektronów w łańcuchu oddechowym
- ich rola polega na utlenianiu za pośrednictwem koenzymu Q zredukowanych
koenzymów flawinowych FMNH
2
-> CoQ -> cyt.c ->O
2
- przyjmują i oddają elektrony zmieniając wartościowość żelaza (Fe
2+
- zred, Fe
3+
-
utl.)
N
b
ia
łk
o
CH
3
-
S – CH
2
żelazoporfiryna
-
S – CH
2
CH
3
1
2
3
4
pierścień pirolowy
mostki metinowe
3
+

Podział koenzymów
1.
Koenzymy przenoszące elektrony i protony, współdziałające z
oksydoreduktazami
-
NAD
+
- dinukleotyd nikotynamidoadeninowy
[wit. PP]
-
NADP
+
- fosforan dinukleotydu nikotynamidoadeninowego
[wit. PP]
-
FAD - dinukleotyd flawinoadeninowy
[wit.B
2
]
-
FMN - mononukleotyd flawinowy
[wit.B
2
]
-
CoQ - koenzym Q
-
Lipoamid - amid kwasu liponowego
-
Heminy - stanowią grupę prostetyczną enzymów np.
peroksydazy ale
też białek nieenzymatycznych np.
cytochromów)
2. Koenzymy przenoszące różne grupy chem., współpracujące z
klasą
transferaz
-
PLP
- fosforan pirydoksalu
[wit. B
6
]
-
nukleozydotrifosforany (ATP, UTP, CTP, GTP)
-
DPT - difosforan tiaminy
[wit. B
1
]
-
THF - kwas tetrahydrofoliowy
3. Koenzymy przenoszące różne grupy chem., współpracujące z
liazami, ligazami, izomerazami,
-
nukleozydotrifosforany
-
PLP
- fosforan pirydoksalu
[wit. B
6
]
-
DPT - difosforan tiaminy
[wit. B
1
]
-
CoA - koenzym A
[wit. B
5
]
-
CoB
12
- koenzym B
12
- kobalamina
[wit. B
12
]
-
Biotyna - witamina H
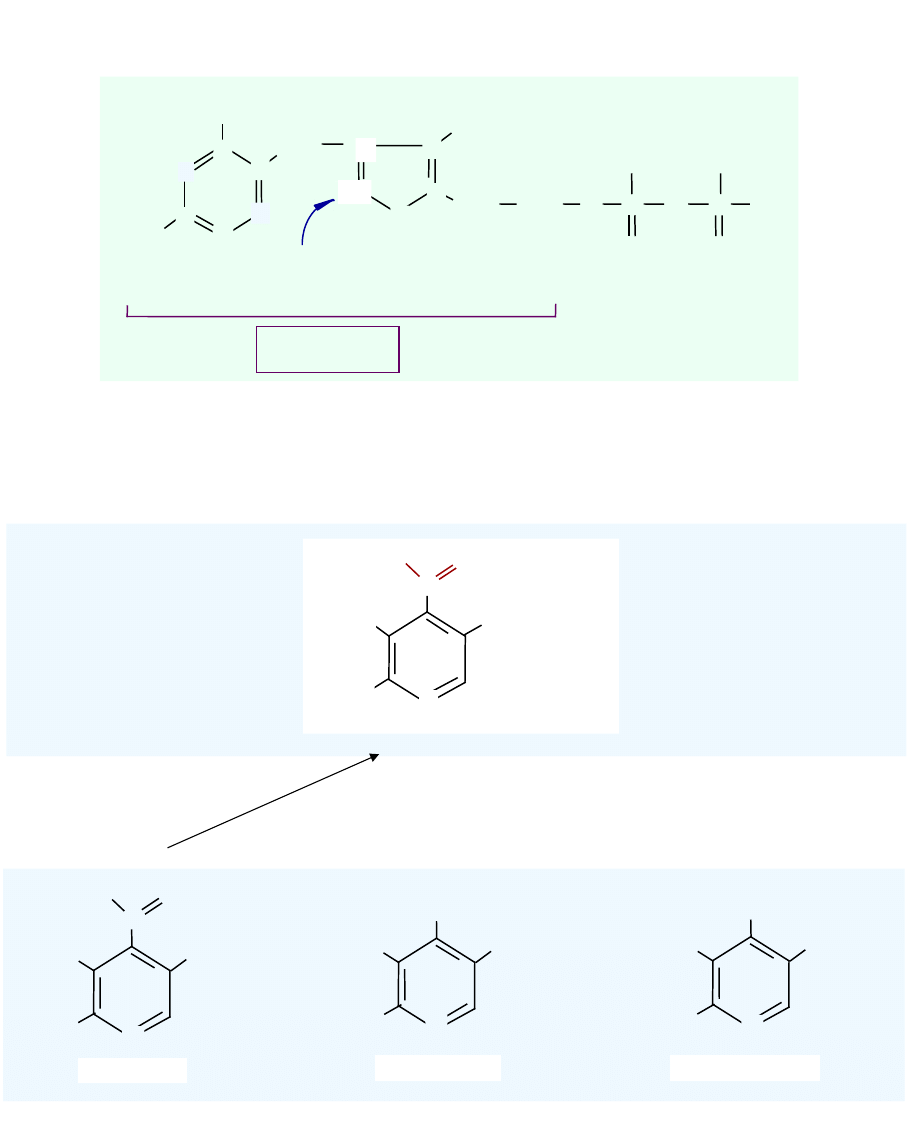
Difosforan tiaminy - DPT
NH
2
H
3
C
CH
2
S
CH
3
CH
2
CH
2
O
O
P
O
P
O
O-
O-
O-
CH
C
N
+
proton
dysocjujący
tiamina
(witamina B
1
)
N
N
C
C
C
H
C
2
Różne formy witaminy B6
C
CH
2
O-
PO
3
2-
HO
H
3
C
C
O
H
N
Fosforan pirydoksalu (PAL, PLP)
CH
2
OH
CH
2
OH
HO
H
3
C
N
pirydoksyna
CH
2
NH
2
CH
2
OH
HO
H
3
C
N
pirydoksamina
C
CH
2
OH
HO
H
3
C
C
O
H
N
pirydoksal
C
4
3
5
2
Kinaza pirydoksalowa + ATP
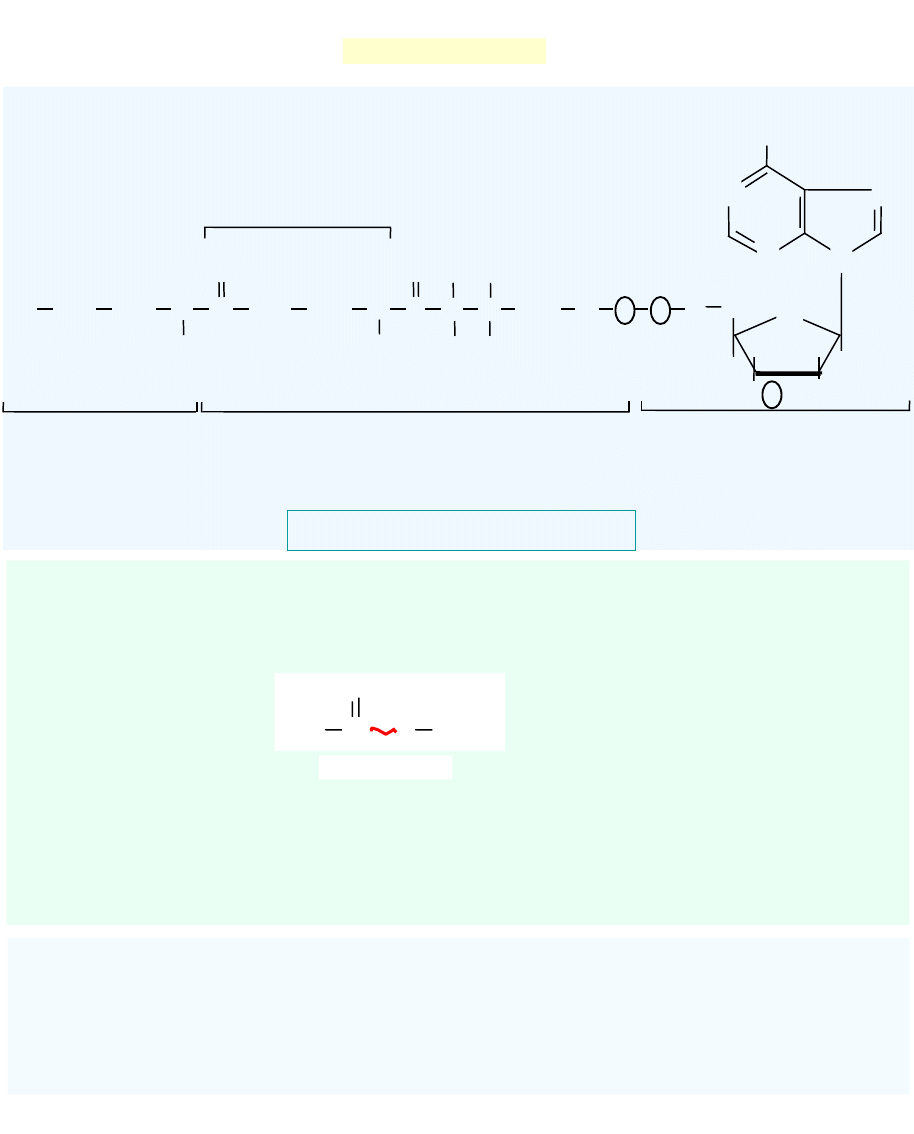
Koenzym A (CoA)
NH
2
N
N
O
CH
2
O
OH
N
N
C
O P
O
P
CH
2
C
CH
3
CH
3
HO
H
C
O
CH
2
CH
2
C
O
CH
2
CH
2
HS
N
H
N
H
cysteamina
fosforan kwasu
pantotenowego
3,5 - difosforan
adenozyny
-alanina
Podstawową funkcją
CoA
jest aktywowanie i przenoszenie reszt acylowych (np. 3,6, 8, 10-
węglowych).
Najczęściej przenoszoną grupą jest
grupa acetylowa
, powstaje
acetylo-CoA.
Acetylo-CoA
- związek bogaty w energię
- wykorzystywany na pokrywanie potrzeb energetycznych
organizmu, przez włączenie do cyklu Krebsa
- wykorzystywany do biosyntezy ważnych substancji jak
np.wyższe kwasy tłuszczowe, cholesterol.
acetylo-CoA
CoA
uczestniczy także w procesach tj.:
- aktywacja kwasów tłuszczowych (syntetaza acylo-CoA)
- degradacja kwasów tłuszcz
owych przez -oksydację
- dekarboksylacja oksydacyjna 2-oksokwasów
C
O
CH
3
CoA
S
P
Kwas pantotenowy – wit. B
5

Podział koenzymów
1.
Koenzymy przenoszące elektrony i protony, współdziałające z
oksydoreduktazami
-
NAD
+
- dinukleotyd nikotynamidoadeninowy
[wit. PP]
-
NADP
+
- fosforan dinukleotydu nikotynamidoadeninowego
[wit. PP]
-
FAD - dinukleotyd flawinoadeninowy
[wit.B
2
]
-
FMN - mononukleotyd flawinowy
[wit.B
2
]
-
CoQ - koenzym Q
-
Lipoamid - amid kwasu liponowego
-
Heminy - stanowią grupę prostetyczną enzymów np.
peroksydazy ale
też białek nieenzymatycznych np.
cytochromów)
2. Koenzymy przenoszące różne grupy chem., współpracujące z
klasą
transferaz
-
PLP
- fosforan pirydoksalu
[wit. B
6
]
-
nukleozydotrifosforany (ATP, UTP, CTP, GTP)
-
DPT - difosforan tiaminy
[wit. B
1
]
-
THF - kwas tetrahydrofoliowy
3. Koenzymy przenoszące różne grupy chem., współpracujące z
liazami, ligazami, izomerazami,
-
nukleozydotrifosforany
-
PLP
- fosforan pirydoksalu
[wit. B
6
]
-
DPT - difosforan tiaminy
[wit. B
1
]
-
CoA - koenzym A
[wit. B
5
]
-
CoB
12
- koenzym B
12
- kobalamina
[wit. B
12
]
-
Biotyna - witamina H
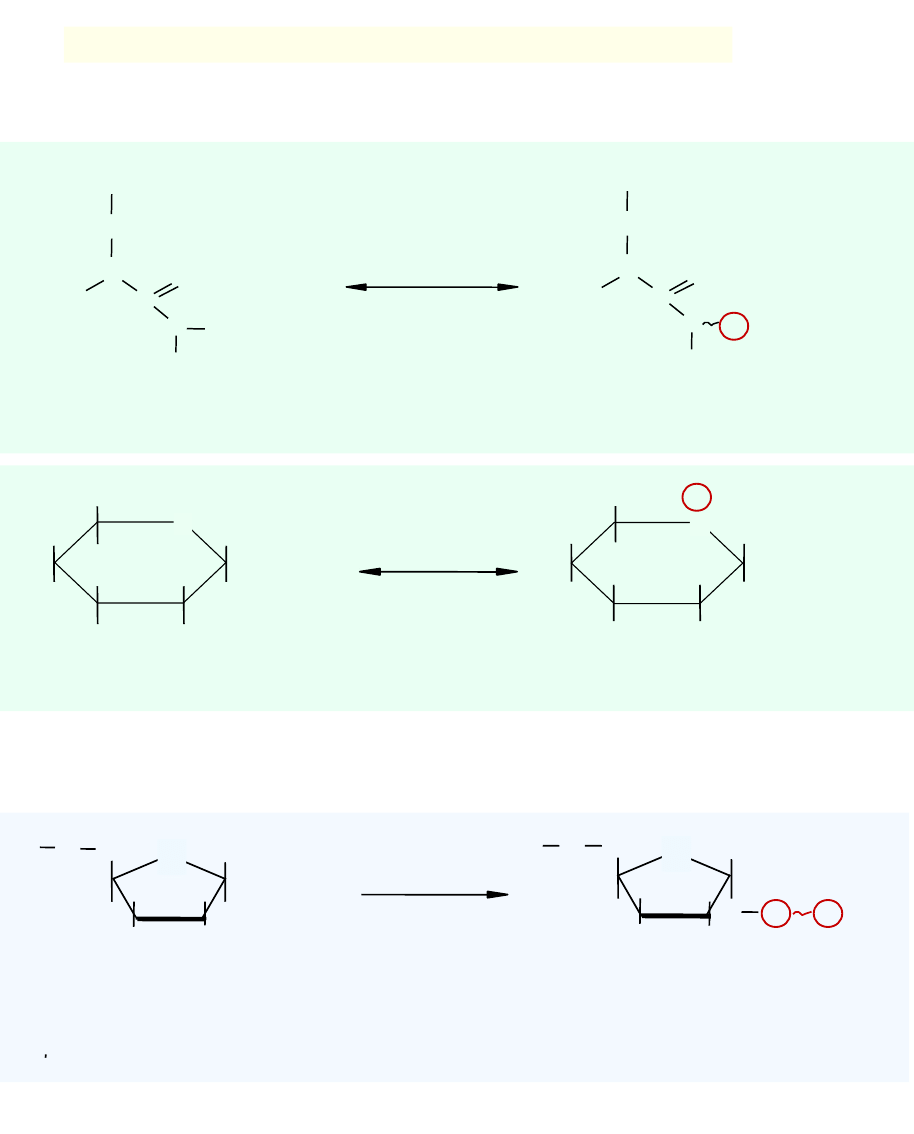
2. Przeniesienie reszty difosforanu z ATP na substrat
OH
CH
2
O
P
O
P
OH
OH
+ ATP
OH
CH
2
O
P
O
P
OH
O
P
P
+ AMP
pirofosfokinaza
Rybozofosforanowa
(syntetaza PRPP)
rybozo- 5-fosforan
5-fosforybozylo-1-
Pirofosforan (PRPP)
COOH
CH
2
N
C
H C
3
N
H
NH
H
COOH
CH
2
N
C
H C
3
N
H
NH
P
+ A TP
+ ADP
kinaza
kreatynowa
kreatyna
fosfokreatyna
Typy reakcji, w których ATP uczestniczy jako koenzym:
1. Przeniesienie pojedynczej reszty fosforanowej z ATP na substrat
+ ATP
OH
OH
OH
OH
H
H
H
H
H
CH
2
OH
OH
OH
OH
OH
H
H
H
H
H
CH
2
-O-
P
+ ADP
glukoza
glukozo-6-fosforan
heksokinaza
O
O
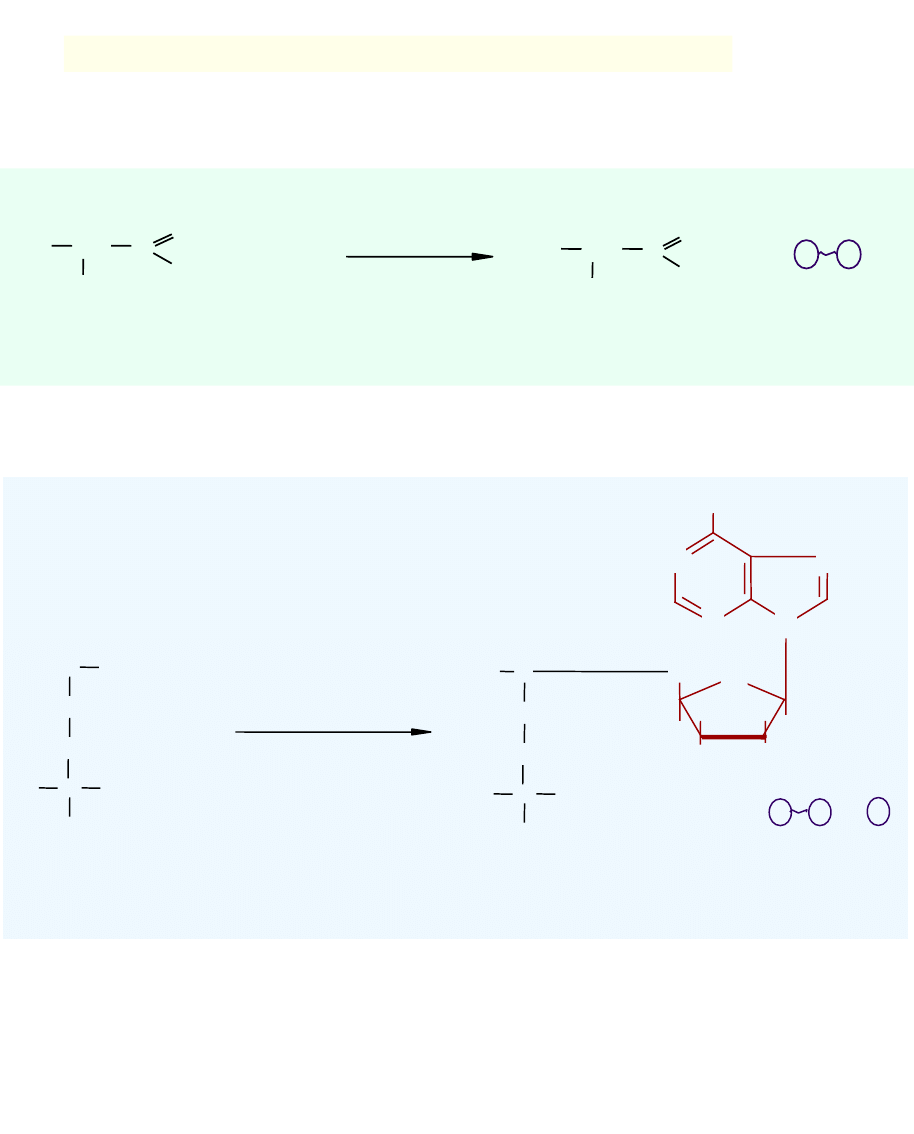
CH
2
NH
2
COOH
C
H
CH
2
S
CH
3
NH
2
OH
CH
2
N
O
N
N
N
OH
CH
2
NH
2
COOH
C
H
CH
2
S
H
3
C
+ ATP
adenozylotransferaza
metioninowa
P P
+
+ P
metionina
adenozylometionina
3. Przyłączenie monofosforanów nukleozydów do substratu
4. Przyłączenie reszty adenozyny do substratu
Typy reakcji, w których ATP uczestniczy jako koenzym:
R CH C
O
OH
NH
2
+ ATP
R CH C
O
AMP
NH
2
AMP
P P
+
syntetaza
aminoacylo-tRNA
aminokwas
aminoacylo-AMP
+
- chroni nienasycone tłuszcze w błonach przed
utlenieniem
- odpowiedzialna za prawidłowy rozwój narządów
- rozrodczych u zwierząt.
Wit. E
(- tokoferol)
- pochodna witaminy D reguluje metabolizm Ca
2+
i fosforu
- brak witaminy D osłabia kości rozwijających się zwierząt
Wit. D
- jest potrzebna do prawidłowego krzepnięcia krwi
Wit. K
- prekursor retinalu, biorącego udział w procesie
widzenia
- brak jej prowadzi do kurzej ślepoty
- młode zwierzęta potrzebują jej do wzrostu
Wit. A
(retinol)
funkcja
witamina
Witaminy rozpuszczalne w tłuszczach
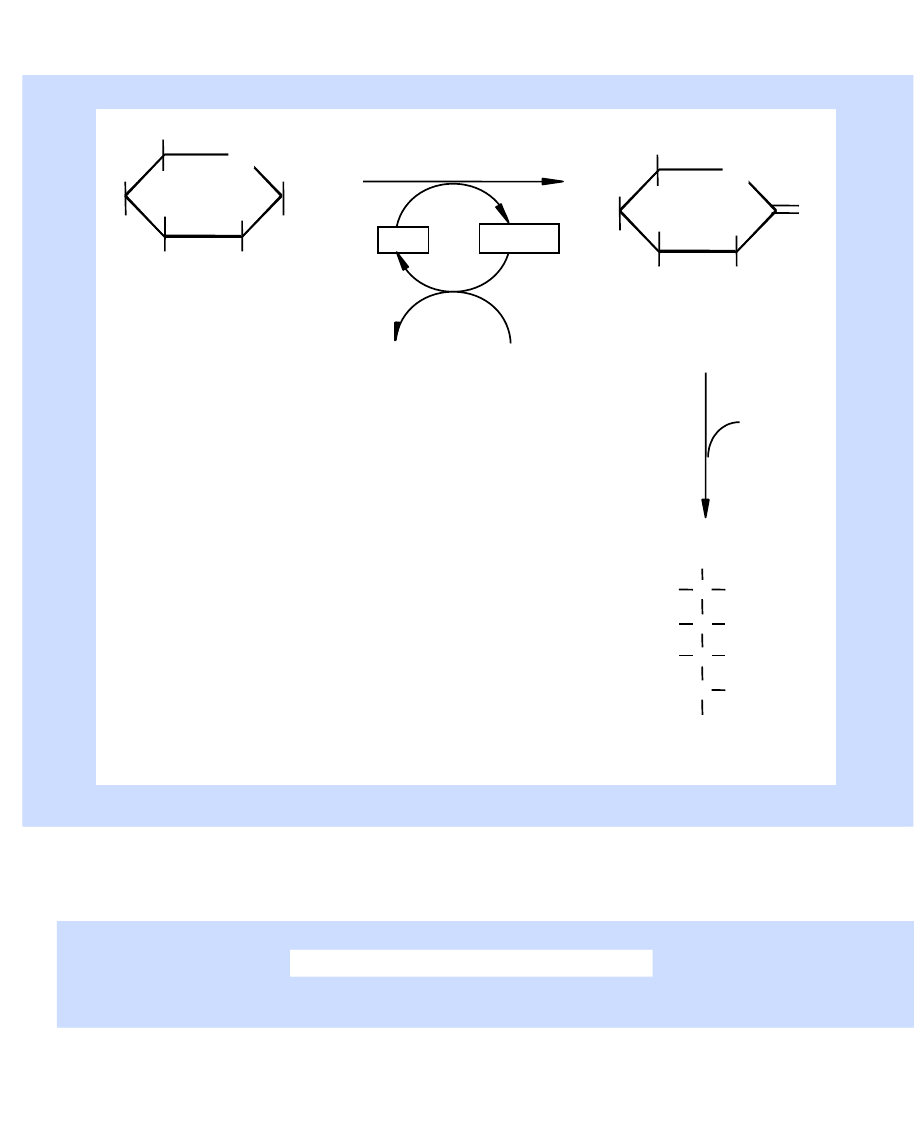
Reakcja katalizowana przez
oksydazę glukozy
O
OH
H
OH
H
HO
H
H
H
OH
CH
2
OH
O
OH
OH
H
HO
H
H
H
CH
2
OH
O
H
H
CO OH
C OH
C
C
C
OH
OH
OH
CH
2
OH
H
H
FAD
FADH
2
O
2
H
2
O
2
-D-glukoza
D-glukonolakton
kwas glukonowy
H
2
O
oksydaza glukozy
2 H
2
O
2 ->
2 H
2
O + O
2
Reakcja katalizowana przez
katalazę
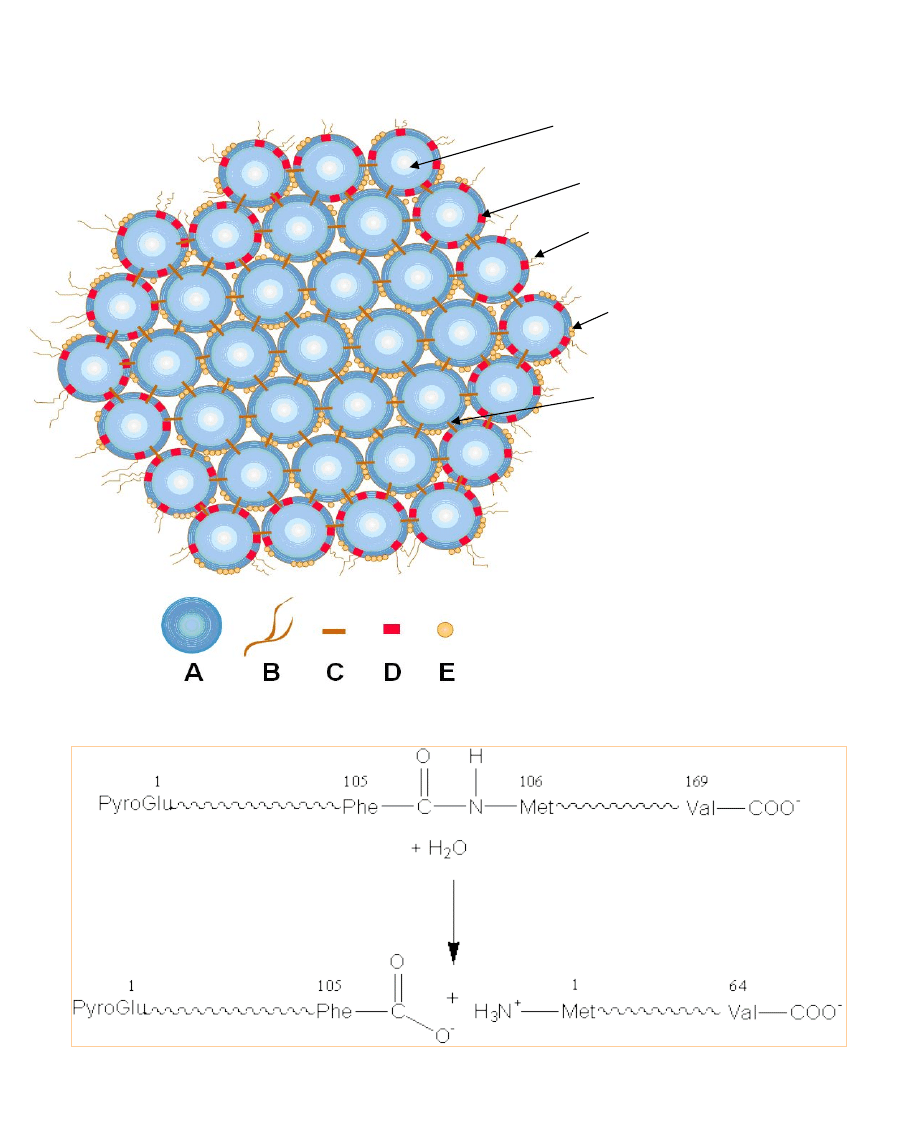
Micela kazeinowa
– kompleks fosofo-kazeino-wapniowy (kazeinian wapnia)
A-submicela
hydrofobowy rdzeń ( i -kazeina)
pow. wzbogacona k-kazeiną (D)
hydrofilowy ogon k-kazeiny (B)
Ca
2
+
wiązane przez PO
4
3+
(E)
wiązania Ca
9
(PO
4
)
6
(C)
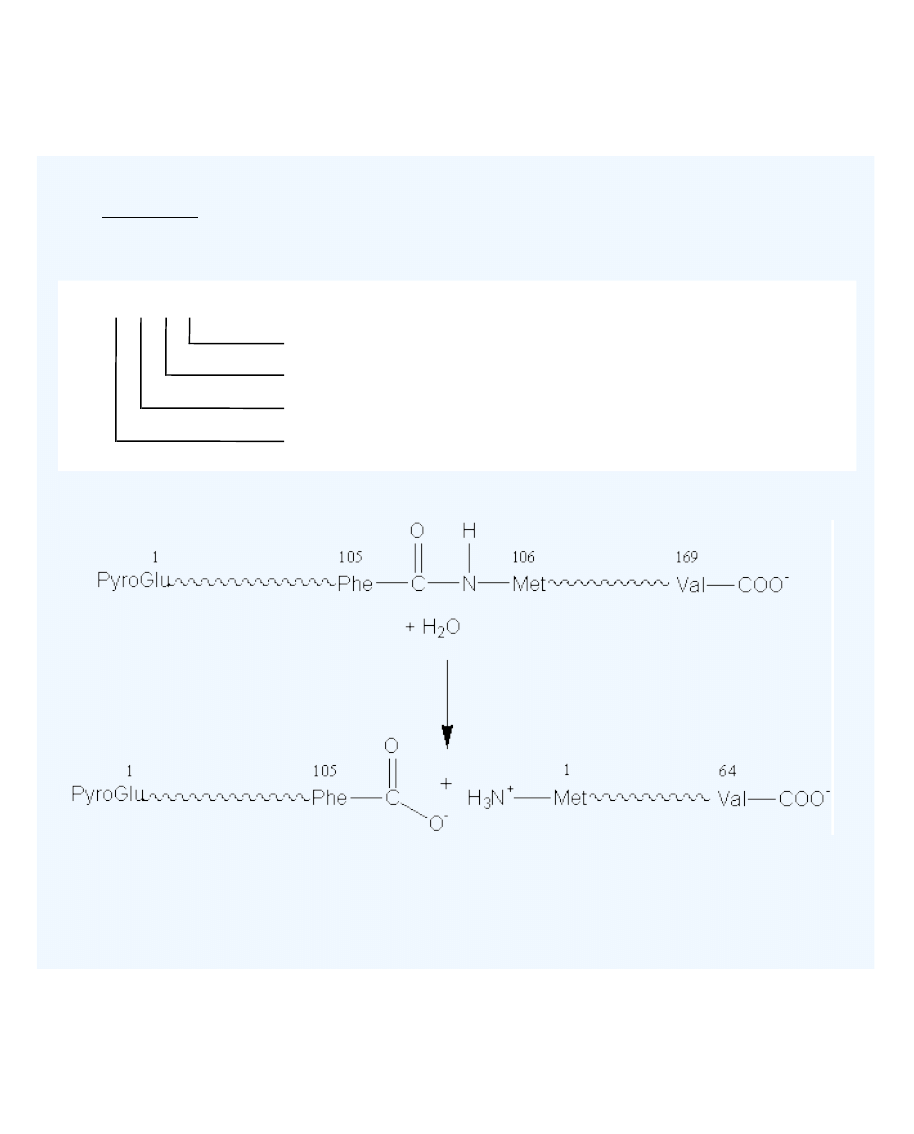
Rys. Hydroliza wiązania peptydowego kappa-kazeiny przez chymozynę

Kazeiny, to grupa fosfoprotein, stanowiąca najliczniejszą grupę białek mleka
(80%). Do głównych frakcji kazeiny należą: alpha-s1, alpha-s2, beta and kappa
kazeina. W mleku kazeina występuje głównie w postaci sferycznych skupisk,
zwanych micellami. Micele utworzone są z podjednostek, submicelli, złożonych z
25-30 cząsteczek kazeiny α, β, κ. Alfa i beta kazeiny to hydrofobowe, wysoko
ufosforylowane białka, które łatwo strącają się w obecności jonów wapnia i
które stanowią rdzeń micelli. Kappa-kazeina posiada tylko jedną ufosforylowaną
resztę seryny i dlatego nie strąca się w obecności jonów wapnia. Zlokalizowana
na powierzchni micelli kappa-kazeina stabilizuje je, a jej mocno glikolizowany
C-końciec łańcucha polipetydowego, wystający ponad powierzchnię micelli,
zapewnia micellom odpowiednie uwodnienie i zapobiega agregacji. Usunięcie
hydrofilowego C-końca kappa-kazeiny przez podpuszczkę, sprawia że w obecności
jonów wapnia micelle agregują i tworzy się skrzep para-kazeiny. Koagulacja
kazeiny przez podpuszczkę następuje w dwóch fazach.
Pierwsza faza ma charakter enzymatyczny. W wyniku hydrolizy wiązania
peptydowego pomiędzy Phe105 oraz Met106 łańcucha polipetydowego kappa-kazeiny,
ma miejsce odszczepienie z cząsteczek kappa-kazeiny C-końcowego fragmentu
łańcucha polipeptydowego, tzw. glikomakropeptydu i powstanie para-kappa-
kazeiny. Glikomakropeptyd zawiera 64 reszty aminokwasowe, jest łatwo
rozpuszczalny w wodzie i przechodzi do roztworu. Glikomakropetyd jest także
rozpuszczalny w kwasie trójchloroctowym, co zostanie wykorzystane w metodzie
Ansona na dzisiejszym ćwiczeniu.
Druga faza prowadzi do utworzenia skrzepu (żelu) głównie w wyniku w wyniku
interakcji między micellami. Interakcja ta spotęgowana jest odłączeniem
glikomakropeptydu (micele tracą powłokę hydratacyjną).
Powyższy mechanizm koagulacji jest szeroko wykorzystywany w technologii
otrzymywania serów podpuszczkowych
2. Białka mleka
Białko mleka krowiego stanowi od 3 do 4% jego suchej masy. Najważniejszymi
białkami mleka są:kazeina- białka mleka i białka serwatki: laktoglobuliny,
laktoalbuminy, immunoglobuliny
Kazeina stanowi ok. 75-85% białek mleka. Zaliczana jest do fosfoprotein.
Kazeina nie jest białkiem jednorodnym, w świeżym mleku wyodrębniono trzech
zasadnicze frakcje: alfa, beta i kappa kazeinę różniących się składem
chemicznym i właściwościami fizykochemicznymi. Te trzy frakcje w obecności
jonów Ca2+ mogą łączyć się ze sobą tworząc skupienia cząsteczek (agregaty)
tzw. micele koloidowe. W mieli kazeiny przeważają wolne grupy kwasowe zdolne
do jonizacji (pochodzące gł. z aminokwasów dikarboksylowych i reszt kwasu
ortofosforowego). Micela zachowuje się więc jak kwas, tworząc sól z jonami
wapnia, czyli kazeinian wapnia. W świeżym mleku ok. 95% kazein występuje
właśnie w postaci koloidalnie rozproszonych, kulistych miceli o kształcie
maliny i średnicy 20-300nm. Micele złożone są z 25-30 cząsteczek , i
kazein, których domeny hydrofobowe są zwrócone do wnętrza, a hydrofilowe w
kierunku rozpuszczalnika. Micela więc to kompleks fosfo-kazeino-wapniowy.
Micele zawierają przeciętnie 93% białka, 2.8 % wapnia, 2.9% fosforu
nieorganicznego, 2.3% fosforu organicznego. Jeśli trzy frakcje kazeiny
występują w postaci miceli, czyli kompleksu fosfo-kazeino-wapniowego, tworzą
one zawiesinę równomiernie rozprowadzoną w całej objętości mleka. Natomiast
wprowadzając kwas do mleka spowodujemy rozerwanie wiązań, w których
uczestniczy Ca2+, uwolnienie się jonu Ca 2+ z mieli, asocjację cząsteczek i
strącenie kazeiny w pI (ok. pH= 4.6) w postaci twarogu.
Podobnie dzieje się przy samoukwaszaniu mleka. Powstający wówczas wówczas z
laktozy kwas mlekowy (fermentacja mlekowa) zakwasza środowisko, powodując
wytrącenie się kazeiny. Kwas mlekowy zabiera wapń z kompleksu fosfo-kazeino-
wapniowego, ma miejsce konkurencja o Ca2+.
Kazeina-Ca + 2CH3CHOHCOOH = kazeina (wytrącona) + (CH3CHOHCOOH)2Ca (mleczan
wapnia)
Wytrącanie kazeiny z mleka mogą również przeprowadzać enzymy proteolityczne:
chymozyna (podpuszczka) i trypsyna.
Kazeiny obok ważnej roli jako pełnią w przemyśle serowarskim, są także bogatym
źródłem aminokwasów egzogennych, oraz fosforu – niezbędnego dla prawidłowej
przemiany materii oraz jonów wapnia potrzebnych do budowy kośca i prawidłowej
pracy mięśni.
Kazeina odgrywa także istotna rolę z punktu widzenia przemysłowego.
Nadprodukcja kazeiny jest często wykorzystywana do produkcji tzw. kazeiny
przemysłowej, gdzie w odpowiednich warunkach uzyskuje się bardzo elastyczna
(jak gumę) odwodniona kazeinę, która może zostać wykorzystana do produkcji
opon samochodowych.

2. Białka mleka
Białko mleka krowiego stanowi od 3 do 4% jego suchej masy. Najważniejszymi
białkami mleka są:
kazeina- białka mleka (
białka serwatki: laktoglobuliny, laktoalbuminy, immunoglobuliny
Kazeina stanowi ok. 75-85% białek mleka. Zaliczana jest do fosfoprotein.
Kazeina nie jest białkiem jednorodnym, w świeżym mleku wyodrębniono trzech
zasadnicze frakcje: alfa, beta i kappa kazeinę różniących się składem
chemicznym i właściwościami fizykochemicznymi. Te trzy frakcje w obecności
jonów Ca2+ mogą łączyć się ze sobą tworząc skupienia cząsteczek (agregaty)
tzw. micele koloidowe. W mieli kazeiny przeważają wolne grupy kwasowe zdolne
do jonizacji (pochodzące gł. z aminokwasów dikarboksylowych i reszt kwasu
ortofosforowego). Micela zachowuje się więc jak kwas, tworząc sól z jonami
wapnia, czyli kazeinian wapnia. W świeżym mleku ok. 95% kazein występuje
właśnie w postaci koloidalnie rozproszonych, kulistych miceli o kształcie
maliny i średnicy 20-300nm. Micele złożone są z 25-30 cząsteczek , i
kazein, których domeny hydrofobowe są zwrócone do wnętrza, a hydrofilowe w
kierunku rozpuszczalnika. Micela więc to kompleks fosfo-kazeino-wapniowy.
Micele zawierają przeciętnie 93% białka, 2.8 % wapnia, 2.9% fosforu
nieorganicznego, 2.3% fosforu organicznego. Jeśli trzy frakcje kazeiny
występują w postaci miceli, czyli kompleksu fosfo-kazeino-wapniowego, tworzą
one zawiesinę równomiernie rozprowadzoną w całej objętości mleka. Natomiast
wprowadzając kwas do mleka spowodujemy rozerwanie wiązań, w których
uczestniczy Ca2+, uwolnienie się jonu Ca 2+ z mieli, asocjację cząsteczek i
strącenie kazeiny w pI (ok. pH= 4.6) w postaci twarogu.
Podobnie dzieje się przy samoukwaszaniu mleka. Powstający wówczas wówczas z
laktozy kwas mlekowy (fermentacja mlekowa) zakwasza środowisko, powodując
wytrącenie się kazeiny. Kwas mlekowy zabiera wapń z kompleksu fosfo-kazeino-
wapniowego, ma miejsce konkurencja o Ca2+.
Kazeina-Ca + 2CH3CHOHCOOH = kazeina (wytrącona) + (CH3CHOHCOOH)2Ca (mleczan
wapnia)
Wytrącanie kazeiny z mleka mogą również przeprowadzać enzymy proteolityczne:
chymozyna (podpuszczka) i trypsyna.
Kazeiny obok ważnej roli jako pełnią w przemyśle serowarskim, są także bogatym
źródłem aminokwasów egzogennych, oraz fosforu – niezbędnego dla prawidłowej
przemiany materii oraz jonów wapnia potrzebnych do budowy kośca i prawidłowej
pracy mięśni.
Kazeina odgrywa także istotna rolę z punktu widzenia przemysłowego.
Nadprodukcja kazeiny jest często wykorzystywana do produkcji tzw. kazeiny
przemysłowej, gdzie w odpowiednich warunkach uzyskuje się bardzo elastyczna
(jak gumę) odwodniona kazeinę, która może zostać wykorzystana do produkcji
opon samochodowych.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
Wyszukiwarka
Podobne podstrony:
Koenzymy, Kosmetologia, Notatki i wyłady, Biochemia
KOENZYMY, Zootechnika, Biochemia
Koenzymy oksydoreduktazy
Koenzymy flawinowe
Koenzym Q10 - substancja życia, Koenzym Q10-substancja życia
Koenzym Q10, Studium kosmetyczne, Chemia kosmetyczna
etanol - otwarte, Napisz wzorami strukturalnymi (zaznacz ewentualny udział koenzymów):
etanol - otwarte, Napisz wzorami strukturalnymi (zaznacz ewentualny udział koenzymów):
koenzymy 1
pros 6 Proenzymy Koenzymy
Witaminy jako koenzymy Kopia
koenzymy
koenzymy
Farmakologia kliniczna koenzymu Q10 J Drzewoski
KOENZYMY zagadnienia na kolokwium, Ogrodnictwo UP Lbn, Biochemia
regulacje - otwarte, Napisz wzorami strukturalnymi (zaznacz ewentualny udział koenzymów):
enzymy koenzymy 2
Koenzym Vita Care Q10 Dental w tabletkach do ssania, Koenzym Q10-substancja życia
więcej podobnych podstron