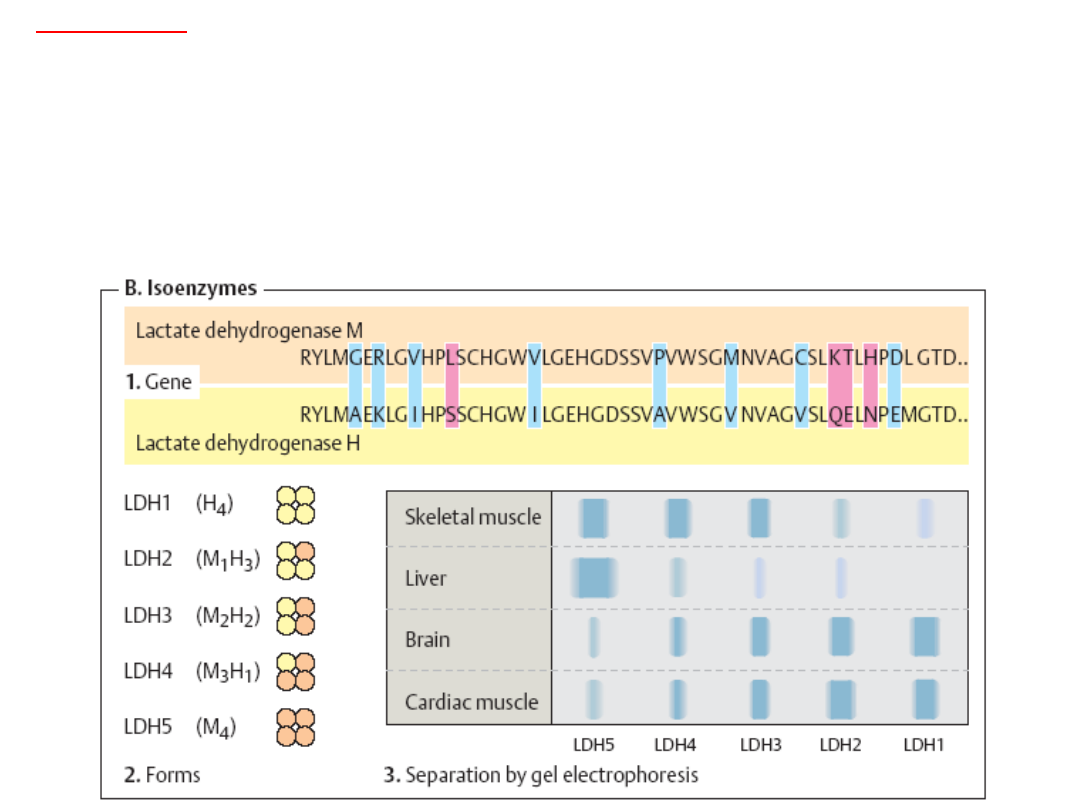
Izoenzymy
- homologiczne enzymy w obrębie danego organizmu, które katalizują tę
samą reakcję, ale różnią się nieznacznie strukturą, wartościami K
m
i V
max
oraz
właściwościami regulacyjnymi. Izoenzymy często ulegają ekspresji w różnych
tkankach lub organellach lub w różnych stadiach rozwojowych. Są kodowane przez
geny zajmujące różne loci, które zwykle powstają w wyniku duplikacji genu i
dywergencji. Izoenzymy można często odróżnić od siebe na podstawie właściwości
biochemicznych, takich jak ruchliwość elektroforetyczna.
Przykładem izoenzymu może być dehydrogenaza mleczanowa (LDH), enzym
uczestniczący w beztlenowym metabolizmie glukozy i syntezie glukozy.
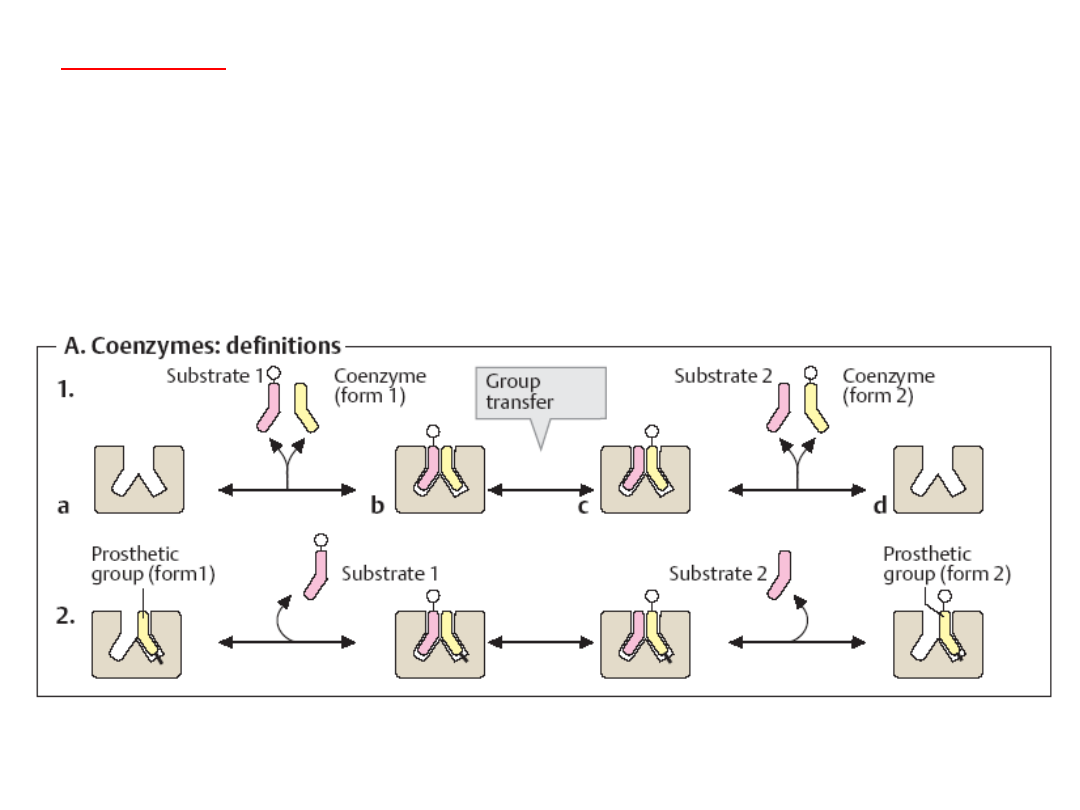
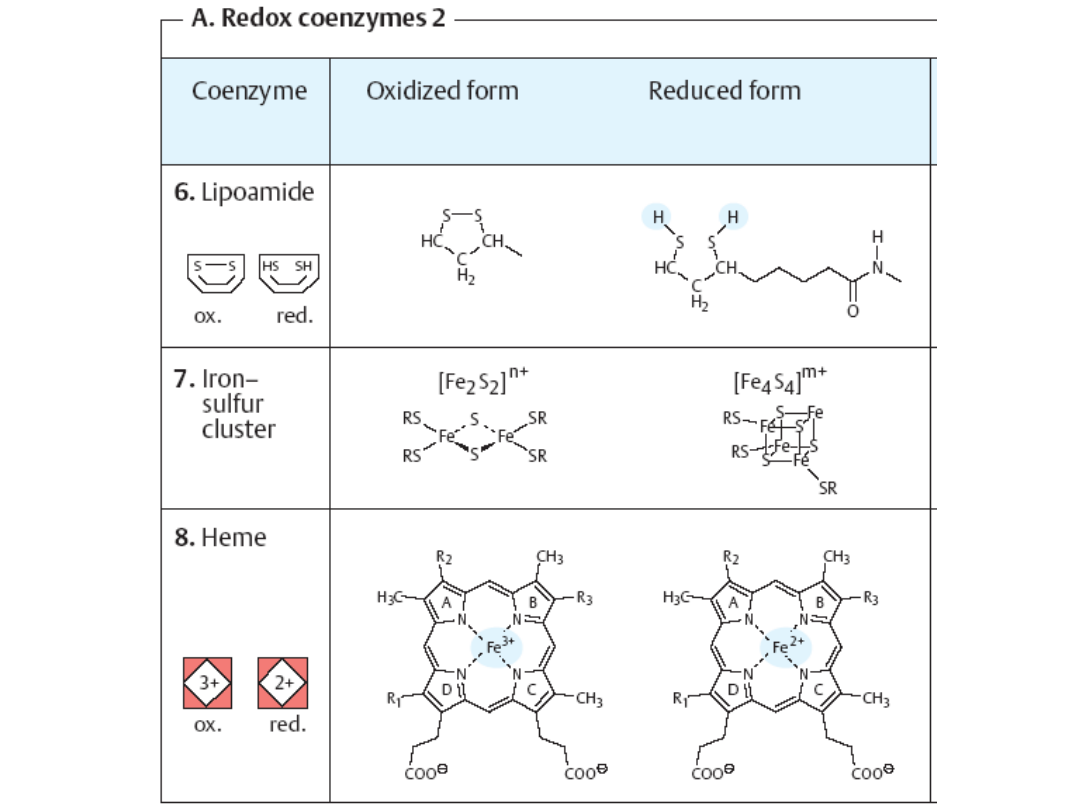
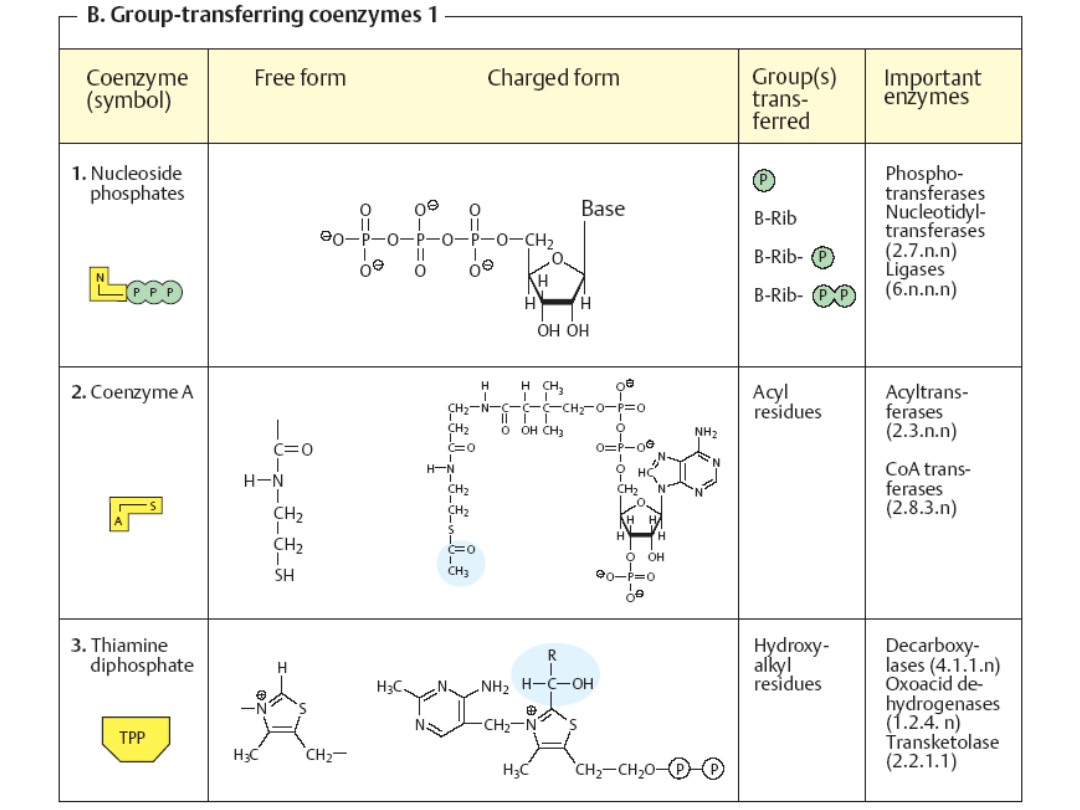
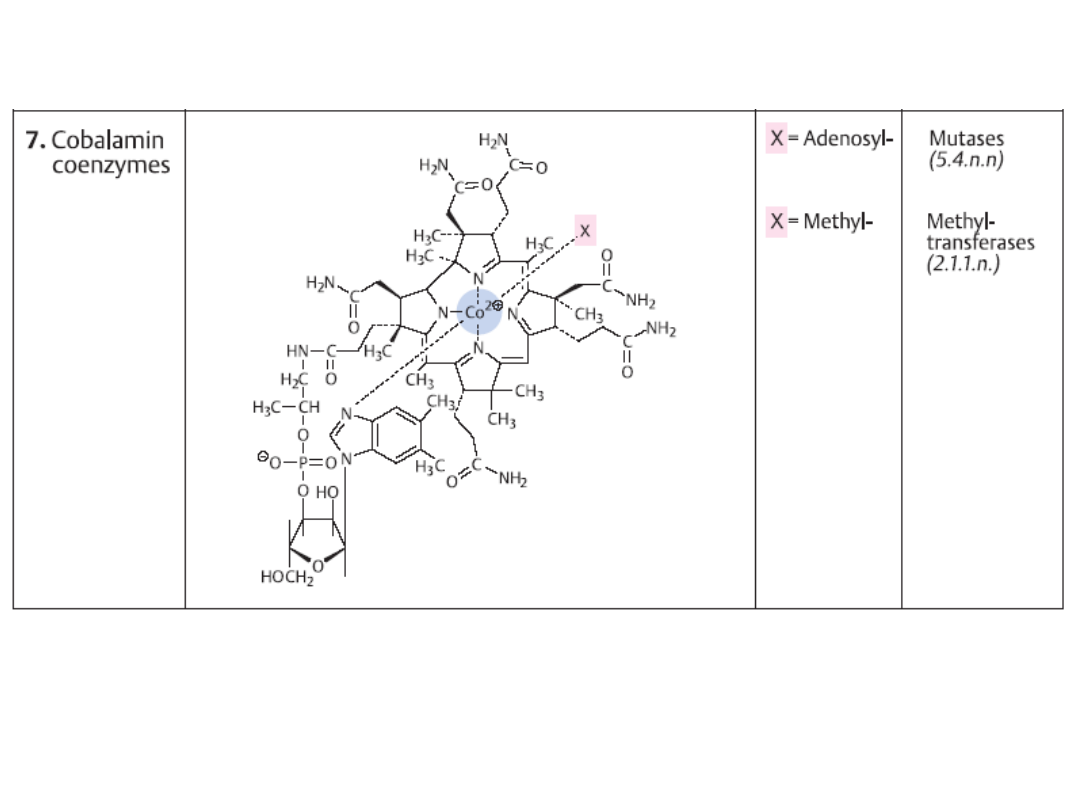
Koenzymy
- małocząsteczkowe, niebiałkowe związki organiczne
decydujące o aktywności katalitycznej pewnych enzymów. Biorą udział w
reakcjach przez oddawanie lub przyłączanie pewnych reagentów
(atomów, grup atomów lub elektronów). Pozostają luźno związane z
właściwym enzymem.
Jako
koenzymy
funkcjonują w większości witaminy lub jony połączone
odwracalnie z
apoenzymem
.

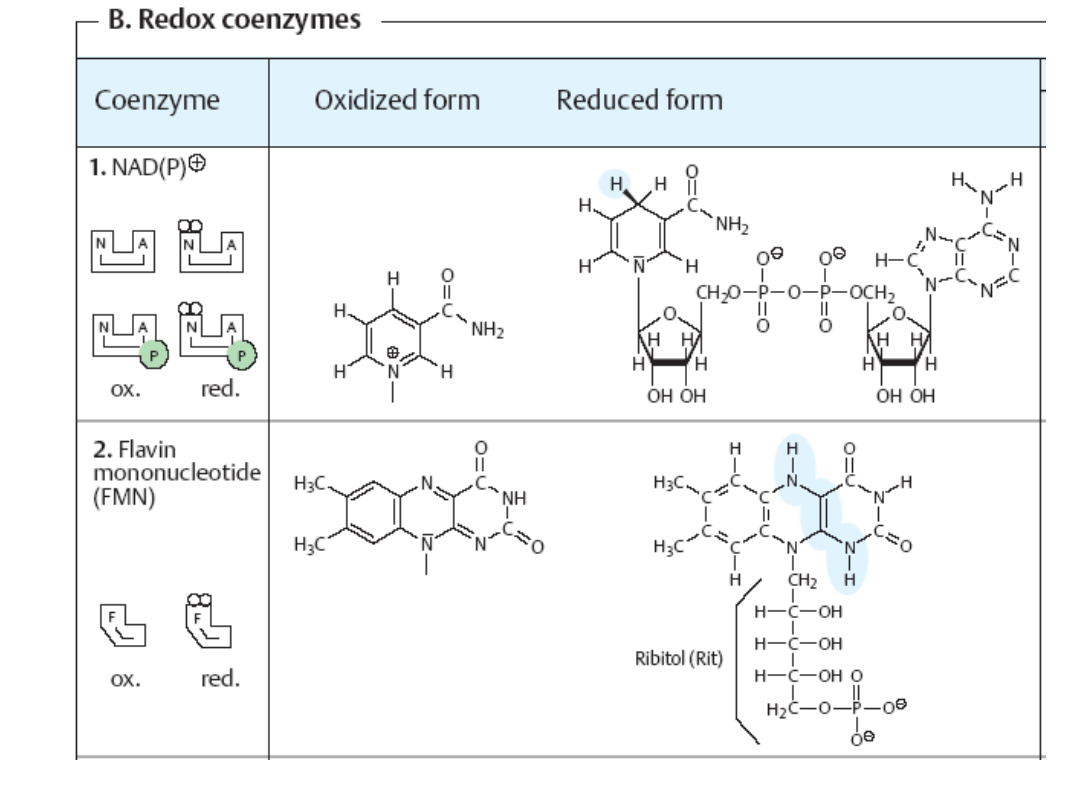
Cząsteczka
NAD
jest dinukleotydem składającym się z
adenozyno-5'-monofosforanu
i
nukleotydu nikotynoamidowego
połączonych ze sobą wiązaniem bezwodnikowym.
Cząsteczka NAD
+
wiąże jeden proton i dwa elektrony. Miejscem ich działania jest amid
kwasu nikotynowego. Drugi proton pozostaje w środowisku reakcji.
Zredukowany NAD
+
(NADH) przekazuje proton i elektrony na mitochondrialny
łańcuch oddechowy, gdzie poprzez wiele ogniw pośrednich są one przekazywane na
tlen, tworząc H
2
O. Procesowi temu towarzyszy powstawanie energii magazynowanej w
postaci ATP.
Cząsteczka
NADP
+
różni się do NAD
+
obecnością
reszty fosforanowej
przy węglu 2'
rybozy nukleotydu adeninowego.
NADP
+
jest także akceptorem protonu i elektronów w reakcjach utleniania, lecz
powstający NADPH nie przekazuje protonu i elektronów na łańcuch oddechowy.
Są one zużytkowywane w różnych reakcjach redukcji, głównie w przebiegu biosyntezy
kwasów tłuszczowych i cholesterolu.
W organizmach samożywnych NADP powstaje w początkowym etapie fotosyntezy i jest
zużywany później w cyklu Calvina.

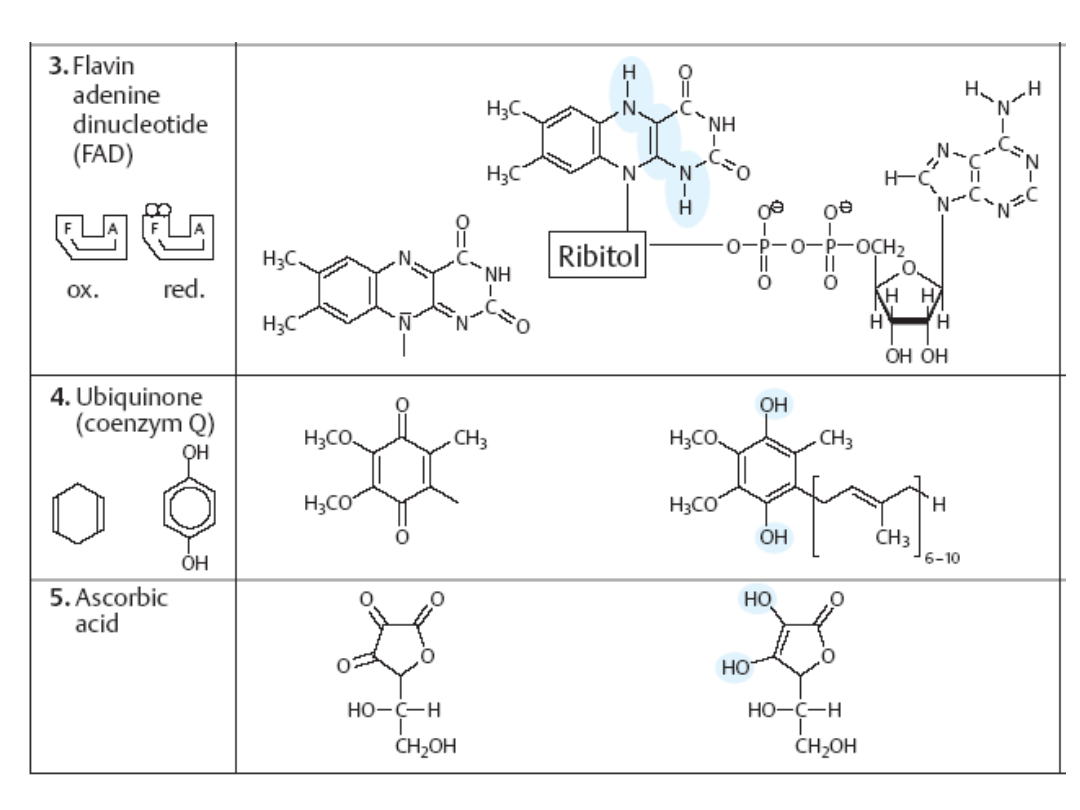
Dinukleotyd flawinoadeninowy, FAD
- organiczny związek chemiczny, złożony z
mononukleotydu flawinowego (FMN) (pochodnej ryboflawiny) i kwasu
adenozynomonofosforowego
(AMP), koenzym oksydoreduktaz, pełniący funkcję
przenośnika elektronów i protonów. Przenosi dwa protony i dwa elektrony, w
efekcie czego utleniona forma FAD przechodzi odwracalnie w formę zredukowaną
FADH
2
.
Mononukleotyd flawinowy, FMN,
koenzym uczestniczący w reakcjach redoks
jako przenośnik elektronów, współdziałający z oksydazami i dehydrogenazami,
zawierający ryboflawinę (witaminę B2); występuje w formie
utlenionej (FMN)
i
zredukowanej (FMNH
2
).
FMN
, (ryboflawino-5'-fosforan) - w organizmie wytwarzany z ryboflawiny (witamina
B
2
), stanowi grupę prostetyczną niektórych oksydaz, np. oksydazy L-
aminokwasowej, zwykle mocno (ale nie kowalencyjnie) związana z apoenzymem.
Uczestniczy w wielu reakcjach red-oks organizmów żywych, np. w reakcji:
FMN + ATP → FAD + PP
i
Flawoproteiny, enzymy flawinowe, enzymy z klasy oksydoreduktaz
; zawierają
jako grupę prostetyczną mononukleotyd flawinowy (FMN) lub dinukleotyd
flawinoadeninowy (FAD); biorą udział w procesach oddychania komórkowego.
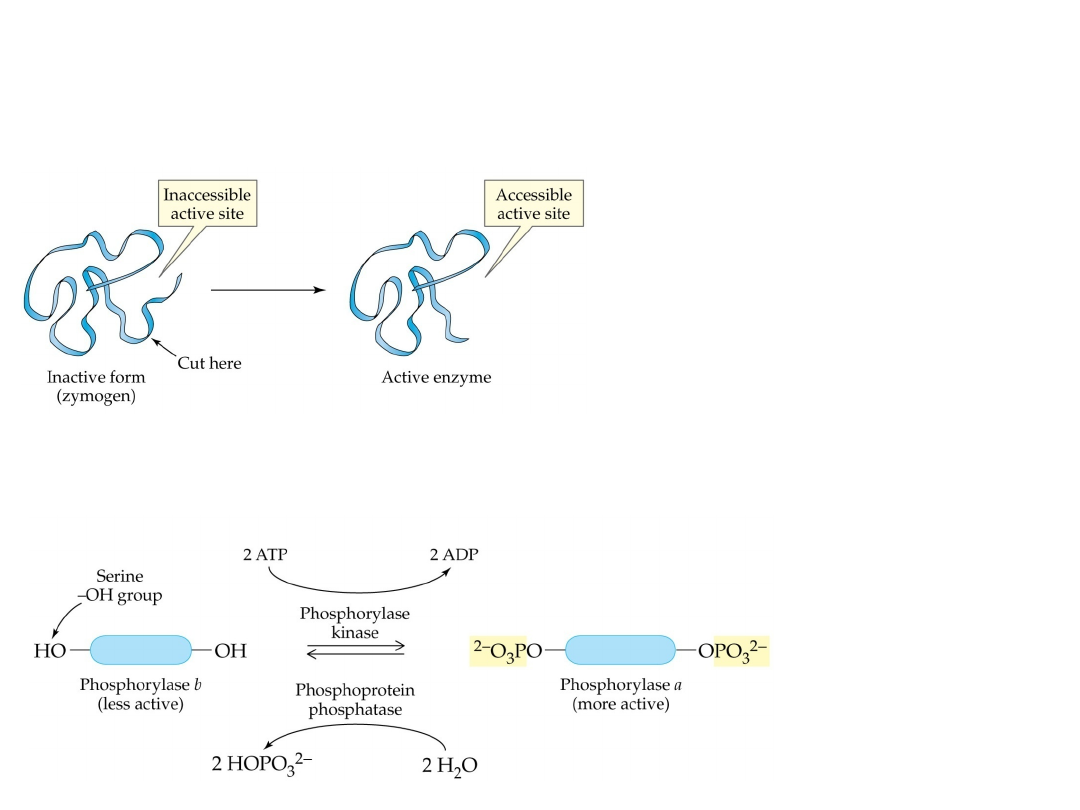
Aktywacja enzymów
Aktywacja zymogenu przez
hydrolizę specyficznych wiązań
peptydowych.
Aktywacja przez fosforylację reszty
seryny (odwracalne modyfikacje
kowalencyjne).
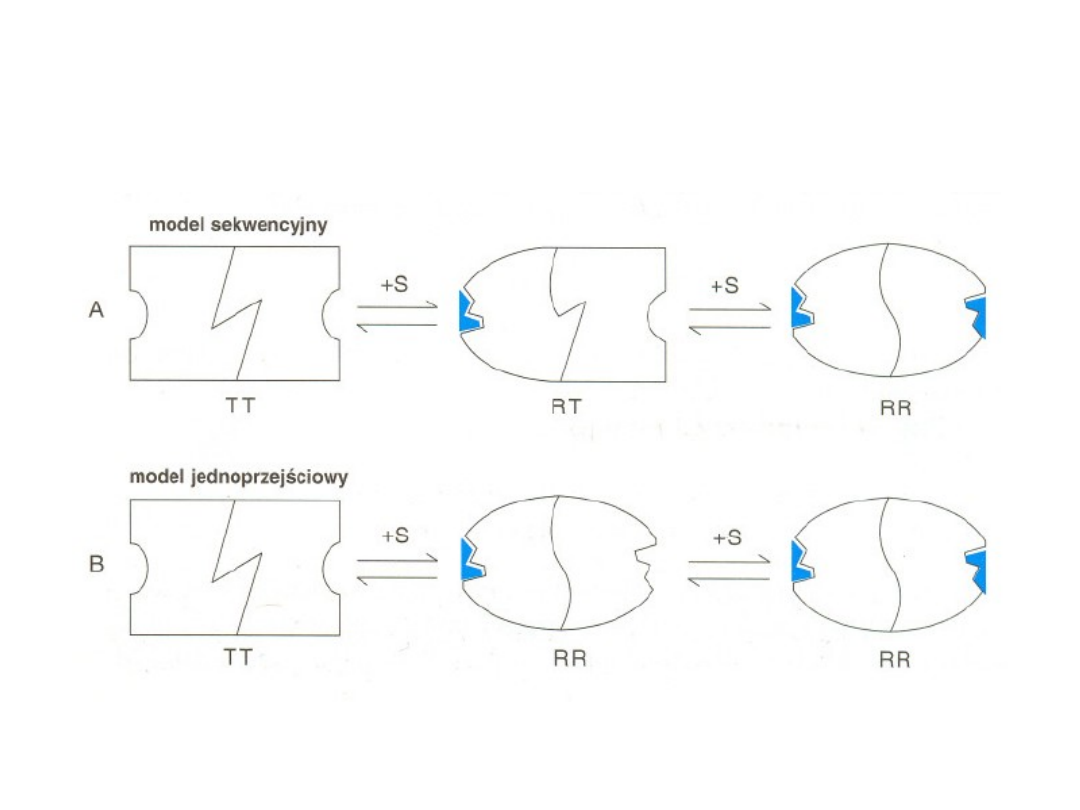
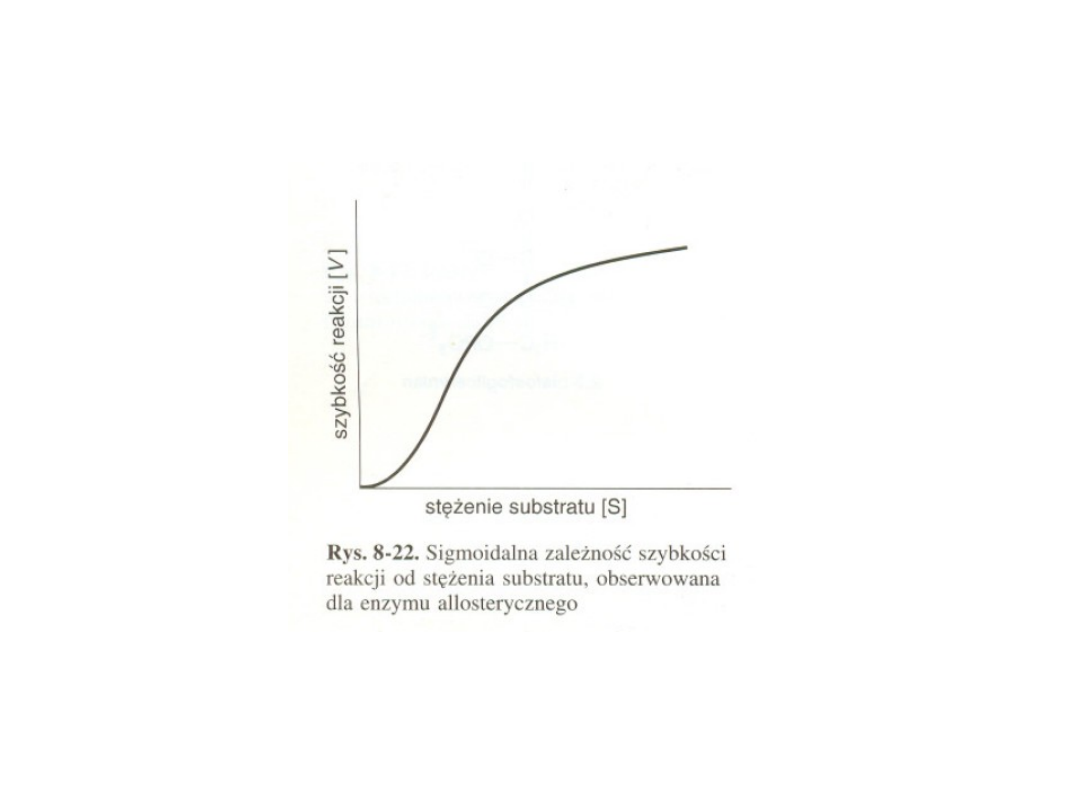
Enzymów allosterycznych nie
obowiązuje kinetyka
Michaelisa-Menten
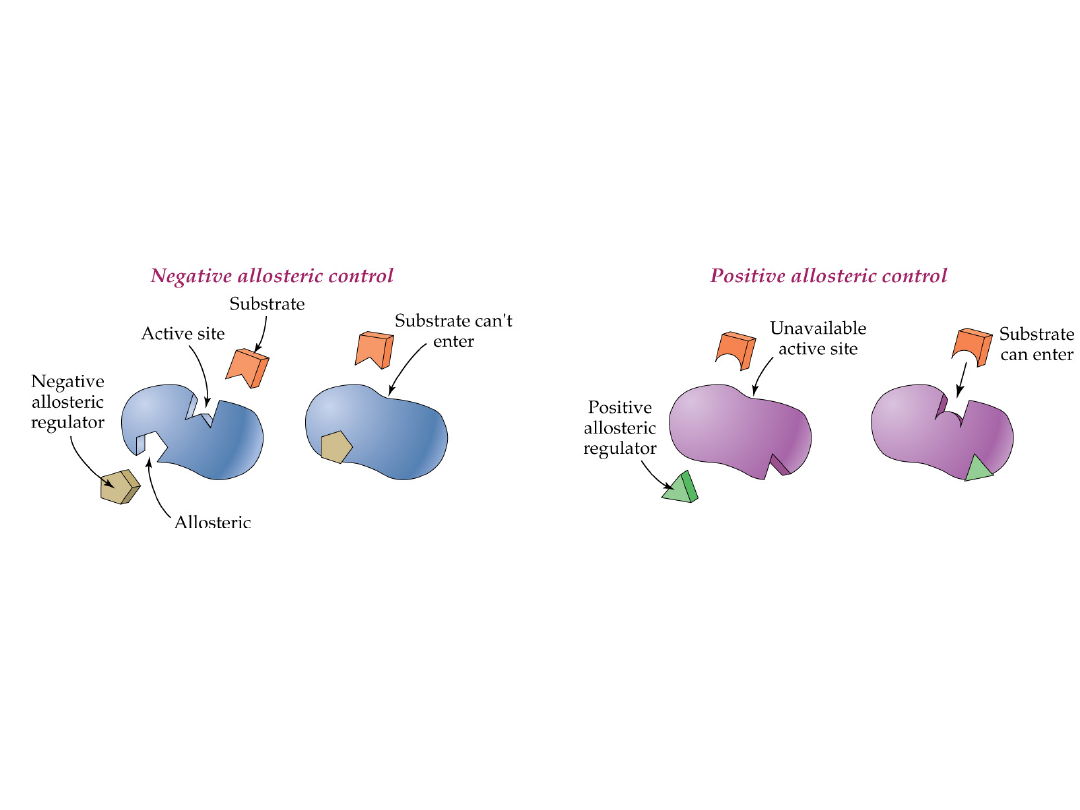
Allosteryczna kontrola enzymów
Allosteryczna kontrola enzymów
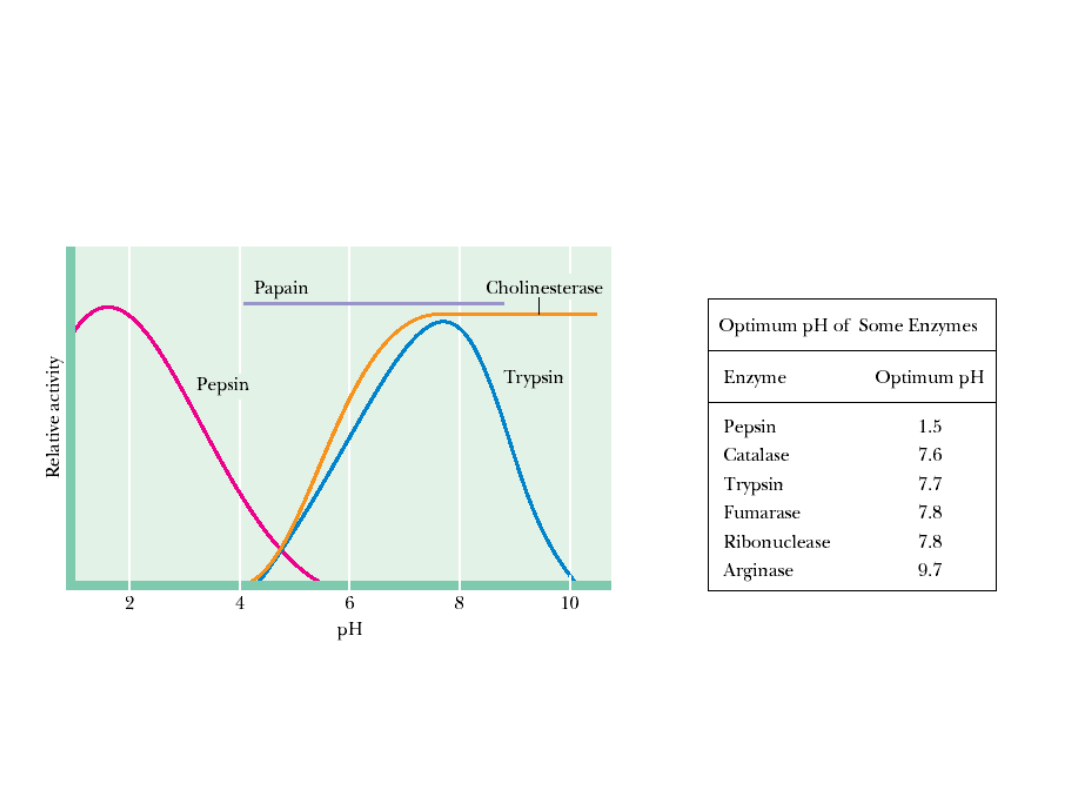
Wpływ środowiska na wydajność reakcji
enzymatycznych
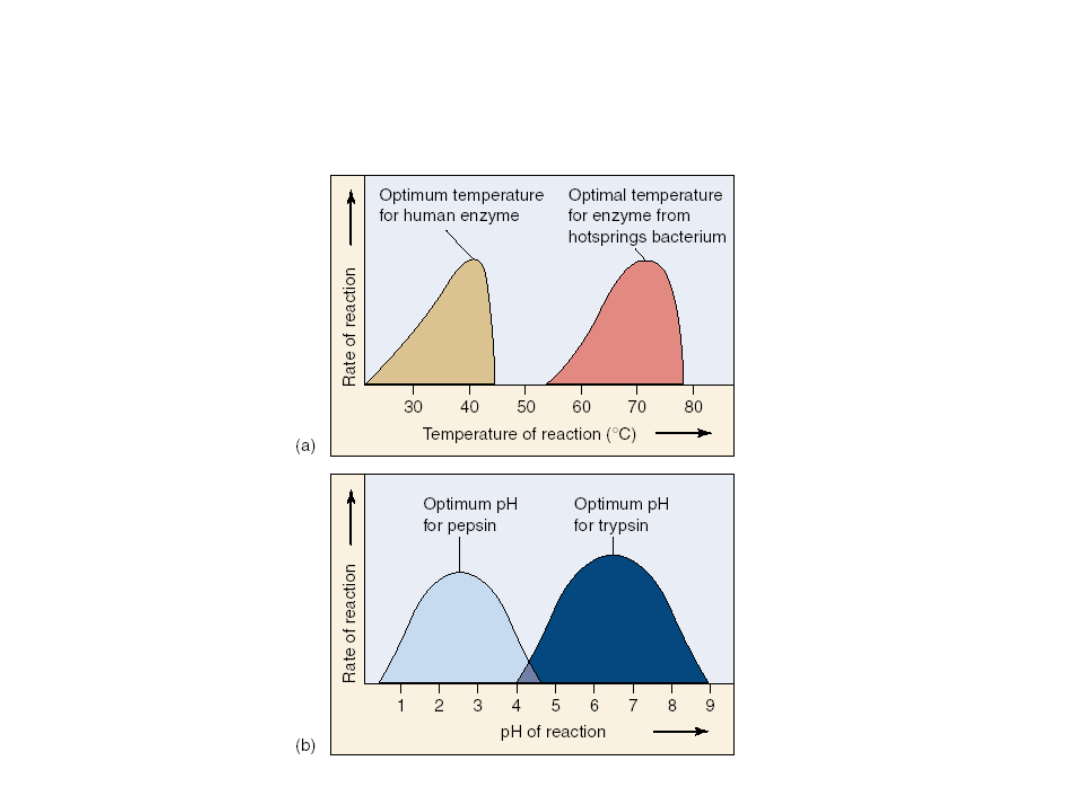
Wpływ środowiska na wydajność reakcji
enzymatycznych
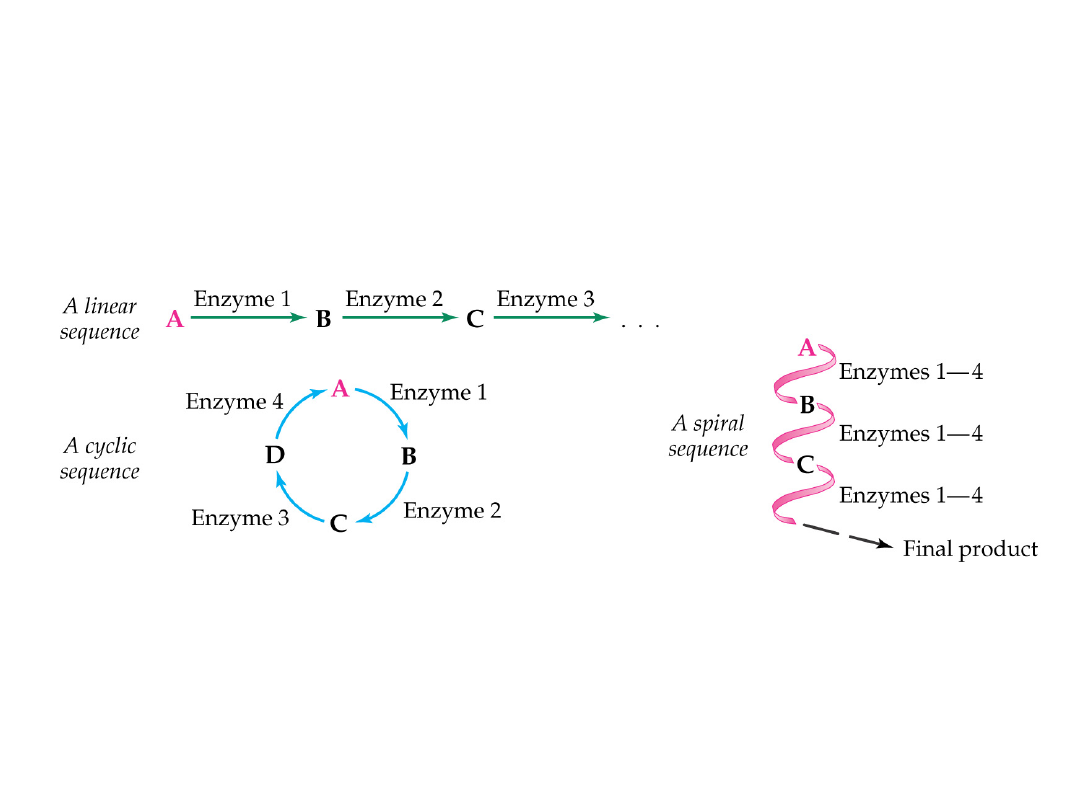
Drogi reakcji enzymatycznych

Sprzężenie zwrotne:
inhibicja pierwszego enzymu szlaku
metabolicznego przez odwracalne wiązanie
produktu końcowego
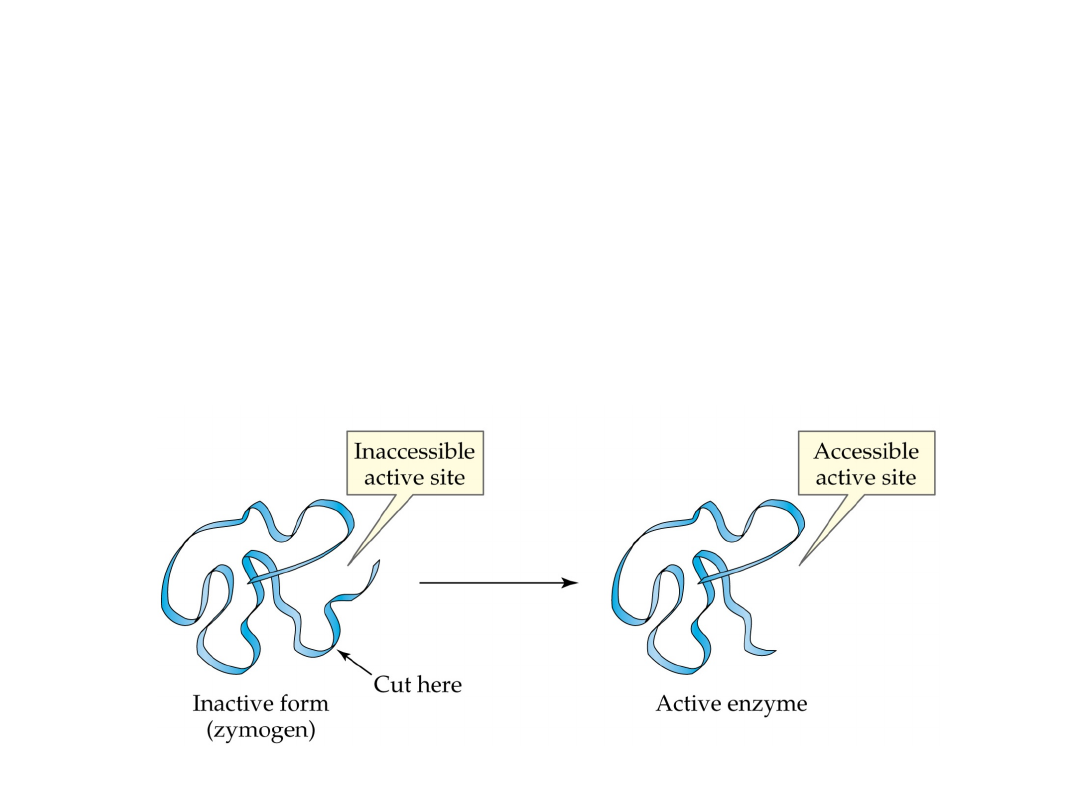
Proenzymy
PROENZYMY, (zymogeny)
- enzymy w naturalnej,
nieaktywnej postaci, które w wyniku działania rozmaitych
czynników przechodzą w postać aktywną; proces aktywacji
proenzymów polega na hydrolitycznym rozerwaniu wiązań
peptydowych fragmentu łańcucha peptydowego; najważniejsze p.
to
pepsynogen, trypsynogen, chymotrypsynogen
.
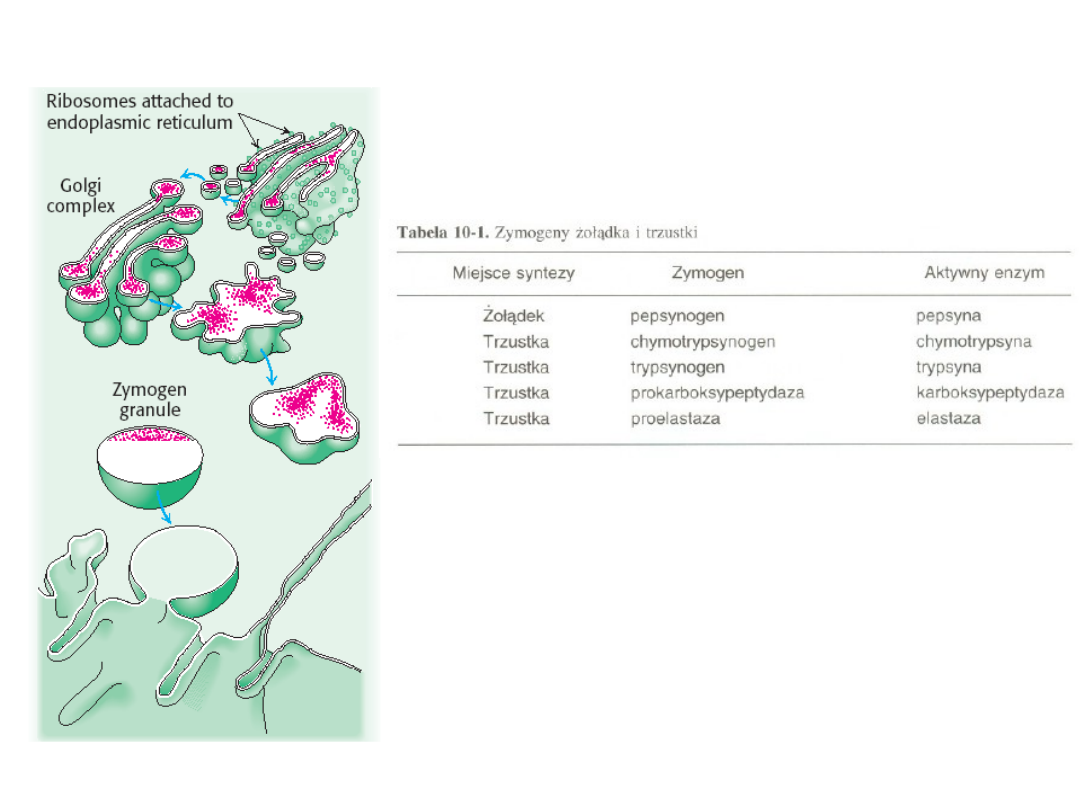
Schemat wydzielania zymogenu przez
komórki pęcherzykowate trzustki
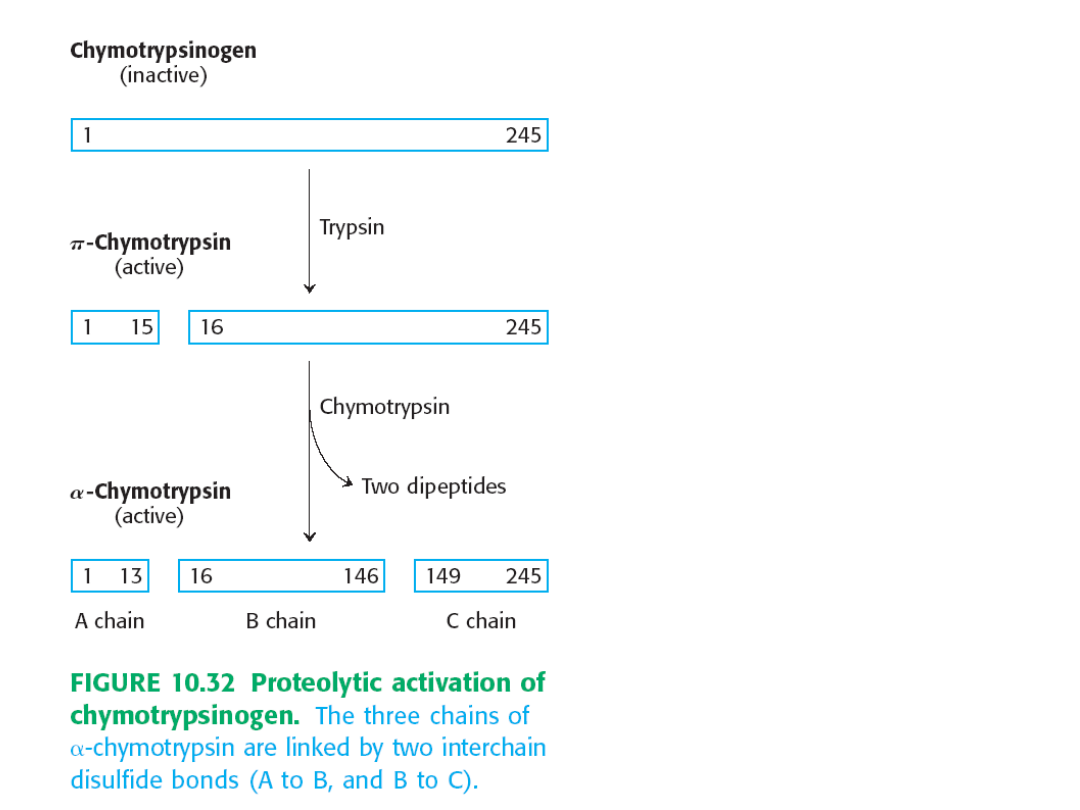
Chymotrypsyna
Chymotrypsyna
Aktywacja chymotrypsynogenu przez
rozszczepienie proteolityczne
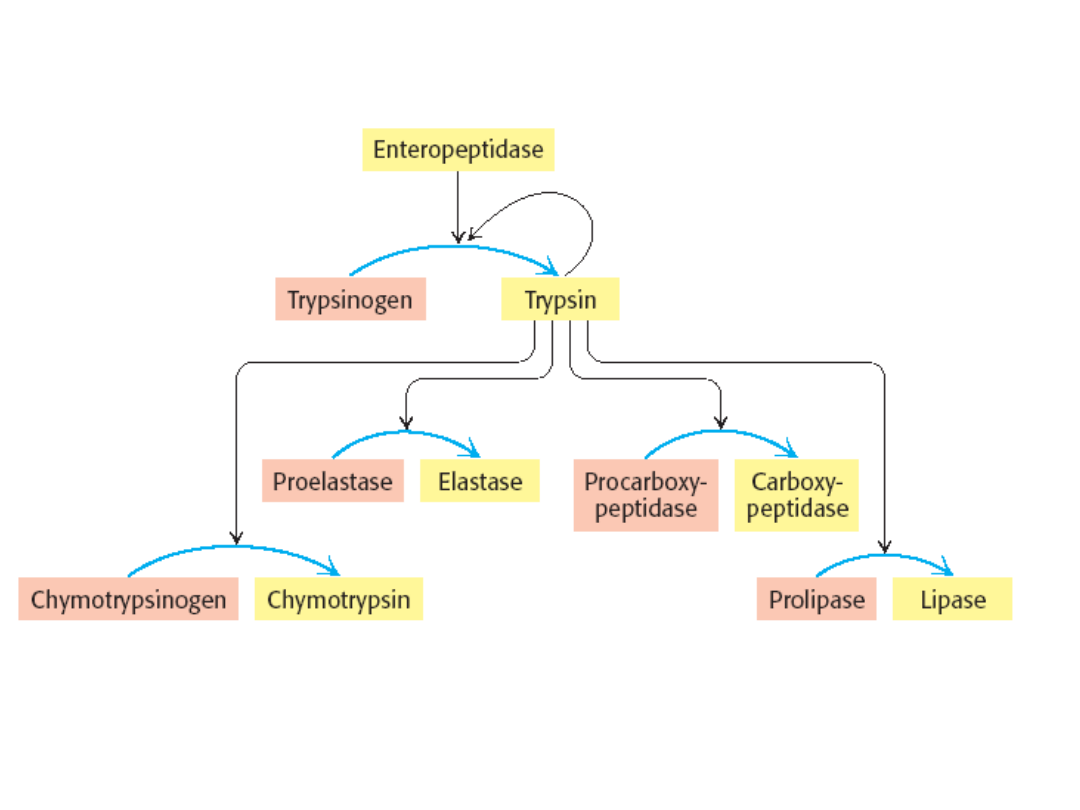
Chymotrypsyna
Chymotrypsyna
Centralna rola trypsyny w aktywowaniu enzymów
trzustkowych
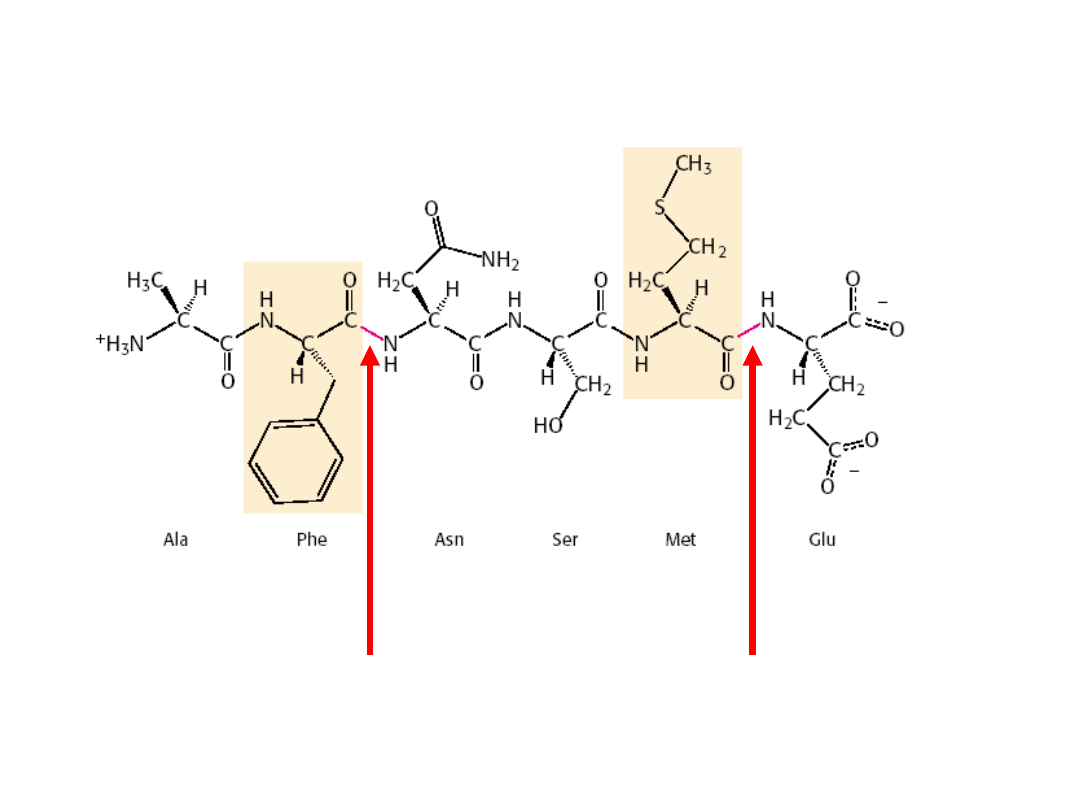
Chymotrypsyna
Chymotrypsyna
•Chymotrypsyna
rozszczepia wiązanie peptydowe (lub estrowe)
po karboksylowej stronie dużych reszt aminokwasów
aromatycznych i hydrofobowych (
Trp, Phe, Tyr, Met
).
Chymotrypsyna
Chymotrypsyna
Chymotrypsyna
Chymotrypsyna
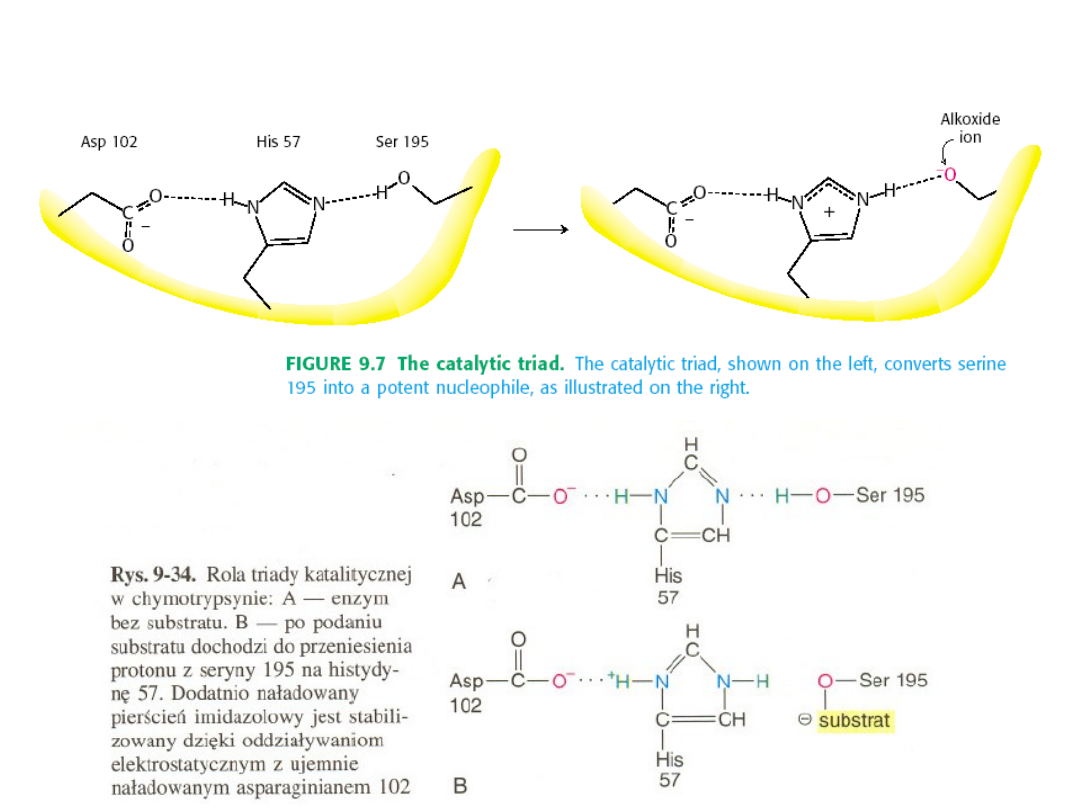
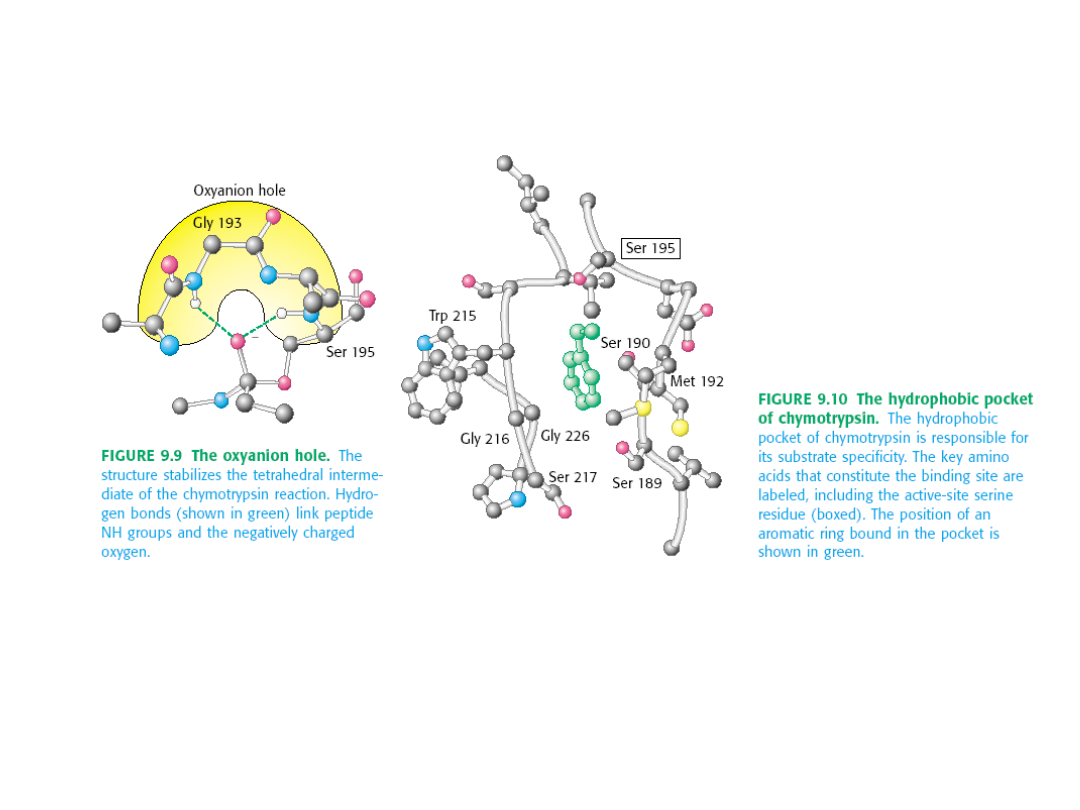
Chymotrypsyna
należy do rodziny enzymów zwanych
proteazami
serynowymi
, ponieważ w miejscu aktywnym mają serynę.
Do tej samej rodzinny należą także
trypsyna i elastaza
.
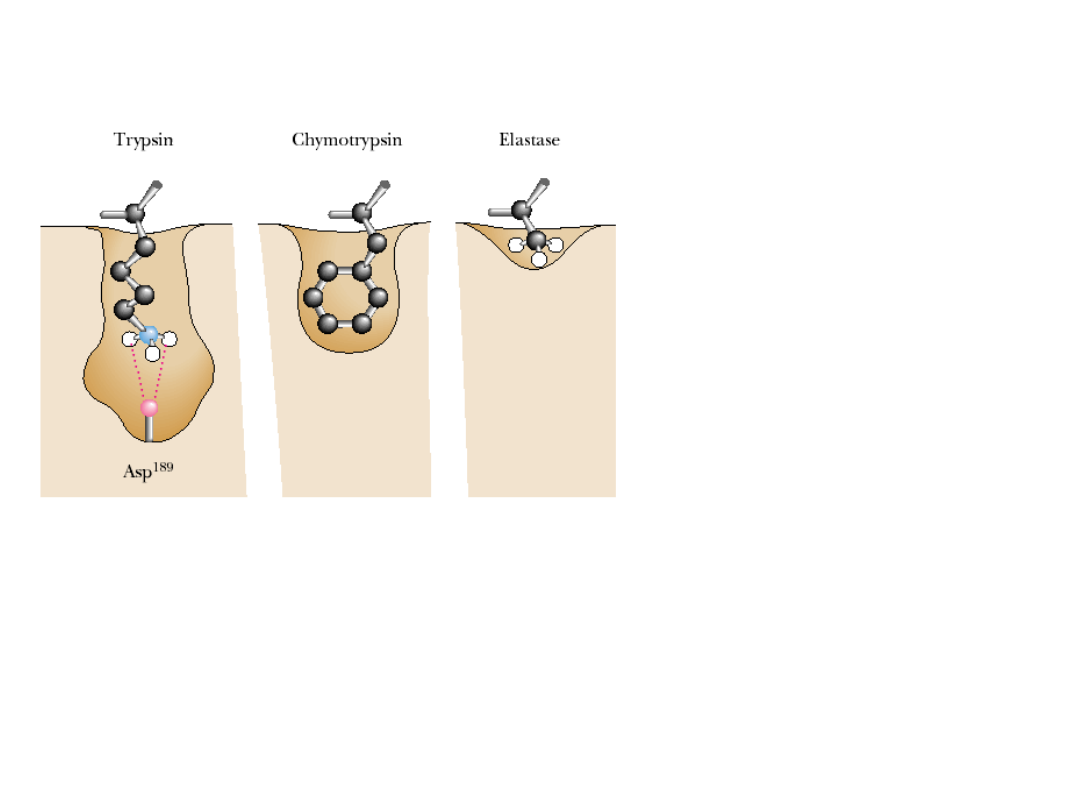
Chymotrypsyna, trypsyna i elastaza
Chymotrypsyna, trypsyna i elastaza
–
–
specyficzność substratowa enzymów trawiennych
specyficzność substratowa enzymów trawiennych
•Trypsyna
rozszczepia peptydy po karboksylowej stronie dodatnio
naładowanych reszt (
Arg
lub
Lys
).
•Chymotrypsyna
rozszczepia peptydy po karboksylowej stronie
dużych reszt aminokwasów aromatycznych i hydrofobowych (
Trp,
Phe,Tyr, Met
).
•Elastaza
rozszczepia peptydy po karboksylowej stronie reszt o
krótkich, nienaładowanych łańcuchach bocznych (
Gly, Ala
).
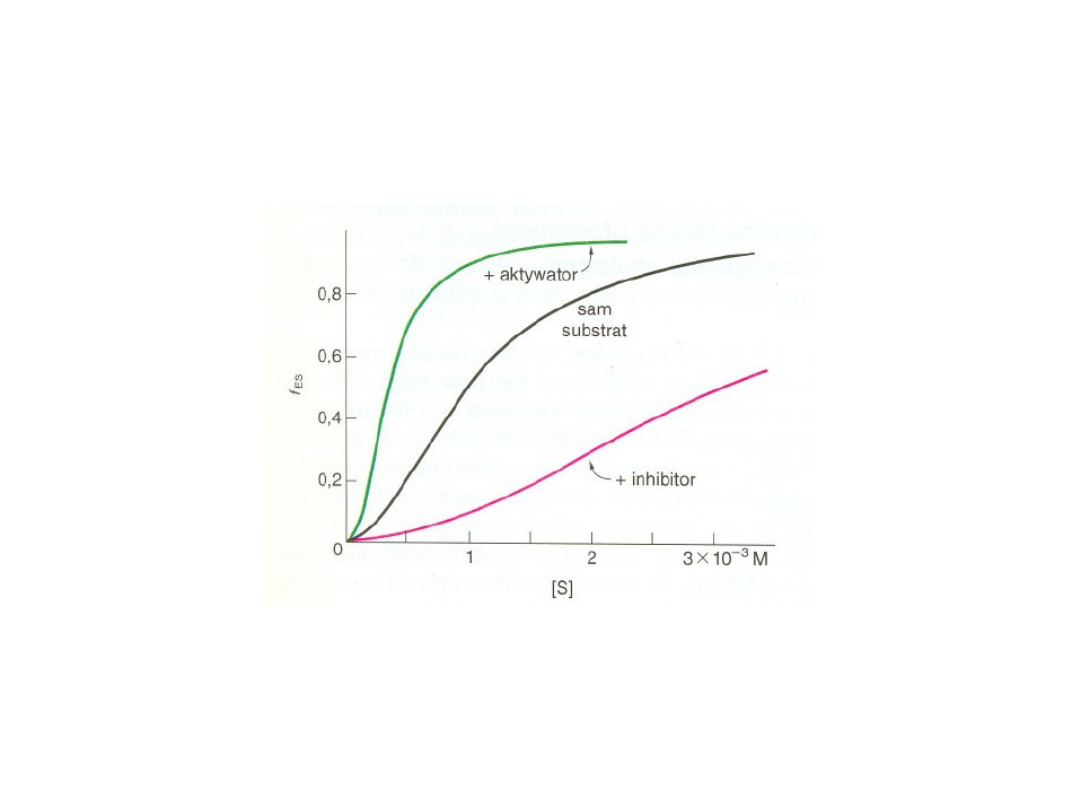
Co przedstawiają poniższe wykresy?
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
Wyszukiwarka
Podobne podstrony:
pros 4 Enzymy 1
Koenzymy, Kosmetologia, Notatki i wyłady, Biochemia
prośba o?zpłatny dzień wolny
Wyznaczanie przyspieszenia ziemskiego za pomocą wahadła pros, Fizyka
Kolo Błony, biochemia, biochemiapros, pros kolo
KOENZYMY, Zootechnika, Biochemia
Koenzymy oksydoreduktazy
Koenzymy flawinowe
Koenzym Q10 - substancja życia, Koenzym Q10-substancja życia
Koenzym Q10, Studium kosmetyczne, Chemia kosmetyczna
etanol - otwarte, Napisz wzorami strukturalnymi (zaznacz ewentualny udział koenzymów):
etanol - otwarte, Napisz wzorami strukturalnymi (zaznacz ewentualny udział koenzymów):
koenzymy 1
Witaminy jako koenzymy Kopia
koenzymy
koenzymy2010
pros 11 Metabolizm kw tłuszczowe, aminokwasy
więcej podobnych podstron