
Metody badania struktury
materii
Spektroskopia atomowa

Podstawy teoretyczne.
• Metody spektroskopii atomowej
wykorzystują zjawiska
pochłaniania (absorpcji) lub
wydzielania (emisji) energii w
postaci promieniowania
elektromagnetycznego przez
elektrony swobodnych
(niezjonizowanych) atomów*.

• Umownie przyjęto, że metody w
których uzyskiwane widmo nie jest
mierzone, a jedynie obserwowane
przez eksperymentatora, noszą
nazwę metod spektroskopowych
("skopeo" - patrzeć, oglądać).

• Natomiast metody w których
mierzy się natężenie emitowanego
lub absorbowanego
promieniowania przez badaną
próbkę, nazywają się metodami
spektrometrycznymi lub
spektrofotometrycznymi ("metreo"
- mierzę).

• Należy dodać, że nazwy "spektrometria" i
"spektrofotometria" są według większości
badaczy tożsame, chociaż część autorów
określenie "spektrofotometria" stosuje w
analizie spektroskopowej cząsteczek
związków chemicznych, a określenie
"spektrometria" w analizie
spektroskopowej atomów pierwiastków.

• Obecnie przyjęty kwantowo-
mechaniczny model budowy atomu
stwierdza, że elektrony mogą
znajdować się w atomie tylko w
pewnych ściśle określonych stanach
energetycznych, opisywanych
funkcjami falowymi, będącymi
rozwiązaniami odpowiedniego
równania Schrődingera.

• Funkcje falowe mogą przyjmować tylko
pewne określone wartości stałych,
nazywanych liczbami kwantowymi, którymi są:
• - główna liczba kwantowa (n), określająca
numer powłoki energetycznej i przyjmująca
wartości kolejnych liczb całkowitych: 1, 2...;
• - poboczna (orbitalna) liczba kwantowa (l),
wskazująca nr podpowłoki na której znajduje
się elektron i przyjmująca wartości od 0 do n-
1;
• -

• magnetyczna liczba kwantowa (m),
wskazująca
ukierunkowanie
przestrzenne orbitalu i przyjmująca
wartości całkowite od -l do +l.
• - spinowa liczba kwantowa (s),
opisująca pewien stan symetrii
danego elektronu i przyjmująca
jedną z dwu wartości: -½ lub +½.

• Zgodnie z zakazem Pauliego, w
atomie nie może istnieć więcej niż
jeden elektron, którego stan
opisany jest danymi czterema
wartościami poszczególnych liczb
kwantowych, co oznacza, że inny
elektron musi się różnić wartością
przynajmniej jednej z tych liczb.

• W temperaturze ok. 20C kolejne elektrony
zapełniają podpowłoki i powłoki
energetyczne w kolejności wzrastających
energii. Np. konfigurację elektronową atomu
sodu przedstawia się zwykle w następujący
sposób:
• 1)
11
Na: 1s
2
, 2s
2
, 2p
6
, 3s
1
• Nie oznacza to jednak, że atom sodu nie
może przyjąć na przykład następujących
konfiguracji elektronowych:

• 2)
11
Na
*
: 1s
2
, 2s
2
, 2p
6
, 3p
1
• lub:
• 3)
11
Na
*
: 1s
2
, 2s
2
, 2p
6
, 4s
1
• Konfigurację elektronową nr 1
nazywa się stanem podstawowym i w
takim stanie występuje praktycznie
cała ilość atomów sodu przy niższych
wartościach temperatury.

• Jeżeli jednak atomom dostarczy się energii,
wówczas elektron (najczęściej z ostatniej
powłoki) może przeskoczyć na inny poziom o
wyższej energii (konfiguracja 2 i 3).
Konfiguracje takie nazywa się stanami
wzbudzonymi i oznacza gwiazdką (np. Na
*
).
Energię potrzebną do przeniesienia elektronu
na wyższy poziom można dostarczyć w postaci
promieniowania elektromagnetycznego o
odpowiedniej długości fali.
•

•
• gdzie : E
k
- energia atomu w określonym
stanie wzbudzonym,
• E
p
- energia atomu w stanie podstawowym,
• - prędkość światła, (3 · 10
8
m s
-1
)
• - stała Plancka, (6,626· 10
-34
J s)
• - długość fali (w metrach).
• - częstość promieniowania (w s
-1
)
c
h
h
E
E
P
K

• Następuje wówczas pochłonięcie
(absorpcja) kwantu
promieniowania. Jest to proces
podstawowy dla atomowej
spektroskopii absorpcyjnej, który
można zapisać równaniem:
P
K
E
E
M
h
M

• Istotne jest, aby wartość energii
niesionej przez foton (kwant
promieniowania) dokładnie odpowiadała
różnicy energii miedzy poziomami
energetycznymi elektronu przed i po
wzbudzeniu atomu. Jeśli energia jaką
niesie promieniowanie nie odpowiada tej
wartości, wtedy promieniowanie nie
zostanie pochłonięte.

• Ponieważ poziomy energetyczne
mogą przyjmować tylko pewne
ściśle określone wartości
(wynikające z rodzaju i wartości
liczb kwantowych), dlatego wartości
ich różnic nie są dowolne, a w
konsekwencji absorbowane mogą
być tylko niektóre długości fal.

• Najbliższy poziom energetyczny na który
może przejść elektron nazywa się
poziomem rezonansowym, a
odpowiadającą mu linię spektralną - linią
rezonansową (konfiguracja 2). W atomie
jest wiele poziomów energetycznych, na
które mogą przenieść się elektrony
wzbudzone. Powoduje to, ze dany
pierwiastek może absorbować wiele
charakterystycznych długości fal.

•
Wraz ze wzrostem wartości głównej liczby
kwantowej różnice energii pomiędzy
kolejnymi poziomami stają się coraz
mniejsze, a odpowiadające im linie
spektralne leżą coraz bliżej siebie. Po
pochłonięciu zbyt dużej ilości energii,
elektron ulega oderwaniu od atomu w
wyniku czego atom ulega jonizacji, a energia
potrzebna do zjonizowania atomu nazywa się
energią jonizacji lub potencjałem jonizacji.

• Wzbudzenie atomu może nastąpić
również pod wpływem energii
cieplnej w wysokiej temperaturze
(np. w płomieniu). Energię
potrzebną do przeskoku na wyższy
poziom energetyczny elektron
zyskuje wtedy wskutek zderzeń
niesprężystych pomiędzy atomami.

• Średni czas życia atomu w stanie
wzbudzonym jest niezwykle krótki, rzędu
zaledwie 10
-8
sekundy. Po tym czasie atom
musi wrócić do swojego stanu
podstawowego, a elektrony wracając na
swoje poprzednie miejsce oddają (emitują)
energię w postaci promieniowania
elektromagnetycznego o długości fali
(barwie) charakterystycznej dla danego
pierwiastka.

• Następuje emisja promieniowania
zgodnie z równaniem:
• Proces ten jest podstawą
atomowej spektroskopii emisyjnej.
h
M
M
K
P
E
E

• Badanie zjawisk absorpcji i emisji
promieniowania
elektromagnetycznego przez atomy
stworzyło podstawy do budowy
modelu atomu przez Nielsa Bohra, a
następnie do stworzenia modelu
kwantowo - mechanicznego przez
wybitnych uczonych początku XX
wieku (de Broglie, Heisenberg,
Shrődinger, Pauli, Hund).

Metody absorpcyjne
•
Badania absorpcji promieniowania przez
wolne atomy zapoczątkowane zostały
zaobserwowaniem w 1802 r przez Wollastona
ciemnych linii w widmie ciągłym światła
słonecznego (tzw. linii Fraunhofera).
Wyjaśnienie ich występowania podali dopiero
w latach 1859 - 1861 Kirchoff i Bunsen.
Zjawisko to powodowane jest absorpcją
promieniowania przez atomy pierwiastków
znajdujących się w zewnętrznej, chłodniejszej
warstwie korony słonecznej (np. helu).

• Wykorzystanie zjawiska absorpcji
promieniowania przez atomy w
praktyce laboratoryjnej nastąpiło
jednak dopiero w 1955 r, kiedy to
Walsh po raz pierwszy zastosował
je do celów analitycznych.

Atomowa spektrometria
absorpcyjna (AAS)
• Atomowa spektrometria
absorpcyjna (ang. Atomic
Absorption Spectrometry AAS; w
literaturze polskojęzycznej
czasami stosuje się skrót ASA)
oparta na kilku ważnych
podstawach:

• a) Źródłem linii absorpcyjnych są
wolne atomy, a nie ich związki.
Dlatego badaną próbkę należy poddać
atomizacji (czyli poddać procesowi
otrzymywania wolnych atomów w
stanie pary) tak, by wytworzyć
możliwie jak najwięcej wolnych
atomów pierwiastka, którego
zawartość chce się oznaczyć.

• Ilość takich atomów powinna być
wprost proporcjonalna do
zawartości oznaczanego
pierwiastka w próbce, przy czym
atomy te powinny znajdować się w
swoim stanie podstawowym.

• Atomy takie uzyskuje się najczęściej
poprzez termiczny rozkład próbki np. w
plazmie niskotemperaturowej (1000 -
4000 K). Niekorzystnym, ubocznym
efektem stosowania takich temperatur
jest wzbudzenie termiczne części
otrzymanych atomów. Stosunek liczby
atomów wzbudzonych do znajdujących się
w swoim stanie podstawowym określa
wzór Boltzmana:

• Gdzie: N
i
- liczba atomów w stanie
wzbudzonym,
• N
0
- liczba atomów w stanie
podstawowym,
• g
0
/g
i
- tzw. stosunek wag statystycznych
stanów,
• T - temperatura [K],
• k - stała Boltzmanna,
• E liczba atomów w stanie wzbudzonym,
kT
E
i
i
e
g
g
N
N
0
0

• Stosunek N
i
/N
0
w temperaturze
2700C dla większości pierwiastków
jest rzędu 10
-10
- 10
-3
, dzięki czemu
ilość niewzbudzonych atomów jest
wystarczająca do prowadzenia
oznaczeń metodą AAS, a linie
rezonansowe są najintensywniejsze.

• Wolne atomy mogą absorbować
tylko długości fal
charakterystyczne dla danego
pierwiastka. Dzięki temu możliwe
jest oznaczanie wielu pierwiastków
zawartych w danej próbce w
sposób niezależny od siebie
(metoda jest bardzo selektywna).

• Absorbancja (ilość zaabsorbowanego
promieniowania) jest wprost
proporcjonalna do ilości wolnych atomów
w środowisku absorbującym (plazmie).
• (8.5)
• gdzie: - natężenia wiązki promieniowania
po przejściu przez ośrodek zawierający
wolne, oznaczane atomy,
•

•
- natężenie wiązki promieniowania
padającego,
•
- atomowy współczynnik absorpcji,
•
- liczba atomów w stanie podstawowym,
•
- długość drogi optycznej.
•
Zależność ta jest podobna do zależności
wynikającej z prawa Boguera-Lamberta-
Beera opisującego absorpcję promieniowania
przez cząsteczki związków chemicznych.

• Linie atomowe (zarówno emisyjne
jak i absorpcyjne) nie są ściśle
monochromatyczne, lecz mają
kształt krzywych Gaussa (ryc. 8.1).
Szerokość linii określa się przez
tzw. szerokość połówkową,
mierzoną w połowie wysokości
piku.
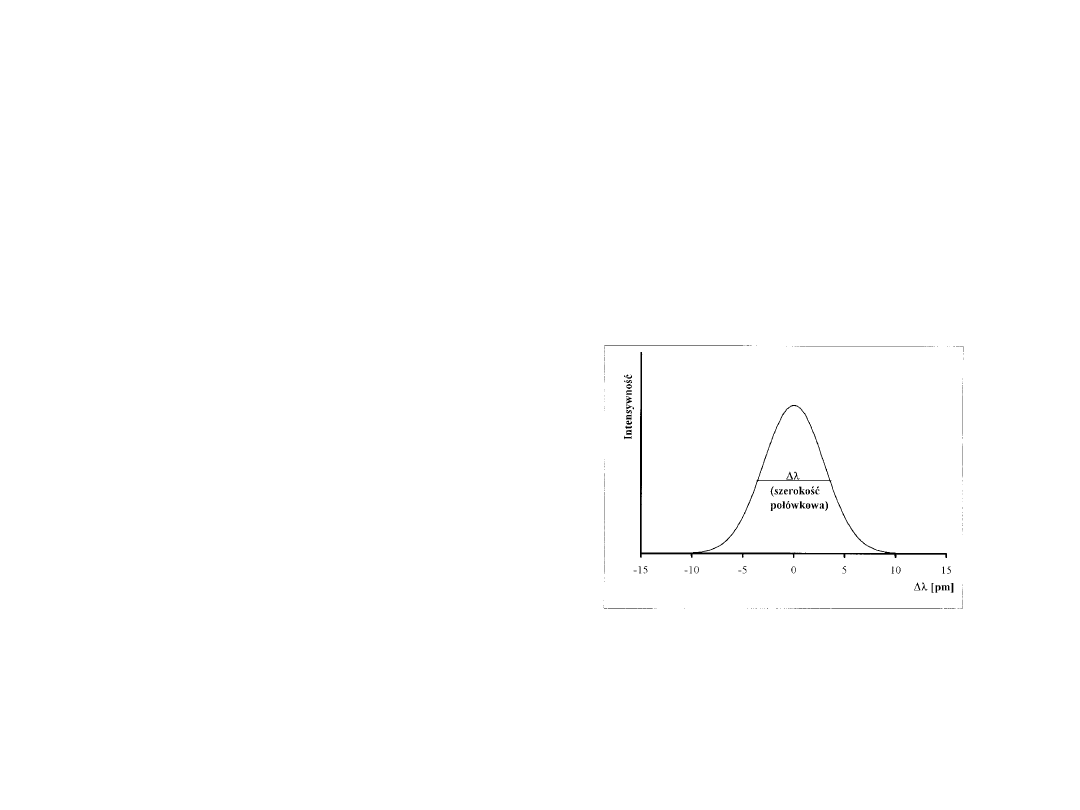
AAS
• Kontur linii
spektralnej

• Naturalna szerokość linii w
zakresie UV-VIS, stosowanych w
AAS jest rzędu 10
-6
- 10
-4
nm.
Znaczny wpływ na szerokość i
kształt linii mają takie czynniki jak
temperatura, ciśnienie oraz pole
elektryczne i magnetyczne
panujące w plazmie:

• Pomiar absorbancji najkorzystniej jest
prowadzić przy maksimum krzywej
opisującej daną linię absorpcyjną.
Dlatego źródło promieniowania
powinno emitować linię o jak
najmniejszej szerokości połówkowej
(znacznie mniejszej niż szerokość linii
absorpcyjnej) i o takiej samej długości
fali.

• Stosowane w AAS źródła
promieniowania nigdy nie dają tylko
jednej linii widmowej, dlatego
promieniowanie to poddaje się
dodatkowo procesowi
monochromatyzacji. Polega on na
wyizolowaniu z widma emitowanego
przez źródło tylko wybranej linii
spektralnej.
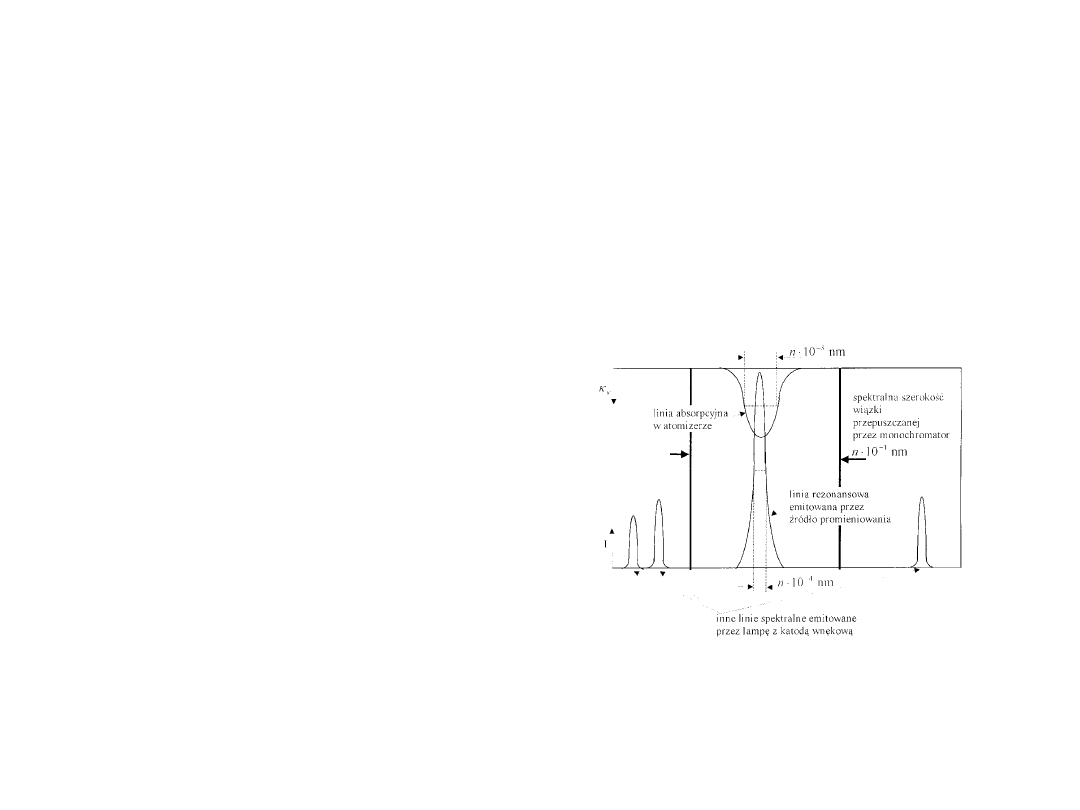
Zasada pomiarów AAS
• Ideę pomiarów
AAS
przedstawiono
poglądowo na
ryc. 8.2

• Aparatura do AAS
• Aparat do atomowej
spektrometrii absorpcyjnej,
którego schemat blokowy
przedstawia ryc. 8.3, składa
się z następujących
elementów:
• 1 - źródła promieniowania
liniowego,
• 2 - atomizera,
• 3 - monochromatora,
• 4 - detektora,
• 5 - wzmacniacza,
• 6 - rejestratora.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
Wyszukiwarka
Podobne podstrony:
Metody badania struktury materiałów (Adam Gryc)
Metody badania białek, Materiały - Biotechnologia
Lab 3 Badania struktury..., materiałoznawstwo i pokrewne
7 Dyfrakcyjne metody badania struktury ciał stałych
Metody badania struktury i czynności układu nerwowego, psychologia uś, rok I
Metody mikroskopowe w badaniach struktury produktów żywnościowych
Interpretacja czynnikowa CPQ, psychologia, studia psychologia, semestr V, materiały gmail, Brachowic
Analiza spektroskopowa w mikroobszarach, ۞ Płyta Studenta Politechniki Śląskiej, Semestr 4, Bsiwm -
24a Metody badania materiałów półprzewodnikowych
bsiwm lab3, STUDIA, SEMESTR IV, Badania struktury i własnosci materiałów
rentgenografia strukturalna, Materiały studia, Metody badań materiałów
zagadnienia na kolos, STUDIA, SEMESTR IV, Badania struktury i własnosci materiałów, bsiwm
Wywiad z dzieckiem, psychologia, studia psychologia, semestr V, materiały gmail, Brachowicz, metody
24 metody badania materiałów półprzewodnikowych
ESPQ, psychologia, studia psychologia, semestr V, materiały gmail, Brachowicz, metody badania osobow
Lab 1 Badanie struktury, STUDIA, SEMESTR IV, Badania struktury i własnosci materiałów
metody badania postawy ciała, fizjoterapia, materiały
więcej podobnych podstron