
Wykłady do końca semestru
Grupy poniedziałkowe 2.1 - 2.6:
09.01 (pon)
II kolokwium
23.01 (pon.)
poprawa I kolokwium
Grupy piątkowe 2.7 - 2.12
13.01 (pt)
16.01 (pn)
20.01 (pt)
II kolokwium
27.01 (pt)
poprawa I kolokwium
30.01 godz. 15-18
poprawa II kolokwium
dla wszystkich grup
Dodatkowe poprawy
Istnieje możliwość poprawy
kolokwium I i II
dla niewielkiej liczby osób.
Terminy:
16.01, 20.01 i 27.01
Godz 8.00 i 9.00
Sala 3.3
Oraz konsultacje:
Środy, godz. 16
Gmach Techn. Chem.
Konieczne jest wcześniejsze
Zgłoszenie na adres:
ziemk@ch.pw.edu.pl
(najpóźniej poprzedniego dnia
Do godz 18 przed kolokwium)
Na kolokwia proszę przychodzić wyłącznie
w przewidzianym dla danej grupy terminie.
Osoby z innych grup będą wypraszane.
Estry
Hydroliza kwasowa i zasadowa
+ H
2
O
R
C
+ R'
H
R
C
R'
H
+
O
O
O
O
O
H
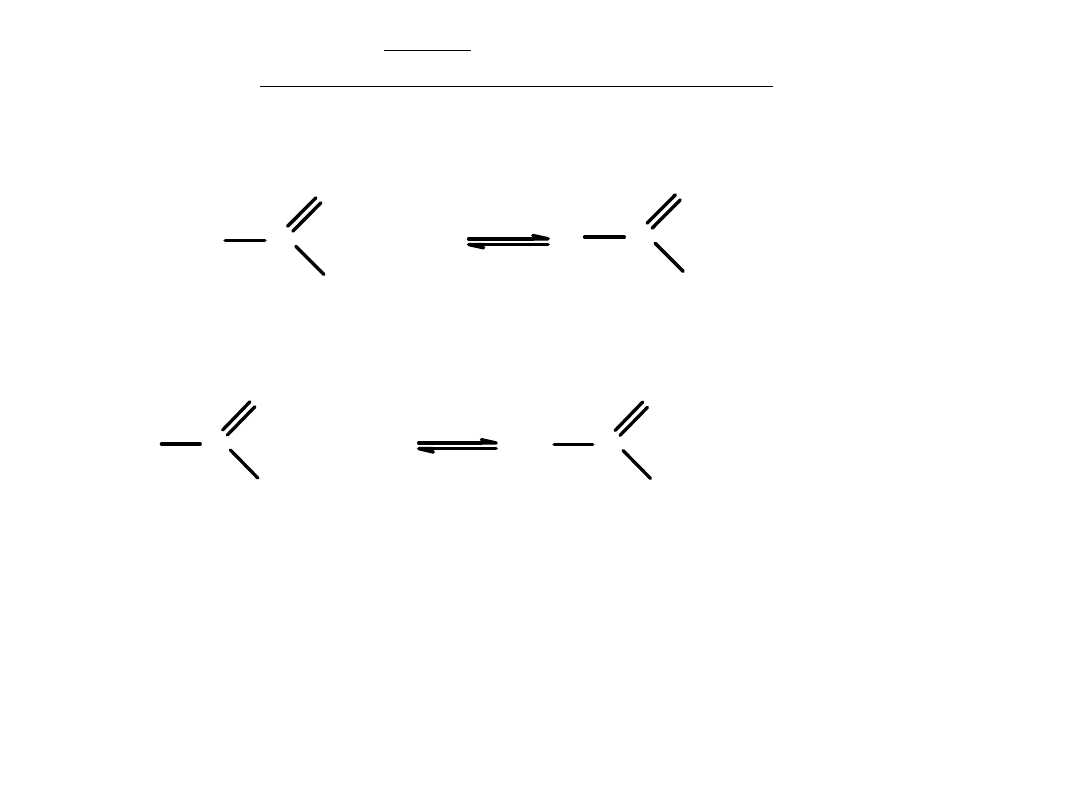
Reakcja tworzenia estru:
Kwasowa hydroliza estru:
+ H
2
O
R
C
+ R'
H
H
+
O
O
O
H
R
C
R'
O
O
Hydroliza kwasowa jest reakcją
odwracalną
, a więc mechanizm hydrolizy
i mechanizm estryfikacji są jednakowe.
W reakcji hydrolizy powstaje
kwas
i
alkohol
. W cząsteczce kwasu
jeden atom tlenu pochodzi od estru a drugi atom tlenu od cząsteczki wody.
Stała równowagi hydrolizy:
K
hydr
=
[kwas][alkohol]
[ester][H
2
O]
Aby przesunąć równowagę reakcji w stronę produktów hydrolizy,
czyli kwasu i alkoholu, należy dać
nadmiar wody
.
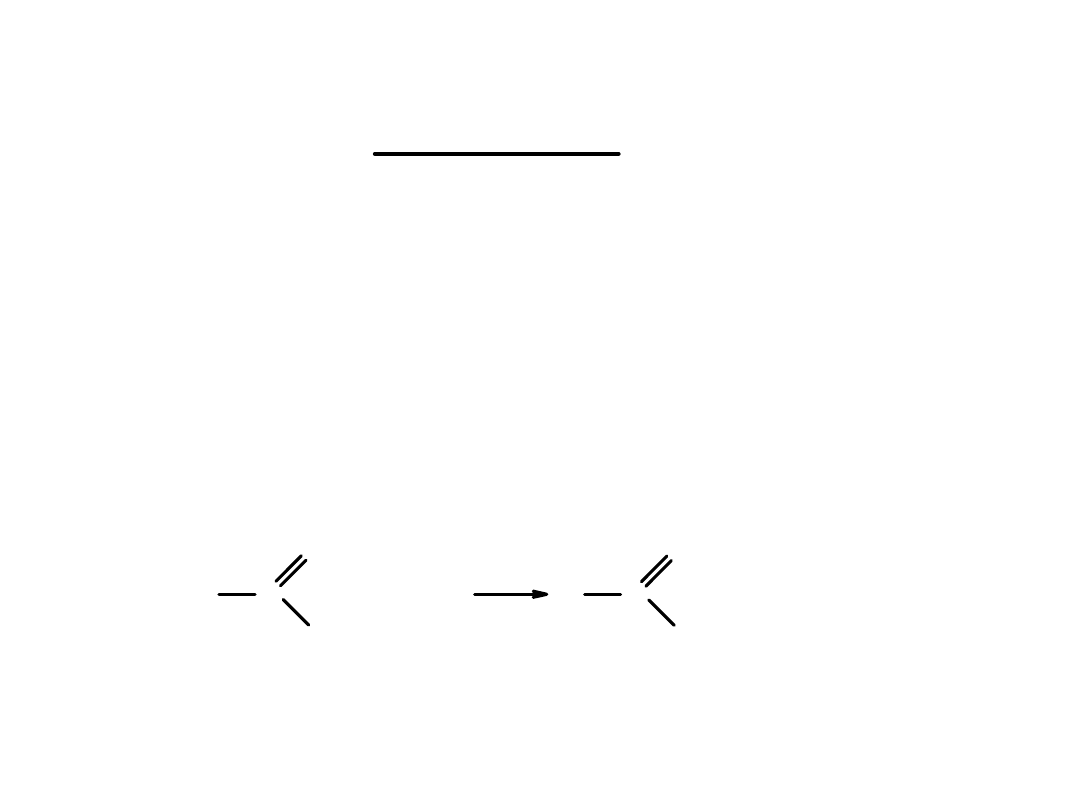
Zasadowa hydroliza estrów:
Estry ulegają reakcji hydrolizy również w środowisku zasadowym.
Produktami reakcji są
sól kwasu karboksylowego
oraz
alkohol
.
Zasadowa hydroliza estrów jest
nieodwracalna
.
O
M H
O
M H
R
C
+ R'
O
O
O
H
R
C
R'
O
O
+
M
= zasada
M = metal
Hydroliza zasadowa estrów jest ważną reakcją w przemyśle.
W reakcji zasadowej hydrolizy tłuszczów otrzymuje się mydła.
Tłuszcze
– estry kwasów tłuszczowych i gliceryny.
Kwasy tłuszczowe
– kwasy o długich łańcuchach.
Najbardziej popularne kwasy tłuszczowe:
palmitynowy - CH
3
(CH
2
)
14
COOH
stearynowy - CH
3
(CH
2
)
16
COOH
mydła
- sole sodowe kwasów tłuszczowych
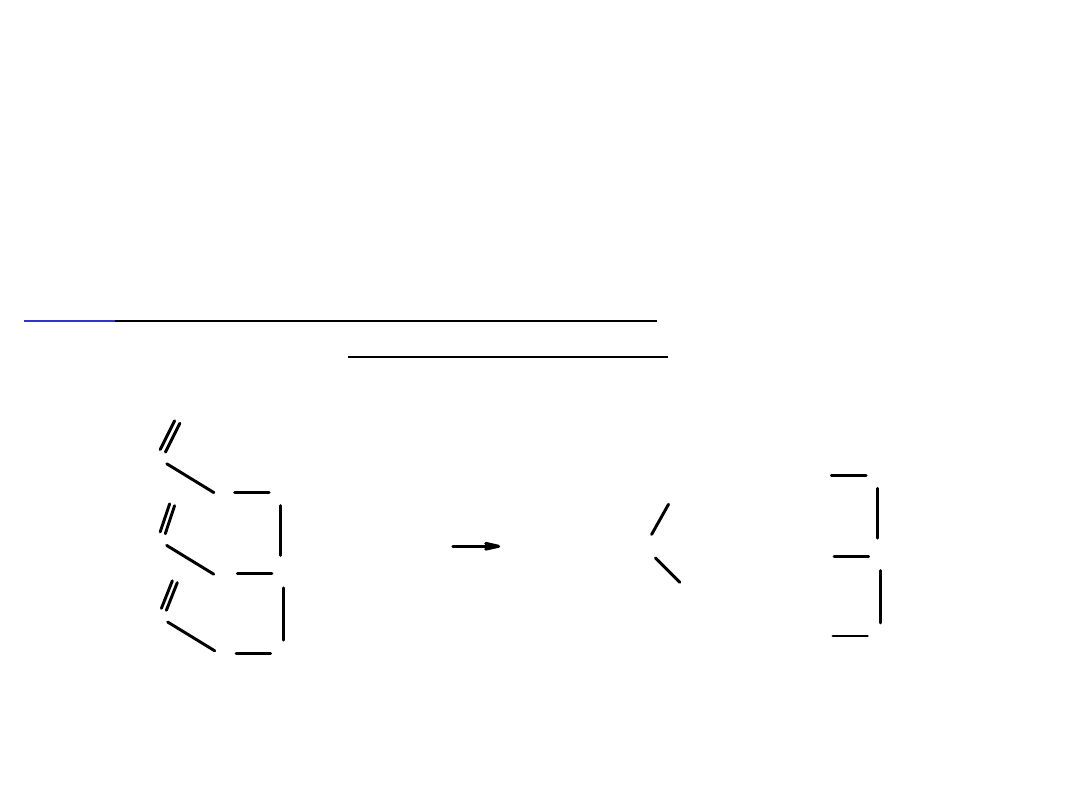
Zmydlanie tłuszczy
+ 3 NaOH
3 CH
3
CH
2
)
16
C
O
ONa
CH
3
(CH
2
)
16
C
O
O
CH
3
(CH
2
)
16
C
O
O
CH
3
(CH
2
)
16
C
O
O
CH
2
CH
2
CH
2
HO
HO
HO
CH
2
CH
2
CH
2
stearynian gliceryny (tluszcz)
sterynian sodu
gliceryna
+
mydlo

Mechanizm myjącego działania mydła
Brud składa się głównie z
tłuszczu
i smaru. Anion kwasu tłuszczowego CH
3
(CH
2
)
n
COO
-
tworzy otoczkę wokół kropelki tłuszczu (
zielona kulka
na rysunku). Do kropelki oleju wnika
część węglowodorowa łańcucha. Na zewnątrz kropelki pozostają polarne końce cząsteczki mydła.
Można powiedzieć, że polarne końce mydła rozpuszczają się w wodzie, a niepolarne długie
łańcuchy w oleju.
W ten sposób tworzy się
graniczna powierzchnia międzyfazowa
między wodą a olejem.
Na powierzchni kulek gromadzi się jednoimienny ładunek ujemny, co zapobiega ich zlewaniu się.
Powstaje emulsja, którą łatwo usunąć z czyszczonej powierzchni.
Mycie i pranie polega więc na tworzeniu
emulsji wody
z cząsteczkami brudu
zlepionymi
tłuszczem.

Mydła i detergenty
należą do środków
powierzchniowo czynnych,
tzn.zmniejszają napięcie powierzchniowe wody.
Detergenty
– syntetyczne środki piorące, których wspólną cechą jest obecność
w cząsteczkach fragmentów polarnych o dużym powinowactwie do wody
(
grup hydrofilowych
) i niepolarnych, o dużym powinowactwie do tłuszczów
(
grupy lipofilowe
).
Zaletą detergentów w porównaniu z mydłami jest ich niewrażliwość na obecność
w wodzie jonów
wapnia
i
magnezu
, czyli na twardość wody.
Twarda woda
zawiera rozpuszczone sole wapnia i magnezu.
W takiej wodzie jony wapnia i magnezu reagują ze stearynianem sodu
i tworzą się nie rozpuszczalne sole –
stearynian wapnia i stearynian magnezu
.
Sole te wytrącają się w postaci osadu.
rozpuszczalny
sterynian sodu
2 CH
3
CH
2
)
16
C
O
ONa
CH
3
CH
2
)
16
C
O
O
nierozpuszczalny
stearynian wapnia
+ Ca
2+
2
Ca + 2 Na
+
Mydła są solami mocnych zasad i słabych kwasów, dlatego w
wodzie
ulegają
hydrolizie
:
CH
3
CH
2
)
16
COONa + H
+
+ OH
_
CH
3
CH
2
)
16
COOH + Na
+
+ OH
_
odczyn zasadowy
Odczyn roztworu mydła
w wodzie jest zawsze
zasadowy
.
Tylko detergenty mają odczyn obojętny.
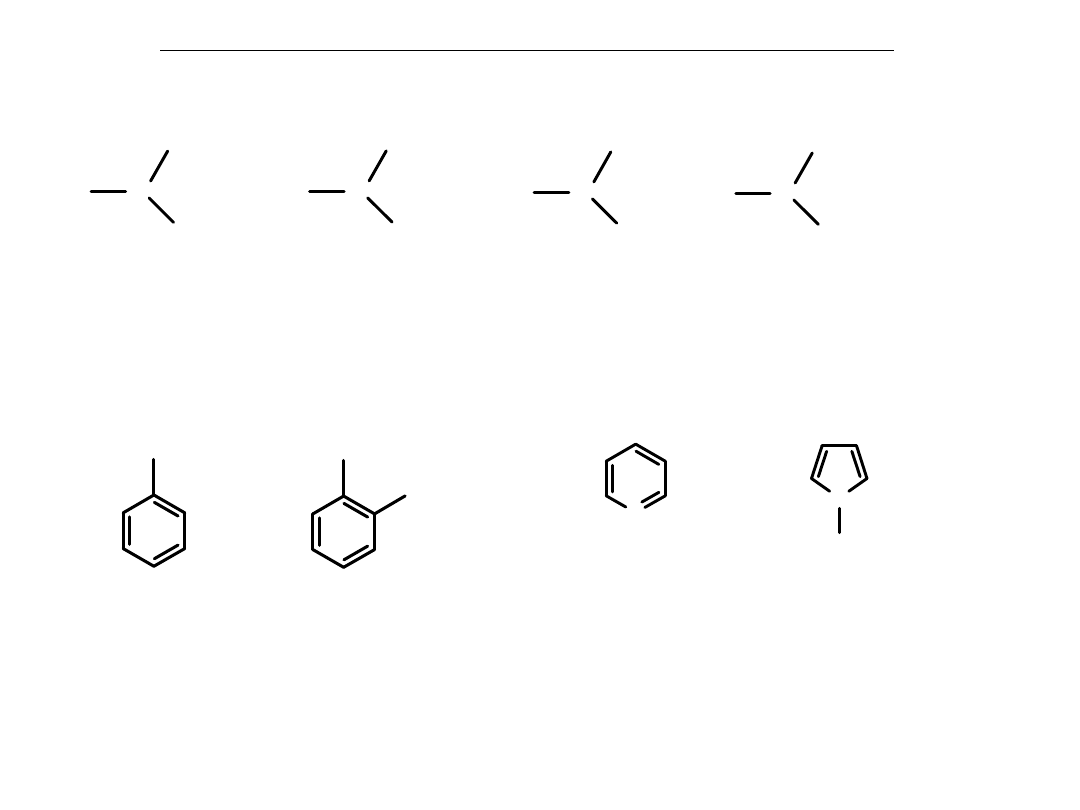
Aminy jako organiczne pochodne amoniaku
Aminy alifatyczne:
N
H
H
H
H
N
N
N
H
H
CH
3
CH
3
CH
3
CH
3
CH
3
CH
3
amoniak
metyloamina
amina I-rzedowa
dimetyloamina
amina II-rzedowa
trimetyloamina
amina III-rzedowa
Aminy aromatyczne:
NH
2
fenyloamina
(anilina)
NH
2
CH
3
2-metylofenyloamina
(o-toluidyna)
Aminy heterocykliczne:
N
N
C
5
H
5
N
pirydyna
H
C
4
H
5
N
pirol
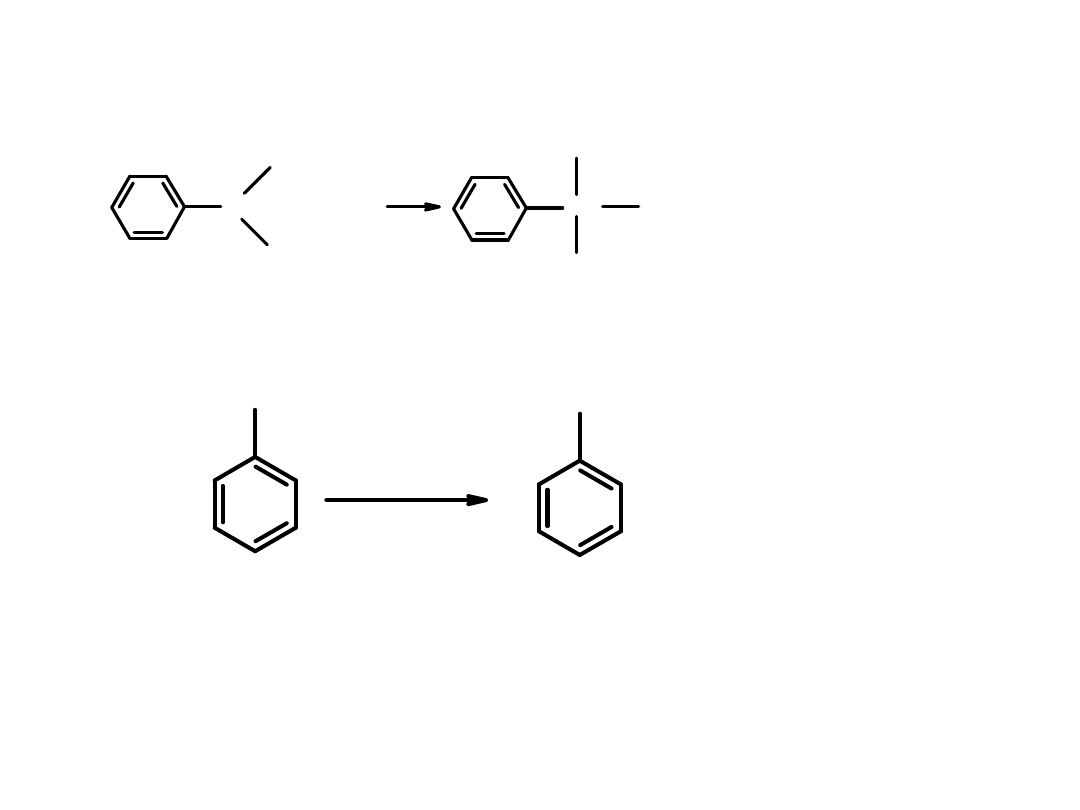
Zasadowy charakter amin
przejawia się w ich reakcjach z kwasami.
Anilina reaguje z kwasem solnym dając sól –
chlorek aniliny
.
+ Cl
_
N:
H
H
+ HCl
N+
H
H
H
Metoda otrzymywania aniliny:
NH
2
NO
2
Fe, 30% HCl
ogrzew.
Anilinę otrzymuje się redukując nitrobenzen w obecności katalizatora.
Nitrobenzen można otrzymać w reakcji nitrowania benzenu.

Paliwa kopalne: gaz ziemny, ropa naftowa i węgiel kamienny
jako źródło paliw i związków chemicznych.
Teoria dotycząca pochodzenia ropy naftowej
: ropa naftowa powstała
ze szczątków roślinnych i zwierzęcych w trakcie długotrwałego procesu
w wysokiej temperaturze i pod wysokim ciśnieniem.
Chemiczny skład ropy naftowej
:
mieszanina węglowodorów gazowych, ciekłych i stałych.
Gazowe i stałe węglowodory rozpuszczone są w ciekłych.
Oprócz tego jako domieszki występują związki siarki, azotu i tlenu.
Dotychczas odkryto w ropie naftowej ok. 600 związków ale jest ich
prawdopodobnie o wiele więcej.
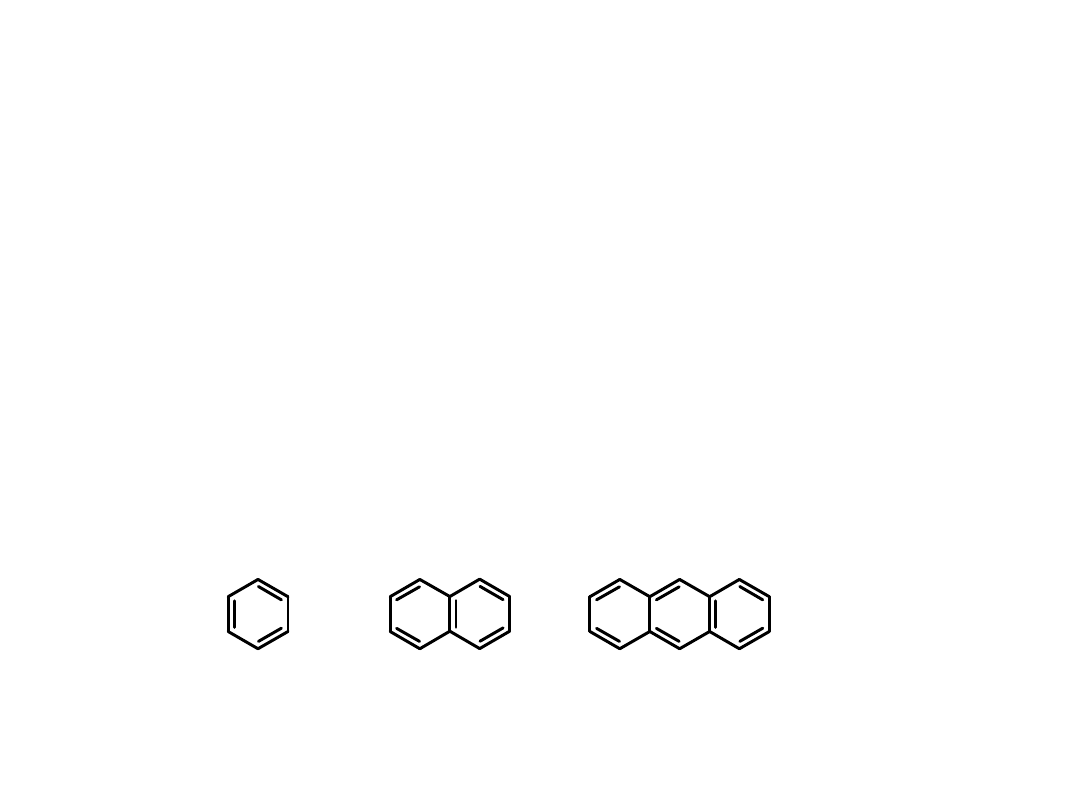
Składniki ropy naftowej:
1.
Alkany alifatyczne
(niecykliczne olefiny i cykloalkany – inaczej parafiny)
Są to
alkany
o ogólnym wzorze
C
n
H
2n+2
mające prosty lub rozgałęziony
łańcuch węglowy,
Lekkie alkany
CH
4
– C
4
H
10
oddziela się od ropy w trakcie jej stabilizacji
po wydobyciu. Jest to
gaz ziemny
.
Wyższe alkany: ciekłe od C
5
H
10
do C
16
H
34
i stałe powyżej C
16
.
Cykloalkany
– węglowodory nasycone zawierające 5- i 6-członowe pierścienie
z łańcuchami bocznymi
oraz układy wielopierścieniowe składające się z kilku cyklicznych pierścieni
połączonych ze sobą.
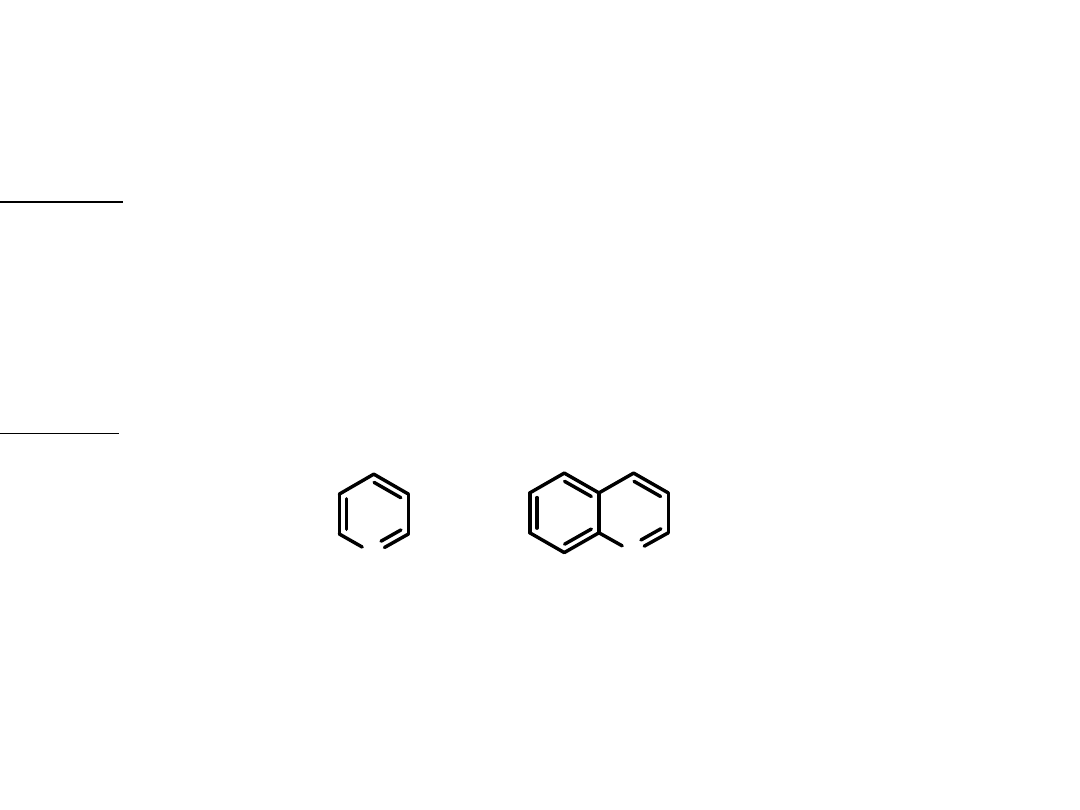
2. Węglowodory
aromatyczne
– benzen, naftalen, antracen i ich pochodne
z bocznymi łańcuchami.
benzen
naftalen
antracen
W ropie naftowej
brak jest alkenów i alkinów
. Otrzymuje się je w dalszej
przeróbce ropy w procesie krakingu.
Związki występujące w ropie jako
domieszki
:
1. Tlenowe – głównie kwasy:
naftenowe
czyli pochodne karboksylowe
wielopierścieniowych związków cyklicznych oraz
Kwasy tłuszczowe
: stearynowy CH
3
(CH
2
)
16
COOH
i palmitynowy CH
3
(CH
2
)
14
COOH
COOH
COOH
Przykłady kwasów naftenowych
Domieszki c.d.
2. Siarkowe –
siarka
w postaci pierwiastka S oraz związków takich jak:
H
2
S – siarkowodór
Siarczki (sole)
Tioetery R-S-R
Merkaptany R-S-H i tiofenole (fenole, w których atom tlenu zastępuje
atom siarki)
3. Azotowe – głównie pirydyna i chinolina, a także inne związki azotowe
N
N
pirydyna
chinolina

Przerób ropy naftowej
I etap
: wstępne oczyszczanie czyli odgazowanie i odwodnienie
II etap
: destylacja frakcyjna – rozdzielenie ropy na frakcje z wykorzystaniem różnic
temperatur wrzenia składników – metodą
rurowo-wieżową
.
Ropę ogrzewa się w piecu rurowym i wprowadza do kolumny destylacyjnej
– stalowej rury o średnicy ok. 1m, z półkami destylacyjnymi.
Na niższych półkach jest wysoka temperatura, im wyżej tym temperatura niższa.
Na najwyższych półkach skraplają się najbardziej lotne substancje o niskiej
temperaturze wrzenia.

Frakcje
otrzymywane z destylacji frakcyjnej:
1. Frakcja benzynowa (40-180
o
C)
2. Nafta (180-280
o
C)
3. Olej napędowy (280-350
o
C)
4. Mazut jako pozostałość po destylacji
Zawartość domieszek, zwłaszcza związków
siarki
, utrudnia przerób ropy naftowej.
Związki siarki powodują
korozję aparatury
i obniżają jakość produktów.
Ponadto domieszki są źródłem emisji do środowiska takich gazów jak:
SO
2
, NO
x
, CO, CO
2
.
Dlatego ropę poddaje się dodatkowym procesom mającym na celu przede wszystkim
odsiarczanie
.
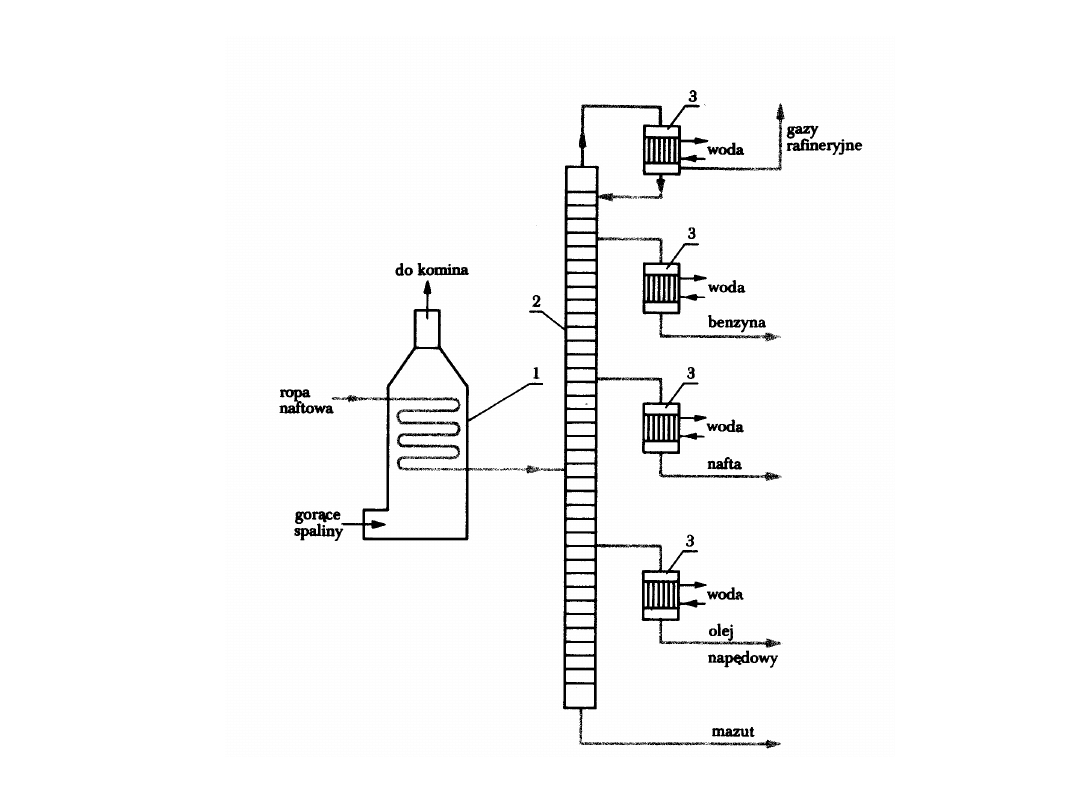
Schemat instalacji do destylacji ropy naftowej metodą rurowo-wieżową

Frakcje otrzymane z destylacji ropy naftowej nie są jeszcze wyrobami
użytkowymi i muszą być poddane dalszej przeróbce
(reformingowi i krakingowi).
Reforming
–proces, któremu poddaje się
frakcję benzynową
w celu
podniesienia liczby oktanowej benzyny.
Węglowodory o prostych łańcuchach w wysokiej temperaturze i w obecności
katalizatora
ulegają izomeryzacji
do węglowodorów o rozgałęzionych
łańcuchach
i
cyklizacji
do związków cyklicznych oraz
aromatyzacji
do aromatycznych.
Dodatkowo reforming dostarcza związków aromatycznych i wodoru
dla przemysłu chemicznego.
Warunki reformingu:
Wysoka temperatura i ciśnienie, katalizator
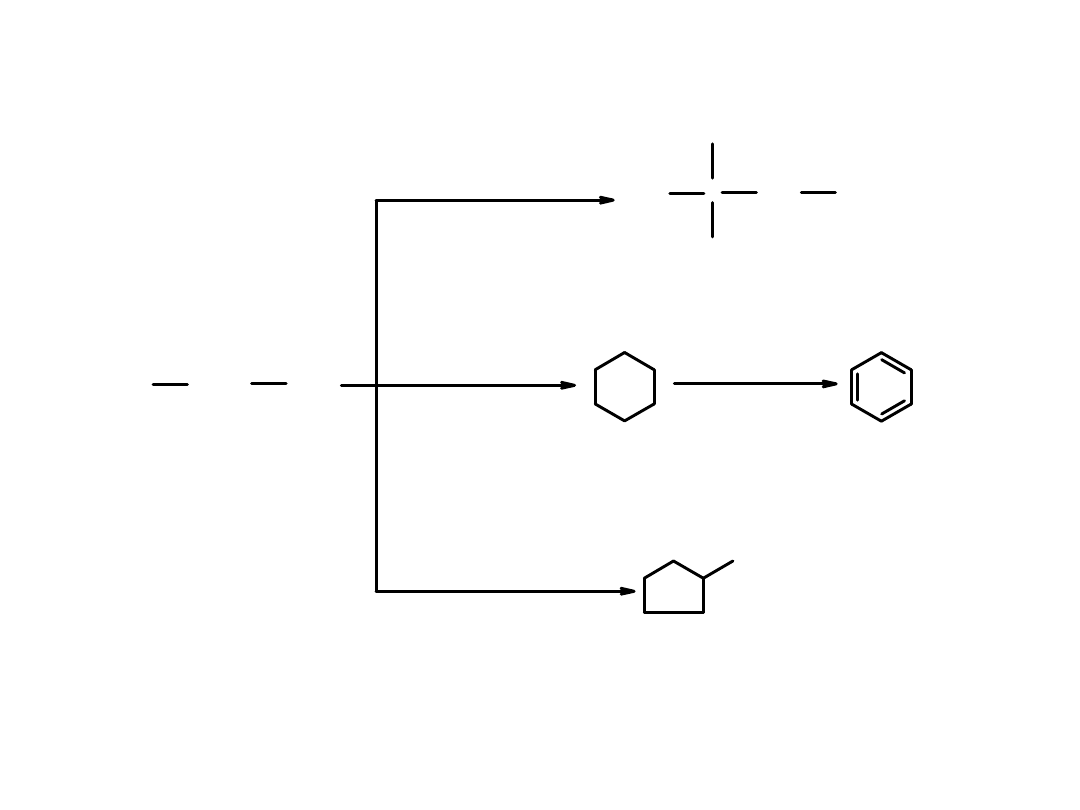
C
CH
3
CH
3
CH
3
CH
2
CH
3
CH
3
CH
3
(CH
2
)
4
CH
3
2,2'-dimetylobutan
izomeryzacja
cyklizacja
aromatyzacja
cyklizacja
heksan
cykloheksan
benzen
metylocyklopentan
LO = 25
LO = 102
LO = 83
LO = 100
LO = 91
Przemiany jakim ulega heksan w procesie reformingu
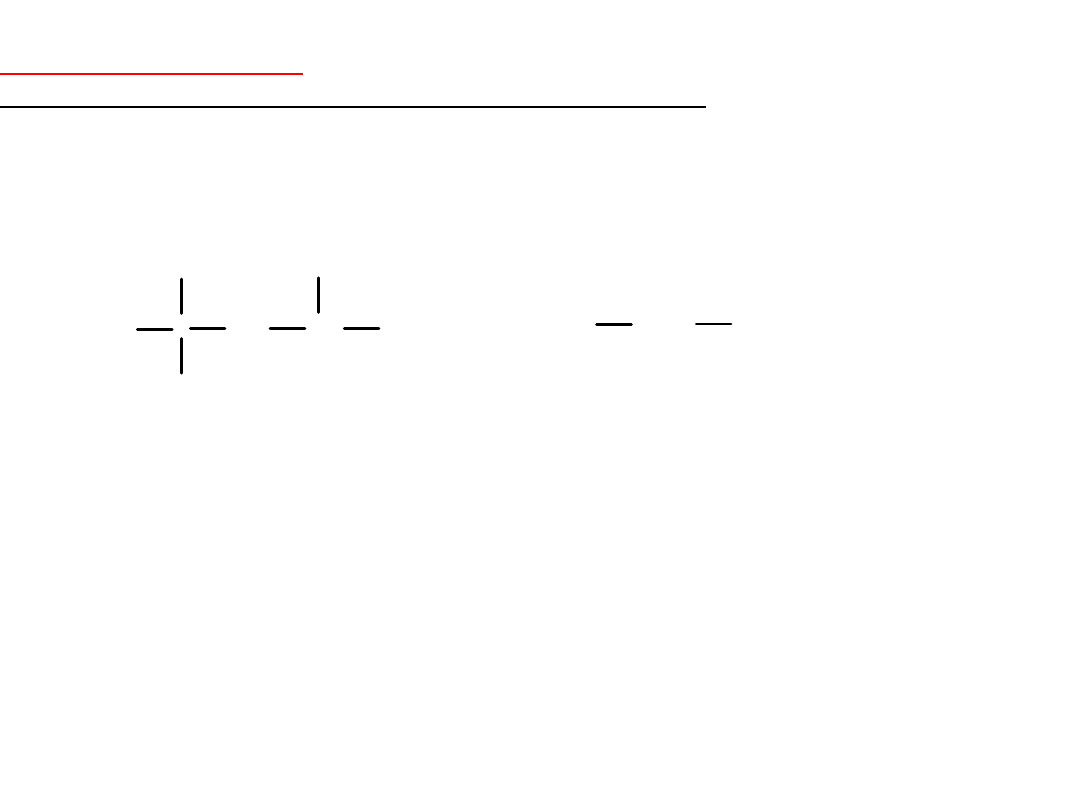
Liczba oktanowa (LO)
– parametr określający jakość benzyny,
miara odporności benzyny na spalanie detonacyjne.
Liczbę oktanową określa się na podstawie wzorców.
Założono, że LO dla 2,2,4-trimetylopentanu (
izooktanu) wynosi
100
,
a dla
n-heptanu
LO = 0
.
CH
3
CH
3
(CH
2
)
5
CH
3
C
CH
3
CH
3
CH
3
CH
2
CH
3
CH
izooktan
LO = 100
n-heptan
LO = 0
Liczba oktanowa 95
oznacza, że benzyna ma taką samą szybkość spalania
jak mieszanina 95% izooktanu i 5% n-heptanu.

n-Alkany
– mają najniższe liczby oktanowe.
Alkany rozgałęzione, alkeny, cykloalkany, węglowodory aromatyczne
mają wysokie LO.
LO można poprawić dodając
antydetonatorów
.
Do lat 80-tych ub. wieku dodawano
tetraetyloołów
Pb(CH
2
CH
3
)
4
.
Jest to związek toksyczny i powoduje zatrucie środowiska.
Dlatego zrezygnowano z niego.
Obecnie dodaję się do paliwa związki organiczne (
etanol, toluen
)
i montuje się w rurach wydechowych
katalizatory
w celu dopalenia tych dodatków.
Kraking termiczny i katalityczny
Proces otrzymywania benzyny z
frakcji wyżej wrzących
(nafty, olejów, mazutu).
Proces wykorzystuje zjawisko rozpadu długich łańcuchów węglowych
na mniejsze fragmenty pod działaniem wysokiej temperatury i ciśnienia
(
kraking termiczny
)
lub w obecności katalizatora w wyższej temperaturze i pod normalnym ciśnieniem
(
kraking katalityczny
).
Po krakingu mieszaninę poddaje kolejnej destylacji frakcyjnej.
W krakingu wyższe węglowodory rozpadają się na te o krótszych łańcuchach
wchodzące w skład
benzyny
.
Jako produkty uboczne powstają
lekkie alkany i alkeny C
1
-C
4
,
które wykorzystuje się w przemyśle chemicznym do otrzymywania
innych związków oraz tworzyw sztucznych.
Zastosowanie lekkich alkanów i alkenów C
1
-C
4
:
Propan i butan
używane są jako gaz płynny do napełniania butli.
Metan i etan
dołącza się do gazu ziemnego.
Etylen, propen, buten
poddaje się polimeryzacji.

Przeróbka węgla kamiennego
Proces koksowania
– ogrzewanie węgla w bateriach koksowniczych
do temperatury ok. 1000
o
C bez dostępu powietrza.
W tych warunkach węgiel kamienny ulega rozkładowi do produktów:
1. koks
2. woda pogazowa
3.smoła węglowa
4.gaz koksowniczy

Przeróbka węgla kamiennego
1. Koks
– czysty węgiel z niewielką domieszką popiołu, o porowatej strukturze.
Zastosowanie – głównie do wytopu żelaza.
2. Woda pogazowa
– zawiera amoniak powstały z rozkładu związków azotowych.
Wykorzystuje się ją do produkcji siarczanu(VI) amonu (NH
4
)
2
SO
4
–ważnego nawozu azotowego.
3. Smoła węglowa
– mieszanina kilku tysięcy związków, głównie aromatycznych.
Smołę węglową poddaje się destylacji frakcyjnej, podobnie jak ropę naftową,
w celu rozdzielenia mieszaniny na frakcje.
Potem frakcje poddaje się jeszcze rozdziałowi chemicznemu.
Ze smoły pogazowej otrzymuje się 3 grupy związków:
Węglowodory aromatyczne – benzen, toluen i ich homologi
Składniki kwaśne - fenole
Składniki zasadowe – głównie azotowe związki heterocykliczne
– pirydyna i jej homologi.
4. Gaz koksowniczy
– mieszanina wodoru, metanu i tlenku węgla CO.
Stosowany jako opał a także do syntez chemicznych.
Polimery i tworzywa sztuczne
Polimery
– związki o budowie łańcuchowej, zbudowane z połączonych ze sobą,
powtarzających się elementów (
merów
).
A
A
A
A
A
A
polimer
mer
Łańcuchy polimerów mogą być zbudowane z identycznych lub różnych merów.
Polimery otrzymuje się w reakcjach łączenia się pojedynczych cząsteczek
prostych związków
–
monomerów
–w długie łańcuchy.
Polimery otrzymuje się w dwóch rodzajach reakcji:
polimeryzacja
polikondensacja
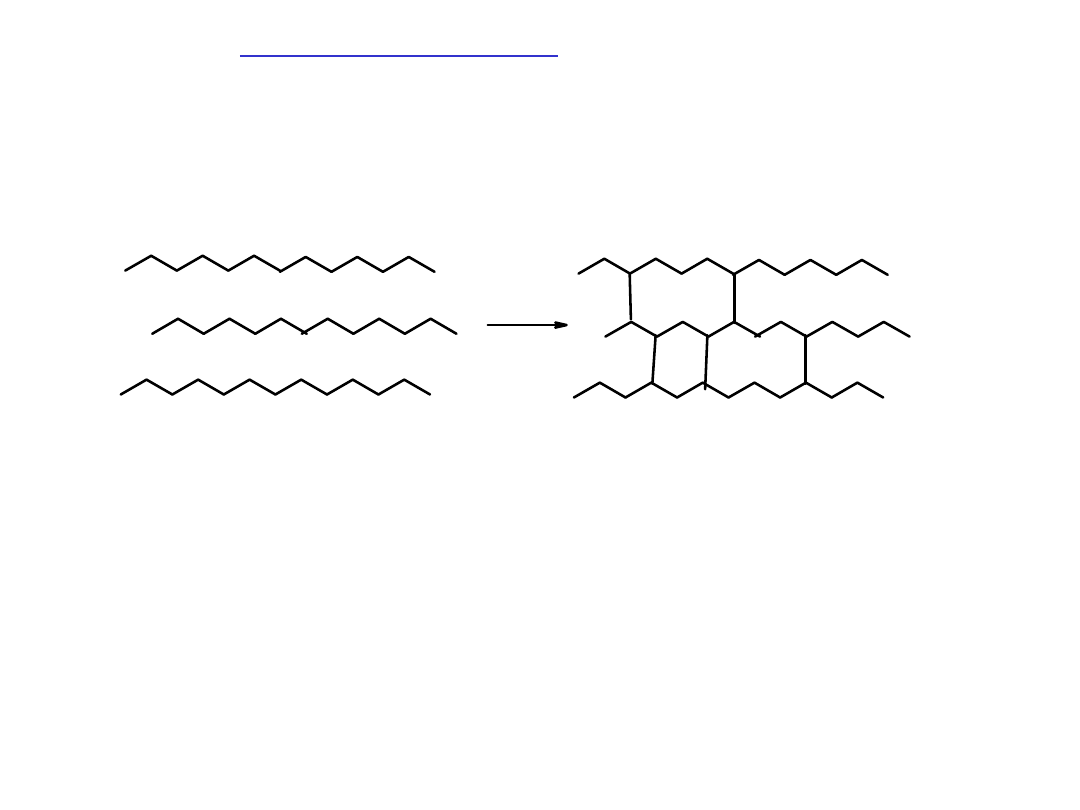
Polimeryzacja
– proces łączenia się cząsteczek monomeru w łańcuch,
któremu nie towarzyszy powstawanie żadnych produktów ubocznych.
Przykład: polimeryzacja etylenu
CH
2
CH
2
CH
2
n CH
2
n
etylen
polietylen
Polikondensacja
– oprócz cząsteczek polimeru powstają proste produkty,
najczęściej woda.
Przykład: tworzenie peptydów z aminokwasów
Proces sieciowania
Jeśli w polimerze są
reaktywne grupy funkcyjne
lub
wiązania wielokrotne
,
to taki polimer można poddać sieciowaniu. Ma on na celu poprawić właściwości
użytkowe polimeru.
Polimer ogrzewa się z odpowiednim związkiem, zwanym
utwardzaczem
, następuje
łączenie się łańcuchów ze sobą, prowadzące do powstania jednej gigantycznej cząsteczki.
polimer nie usieciowany
polimer usieciowany
Masy cząsteczkowe polimerów – od 10 000 do kilkudziesięciu milionów u.
Polimery dzielimy na
:
naturalne
– np. kauczuk, celuloza
naturalne i modyfikowane
– np. guma (kauczuk usieciowany siarką),
octan celulozy
syntetyczne
– polietylen, polipropylen, polichlorek winylu (PCV).

Aby polimer stał się wyrobem użytkowym musi być poddany odpowiedniej
obróbce.
Dodaje się różne
domieszki
poprawiające właściwości użytkowe:
• barwniki i pigmenty
• wypełniacze – kreda, gips, sadza, proszek drzewny –
• nadają tworzywu większą wytrzymałość mechaniczną
• plastyfikatory (zmiękczacze) – poprawiają elastyczność tworzywa
Kompozyty
- materiały o niejednorodnej strukturze składające się z kilku
komponentów. Jeden z komponentów stanowi
lepiszcze
, które zapewnia
spójność, a pozostałe to komponenty
konstrukcyjne
zapewniające dobre
własności mechaniczne.
Komponenty konstrukcyjne:
włókno szklane
kwarc
azbest
włókna węglowe
kevlar (polimer z grupy poliamidów, z którego produkuje się bardzo wytrzymałe
włókna m.inn. na kamizelki kuloodporne).

Laminaty
- należą do kompozytów.
otrzymuje się je nasycając półpłynnym
polimerem
materiały nadające
wytrzymałość mechaniczną – tkaniny, papier, włókna szklane (tzw.
zbrojenie
)-
i prowadzi się polimeryzację aż do utwardzenia.
Zbrojenie jest układane w postaci warstw i najczęściej jednokierunkowo.
Laminatów używa się jako tworzywa konstrukcyjne do kadłubów łodzi
i samolotów, karoserii samochodowych, elementów budynków.
Włókna
– polimer wytłacza się przez sita o bardzo drobnych otworkach
w celu wytworzenia nici.
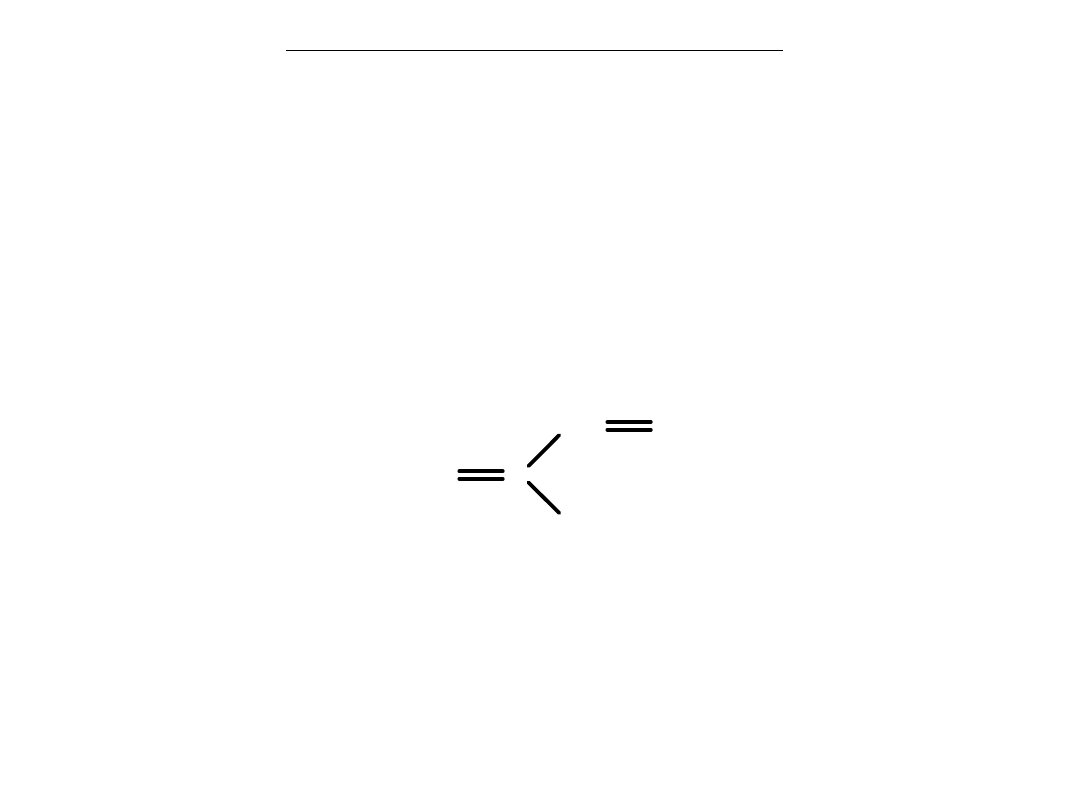
Polimery naturalne - kauczuk
Kauczuk naturalny
– brunatne elastyczne ciało stałe.
Substancja otrzymywana z soku (lateksu) roślin kauczukodajnych.
Znany i stosowany od kilkuset lat.
Rozpuszcza się powoli w węglowodorach.
Roztwór kauczuku w toluenie –
klej
do gumy i skóry.
Chemicznie – kauczuk naturalny jest
poliizoprenem
.
Powstaje przez polimeryzację
izoprenu.
CH
2
C
CH
CH
3
CH
2
izopren
monomer
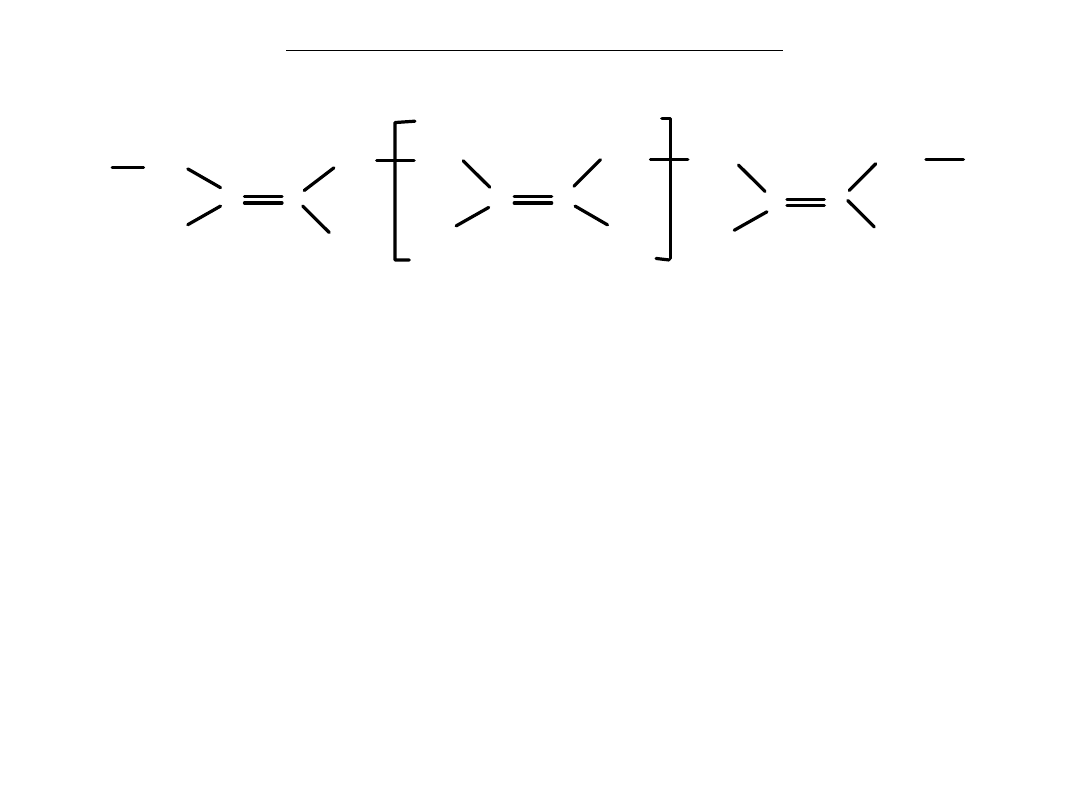
Polimery naturalne - kauczuk
CH
2
C
C
C
C
C
C
H
H
H
CH
2
CH
2
CH
2
CH
3
CH
3
CH
3
CH
2
CH
2
n
mer
poliizopren
Wszystkie wiązania podwójne w łańcuchu kauczuku naturalnego mają
konfigurację cis
.
Można sztucznie uzyskać kauczuk identyczny z naturalnym polimeryzując
izopren
.
Istnieje również kauczuk naturalny o nazwie
gutaperka
, w którym wszystkie
wiązania mają konfigurację
trans
.
Gutaperka jest pozyskiwana z innych drzew niż kauczuk.

Polimery naturalne modyfikowane
Guma
– otrzymuje się z kauczuku w procesie wulkanizacji. Kauczuk ogrzewa się
z ok.
3% dodatkiem siarki
. Następuje proces
sieciowania
.
Łańcuchy poliizoprenowe łączą się ze sobą za pomocą mostków siarkowych.
Guma posiada znacznie lepsze właściwości fizyczne niż kauczuk.
Opony samochodowe
produkuje się z gumy zawierającej 50% masowych sadzy,
która poprawia wytrzymałość na ścieranie.
Współcześnie gumę łączy się z innymi materiałami np. siatką metalową
i otrzymuje się w ten sposób
kompozyty
.
Octan celulozy
– produkt reakcji kwasu octowego z celulozą a więc ester
z punktu widzenia chemii.
Celuloza zawiera grupy hydroksylowe OH i spełnia rolę alkoholu.
Octan celulozy jest bezbarwną przezroczystą substancją dającą formować się
w cienkie folie i włókna o dużej wytrzymałości.
Produkuje się z niego błony fotograficzne i jedwab octanowy.

Nylon
– jedno z najbardziej popularnych tworzyw sztucznych
Oficjalnie ogłoszono jego wynalezienie w 1938 roku.
Zastosowanie – spadochrony, pończochy, tkaniny, wyposażenie dla wojska.
Zastąpił drogi i mało wytrzymały jedwab naturalny produkowany w Japonii.
Dziś stosowany jako składnik tworzyw zawierających włókna szklane i węglowe.
Tworzywa te zastępują metal m. inn. w elementach silników.
Jest to pierwszy syntetyczny polimer, na sprzedaży którego zarobiono
ogromne pieniądze.
Z chemicznego punktu widzenia
nylon jest poliamidem
.
Powstaje w reakcji polikondensacji dikwasu z diaminą. W reakcji wydziela się woda.
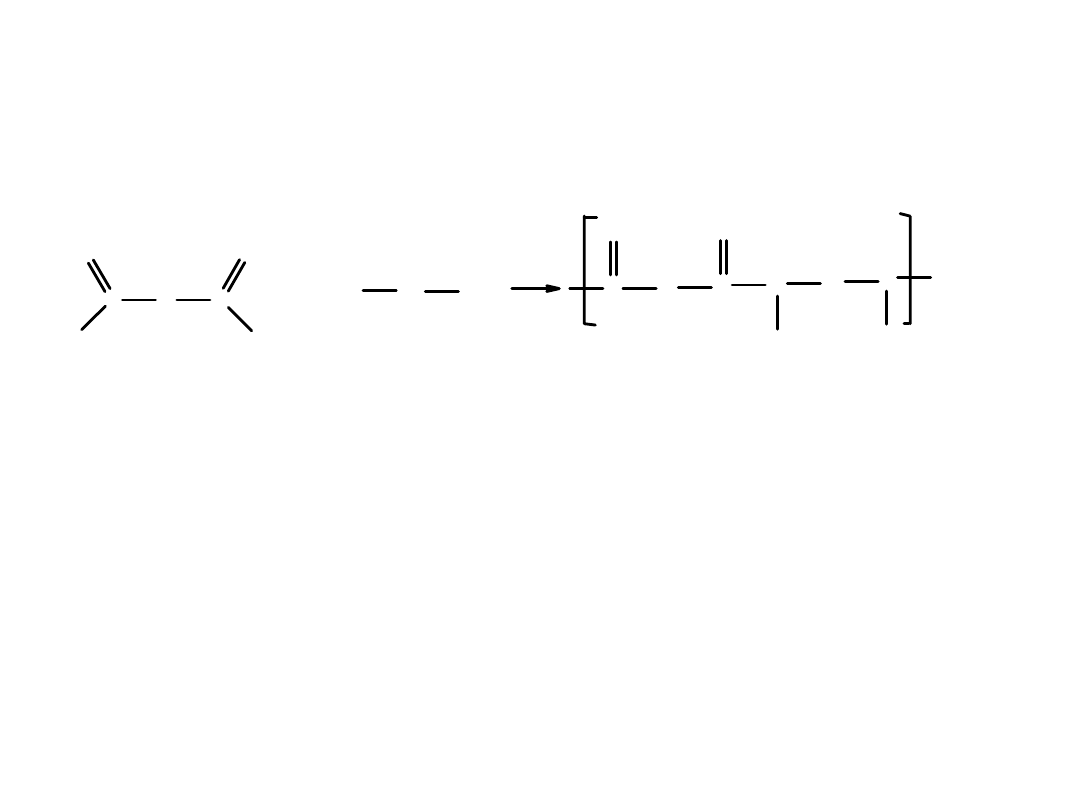
Reakcja polikondensacji, w której tworzy się nylon
C
C
O
O
OH
OH
NH
2
H
2
N
+
n
n
O
O
N
N
C
C
H
H
n
+ 2 H
2
O
R
R
R'
R'
Właściwości nylonu zależą od długości łańcuchów
R
i
R’
.
Najczęściej
R
ma 4 atomy C a
R’
– 6 atomów C.
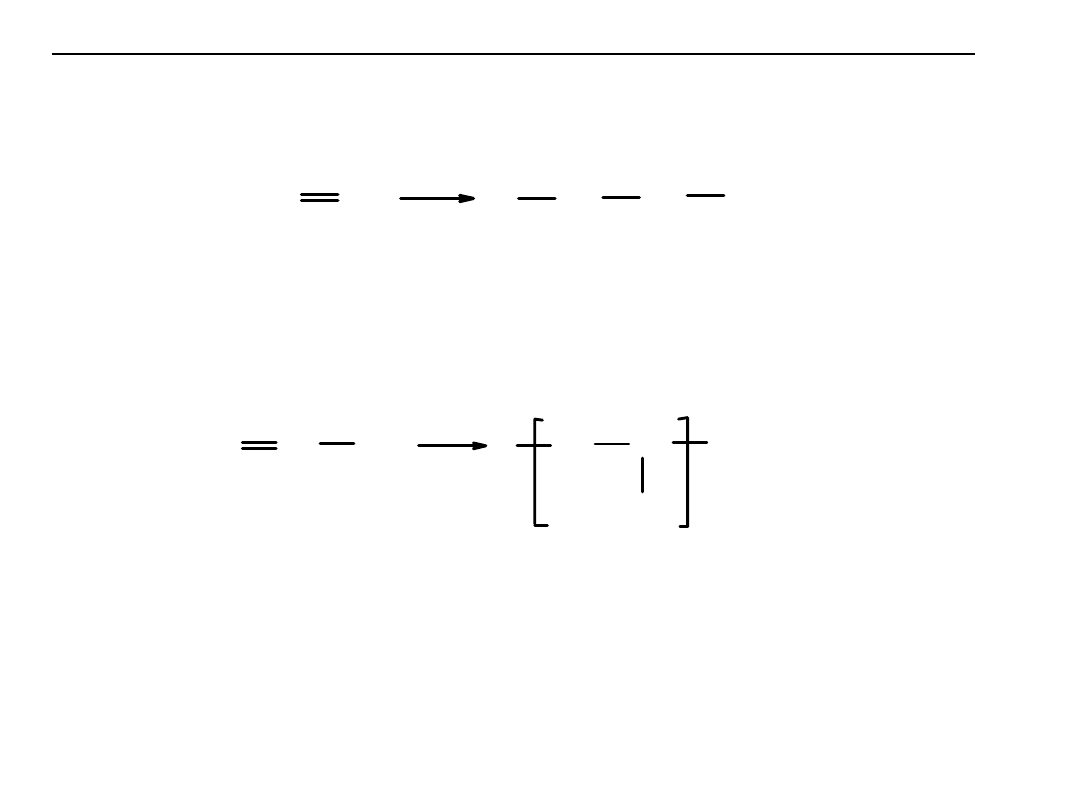
Inne polimery otrzymywane w reakcjach polimeryzacji:
Polietylen
– powstaje w reakcji polimeryzacji etylenu.
n CH
2
CH
2
kat.
CH
2
CH
2
[
]
n
Zastosowanie: opakowania, pojemniki na wodę i chemikalia, zabawki,
wyroby galanteryjne
Polipropylen
– powstaje w reakcji polimeryzacji propylenu.
Zastosowanie i właściwości podobne do etylenu.
n CH
2
CH
kat.
CH
2
CH
n
CH
3
CH
3
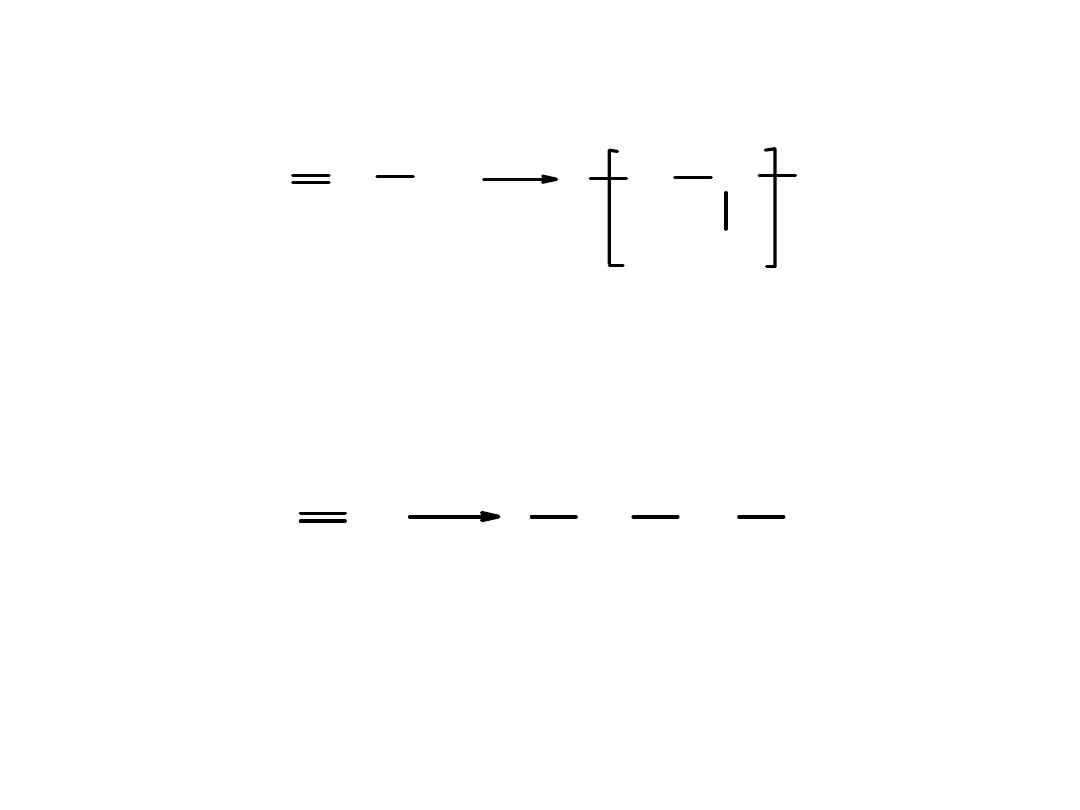
Polichlorek winylu (PVC, PCV)
– powstaje w reakcji polimeryzacji chloroetenu (chlorku winylu)
n CH
2
CH
kat.
CH
2
CH
n
Cl
Cl
Zastosowania:
płytki i wykładziny podłogowe, zabawki, opakowania, izolacja przewodów
elektrycznych.
Teflon
– powstaje w reakcji polimeryzacji tetrafluoroetylenu
n CF
2
CF
2
CF
2
CF
2
kat
[
]
n
Zastosowanie: teflon jest białym ciałem stałym o wysokiej odporności
chemicznej i cieplnej.
Niepalny. Używa się go do powłok reaktorów i naczyń kuchennych, uszczelek.
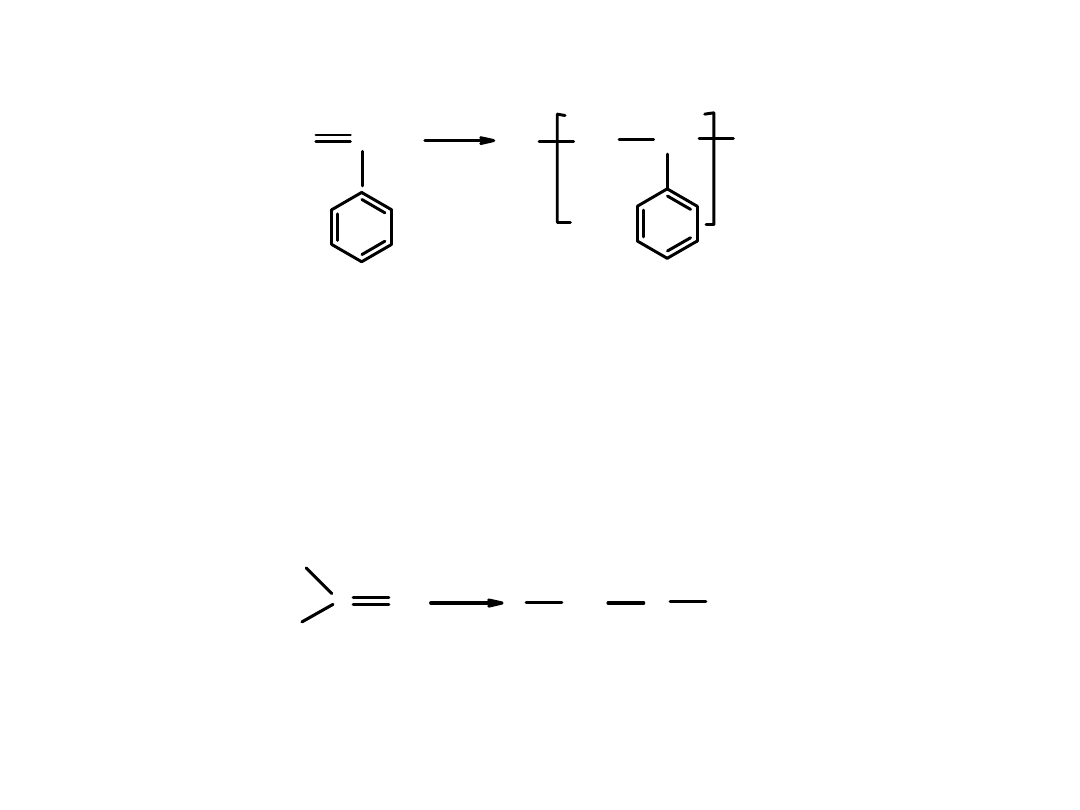
Polistyren
– powstaje w reakcji polimeryzacji styrenu
n CH
2
CH
CH
2
CH
n
kat
Zastosowanie: polistyren jest bezbarwnym przezroczystym ciałem stałym
o znacznej wytrzymałości mechanicznej ale kruchym. Palny.
Stosuje się go do wyrobu pojemników, opakowań, elementów gospodarstwa
domowego (odkurzacze, lodówki).
Styropian
– spieniony polistyren
Poliformaldehyd
– powstaje w reakcji polimeryzacji aldehydu mrówkowego
n
C
O
H
H
CH
2
O
[
]
n
Zastosowanie: dzięki dobrej wytrzymałości mechanicznej i cieplnej nadaje się
do wyrobu elementów precyzyjnych urządzeń (koła zębate, panewki łożysk).
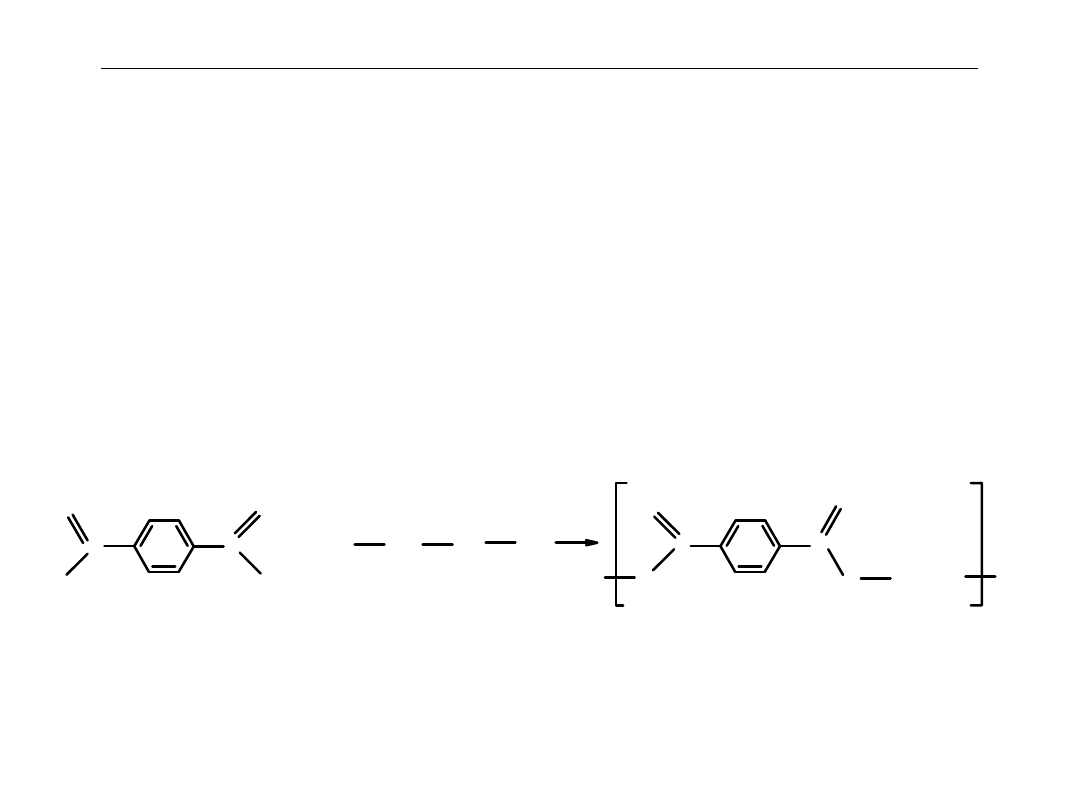
Polimery otrzymywane w reakcjach polikondensacji:
Otrzymywanie
nylonu
omówiono wcześniej. Nylon jest przykładem
poliamidu
.
Jego budowa przypomina budowę białka. Dzięki takiej budowie włókna
poliamidowe mają właściwości naturalnych włókien białkowych np. jedwabiu.
Poliestry
: najczęściej spotykany
politereftalan glikolu etylenowego,
inaczej
politereftalan etylenu
lub
PET
.
Produkuje się z niego głównie butelki i opakowania i włókna
elanę
.
Z włókien powstaje m.inn. tkanina
polar
.
Powstaje w reakcji polikondensacji kwasu 1,4-benzenodikarboksylowego
(
kwasu tereftalowego
) z
glikolem etylenowym
.
C
C
O
O
OH
OH
OH
HO
CH
2
CH
2
CH
2
CH
2
n
+
C
C
O
O
H
O
O
OH
n
n
+ 2n H
2
O
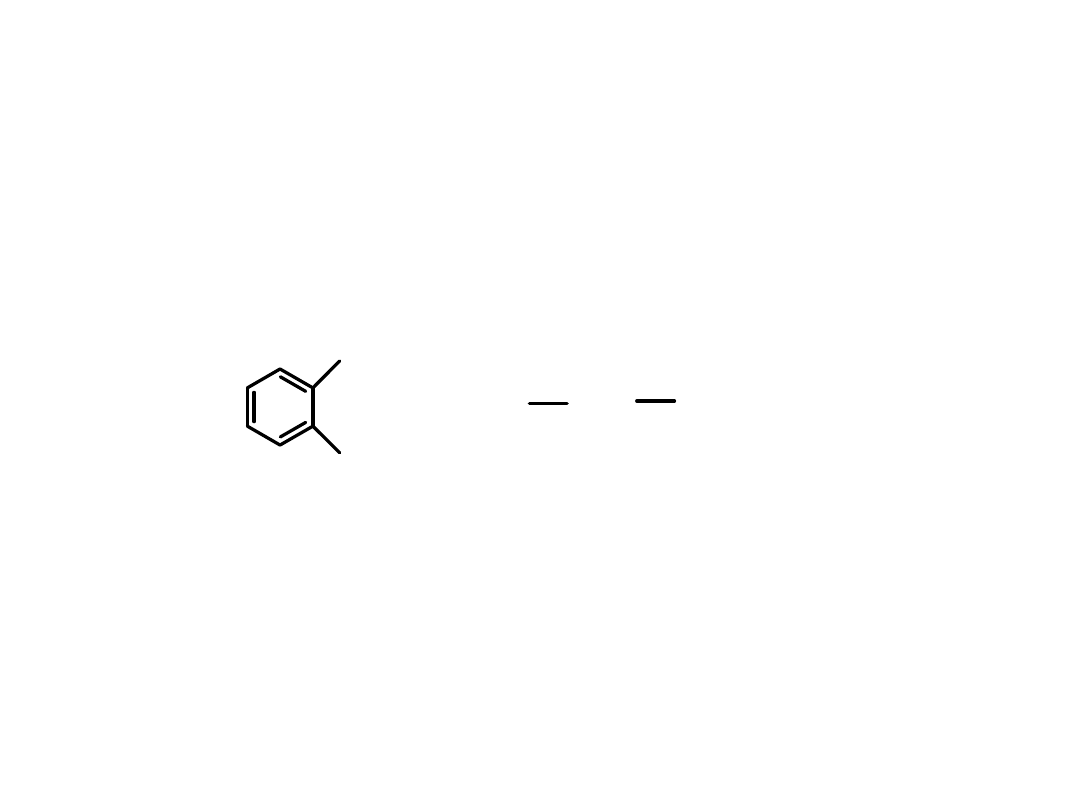
Poliestry o zbliżonej budowie, będące poliestrami kwasu
1,2-benzenodikarboksylowego (
kwasu ftalowego
)
i różnych
alkoholi wielowodorotlenowych
stosowane są do wyrobu farb
i emalii (farby ftalowe).
(CH
2
)
2
COOH
COOH
HO
OH
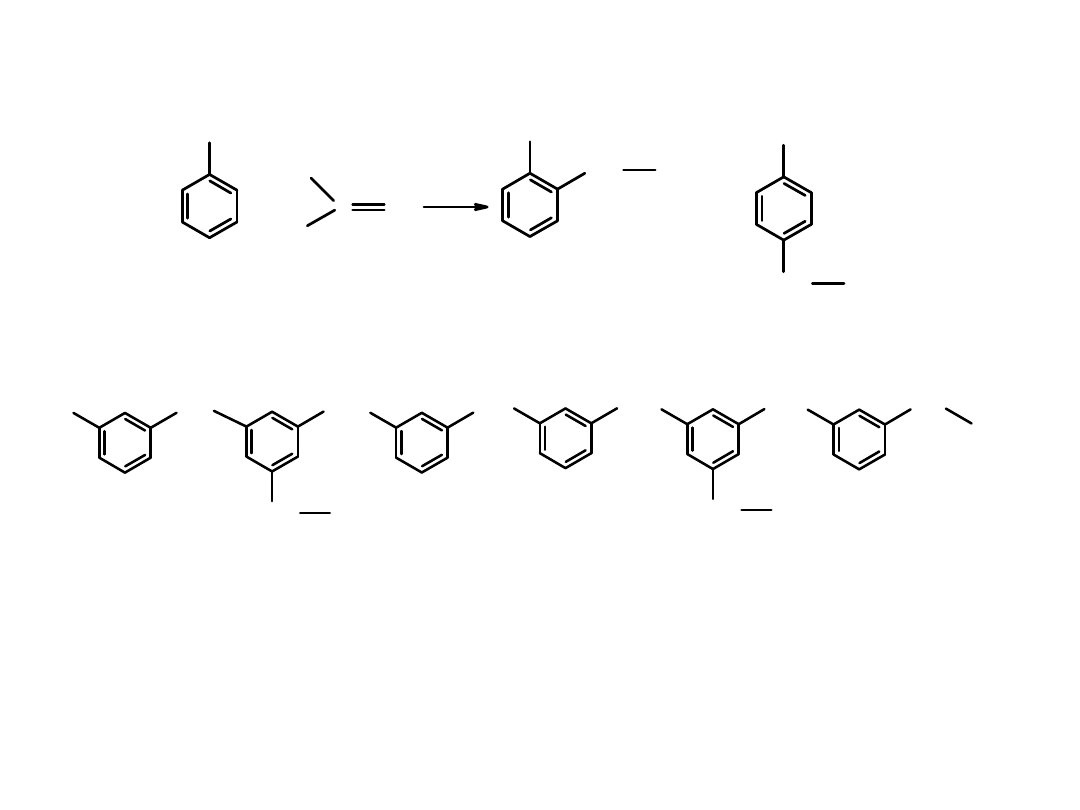
Żywica fenolowo-formaldehydowa
– powstaje w reakcji fenolu
z aldehydem mrówkowym.
OH
C
O
H
H
+
OH
OH
CH
2
OH
OH
CH
2
+
I etap
II etap: utworzone produkty reagują ze sobą lub z fenolem dając polimer –
żywicę
.
CH
2
CH
2
CH
2
CH
2
OH
CH
2
CH
2
CH
2
OH
CH
2
Polimer ma konsystencję półpłynną. Przekształca się go w wyroby użytkowe, nasycając nim
odpowiednie wypełniacze np. papier, tkaniny, pył drzewny i poddając prasowaniu
w podwyższonej temperaturze. Łańcuchy polimeru łączą się między sobą w
procesie sieciowania
i następuje
utwardzenie
żywicy.

Technologia chemiczna – procesy w przemyśle
Technologia chemiczna
– wiedza o procesach produkcyjnych, których celem jest przemiana
chemiczna surowców w produkty.
Celem technologii
jest opracowanie metod jak najlepszego wykorzystania surowców
i przerabiania ich z jak najmniejszym nakładem energii i kosztów.
Proces technologiczny
jest to zorganizowany zbiór czynności, w których surowiec zostaje
przetworzony w produkt.
Etapy
projektowania procesu technologicznego:
Opracowanie koncepcji chemicznej procesu
Opracowanie koncepcji technologicznej procesu
Wykonanie projektu instalacji przemysłowej
Każdemu projektowi powinna towarzyszyć analiza ekonomiczna.
Tylko opłacalne projekty
mają szanse na realizację.
Cechy
dobrego procesu technologicznego:
Jest
zapotrzebowanie
rynku na produkt
Produkcja według zaproponowanej metody jest
opłacalna
Nie narusza się praw osób trzecich (
patenty
)
Produkcja jest
przyjazna
dla środowiska

Przykłady procesów technologicznych
Wytwarzanie biogazu
Biogaz – w warunkach naturalnych powstaje jako gaz wysypiskowy
na wysypiskach odpadów lub gaz błotny na torfowiskach.
Biogaz
jest produktem
fermentacji metanowej
bez dostępu powietrza
za pomocą
bakterii
związków pochodzenia organicznego:
Ścieki
Odpady komunalne
Odchody zwierzęce
Gnojowica
Odpady przemysłu rolno-spożywczego
Biomasa
Substancje organiczne rozkładane są przez bakterie na substancje proste.
W procesie fermentacji do 60% substancji organicznej zamieniane jest w biogaz.

Przykłady procesów technologicznych
Wytwarzanie biogazu
Zgodnie z ustawą z roku 2005
definicja biogazu
brzmi:
„Biogaz to gaz pozyskany z biomasy, w szczególności z instalacji przeróbki
odpadów zwierzęcych lub roślinnych, oczyszczalni ścieków oraz składowisk
odpadów.”
Biogaz
powstaje z tzw.
odnawialnych źródeł energii
czyli biomasy otrzymywanej
z następujących źródeł:
Odpady organiczne na wysypiskach
Odpady zwierzęce w gospodarstwach rolnych
Osady ściekowe w oczyszczalniach ścieków

Skład biogazu
:
metan CH
4
55 – 75%, dwutlenek węgla CO
2
25 – 45%, poza tym azot N
2
,
wodór H
2
, siarkowodór H
2
S i tlen O
2
.
Biogaz powstaje w specjalnych
komorach fermentacyjnych i bioreaktorach
umieszczanych bezpośrednio na wysypiskach.
Celowa produkcja biogazu następuje również w komorach fermentacyjnych
biogazowni
.
Na przebieg procesu fermentacji
korzystnie wpływa
utrzymanie stałej
wysokiej temperatury,
wysokiej wilgotności (powyżej 50%),
korzystnego pH (powyżej 6,8) oraz ograniczenie dostępu
powietrza.
Pozostałość po fermentacji wykorzystuje się jako
nawóz
.
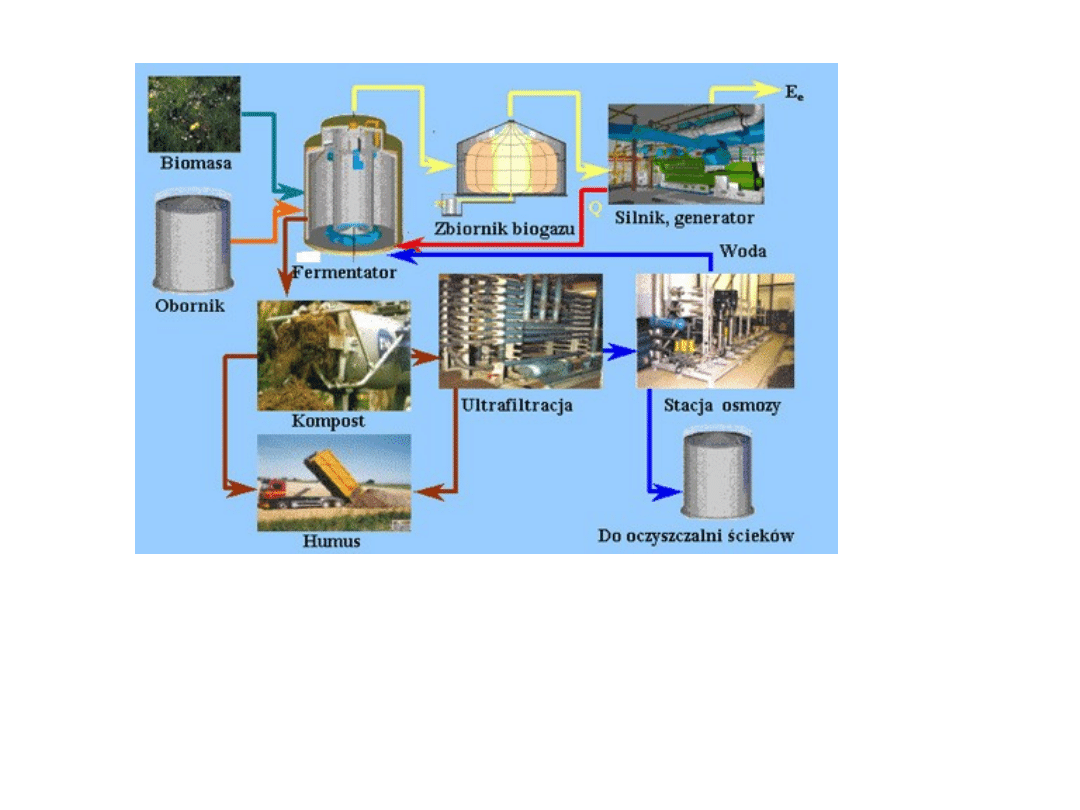
Schemat produkcji biogazu w biogazowni wiejskiej

Zaletami biogazowni rolniczych są:
•Zmniejszenie zużycia kopalnych surowców energetycznych oraz emisji związków
powstających podczas ich spalania,
•Redukcja emisji gazów cieplarnianych, podtlenku azotu i metanu,
•Poprawa warunków nawożenia pól uprawnych,
•Zniszczenie nasion chwastów, a więc zmniejszenie zużycia chemicznych środków ochrony roślin,
•Zmniejszenie ryzyka zanieczyszczenia wód gruntowych i powierzchniowych.
Zbiorniki biogazu

Produkcja kwasu siarkowego H
2
SO
4
Surowce
, z których można otrzymać kwas siarkowy:
Siarka rodzima
Siarczki metali, głównie piryty zawierające siarczek żelaza, siarczki cynku,
ołowiu i miedzi
Organiczne związki siarki występujące w ropie naftowej
Siarkowodór znajdujący się w niektórych złożach gazu ziemnego
W 20 wieku kwas siarkowy produkowano wykorzystując gips (CaSO
4
•2H
2
O).
Polski przemysł wykorzystuje
siarkę rodzimą
.
Wydobywanie siarki rodzimej
– metoda
otworowa
, czyli podziemny wytop
za pomocą gorącej wody, którą wtłacza się do złoża.
Stopiona siarka wypływa na powierzchnię po ciśnieniem wody
i jest magazynowana w ogrzewanych zbiornikach.

Produkcja kwasu siarkowego H
2
SO
4
Przetwarzanie siarki w kwas siarkowy:
I etap
–
utlenianie siarki
tlenem z powietrza. Reakcja jest silnie egzotermiczna
przebiega w fazie gazowej między parami siarki i tlenem.
S + O
2
SO
2
Siarkę wprowadza się do komory spalania w stanie ciekłym i
rozpyla
za pomocą
dysz na drobne krople. Zawiesina ciekłej siarki w strumieniu powietrza
przepływa przez
komorę spalania
, gdzie zachodzi reakcja utleniania do SO
2
.
Szybkość procesu zależy od wielkości kropel i prędkości ich ruchu wobec
otaczającego je gazu.
W celu przyśpieszenia spalania siarki, w piecu umieszcza się szereg przegród
(
szykan
), które wymuszają zmiany kierunku przepływu strumienia gazów
i wzmacniają burzliwy charakter przepływu.
W nowszych modelach reaktora stosuje się
piec cyklonowy
, w którym wytwarza
się wirowy ruch gazów.
W takim reaktorze występują silne turbulencje co zwiększa szybkość spalania siarki.

II etap:
utlenianie SO
2
do SO
3
Jest to silnie egzotermiczna reakcja odwracalna.
SO
2
+ 0,5 O
2
SO
3
Stosuje się nadmiar tlenu i
katalizator wanadowy
. Katalizator osadza się na stałym
nośniku o dużej powierzchni właściwej.
Technicznym
problemem jest odbiór ciepła
od reagujących gazów.
Odbiór ciepła musi być intensywny, ponieważ reakcja jest silnie egzotermiczna.
Rozwiązaniem jest umieszczenie
wymienników
ciepła.
W reaktorze znajduje się kilka warstw katalizatora, przez które przechodzą
reagujące gazy.
Za każdą warstwą gazy są ochładzane wymiennikiem ciepła.
Innym sposobem obniżenia temperatury jest doprowadzanie
zimnego powietrza
,
które mieszając się z gorącymi gazami obniża ich temperaturę pomiędzy kolejnymi
warstwami katalizatora.

III etap:
reakcja SO
3
z wodą
SO
3
+ H
2
O H
2
SO
4
Reakcja jest nieodwracalna, biegnie w umiarkowanej temperaturze i jest silnie
egzotermiczna.
Prowadzi się ją w
absorberze
. Gazy z II etapu składają się z SO
3
(ok. 10% mol.),
głównie z azotu pochodzącego z powietrza i tlenu.
Gazy te są absorbowane w roztworze kwasu siarkowego
tzn. reagują z wodą, która jest zawarta w rozcieńczonym kwasie.

Problemy techniczne
w III etapie:
1. Musi być odbierana duża ilość wydzielającego się
ciepła
2. Absorbowane gazy nie mogą zawierać wilgoci, ponieważ para wodna i SO
3
tworzą
mgłę
, której nie można skroplić do kwasu.
Ta kwaśna zawiesina trafia do atmosfery razem z gazami kominowymi
i jest przyczyną niszczenia środowiska.
Rozwiązaniem jest dokładne
osuszanie powietrza
używanego w I etapie
do utleniania siarki.
Ponadto kwas siarkowy, w którym przeprowadza się absorpcję, musi mieć
stężenie ok. 96-98%.
Po absorpcji SO
3
stężenie kwasu wzrasta o ok. 1%.

Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
Wyszukiwarka
Podobne podstrony:
Algebra Wykład 13 (11 01 11) ogarnijtemat com
Plan wykładu 3aaaa ogarnijtemat.com, Chemia
Plan wykładu dddddd ogarnijtemat com
Wykład 06 ogarnijtemat com
Plan wykładu 5aaaa ogarnijtemat.com, Chemia
Plan wykładu 4aaaaa ogarnijtemat.com, Chemia
Wykład 07 ogarnijtemat com
Wykład 10 ogarnijtemat com
Wykład 12 ogarnijtemat com
więcej podobnych podstron