
Materiały pochodzą z Platformy
Edukacyjnej Portalu
www.szkolnictwo.pl
Wszelkie treści i zasoby edukacyjne publikowane na łamach Portalu www.szkolnictwo.pl mogą być wykorzystywane przez jego
Użytkowników
wyłącznie
w zakresie własnego użytku osobistego oraz do użytku w szkołach podczas zajęć dydaktycznych. Kopiowanie, wprowadzanie zmian,
przesyłanie,
publiczne
odtwarzanie
i wszelkie wykorzystywanie tych treści do celów komercyjnych jest niedozwolone. Plik można dowolnie modernizować na potrzeby
własne
oraz
do
wykorzystania
w szkołach podczas zajęć dydaktycznych.

Enzymy - chemiczne regulatory
reakcji cz. II
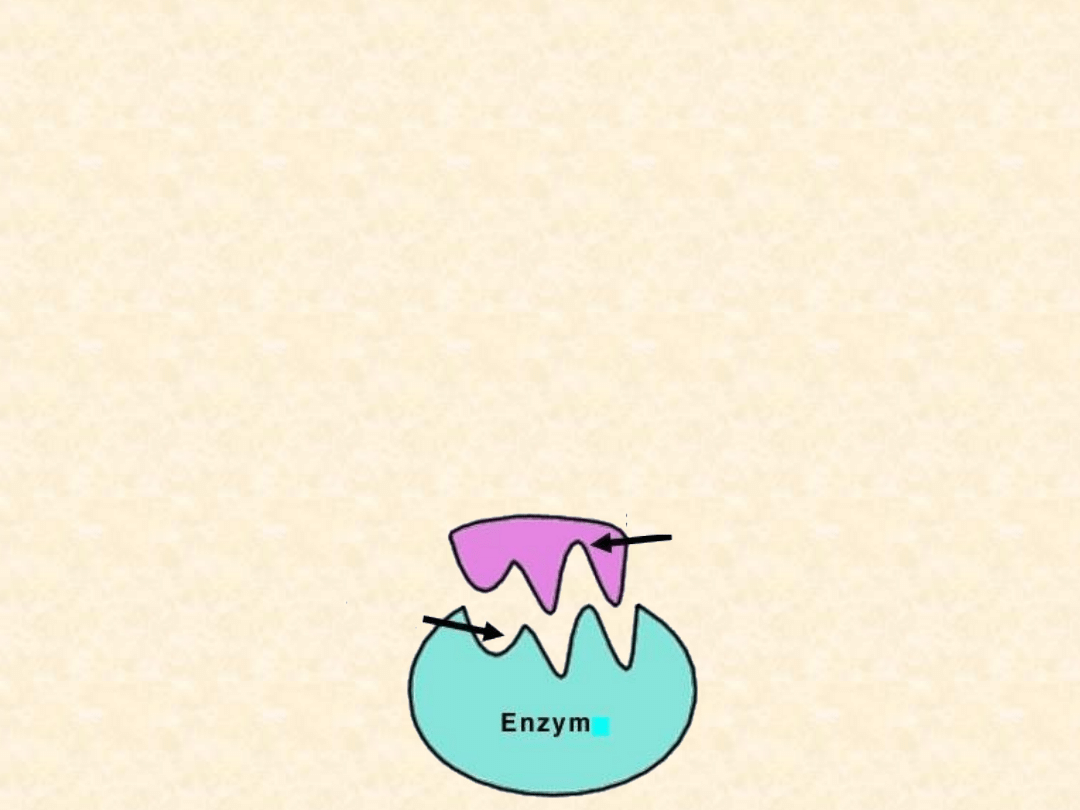
Działanie enzymu
Ponieważ warunkiem zajścia procesu enzymatycznego jest
połączenie się enzymu z substratem. Na powierzchni
części białkowej enzymu znajduje się miejsce, zwykle
złożone z aminokwasów zawierających dużą liczbę
wolnych grup funkcyjnych, za pomocą których dochodzi
do połączenia się enzymu z reagującymi substancjami.
Jest to tzw.
centrum (miejsce) aktywne
, dzięki któremu
powstaje kompleks enzym-substrat. Właśnie podczas
łączenia substratu z enzymem zachodzi obniżenia energii
aktywacji.
SUBSTRAT
MIEJSCE
AKTYWNE
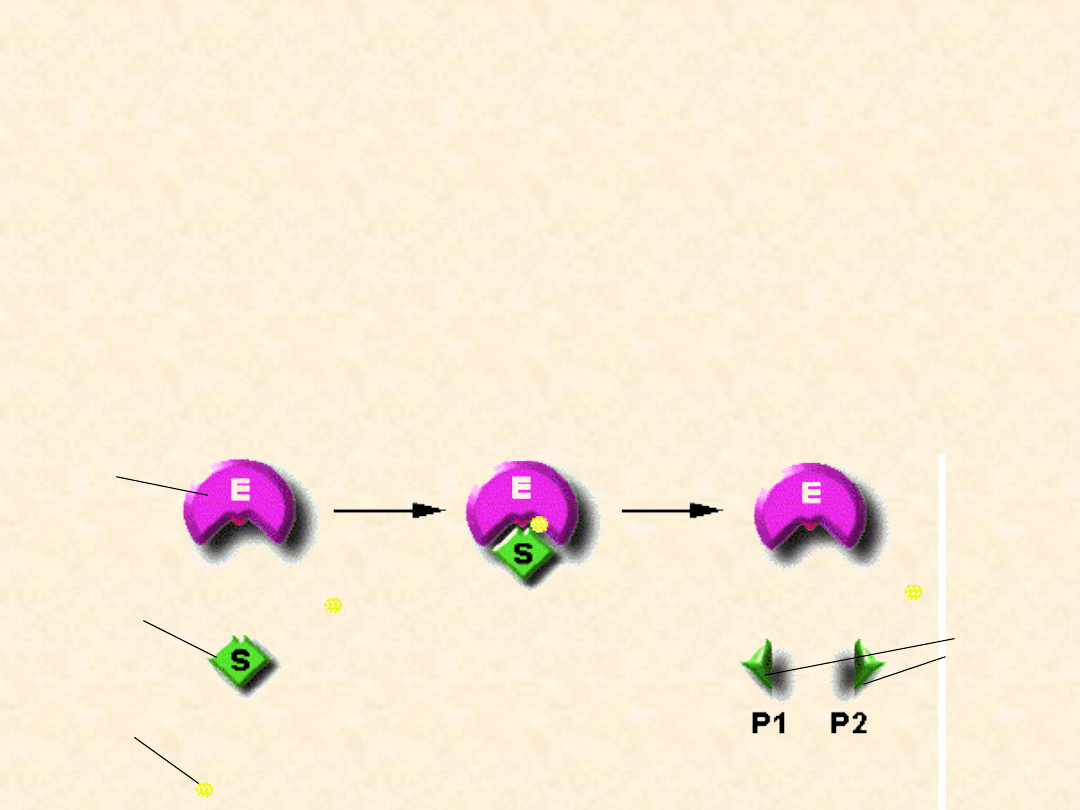
Kataliza enzymatyczna
Kataliza enzymatyczne przebiega według następujących
etapów:
• aktywowanie centrum i substratów, mające na celu ich
przestrzenne dopasowanie
• wytworzenie kompleksu enzym-substrat, co obniża
energię aktywacji i umożliwia szybkie zajście procesu
• oddzielenie enzymu od produktów
KOENZYM
SUBSTRAT
ENZYM
KOMPLEKS ENZYM-SUBSTRAT
PRODUKTY
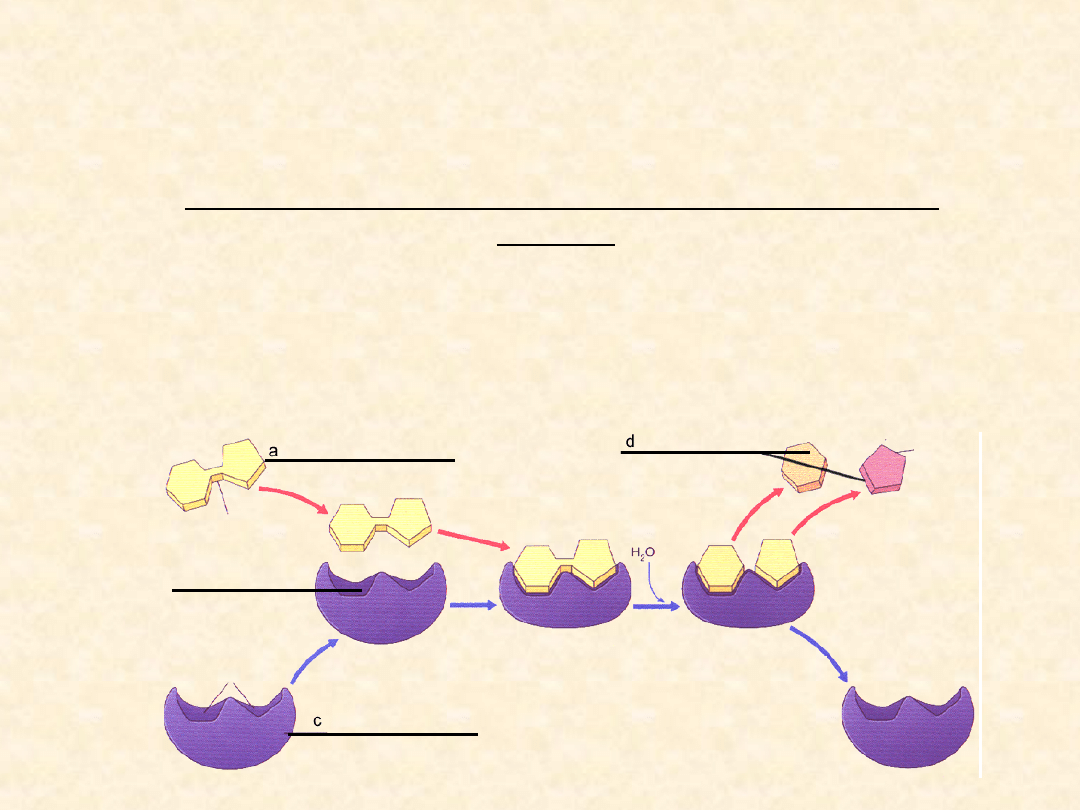
Modele tłumaczące tworzenie
się kompleksu enzym-substrat
Model "klucza i zamka" (ang. "Lock and key"
model)
Jak sugerował w roku 1894 Hermann Emil Fischer,
zarówno enzym jak i jego substraty są do siebie
geometrycznie dopasowane w taki sposób, że idealnie
pasują jeden do drugiego (jak "klucz i zamek") – enzym
(molekularny zamek) do którego pasują tylko specyficzne
substraty (molekularne klucze).
SUBSTRAT - KLUCZ
ENZYM - ZAMEK
CENTRUM AKTYWNE
PRODUKTY

Modele tłumaczące tworzenie
się kompleksu enzym-substrat
Model indukowanego dopasowania (ang. Induced
fit model)
Model ten zaproponowany przez Daniela E. Koshlanda
zakłada, że enzymy są zwykle dość elastyczne
strukturalnie, ponieważ grupy boczne aminokwasów
tworzące centrum aktywne podlegają rearanżacjom
przestrzennym, ściśle dopasowując swe pozycje do
wiązanego
substratu,
co
dopiero
umożliwia
przeprowadzenie katalizy.
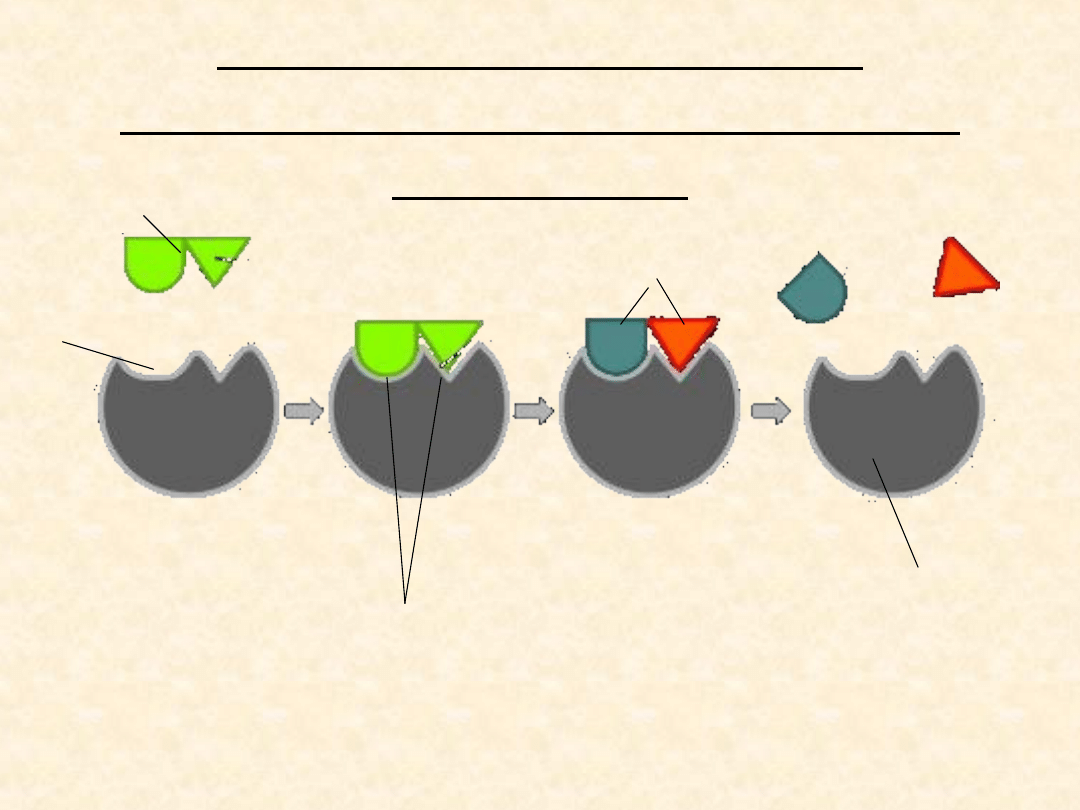
Model indukowanego
dopasowania (ang. Induced
fit model)
SUBSTRAT
CENTRUM AKTYWNE
CENTRUM AKTYWNE
DOPASOWUJE SIĘ
DO SUBSTRATU
PRODUKTY
ENZYM

Czynniki wpływające na
czynność enzymów
Wymienia się kilka determinant aktywności metabolicznej
enzymów:
• obecność inhibitorów
• temperatura
• pH środowiska
• utrwalacze
• stężenie reagujących składników
Pewne reakcje enzymatyczne wymagają obecności tzw.
aktywatorów, czyli substancji, które uczynniają enzymy.

Inhibitory enzymów
Substancje hamujące działanie enzymów to inhibitory
reakcji enzymatycznych. Rozróżnia się dwa typy inhibicji
(hamowania) enzymów: nieodwracalną i odwracalną. W
inhibicji nieodwracalnej inhibitor wiąże się kowalencyjnie z
enzymem tak silnie, że jego dysocjacja jest niemożliwa. W
tym
przypadku
enzym
ulega
unieczynnieniu
lub
całkowitemu zniszczeniu. W inhibicji odwracalnej szybko
osiągany jest stan równowagi w układzie enzym-inhibitor.
Wyróżnia się dwa typy inhibicji odwracalnej:
• kompetycyjna
• niekompetycyjna

Inhibicja kompetycyjna
Inhibitor kompetycyjny jest zazwyczaj strukturalnie podobny
do normalnego substratu danego enzymu. Dzięki temu
współzawodniczy z substratem o centrum aktywne.
Enzym może wiązać albo cząsteczkę substratu, albo
cząsteczkę inhibitora, ale nigdy obie równocześnie.
Inhibitor łączy się z centrum aktywnym tymczasowo i nie
uszkadza
enzymu.
Inhibicja
kompetycyjna
jest
odwracalna, gdyż jeżeli wzrośnie stężenie substratu,
działanie inhibitora zostaje przezwyciężone, ponieważ
duże stężenie substratu będzie z powodzeniem
współzawodniczyć z cząsteczką inhibitora o wiązanie się
w miejscu aktywnym.
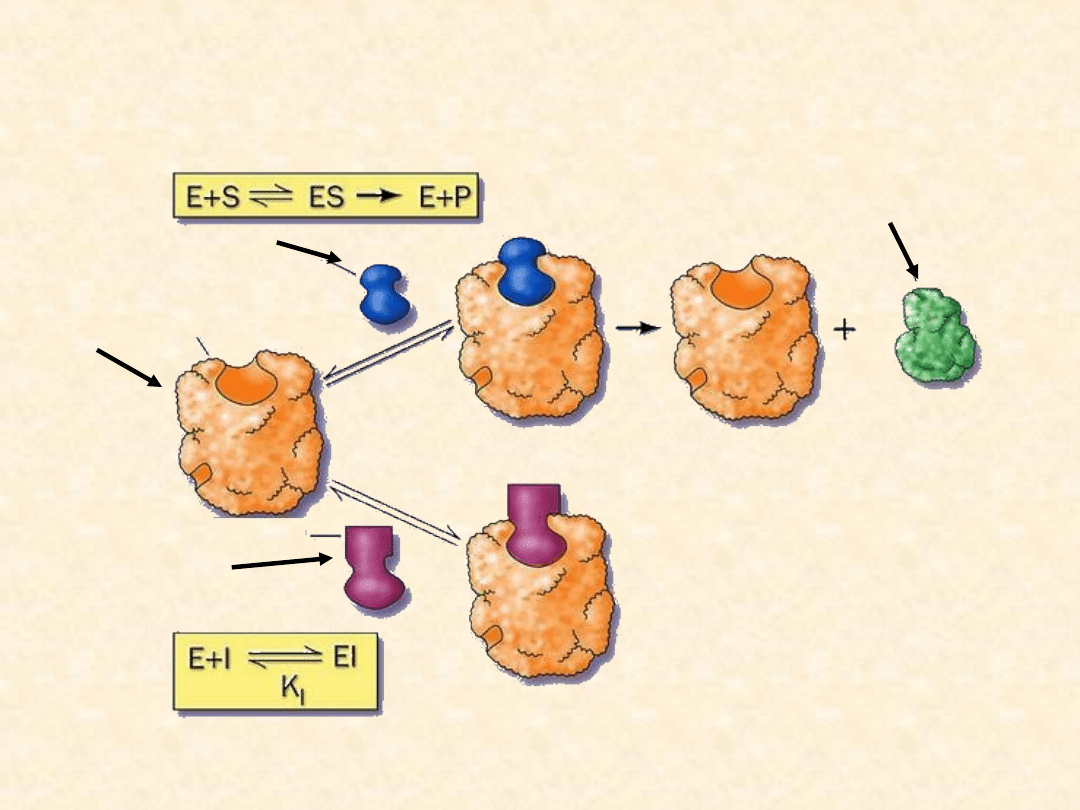
INHIBITOR
SUBSTRAT
ENZYM
PRODUKT
Inhibicja kompetycyjna

Inhibicja niekompetycyjna
Inhibitor niekompetycyjny wiąże się odwracalnie z enzymem
w innym miejscu niż centrum aktywne i powoduje zmianę
przestrzenną kształtu enzymu – substrat wprawdzie może
być wiązany, ale dalsza reakcja i tak ulega zahamowaniu.
Ponieważ inhibitor wiąże się w innym miejscu niż substrat,
enzym może wiązać albo inhibitor, albo substrat, lub też
inhibitor i substrat równocześnie. Efektu działania
inhibitora niekompetycyjnego nie można przezwyciężyć
przez zwiększenie stężenia substratu.
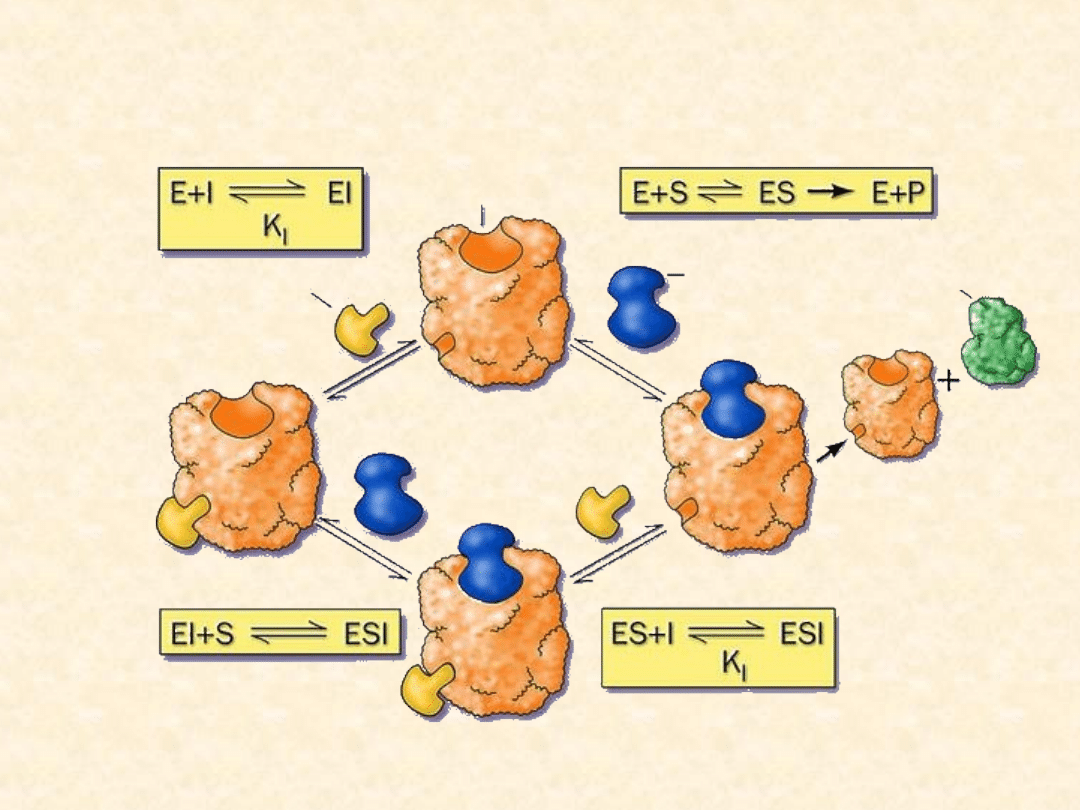
Inhibicja niekompetycyjna
INHIBITOR
ENZYM
SUBSTRAT
PRODUKT

Temperatura wpływa na
aktywność enzymów
Dla większości enzymów można określić tzw. optimum
termiczne, czyli temperaturę, w której szybkość
katalizowanych przez nie reakcji jest największa.
Temperatura
optymalna
dla
enzymów
organizmu
człowieka zbliżona jest do temperatury ciała.
Szybkość większości reakcji katalizowanych przez enzymy
wzrasta wraz ze wzrostem temperatury, lecz jednak do
pewnych granic. W temperaturze powyżej 50 °C
większość enzymów traci aktywność, gdyż pod wpływem
ciepła dochodzi do denaturacji białka, czyli do
nieodwracalnej zmiany jego trzeciorzędowej struktury.
Fakt ten wyjaśnia, dlaczego większość organizmów ginie
w tej temperaturze.

Dla każdego enzymu istnieje
optymalne pH
Dla większości enzymów można określić pewne optymalne
pH i wąski przedział pH , poza którym nie wykazują swej
aktywności. Większość enzymów dla optymalnego
katalizowania reakcji wymaga środowiska obojętnego,
zaś silne kwasy i zasady powodują ich unieczynnienie -
denaturację. Wiele enzymów wykazuje optimum
aktywności w pobliżu pH 6,8, ale ogólnie istnieje duże
zróżnicowanie optimum pH dla enzymów, wywołane
różnicami środowiska, w którym enzymom przyszło
działać. Na przykład enzym trawienny pepsyna jest
przystosowany do działania w kwaśnym pH żołądka
(około pH 2,0)
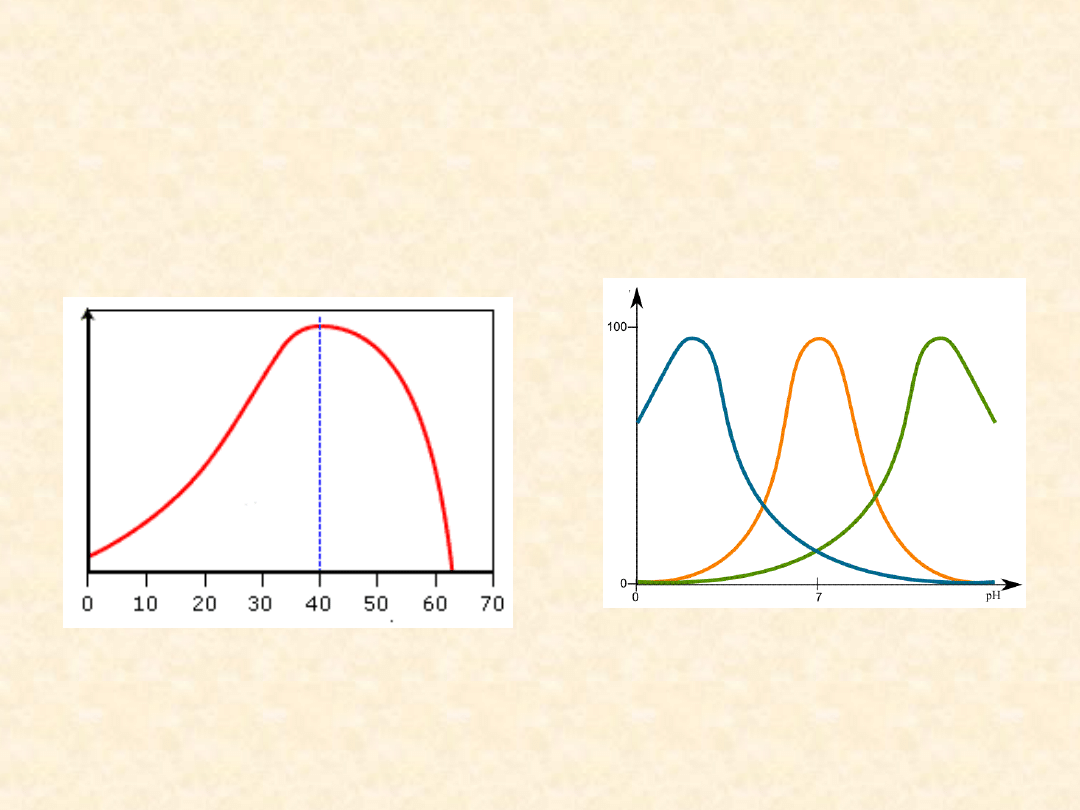
Wpływ temperatury i pH na
aktywność enzymów
temperatura °C
a
kt
y
w
n
o
ść
e
n
zy
m
u
a
kt
y
w
n
o
ść
e
n
zy
m
u
pH
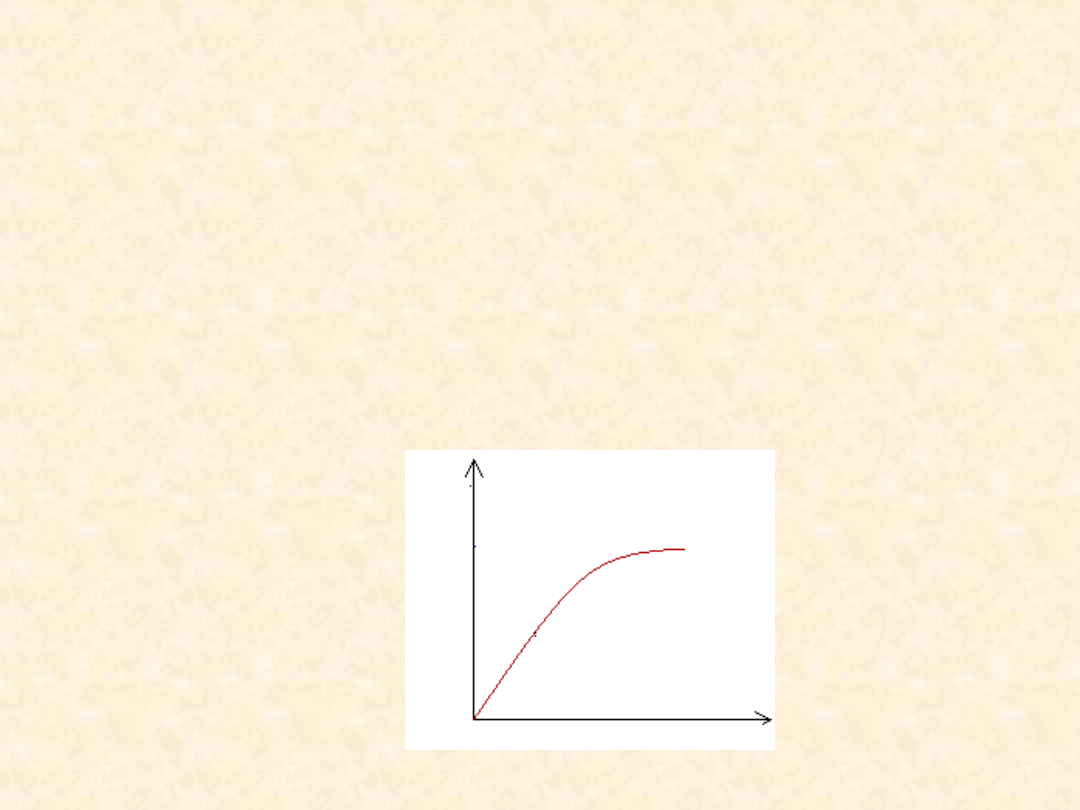
Stężenie reagujących składników
Normalny układ zależności szybkości działania enzymu od
stężenia substratu [S] polega na tym, że przy małych
stężeniach substratu podwojenie [S] powoduje podwojenie
początkowej szybkości V
0
. Jednakże przy większych
stężeniach substratu enzym ulega wysyceniu i dalszy
wzrost [S] powoduje tylko małą zmianę V
0
. Dzieje się tak,
ponieważ przy wysycających stężeniach substratu
praktycznie wszystkie cząsteczki enzymu zawierają
związany substrat.
V
0
[S]
Zależność między stężeniem substratu [S] a początkową szybkością
reakcji (V
0
)
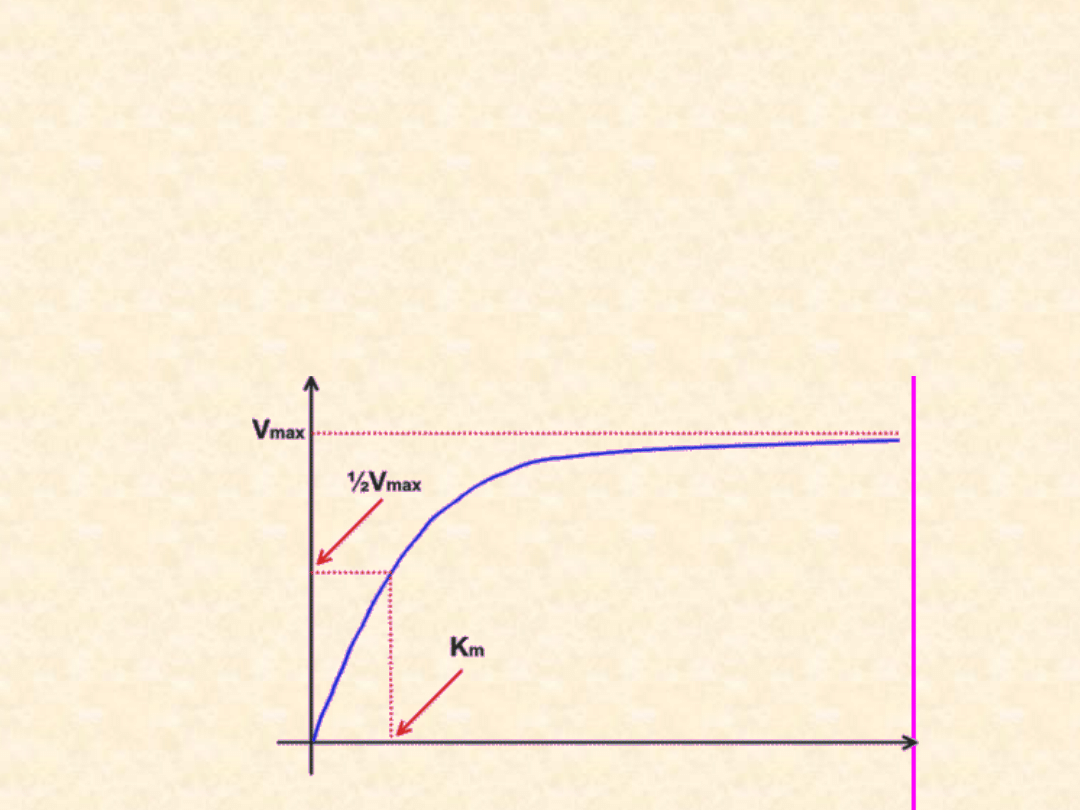
Stała Michaelisa - Menten
Zależność szybkości katalizowanej reakcji od stężenia
substratu jest określona krzywą Michaelisa - Menten.
K
m
oznacza stałą Michaelisa, tzn. takie stężenie substratu,
przy którym szybkość katalizowanej reakcji osiąga
połowę szybkości maksymalnej.
stężenie substratu
sz
y
b
ko
ść
r
e
a
k
cj
i

Enzymy nie działają pojedynczo, zwykle są one zorganizowane
w
kompleksy
enzymatyczne,
katalizujące
wiele
skomplikowanych przemian metabolicznych. W takich
przypadkach produkt działania jednego enzymu jest
substratem do działania następnego.
Szereg enzymów występuje wyłącznie w określonych
organelach,
np.
w
chloroplastach,
mitochondriach,
lizosomach. Jeżeli enzymy te można wykryć metodami
histochemicznymi, wówczas określa się je jako markery,
czyli znaczniki danych organeli. Na przykład dehydrogenaza
bursztynianowa – enzym cyklu Krebsa – jest markerem
wewnętrznej błony mitochondrium.

Aktywacja proteolityczna
Wiele enzymów jest syntetyzowanych jako większe,
nieaktywne formy prekursorowe o nazwie proenzymy
lub zymogeny. Aktywacja zymogenów polega na
nieodwracalnej hydrolizie jednego lub więcej wiązań
peptydowych. Na przykład protezay trzustkowe –
trypsyna, chymotrypsyna – pochodzą z prekursorów
zymogenowych
(odpowiednio
–
trypsynogenu,
chymotrypsynogenu) uaktywnianych proteolitycznie.
Przedwczesna aktywacja tych prekursorów wywołuje
ostre zapalenie trzustki. Również kaskada krzepnięcia
krwi obejmuje serię aktywacji różnych zymogenów.

Literatura:
• Danowski J., 2005. Repetytorium dla maturzystów i
kandydatów na wyższe uczelnie. Tom I. Medyk,
Warszawa
• Hames B.D., Hooper N.M., 2002. Krótkie wykłady.
Biochemia. PWN, Warszawa
• Pyłka – Gutowska E., 1995. Vademecum maturzysty.
Biologia. Oświata, Warszawa
• Villee i inni, 1996. Biologia. Multico, Warszawa
• Wiśniewski H, 1998. Biologia. Agmen, Warszawa
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
Wyszukiwarka
Podobne podstrony:
Enzymy chemiczne regulatory reakcji część II
Enzymy chemiczne regulatory reakcji część I
Enzymy chemiczne regulatory reakcji czesc I
Enzymy – chemiczne regulatory
Zasady Inżynierii Chemicznej, Mieczysław Serwiński, część II
Bogoczek R ''Technologia Chemiczna Organiczna'', część II
Część II wiązania chemiczne zadania(1)
Technologia Chemiczna Organiczna, Romuald Bogoczek, część II
Kinetyka reakcji enzymatycznych (część II)
Astma wywołana przez związki chemiczne o małej masie cząsteczkowej część II
Strukturalizm i stylistyka (część II)
Związki chemiczne produkty reakcji tlenków z wodą
Reakcje Hydrolizy, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia - Laborki
Pierwszy rok dziecka rozwój czesc II od urodzenia do 6 do 12 m cy
część II
ABC tynków część I i II
więcej podobnych podstron