Cz. II Materiał powtórzeniowy do sprawdzianu dla klas I LO - Wiązania chemiczne +
przykładowe zadania i proponowane rozwiązania
I. Wiązanie koordynacyjne
- semipolarne (donorowo-akceptorowe) - jest szczególnym
przypadkiem wiązania kowalencyjnego, wiążąca para elektronowa pochodzi od jednego
z atomów - donora (dawcy pary elektronowej, drugi atom jest akceptorem (biorcą) pary
elektronowej.
Uwaga:
- w cz. I przy analizie polarności cząsteczek CO i SO
2
przyjęto na potrzeby
zjawiska pewien zakres uproszenia.
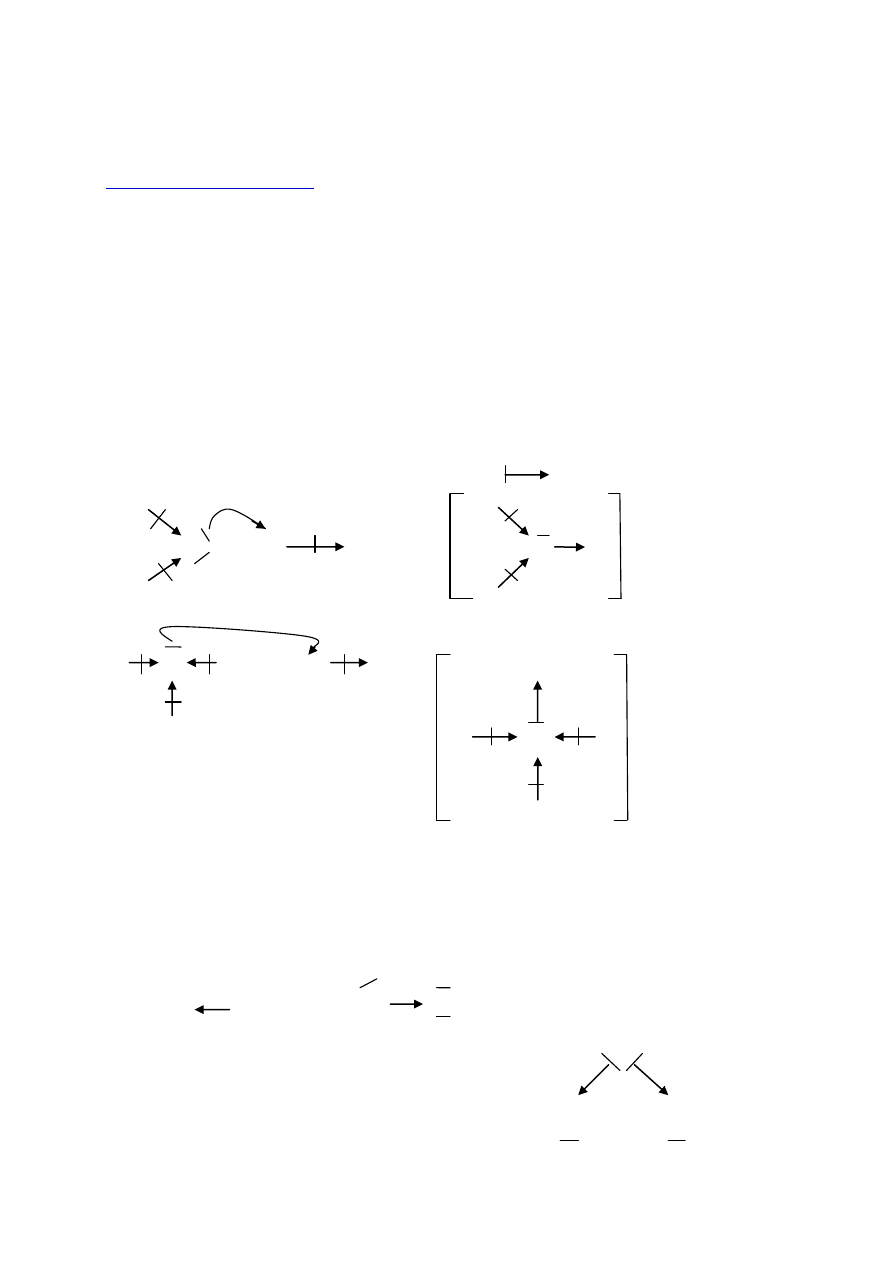
Analiza wiązań w kationie amonowym i kationie hydroniowym (oksoniowym)
-
kolor zielony - dotyczy donora
-
kolor czerwony - dotyczy akceptora
- graficzne oznaczenie wiązania koordynacyjnego:
δ+
H H +
2δ-
O
+
δ+
H
δ-
Cl
O
|
H
+ Cl
-
δ+
H H
kation hydroniowy H
3
O
+
H
N
H +
δ+
H
OH
H
+
H H
N
H + OH
-
H
kation amonowy NH
4
+
Zad. 1 Dla podanych cząsteczek tlenków: CO, SO
2
, SO
3
narysuj wzory elektronowe
kreskowe atom - donor, atom akceptor, zaznacz wiązania koordynacyjne:
Rozwiązanie:
- CO:
|
C
═ |
O
|
SO
2
:
S
|
O
|
SO
3
: | O |
//
||
O
S
|
O
| |
O
|

Zad. 2 Dla podanych cząsteczek kwasów tlenowych : HNO
3
, H
3
PO
4
, H
2
SO
4
narysuj
wzory elektronowe kreskowe atom - donor, atom akceptor, zaznacz wiązania
koordynacyjne:
Rozwiązanie:
O H ─ O
O
|
//
HNO
3
:
H O ─
N
H
2
SO
4
;
S
|
O
| H ─ O
O
|
H
3
PO
4
: H ─ O
H ─ O
P
|
O
|
H ─ O
Zad.3 Dla podanych cząsteczek kwasów tlenowych : HClO
2
, HClO
3
, HClO
4
narysuj
wzory elektronowe kreskowe atom - donor, atom akceptor, zaznacz wiązania
koordynacyjne
(zadanie do samodzielnego wykonania)
II. Wiązanie wodorowe
- szczególny przypadek wiązania koordynacyjnego, w którym
akceptorem pary elektronowej jest zawsze atom wodoru
w cząstce zw. chemicznego
a donorem atom dysponujący parami elektronowymi niewiążącymi (O, N, F)
w cząsteczce tego samego związku lub cząsteczce innego związku (np. woda - woda,
fluorowodór - fluorowodór, amoniak - amoniak (skroplony), woda - alkohol, , alkohol -
alkohol, w wyniku tworzenia się wiązań wodorowych cząsteczki ulegają asocjacji -
tworzą się aglomeraty, to z kolei wpływa na stan skupienia, temp, wrzenia.
Wiązania wodorowe występują w cząsteczkach białek, kwasach nukleinowych - tworząc
tzw. mostki wodorowe wpływają na ich strukturę przestrzenną i właściwości.
Oznaczenie graficzne wiązania wodorowego:
…….
lub
--------
Zad. 1. Przedstaw graficznie asocjat składający się z 2-ch cząsteczek metanolu (CH
3
-
OH) oraz asocjat składający się z cząsteczki wody i cząsteczki metanolu. Zaznacz
wiązanie wodorowe.
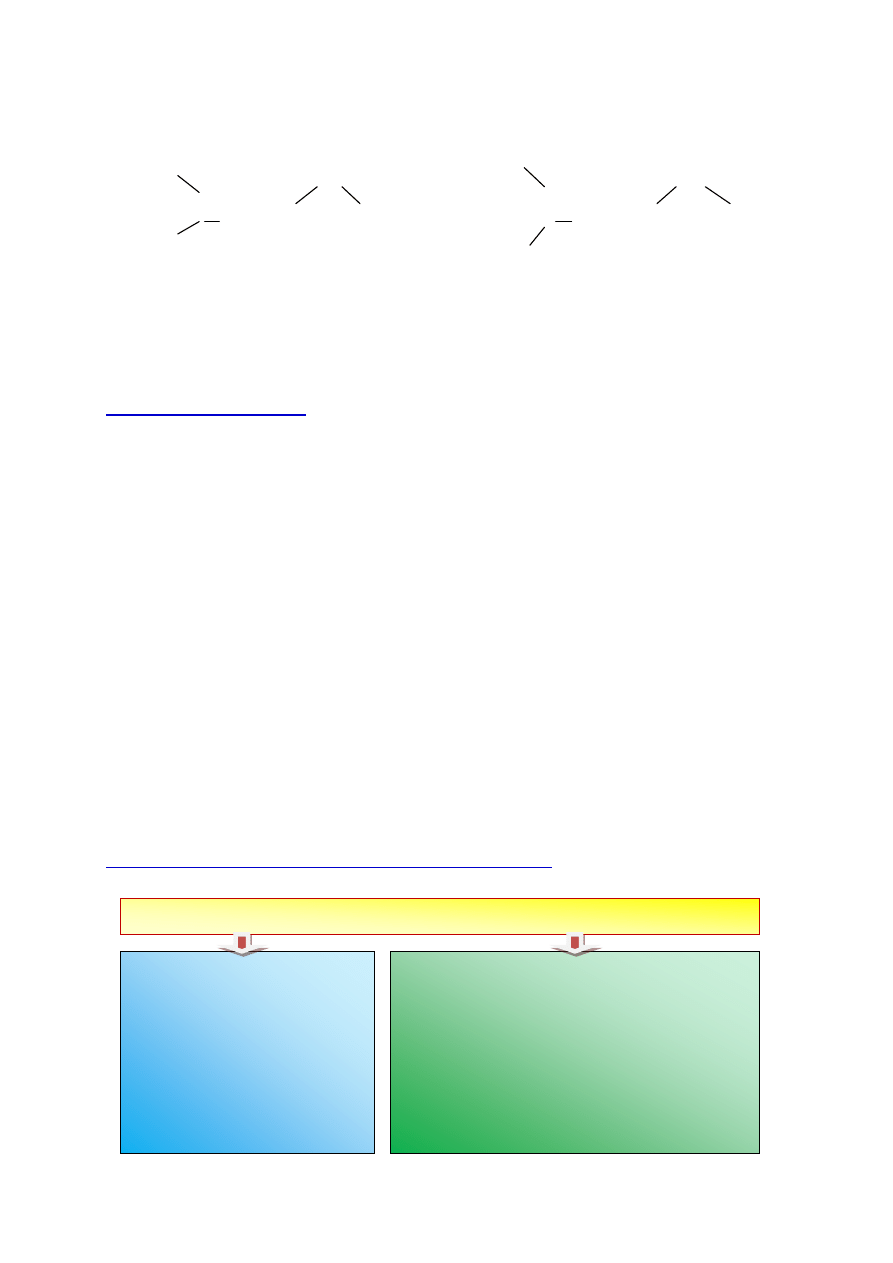
Rozwiązanie:
H
3
C |O| H
3
C |O|
O
|
......
H
CH
3
O
|
…..
H
H
H H
Zad. 2. Cząsteczki wody tworzą asocjaty usieciowane (rozgałęzione) natomiast
cząsteczki HF tworzą asocjaty liniowe. Przedstaw asocjat składający się z 4-ch
cząsteczek wody i asocjat składający się z 4-ch cząsteczek HF
(zadanie do samodzielnego
wykonania).
III. Wiązania metaliczne:
- występują w metalach i stopach metali, powstają między
kationami metali tworzących sieć krystaliczną (kryształ metalu) i elektronami (elektrony
zdelokalizowane) , które zajmują powłoki walencyjne wszystkich atomów metalu
tworzących sieć, elektrony mają zdolność swobodnego poruszania się między kationami
- jt. tzw. gaz elektronowy, który równoważy ładunek na kationach metalu. Wiązania
metaliczne nie są ukierunkowane. Obecność elektronów zdelokalizowanych nadaje
metalom swoiste właściwości fizyczne:
dobre przewodnictwo elektryczne i cieplne,
podatność na odkształcenia, kowalność, ciągliwość,
metaliczny połysk, maja wysokie tepm. topnienia (
wyjątek ; litowce, rtęć, gal,
ind)
IV. Oddziaływania van der Vaalsa -
są to słabe oddziaływania między cząsteczkami
niepolarnymi (miedzy dipolami wzbudzonymi - chwilowymi), siły te wpływają na stan
skupienia materii. Przykładem występowania w/w oddziaływań jest kryształ grafitu,
miedzy poszczególnymi warstwami grafitu (w których atomy węgla są powiązane ze
sobą 3 wiązaniami kowalencyjnymi) występują słabe oddziaływania
miedzycząsteczkowe, stąd grafit jest w odróżnieniu od diamentu miękki, tłustawy w
dotyku, jest przewodnikiem prądu.
IV. Wpływ wiązań chemicznych na właściwości substancji
1.
Związki kowalencyjne
- w stałym stanie skupienia tworzą dwa rodzaje kryształów
Kryształy
Kryształy cząsteczkowe -
S
8
,
SiH
4
: sieć tworzą cząsteczki
związku między którymi
występują słabe siły
oddziaływań
międzycząsteczkowych, mają
niskie temp. topnienia
Kryształy kowalencyjne
- diament, krzem,
german :sieć tworzą atomy powiązane
wiązaniami kowalencyjnymi, z reguły nie
przewodzą prądu, nie ulegają dysocjacji i
nie rozpuszczają się w rozpuszczalnikach
polarnych, dobrze rozpuszczają w
rozpuszczalnikach niepolarnych (benzyna),
mają wysokie temp. topnienia

2.
Wiązania kowalencyjne w tlenkach a charakter chemiczny tlenków
Im większy udział wiązań kowalencyjny w cząsteczkach, tym bardziej kwasowy ma
charakter określony tlenek
wzrost udziału wiązań kowalencyjnych
MnO - tl.
zasadowy
, MnO
2
- tl.
amfoteryczny
, MnO
3
- tl.
kwasowy
, Mn
2
O
7
-tl.
kwasowy
CrO - tl.
zasadowy
Cr
2
O
3
- tl.
amfoteryczny
, CrO
3
- tl.
kwasowy
SO
2
- tl.
kwasowy,
SO
3
- tl.
kwasowy
wzrost charakteru kwasowego tlenków
3.
Zawiązki jonowe
(
wyjątek HF
) w stanie stały tworzą sieć krystaliczną, którą tworzą
kationy metalu (
wyjątek kation amonowy NH
4
+
)
i aniony proste (np. O
2-
, Cl
-
, S
2-
, H
-
) lub
złożone (np. SO
4
2-
, HSO
4
-
, NO
3
-
, H
2
PO
4
-
, PO
4
3-
, OH
-
) otaczających się wzajemnie, ilość
ładunków dodatnich na kationach jest równoważona przez ładunki ujemne na anionach.
Związki jonowe dobrze rozpuszczają się w wodzie, w stanie stałym nie przewodzą prądu
elektrycznego, stopione lub rozpuszczone w wodzie są przewodnikami prądu, wiązania
są wiązaniami mocnymi, stąd z reguły związki jonowe mają wysokie temp. topnienia.
Im większy udział wiązań jonowych w tlenku, wodorku lub wodorotlenku tym silniejszy
ich charakter zasadowy.
4.
Związki o wiązaniach kowalencyjnych spolaryzowanych
- głównie gazy lub ciecze,
dobrze rozpuszczalne w rozpuszczalnikach polarnych (np. w wodzie), dość łatwo dające
się skroplić (np. amoniak).
Wyszukiwarka
Podobne podstrony:
Wiązania chemiczne (II)
Część II zadania
Enzymy chemiczne regulatory reakcji część II
03 Wiazania chemiczne II rzedui Nieznany (2)
Bogoczek R ''Technologia Chemiczna Organiczna'', część II
Czesc I wiazania chemiczne zada Nieznany
Enzymy chemiczne regulatory reakcji czesc II
Wiązania chemiczne (II)
Technologia Chemiczna Organiczna, Romuald Bogoczek, część II
zadania wiązania chemiczne liceum
Astma wywołana przez związki chemiczne o małej masie cząsteczkowej część II
Część II zadania
Zasady Inżynierii Chemicznej, Mieczysław Serwiński, część II
3 WIAZANIA CHEMICZNE II cz
Wyklad 4 Wiazania chemiczne w cialach stalych
Strukturalizm i stylistyka (część II)
więcej podobnych podstron