
Materiały pochodzą z Platformy
Edukacyjnej Portalu
www.szkolnictwo.pl
Wszelkie treści i zasoby edukacyjne publikowane na łamach Portalu www.szkolnictwo.pl mogą być wykorzystywane przez jego
Użytkowników
wyłącznie
w zakresie własnego użytku osobistego oraz do użytku w szkołach podczas zajęć dydaktycznych. Kopiowanie, wprowadzanie zmian,
przesyłanie,
publiczne
odtwarzanie
i wszelkie wykorzystywanie tych treści do celów komercyjnych jest niedozwolone. Plik można dowolnie modernizować na potrzeby
własne
oraz
do
wykorzystania
w szkołach podczas zajęć dydaktycznych.

Elektronowa teoria
wiązania
chemicznego
Lewisa - Kossela

KONSEKWENCJE BUDOWY ATOMU DLA WŁAŚCIWOŚCI
PIERWIASTKA
Najbardziej zewnętrzne podpowłoki elektronowe atomu nazywa się
powłoką walencyjną.
Powłokę walencyjną tworzą podpowłoki o zbliżonej energii, zazwyczaj są to
orbitale: s, s i p lub s i d.
Elektrony położone na powłoce walencyjnej nazywamy
elektronami
walencyjnymi
.
ENERGIA JONIZACJI
Energia jonizacji
jest to energia potrzebna do oderwania
jednego elektronu od atomu i przeniesienia go do
nieskończoności.
W zależności od liczby oderwanych elektronów rozróżnia się
pierwszą, drugą trzecią energię jonizacji.
Energia potrzebna do oderwania elektronu zależy od jego odległości
od
jądra atomowego oraz od ładunku jądra (prawo Coulomba).
Wraz ze wzrostem ładunku jądra rośnie siła przyciągania elektronów
i dlatego
energia jonizacji powiększa się w obrębie okresu.
W tej samej grupie układu okresowego maleje energia
jonizacji przy wzroście promienia atomowego.
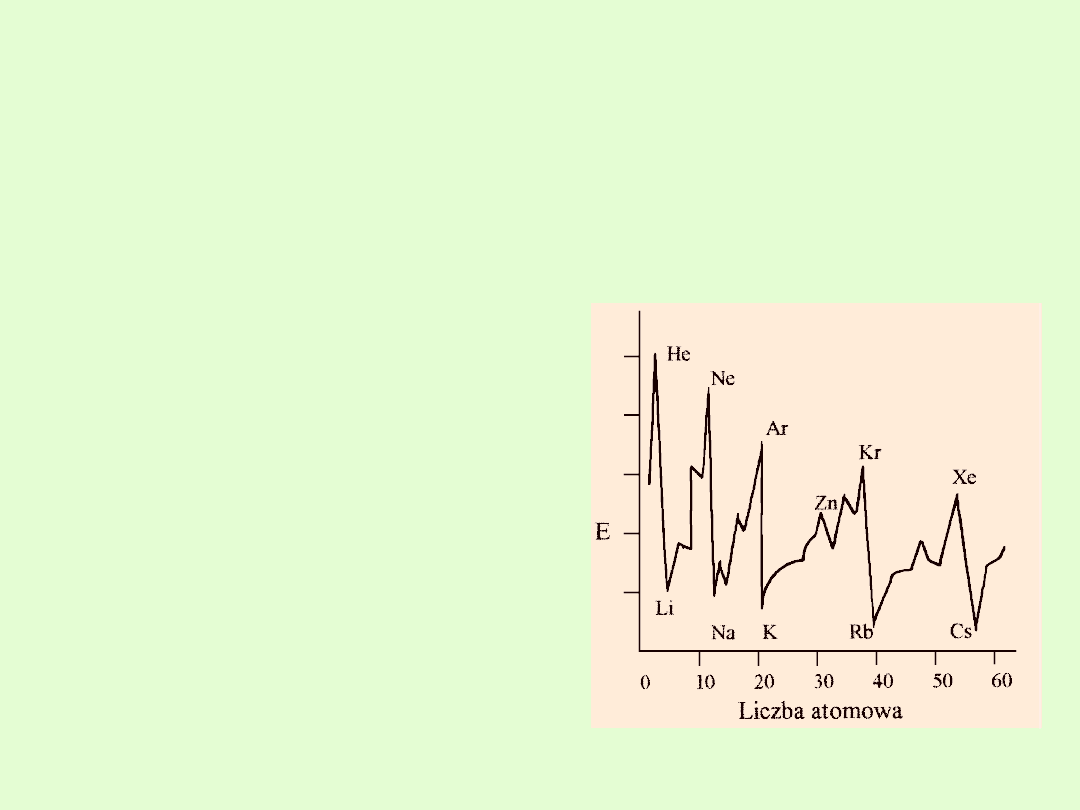
Najwyższe I energie jonizacji mają
gazy szlachetne, a najniższe
pierwiastki 1 grupy układu
okresowego.
Dla dużych atomów, których
powłoki walencyjne mają podobne
energie, wartości I energii jonizacji
nie zmieniają się tak znacznie, jak
w atomach o małej liczbie
atomowej.
Pierwszym potencjałem jonizacyjnym nazywamy energię potrzebną do
przemiany M -> M
+
, drugim - do przemiany M
+
-> M
2+
, a trzecim - do
przemiany M
2+
-> M
3+
.
A + energia I → A
+
+ e
A+ + energia II → A
2+
+ e
A2+ + energia III → A
3+
+ e
energia I << energia II << energia III
Energię jonizacji podajemy w eV/atom lub kJ/mol
POWINOWACTWO ELEKTRONOWE
Powinowactwo elektronowe
wyraża ilość energii wydzielanej
podczas przyłączenia się elektronu do obojętnego atomu w
stanie gazowym.
X + e = X
-
+ energia
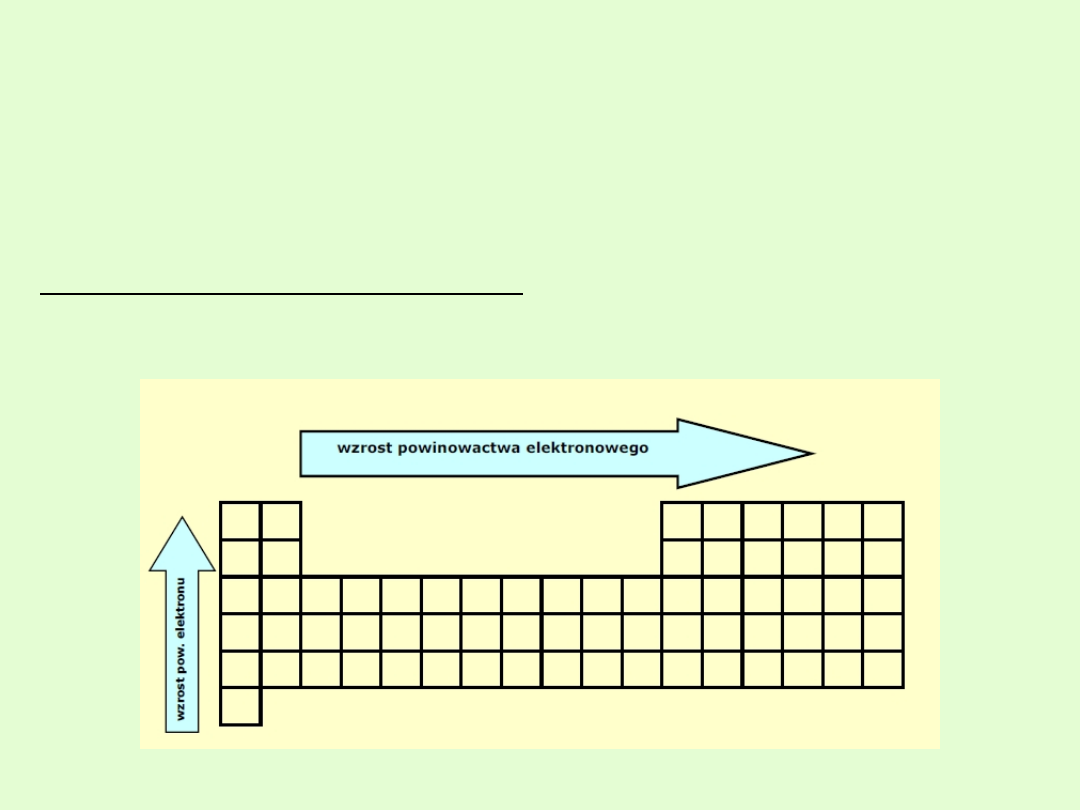
Wraz ze wzrostem liczby atomowej:
1. W obrębie okresu powinowactwo elektronowe wzrasta ( maleje
promień atomu).
2. W obrębie grupy powinowactwo elektronowe maleje ( wzrasta promień
atomu).
W przeciwieństwie do potencjału jonizacyjnego, powinowactwo
elektronowe można zmierzyć tylko w nielicznych przypadkach i to
niezbyt dokładnie.
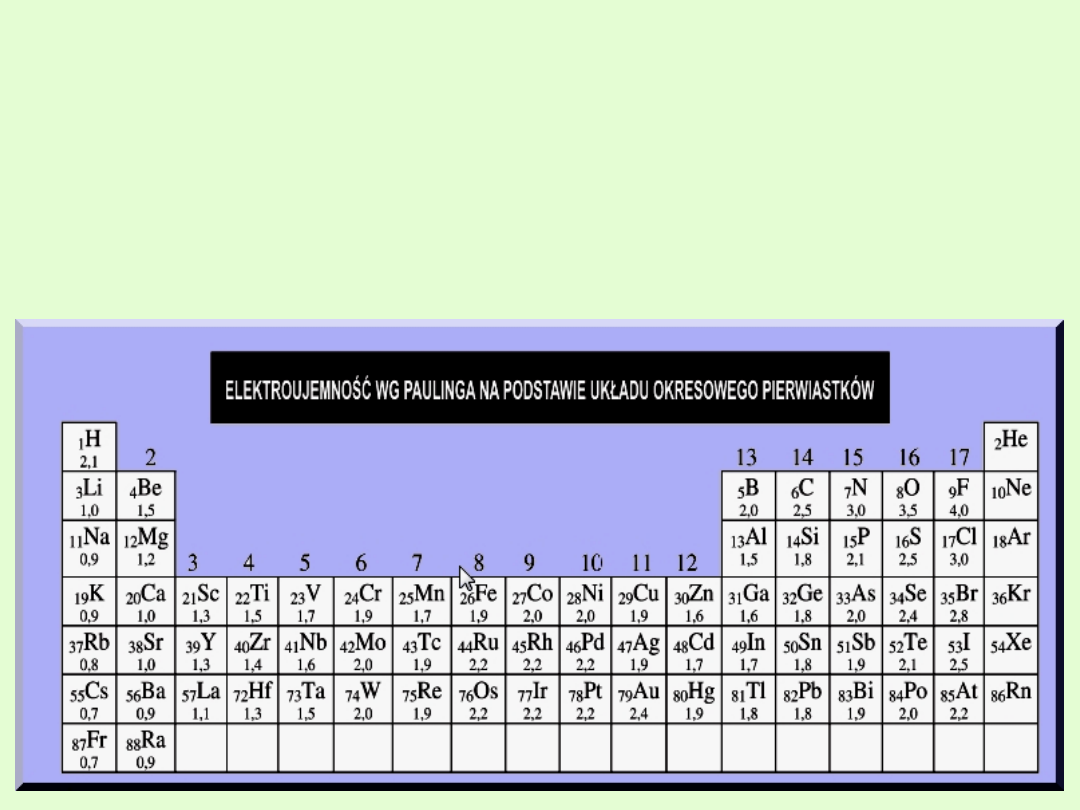
Pauling ułożył skalę elektroujemności opartą na wartościach wiązań.
Posługując się wartościami energii jonizacji EJ oraz powinowactwa
elektronowego PE można obliczyć elektroujemności X w skali Paulinga
(metoda Mullikena)
Elektroujemność
to miara tendencji do przyciągania elektronów
przez atomy danego pierwiastka, gdy tworzy on związek
chemiczny z atomami innego pierwiastka.

Elektroujemność wolnego atomu jest wielkością stałą. W wyniku
tworzenia związków ulega zmianie i zależy od rodzaju i liczby
związanych z nim innych atomów.
Pojęcie elektroujemności jest użyteczne do określenia typu
wiązania w związku, warto więc uwzględnić poniższy podział.
TYP WIĄZANIA
RÓŻNICA ELEKTROUJEMNOŚCI
∆ x
Kowalencyjne
0,0 ≤ ∆ x < 0,4
Kowalencyjne spolaryzowane
0,4 ≤ ∆ x < 1,7
Jonowe
∆ x ≥ 1,7
Przykład
atom H = 2,1 atom Cl = 3,0 ∆ x = 3,0 – 2,1 = 0,9
Atom Na = 0,9 atom Cl = 3,0 ∆ x = 3,0 – 0,9 =
2,1
atom H = 2,1 atom Cl = 3,0 ∆ x = 3,0 – 2,1 = 0,9
Atom Na = 0,9 atom Cl = 3,0 ∆ x = 3,0 – 0,9 =
2,1

WIĄZANIA CHEMICZNE
Wiązanie chemiczne
jest to wzajemne oddziaływanie rdzeni
atomowych i elektronów walencyjnych tworzących cząsteczkę
chemiczną lub makroskopowy zbiór cząsteczek.
Tworzenie wiązań jest wywołane dążeniem układu do
zmniejszenia posiadanej energii i polega na:
Przekształceniu się atomów w jony dodatnie i ujemne
Przekształcenie się atomów w cząsteczki kowalencyjne
Przekształcenie się atomów w zbiory zlokalizowanych kationów i
zdelokalizowanych elektronów.
W powstawaniu wiązań chemicznych mogą brać udział
elektrony walencyjne, do których należą:
W atomach pierwiastków bloku s i p elektrony zewnętrznej powłoki
W atomach pierwiastków bloku d elektrony s powłoki zewnętrznej i
elektrony d powłoki przedostatniej
W atomach pierwiastków bloku f elektrony s powłoki zewnętrznej ,
elektrony d powłoki przedostatniej i elektrony f powłoki drugiej od
zewnątrz.
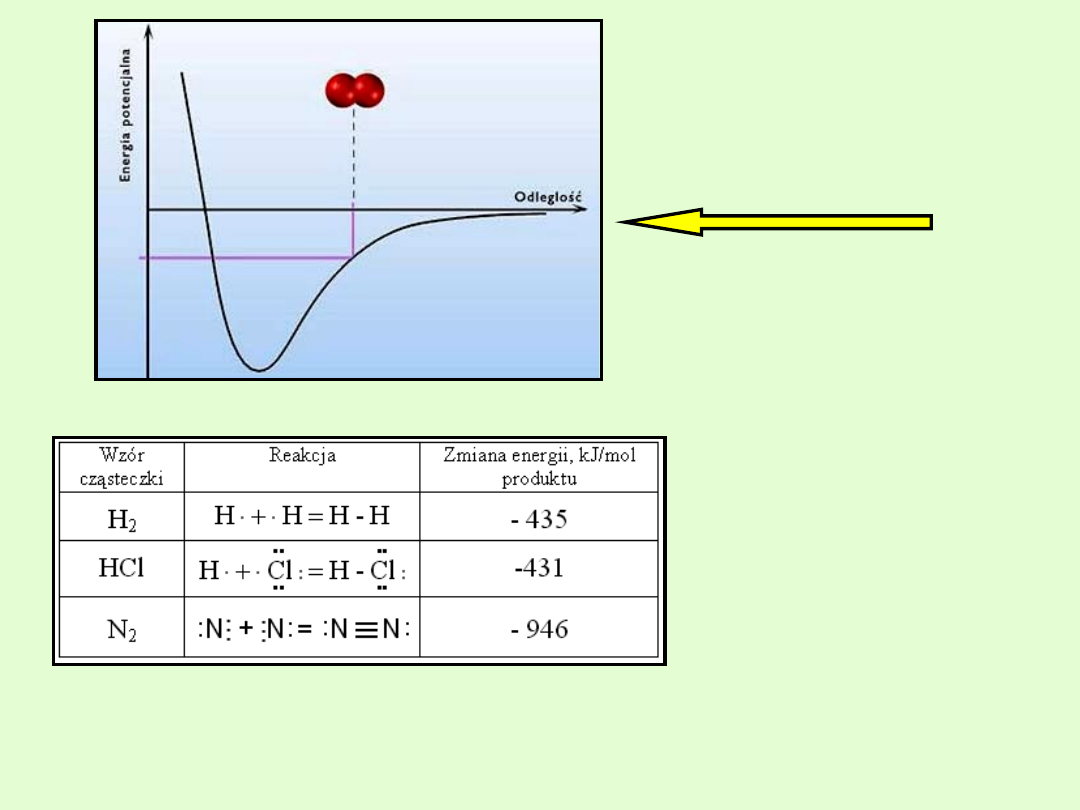
Zmiana energii układu
podczas tworzenia
wiązania chemicznego.
Zmiana energii układu
przy powstawaniu
cząsteczek związków
chemicznych.
Ujemny znak wartości zmiany energii świadczy o obniżeniu się energii
układu przy zajściu omawianych reakcji.
TEORIE WIĄZAŃ CHEMICZNYCH
TWORZENIE
WIĄZAŃ CHEMICZNYCH
Elektronowa teoria
wiązania chemicznego
Kwantowa teoria wiązania
chemicznego
Pionierem rozwoju teorii wiązania
chemicznego był R. Abegg, który
sformułował teorię oktetu.
W 1916 r. W. Kassel opisał wiązanie
jonowe, a G.Lewis wiązanie
kowalencyjne.
Jednym z podstawowych założeń obu
tych
teorii było przyjęcie, że w przypadku
helu
dwa elektrony walencyjne zapewniają
szczególną trwałość atomom tych
pierwiastków, a w przypadku
pozostałych gazów szlachetnych
osiem elektronów walencyjnych.
Kwantowa teoria wiązania
chemicznego
w odróżnieniu od teorii
elektronowej
stosowana jest w chemii
kwantowej
do opisu wiązań chemicznych.
Stosuje się tutaj dwa sposoby
opisu
elektronów w cząsteczce, tj.
metodą orbitali molekularnych
metodą wiązań walencyjnych

REGUŁA OKTETU I DUBLETU
Reguła oktetu
W procesie tworzenia wiązań chemicznych atom oddaje,
pobiera lub uwspólnia taką ilość elektronów aby uzyskać 8
elektronów – oktet.
Atomy helowców, z wyjątkiem He (dublet) zawierają oktet w powłoce
zewnętrznej, co wyjaśnia ich bierność chemiczną. W przeważającej
liczbie związków reguła oktetu jest spełniona.
W tym przypadku uzyskują strukturę izoelektronową z atomem
helowca położonym najbliżej w układzie okresowym w stosunku do
atomu danego pierwiastka.
Np.:
Na Mg Al
dążą do struktury
neonu
Si P S Cl
dążą do struktury
argonu
Reguła dubletu
Liczba wiązań kowalencyjnych, które może utworzyć atom jest
równa liczbie niesparowanych elektronów walencyjnych.
Wiązanie powstaje wówczas, gdy dwa elektrony pochodzące
od różnych atomów utworzą dublet, czyli parę o przeciwnie
skierowanych spinach.
Znane są odstępstwa od reguły oktetu elektronowego w związkach typu SF
6
lub
PCl
5
.
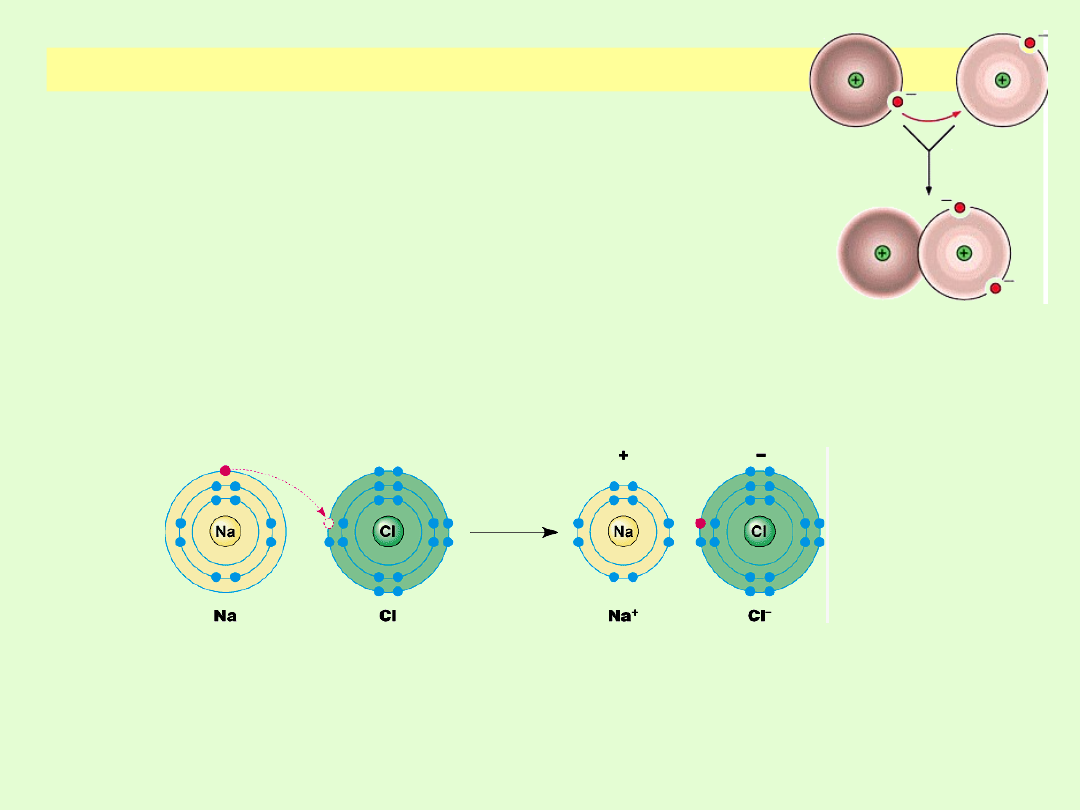
WIĄZANIE JONOWE
Podczas powstawania wiązania jonowego następuje
przekazanie elektronów od atomów pierwiastków
chętnie je oddających ( elektrododatnich) do
atomów pierwiastków łatwo przyjmujących
elektrony (elektroujemnych).
Utworzenie jonów powoduje uzyskanie przez nie
szczególnie trwałych konfiguracji zewnętrznej
powłoki.
Struktura związku jest utrzymywana przez
oddziaływania elektrostatyczne.
Wiązanie jonowe tworzy się pomiędzy atomami o
skrajnej różnicy elektroujemności - ∆ x ≥ 1,7
Największy udział tego rodzaju wiązania można zaobserwować w związkach
litowców z fluorowcami. Teoretycznie najsilniejszym wiązaniem jonowym
charakteryzuje się fluorek fransu - FrF, gdyż posiada największą różnicę
elektroujemności
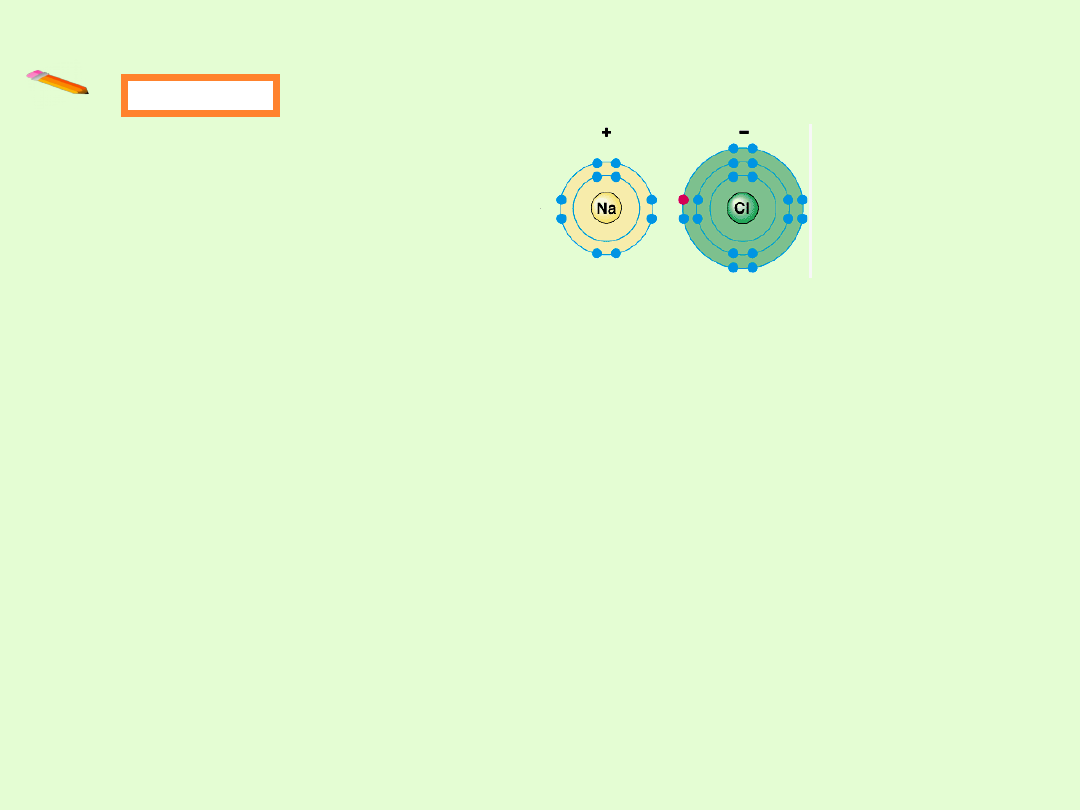
Przykład
Energia jonizacji Na 5,1 eV
Powinowactwo elektronowe Cl
(energia uwolniona po przyłączeniu elektronu)
-3,8 eV
Energia potrzebna: 5,1 eV – 3,8 eV = 1,3 eV
Na + Cl + 1,3 eV → Na
+
+ Cl
-
Energia wiązania: 4,2 eV
NaCl + 4,2 eV → Na + Cl
NaCl
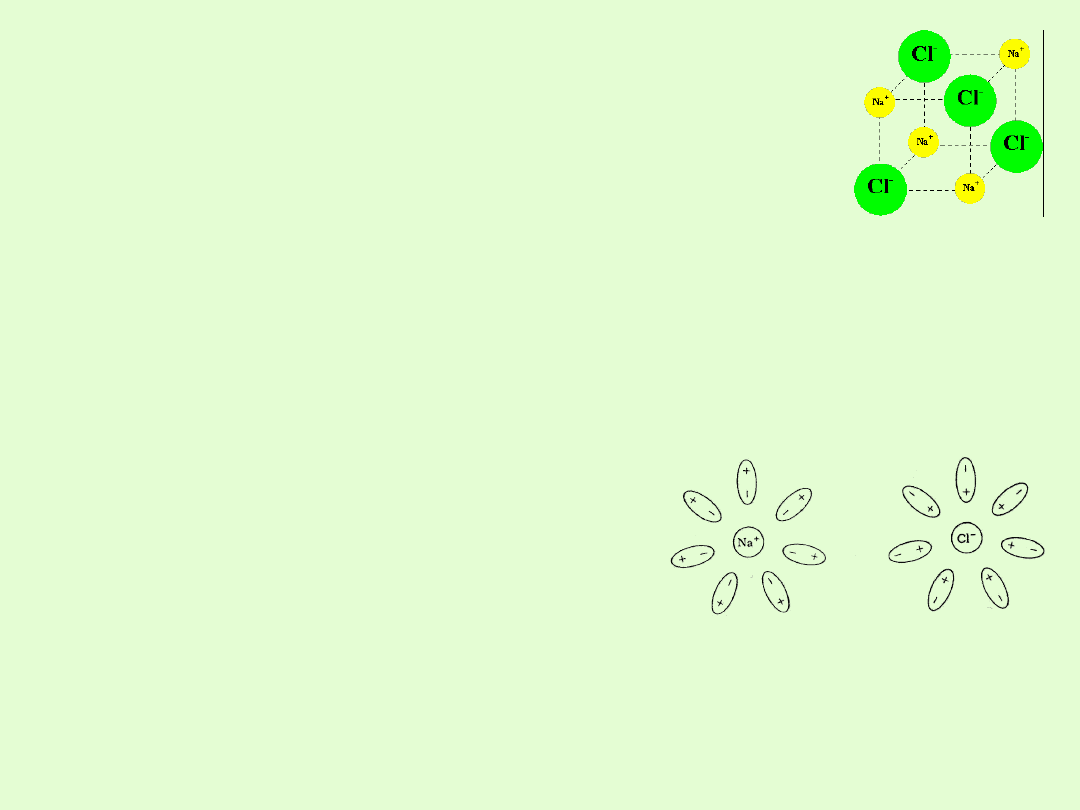
Cechy związków jonowych:
Tworzą wiązania jonowe między pierwiastkami różniącymi się
znacznie elektroujemnością.
Przechodzenie elektronu (elektronów) walencyjnych z jednego
atomu do powłoki zewnętrznej drugiego prowadzi do utworzenia
jonów.
Wzory chemiczne nie są wzorami podstawowego
mikroelementu strukturalnego, wyrażają jedynie stosunki
stechiometryczne ( w związkach o wiązaniach jonowych
powstają duże sieci krystaliczne i w rzeczywistości nie
można wyodrębnić poszczególnych cząsteczek).
W stanie stałym tworzą jonową sieć krystaliczną
Posiadają wysokie temperatury topnienia i wrzenia,
ponieważ siły kulombowskiego oddziaływania
jonów są znaczne.
rozpuszczają się w rozpuszczalnikach polarnych
W stanie ciekłym i stopionym przewodzą prąd elektryczny
( przewodniki II rodzaju).
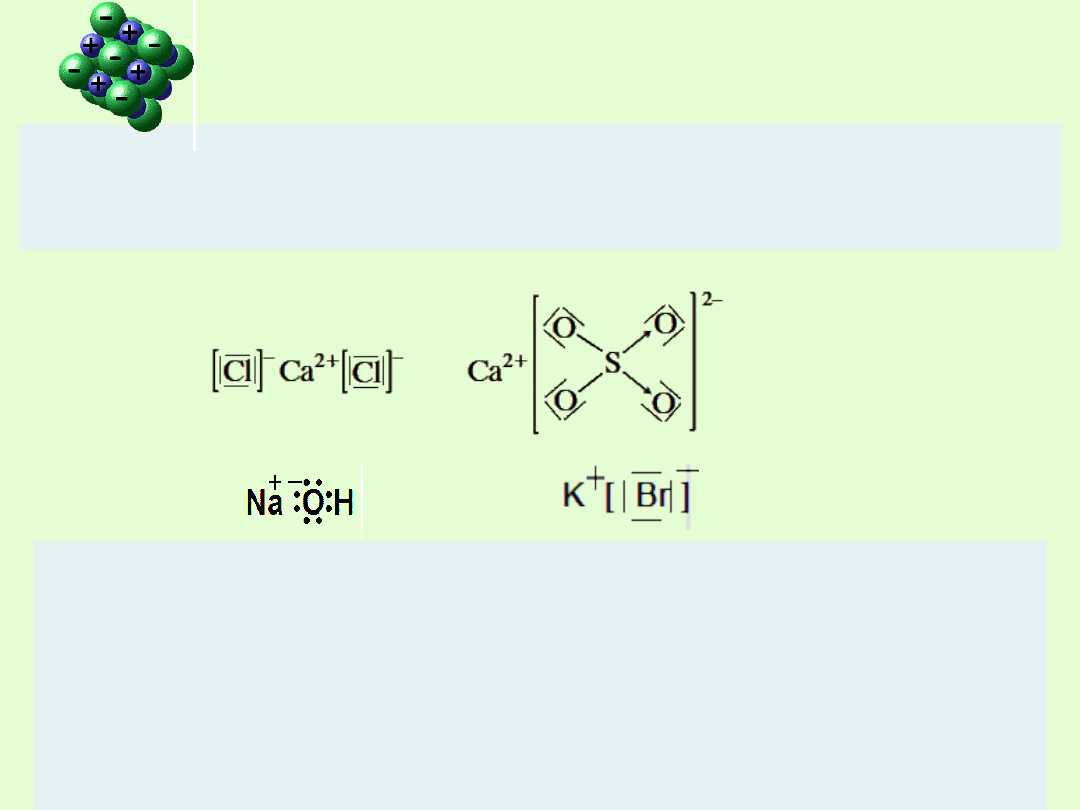
Wzory elektronowe
Sposób zapisu chemicznych wzorów strukturalnych, polegający na
zaznaczaniu rozmieszczenia elektronów walencyjnych: uwspólnionych i
nieuwspólnionych par elektronów (te ostatnie nazywa się wolnymi, czyli
niewiążącymi parami elektronowymi).
Poszczególne elektrony oznacza się zazwyczaj kropkami, pary
elektronowe zaś dwukropkami albo kreskami obok symbolu danego
atomu.
Wzory elektronowe cząsteczek związków o budowie jonowej ( zapis
umowny)
Przykłady związków o budowie jonowej:
MgCl,NaNO
3,
KOH CaO, MgO, NaBr
Warto wspomnieć o często spotykanym wyjątku - fluorowodorze, który pomimo
elektroujemności równej 1,9 między wodorem, a fluorem nie tworzy wiązania
jonowego, ale kowalencyjne, co wskazuje na nieprecyzyjność tego przyjętego
systemu klasyfikacji wiązań.
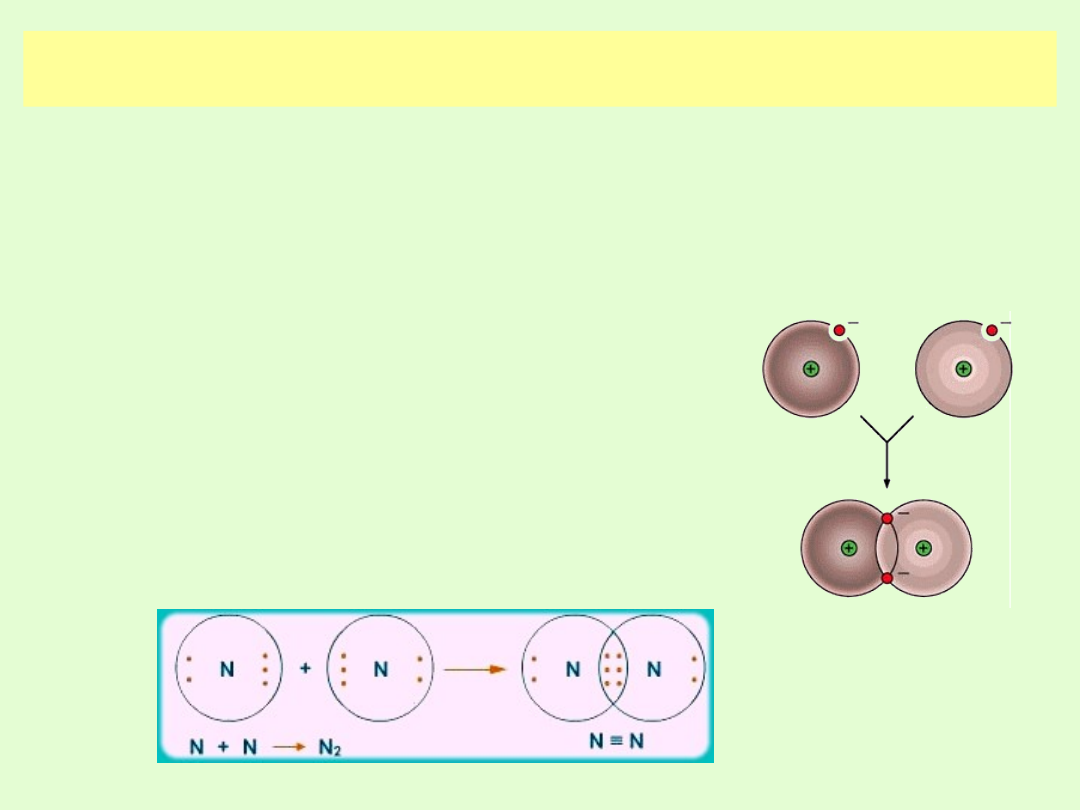
WIĄZANIE KOWALENCYJNE NIESPOLARYZOWANE
(atomowe niespolaryzowane)
Jeżeli atomy mają jednakowe (cząsteczki pierwiastka) lub
prawie jednakowe wartości elektroujemności, aby zachować
tendencję do uzyskania struktury gazów szlachetnych tworzą
jedną lub więcej wspólnych par elektronowych.
Różnica elektroujemności pierwiastków tworzących wiązania
atomowe niespolaryzowane musi zawierać się w przedziale 0,0
≤ ∆ x < 0,4
Wspólne elektrony jednakowo są przyciągane
przez jądra.
W tworzeniu wiązania muszą być spełnione
reguły:
oktetu i dubletu.
Jądra tych atomów znajdują się blisko siebie
ponieważ elektrony ich zewnętrznych powłok
poruszają się swobodnie po orbitalach
wspólnych dla obu atomów.
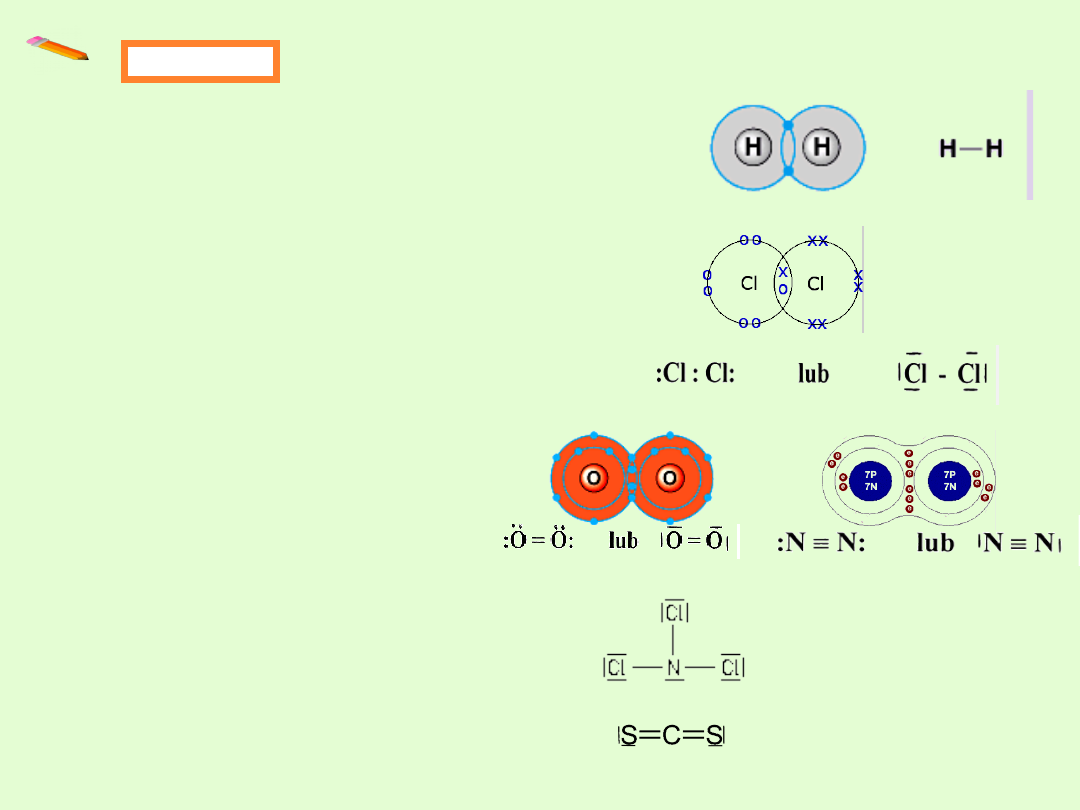
Przykłady
Gdy dwa atomy wodoru tworzą
cząsteczkę, ich elektrony rozmieszczają
się symetrycznie wokół obydwu jąder,
tworząc parę elektronową.
W przypadku chloru powstaje jedna
wspólna para elektronowa
i wtedy każdy z atomów chloru ma 8
elektronów walencyjnych - powstaje oktet a
konfiguracja elektronowa staje się podobna
do konfiguracji argonu (K
2
L
8
M
8
)
Przykłady, gdy utworzenie jednej
wiążącej pary elektronowej nie
wystarcza do utworzenia oktetu:
Przykłady związków chemicznych:
Trichlorek azotu NCl
3
Disiarczek węgla CS
2

Właściwości związków o budowie kowalencyjnej
W przeciwieństwie do związków jonowych związki kowalencyjne tworzą
w stanie stałym sieć krystaliczną zbudowaną z odrębnych cząsteczek.
Istnieje pewna liczba substancji kowalencyjnych, w których nie występują odrębne
cząsteczki kowalencyjne, ponieważ wiązania kowalencyjne rozciągają się na całą
sieć.
Kryształy kowalencyjne, których elementy składowe połączone są wiązaniami
kowalencyjnymi ze względu na siłę takich wiązań są to kryształy o dużej twardości i
bardzo wysokiej temperaturze topnienia ( w odróżnieniu od kryształów
cząsteczkowych), nierozpuszczalne. Przedstawicielem tej grupy kryształów jest
diament, krzem pierwiastkowy.
Rozpuszczają się w rozpuszczalnikach niepolarnych lub słabo polarnych.
Skroplone związki kowalencyjne i ich roztwory nie przewodzą prądu
elektrycznego.
Reakcje między związkami kowalencyjnymi polegają na rozerwaniu
istniejących wiązań i powstaniu nowych. Reakcje z ich udziałem zachodzą
powoli i przy małej wydajności.

WIĄZANIE KOWALENCYJNE SPOLARYZOWANE
(atomowe spolaryzowane)
Różni się tym od wiązania kowalencyjnego niespolaryzowanego,
że między atomami występuje większa różnica
elektroujemności, co skutkuje tzw. polaryzacją wiązania, czyli
przesunięciem wiążącej pary elektronowej w kierunku atomu
bardziej elektroujemnego.
Umowne określenie zakłada różnicę elektroujemności
w przedziale0,4 ≤ ∆ x < 1,7
Polaryzacja wiązania
– wspólna para elektronowa nie należy w
jednakowym stopniu do obu atomów, lecz jest przesunięta w kierunku
atomu bardziej elektroujemnego.
W efekcie niesymetryczny rozkład ładunku prowadzi do powstania
cząstkowego ładunku ujemnego (δ-) przy atomie pierwiastka o większej
elektroujemności i cząstkowego ładunku dodatniego (δ+) przy atomie o
mniejszej elektroujemności.
Kształt cząsteczki rozstrzyga o tym, jak ładunki te są rozłożone
w przestrzeni.
Jeżeli w cząsteczce można biegun ujemny oddzielić od
dodatniego jedną płaszczyzną to
cząsteczka ta jest polarna
,
czyli jest
dipolem.
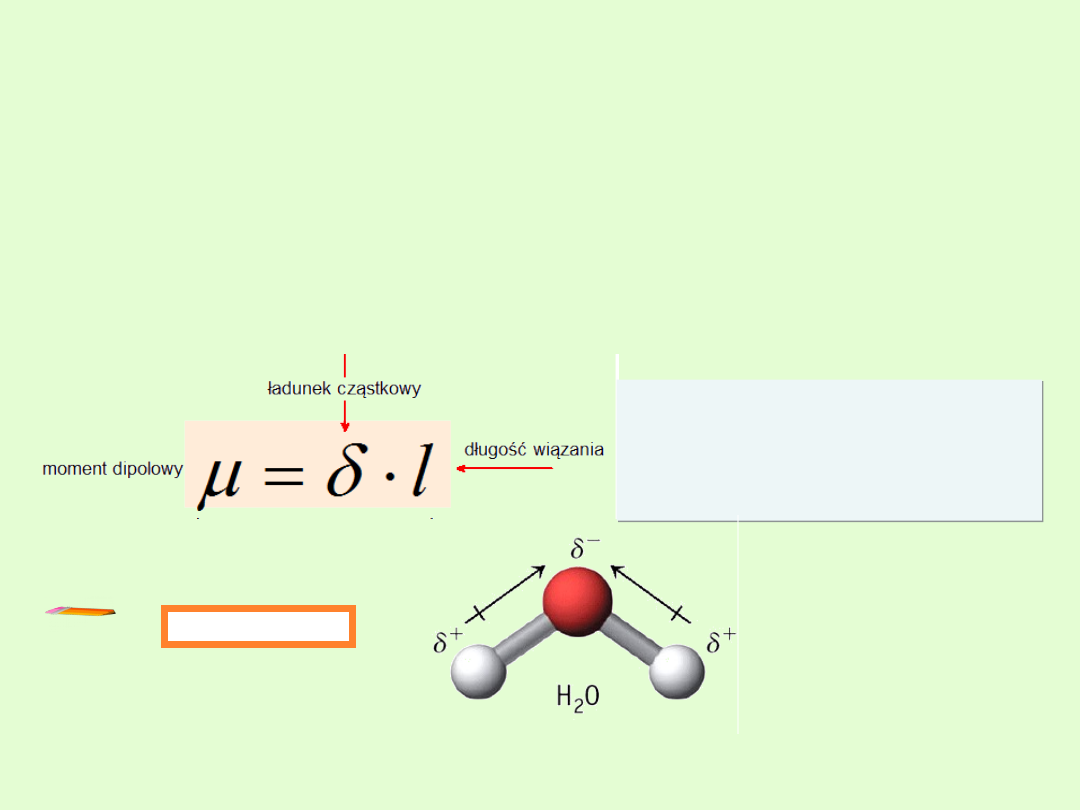
Dipol elektryczny
Układ dwóch rozdzielonych ładunków elektrycznych o tych samych
wartościach bezwzględnych, lecz przeciwnych znakach, oddalonych od
siebie na pewną odległość. Kierunek dipola wyznacza oś łącząca atomy,
pomiędzy którymi powstaje spolaryzowane wiązanie.
Miarą polarności cząsteczki jest wartość jej momentu
dipolowego, który
stanowi sumę wektorową momentów poszczególnych wiązań
.
Wartość momentu dipolowego oblicza się:
Jednostki:
C∙m; ( kulomb x metr)
D (debaj) 1 D = 3,33564 10
–30
C
· m
Jednostki:
C∙m; ( kulomb x metr)
D (debaj) 1 D = 3,33564 10
–30
C
· m
Przykłady
1,85D
μ
O
H
2
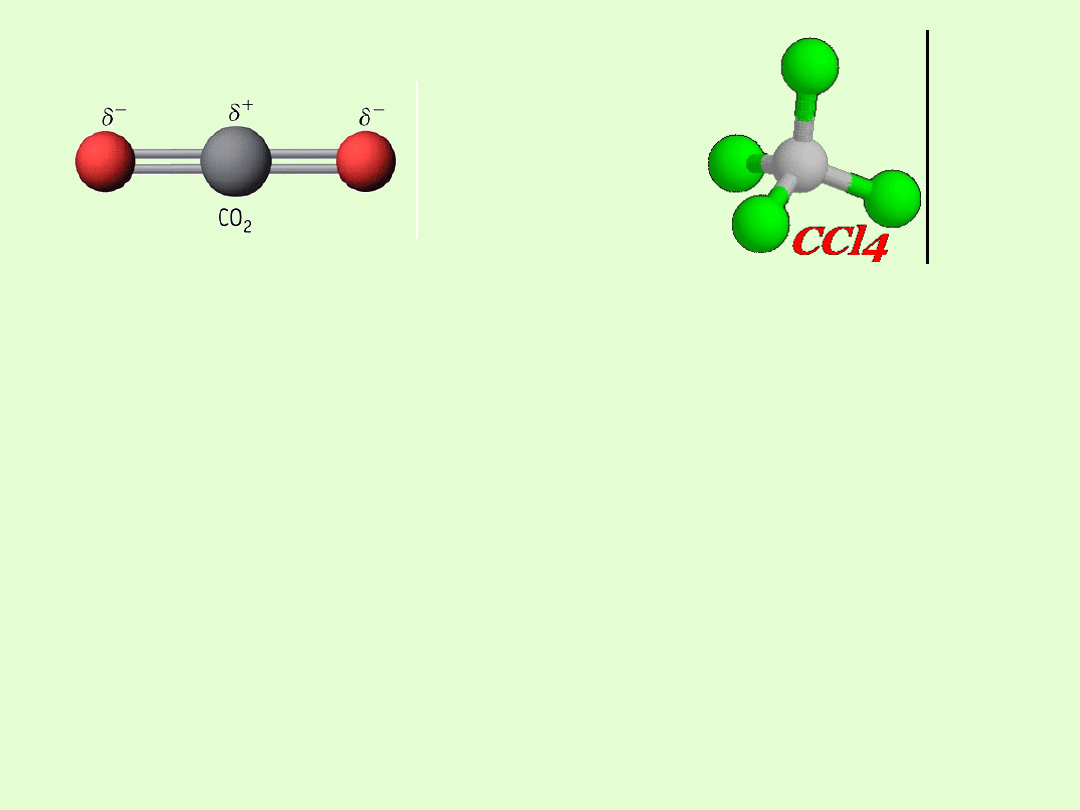
Moment dipolowy cząsteczki ma wartość 0 D jeśli cząsteczka jest
sferycznie symetryczna np.; CO
2
, CCl
4
, CH
4
Symetryczny kształt cząsteczki nie pozwala na oddzielenie
płaszczyzną części dodatniej od ujemnej.
Wypadkowy moment dipolowy wynosi 0
0D
μ
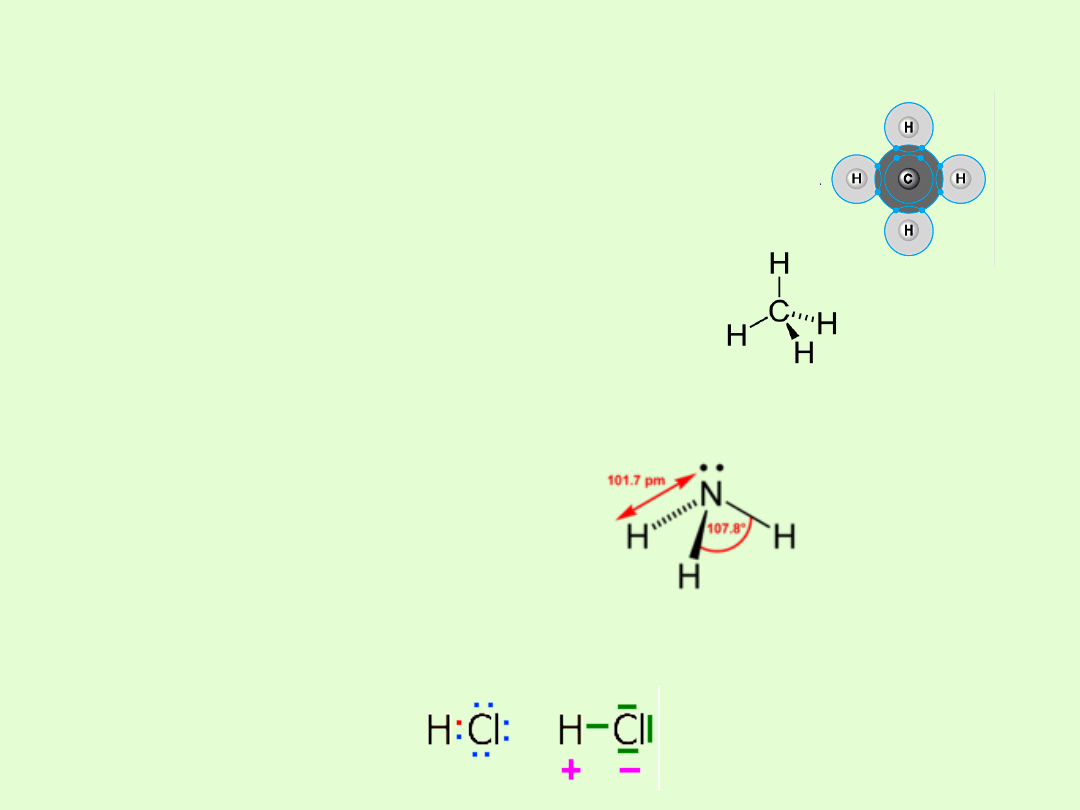
Wiązanie chemiczne jest tym bardziej spolaryzowane im większa
jest różnica elektroujemności tworzących go atomów.
Stopień polaryzacji wiązania C-H jest niewielki, gdyż
różnica elektroujemności wynosi zaledwie ∆x = 0,4.
Cząsteczka metanu nie wykazuje momentu
dipolowego ze względu na swą budowę symetryczną,
gdyż momenty dipolowe między atomami węgla i
atomami wodoru jako przeciwne znoszą się.
Z powodu stosunkowo znacznej różnicy elektroujemności między
atomem azotu i wodoru – Δx = 0,84 oraz asymetrycznej budowie,
cząsteczka amoniaku ma dość duży moment dipolowy (μ=1,46 D).
W cząsteczce chlorowodoru wspólna para elektronowa jest silniej
przyciągana przez atom chloru niż przez atom wodoru, jest więc
przesunięta w kierunku atomu chloru. Różnica elektroujemności Δx = 0,9
Moment dipolowy cząsteczki μ = 1,02 D
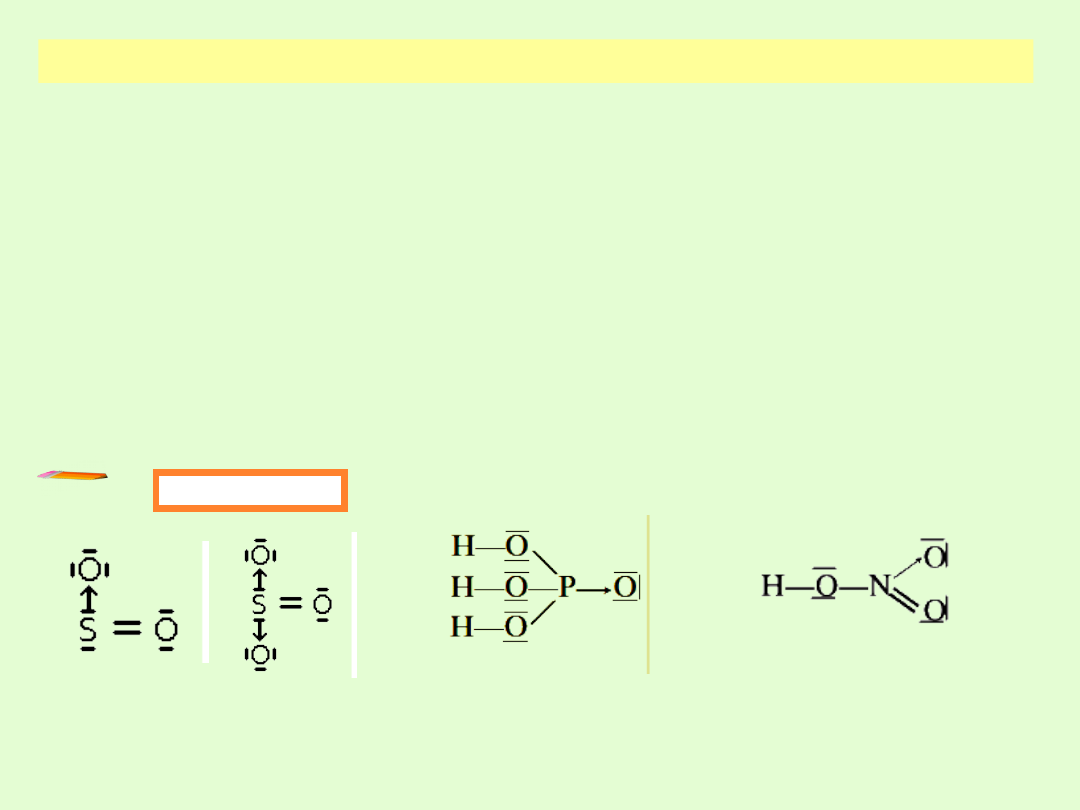
WIĄZANIE KOORDYNACYJNE
Wspólna wiążąca para elektronowa pochodzi w całości tylko od
jednego atomu, cząsteczki lub jonu.
Dawcę pary elektronowej w wiązaniu koordynacyjnym nazywa
się
donorem
pary elektronowej.
Biorcę pary elektronowej nazywa się
akceptorem.
Donorem zwykle jest niemetal, stanowiący część cząsteczki zdolnej do
samodzielnego istnienia.
Wiązanie koordynacyjne symbolizujemy jako → (od donora do
akceptora)
Przykłady
Tlenki siarki SO
2
i SO
3
Kwas
ortofosforowy(V)
H
3
PO
4
Kwas azotowy(V)
HNO
3
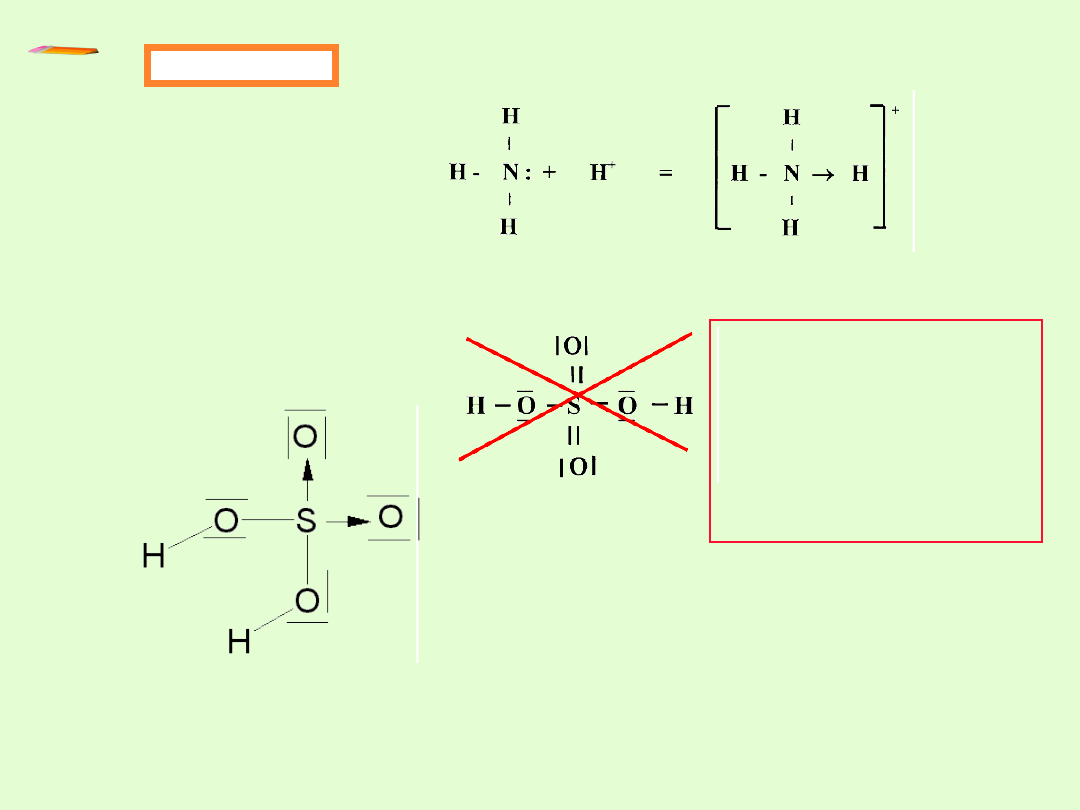
Przykłady
Kation amonowy NH
+
4
Donorem jest atom azotu, a akceptorem kation wodoru
Kwas siarkowy (VI)
H
2
SO
4
Z powyższego wzoru
elektronowego
wynika, że at. S ma
układ 12 –elektronowy.
Nie jest więc spełniona
reguła oktetu !
Spełniona jest reguła oktetu elektronowego
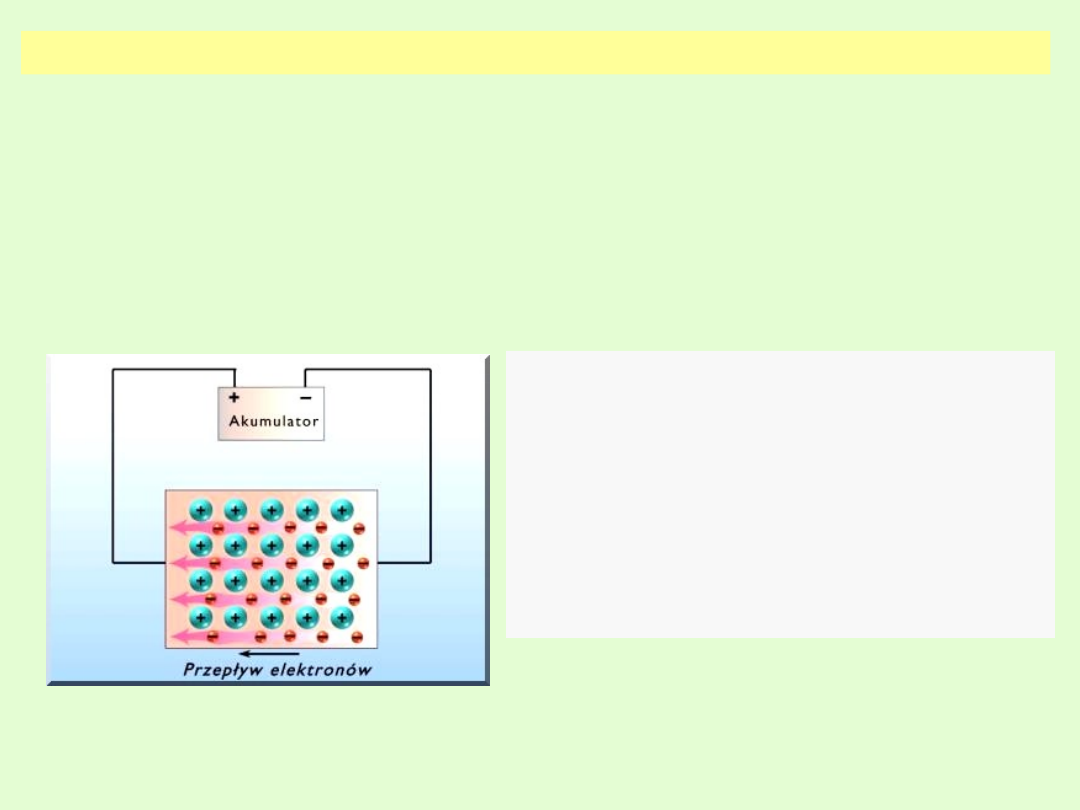
WIĄZANIE METALICZNE
W sieci metalicznej węzły sieci przestrzennej są obsadzone przez
atomy pozbawione elektronów walencyjnych (tzw. "zręby
atomowe”
–
jony
dodatnie).
Elektrony
walencyjne
są
„zdelokalizowane” i tworzą „chmurę elektronową” (gaz
elektronowy Fermiego) przenikającą cały kryształ. Obecność
„gazu elektronowego” ogranicza siły odpychania pomiędzy
kationami tworzącymi sieć i stabilizuje w ten sposób strukturę
krystaliczną metalu.
.
Obecność „chmury elektronowej”
zapewnia kryształom metalicznym
przewodnictwo elektronowe.
Dzięki ruchliwości elektronów
posiadają charakterystyczny połysk, a
ciasne ułożenie zrębów atomowych i
ich zdolność do drgań zapewnia dobre
przewodnictwo cieplne

Granica między wiązaniami kowalencyjnymi i jonowymi jest
bardzo płynna.
Z formalnego punktu widzenia, przyjmuje się, że wiązania
kowalencyjne występują, gdy różnica między
elektroujemnościami atomów wynosi nie więcej niż 1,7 w skali
Paulinga.
Jest to jednak granica bardzo umowna.
Dla uproszczenia i wygody przyjęto, że przy dostatecznie dużej
różnicy elektroujemności traktuje się jako jonowe, a przy nieco
mniejszej różnicy elektroujemności wpływ jonowego efektu jest
pomijany.
Współcześnie o tym, czy dane wiązanie zaklasyfikować jako
kowalencyjne, czy jonowe, decydują dokładne pomiary gęstości
chmury elektronowej oraz odległości międzyatomowych,
dokonywane zwykle metodą rentgenografii strukturalnej.
UWAGI KOŃCOWE

Źródło
„ Szkolny poradnik chemiczny”- Dobkowska, Pazdro
Chemia Ogolna WPC1002w - Władysław Walkowiak
Chemia 1 ( podręcznik lo) S. Hejwowska, R. Marcinkowski
http://oen.dydaktyka.agh.edu.pl/dydaktyka/chemia
Ilustracje:
http://www.chemguide.co.uk
http://www.bbc.co.uk
http://www.knowledgerush.com/wiki_image/6/6a/GN_Lewis_sm.jpg
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
Wyszukiwarka
Podobne podstrony:
03 Wiazania chemiczne II rzedui Nieznany (2)
3 WIAZANIA CHEMICZNE II cz
Część II wiązania chemiczne zadania(1)
Wyklad 4 Wiazania chemiczne w cialach stalych
6 wykad WiĄzania chemiczne[F]
Wykład 1, budowa atomu, wiązania chemiczne
2 Atom i cząstka Wiązania chemiczne klucz
2 Atom i cząstka Wiązania chemiczne
NANOC W Nano Wyklad 05 Synteza Metodami Chemicznymi II (1)
7 układ okresowy pierwiastków, wiązania chemiczne
Budowa atomu i wiązania chemiczne test odpowiedzi
wypisać i wymienić rodzaje wiązań chemicznych
WIĄZANIA CHEMICZNE
Atom, cząsteczka, wiązanie chemiczne
ściąga rodzaje wiązań chemicznych
Wiązania chemiczne
więcej podobnych podstron