
Budowa atomu
Wiązania chemiczne

Główne części każdego atomu to jądro atomowe
i elektrony przemieszczające się wokół niego
po orbitach.
Przestrzeń, w której poruszają się elektrony nazywa
się strefą elektronową. Średnica jądra atomowego
to zaledwie 1/10000 średnicy całego atomu.
Jądro zwiera dwa rodzaje cząstek elementarnych:
protony i neutrony.
Masa neutronu jest w przybliżeniu równa masie
protonu.
Masa całego atomu zleży wyłącznie od masy jądra
atomowego, czyli o sumy mas neutronów
i protonów w tym jądrze.

Atom jako całość jest układem trwałym.
Pomiędzy protonami i elektronami występują
jednoczesne siły przyciągania spowodowane
tym iż mają one różnoimienne ładunki
elektryczne.
Protony obdarzone są dodatnim a elektrony
ujemnym ładunkiem elektrycznym.
Liczba protonów w jądrze równa jest liczbie
elektronów krążących wokół jądra, dlatego
atom jako całość jest elektrycznie obojętny.

Historyczny rozwój
teorii budowy atomu
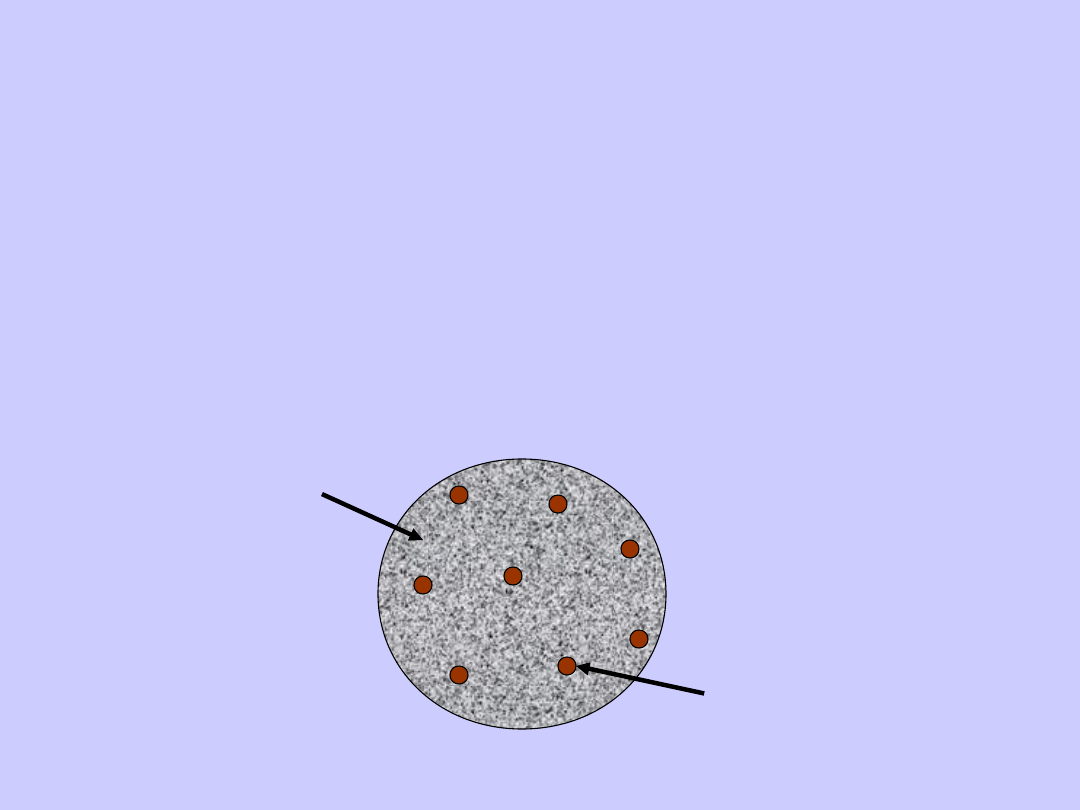
W 1903 r. J.J. Thomson zaproponował następujący
model atomu. Atom ma postać kuli równomiernie
wypełnionej elektrycznym ładunkiem dodatnim,
wewnątrz której znajduje się elektron. Sumaryczny
ładunek dodatni kuli równy jest ładunkowi elektronu,
tak więc atom jako całość jest obojętny elektrycznie.
Materia dodatnia
Ujemne elektrony
Model Thomsona
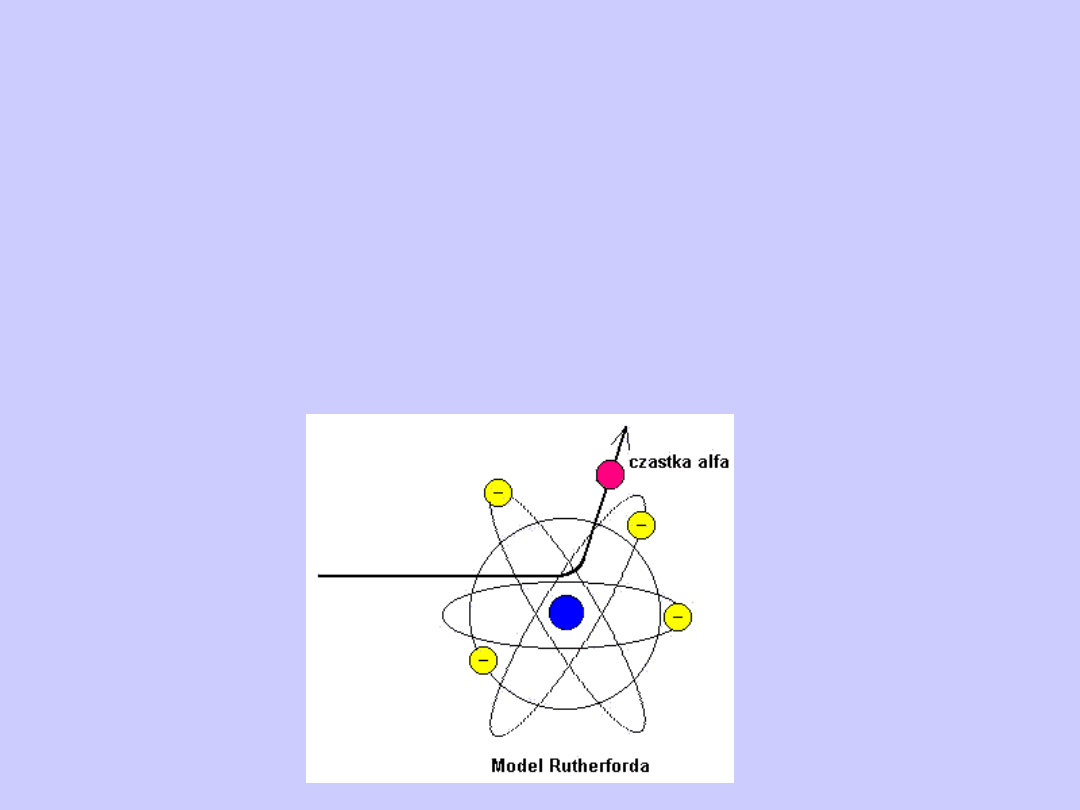
Model Rutherforda
Rozkład dodatnich i ujemnych ładunków w atomie może
być wyznaczony doświadczalnie za pomocą
bezpośredniego "sondowania" wnętrza atomu. Takie
sondowanie przeprowadził E. Rutherford
razem ze współpracownikami za pomocą cząstek ;
obserwowali oni zmianę kierunku ich lotu (rozproszenie)
przy przechodzeniu przez cienką warstwę materii.

Opierając się na tym wniosku Rutherford w 1911 r.
zaproponował jądrowy model atomu. Według Rutherforda
atom ma postać układu ładunków, w którego środku
znajduje się ciężkie dodatnio naładowane jądro o ładunku
Ze, o wymiarach nie przekraczających 10
-14
m, a wokół
jądra w całej objętości zajmowanej przez atom
rozmieszczone jest Z elektronów. Prawie cała masa
atomu skupiona jest w jądrze.
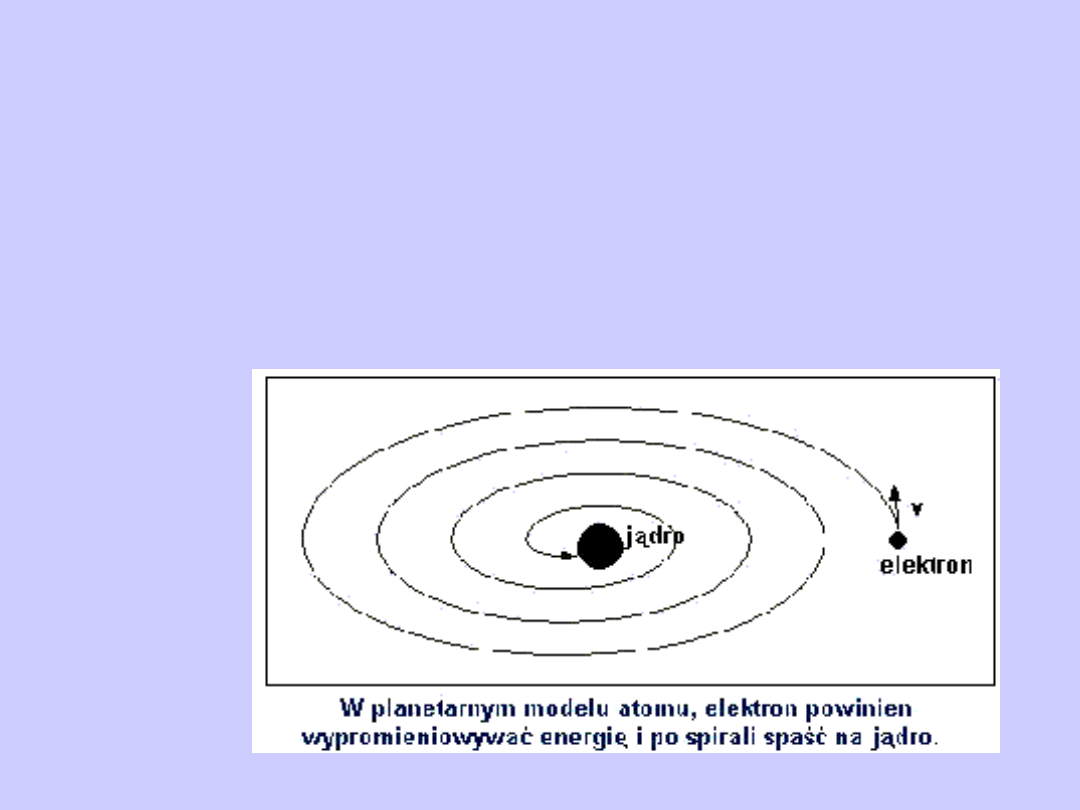
Wyniki doświadczeń nad rozpraszaniem cząstek świadczą na
korzyść zaproponowanego przez Rutherforda jądrowego
modelu atomu. Jednakże ten model okazał się sprzeczny z
prawami mechaniki klasycznej i elektrodynamiki.
Rutherford założył, że elektrony poruszają się wokół jądra po
zakrzywionych trajektoriach. Ale w tym przypadku elektron
będzie poruszał się z przyspieszeniem, w związku z czym -
zgodnie z elektrodynamiką klasyczną - powinien on
nieprzerwanie emitować fale elektromagnetyczne. Procesowi
emisji promieniowania towarzyszy strata energii, zatem
elektron powinien w końcu spaść na
jądro.
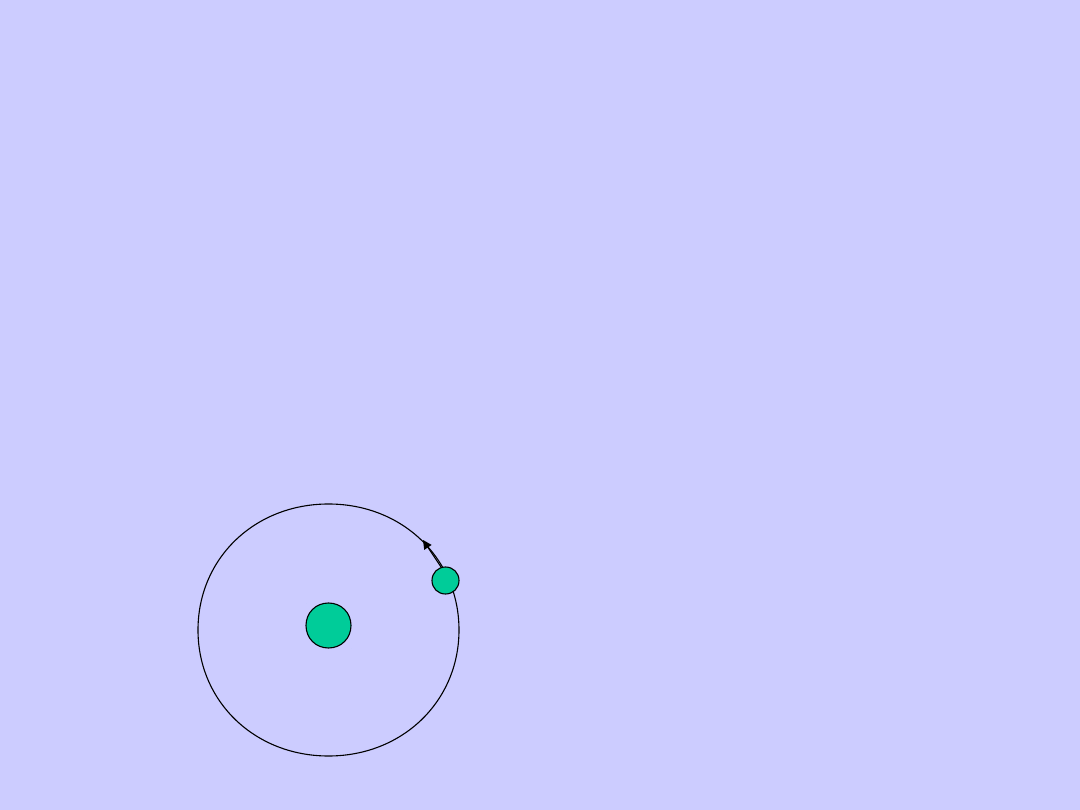
Model Bohra
Jądrowy model atomu Rutherforda w połączeniu z
klasyczną mechaniką i elektrodynamiką nie jest w
stanie wyjaśnić ani stabilności atomu, ani
charakteru widma atomowego.
W 1913 r. duński fizyk Niels Bohr znalazł wyjście
z powstałego tu impasu, co prawda, kosztem
wprowadzenia założeń sprzecznych z klasycznymi
wyobrażeniami. Przyjęte przez Bohra założenia
zawarte są w dwóch sformułowanych przezeń
postulatach.
+
-

Pierwszy postulat Bohra
Elektron nie może krążyć po dowolnej orbicie, lecz
tylko po tych,
dla których moment pędu elektronu jest
wielokrotnością h/2
.
h - stała nazwana stałą Plancka wynosząca 6,62*10
-
34
J*s
Każdej orbicie odpowiada inny stan energetyczny
atomu. Znajdując się na orbicie dozwolonej elektron
nie promieniuje energii. Orbity dozwolone zostały
nazwane stacjonarnymi.

Drugi postulat Bohra
Atom absorbuje lub emituje promieniowanie w postaci
kwantu
o energii h przechodząc z jednego stanu
energetycznego E
n
do drugiego E
k
(czyli przejściu
elektronu z jednej orbity dozwolonej na inną).
Różnica energii tych stanów atomów równa się energii
wypromieniowanego kwantu:
h
= E
n
- E
k
We wzorze tym E
n
oznacza energie atomu w stanie
początkowym,
E
k
- w stanie końcowym, v - jest częstotliwością
emitowanego lub zaabsorbowanego promieniowania.
Energia zostaje wypromieniowana, gdy E
n
>E
k
,
pochłonięta zaś, jeżeli E
n
< E
k
.
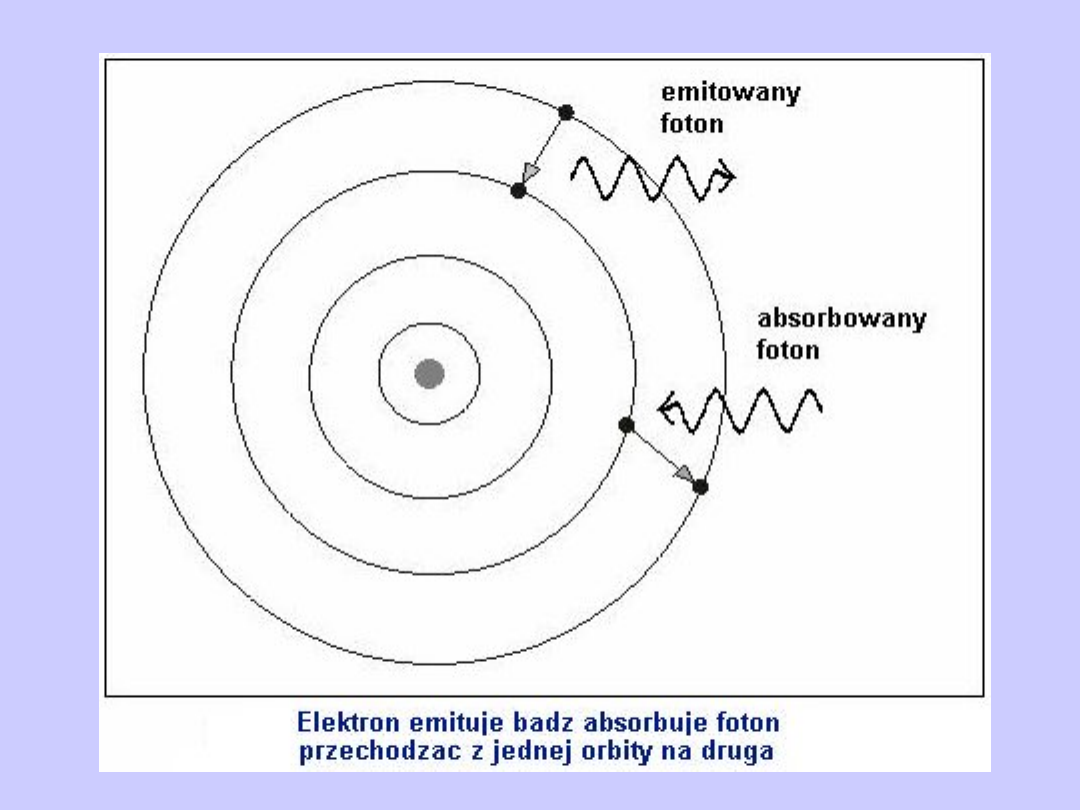

Prawa mechaniki opisują równowagę dynamiczną
elektronów w stanach stacjonarnych, ale nie
stosują się do przechodzenia elektronu pomiędzy
dwoma stanami stacjonarnymi.
Trzeci postulat Bohra

Zgodnie z pierwszym postulatem Bohra możliwe są tylko
takie orbity, dla których moment pędu elektronu m
e
vr
spełnia warunek
Liczbę n nazywamy główną liczbą kwantową.
Rozpatrzmy elektron poruszający się w polu jądra
atomowego o ładunku Ze. Przy Z = 1 taki układ
odpowiada atomowi wodoru, przy innych Z - jonowi
wodoropodobnemu, tj. atomowi o liczbie atomowej Z,
z którego usunięto wszystkie elektrony oprócz
jednego.
m
e
vr = nh (n = 1, 2, 3, ....)

Obecnie teoria Bohra ma głównie znaczenie
historyczne.
Po pierwszych sukcesach tej teorii coraz bardziej
widoczne stawały się jej niedociągnięcia. Szczególnie
przygnębiające były niepowodzenia wszystkich prób
skonstruowania teorii atomu helu - jednego z
najprostszych atomów, następnego atomu
bezpośrednio po atomie wodoru.
Po odkryciu falowych własności materii, stało się
zupełnie jasne, że oparta na mechanice klasycznej
teoria Bohra mogła być jedynie przejściowym etapem
na drodze do stworzenia konsekwentnej teorii zjawisk
atomowych.

Elektronowa struktura atomu

Dualizm korpuskularno-falowy - cecha wielu obiektów
fizycznych (np: światła czy elektronów) polegająca na
tym, że w pewnych sytuacjach, zachowują się one jakby
były cząstkami (korpuskułami),
a w innych sytuacjach jakby były falami.
Wg mechaniki kwantowej właściwie całą materię
charakteryzuje ten dualizm. Każdej cząstce, a nawet
każdemu obiektowi makroskopowemu można przypisać
charakterystyczną dla niego funkcję falową.
Z drugiej strony każde oddziaływanie falowe można
opisać
w kategoriach cząstek.
Dualizm korpuskularno-falowy
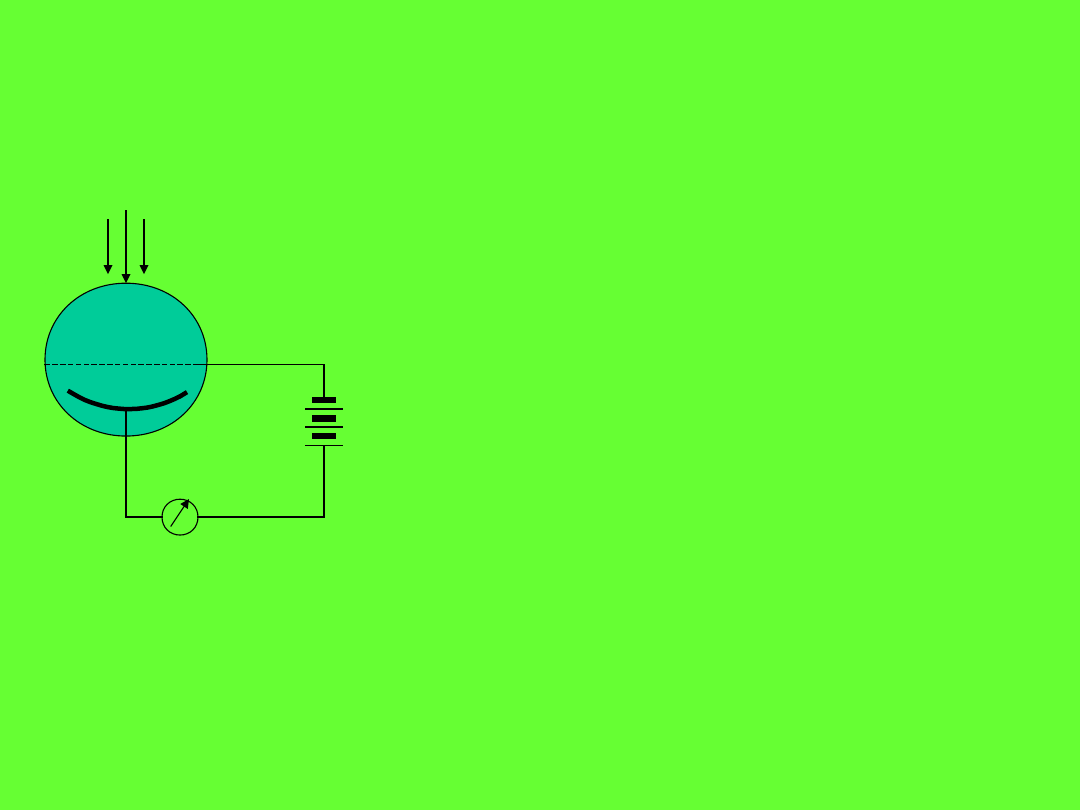
Efekt fotoelektryczny
A
K
G
+
-
S
Emisja elektronów z katody zachodzi
tylko wówczas, gdy długość fali światła
padającego nie przekracza pewnej
wartości progowej „czerwonej linii
efektu fotoelektrycznego”. Ta graniczna
wartość
0
c/
0
jest charakterystyczna
dla metalu katody.
Wynika z tego, że energia fotonu musi posiadać pewną minimalną
wartość, poniżej której nie jest możliwe wybicie elektronu z katody.
Nadmiar energii h( –
0
) jest zamieniany na energię kinetyczną
elektronu.
Dualizm korpuskularno-falowy
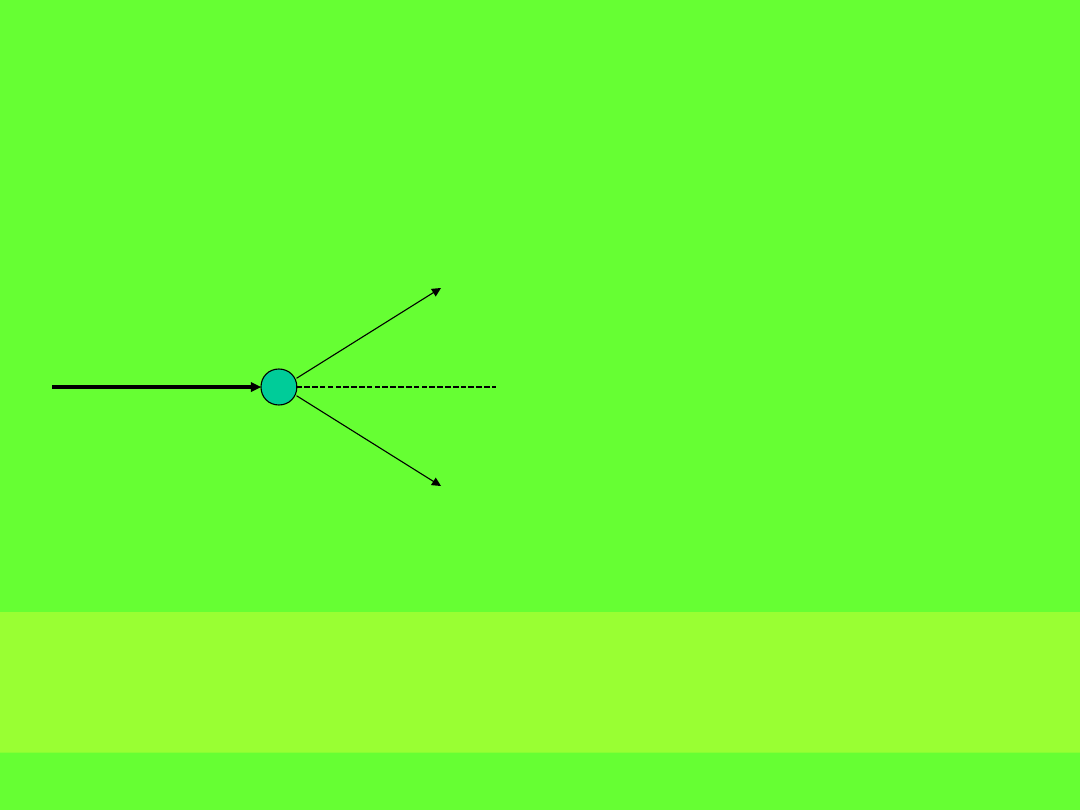
Efekt Comptona
Od
rzu
con
y e
lek
tro
n
Ro
zp
ro
sz
on
y f
ot
on
m v
h ’/c
h /c
Doświadczenie polegało na
rozproszeniu
promieniowania
Röntgena na parafinie.
Compton stwierdził, że
długość fali promieniowania
rozproszonego
jest większa niż pierwotnie.
W przeciwieństwie do zjawisk interferencji czy dyfrakcji promieniowania
elektromagnetycznego efektu fotoelektrycznego oraz efektu Comptona
nie da się wyjaśnić na drodze teorii falowej.

Dyfrakcja – odchylenie się fal od prostoliniowego kierunku
rozchodzenia się, np. po przejściu przez szczelinę.
Interferencja – nakładanie się fal prowadzące do zwiększenia
lub zmniejszenia amplitudy fali wypadkowej.

Hipoteza de Broglie’a
Dualizm korpuskularno-falowy
Dualizm korpuskularno-falowy jest cechą nie tylko światła
(fotonów), lecz i wszystkich cząstek materialnych o masie
spoczynkowej różnej od zera, np. elektronów
v
v
,
m
h
m
c
h
p
h
E
Przykład: dla kuli o masie 1g, wystrzelonej z prędkością
300 m/s, jest rzędu 10
-31
cm (h =6,624 · 10
-34
J · s).

Równanie Schrödingera
0
)
(
8
2
2
2
2
2
2
2
2
V
E
h
m
z
y
x
Równanie podaje przestrzenną zależność funkcji falowej
od stanu energetycznego układu i masy elektronu.
x, y, z – współrzędne elektronu,
m – masa elektronu,
E – energia całkowita układu,
V – energia potencjalna układu,
h – stała Planca.

Liczby kwantowe n, l, m i s
n – główna liczba kwantowa, określa przede wszystkim
energię
elektronu w atomie. Główna liczba kwantowa może
przybierać
tylko wartości równe liczbom naturalnym: n = 1, 2, 3, .....
n określa przynależność elektronu do poziomów: K, L, M,
N, O, P, Q
l – poboczna liczba kwantowa, kwantuje moment pędu
związany
z ruchem elektronu w polu jądra. Dla danego n wartości l
wynoszą:
0, 1, 2, ..., (n-1). Liczba l określa przynależność do
orbitali:
s, p, d, f, g...
m – magnetyczna liczba kwantowa, decyduje o możliwych
wartościach
składowej momentu pędu w wyróżnionym kierunku (z).
Dla danego l
możliwe wartości m wynoszą: 0, 1, 2, ..., l.

Liczby kwantowe n, l, m i s
s – spinowa liczba kwantowa, kręt elektronu, może przyjmować
wartości ±
1
/
2
. Ma ona duże znaczenie przy tworzeniu wiązań
chemicznych.
Zakaz Pauliego
Możliwe są tylko takie stany elektronowe w atomie, w których
żaden elektron nie ma identycznych wszystkich czterech
liczb kwantowych.

n = 1, 2, 3, .....
l = 0, 1, 2, ..., (n-1)
m = 0, 1, 2, ..., l
s = ±
1
/
2
n
l
m
s
Liczba
stanów
1 (K)
0 (s)
0
±1/2
2
2 (L)
0 (s)
1 (p)
0
0, -1, +1
±1/2
±1/2
2
6
3 (M)
0 (s)
1 (p)
2 (d)
0
0, -1, +1
0, -1, -2, +1, +2
±1/2
±1/2
±1/2
2
6
10
4 (N)
0 (s)
1 (p)
2 (d)
3 (f)
0
0, -1, +1
0, -1, -2, +1, +2
0, -1, -2, -3, +1,
+2, +3
±1/2
±1/2
±1/2
±1/2
2
6
10
14
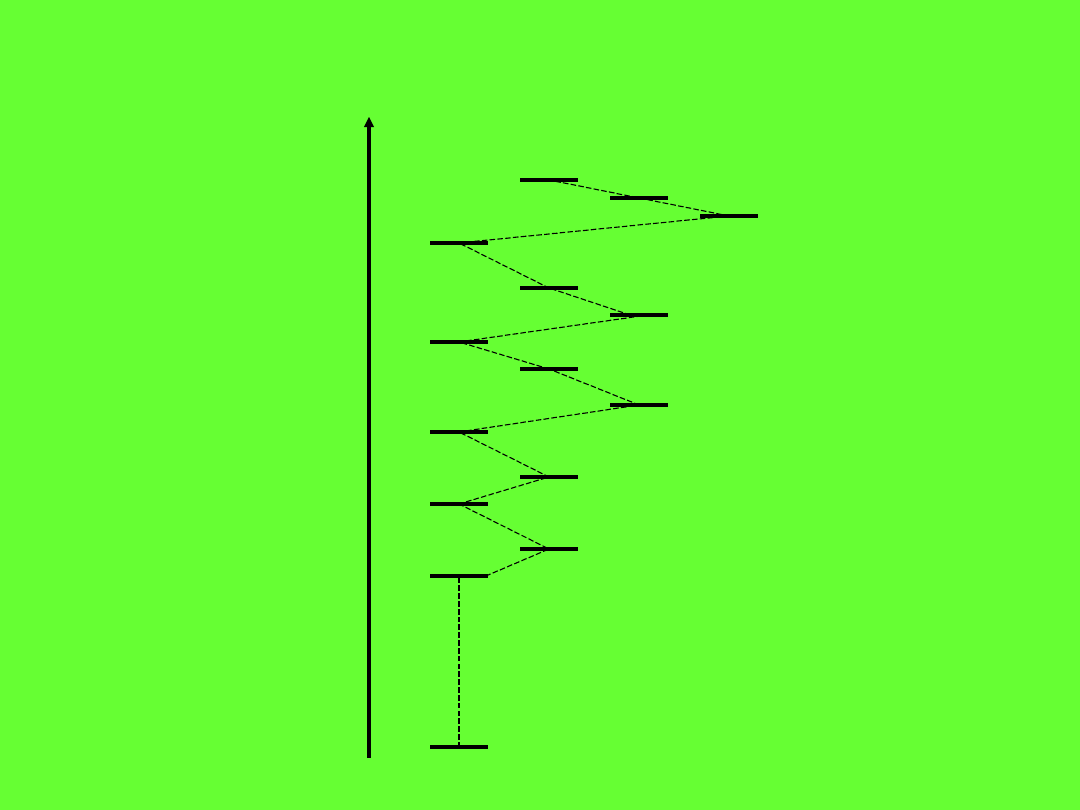
Kolejność poziomów energetycznych w atomie
1s
2s
3s
4s
5s
6s
2p
3p
4p
5p
6p
3d
4d
5d 4f
E
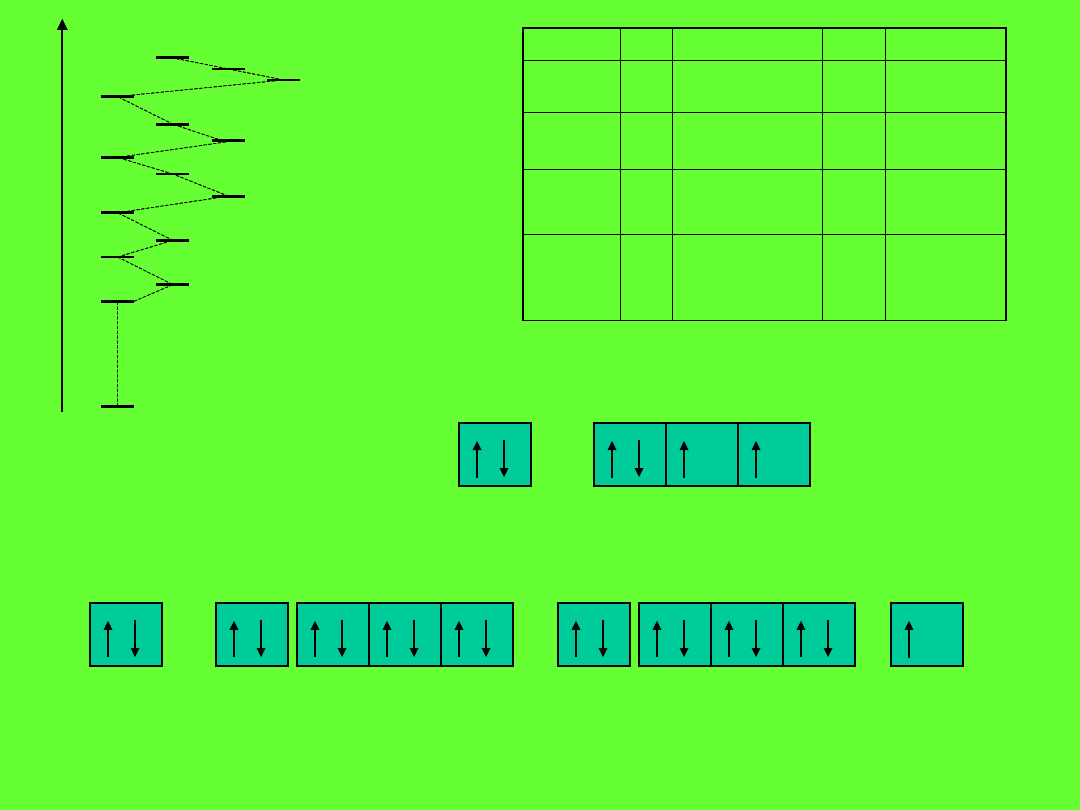
1s
2s
3s
4s
5s
6s
2p
3p
4p
5p
6p
3d
4d
5d
4f
E
1s
2s
3s
4s
5s
6s
2p
3p
4p
5p
6p
3d
4d
5d
4f
E
O, 8 elektronów
2
6
10
14
±1/2
±1/2
±1/2
±1/2
0
0, -1, +1
0, -1, -2, +1, +2
0, -1, -2, -3, +1, +2, +3
0 (s)
1 (p)
2 (d)
3 (f)
4 (N)
2
6
10
±1/2
±1/2
±1/2
0
0, -1, +1
0, -1, -2, +1, +2
0 (s)
1 (p)
2 (d)
3 (M)
2
6
±1/2
±1/2
0
0, -1, +1
0 (s)
1 (p)
2 (L)
2
±1/2
0
0 (s)
1 (K)
Liczba stanów
s
m
l
n
2
6
10
14
±1/2
±1/2
±1/2
±1/2
0
0, -1, +1
0, -1, -2, +1, +2
0, -1, -2, -3, +1, +2, +3
0 (s)
1 (p)
2 (d)
3 (f)
4 (N)
2
6
10
±1/2
±1/2
±1/2
0
0, -1, +1
0, -1, -2, +1, +2
0 (s)
1 (p)
2 (d)
3 (M)
2
6
±1/2
±1/2
0
0, -1, +1
0 (s)
1 (p)
2 (L)
2
±1/2
0
0 (s)
1 (K)
Liczba stanów
s
m
l
n
K, 19 elektronów
1s
2
2s
2
p
4
K, 19 elektronów
1s
2
2s
2
p
6
3s
2
p
6
4s
1
x
y
z
x
y
z
x
y
z
x
y
z
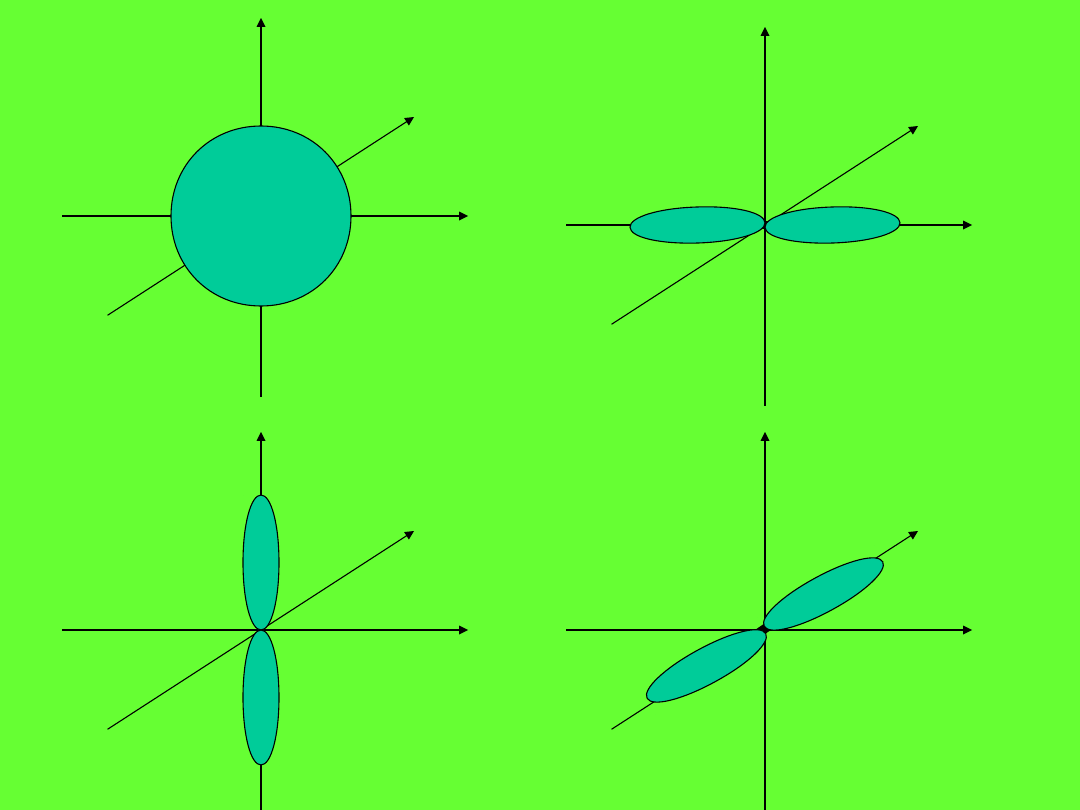
Orbitale
s
p
x
p
y
p
z

Wiązania chemiczne

Tworzenie się związków chemicznych i powstawanie
odpowiednich wiązań chemicznych tłumaczy się
charakterystycznym kwantowo-mechanicznym
oddziaływaniem pomiędzy elektronami i jądrami
łączących się atomów.
Aby utworzona molekuła była trwała, musi być
uboższa energetycznie niż wchodzące w jej skład
oddzielne atomy. Oznacza to, że proces tworzenia się
molekuł powinien być energetycznie korzystny, a więc
powinien prowadzić do osiągnięcia przez układ minimum
energii.
Podstawowymi wielkościami charakteryzującymi
wiązanie jest:
• energia wiązania (energia dysocjacji),
• odległość pomiędzy atomami,
• kąt pomiędzy kierunkami wiązań.

Wiązanie chemiczne jest siłą przyciągającą do siebie
atomy
i utrzymującą je razem.
Molekuła jest to zgrupowanie atomów powstające w
wyniku tych oddziaływań.
Długość wiązania jest związana z jego siłą: im wiązanie
silniejsze,
tym bliżej siebie znajdują się atomy. Dwa atomy wodoru
połączone wiązaniem kowalencyjnym znajdują się w
odległości 0,74 angstremów, podczas gdy w przypadku
oddziaływań van der Waalsa odległość ta wynosi 1,2
angstrema.
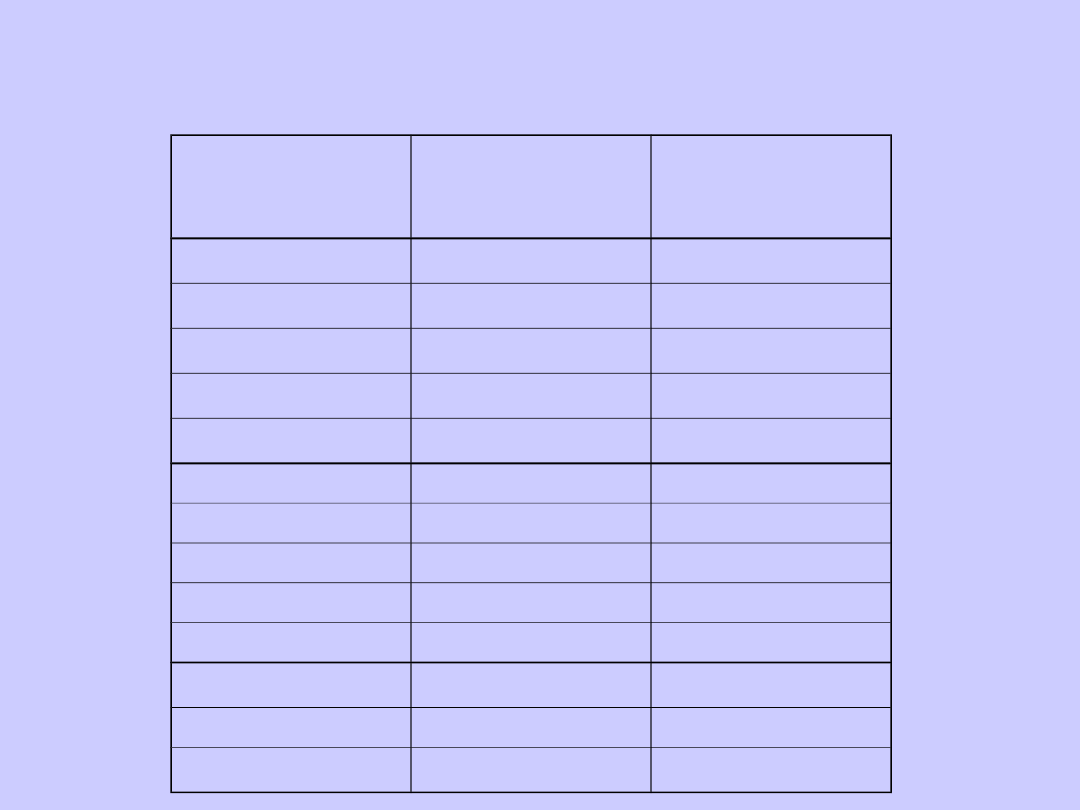
Związek
chemiczny
Ed
(kcal/mol)
L
(
o
A)
H
2
104
0,72
F
2
37
1,42
Cl
2
59
1,99
Br
2
46
2,28
I
2
36
2,67
HF
135
0,92
HCl
103
1,27
HBr
87
1,41
HI
71,4
1,61
NO
150
1,151
O
2
119
1,207
CO
256
1,128
N
2
226
1,094
Długość wiązań i energia dysocjacji niektórych cząsteczek
dwuatomowych

Pierwszą ogólną teorię tłumaczącą łączenie się atomów pomiędzy
sobą w związkach chemicznych podali: Kossel, Lewis (1916) oraz
Langmuir (1919).
Teoria ta nazywana jest elektronową teorią wiązania chemicznego.
Elektronowa teoria wiązania chemicznego opiera się
na trwałości konfiguracji oktetowej i w sposób
jednolity na podstawie reguły oktetu wyjaśnia różne
typy i liczby wiązań w związkach chemicznych.
Obecnie rozwinięciem kwantowej teorii atomu jest
kwantowa teoria tworzenia wiązań chemicznych.

Elektronowa teoria
wiązania chemicznego
Układ okresowy, tablica
Wernera

Rodzaje wiązań:
-
wiązania jonowe,
- wiązania kowalencyjne,
- wiązania kowalencyjne spolaryzowane,
- wiązania koordynacyjne,
- wiązania metaliczne,
- wiązania wodorowe,
- oddziaływania van der Waalsa,
- oddziaływania hydrofobowe.
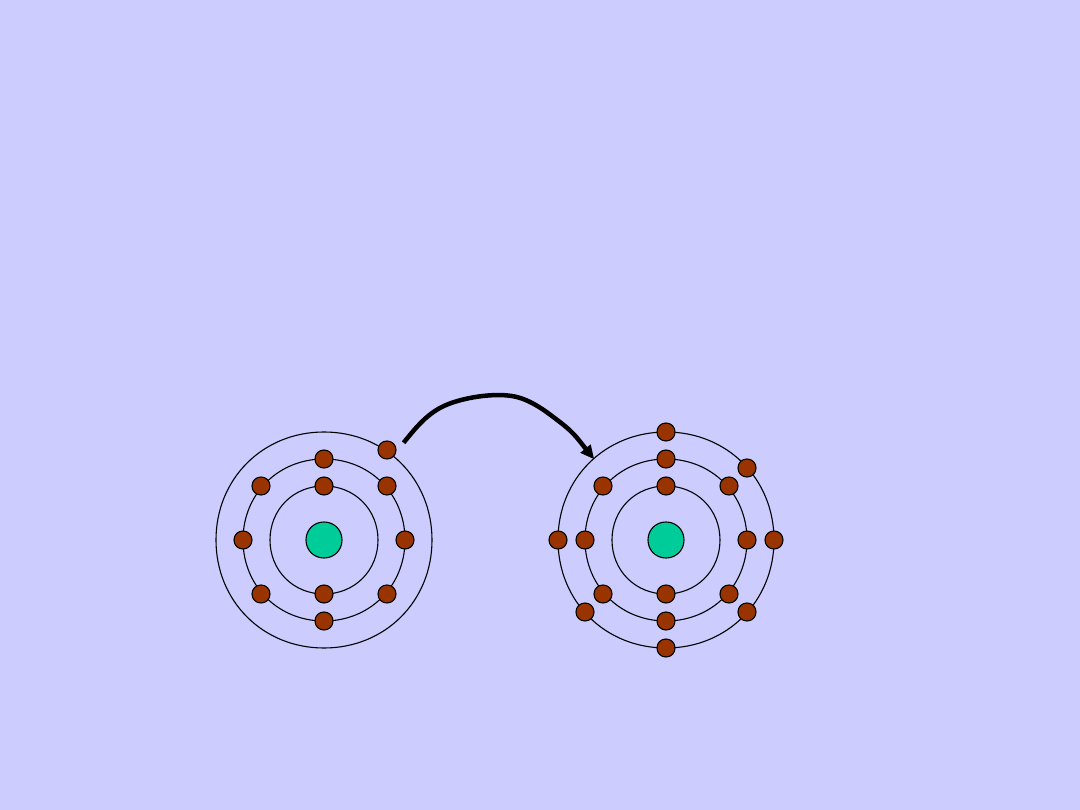
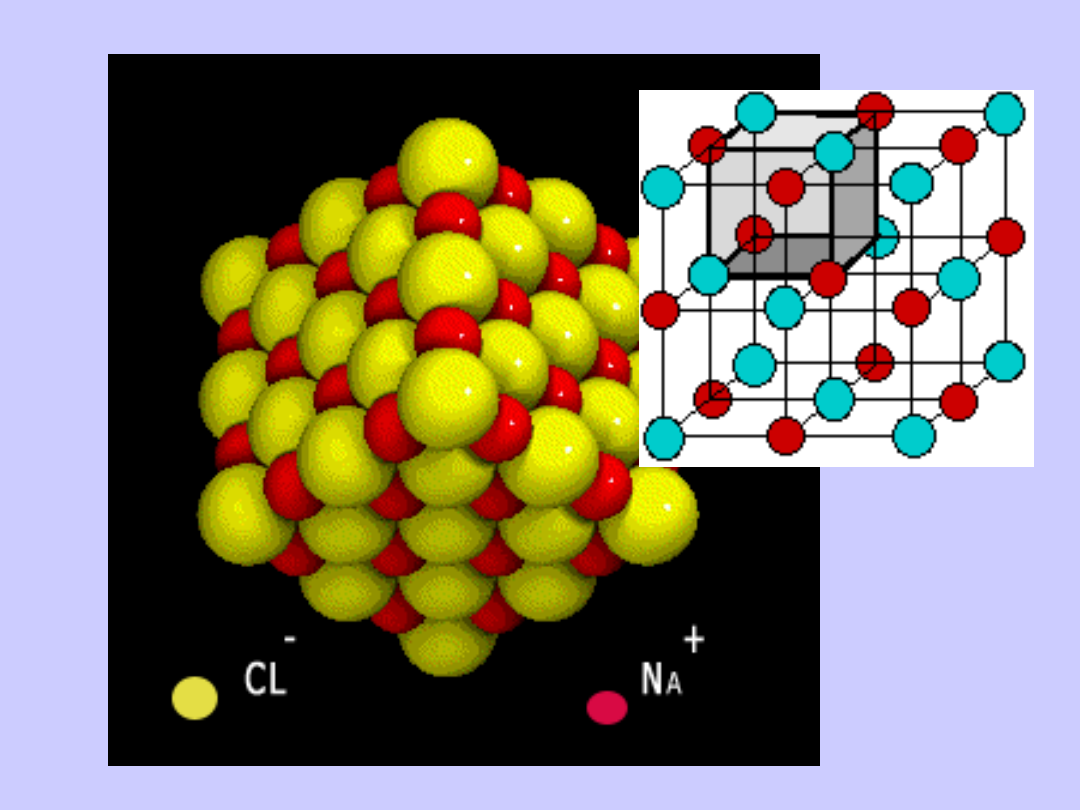
Wiązania jonowe występują w układach złożonych
z atomów skrajnie różniących się
elektroujemnością.
W czasie powstawania wiązania jonowego atom
pierwiastka elektrododatniego oddaje, a atom
pierwiastka elektroujemnego przyłącza elektrony.
Tworzą się dwa jony o różnoimiennych ładunkach,
przyciągające się dzięki działaniu sił elektrostatycznych.
Na
Cl
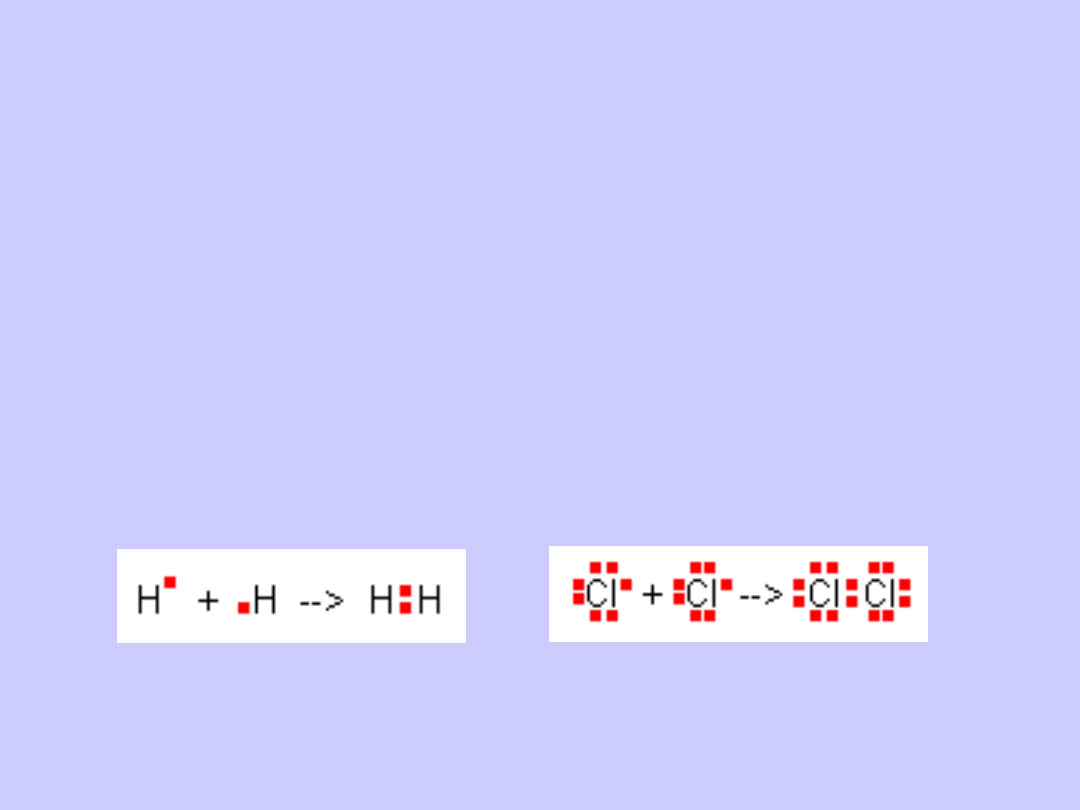
Wiązania atomowe (kowalencyjne) powstają
również, gdy łączą się ze sobą atomy pierwiastków
elektroujemnych o takich samych wartościach
elektroujemności.
Podobnie jak w wiązaniu jonowym, wiążące się atomy
dążą do osiągnięcia struktury oktetowej najbliższego
gazu szlachetnego.
Wiązania tego typu występują w cząsteczkach H
2
, Cl
2
,
O
2
, N
2
itp.
Przykładem jest wodór dla którego pojedynczy atom ma
jeden elektron.
Gdy dwa atomy wodoru tworzą cząsteczkę, ich
elektrony rozmieszczają się symetrycznie wokół
obydwu jąder, tworząc parę elektronową.
W wiązaniu atomowym wiążąca para elektronowa
znajduje się
w jednakowej odległości od jąder atomów
tworzących wiązanie.

Wiązanie atomowe spolaryzowane jest wiązaniem
pośrednim między jonowym a atomowym; powstaje
wówczas, gdy łączą się ze sobą atomy pierwiastków
różniących się elektroujemnością, lecz nie tak
znacznie jak w przypadku tworzenia wiązania
jonowego.
Cechą charakterystyczną tego wiązania jest
przesunięcie pary elektronowej wiążącej atomy w
kierunku atomu pierwiastka bardziej
elektroujemnego.
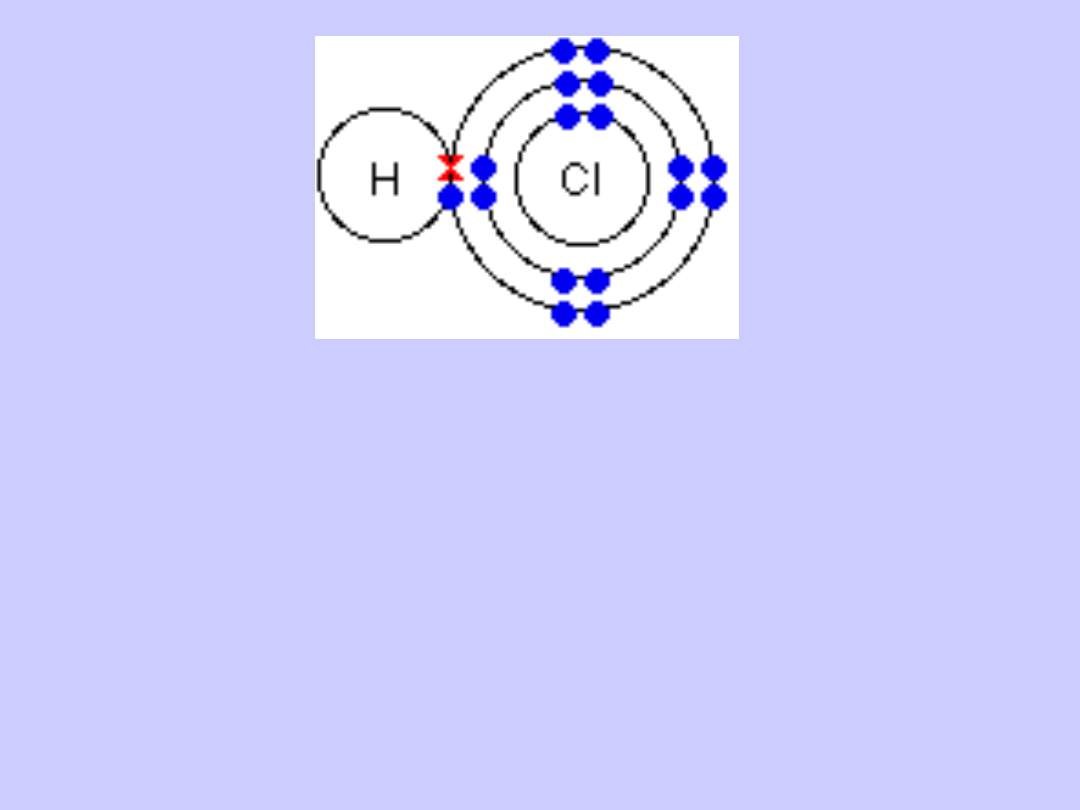
Cząsteczki z wiązaniami kowalencyjnymi
spolaryzowanymi z powodu nierównomiernego,
niesymetrycznego w stosunku do środka
cząsteczki, rozmieszczenie ładunków wykazują
biegunowość. W cząsteczkach tych wyróżnić można
biegun dodatni i ujemny.
Cząsteczki o budowie polarnej nazywamy dipolami,
tzn. cząsteczkami dwubiegunowymi.
Cząsteczki dwubiegunowe mają tzw. moment
dipolowy u
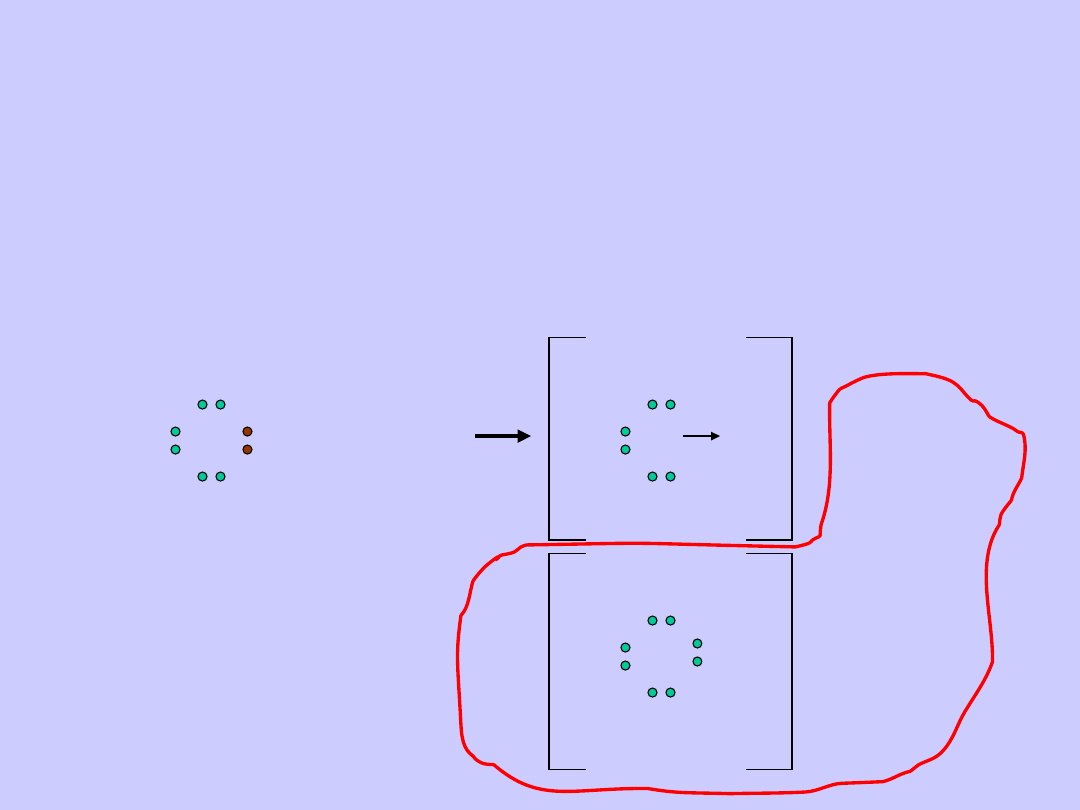
Wiązanie koordynacyjne tym różni się od wiązania
atomowego lub atomowego spolaryzowanego, że
para elektronowa tworzących wiązanie oddawana
jest przez jeden z dwóch łączących się atomów.
Najprostszym przykładem powstawania wiązania
koordynacyjnego jest tworzenie się jonu amonowego
+
H
+
Cl
-
N
H
H
H
N
H
H
H
H
+
+
Cl
-
N
H
H
H
H
+

Połączenia, w których występują
wiązania koordynacyjne noszą nazwę
związków koordynacyjnych,
związków kompleksowych, albo
kompleksów.
W związku kompleksowym wyróżnia
się atom centralny i cząsteczki
koordynowane zwane ligandami.
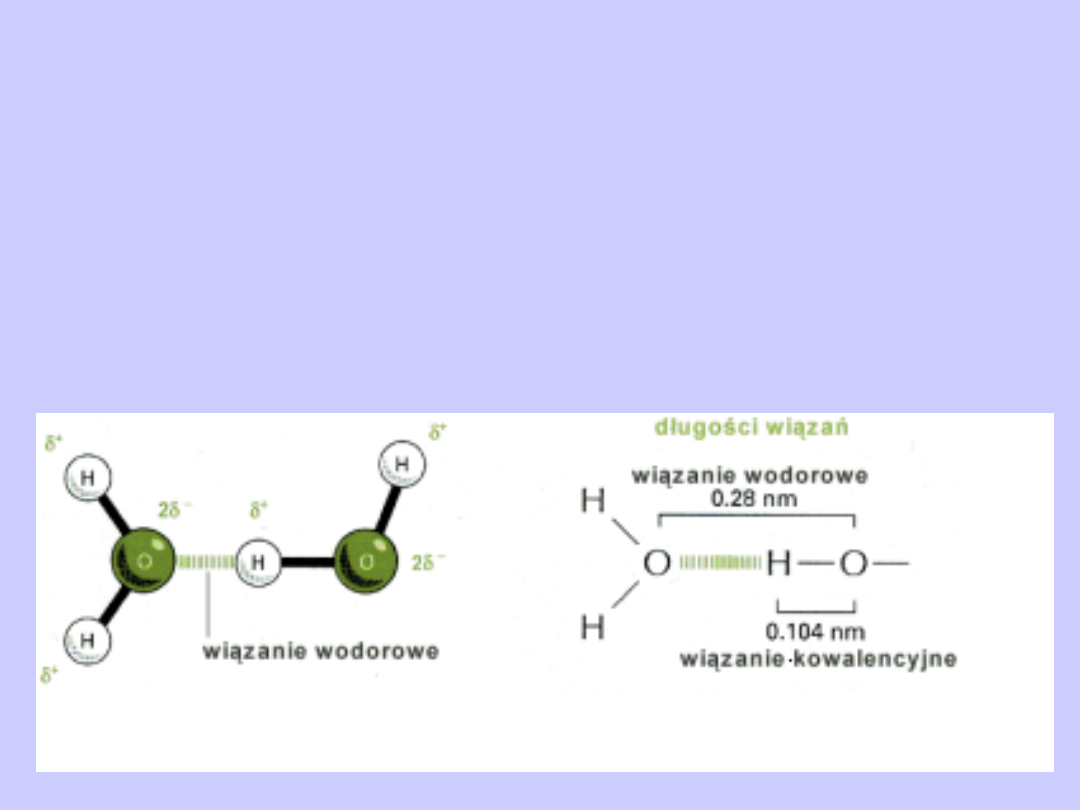
Wiązania wodorowe
Jest to słabe oddziaływanie elektrostatyczne pomiędzy
elektroujemnym atomem (akceptorem), a atomem
wodoru, który jest kowalencyjnie połączony z innym
atomem elektroujemnym (donorem). W wiązaniu tym
wodór pełni rolę mostka łączącego dwa elektroujemne
atomy.
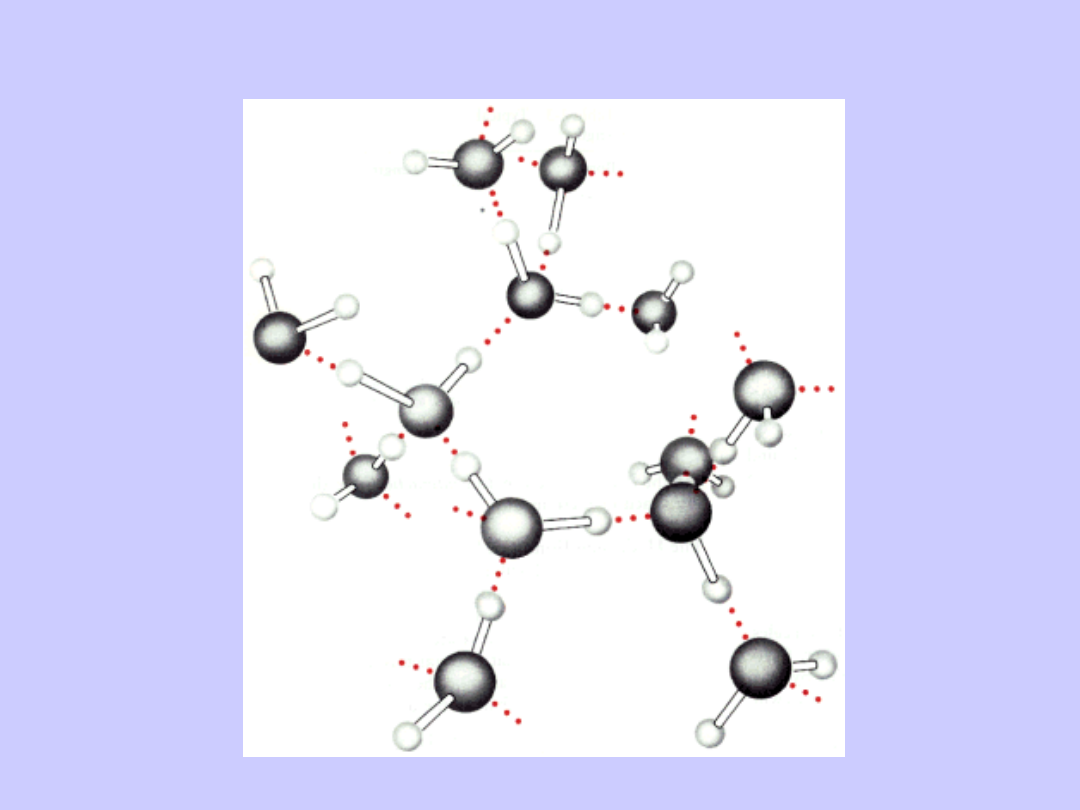
Wiązania wodorowe

Siły van der Waalsa
Siły van der Waalsa są bardzo słabymi oddziaływaniami
zachodzącymi pomiędzy wszystkimi typami atomów
(zarówno polarnymi jak i niepolarnymi). W chmurze
elektronowej otaczającej jądro pojawiać się mogą
chwilowe fluktuacje rozmieszczenia ładunków
ujemnych - wynik normalnego ruchu elektronów. Takie
nieregularności prowadzą do powstawania i zanikania
dipoli, które wpływają na rozmieszczenie elektronów w
sąsiednich atomach.
Gdy atomy znajdujące się w bezpośrednim sąsiedztwie
mają spolaryzowane chmury elektronowe, pojawiać się
może słabe przyciąganie. Zanika ono bardzo szybko
wraz ze wzrostem odległości między atomami,
natomiast gdy atomy znajdą się zbyt blisko siebie
zostają odepchnięte przez jednoimienne ładunki chmur
elektronowych.

Oddziaływania van der Waalsa
odpowiadają
na przykład za przyciąganie się cząsteczek
niepolarnych cieczy oraz stanowią siły
łączące składniki ścian komórkowych
(poprzez przyciąganie się niepolarnych
łańcuchów fosfolipidów).

Kwantowa teoria wiązania chemicznego
Teoria ta zakłada, że podczas powstawania wiązania
chemicznego chmury elektronowe orbitali (zawierających
niesparowany elektron) każdego z wiążących się atomów
przenikają się lub nakładają nawzajem i powstają w ten
sposób tzw. orbitale molekularne.
Z obliczeń stosowanych w mechanice kwantowej wynika, że energia
orbitalu cząsteczkowego powstałego z połączenia dwóch,
obsadzonych pojedynczymi elektronami o przeciwnych spinach,
orbitali atomowych jest tym mniejsza, a energia wiązania tym
większa, im lepiej nakładają się lub przenikają chmury elektronowe
danych orbitali atomowych.
Takie nakładanie się orbitali atomowych powoduje zwiększenie
gęstości chmury elektronowej pomiędzy jądrami atomowymi. Z kolei
przenikanie się chmur elektronowych jest najpełniejsze
wówczas, gdy wyróżnione kierunkami wiążących orbitali
atomowych leżą na wspólnej osi. W ten sposób przestrzenna
konfiguracja orbitali wpływa na kierunek wiązań chemicznych w
przestrzeni i na kształt cząsteczek.
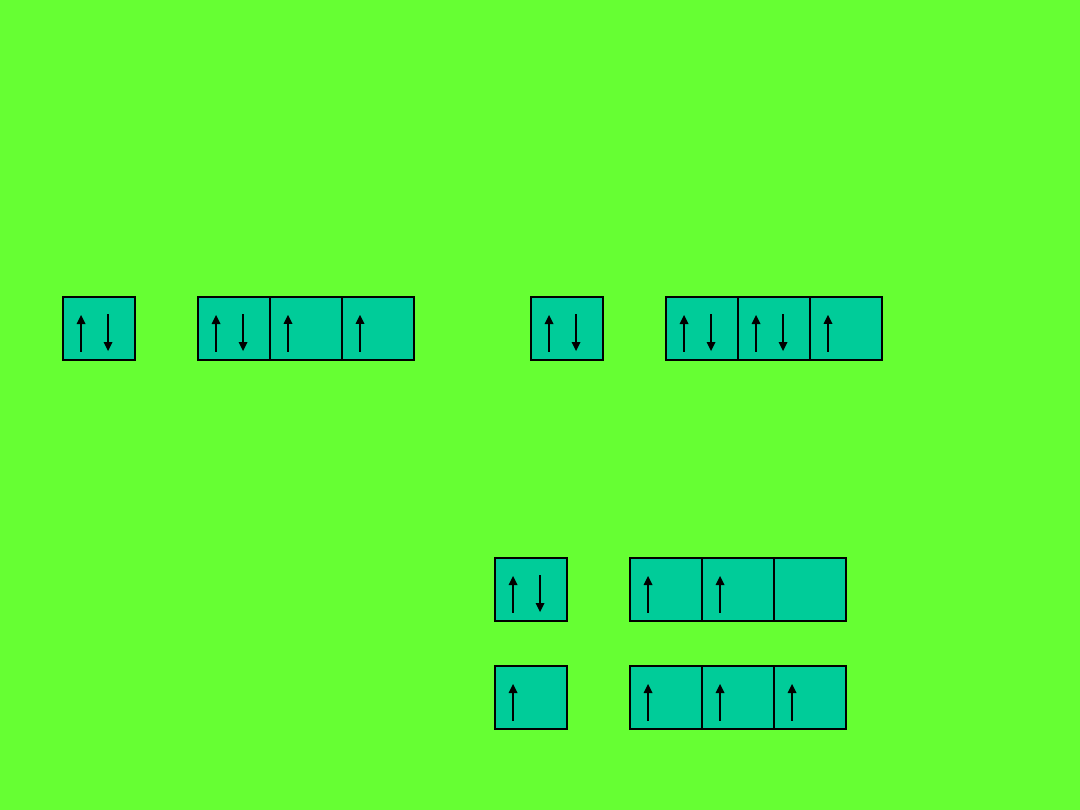
Udział w wiązaniu kowalencyjnym biorą tylko elektrony nieparzyste
zawarte w atomie:
tlen (8)
s
2
p
4
chlor (17)
s
2
p
5
węgiel (8)
s
2
p
2
s
1
p
3
w stanie podstawowym:
w związkach:

Schemat wiązania s-s
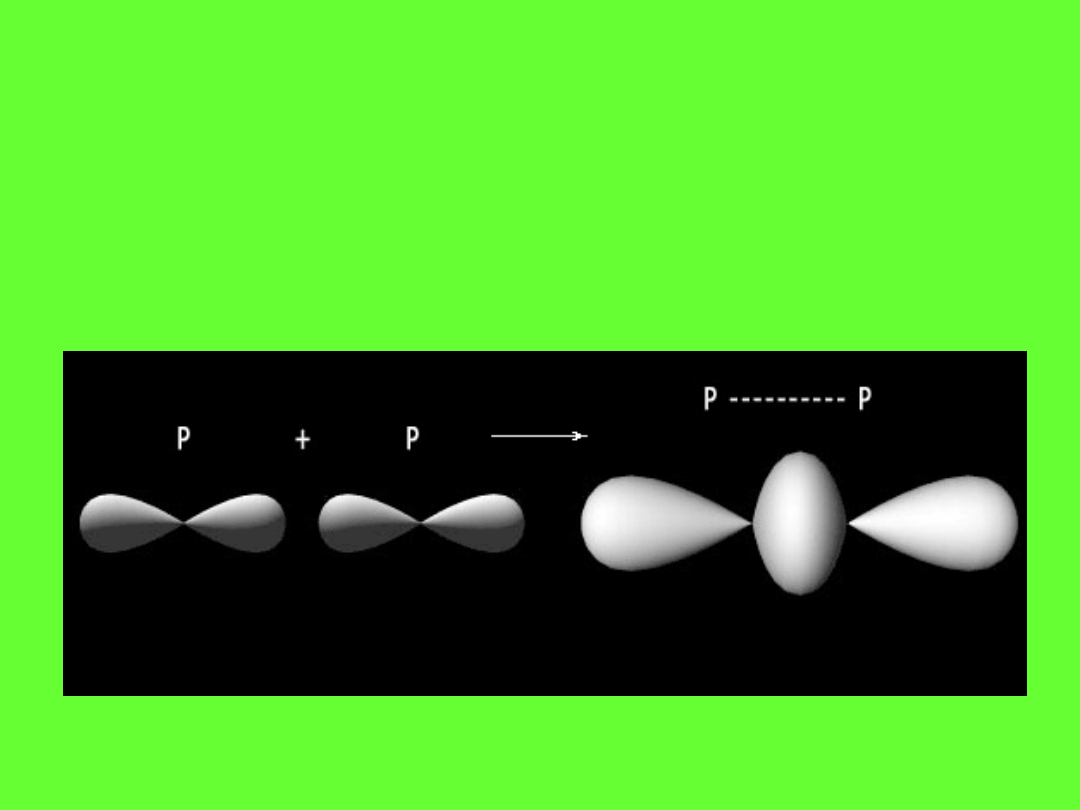
Schemat wiązania p-p

Schemat wiązania s-p
Orbitale molekularne tworzą się z orbitali atomowych poprzez
kombinację funkcji falowych
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
Wyszukiwarka
Podobne podstrony:
Budowa atomu i wiązania chemiczne test odpowiedzi
Chemia - Budowa atomu i wiązania chemiczne(1), EDUKACJA 35 000 TYS. plików z każdej branży
Chemia, Chemia - Budowa atomu i wiązania chemiczne, LICZBA ATOMOWA(liczba porządkowa):wielkość chara
WYKŁAD (budowa atomu, CHEMIA
BUDOWA ATOMU, WIĄZANIA zadania
Wyklad 4 Wiazania chemiczne w cialach stalych
Budowa atomu 2, CHEMIA, semestr 1, chemia ogólna, wykłady
budowa materii i wiazania chem, Chemia, Gimnazjum, kl1, Budowa atomu
wiazania-chemiczne-i-budowa-czasteczek
Budowa atomu a układ okresowy pierwiastków chemicznych
budowa atomu wykład 1
Wyklad 4 Wiazania chemiczne w cialach stalych
Budowa atomu a układ okresowy pierwiastków chemicznych
Wyklad 8 Wiazania chemiczne
Wiązania chemiczne (II)
więcej podobnych podstron