
WIĄZANIE CHEMICZNE

Teoria orbitali molekularnych
• Zachowanie elektronów w cząsteczce
opisują
orbitale molekularne
(cząsteczkowe).
• Orbital molekularny jest orbitalem
wielocentrowym (odnosi się do układu
zawierającego więcej niż jedno jądro
(orbital atomowy: jednocentrowy).
• Określony orbital może opisywać
zachowanie co najwyżej
dwóch
elektronów
• Orbitale molekularne opisywane są przy
pomocy
czterech liczb kwantowych
,
obowiązuje
zakaz Pauliego
oraz
reguła
Hunda
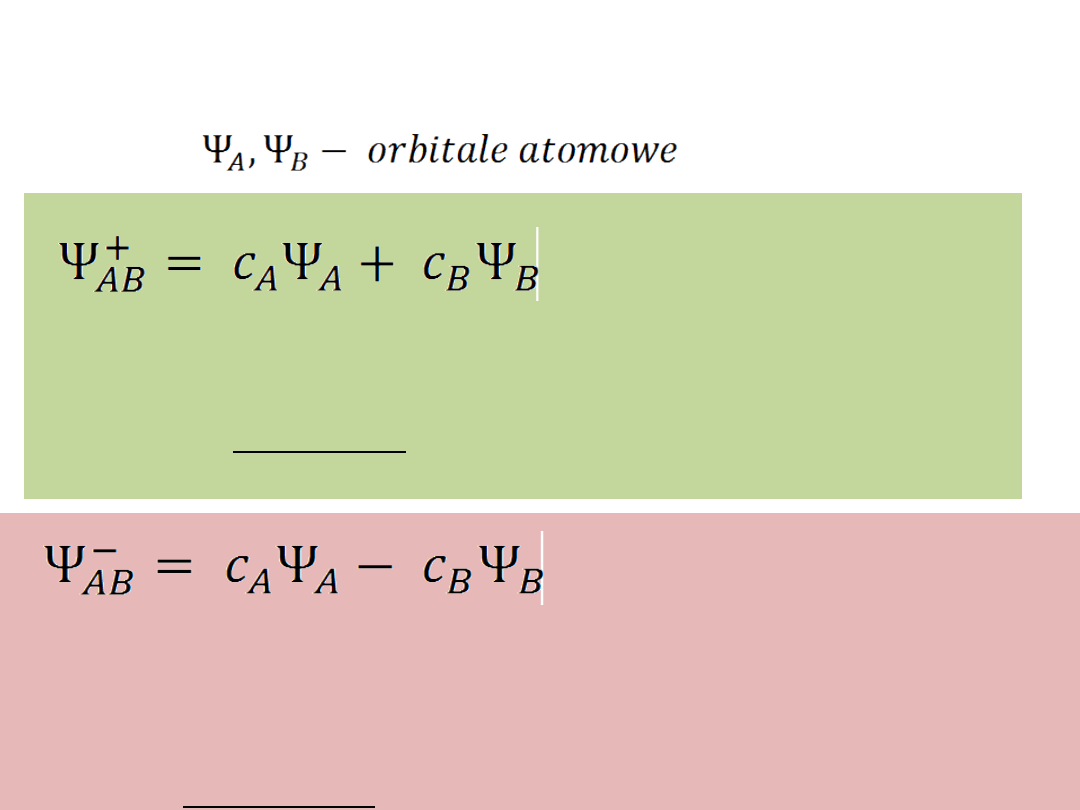
Teoria orbitali molekularnych
A-B
ORBITAL WIĄŻĄCY
- o niższej energii niż energia
odpowiednich orbitali atomowych
Układ o większej trwałości
ORBITAL ANTYWIĄŻĄCY
- cząsteczka zawierająca
obydwa elektrony na tym orbitalu ma wyższą energię
niż dwa izolowane atomy A i B
Układ o mniejszej trwałości

EFEKTYWNE ORBITALE MOLEKULARNE
• Obu orbitalom atomowym odpowiadają
porównywalne energie elektronów
• Orbitale atomowe nakładają się na
siebie; im większe jest nakładanie tym
wiązanie jest mocniejsze
• Oba orbitale atomowe wykazują taką
samą symetrię w stosunku do osi
łączącej oba jądra
Teoria orbitali molekularnych
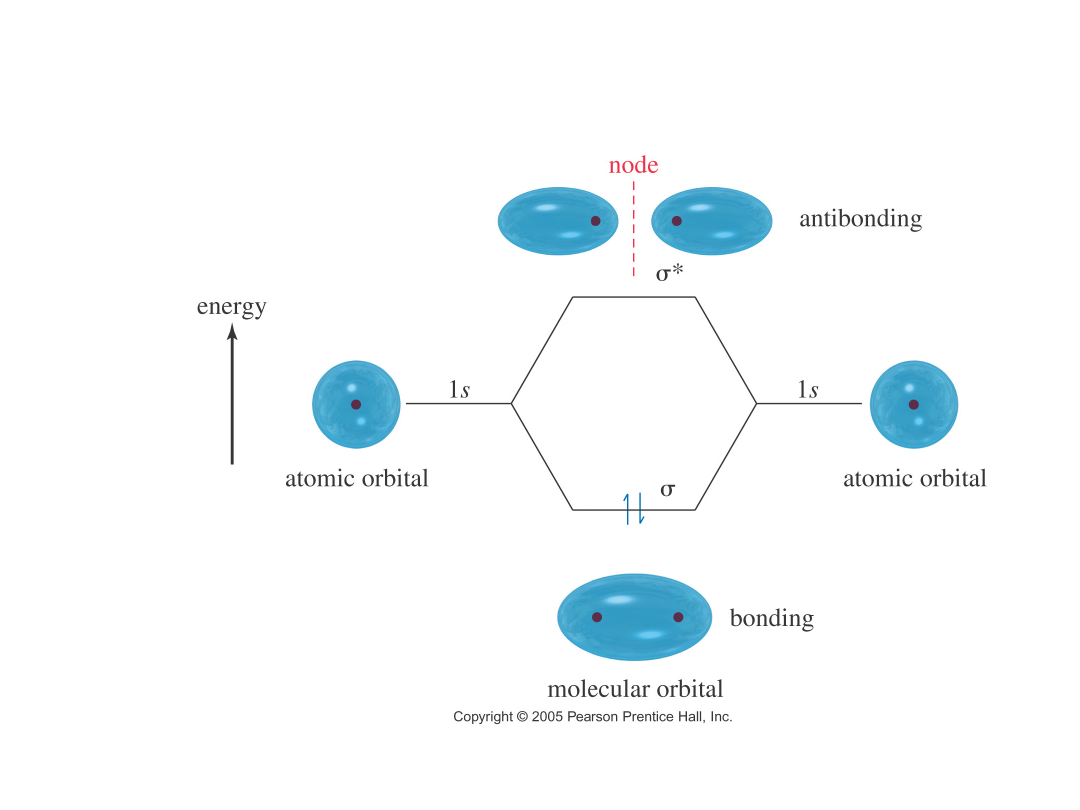
Nakładanie się orbitali…
Wiązanie s
Wiązanie s
igma
igma
()
H
2
: nakładanie się orbitali s-s
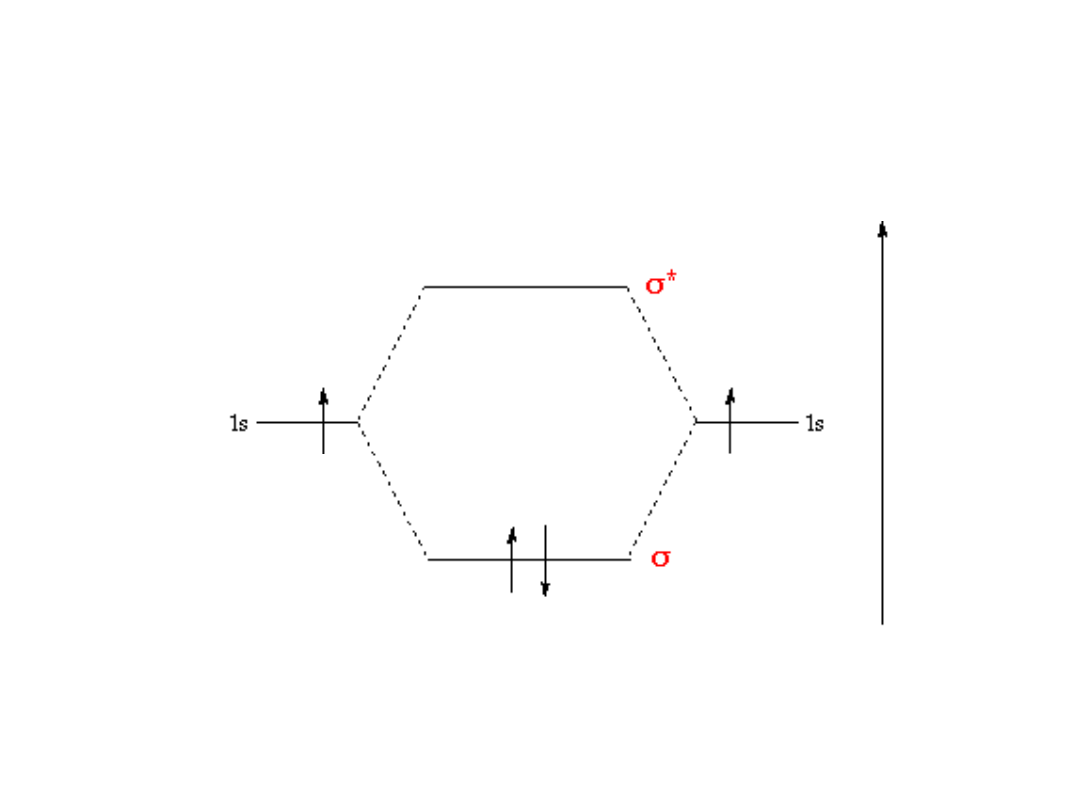
Orbital molekularny
Energia
Orbital atomowy
Orbital atomowy
H
2
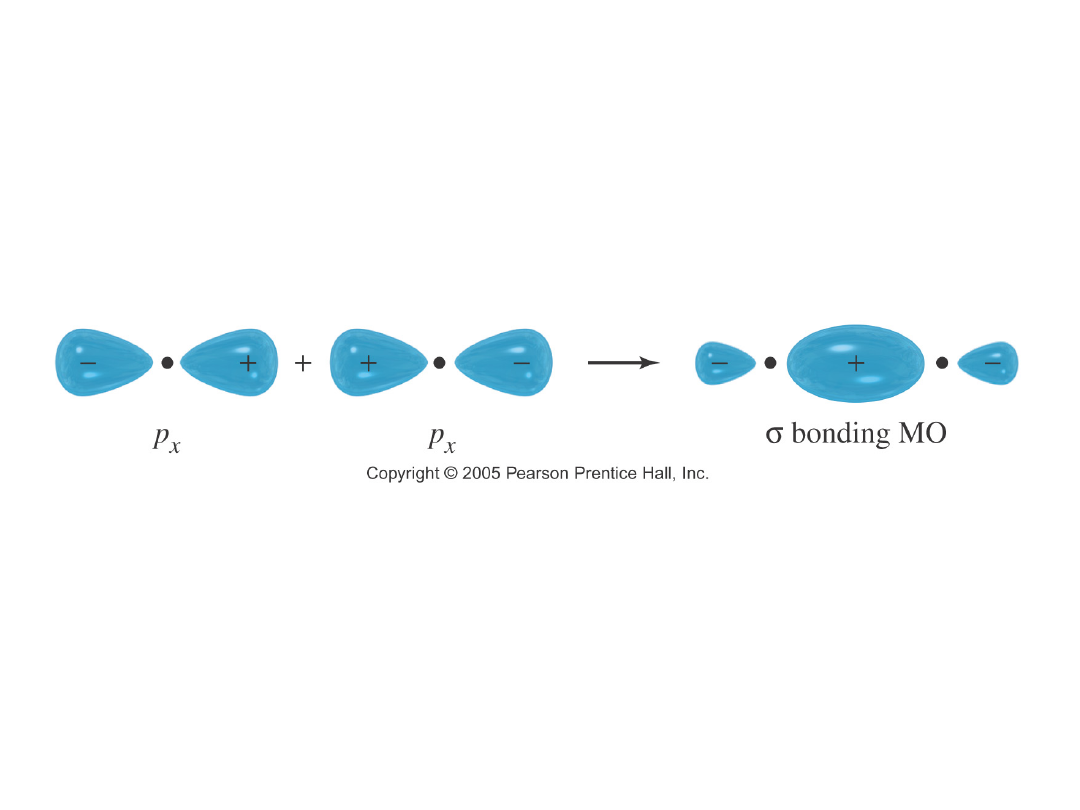
Nakładanie się orbitali…
Cl
2
: nakładanie się orbitali p-p

Orbitale zhybrydyzowane
• Uśrednienie chmur elektronowych tj.
tworzenie się orbitali typu pośredniego
w stosunku do orbitali s, p, d
• Mają inny kształt niż orbitale typu
prostego
• Utworzone orbitale zapewniają
maksymalne nakładanie się orbitali
atomowych
• Cząsteczki mają określoną geometrię

Wiązania tworzą się poprzez
nakładanie się:
• Orbitali zhybrydyzowanych z
orbitalami atomowymi
• Orbitali zhybrydyzowanych z innymi
orbitalami zhybrydyzowanymi
Orbitale zhybrydyzowane
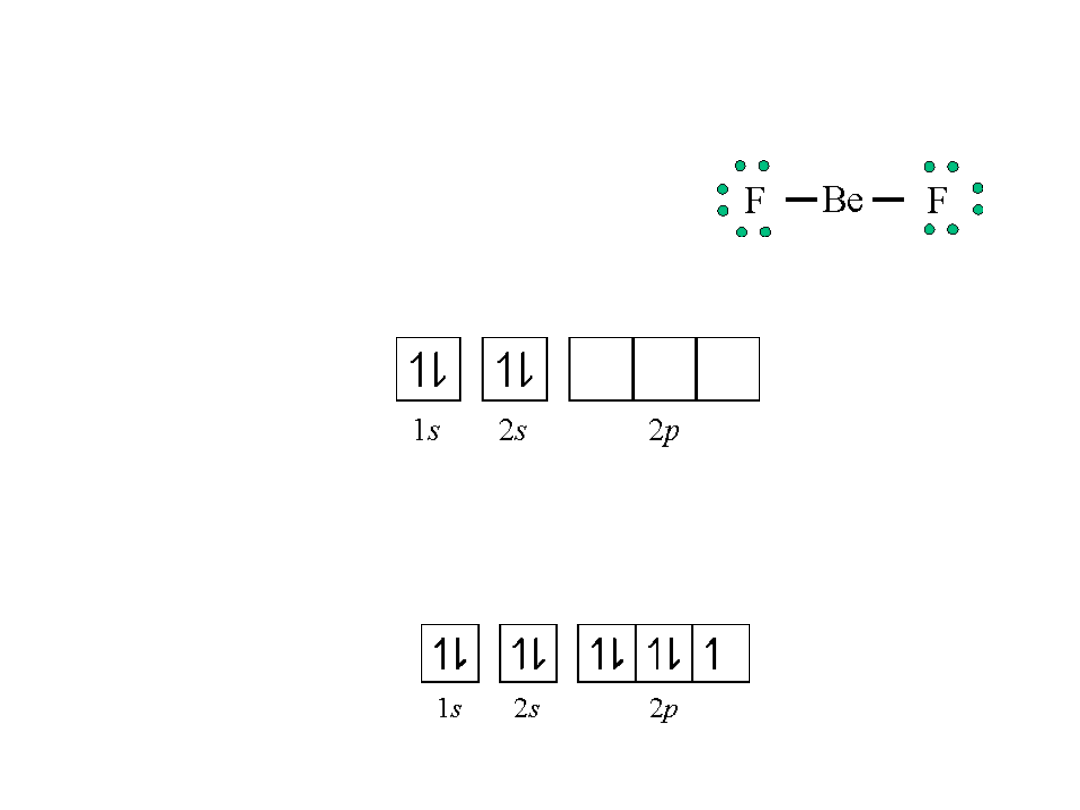
Orbitale zhybrydyzowane
Hybrydyzacja spBeF
2
F: 1s
2
2s
2
2p
5
Be: 1s
2
2s
2
Stan podstawowy
Sparowane elektrony!
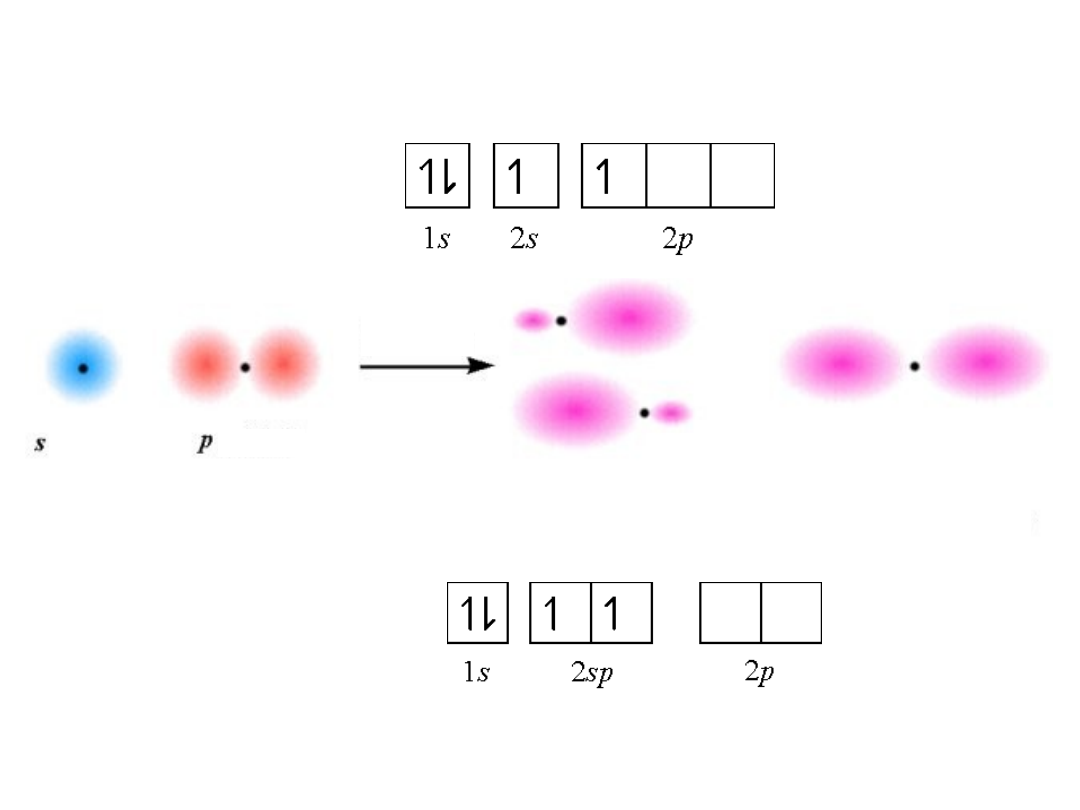
Be:
zhybrydyzowane
orbitale sp
hybrydyzacja
Hybrydyzacja sp
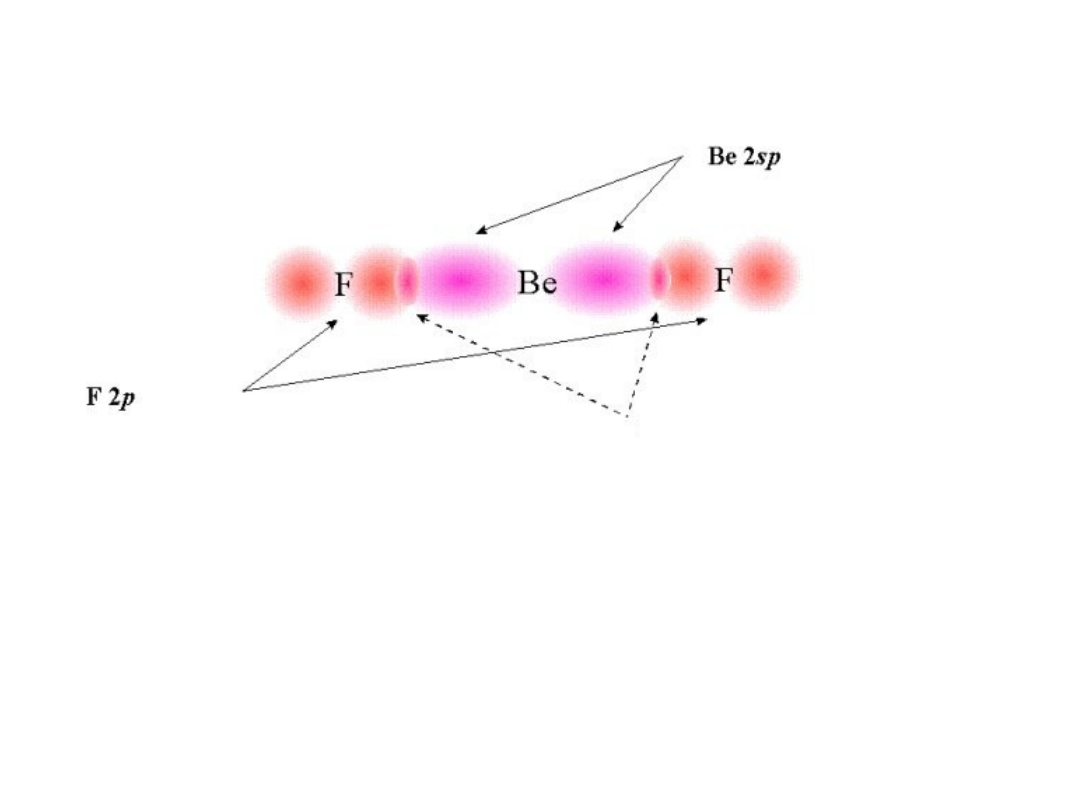
Nakładanie się orbitali: wiązanie
Orbitale zhybrydyzowane sp są jednakowo zorientowane 180
Cząsteczka jest liniowa!
Hybrydyzacja sp
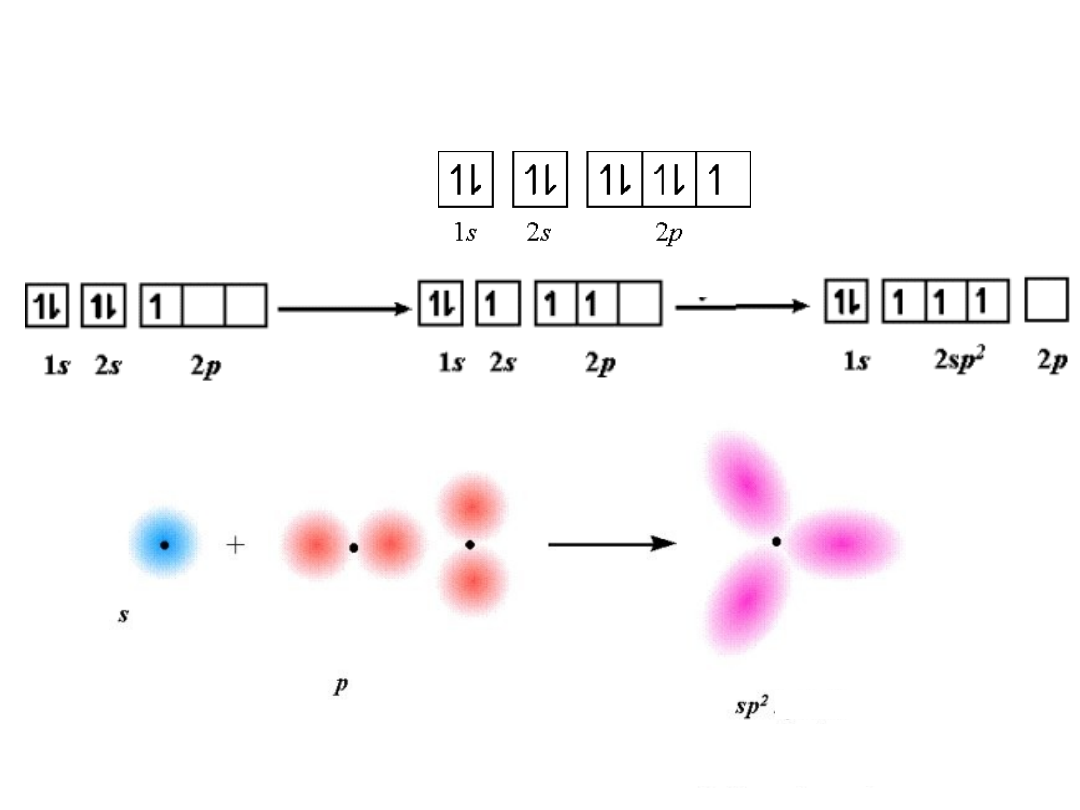
Hybrydyzacja sp
2
BF
3
F: 1s
2
2s
2
2p
5
Trygonalna
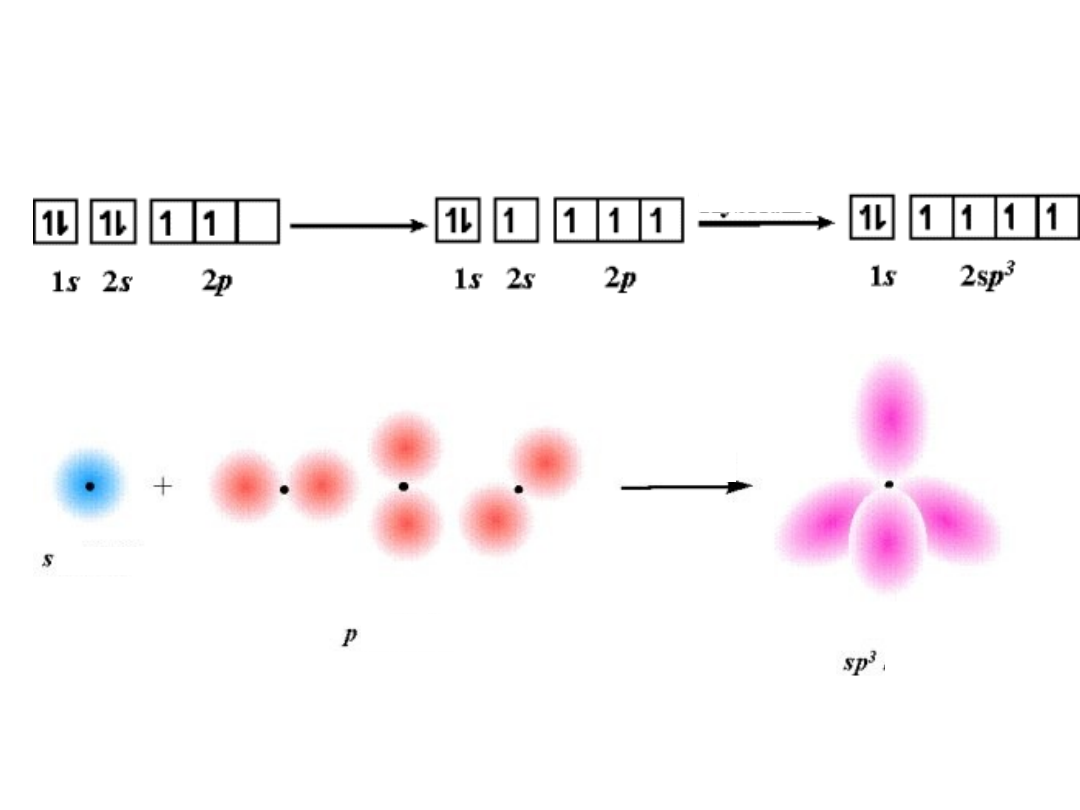
Hybrydyzacja sp
3
CH
4
Tetraedryczna
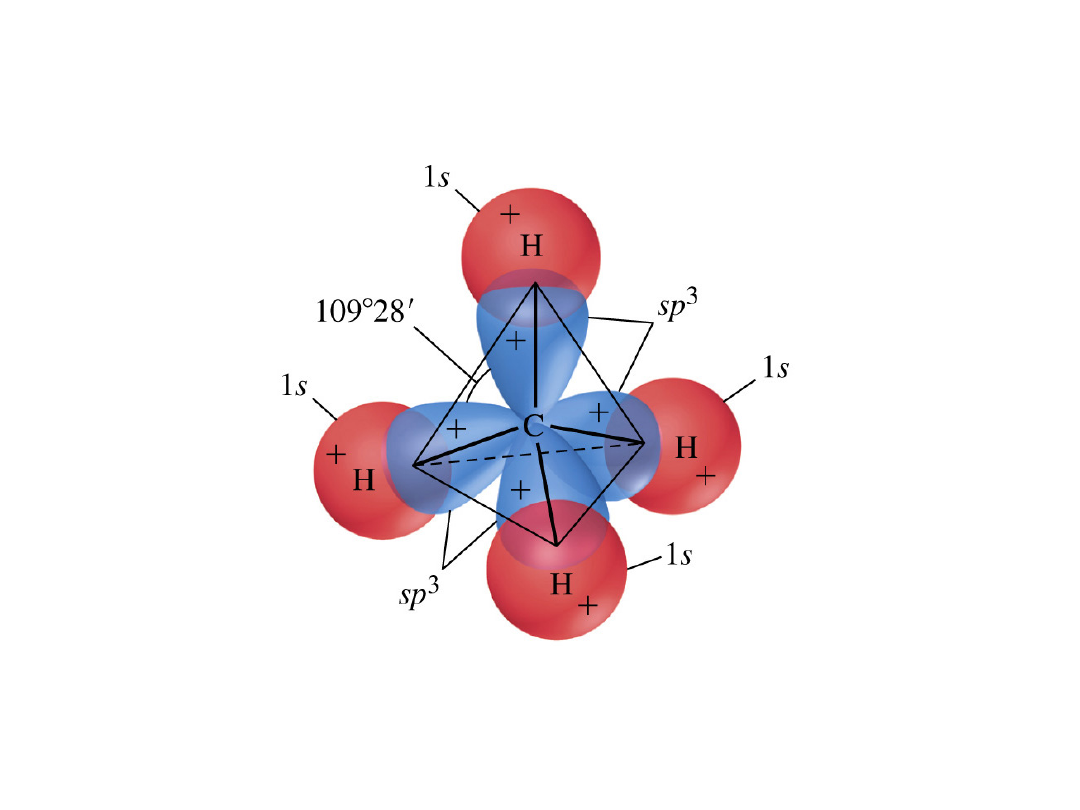
CH
4
sp
sp
2
sp
3
sp
3
d
sp
3
d
2
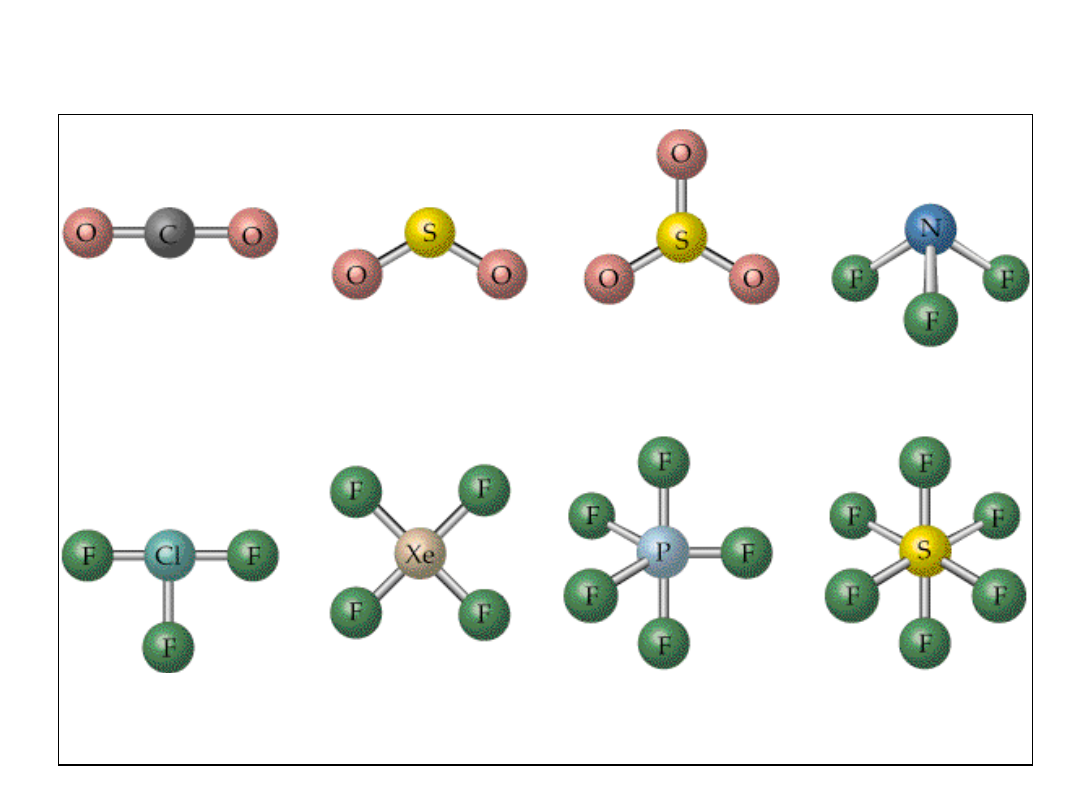
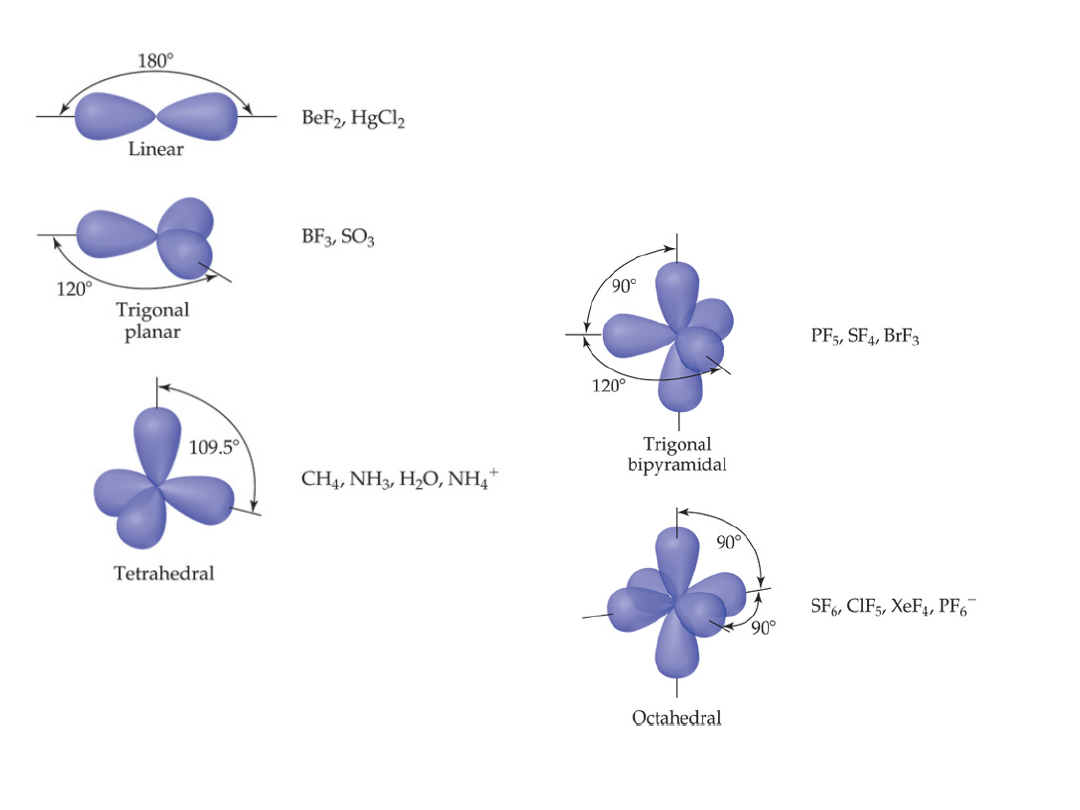
Geometria cząsteczek
liniowa
AB
2
AB
3
AB
4
LINIOWA
TRYGONALNA
TETRAEDR
T
KWADRATOWA BIPIRAMIDA
TRYGONALNA
OKTAEDR
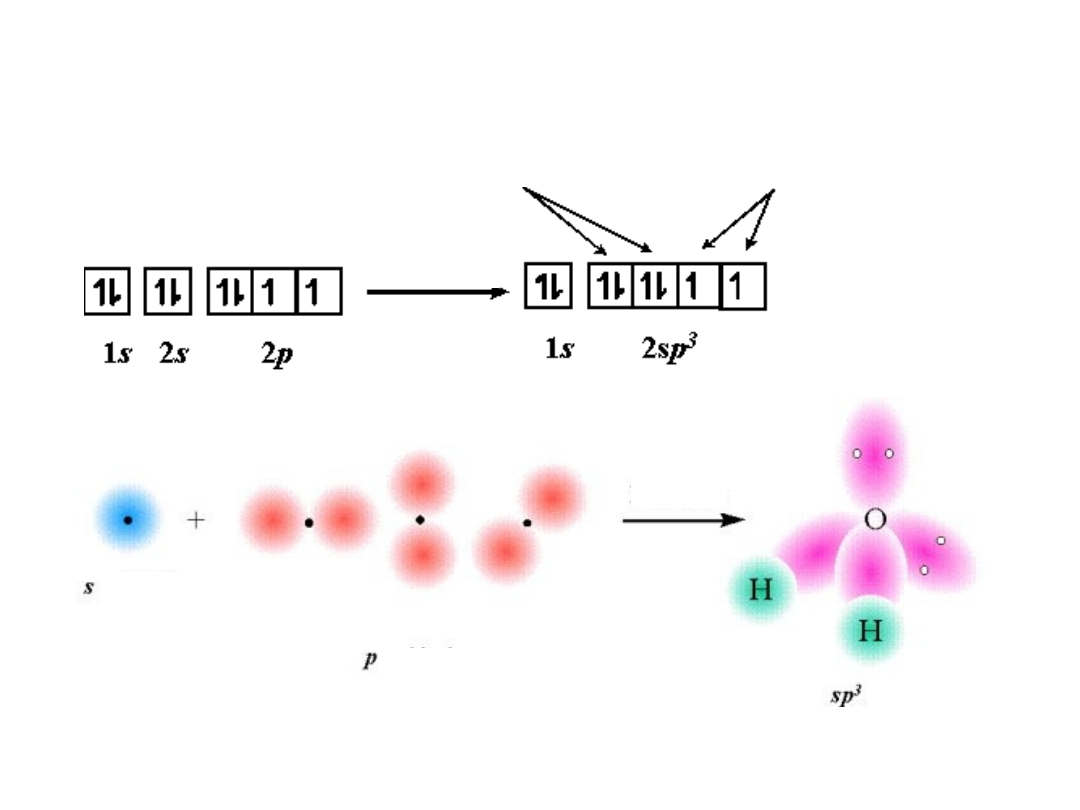
Hybrydyzacja sp
3
H
2
O
tlen
Wolne paryNiesparowane elektrony
Tetraedryczna
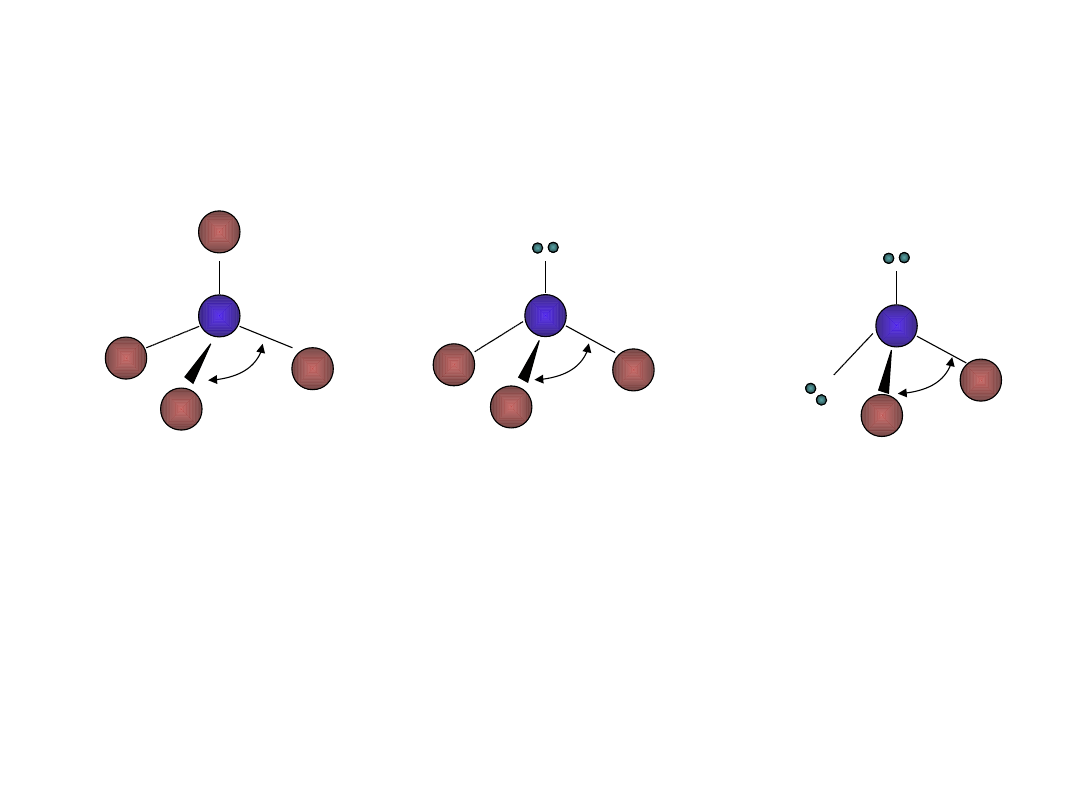
109. 5°
CH
4
NH
3
107°
104 .°5
H
2
O
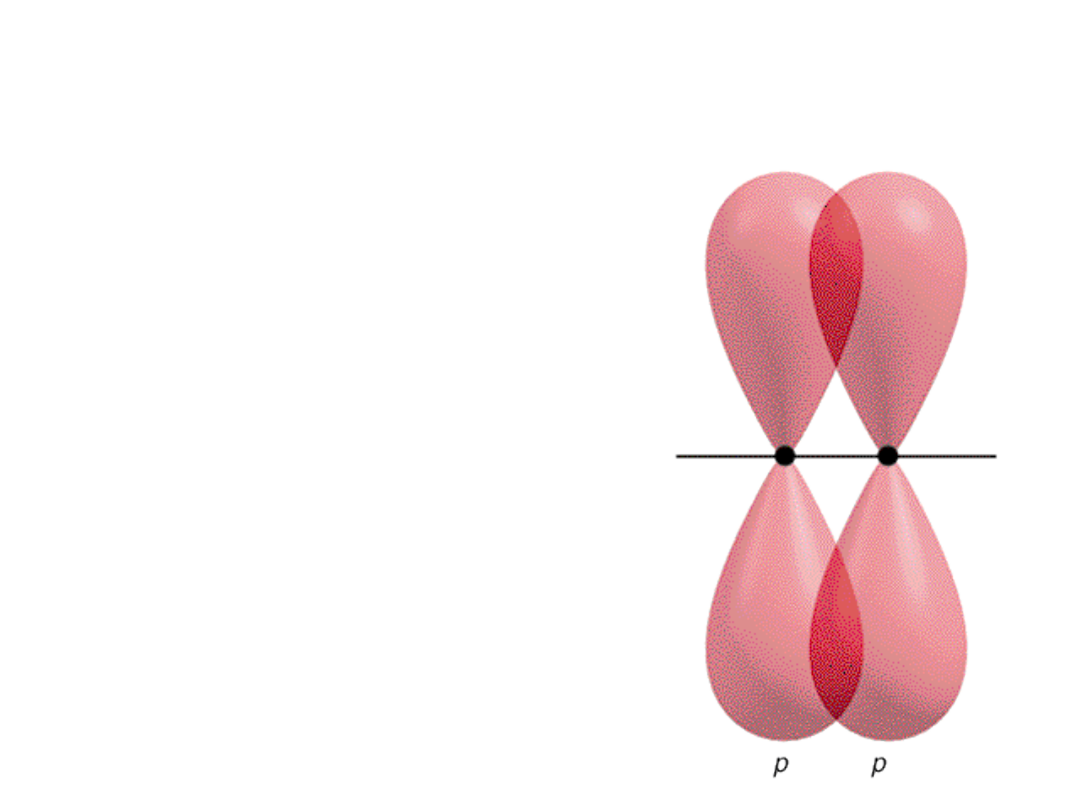
Nakładanie się orbitali…
Wiązanie pi ()
Boczne nakładanie się orbitali
H
H
2
2
C=CH
C=CH
2
2
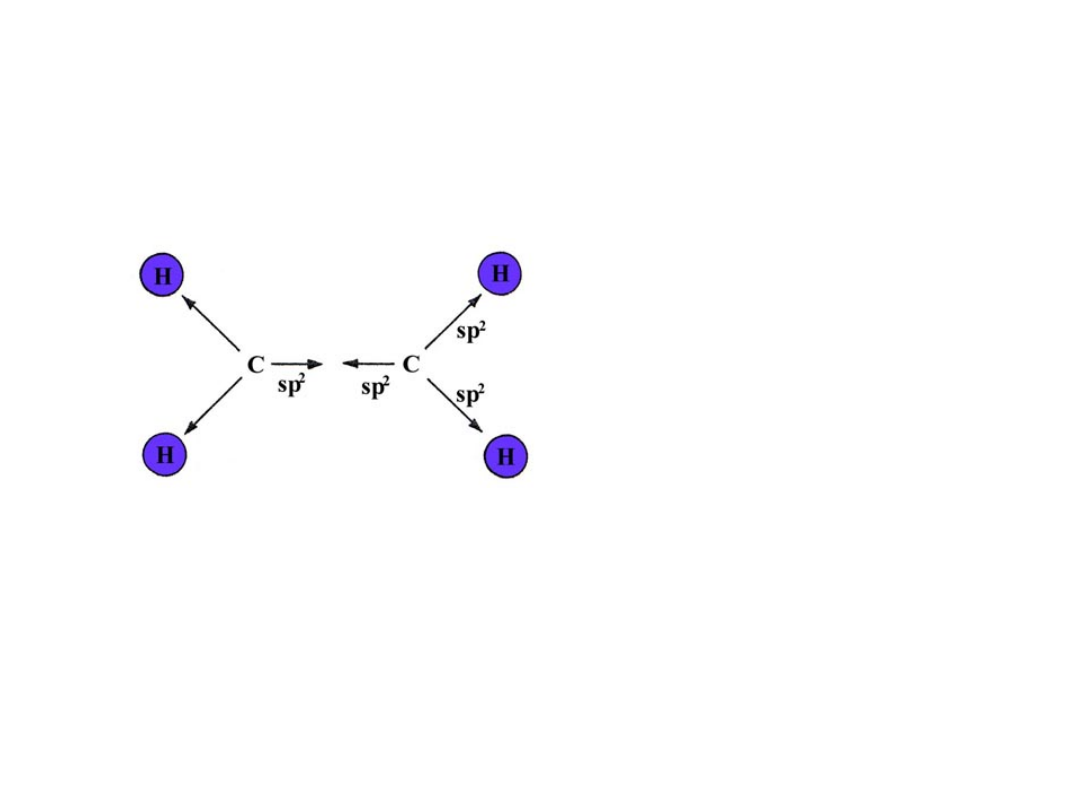
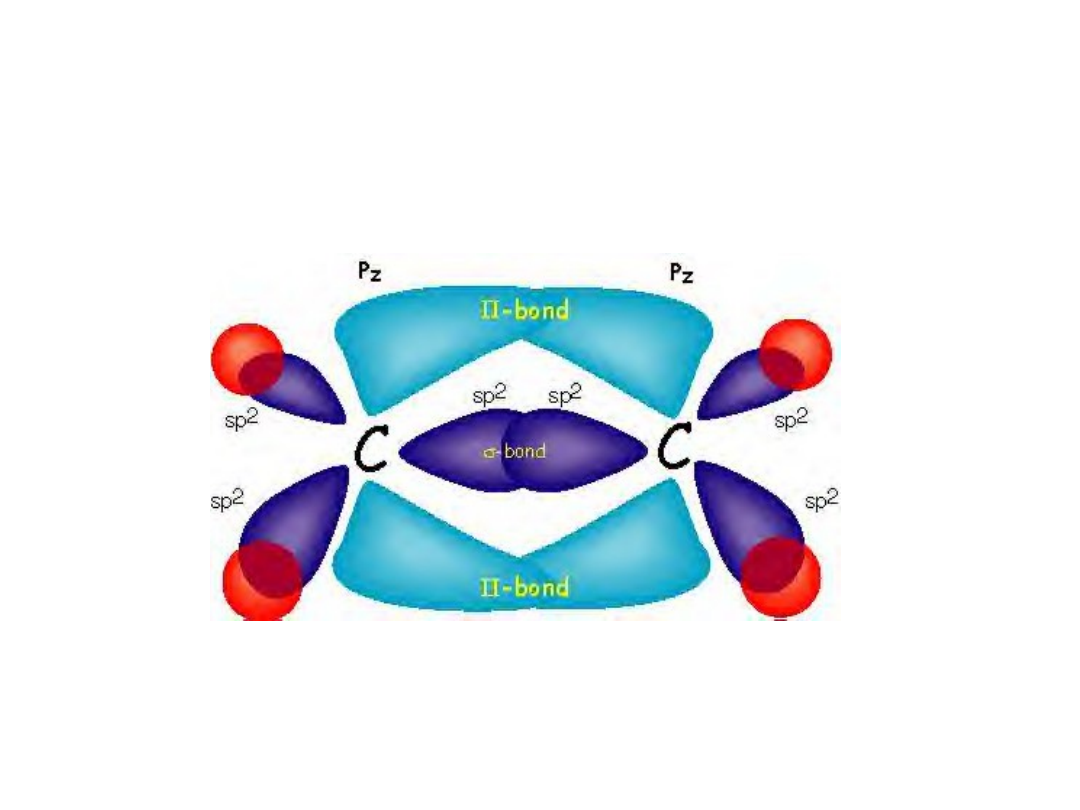
C
Trzy orbitale sp
2:
- Wiązanie sigma C-C
- Wiązania sigma C-H
Orbital p tworzy poprzez nakładanie
Boczne z drugim orbitalem p wiązanie pi
Wzdłuż wiązania sigma tworzy się drugie wiązanie:
Etylen wiązanie podwójne C-C
H
H
2
2
C=CH
C=CH
2
2
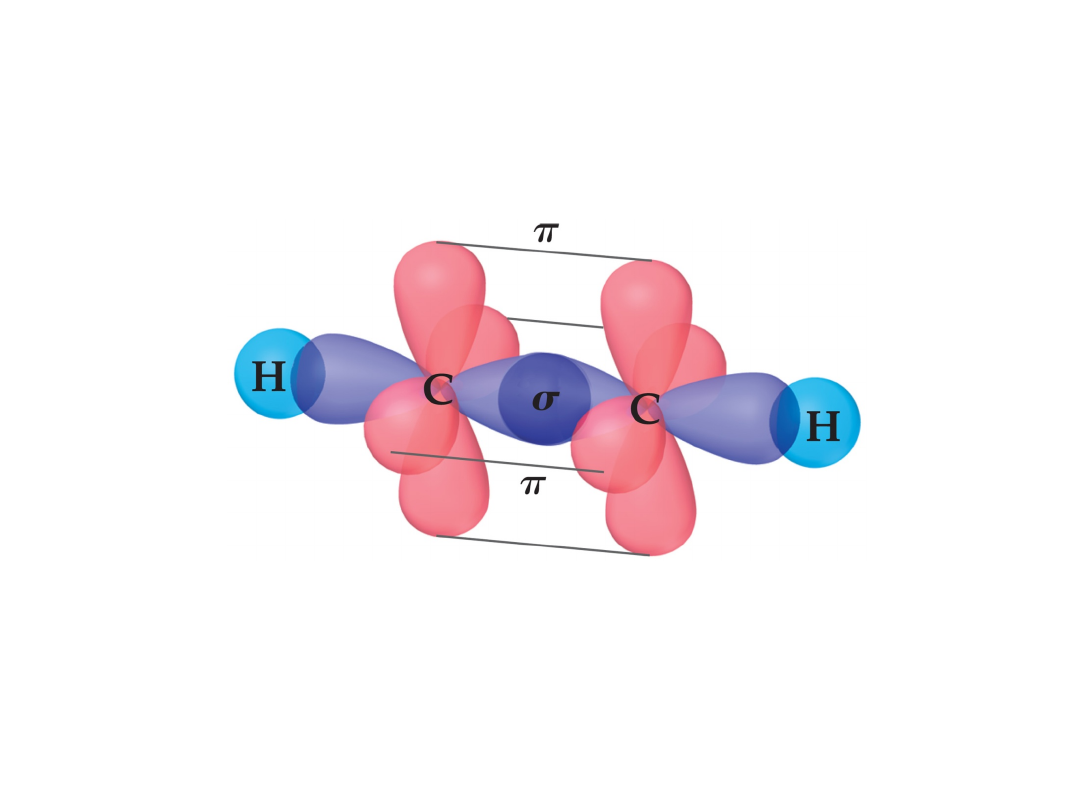
Acetylen
Acetylen
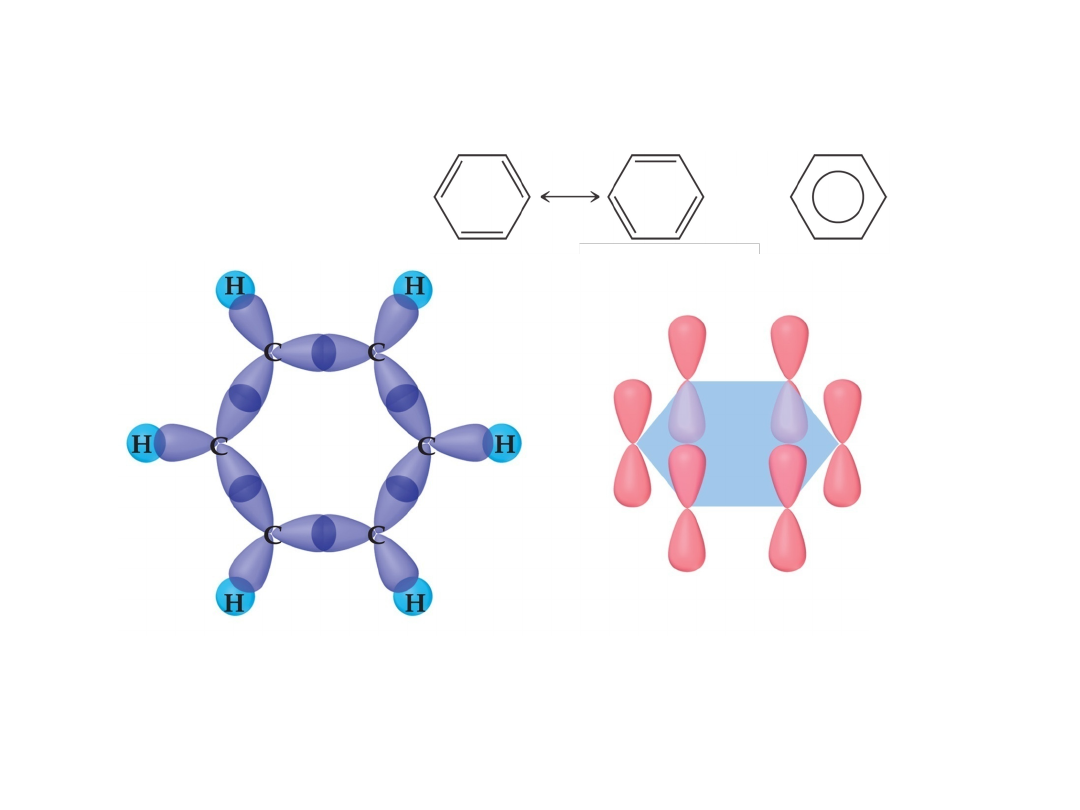
Wiązania zdelokalizowane
lub
„Struktury graniczne”
Wzory mezomeryczne
Węgiel: sp
2
Trzy wiązania sigma w płaszczyźnie
Czwarty elektron
walencyjny każdego
atomu węgla znajduje się
na orbitalu atomowym p,
prostopadłym do wiązań
sigma
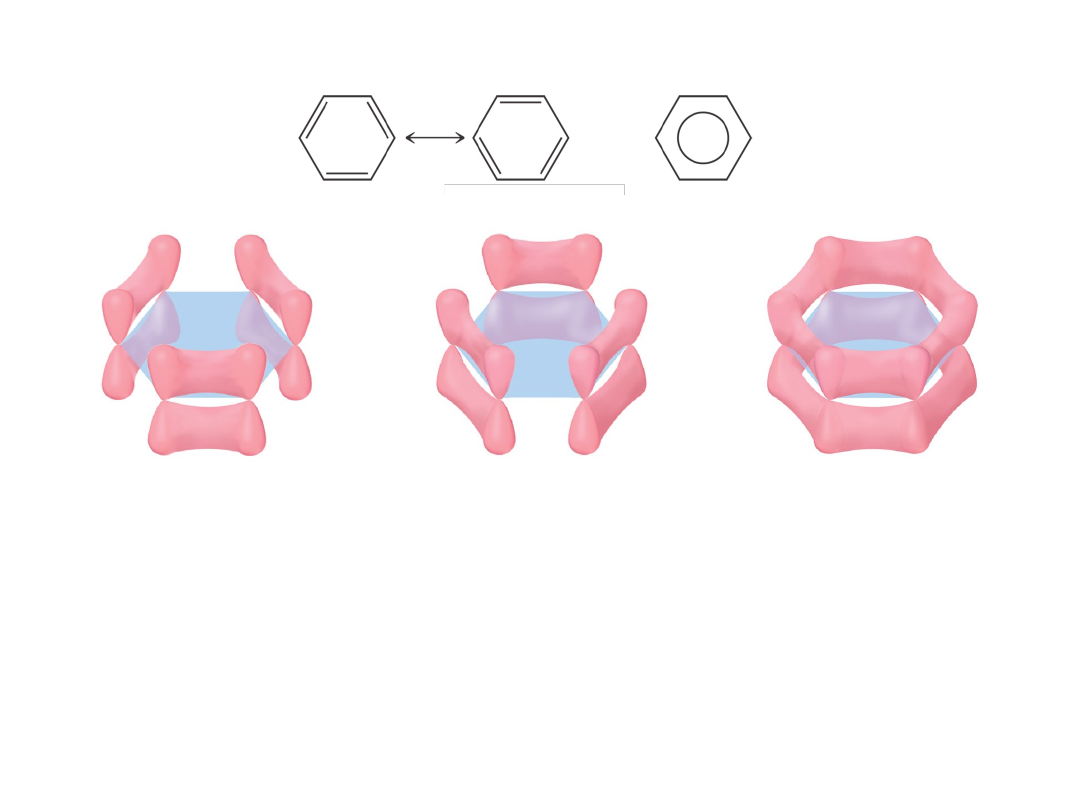
lub
Boczne nakładanie orbitali p (każdy z jednym elektronem)
prowadzi do utworzenia 6 orbitali cząsteczkowych typu pi
3 wiążące (obsadzone); 3 niewiążące (nieobsadzone)
Delokalizacja wiązań: stabilność termodynamiczna!

• Wiązania pojedyncze to zawsze
wiązania sigma ()
• Wiązania sigma () to mocne wiązania
• Wiązania wielokrotne to wiązania pi ()
• Wiązanie pi () znacznie łatwiej ulega
rozerwaniu niż wiązanie sigma ()
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
Wyszukiwarka
Podobne podstrony:
pdf wykład 03 orbitale molekularne i hybrydyzacja 2014
wykład 5 teoria orbitali molekularnych
Hybrydyzacja orbitali atomowych
12) Hybrydyzacja orbitaliid 136 Nieznany (2)
Hybrydyzacja orbitali atomowych
12) Hybrydyzacja orbitali
W4 Proces wytwórczy oprogramowania
W4 2010
Statystyka SUM w4
w4 3
W4 2
W4 1
w4 skrócony
in w4
więcej podobnych podstron