
Równowaga kwasowo -
zasadowa

Fizjologiczne pH krwi = 7,35 – 7,45
Bufor – układ: słaby kwas + jego anion
Równanie Hendersona – Hasselbacha
–
określa
zależność
pomiędzy
pH
płynów
ustrojowych a stałą dysocjacji kwasu, który wraz
ze swoim anionem stanowi bufor ustrojowy
pH buforu nie zależy od bezwzględnych stężeń
kwasu i jego anionu ale od
stosunku stężenia anionu do stężenia kwasu
pH buforu nie zmienia się po rozcieńczeniu

Istnieje stała tendencja do
zakwaszania organizmu:
Kwasy są dostarczane z pożywieniem
Kwasy – produkt końcowy metabolizmu białek,
lipidów i węglowodanów
CO
2
–
produkt
końcowy
metabolizmu
komórkowego
Kwasy
-
produkty
pośrednie
przemiany
węglowodanów w hipoksji (kwas mlekowy) oraz
tłuszczów
(hydroksymaślan,
acetooctan)
w
cukrzycy lub głodzeniu
Kwasy – produkty utleniania aminokwasów
zawierających siarkę (metionina) oraz fosfolipidów

Bufory krwi
Wodorowęglanowy – 53% poj. buforowej
Hemoglobinianowy – 35% poj. buforowej
Białczanowy – 7% poj. buforowej
Fosforanowy – 5% poj. buforowej

Bufor wodorowęglanowy
Bardzo
efektywny,
gdyż
H
2
CO
3
pozostaje
w
stanie
równowagi
ze
swoim
bezwodnikiem CO
2
CO
2
+ H
2
O
H
2
CO
3
H
+
+ HCO
3-
800cz
1cz
0,03cz
0,03cz

Bufor wodorowęglanowy
c.d.
Głównym donorem H
+
jest w sposób
pośredni CO
2
rozpuszczony we krwi
Prawo Henriego – stężenie gazu
rozpuszczonego w cieczy jest wprost
proporcjonalne do ciśnienia gazu nad
cieczą, czyli CO
2
rozp pozostaje w stanie
równowagi
z
CO
2
z
powietrza
pęcherzyków płucnych
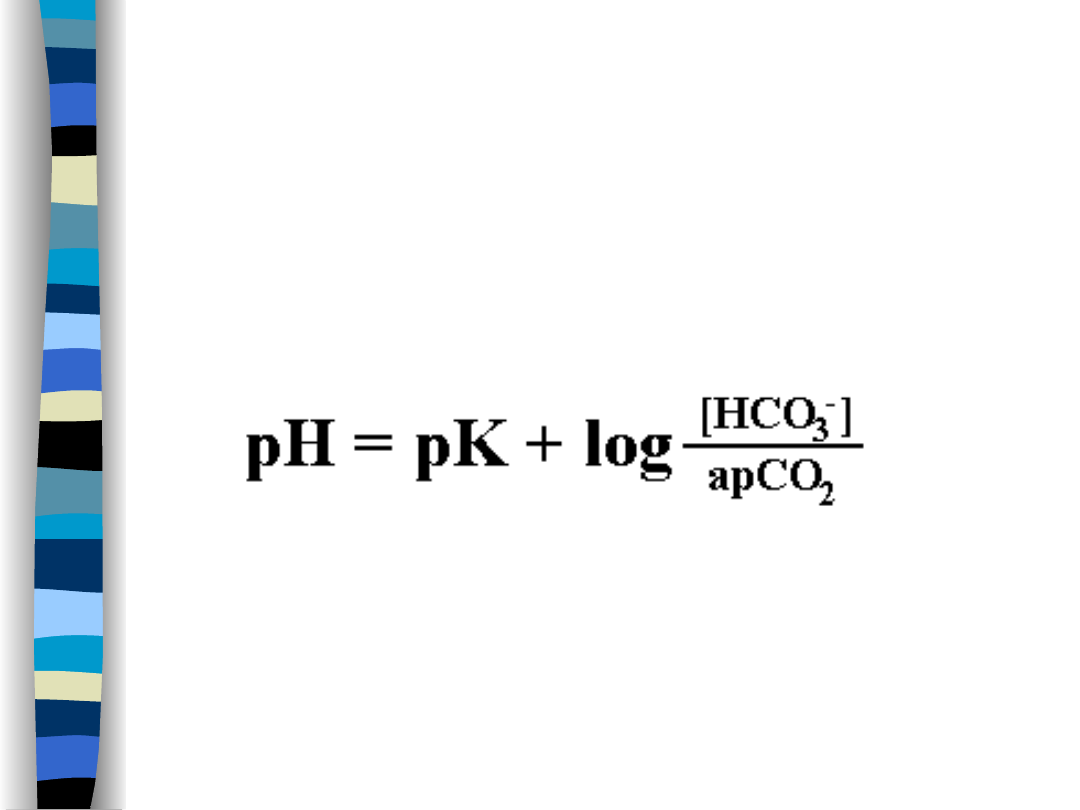
Bufor wodorowęglanowy
c.d.
Równanie Hendersona – Hasselbacha
dla tego buforu
pK = 6,1
a – współczynnik rozpuszczalności CO
2
; w
temp. 37
o
C = 0,03

Bufor wodorowęglanowy
c.d.
To równanie tłumaczy regulację pH we
krwi
w
zależności
od
zmian
metabolicznych i zmian oddechowych

Bufor białczanowy
W fizjologicznym pH osocza = 7,4
większość białek osoczowych jest
anionami (akceptorami H
+
)
Punkty izoelektryczne białek osocza
w pH = 4,9 – 6,4

Bufor hemoglobinianowy
Najważniejszy bufor białkowy krwi – Hb
stanowi prawie 75% całkowitego białka
krwi.
Hb ma charakter kwaśny – grupy
kwasowe
hemu
przeważają
nad
zasadowymi globiny. Stąd Hb ma duże
zdolności wiązania zasad.

Bufor hemoglobinianowy
Kwaśność Hb ulega wybitnej zmianie
w zależności od stopnia utlenowania
Hb utlenowana jest 40 – 70x silniejszym
kwasem niż odtlenowana, stąd Hb
odtlenowana jest lepszym akceptorem
H
+
niż utlenowana.

Rola płuc w regulacji RKZ
Spadek pH, wzrost pCO
2
Pobudzenie ośrodka oddechowego
Przyspieszenie i pogłębienie oddechów
Zwiększone usuwanie CO
2
drogą płuc

Rola przewodu
pokarmowego w regulacji
RKZ
Regulacja
zachodzi
poprzez
wywołanie
wymiotów
w
celu
usunięcia H
+
i Cl
-
Utrata Cl
-
pociąga za sobą wzrost
resorpcji HCO
3-
w nerkach
Ten
typ
buforowania
n.p.
u
pacjentów
z kwasicą ketonową

Rola układu kostnego w
regulacji RKZ
Największy magazyn zasad w organizmie
W procesy buforowania włącza się najpóźniej –
tygodnie, miesiące, lata
Podstawowy
czynnik
buforujący
–
hydroksyapatyt
Oddysocjowanie jednego jonu Ca
2+
wiąże się z
przyłączeniem 2xH
+
Długotrwałe
zakwaszenie
może
więc
prowadzić do patologicznych zmian w kośćcu,
demineralizacji,
czego
konsekwencją
są
złamania

Zaburzenia równowagi
kwasowo - zasadowej

Kwasica oddechowa
Skutek retencji CO
2
w organizmie
Wzrost pCO
2
, obniżenie pH, [HCO
3-
] bez
zmian
Przyczyny
1.
Uszkodzenie nerwowej regulacji oddychania
Choroby OUN, urazy - uszkodzenie ośrodka
oddechowego
Uszkodzenie unerwienia mięśni oddechowych
(toksyny: jad kiełbasiany, kurara)

Kwasica oddechowa
2.
Ograniczenie
ruchomości
klatki
piersiowej
Zmiany w strukturze kostnej klatki
piersiowej (pourazowe, stany zapalne)
Nadmierna otyłość
Upośledzenie
czynności
mięśni
oddechowych (zanik mięśni, skurcz
tężcowy)

Kwasica oddechowa -
przyczyny
3.
Choroby płuc lub opłucnej
Obrzęk płuc, nacieki nowotworowe
4.
Ostra lub przewlekła niewydolność
mięśnia sercowego
5.
Niedostateczne oddychanie sztuczne
lub stosowanie mieszanek gazowych o
dużej zawartości CO
2
Kwasica oddechowa
Ostra
– znaczne
zmiany pH, gdyż
gromadzący się
CO
2
może być
buforowany tylko
przez bufory
wewnątrzkomórk
owe
Przewlekła
-stosunkowo
często występuje
w przewlekłym
zapaleniu oskrzeli
i rozedmie płuc
u palaczy

Kwasica oddechowa –
mechanizmy obronne
Buforowanie chemiczne
Hamowanie glikolizy i cyklu Krebsa
Kompensacja nerkowa – po 2-3 dniach
Hamowanie
glikolizy,
wzrost
glukoneogenezy
Postępowanie terapeutyczne –
poprawa wentylacji płucnej

Zasadowica oddechowa
Efekt
zwiększonej
wentylacji
przy
prawidłowym
wytwarzaniu
CO
2
w
tkankach
Zmniejszenie pCO
2
, wzrost pH, [HCO
3-
]
w normie
Przyczyny
1.
Hiperwentylacja psychogenna – silne
bodźce nerwowe, np. ból, histeria
2.
Urazy lub zmiany chorobowe w obrębie
OUN: gorączka, egzo- lub endotoksyny
(np. w śpiączce wątrobowej), nowotwory

Zasadowica oddechowa
3.
Hipoksja o różnym pochodzeniu
Obniżenie pCO
2
w otoczeniu
W przebiegu przewlekłych chorób
płuc
4.
Posocznica, zatrucie salicylanami
5.
Mechaniczna hiperwentylacja bez
kontroli pO
2
i pCO
2
we krwi

Mechanizmy kompensacji
Buforowanie chemiczne
Buforowanie nerkowe
Zmniejszenie resorpcji HCO
3-
(wzrost
resorpcji Cl
-
)
Zahamowanie
amoniogenezy
i
tworzenia
kwaśności
miareczkowej
moczu

Objawy zasadowicy
oddechowej
Na skutek zwężenia naczyń mózgowych
–
zawroty
głowy,
zaburzenia
świadomości, osłabienie, niepokój

Kwasica metaboliczna
Spadek [HCO
3-
], spadek pH, pCO
2
w
normie

Przyczyny kwasicy
metabolicznej
1.
Zwiększone wytwarzanie lub podaż
z zewnątrz nadmiernej ilości kwasów
przewyższająca możliwości buforowania
i wydzielania
Ciała ketonowe
Mleczany
Salicylany
Metanol, glikol etylenowy
Kwasica mocznicowa

Kwasica metaboliczna -
kompensacja
Hiperwentylacja
Bufory komórkowe
Po kilku tygodniach włącza się układ
kostny

Kwasica ketonowa
Występuje
w
stanach
głodzenia,
niewyrównanej cukrzycy
Wytwarzane
są
nielotne
kwasy:
acetooctowy,
β-hydroksymasłowy
i
aceton
Buforowanie przez HCO
3-
powoduje
stopniowe
wyczerpywanie
zasobów
tego buforu

Zaburzenia RKZ w
zatruciach metanolem i
glikolem etylenowym
Produkty ich metabolizmu mają charakter
kwaśny – kwasica metaboliczna
Przemiany glikolu jak i metanolu zużywają
znaczne ilości NAD
+
. Wzrost stosunku
NADH/NAD
+
prowadzi do zahamowania
glukoneogenezy i akumulacji mleczanu –
kwasica mleczanowa

Zaburzenia RKZ w
zatruciach salicylanami
Kwas
salicylowy,
kwas
acetylosalicylowy, salicylamid, salicylan
sodu

Objawy kliniczne zatrucia
salicylanami
Zartucia lekkie i średnie: nudności,
wymioty, hiperwentylacja, pocenie się,
tachykardia
Zatrucia ostre: j.w. + utrata
przytomności, drgawki, zatrzymanie
akcji serca

Salicylany
Pobudzają ośrodek oddechowy co prowadzi
do hiperwentylacji i alkalozy oddechowej
Zaburzają proces fosforylacji oksydacyjnej
pirogronianu – kwasica mleczanowa
Kwas salicylowy hamuje karboksylazę
pirogronianową
–
zahamowanie
glukoneogenezy
Kwasica metaboliczna jest dodatkowo
wzmacniana przez stymulację glikolizy w
komórkach przez zasadowicę oddechową
Nasilają ketogenezę

Następstwa kwasicy
Hiperkaliemia na skutek kompensacji
komórkowej – ryzyko zatrzymania akcji
serca w rozkurczu
Wpływ na powinowactwo hemoglobiny
do tlenu

Zasadowica metaboliczna
Wzrost pH, na skutek zwiększenia
stężenia HCO
3-
, pCO
2
bez zmian
Buforowanie – układ oddechowy

Zazwyczaj dwa mechanizmy
patogenetyczne
1.
Inicjujący zasadowicę
Nadmierna utrata H+
lub
Nadmierna retencja HCO
3-
2.
Podtrzymujący
(hamujący
wyrównywanie
zaburzeń)
–
w
odpowiedzi na niedobór w ECF H
+
,
KCl, NaCl

Mechanizmy inicjujące
zasadowicę metaboliczną
Utrata H
+
z organizmu: wymioty, leki
moczopędne (furosemid)
Nadmierna
podaż
zasad:
NaHCO
3
,
cytrynian sodu, CaCO
3
Hipokaliemia – powoduje transport H
+
do
komórek, K
+
przechodzi do ECF
Nadczynność
kory
nadnerczy
–
aldosteron powoduje resorpcję zwrotną
Na
+
i HCO
3-
oraz utratę H
+
i K
+
z moczem

Gospodarka wodno -
elektrolitowa

Całkowita woda organizmu stanowi:
Mężczyźni – 60% m.c.
Kobiety 50% m.c.
Niemowlęta 75% m.c.
i jest uzależniona od:
Płci
Wieku
Poziomu tkanki tłuszczowej
Całkowita woda organizmu
(ok. 60% m.c.)
wewnątrzkomórkowa
(40% m.c.)
zewnątrzkomórkowa
(20% m.c.)
transkomórkowa
(1-3% m.c.)
wewnątrznaczyn.
(2% m.c.)
pozanaczyniowa
(38% m.c)
osocze
(5% m.c.)
płyn tkankowy
(śródmiąższowy)
limfa
(15% m.c.)
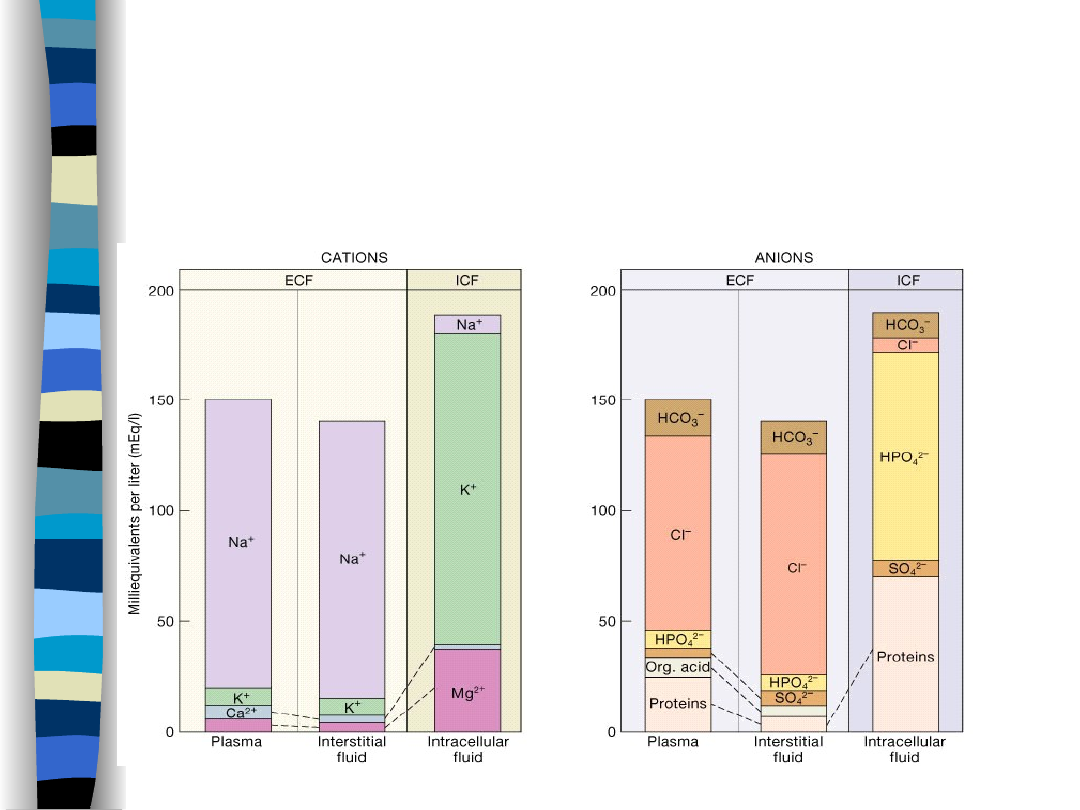
Skład elektrolitowy
przestrzeni wodnych
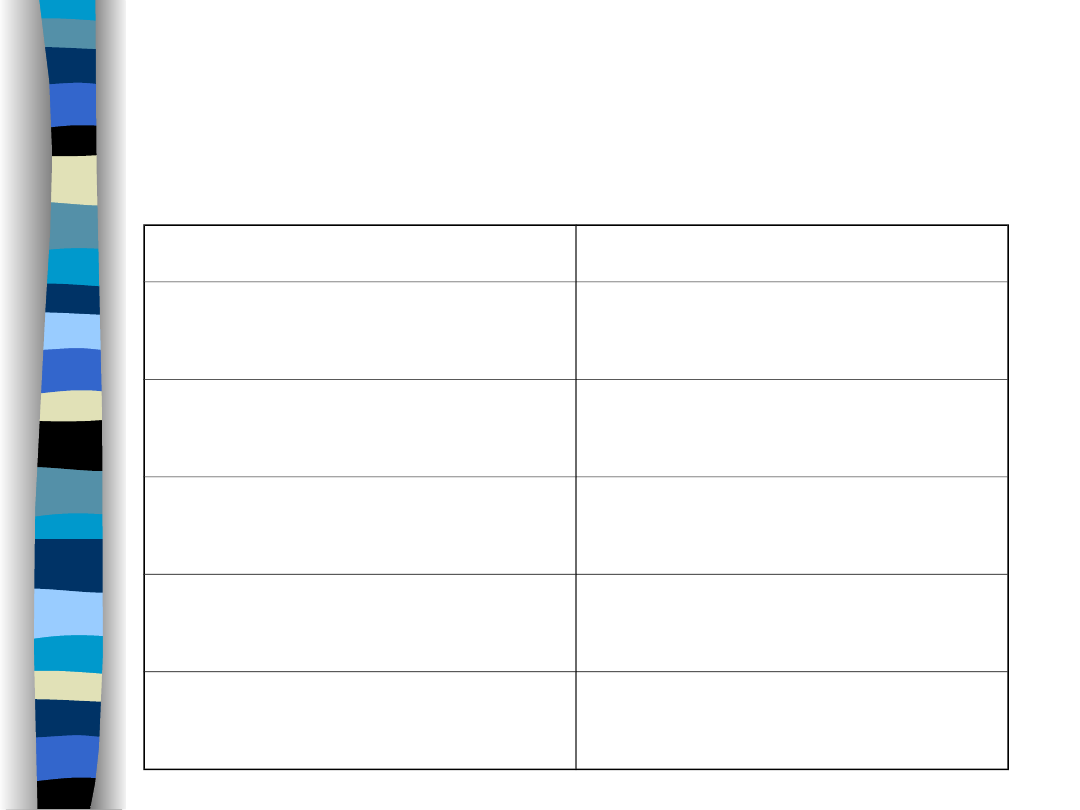
Dobowy bilans wodny
Wydalanie
Pobieranie
Przez skórę 400
ml
Z płynami 1500
ml
Przez płuca 500
ml
Z pokarmem 800
ml
Z moczem 1500
ml
Woda oksyd. 250
ml
Z kałem 150
ml
Razem 2550
ml
Razem 2550
ml

Regulacja bilansu
wodnego

Mechanizmy utrzymujące
izowolemię
Nerwowy – mechanizm pragnienia
Układ RAA
Przedsionkowy peptyd natriuretyczny
ANP
Wazopresyna

Ośrodek
pragnienia
–
okolica
nadwzrokowa podwzgórza
Pobudzenie ośrodka pragnienia poprzez:
Wzrost ciśnienia osmotycznego ECF
(odwodnienie
komórek
ośrodka
pragnienia; progowa wartość ciśnienia
osm. 295 mOsm/ kg)
Zmniejszenie objętości ECF – utrata ECF
bez zmian osmolalności; pobudzenie
ośrodka pragnienia przez angiotensynę II
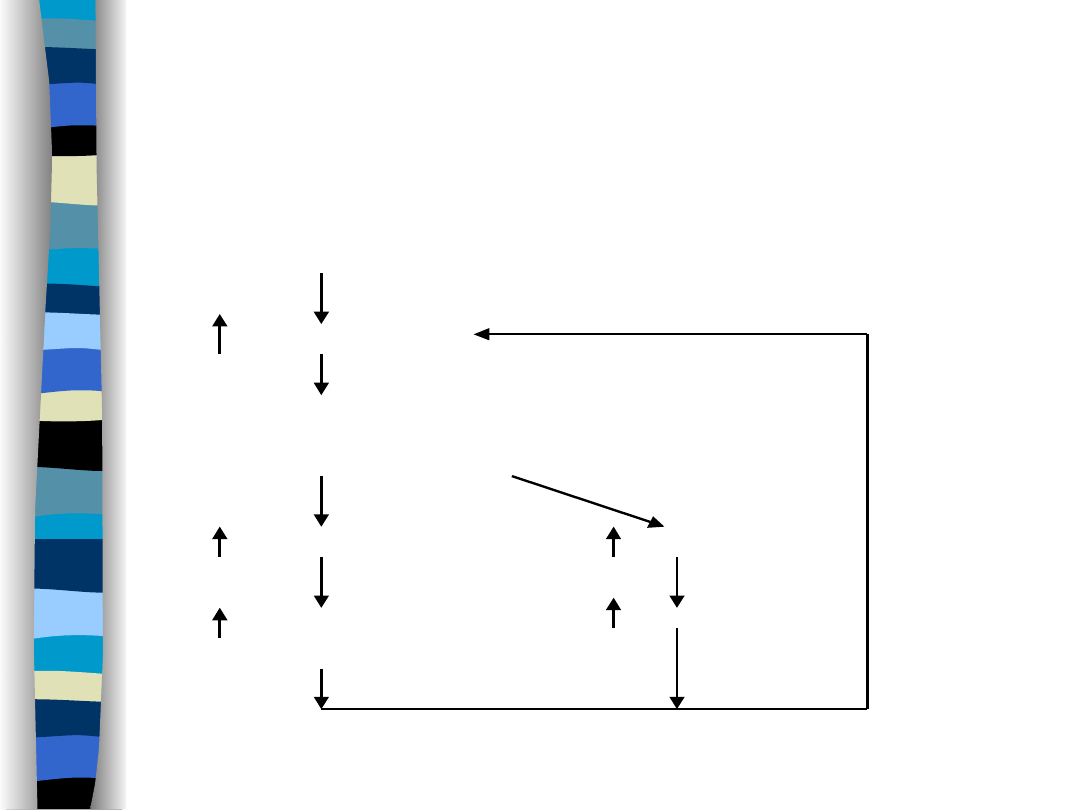
Mechanizm
wazopresynowy
Niedobór wody
(-)
osmolalność ECF
niedobór wody
w komórkach
osmoreceptorowych
wydzielanie ADH
pragnienie
wchłanianie wody –
pobór wody
kanalik dystalny
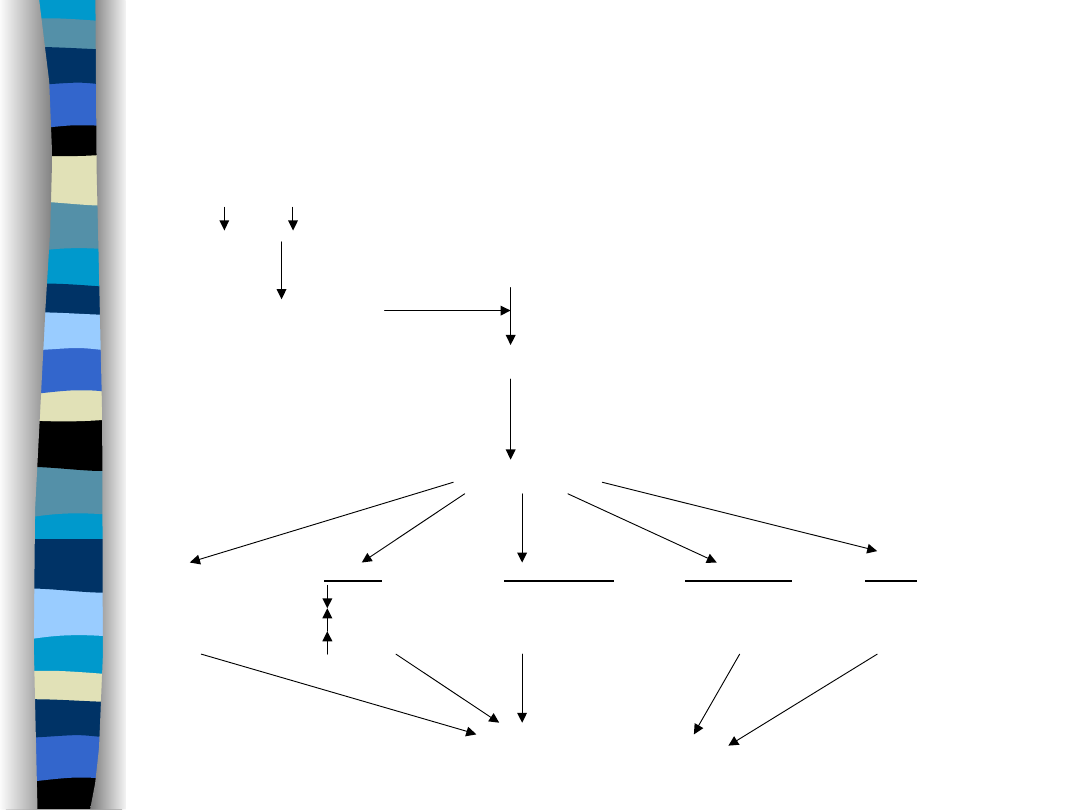
Na+, RR
angiotensynogen
sekrecja reniny
angiotensyna I
angiotensyna II
skurcz
Nerki:
Nadnercza:
Przysadka:
OUN:
obwodowych
GFR
stymulacja
stymulacja
stymulacja
naczyń
resorpcja Na+
sekrecji
sekrecji
ośrodka
krwionośnych
ukrwienie nerki aldosteronu
wazopresyny
pragnienia
wzrost objętości ECF
nasilenie przepływu krwi przez nerki
Układ RAA

Przedsionkowy peptyd
natriuretyczny (ANP)
Nasila natriurezę i diurezę
Hamuje układ RAA
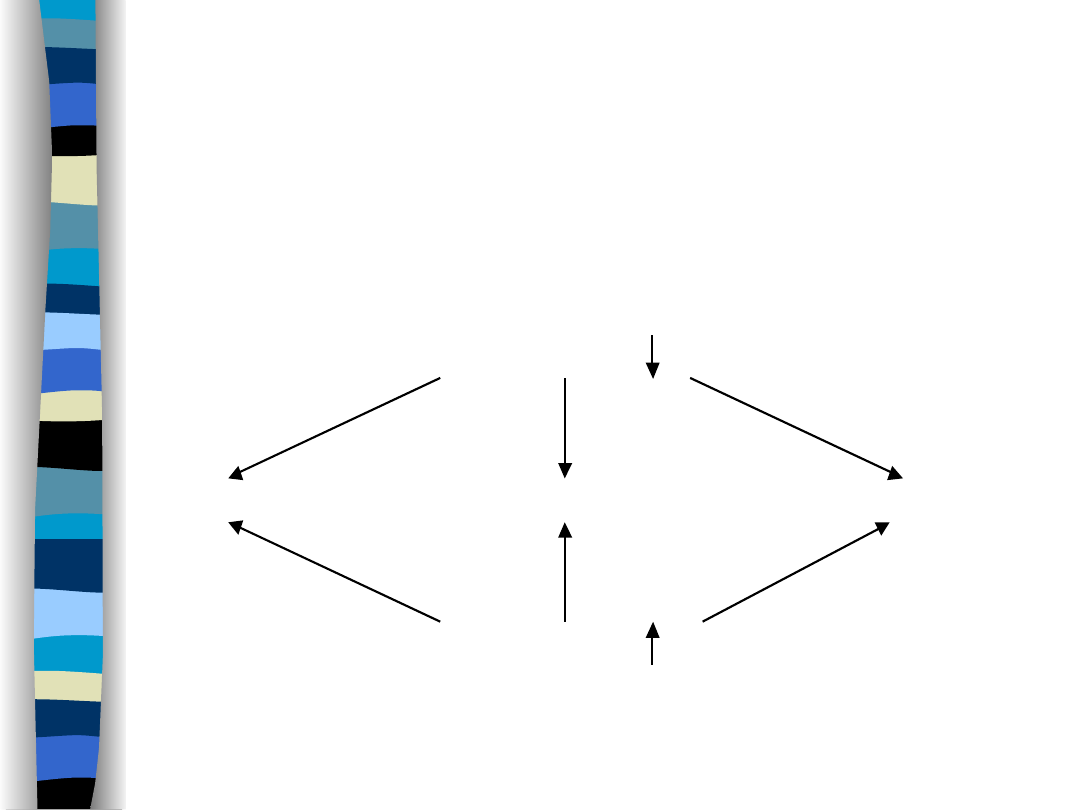
Podział zaburzeń
gospodarki wodnej
Odwodnienie ( ECF)
hipotoniczne
izotoniczne
hipertoniczne
Przewodnienie ( ECF)
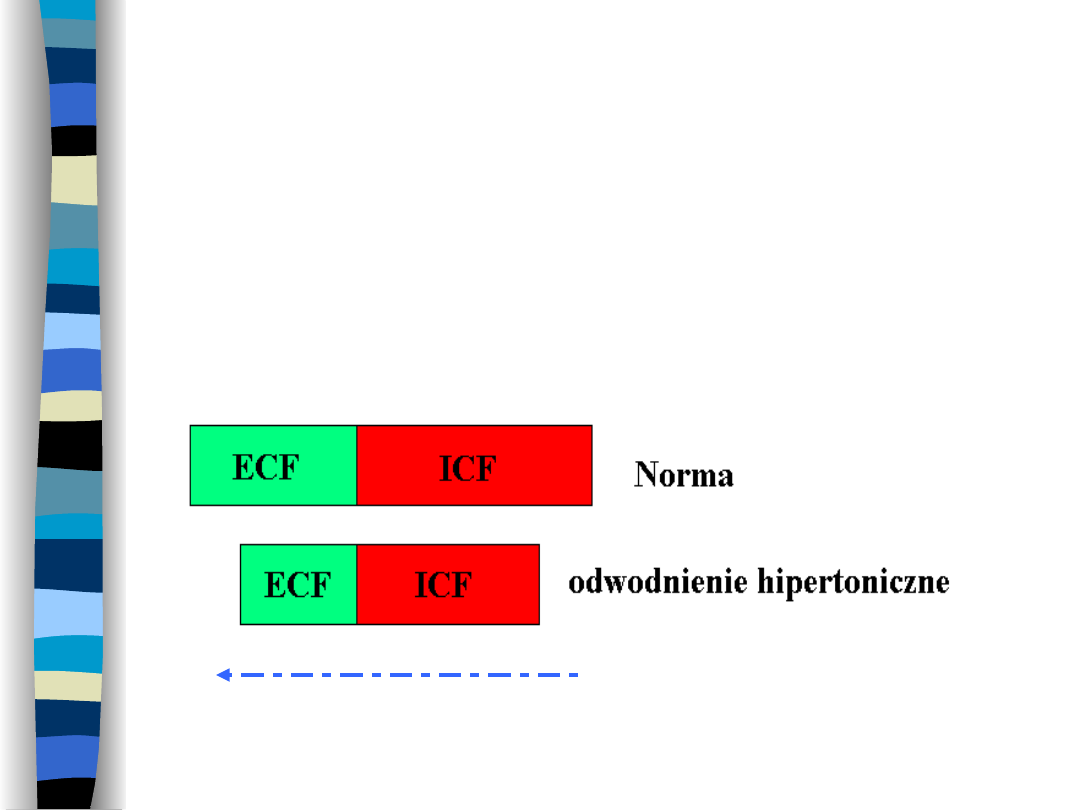
Odwodnienie
hipertoniczne
Wynik utraty czystej wody z przestrzeni
ECF
Ruch H
2
O

Przyczyny odwodnienia
hipertonicznego
1.
Zmniejszone spożycie wody:
Osłabienie
lub
brak
uczucia
pragnienia (osoby nieprzytomne, po
urazach czaszki, niemowlęta)
Niewystarczająca
podaż
płynów
(braki wody w otoczeniu, chorzy
karmieni sondą)

Przyczyny odwodnienia
hipertonicznego c.d.
2. Nadmierna utrata wody i płynów
hipotonicznych:
Nadmierne pocenie się
Hiperwentylacja
Wielomocz po ostrej niewydolności
nerek
Moczówka prosta
Wzmożona diureza osmotyczna (np. w
cukrzycy)
Biegunki
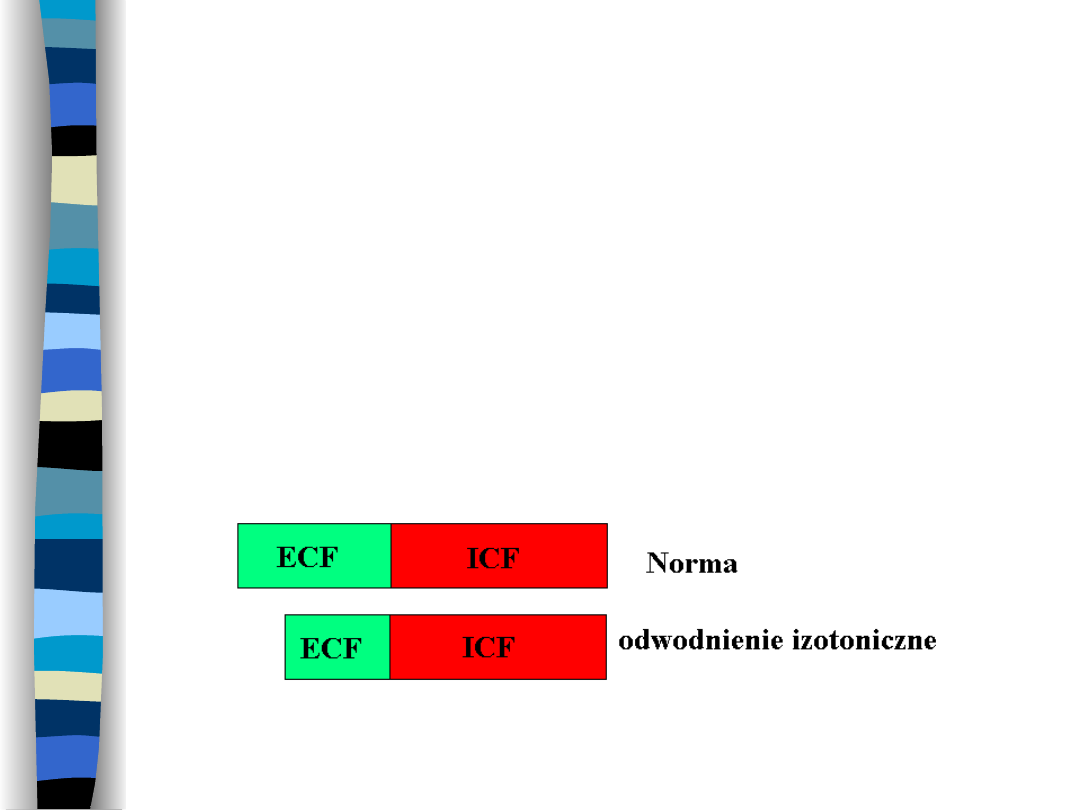
Odwodnienie izotoniczne
Wynik utraty płynów o molalności
normalnej dla ECF
Zmniejsza się objętość ECF, ICF w
normie, osmolalność obu przestrzenie
nie zmienia się

Przyczyny odwodnienia
izotonicznego
Krwotoki – utrata pełnej krwi
Utrata osocza – oparzenia, zapalenie błon
surowiczych, zapalenie trzustki, udar
cieplny)
Wymioty, biegunki, przetoki przewodu
pokarmowego
Leki moczopędne
Przemieszczanie się płynów do przestrzeni
transcelularnej (np. w niedrożności jelit)
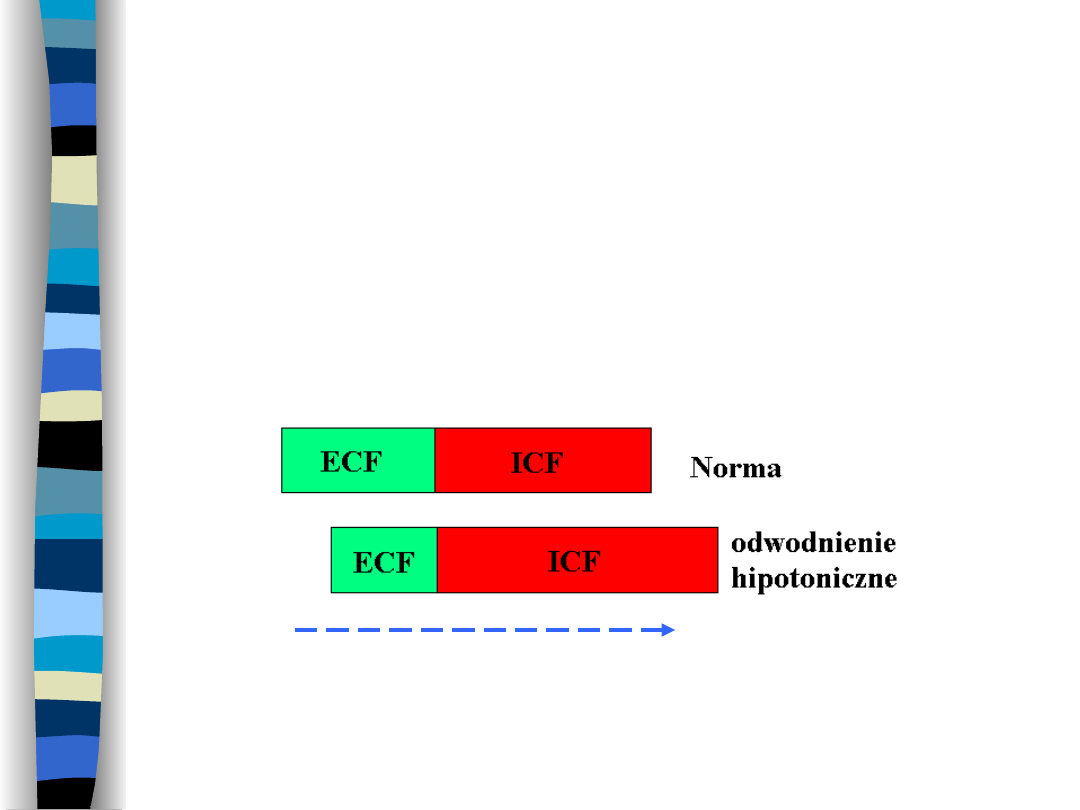
Odwodnienie hipotoniczne
Spowodowane
jest
utratą
płynów
hipertonicznych z przestrzeni ECF
Ruch
H
2
O

Przyczyny odwodnienia
hipotonicznego
1.
Utrata sodu wraz z wodą przez nerki,
skórę lub przewód pokarmowy
Przewlekła niewydolność nerek
Wielomocz po ostrej niewydolności nerek
Niedoczynność kory nadnerczy
(hipoaldosteronizm)
Leki moczopędne
Biegunki, wymioty, nadmierne pocenie się
2.
Niedostateczna podaż sodu

Z powodu hipotonii ECF
i przewodnienia komórek chorzy
z odwodnieniem hipotonicznym
nie odczuwają pragnienia

Objawy wspólne dla
wszystkich rodzajów
odwodnień
Zmniejszenie objętości krwi krążącej
Osłabienie filtracji kłębuszkowej – oliguria
(już przy utracie wody stanowiącej 2% m.c.)
Objawy sercowo – naczyniowe – przy
utracie wody 4 – 6% m.c.: zmniejszenie
pojemności wyrzutowej serca, spadek
ciśnienia tętniczego, tachykardia, wzrost
oporu
naczyniowego,
hipotonia
ortostatyczna, omdlenia

Objawy wspólne dla
wszystkich rodzajów
odwodnień c.d.
Obniżenie napięcia tkankowego –
miękkość
gałek
ocznych,
brak
wygładzania się skóry ujętej w fałd
Zaburzenia ze strony OUN – bóle
i zawroty głowy, znużenie, utrata
świadomości, śpiączka

Odwodnienie ciężkie – utrata wody w
ilości ok. 14% m.c. – śmierć na skutek
braku wypełniania naczyń krwionośnych.
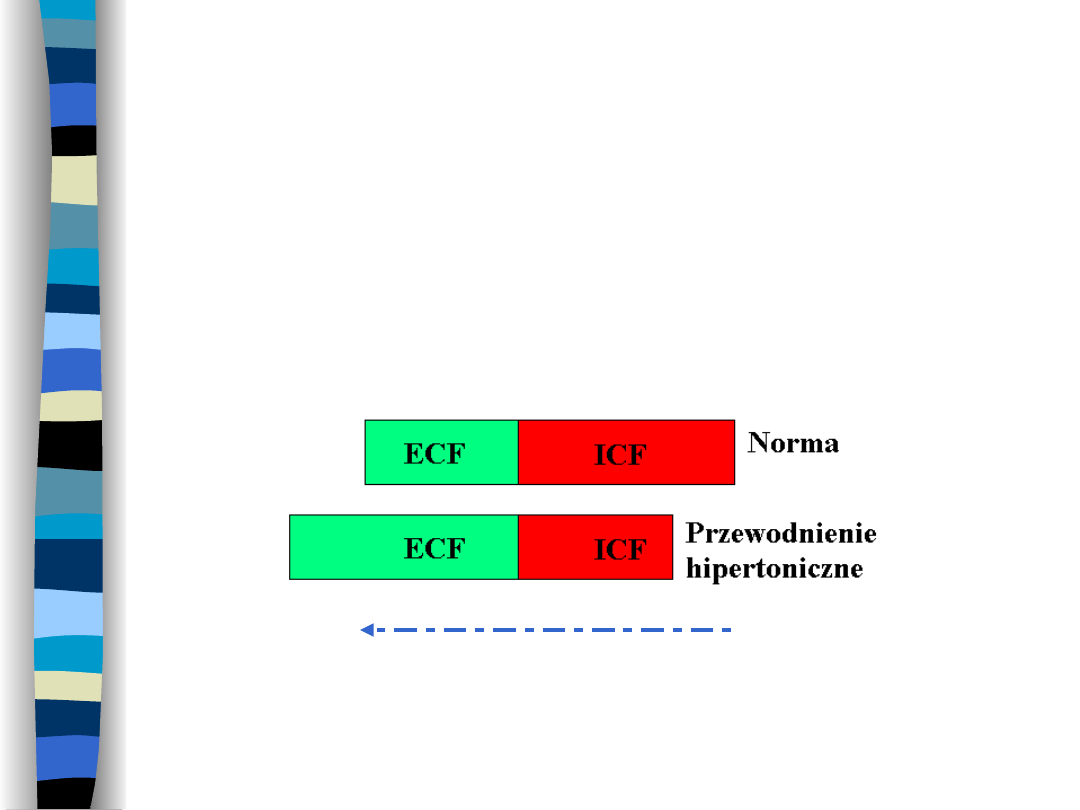
Przewodnienie
hipertoniczne
Wzrost objętości ECF, zmniejszenie
objętości ICF
Ruch H
2
O

Przyczyny przewodnienia
hipertonicznego
1.
Nadmierna podaż sodu – spożywanie
słonych
potraw
przez
osoby
z
niewydolnością nerek, nadczynnością
kory nadnerczy; pozajelitowa podaż
płynów hipertonicznych u chorych po
zabiegach
chirurgicznych
gdy
dochodzi do wzrostu wydzielania
wazopresyny i zmniejszenia diurezy
2.
Retencja sodu w organizmie

Objawy przewodnienia
hipertonicznego
Obrzęki
Zwiększone ciśnienie żylne
Ciśnienie tętnicze prawidłowe lub
nieznacznie podwyższone
Niewydolność lewokomorowa
Stany zastoinowe w płucach, duszność,
przyspieszenie i pogłębienie oddechów

Objawy przewodnienia
hipertonicznego c.d.
Podwyższenie temperatury ciała
Niepokój,
uczucie pragnienia
; przy
znacznym
przewodnieniu
senność,
zaburzenia świadomości
Hipernatremia,
hiperosmia,
zmniejszenie
stężenia
białka
całkowitego,
zmniejszenie
liczby
erytrocytów
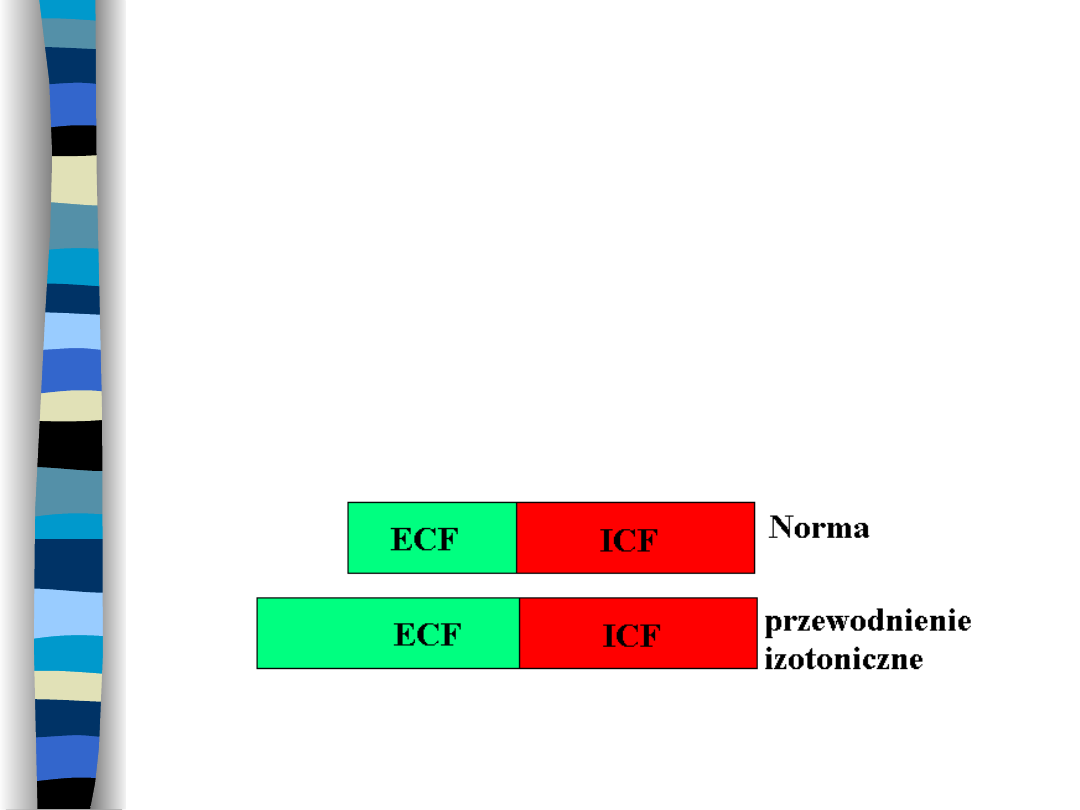
Przewodnienie izotoniczne
Dochodzi do nagromadzenia się płynu
izotonicznego w ECF bez zmian
osmolalności ECF i objętości ICF

Przyczyny przewodnienia
izotonicznego
Przewlekła niewydolność nerek
Zespół nerczycowy
Marskość wątroby
Ostre kłębuszkowe zapalenie nerek
Choroba głodowa
Nadczynność kory nadnerczy

Główny objaw przewodnienia
izotonicznego to
obrzęki o
charakterze uogólnionym
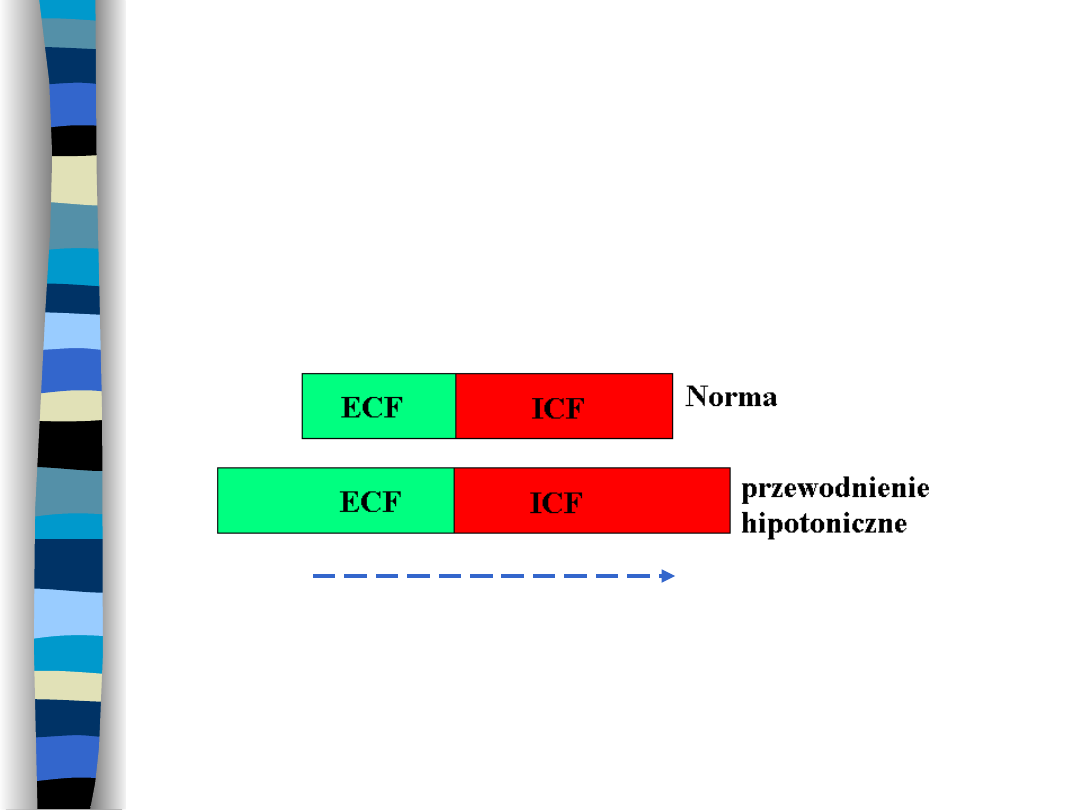
Przewodnienie
hipotoniczne (zatrucie
wodne)
Wzrost objętości przestrzeni ECF i ICF
Ruch H
2
O

Przyczyny przewodnienia
hipotonicznego
Nadmierna retencja wody w ECF na
skutek podaży płynów bezelektrolitowych
drogą doustną lub pozajelitową chorym,
u
których
wydalanie
wody
jest
upośledzone
(stany
pooperacyjne,
choroby nerek, wątroby, niewydolność
kory nadnerczy, osoby niedożywione)
Reakcje stresowe – bodziec do wydzielania ADH
Masywne płukanie żołądka wodą
Zespół Schwartza - Bartera

Przewodnienie
hipotoniczne
Kluczowe są objawy mózgowe –
związane
z
obrzękiem
komórek
mózgowych:
nudności,
wymioty,
drgawki, stany splątania, śpiączka

Zaburzenia gospodarki
elektrolitowej

Sód
Główny
kation
przestrzeni
zewnątrzkomórkowej; [Na
+
]
ECF
= 135 – 145
mmol/l
Zawartość w organizmie – 58 – 60 mmol/kg
m.c.
91% tej ilości w ECF
Sód
Dobowe spożycie
2,5 – 15 g
Wchłanianie:
dwunastnica i
jelito cienkie
Dobowe
zapotrzebowanie
~1 g
Wydalanie:
Nerki 95%
Przewód
pokarmowy
4,5%
Skóra 0,5%

Hiponatremia
1.
Nasilona utrata sodu i wody z organizmu
Przez
skórę
- obfite pocenie się,
niewyczuwalne parowanie
Przez
przewód pokarmowy
- wymioty
i biegunki
Drogą
nerek
- faza diuretyczna w ostrej
niewydolności
nerek,
poliuria
w
przewlekłej niewydolności nerek, leki
moczopędne, zapalenie nerek z utratą
soli
(wybiórcze
uszkodzenie
mechanizmów
odpowiedzialnych
za
resorpcję sodu)

Hiponatremia
2.
Utrata
sodu
przy
prawidłowym
uwodnieniu
Niedoczynność kory nadnerczy
3.
Retencja
wody
w
organizmie
– hiponatremia z rozcieńczenia
Zespół Schwartza – Bartera (SIADH)

Hiponatremia – objawy
kliniczne
Zależą głównie od wzrostu objętości
przestrzeni wewnątrzkomórkowej oraz
zaburzeń w składzie i metabolizmie
komórek
Najważniejsze
są
zaburzenia
neurologiczne skojarzone z obrzękiem
mózgu

Hiponatremia – objawy
kliniczne
135 – 125 mmol/l
Na ogół bez objawów neurologicznych
Brak apetytu, nudności, osłabienie
125 – 110 mmol/l
Bóle głowy, splątanie, senność lub
pobudzenie
< 110 mmol/l
Drgawki, śpiączka

Hipernatremia
Utrata płynów hipotonicznych przez
przewód
pokarmowy,
skórę,
nerki
(moczówka prosta), hiperwentylacja
Nadmierna podaż sodu, np. NaHCO
3
,
spożywanie pokarmów słonych w dużych
ilościach, chorzy dializowani płynem
bogatosodowym
Nieadekwatna podaż wody (dzieci,
obłożnie chorzy)
Hipertoniczność
zależna
od
hiperglikemii

Objawy kliniczne
hipernatremii
Wynikają
przede
wszystkim
z
odwodnienia komórek
Zależą
od
szybkości
narastania
hipernatremii

Objawy kliniczne
hipernatremii
Hipernatremia rzędu 160 mmol/l
narastająca powoli
Zwiększenie
pobudliwości
nerwowej,
wzmożenie
odruchów
ścięgnistych
i
napięcia mięśni szkieletowych, skurcze
mięśni, drgawki
Hipernatremia 170 mmol/l
Zaburzenia orientacji, wysoka gorączka,
drgawki, śpiączka

Potas
Występuje w ilości ok. 50 mmol/kg m.c.
3% tej ilości w ECF, 97% w ICF
Stężenie K+ w osoczu – 3,6 – 5,5
mmol/l
Stężenie K+ w ICF – 130 –150 mmol/l

Potas
Dobowe zapotrzebowanie na potas
wynosi 75 – 100 mmol
Wchłanianie potasu głównie w górnym
odcinku jelita cienkiego
Wnikanie potasu do komórek odbywa
się wbrew gradientowi stężeń na
zasadzie transportu aktywnego

Wydalanie potasu
85 – 90% drogą nerek
10 – 15% z kałem
5% - z potem

Hipokaliemia [K
+
]<3,6
mmol/l
1.
Niedostateczna podaż w pożywieniu
2.
Utrata drogą nerek
Hiperaldosteronizm pierwotny i wtórny
Zespół Cushinga
Terapia sterydami nadnerczowymi
Diureza osmotyczna, tiazydy moczopędne
Wielomocz po ostrej niewydolności nerek
Kwasica kanalikowa typu I i II
Hipokaliemia [K
+
]<3,6
mmol/l
3.
Utrata przez
przewód pokarmowy
Uporczywe wymioty
Biegunki
Przetoki jelitowe
Wrzodziejące
zapalenie jelit
Zespół złego
wchłaniania
Stężenie potasu w:
Ślina – 15 – 25
mmol
Sok żołądkowy 5-
20 mmol
Sok jelitowy 5 –
15 mmol
Żółć – podobne do
osocza

Hipokaliemia [K
+
]<3,6
mmol/l
4.
Redystrybucja
Zasadowica – wzrost pH o 0,1 to
obniżenie [K+] o 0,3 – 0,9 mmol/l
(średnio 0,6 mmol/l)
Wzrost sekrecji/ podaży insuliny

Objawy kliniczne hipokaliemii gdy [K
+
]
< 2,5 mmol/l
OUN: senność, apatia, czasem pobudzenie
Osłabienie
siły
mięśniowej,
uczucie
zmęczenia, niedowłady mięśni, osłabienie
odruchów ścięgnistych
Ze strony serca: tachykardia, zmniejszenie
siły skurczów i pojemności wyrzutowej
komór, zmiany w EKG (arytmia, spłaszczenie
fali T, obniżenie odcinka ST, wykształcenie
się fali U)
Nieprawidłowa motoryka jelit: wzdęcia,
zaparcia, porażenny niedowład jelit

Hiperkaliemia [K+] > 5,5
mmol/l
1.
Zaburzenia czynności nerek
Ostra i przewlekła niewydolność nerek
Mocznica
Kwasica kanalikowa typu IV
2.
Hipoaldosteronizm
3.
Masywny rozpad komórek (po oparzeniach,
zmiażdżeniach, w ostrym zapaleniu trzustki)
4.
Szybkie przetoczenie krwi konserwowanej
– podczas przechowywania erytrocytów uwalnia się
z nich potas
5.
Nadmierna podaż z płynami infuzyjnymi, lekami (K-
penicylina), płynami dializacyjnymi

Hiperkaliemia [K+] > 5,5
mmol/l
6.
Redystrybucja w kwasicy
7.
Rzekoma (hemoliza próbki, ucisk stazy)

Objawy kliniczne
hiperkaliemii
1.
Zaburzenia czynności mięśnia sercowego
[K+] > 7,5 mmol/l – zwolnienie czynności
serca, występują skurcze dodatkowe
[K+] = 9 mmol/l – migotanie komór;
zatrzymanie akcji serca
2.
Zaburzenie
przewodzenia
impulsów
w układzie nerwowym: parestezje, apatia,
senność, śpiączka

Objawy kliniczne
hiperkaliemii
3.
Ze strony układu mięśniowego
Osłabienie siły mięśniowej
Skurcze
Porażenie mięśni, w tym oddechowych
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
- Slide 72
- Slide 73
- Slide 74
- Slide 75
- Slide 76
- Slide 77
- Slide 78
- Slide 79
- Slide 80
- Slide 81
- Slide 82
- Slide 83
- Slide 84
- Slide 85
- Slide 86
- Slide 87
- Slide 88
- Slide 89
- Slide 90
Wyszukiwarka
Podobne podstrony:
Równowaga kwasowo zasadowa fizjot3
Równowaga kwasowo zasadowa fizjot3
Fizjologia kolo RKZ, II rok, II rok CM UMK, Giełdy, od Joe, FIZJOLOGIA, KOLOKWIA, RÓWNOWAGA KWASOWO-
woda jako składnik żywności oraz równowagi kwasowo- zasadowe w żywności, żywienie człowieka i ocena
01 rownowaga kwasowo zasadowa
SPEKTROFOTOMETRYCZNE?DANIE RÓWNOWAG KWASOWO ZASADOWYCH W ROZTWORACH WODNYCH sprawozdanie równowag
Równowaga kwasowo 2 2011 (1), anestezjologia i intensywna terapia
10 GOSPODARKA WODNO ELEKTROLITOWA I RÓWNOWAGA KWASOWO ZASADOWAid 10549 ppt
więcej podobnych podstron