
Diagram
Ellinghama
Katarzyna
Abramczyk
Agnieszka
Brudnowska
IV rok
1
Samorzutność
procesów chemicznych
2
II Zasada Termodynamiki:
W procesach samorzutnych całkowita entropia wzrasta
ΔS
całkowita
=ΔS
otoczenia
+ΔS
układu
> 0
ΔS
całkowita
> 0
przemiana
samorzutna
III Zasada Termodynamiki:
W temperaturze zera bezwzględnego entropia
wszystkich doskonałych substancji jest równa
zero.
ΔS
kryst
= 0 K

Samorzutność procesów chemicznych
3
Standardowe entropie molowe wody w
różnych fazach:
Faza
Temperatura
o
C
S
o
J/mol*K
Stała
-273
0
3,4
43,2
Ciekła
0
50
100
65,2
75,3
86,8
Gazowa
100
196,9

Samorzutność procesów chemicznych
4
ΔS
całkowita
=ΔS
otoczenia
+Δs
układu
p =
const.
ΔS
otoczenia
=ΔH
układu
/T
ΔS
otoczenia
= ΔS
układu
-
(ΔH
układu
/T)
-TΔS
całkowita
= ΔH
układu
-
TΔS
układu
Samorzutność procesów chemicznych
5
-TΔS
całkowita
= ΔH
układu
-
TΔS
układu
ΔG
ΔG = ΔH - TΔS
Zmiana entalpii
Zmiana entropii
Proces samorzutny
Egzotermiczna, (ΔH <
0)
Wzrost, (ΔS > 0)
Tak, ΔG < 0
Egzotermiczna, (ΔH <
0)
Zmniejszenie, (ΔS <
0)
Tak, jeśli |TΔS| < ΔH,
ΔG < 0
Endotermiczna, (ΔH
> 0)
Wzrost, (ΔS > 0)
Tak, jeśli TΔS > ΔH,
ΔG < 0
Endotermiczna, (H >
0)
Zmniejszenie, (ΔS <
0)
Nie, ΔG > 0

Samorzutność procesów chemicznych
6
ΔG<0
ΔG=0
ΔG>0
Przemiana:
samorzutna
wymuszona
równowaga
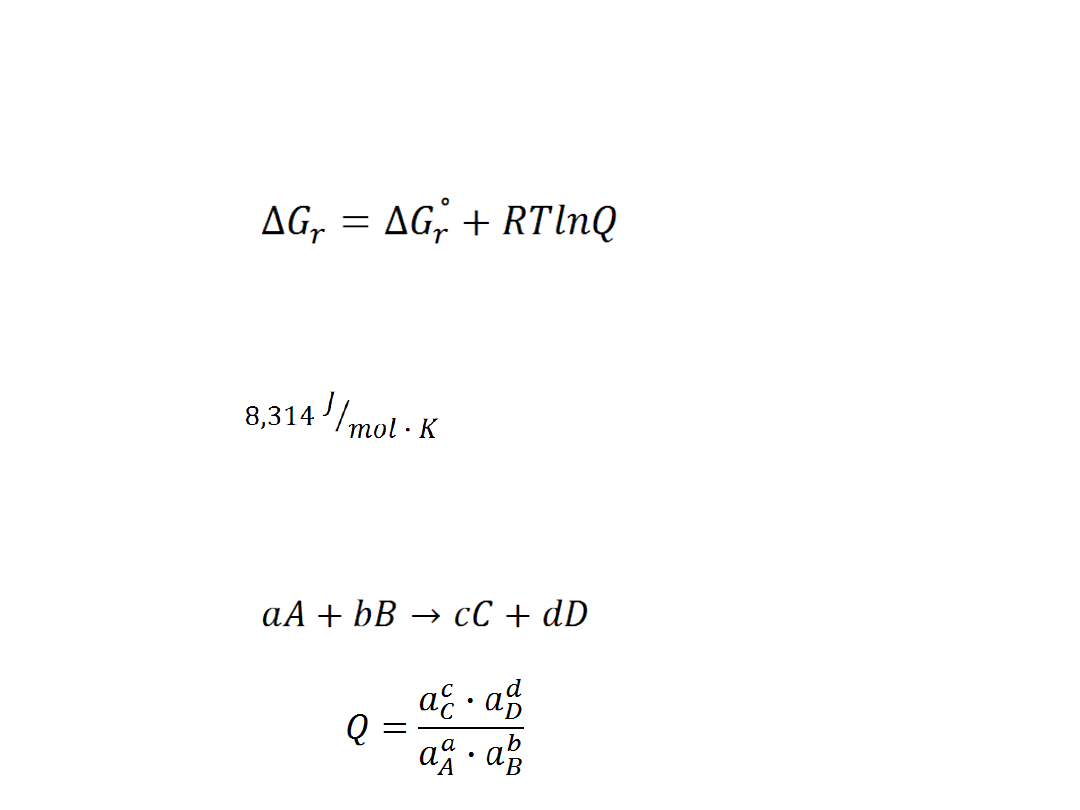
Samorzutność procesów chemicznych
7
Gdzie:
ΔG
r
-zmiana entalpii swobodnej reakcji
ΔG
r
°
-Zmiana standardowej entalpii swobodnej reakcji
R - Stała gazowa ( )
T - Temperatura [K]
Q – iloraz reakcji, zdefiniowany dokładnie tak samo, jak stała
równowagi reakcji
Dla
reakcji:
Gdzie: ai-
aktywność
cząstkowa
składnika „i”
Samorzutność procesów chemicznych
8
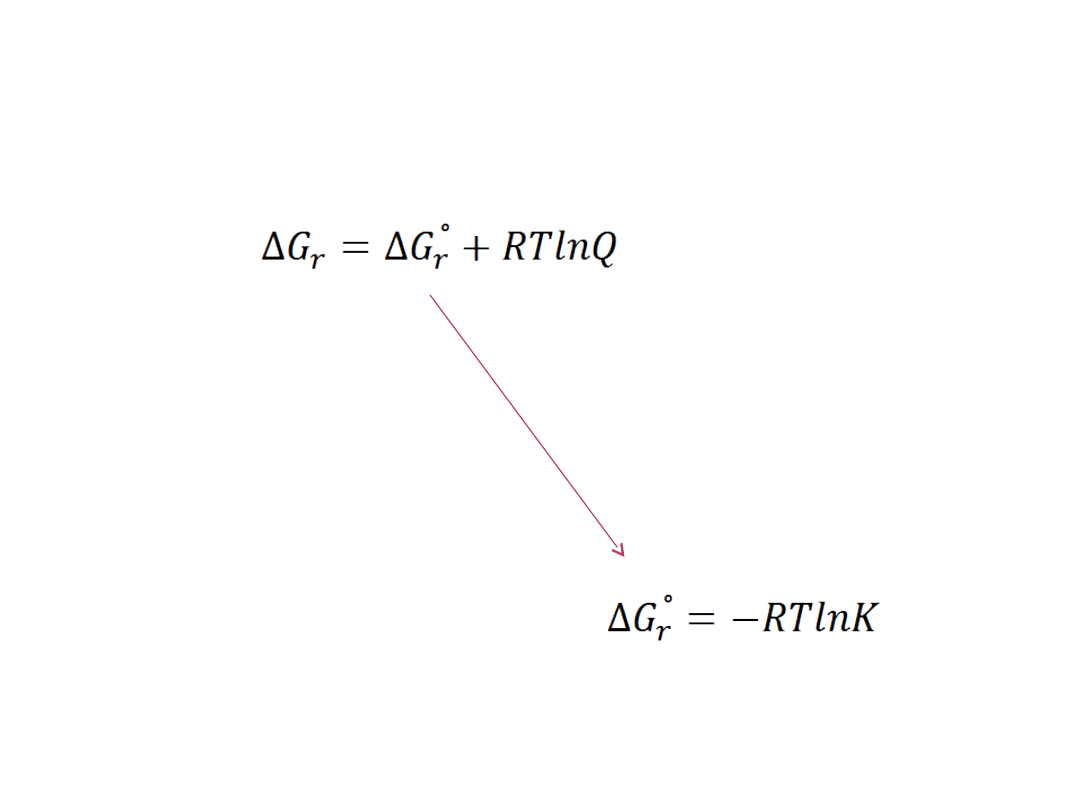
Gdy:
ΔG
r
=0 i Q=K
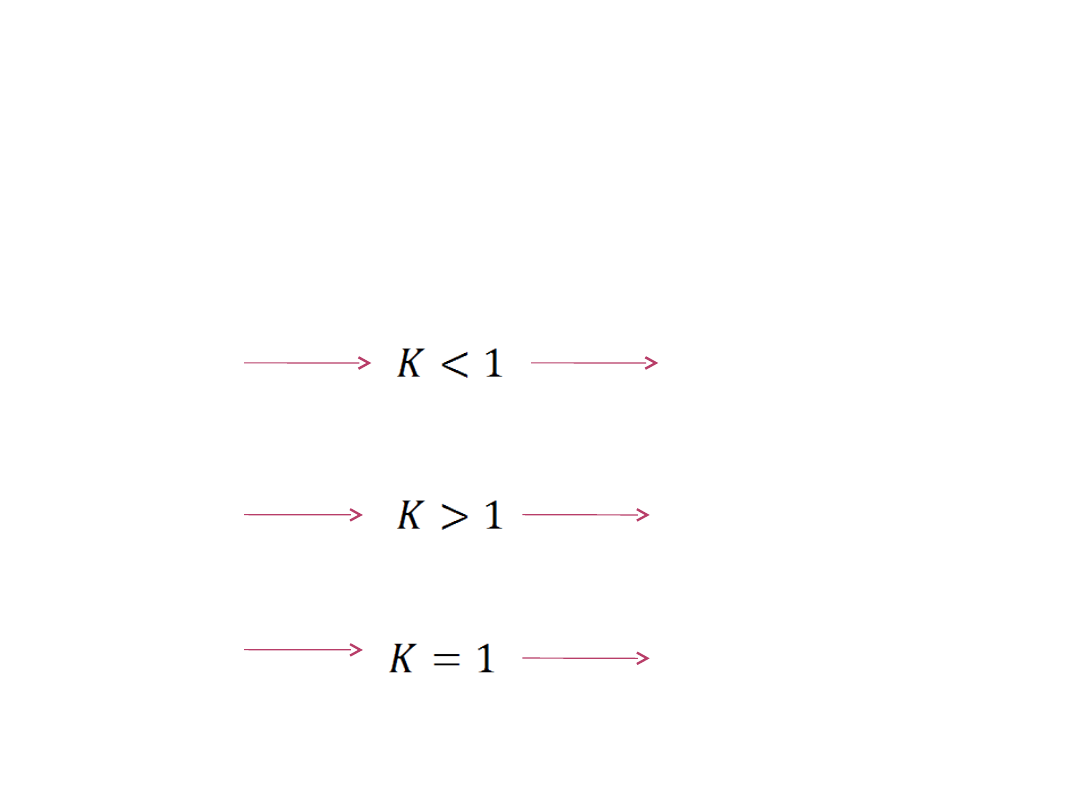
Samorzutność procesów chemicznych
9
ΔG<0
ΔG=0
ΔG>0
Przemiana:
samorzutna
wymuszona
równowaga

Charakterystyka diagramu Ellinghama
10
G
0
= H
0
-TS
0
y = a + xb

Co to są diagramy Ellinghama?
Diagramy Ellinghama przedstawiają graficzną zależność zmiany entalpii
swobodnej reakcji Δ G
0
od temperatury T.
Zależność entalpii swobodnej od temperatury wyrażona jest wcześniej
przedstawionym wzorem :
G
0
= H
0
- TS
0
i jest to zależność liniowa , typu y= mx + c
gdzie:
y- wartość zmiany entalpii swobodnej
x- jest temperaturą T
m –jest nachyleniem
Wyjaśnienie pojęcia
11

Aby sprawdzić czy proces redukcji tlenku metalu MeO węglem
przebiega w sposób samorzutny należy porównać wartość
standardowej entalpii swobodnej tworzenia tlenków węgla (a ,b ,c )z
standardową entalpią tworzenia tlenku metalu (d) :
a. ΔG
0
(C, CO)
b. ΔG
0
(C, CO
2
)
c. ΔG
0
(CO, CO
2
)
d. ΔG
0
(Me, Me
x
O)
-ΔG
0
(Me, Me
x
O)
)
(
)
(
2
)
(
2
1
g
g
s
CO
O
C
)
(
2
)
(
2
)
(
g
g
s
CO
O
C
)
(
2
)
(
2
)
(
2
1
g
g
g
CO
O
CO
)
(
)
(
2
)
lub
(
2
1
s
x
g
c
s
O
Me
O
xMe
)
(
2
)
lub
(
)
(
2
1
g
c
s
s
x
O
xMe
O
Me
12

Metale można otrzymywać poprzez redukcję ich tlenków węglem
lub tlenkiem węgla, gdy równowaga jednego z poniższych
procesów jest przesunięta w prawą stronę, czyli gdy K > 1.
MO
(s)
+ C
(s)
M
(s)
+ CO
(g)
MO
(s)
+ ½ C
(s)
M
(s)
+ ½ CO
2 (g)
MO
(s)
+ CO
(g)
M
(s)
+ CO
2 (g)
Otrzymywanie metali z ich tlenków
13

Samorzutność reakcji redukcji
14
Samorzutność reakcji redukcji w dowolnej temperaturze można
przewiedzieć w prosty sposób, korzystając z przedstawionego
diagramu Ellinghama. Na diagramie mamy linie odpowiadające
reakcjom utlenienia węgla oraz linie różnych tlenków. Można
przewidzieć jaka jest najniższa temperatura w której np. ZnO może
być zredukowany do metalicznego Zn przez C. Reakcja redukcji
tlenku cynku za pomocą węgla będzie przebiegać samorzutnie; gdy
ΔG
0
całkowitej reakcji będzie ujemna czyli gdy zmiana entalpii
tworzenia tlenku węgla będzie niższa od zmiany entalpii tworzenia
tlenku cynku ΔG
0
tw
(C, CO) < ΔG
0
tw
(Zn,ZnO). Trzeba wyznaczyć
temperaturę, poniżej której swobodna entalpia utleniania węgla jest
mniejsza od swobodnej entalpii tworzenia cynku. Na naszym
diagramie jest to miejsce, od którego linia utlenienia węgla znajduje
się pod linią ZnO czyli około 950 stopni Celsjusza.
15
Reakcja 1
M
(s)
+ ½ O
2(g)
MO
(s)
Reakcja 2
½ C
(s)
+ ½ O
2(g)
½ CO
2(g)
Reakcja 3
C
(s)
+ ½ O
2(g)
CO
(g)
Reakcja 4
CO
(g)
+ ½ O
2(g)
CO
2(g)

W reakcjach, w których następuje wypadkowy wzrost ilości gazu,
standardowa entropia reakcji ma dużą wartość dodatnią, dlatego
też ∆
r
G° silnie maleje ze wzrostem temperatury (reakcja nr 3).
C
(s)
+ ½ O
2(g)
= CO
(g)
W reakcjach, w których następuje spadek ilości gazu, a tym
samym niska wartość entropii, ∆
r
G° rośnie ze wzrostem
temperatury (reakcja nr 4).
CO
(g)
+ ½ O
2(g)
= CO
2(g)
Możliwe jest także, że ilość gazu nie zmienia się co z kolei daje
informacje o małych wahaniach entropii, a w konsekwencji
nieznacznej zmiany ∆
r
G° w stosunku do wzrastającej temperatury
(reakcja nr 2).
C
(s)
+ O
2(g)
= CO
2(g)
Zależności standardowych entalpii swobodnych
reakcji od temperatury uwarunkowane są
wartościami ich entropii zgodnie z wzorem
∆
r
G°dT =
-∆
r
S°
.
16

17
Za skutecznością redukcji tlenku przemawiają reakcje konkurencyjne
pomiędzy wiązaniem się tlenu z węglem, a metalem. Wykorzystując
reakcje podane pod wykresem można opisać standardowe entalpie
swobodne redukcji za pomocą ich standardowych entalpii swobodnych.
MO
(s)
+ C
(s)
M
(s)
+ CO
(g)
∆
r
G° = ∆
r
G°(3) - ∆
r
G°(1)
MO
(s)
+ ½ C
(s)
M
(s)
+ ½ CO
2 (g)
∆
r
G° = ∆
r
G°(2) - ∆
r
G°(1)
MO
(s)
+ CO
(s)
M
(s)
+ CO
2 (g)
∆
r
G° = ∆
r
G°(4) - ∆
r
G°(1)
Gdy ∆
r
G°>0, równowaga reakcji jest przesunięta w lewo. Dotyczy to
przypadków, w których linia reakcji nr 1 leży poniżej linii opisującej jedną
z reakcji od 2 do 4.
Natomiast samorzutność reakcji redukcji w dowolnej temperaturze można
wywnioskować z innej cechy diagramu. Tlenki metalu redukują się w
każdej reakcji z węglem, w której linia ∆
r
G° leży wyżej niż linia reakcji od 2
do 4 dlatego, że wtedy dla sumarycznej reakcji ∆
r
G°<0. Dla przykładu ZnO
można zredukować węglem do Zn dopiero powyżej 1500°C, natomiast
Ag
2
O ogrzany powyżej 200°C ulega rozkładowi nawet bez obecności węgla
ponieważ standardowa entalpia swobodna reakcji nr 1 staje się dodatnia

Należy pamiętać, że w temperaturze pokojowej entalpia reakcji ma
dominujący wpływ na ∆
r
G° ponieważ człon T∆
r
S° jest względnie
mały. Fakt ten pozwala uszeregować wzrost ∆
r
G° na takiej samej
zasadzie jak ∆
r
H°, dlatego też tworzenie CaO jest procesem
najbardziej egzotermicznym, a Ag
2
O najmniej. Standardowa entropia
reakcji różnych tlenków metali jest porównywalna dla wszystkich
metali, ponieważ w każdej z nich gazowy tlen jest usuwany, a
powstający tlenek jest zwartym ciałem stałym. Pozwala to na
stwierdzenie, że temperaturowe zależności standardowych entalpii
swobodnych dla reakcji utleniania powinny mieć podobny przebieg
dla wszystkich metali, o czym świadczy też nachylenie linii na
diagramie. Załamania krzywych pojawiające się w wyższej
temperaturze odpowiadają parowaniu metali. Natomiast załamania
słabiej zaznaczone świadczą o topnieniu metali bądź ich tlenków.
18
19
ΔG
0
r
= Σ ΔG
0
prod
– Σ ΔG
0
subst
MO + C M + CO
ΔG
0
r
= ΔG
0
tw
(M) + ΔG
0
tw
(CO) – ΔG
0
tw
(C) - ΔG
0
tw
(MO) < 0
ΔG
0
r
pierwiastków w stanie podstawowym
równa jest 0 i dlatego:
ΔG
0
tw
(CO) – ΔG
0
tw
(MO) < 0
ΔG
0
tw
(CO) < ΔG
0
tw
(MO)
Skuteczność reakcji tlenku metalu
zależy od konkurencji pomiędzy
węglem a metalem o związany z
nim tlen. Aby reakcja ta zachodziła
ΔG
0
musi być mniejsza od zera.
20
ZnO + C CO + Zn
ΔG
r
= ΔG
0
tw
(CO) + ΔG
0
tw
(Zn) – ΔG
0
tw
(C) - ΔG
0
tw
(ZnO) < 0
Δ G
0
tw
(CO) – ΔG
0
tw
(ZnO) < 0
Δ G
0
tw
(CO) < Δ G
0
tw
(ZnO)

Tlenki metali można redukować również za pomocą innych metali które są
trwalsze. Na przykład diagram Ellinghama może być wykorzystany w celu
zbadania czy metal M2 może być użyty do redukcji tlenku innego metalu
M1. W tym przypadku sprawdzamy na wykresie czy w interesującej nas
temperaturze linia tlenku M2 leży pod linia tlenku M1.
M
1
O + M
2
M
2
O + M
1
ΔG
0
r
= ΔG
0
tw
(M
2
O) + ΔG
0
tw
(M
1
) - ΔG
0
tw
(M
1
O) - ΔG
0
tw
(M
2
) < 0
ΔG
0
tw
(M
2
O) - ΔG
0
tw
(M
1
O) < 0
ΔG
0
tw
(M
2
O) < ΔG
0
tw
(M
1
O)
Przykład:
MgO + Ca Mg + CaO
T< 2300
ΔG
tw
(CaO) < ΔG
tw
(MgO)
21
• dla reakcji:
MO(s) + C(s) → M(s) + CO(g)
ΔG
tw
(CO) < ΔG
tw
(MO)
Przykład:
Al
2
O
3
– minimalna temperatura potrzebna do redukcji tlenku Al
2
O
3
wynosi
ok. 2100
o
C
• dla reakcji:
MO(s) + ½ C(s) → M(s) + ½ CO
2
(g)
ΔG
tw
(CO
2
) < ΔG
tw
(MO)
Przykład:
SiO
2
– minimalna temperatura potrzebna do redukcji tego tlenku węglem
wynosi ok. 2450
o
C
• dla reakcji:
MO(s) + CO(g) → M(s) + CO
2
(g)
ΔG(*) < ΔG
tw
(MO)
Przykład:
Ag
2
O –w całym zakresie temperatur jest możliwa redukcja tego tlenku
tlenkiem węgla (II)
22

Podsumowanie
23
Dzięki diagramom Ellinghama możliwe jest znalezienie temperatur,
w których metal
jest stabilny i temperatur, w których metal
będzie się spontanicznie utleniał.
Diagramy te mogą pomóc zwizualizować względną stabilność
utlenianych metali i ich
produktów.
Można poprzez nanoszenie kilku zależności na jeden wykres
porównywać stabilność tych tlenków bezpośrednio. Tlenki, których linie
leżą niżej na wykresie są
bardziej stabilne.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
Wyszukiwarka
Podobne podstrony:
prezentacja diagram Ellinghama Kopia
prezentacja diagram Ellinghama Kopia
diagram ellinghama
Zestaw 4 Ellingham diagrams
Diagram komunikacji
Sieć działań(diagram strzałkowy) v 2
8(45) Diagramy klas cz2
Diagramy w UML
Diagram%d
4 Diagram DPU
diagramy procentowe id 135538 Nieznany
block diagram
Zadania zajęcia 3 PSI - diagramy sekwencji i kooperacji, szkoła, PSI
więcej podobnych podstron