Chemia
Chemia
Prof. dr hab. Krystyna A. Skibniewska
Katedra Podstaw Bezpieczeństwa WNT
E-mail: kas@uwm.edu.pl

Warunki zaliczenia
Warunki zaliczenia
przedmiotu
przedmiotu
Każdy wykład będzie
kończył się
sprawdzeniem obecności. Osoby
przeszkadzające wykładowcy i/lub
słuchaczom będą wypraszane z sali.
Ćwiczenia będą odbywały się w sali
A021, w nowym budynku Wydziału
Nauk Technicznych przy ul
Oczapowskiego 11,
przy stadionie.

Na zajęcia należy przyjść w obuwiu na
płaskim obcasie, z włosami
spiętymi/związanymi.
Obowiązkowo
należy przynieść
ochronny fartuch z długim rękawem o
dowolnym kroju i kolorze.
Na zajęciach studenci wykonują
doświadczenia chemiczne oraz opisują
je, dlatego też prosimy o przyniesienie
na zajęcia jednego cienkiego zeszytu
przeznaczonego
tylko
na chemię.

W wyznaczonych terminach odbędą się
3 kolokwia z wcześniej przerobionego
materiału. Prócz materiału z ćwiczeń
każde kolokwium będzie obejmowało
materiał wykładowy.
Student uzyska zaliczenie
przedmiotu, jeżeli nie będzie miał
więcej, niż jedną
usprawiedliwioną
(zwolnienie
lekarskie lub od opiekuna roku)
nieobecność i oceny pozytywne z
wszystkich
kolokwiów.

Zagadnienia do zaliczenia
Zagadnienia do zaliczenia
Budowa i właściwości gazów, cieczy i ciał stałych,
Siły spójności tworzyw jednorodnych i niejednorodnych,
Podstawy termodynamiki i kinetyki chemicznej,
Fizykochemia wody,
Układy koloidalne – otrzymywanie, właściwości i trwałość,
Podział i zastosowania emulsji,
Zjawiska powierzchniowe – ich znaczenie w budownictwie,
Reakcje chemiczne ze szczególnym uwzględnieniem
reakcji hydratacji i hydrolizy,
Chemia mineralnych materiałów budowlanych ze
szczególnym uwzględnieniem materiałów wiążących,
Chemia tworzyw sztucznych i tworzyw bitumicznych,
Procesy korozji tworzyw cementowych,
Chemia metali – procesy korozji,
Selekcja i utylizacja odpadów materiałowych w
budownictwie.

Podręczniki
Podręczniki
Czarnecki L., Broniewski T.,
Henning O. 2010. Chemia w
budownictwie. Wyd. Arkady,
Warszawa,
Zbiór zadań z chemii (np. dla
szkół średnich),
Wiele innych podręczników z
chemii ogólnej, nieorganicznej i
fizycznej.


Plan wykładu 1
Plan wykładu 1
Układ okresowy pierwiastków.
Układ a właściwości
pierwiastków.
Dysocjacja, reakcje w
roztworach wodnych,
hydroliza.
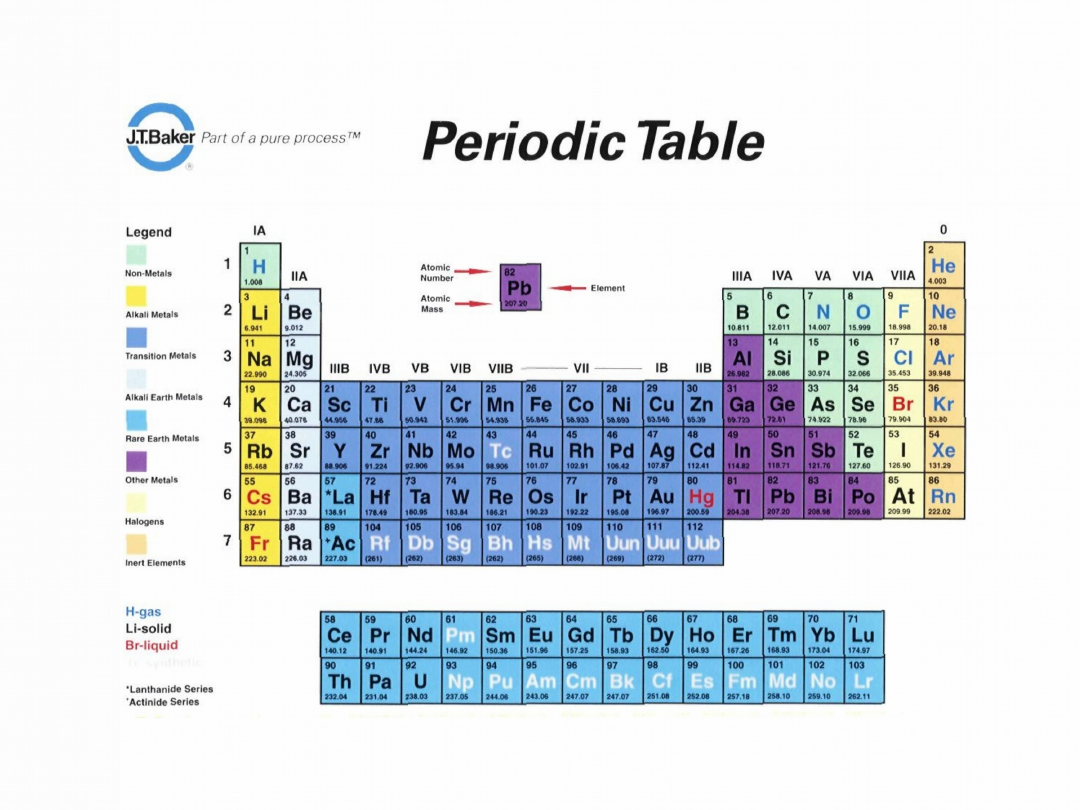

Układ okresowy
Układ okresowy
pierwiatków
pierwiatków
Zbudowany jest z grup
(pionowych) i okresów
(poziomych).
Grupy (z drobnymi wyjątkami)
tworzone są przez pierwiastki o
podobnych właściwościach.
Li
LiOH
Na
NaOH
K
KOH
Cs!!
!
CsOH
N
NH
3
N
2
O
3
P
PH
3
P
2
O
3
As
AsH
3
As
2
O
3
!!
!
Sb
SbH
3
Sb
2
O
3

W układzie okresowym wymienione są
pierwiastki.
W przyrodzie rzadko kiedy pierwiastki
występują samodzielnie (wyjątkiem grupa
ostatnia - gazy szlachetne, a więc hel, neon,
argon, krypton, ksenon, radon).
Tlenki to związki pierwiastków w tlenem, w
których tlen jest zawsze dwuwartościowy (-
2), np. Na
2
O, CaO, Al
2
O
3
, Fe
2
O
3
, CO i CO
2
, SO
2
i SO
3
.
Co oznaczają cyfry:
C
2
H
5
OH + 3O
2
2 CO
2
+ 3H
2
O

Tlenki reagują z wodą tworząc zasady
lub kwasy.
Mamy więc pierwiastki tlenki
zasadowe i kwasowe.
Zasadowe są na początku (w 1 – 2
grupie układu), kwasowe na końcu,
po prawej stronie.
W środku są pierwiastki amfoteryczne,
czyli zarazem kwasowe i zasadowe,
ale o tym kiedy indziej.

Dysocjacja
– rozpad na jony
Wg teorii dysocjacji elektrolitycznej:
Kwas dysocjuje na kation wodoru
H
+
i anion reszty kwasowej.
Zasada (wodny roztwór
wodorotlenku) dysocjuje na anion
grupy wodorotlenowej OH
-
i kation
metalu (również NH4
+)
.
Sól dysocjuje na kation metalu i
anion reszty kwasowej.

Reakcje w roztworach
wodnych
NaOH + HNO
3
→NaNO
3
+ H
2
O
a tak naprawdę:
Na
+
+ OH
-
+ H
+
+ NO
3-
→ Na
+
+ NO
3-
+ H
2
O
Na
+
+ OH
-
+ H
+
+
NO
3
-
→
Na
+
+
NO
3-
+ H
2
O
czyli:
OH
-
+ H
+
→ H
2
O

Typy reakcji
Reakcje syntezy, analizy,
wymiany.
Reakcje odwracalne i
nieodwracalne.

Dziękuję za uwagę
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
Wyszukiwarka
Podobne podstrony:
Zao bud 2
Dz i zao bud 4
Dz i zao bud 5
Dz i zao bud 5
Zao bud 3
Dz bud 4
Wykład och zao 6
BUD OG wykład 11 3 Geosyntetyki
BUD OG wykład 11 1 Tworzywa sztuczne
Wykład och zao 3a
wykład III bud ciało i szybkość
Bud II ćw proj 4
Kal kosz wprow 2014 zao
mat bud 006 (Kopiowanie) (Kopiowanie)
bud 13
więcej podobnych podstron