
Materia występuje w trzech stanach skupienia:
– stałym
– ciekłym
– gazowym
Istnieje również czwarty stan skupienia, stan plazmy, który istnieje
jedynie w zakresie niezwykle wysokich temperatur.
• Stan stały charakteryzuje się utrzymaniem kształtu, postaci i
objętości próbki, niezależnie od kształtu naczynia.
• Stan ciekły odznacza się tym, że próbka zachowuje swoją określoną
objętość podczas przelewania z jednego zbiornika do drugiego, ale
przyjmuje kształt dna mieszczącego ją naczynia
• Stan gazowy charakteryzuje się tym, że próbka nie ma ani własnego
kształtu, ani objętości i może rozprzestrzeniać się po całej objętości
naczynia, w której jest zawarta.

Różnice występujące między różnymi stanami skupienia można
łatwo wyjaśnić za pomocą teorii kinetycznej materii zgodnie z
którą w temperaturach powyżej zera absolutnego (tj. powyżej
-273°C) atomy i cząsteczki substancji znajdują się w
nieustannym ruchu.
W ciałach stałych ruch ten nie jest wielki i odnosi się głównie do
oscylacji atomów i cząsteczek względem węzłów sieci krystalicznej.
W miarę ogrzewania rośnie energia kinetyczna ruchów a w
temperaturze zwanej temperaturą topnienia cząsteczki lub
pojedyncze atomy tracą zdolność powrotu do swych pierwotnych
położeń i substancja stała przechodzi w ciecz. Wzajemne
oddziaływanie między atomami i cząsteczkami jest jednak ciągle
tak duże, że objętość cieczy w danej temperaturze pozostaje stała.
Dalsze ogrzewanie cieczy prowadzi wreszcie do stanu, w którym
cząsteczki uzyskują energię kinetyczną wystarczającą do
pokonania sił wzajemnego przyciągania i ciecz zamienia się w gaz,
zdolny do rozprzestrzeniania się w całej dostępnej przestrzeni
.

Ciała stałe
bezpostaciowe i krystaliczne
Ciała bezpostaciowe - (szkło, stopiona i ochłodzona krzemionka, żywice
polimetakrylowe)
to substancje, których atomy, cząsteczki lub jony nie
są rozmieszczone w prawidłowej sieci przestrzennej.
Substancje te, określone często jako ciecze przechłodzone o dużej
lepkości, wykazują niektóre cechy charakterystyczne dla ciał stałych, jak
twardość i zdolność zachowania nie zmienionego kształtu, nie wykazują
ściśle określonej temperatury topnienia, ogrzewane stopniowo miękną i
rozpływają się.
Ciała bezpostaciowe są
izotropowe
. Oznacza to, że wykazują one we
wszystkich kierunkach identyczne właściwości fizyczne, ich twardość,
wytrzymałość mechaniczną, rozszerzalność cieplną, przewodnictwo
elektryczne, właściwości optyczne - nie zależą od kierunku działania.
Ciała krystaliczne - wykazują w określonych kierunkach przestrzeni
prawidłowe, powtarzające się okresowo ułożenie atomów, cząsteczek lub
jonów, tworzących prawidłową sieć krystaliczną. Topią się w ściśle
określonych
temperaturach.
Kryształy są
anizotropowe
– to znaczy że ich właściwości zmieniają
się wraz ze zmianą kierunku
W zależności od rodzaju wiązań ciała krystaliczne można podzielić na
kryształy;
– z siecią jonową
– z siecią atomową
– z siecią cząsteczkową
– z siecią metaliczną

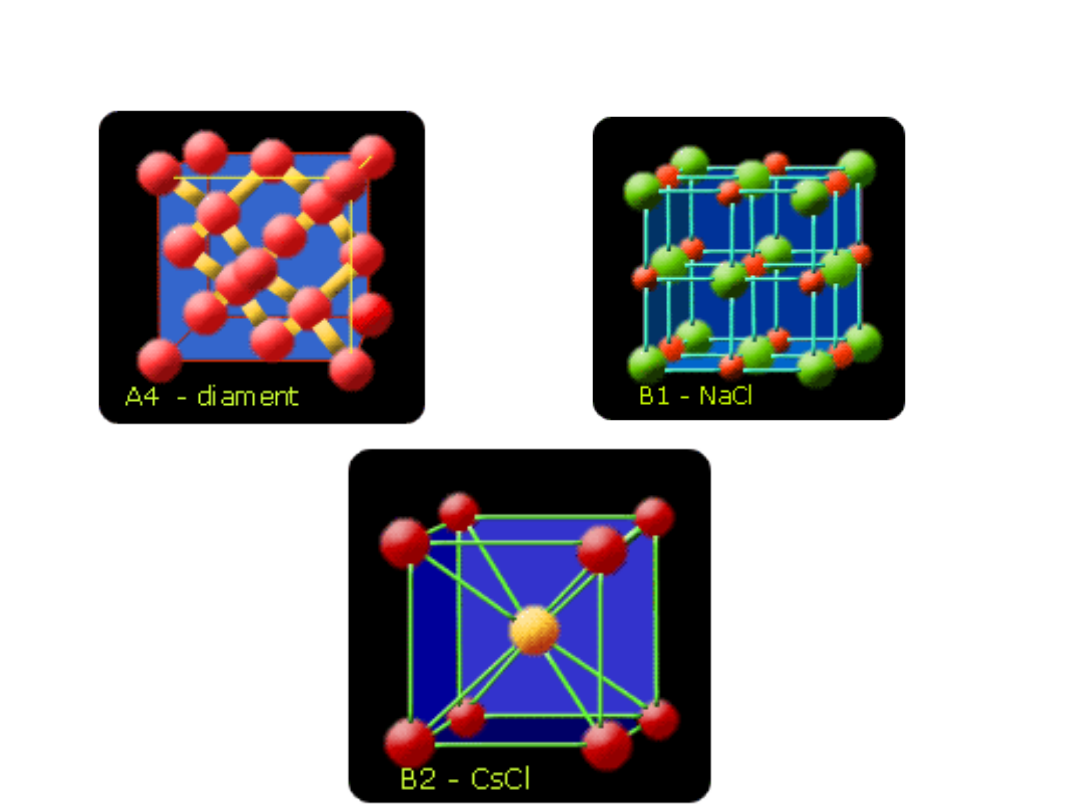
Kryształy jonowe
W ciałach stałych jonowych cząstkami w węzłach sieci
są jony dodatnie i ujemne. Siły przyciągania są duże.
Wskutek tego jonowe ciała stałe mają zwykle dość
wysokie temperatury topnienia, dużo wyższe od
pokojowej.
W związkach jonowych, np w alkalicznych halogenkach,
siły wiązania polegają na działających we wszystkich
kierunkach siłach przyciągania elektrostatycznego
przeciwnie naładowanych jonów, które tworzą elementy
struktury
periodycznej
sieci
krystalicznej.
Elektrostatyczny lub polarny charakter sił wiązania i
kulistosymetryczny rozkład ładunku powodują, że
pojedyncze jony w sieci jonowej są otoczone możliwie
dużą liczbą jonów naładowanych przeciwnie.

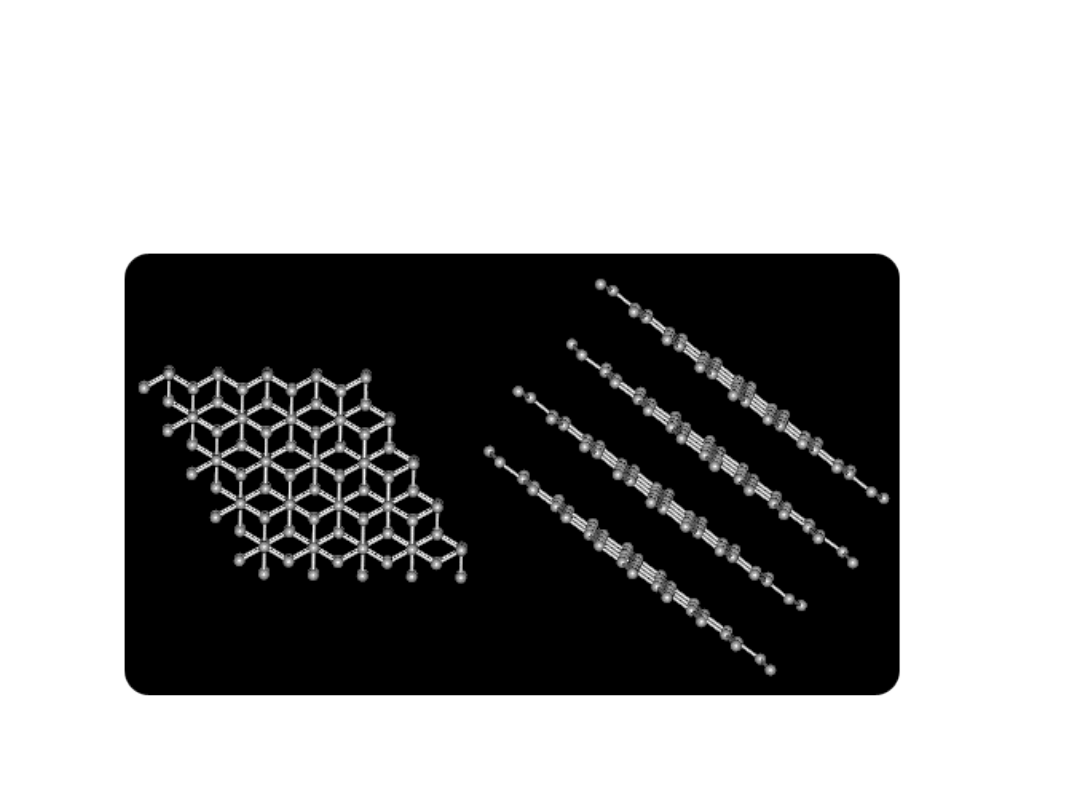
Kryształy cząsteczkowe
Kryształami cząsteczkowymi - nazywamy
takie struktury, w których pojedyncze cząsteczki
utrzymywane są w sieci krystalicznej w wyniku
oddziaływania:
•sił van der Waalsa
•dipolowego
Ten typ kryształu występuje najczęściej w
związkach organicznych.
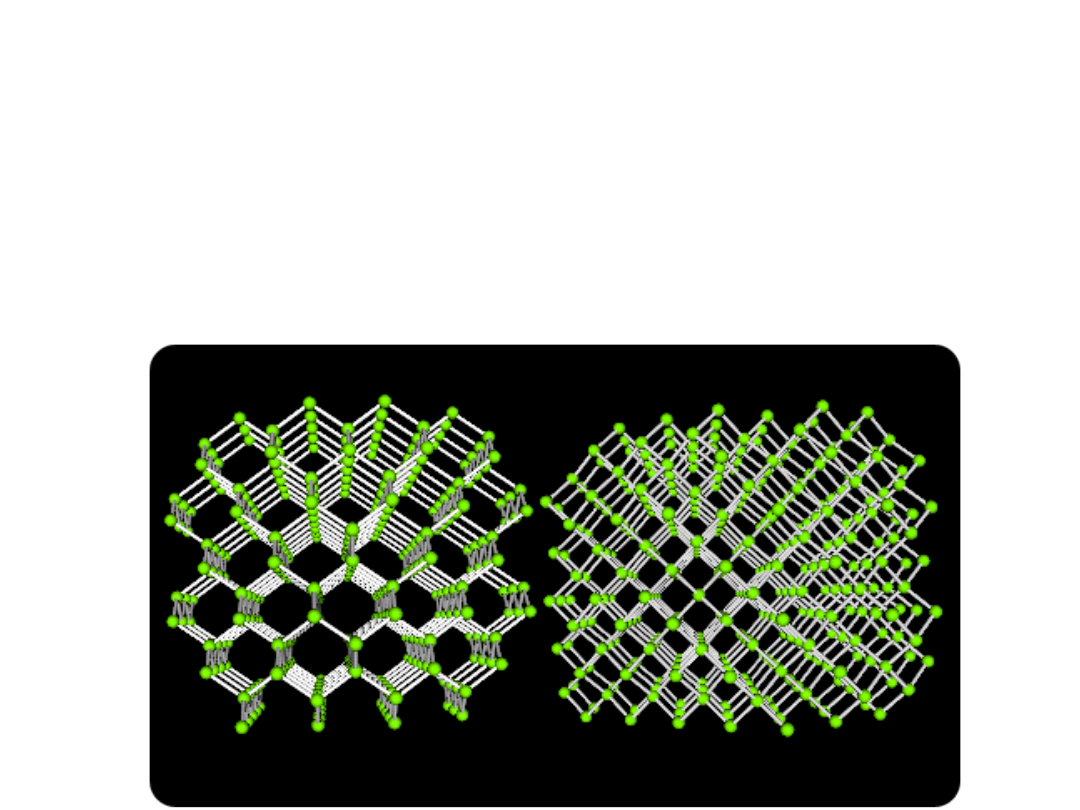
Kryształy kowalencyjne
• W kryształach kowalencyjnych atomy są związane z sobą
wiązaniami atomowymi.
W kryształach atomowych traci sens pojęcie cząsteczki, gdyż nie
można tu wyróżnić indywidualnych cząsteczek. Cały kryształ
atomowy (kowalencyjny) trzeba traktować jako jedną olbrzymią
cząsteczkę. Przykładem kowalencyjnej struktury krystalicznej może
być sieć krystaliczna diamentu, w której każdy atom jest otoczony
czterema innymi atomami węgla rozmieszczonymi w narożnikach
czworościanu.
Sieć diamentu dzięki szczególnie gęstemu upakowaniu
przestrzennemu atomów i dzięki wiązaniom kowalencyjnym między
nimi określa właściwości fizyczne tej odmiany alotropowej węgla, tj.
najwyższą twardość i bardzo dużą gęstość
• W sieci krystalicznej grafitu poszczególne warstwy płaskie
związane są słabymi siłami oddziaływania
międzycząsteczkowego, co powoduje, że odstępy między
tymi warstwami (0,341 nm) są duże w porównaniu z
odstępami atomów w obrębie tej samej warstwy (0,142
nm)

Kryształ metaliczny
Kryształ metaliczny - budowę metalu
najprościej można opisać w ten sposób, że od
każdego atomu metalu odczepiają się elektrony
walencyjne, których liczba jest zależna od jego
położenia w układzie okresowym i które w sieci
przestrzennej,
utworzonej
przez
pozostałe
dodatnie jony, poruszają się mniej lub bardziej
swobodnie jako gaz elektronowy.

Właściwości fizyczne kryształów z różnymi wiązaniami
Właściwości
KRYSZTAŁY
cząstecz
kowe
kowalency
ne
jonowe
metaliczn
e
mechaniczn
e
mała
twardość,
mała
wytrzymałoś
ć
duża twardość,
duża
wytrzymałość
duża twardość,
duża wytrzymałość
różna
wytrzymałość,
dla różnych
metali, na ogół
duża,
ciągliwość
termiczne
Temp.
topnienia
niskie, duży
współczynni
k
rozszerzalno
ści cieplnej
Temp. topnienia
wysokie, mały
współczynnik
rozszerzalności
cieplnej
Temp. topnienia
wysokie, mały
współczynnik
rozszerzalności
cieplnej
Temp.
topnienia
różne, duży
współczynnik
rozszerzalnośc
i cieplnej
elektryczne
izolatory
W stanie
czystym nie
przewodzą
prądu
W stanie ciekłym
źle przewodzą prąd,
w stanie stopionym
i w roztworach
wodnych wykazują
przewodnictwo
jonowe
Dobre
przewodniki
prądu

Budowa krystaliczna ciał stałych warunkuje szereg ich cech
fizycznych:
twardość,
łupliwość,
załamanie światła,
temp. topnienia,
rozpuszczalność.
• W kryształach o sieci mieszanej, zwłaszcza o budowie
warstwowej, tworzą się płaszczyzny łupliwości w miejscach
słabych wiązań międzycząsteczkowych np:
• Grafit – w poszczególnych warstwach występuje między
atomami węgla wiązanie atomowe natomiast między
warstwami słabe oddziaływanie van der Waalsa
• Talk – wiązanie jonowe w warstwach, między warstwami
oddziaływanie van der Waalsa
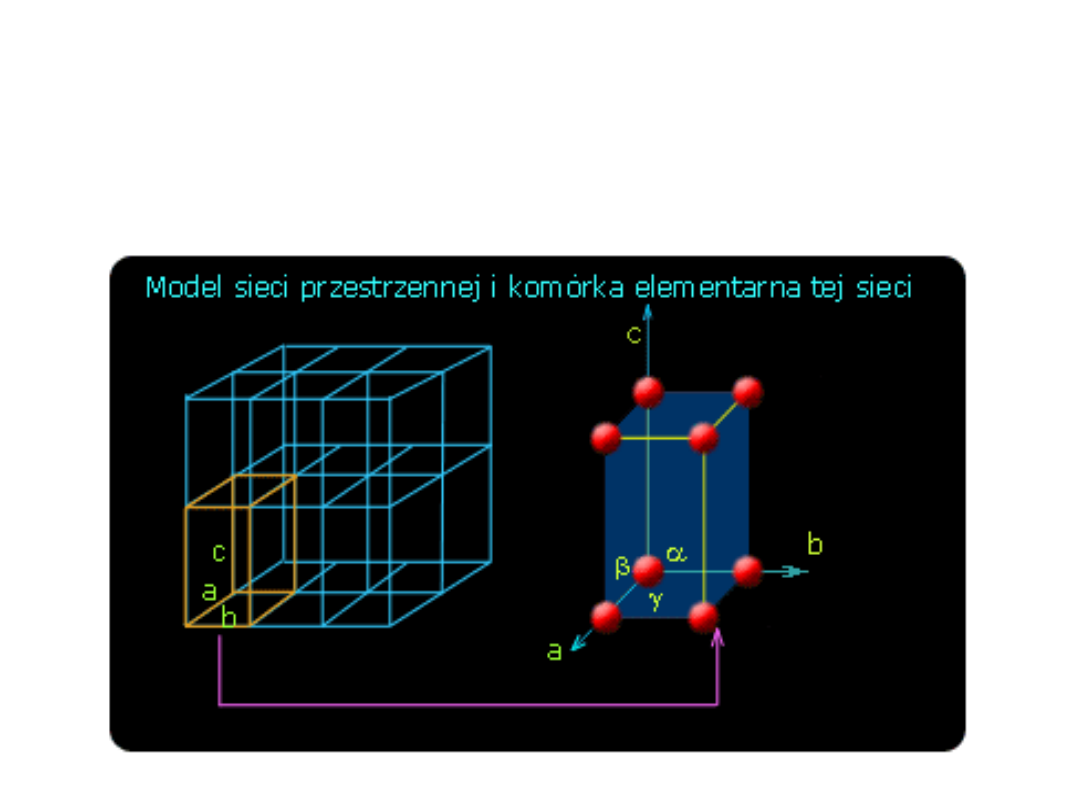
Struktury krystaliczne
Sieć przestrzenna - nieskończenie rozciągający się,
regularny,
przestrzennie
periodyczny układ punktów,
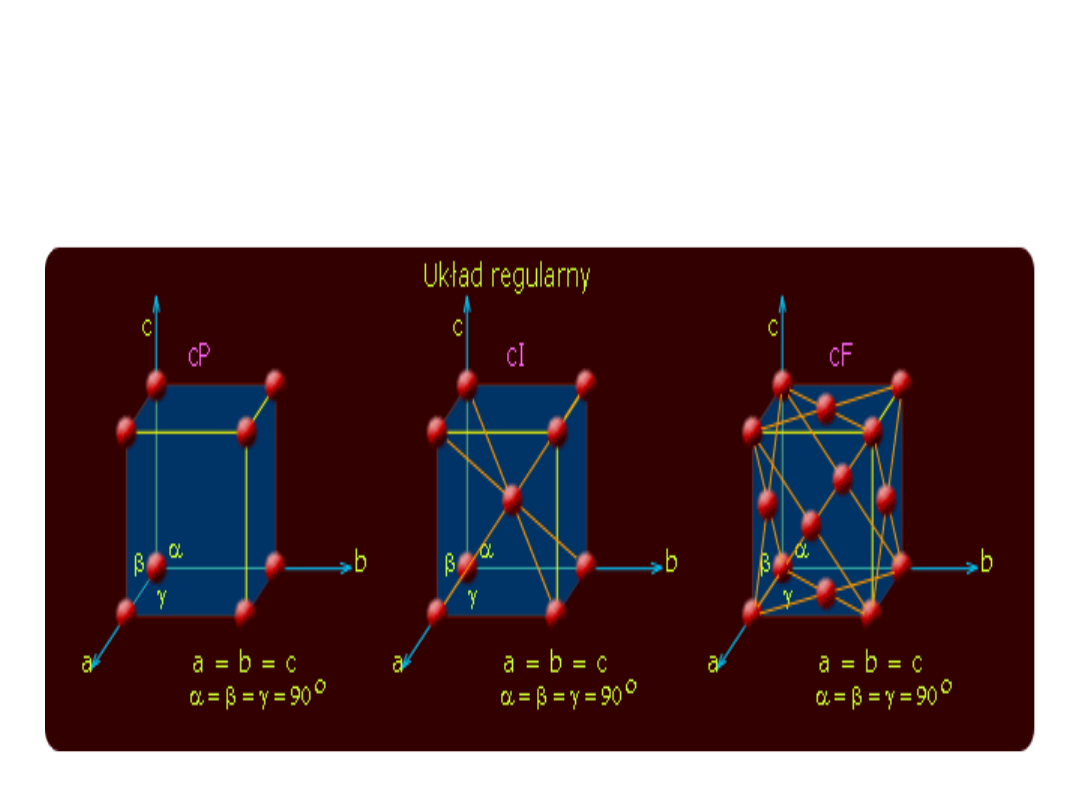
Typy komórek elementarnych kryształów
Układ regularny -trzy jednakowe osie o długości
a, tworzące z sobą kąty proste
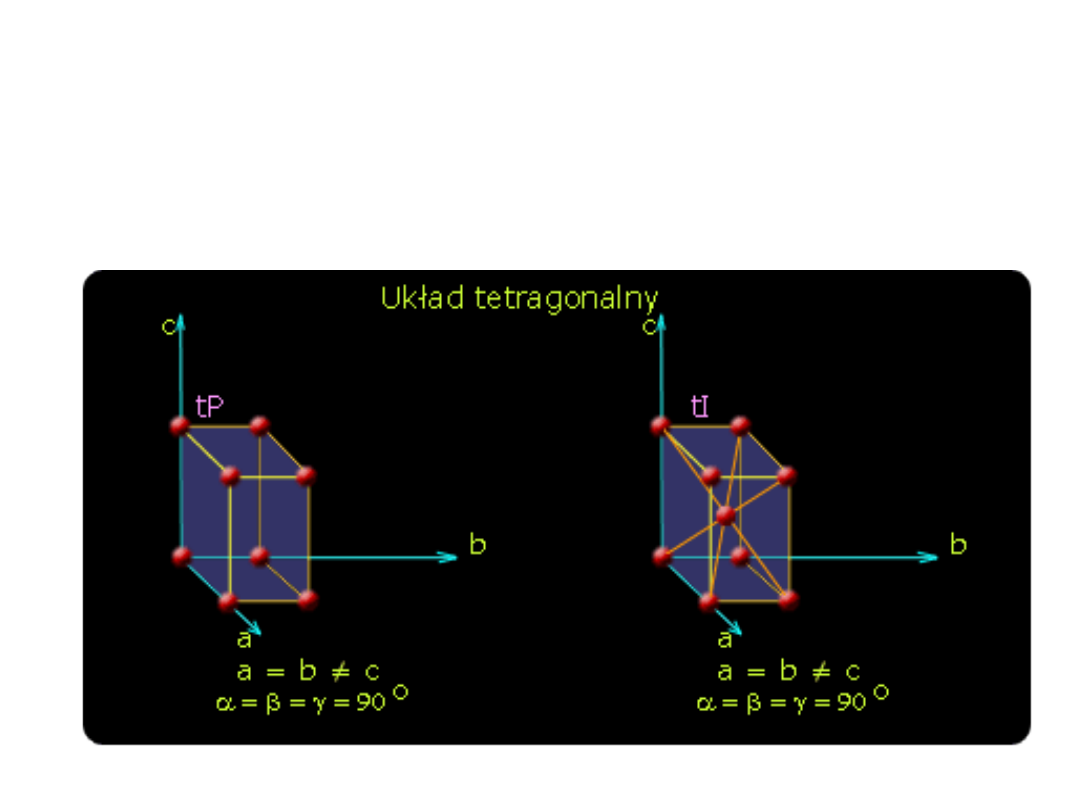
Układ tetragonalny - dwie jednakowe krawędzie
oraz trzecia krawędź o innej długości, wzajemne
prostopadłe
-heksagonalny
i
trygonalny
nieromboedryczny dwie równe krawędzie, pod
kątem 120
o
, i trzecia krawędź o innej długości,
prostopadła do dwóch pierwszych
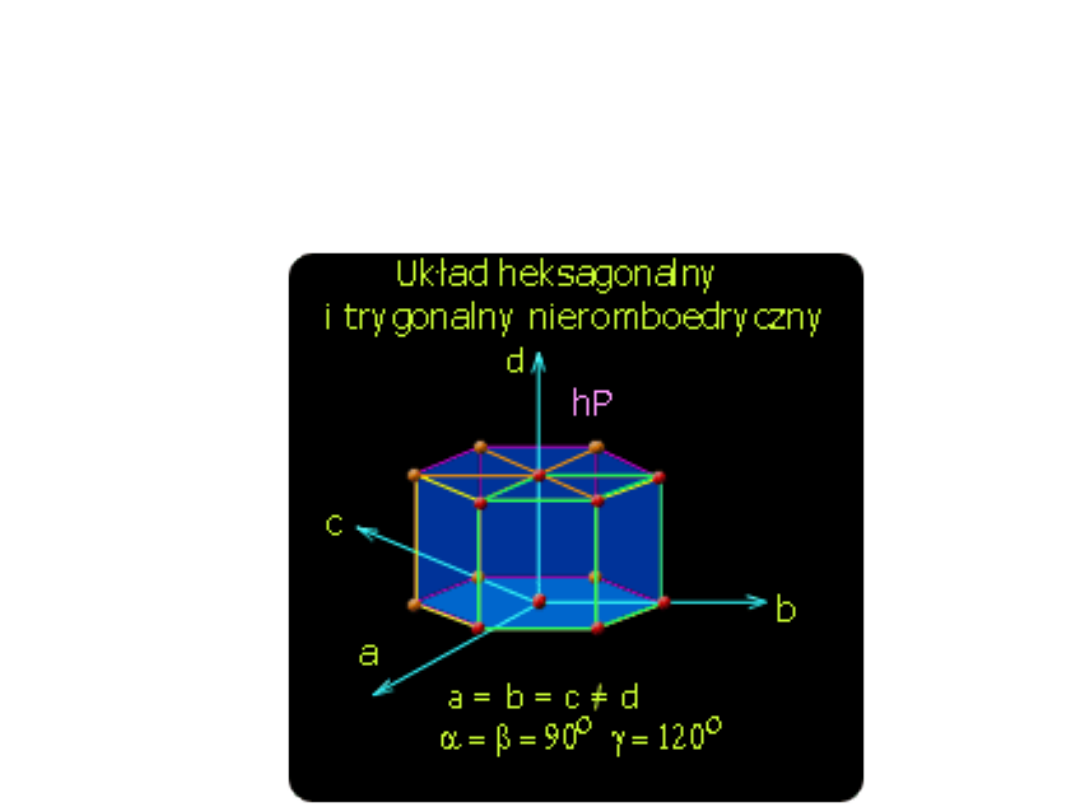
Układ heksagonalny i trygonalny
nieromboedryczny
dwie równe krawędzie, pod kątem 120
o
, i trzecia
krawędź o innej długości, prostopadła do dwóch
pierwszych
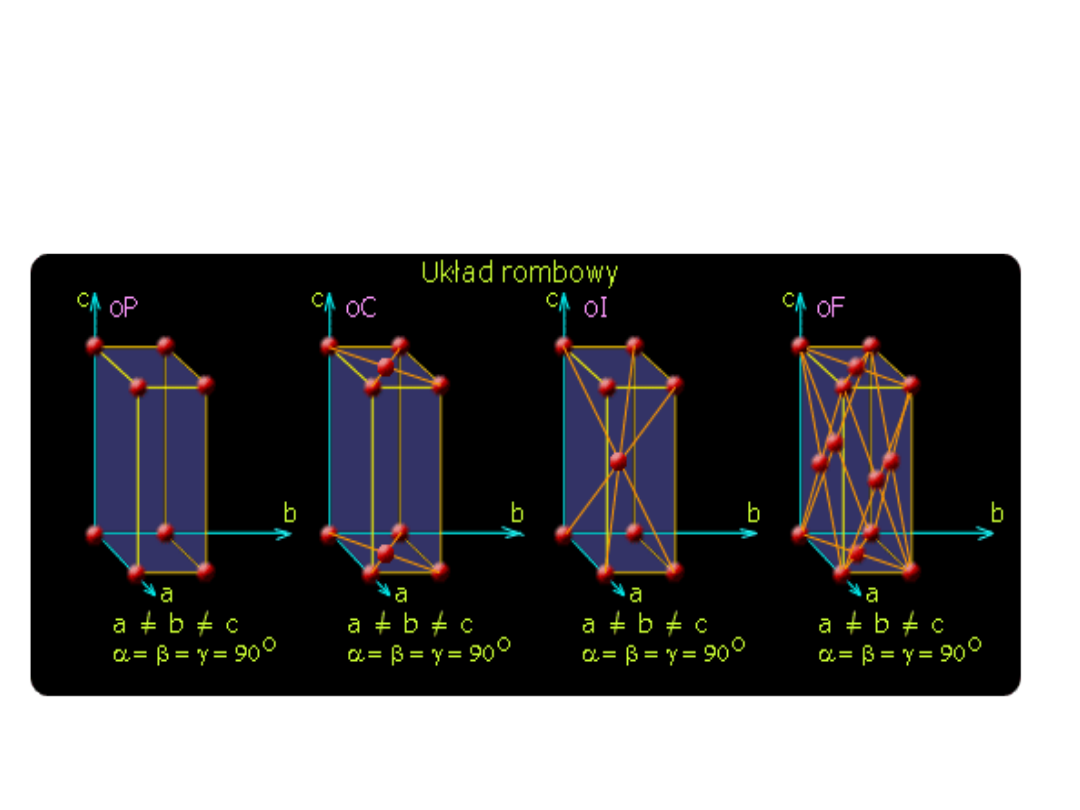
Układ rombowy
trzy krawędzie o niejednakowych długościach,
wszystkie wzajemne prostopadłe
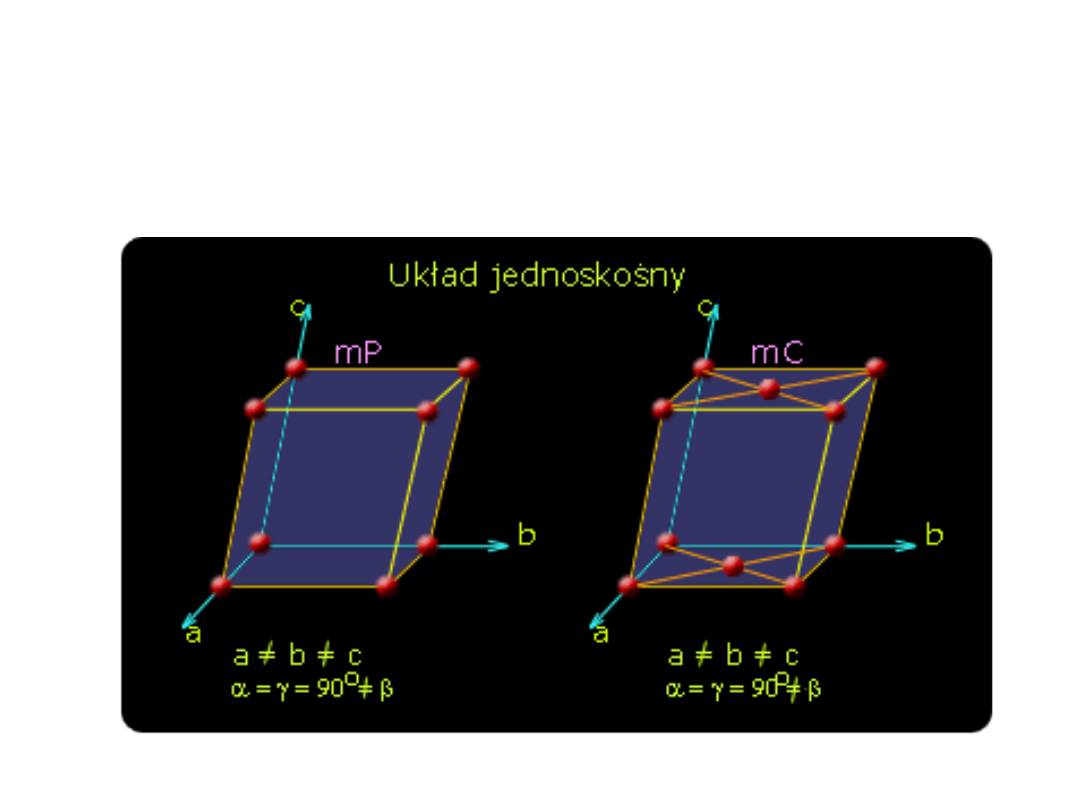
Układ jednoskośny
dwie krawędzie a i c pod kątem względem siebie i
trzecia krawędź pod kątem prostym do a i c
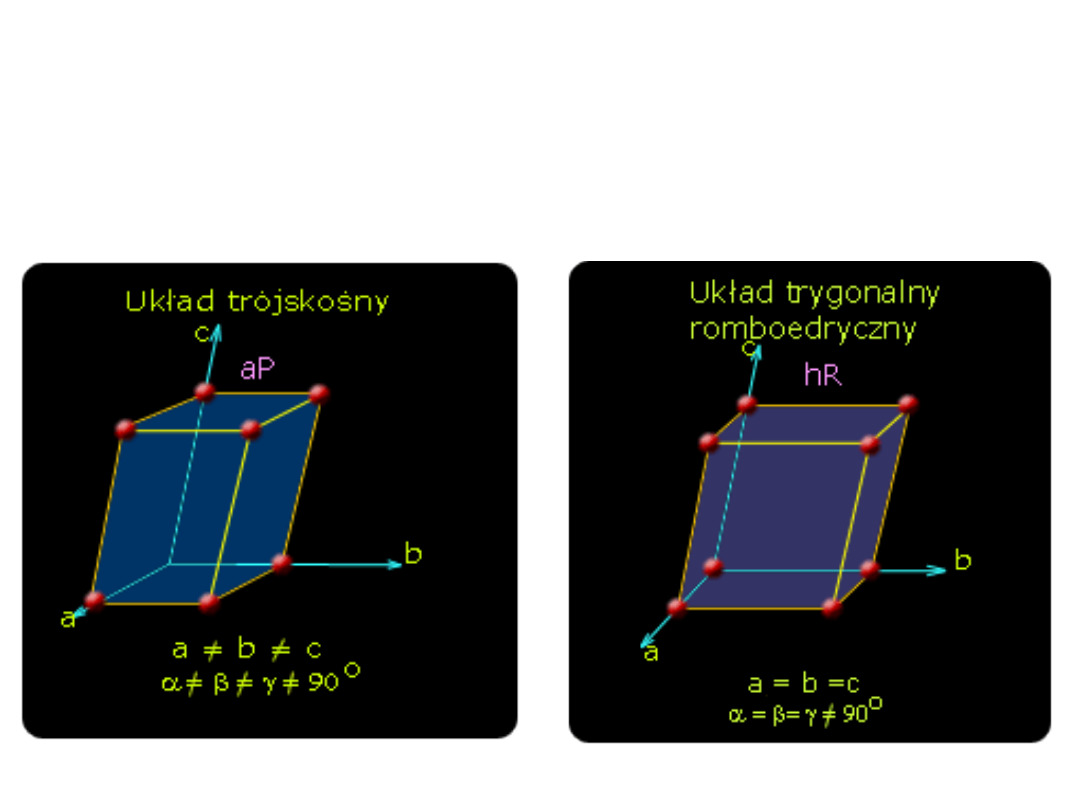
Układ trójskośny
trzy krawędzie a, b, c z
trzema kątami , ,
między nimi
Układ trygonalny
romboedryczny
trzy krawędzie a, b i c oraz
kąty , , są jednakowe
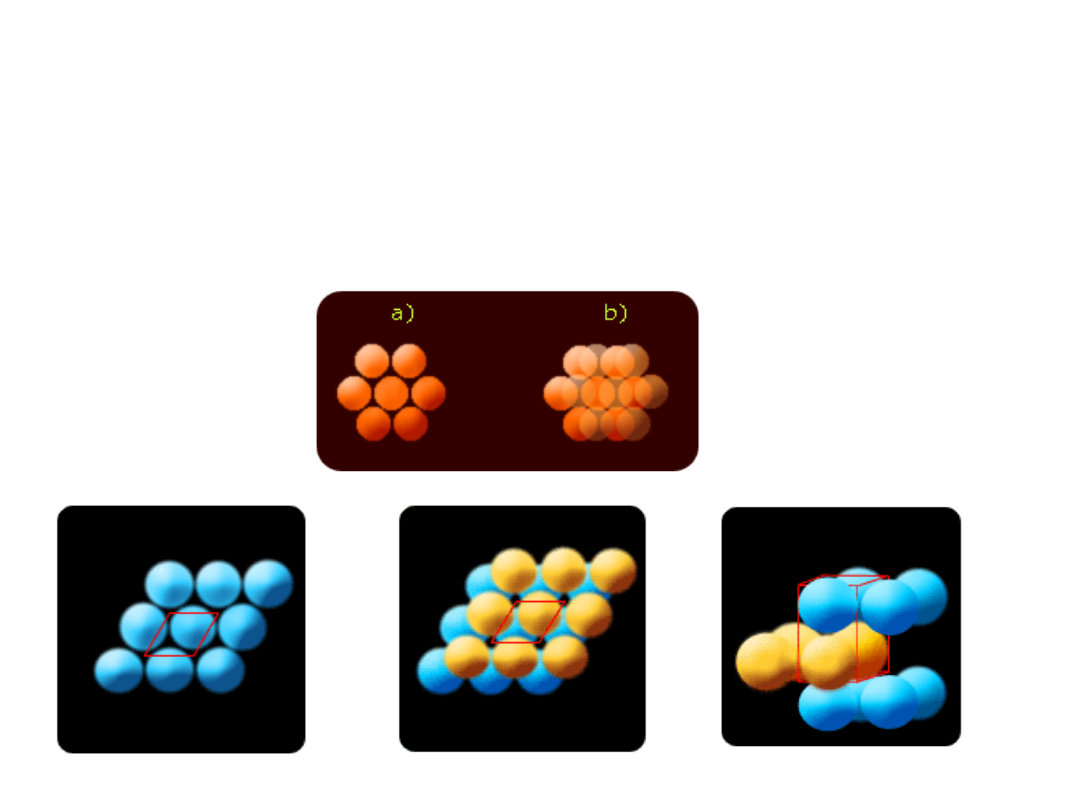
Upakowanie atomów w sieci
krystalicznej
1. Ścisłe upakowanie heksagonalne (hexagonal close
packed = h.c.p.)
(magnez, cynk)

Ścisłe upakowanie sześcienne ( face centered
cubic = f.c.c. )
miedź, srebro i złoto
proste cząsteczki obrotowe, jak CH
4
i HCl
Typy struktur pierwiastków i związków chemicznych

• Pierwiastki chemiczne mogą występować w
różnych odmianach alotropowych – węgiel:
diament, grafit, fulereny
• Związki chemiczne tworzą odmiany polimorficzne
-SiO
2
α – kwarc → γβ trydymit → γ
krystobalit → szkło
• Odmiany alotropowe (polimorficzne) różnią się
między sobą budową sieci krystalicznej oraz
właściwościami fizycznymi.

Stan ciekły
• Jest to stan pośredni między gazami a ciałami
stałymi, charakteryzują się znaczną w
porównaniu z gazami lepkością i gęstością oraz
niewielką ściśliwością oraz rozszerzalnością
cieplną
• Cząsteczki cieczy nie poruszają się bezwładnie,
oraz nie mają takiej swobody ruchu jak to ma
miejsce w gazach.
• Ciecze maja strukturę pseudokrstaliczną -
występuje lokalne uporządkowanie cząsteczek w
temperaturze bliskiej temperaturze krzepnięcia
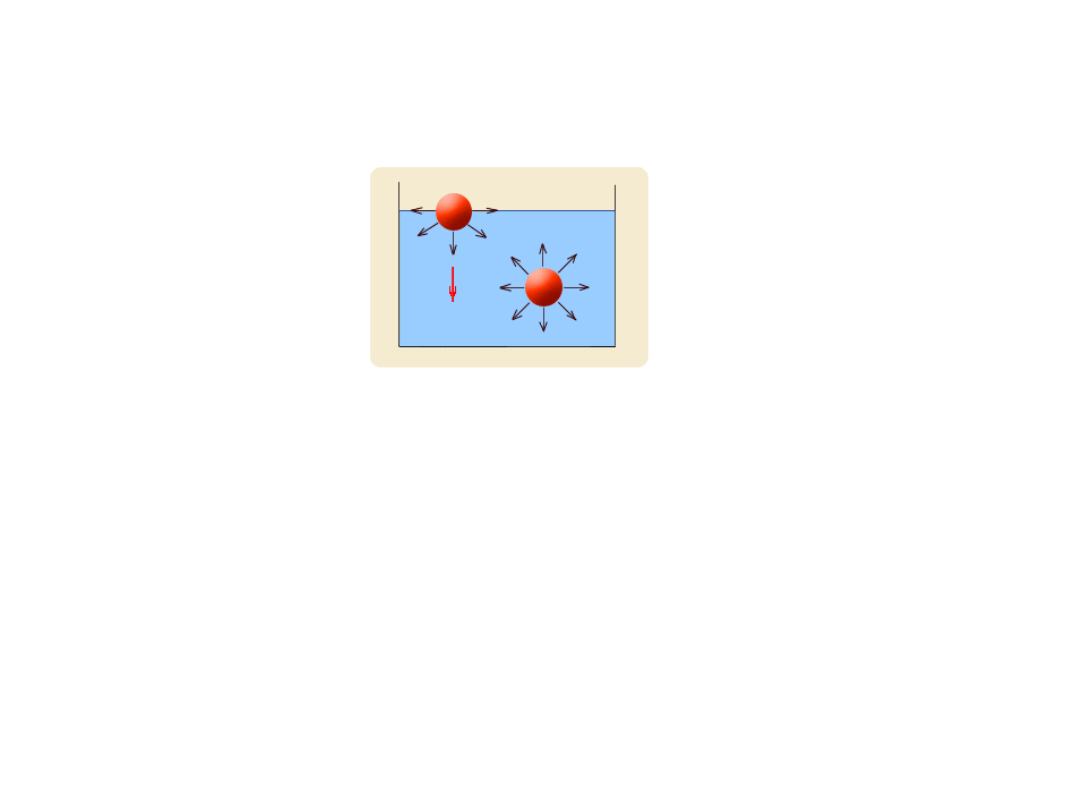
Napięcie powierzchniowe cieczy
• Napięcie powierzchniowe (ρ) cieczy - powstaje w wyniku wzajemnego
oddziaływania cząsteczek we wnętrzu i na powierzchni cieczy.
Siła wypadkowa działająca na cząsteczki położone na powierzchni jest skierowana
w głąb cieczy i działa prostopadle do jej powierzchni i usiłuje zmniejszyć swobodną
powierzchnię cieczy. Ciecz dąży zatem do zmniejszenia liczby cząsteczek na swojej
powierzchni, a więc do osiągnięcia możliwie najmniejszej swobodnej powierzchni.
Chcąc zwiększyć swobodną powierzchnię cieczy, trzeba wykonać pewną pracę na
pokonanie napięcia powierzchniowego
ρ
= W/S (J/m
2
)
Napięcia powierzchniowe cieczy możemy zmieniać przez rozpuszczenie w
cieczy obcej substancji, lub poprzez zmianę temperatury.
Substancje obniżające napięcie powierzchniowe noszą nazwę powierzchniowo
czynnych do których zaliczamy mydła, niektóre kwasy sulfonowe i ich sole oraz
inne związki organiczne.

Lepkość cieczy
Lepkość cieczy jest wynikiem sił tarcia wewnętrznego
pomiędzy cząsteczkami cieczy.
Lepkość cieczy zależy od, rodzaju cieczy i temperatury
cieczy. Wraz z podwyższeniem temperatury lepkość cieczy
silnie maleje.
Mało ruchliwe płyny o dużej lepkości, jak oliwa lub
gliceryna, to ciecze o dużym tarciu wewnętrznym.
Ciecze ruchliwe, jak eter, alkohol etylowy itp. to ciecze o
małym tarciu wewnętrznym, czyli o małej lepkości.

Zwilżalność – zdolność do pokrywania ciała
stałego przez ciecz
Kapilarność – zachowanie się cieczy w cienkich
kapilarach
Działanie kapilarne powoduje wsiąkanie wody w
ciała stałe porowate (wznoszenie się wilgoci w
murach).
Prężność pary w kapilarach jest niższa niż nad
powierzchnią swobodną cieczy, zatem temp.
Wrzenia i skraplania w kapilarach jest wyższa, a
temp. topnienia i krzepnięcia niższa. Ma to
ważne znaczenie przy suszeniu materiałów
porowatych i ze względu na ich mrozoodporność.

• Układy, w których uzyskano znaczne rozwinięcie
powierzchni wskutek rozdrobnienia jednej z faz,
nazywamy – układami dyspersyjnymi
• W każdym układzie rozróżniamy fazę
rozproszoną i fazę rozpraszającą, która otacza i
oddziela od siebie cząstki fazy rozproszonej.
• Biorąc pod uwagę rozmiary cząstek
rozproszonych, rozróżniamy:
- układy o rozdrobnieniu molekularnym- o
rozmiarach cząstek mniejszych od 1 (10 Ǻ)
- układy o rozdrobnieniu koloidalnym – o
rozmiarach cząstek od 1 do 200 nm (10-2000 Ǻ)
- układy grubodyspersyjne- o rozmiarach
cząstek większych od 200 nm.
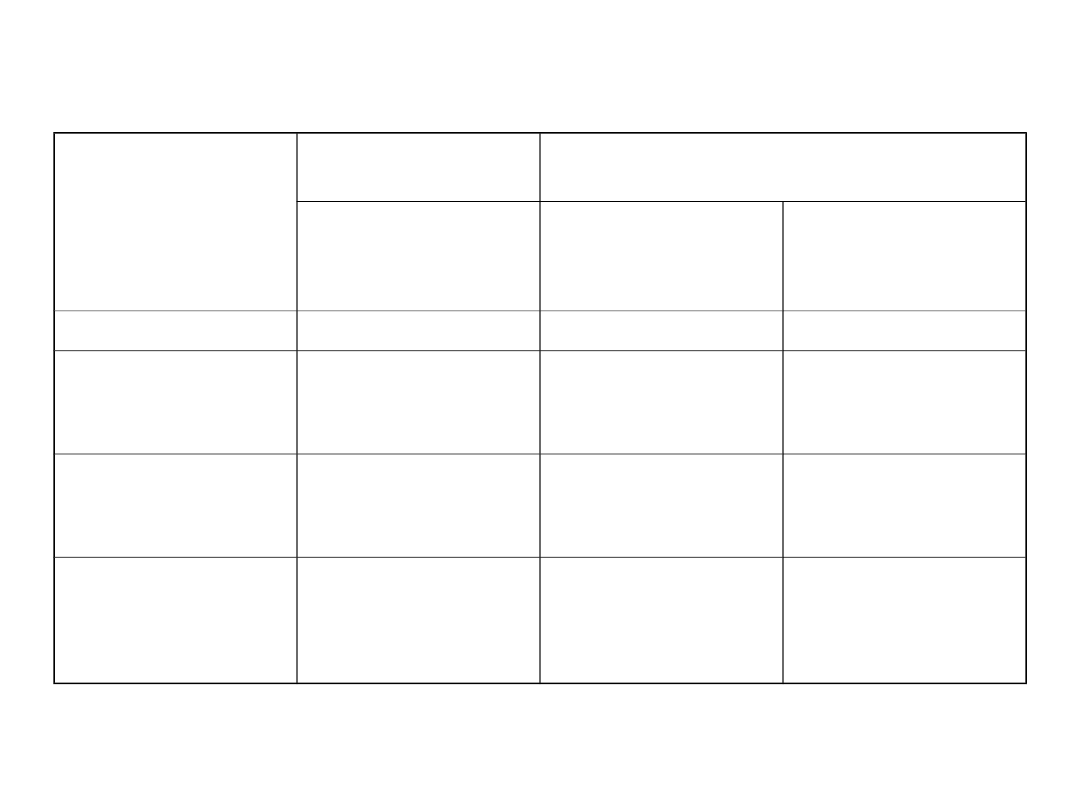
Charakterystyka układów rozproszonych
CECHY
Mieszanina
jednorodna
Mieszaniny niejednorodne
Roztwory
właściwe
koloidy
zawiesiny
rozproszenie
cząsteczkowe
nadcząsteczkowe
makroskopowe
Wielkość
cząsteczek
<1 nm
Od 1 do 10
3
nm
> 1μm
Rozdzielność
przez sączenie
Nie rozdzielane
Rozdzielane tylko
przez
ultrasączenie
rozdzielane
Rozpoznawalność
optyczna
W mikroskopie
elektronowym
tylko największe
cząstki
W mikroskopie
elektronowym
W mikroskopie
optycznym
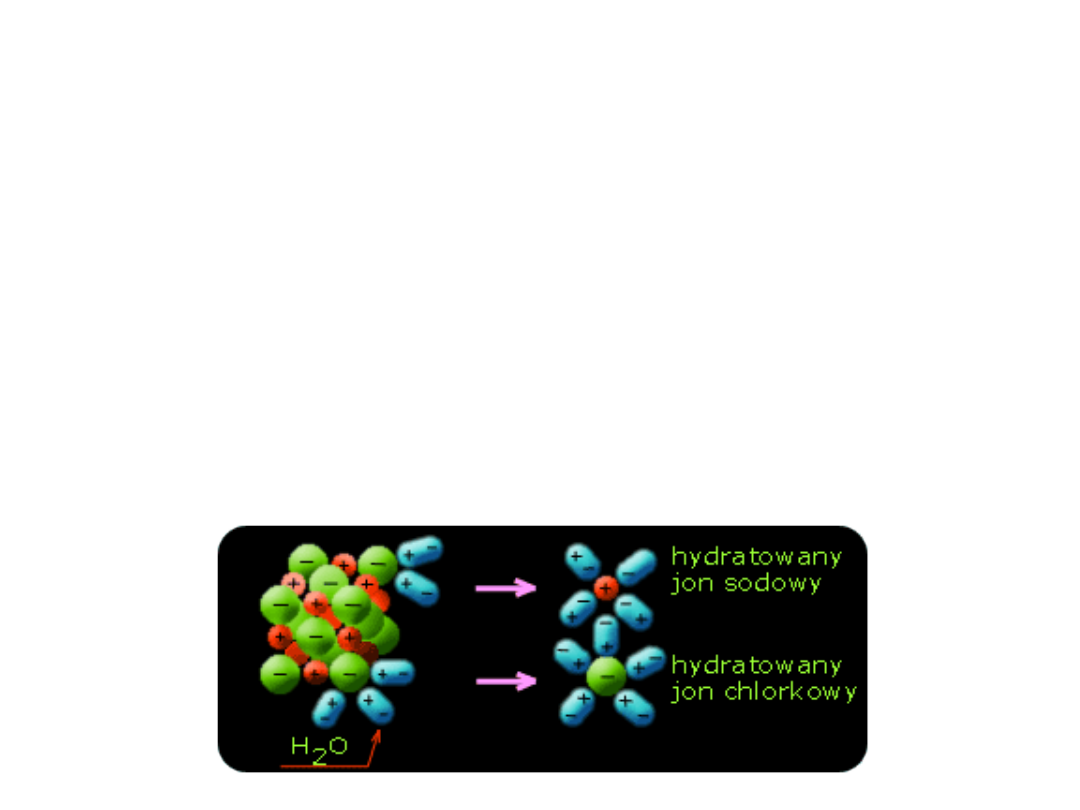
Roztwory rzeczywiste
Roztwory rzeczywiste powstają:
w wyniku rozproszenia substancji, która dąży do osiągnięcia
stanu o maksymalnym uporządkowaniu, dzięki czemu
rozproszenie substancji następuje przy całkowitym braku
współdziałania pomiędzy cząsteczkami rozpuszczalnika a
substancji rozproszonej.
w
wyniku
reakcji
chemicznej
danej
substancji
z
rozpuszczalnikiem, zwanej solwatacją, polegającej na
rozerwaniu (zniszczeniu) wiązań istniejących pomiędzy
cząsteczkami lub atomami substancji rozpuszczonej i
izolowaniu ich od siebie przez cząsteczki rozpuszczalnika.
• Reakcja solwatacji w przypadku wody jako rozpuszczalnika
nosi nazwę reakcji hydratacji i polega na tym, że cząsteczki
wody będące dipolami otaczają cząsteczkę rozpuszczonego
związku.
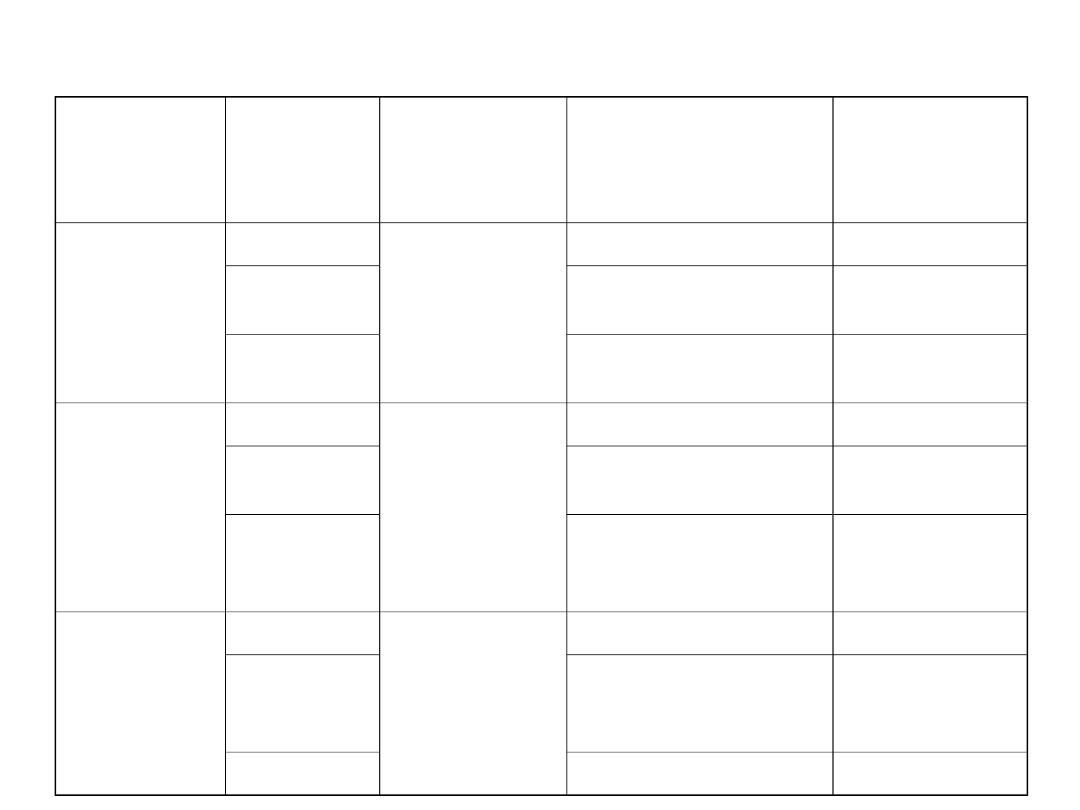
Podział koloidów ze względu na stan skupienia
Ośrodek
rozpraszaj
ący
Substancj
a
rozproszo
na
Rodzaj
koloidu
przykłady
Nazwa
szczegółowa
koloidu
gaz
gaz
areozole
-
-
ciecz
mgła
Areozole
ciekłe (mgły)
Ciało stałe
Dym, kurz
Areozole stałe
(dymy)
ciecz
gaz
Zole –
roztwory
koloidalne
piana
piany
ciecz
Mleko
Lizole,
emulsje
Ciało stałe
Zole tlenków
metali,
wodorotlenków
Zawiesiny
koloidalne
Ciało stałe
gaz
dirozole
pumeks
Piany stałe
ciecz
Kwarc mleczny
Piany stałe
(emulsje
stałe)
Ciało stałe
Szkło rubinowe
Zole stałe

• Układy o rozdrobnieniu molekularnym nazywamy
roztworami rzeczywistymi, w ich przypadku
trudno mówić o istnieniu fazy rozproszonej i
rozpraszającej i istnieniu granicy faz
• W układzie dyspersyjnym cząstki fazy
rozproszonej mogą być całkowicie izolowane
przez fazę rozpraszającą. W przypadku cząstek
koloidalnych mówimy wtedy o roztworze
koloidalnym (zol)
• Układy spoiste- cząstki rozproszone stykają się ze
sobą bezpośrednio i tworzą układ mniej lub
bardziej sztywny (żel)

Roztwory koloidalne
• Roztwory koloidalne (zole) zależnie od ośrodka
rozpraszającego możemy nazywać bardziej
szczegółowo -alkozole ( faza rozpraszająca –
alkohol), areozole ( powietrze), hydrozole (woda).
• Cechy roztworów koloidalnych:
- przezroczyste, klarowne
- efekt Tyndalla – rozproszenie światła przez
cząstki koloidalne
- ruchy Browna – chaotyczne, bezwładne
ruchy cząstek koloidalnych
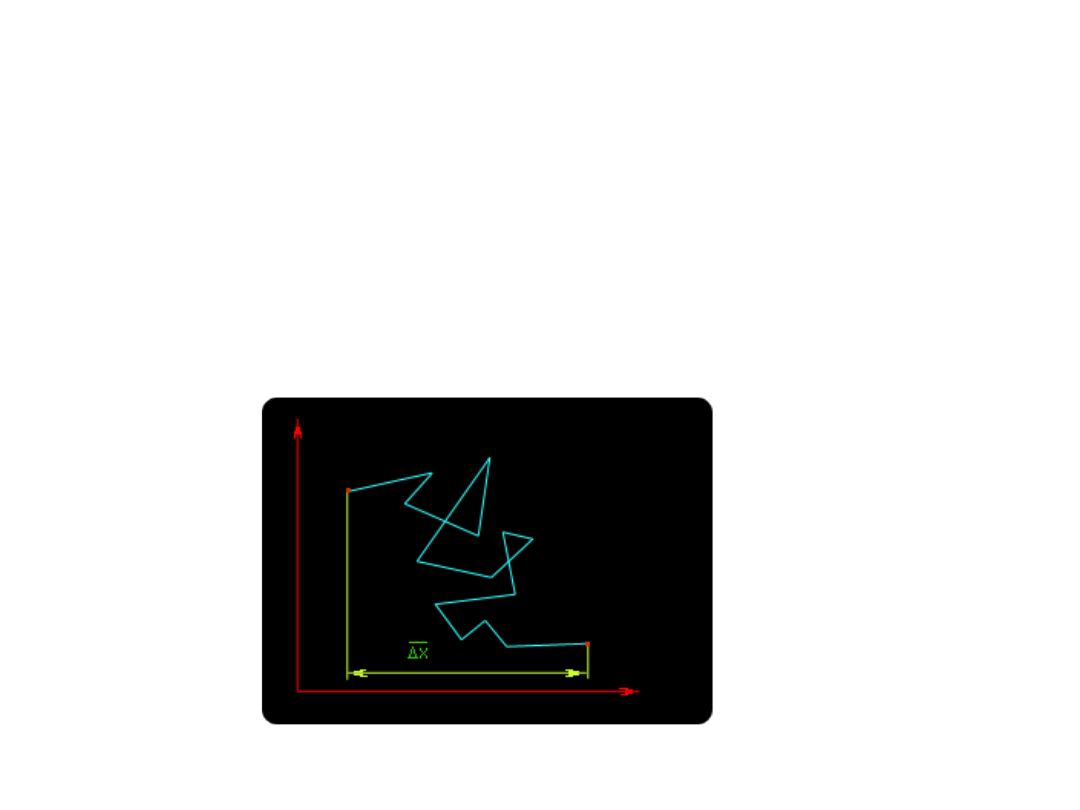
-
ruchy Browna – chaotyczne, bezwładne ruchy
cząstek koloidalnych-
cząsteczki cieczy wykonują
ustawiczne ruchy drgające i zderzają się z cząstkami
koloidalnymi. Ze względu na małe rozmiary cząstek
prawdopodobieństwo dokładnego zrównoważenia uderzeń
nadchodzących z jednej strony cząstki przez uderzenia
nadchodzące z drugiej jest małe i w rezultacie cząstka
przesuwa się w sposób zupełnie nieregularny, chaotyczny.
Ruchy Browna powodują dyfuzję, lecz jest ona znacznie
wolniejsza niż w roztworach rzeczywistych.

Otrzymywanie i oczyszczanie koloidów
• Metody otrzymywania:
- dyspersyjne- polegają na zmniejszaniu rozmiarów cząstek o
charakterze grubodyspersyjnym do rozmiarów cząstek
koloidalnych
- kondensacyjne – łączenie cząstek znajdujących się w stanie
rozproszenia molekularnego
• Metody dyspersyjne:
- w młynach koloidowych o bardzo dużej liczbie obrotów
- metoda rozpraszania katodowego ( metoda Brediga)- polega na
wytworzeniu za pomocą prądu stałego, łuku elektrycznego
pomiędzy dwiema elektrodami metalowymi zanurzonymi w
wodzie, z których katod stanowi metal poddawany
rozdrobnieniu. Pary metalu wydzielające się w tych warunkach
są gwałtownie chłodzone i zestalają się w wodzie tworząc cząstki
koloidalne.
- zastosowanie fal ultradzwiękowych
- niektóre cząstki (żelatyna, białka) w zetknięciu z woda
samorzutnie mogą tworzyć roztwory koloidalne

• Metody kondensacyjne z polegają na wydzieleniu
trudno rozpuszczalnej substancji z silnie
rozcieńczonych roztworów w trakcie różnego
rodzaju reakcji chemicznych:
- utlenianie
- redukcji
- hydrolizy
- wymiany podwójnej
• Oczyszczanie roztworów koloidalnych:
- dializa – zanieczyszczenia roztworu koloidalnego
dyfundują stopniowo przez błonę, która jest
nieprzepuszczalna dla cząstek koloidalnych, na
zewnątrz i zostają uniesione przez prąd wody.
Wewnątrz dializatora pozostaje roztwór koloidalny
pozbawiony elektrolitów.

• Koagulacja – strącanie z roztworu
cząstek koloidalnych
• Peptyzacja – zjawisko
przechodzenia skoagulowanego
osadu z powrotem do roztworu
koloidalnego.

Koloidy liofobowe (hydrofobowe)
• Koloidy liofobowe – swoją trwałość zawdzięczają
elektrostatycznemu odpychaniu się cząstek,
które zyskują jednoimienny ładunek elektryczny
w skutek selektywnej adsorpcji jednego z jonów
zawartych w roztworze. Jeżeli fazą rozpraszającą
jest woda to mówimy o koloidach hydrofobowych.
• Zole wodorotlenków metali: Fe(OH)
3
, Cd(OH)
2
,
Al.(OH)
3
, Cr(OH)
3
, i zole tlenków metali: TiO
2
,
ZrO
2
– ładują się dodatnio
• Zole metali: Ag, Au, Pt oraz zole siarczków As
2
S
3
,
Sb
2
S
3
- ładują się ujemnie

• Aby doprowadzić do koagulacji koloidu
hydrofobowego należy zobojętnić ładunek
elektryczny nagromadzony na powierzchni
cząstek. Można to osiągnąć poprzez dodanie do
roztworu elektrolitu zawierającego dobrze
adsorbujące się jony przeciwnego znaku.
Koagulacja rozpoczyna się w chwili gdy zostanie
osiągnięte całkowite zobojętnienie elektryczne
cząstek czyli punkt izoelektryczny. Proces ten
często nazywa się wysalaniem
• Peptyzacja polega na usunięciu z osadu
zaadsorbowanych jonów koagulujących. Cząstki
odzyskują swój pierwotny ładunek i ponownie
zaczynają się odpychać.

Koloidy liofilowe (hydrofilowe)
• Koloidy liofilowe – zawdzięczają swoja trwałość zdolności
cząstek do tworzenia na swojej powierzchni
wielowarstwowej otoczki złożonej z cząsteczek
rozpuszczalnika (wody – koloidy hydrofilowe). Otoczka
hydratacyjna chroni cząstki koloidalne od bezpośredniego
zetknięcia się i w ten sposób uniemożliwia ich koagulację.
• Są to roztwory koloidalne substancji wielkocząsteczkowych:
białka, skrobi, dekstryn, barwników.
• Cząstki niektórych białek wykazują pewien ładunek
elektryczny, dzięki któremu dodatkowo zwiększa się
trwałość zolu. Ładunek ten nie powstaje na skutek adsorpcji
jonów przez cząstki koloidalne, ale jest wynikiem dysocjacji
grup kwasowych lub zasadowych wchodzących w skład
białka
OH
NH
R
O
H
NH
R
O
H
COO
R
O
H
COOH
R
3
2
2
3
2

• Koloidy hydrofilowe różnią się od
koloidów hydrofobowych zachowaniem
wobec dodatków elektrolitów. Ulegają one
koagulacji dopiero pod wpływem dużej
ilości soli.
• Koloidy hydrofilowe odznaczają się
większą trwałością niż hydrofobowe, a ich
dodatek do zolów hydrofobowych może
znacznie zwiększyć trwałość tych
ostatnich ( koloidy ochronne)

Budowa cząstki koloidalnej
-
miceli
• Jądro cząstki koloidalnej, wokół
niej powłoka jonów jednego
znaku – warstwa adsorpcyjna
• Według reguły Fajansa
cząsteczki ciał stałych
adsorbują jony wspólne z jonami
wchodzącymi w skład ciała
wytrąconego z roztworu.
• Sole złożone z cząsteczek
Fe(OH)
3
wykazują selektywną
adsorpcję jonów Fe
3+
. Mogą
również tej selektywnej
adsorpcji ulec jony
izostrukturalne (podobnej
budowie i wielkości)
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
Wyszukiwarka
Podobne podstrony:
A Charakterystyka hodow bud etu 2006 pop, Finanse Publiczne, Wykład III
A Etapy historii bud etu, Finanse Publiczne, Wykład III
B POJECIE BUD ETU I SKARBU PANSTWA, Finanse Publiczne, Wykład III
TBL WYKŁAD III Freud
wykład III Ubezpieczenia na życie2011
wykład III pns psychopatologia
WYKLAD III diagnoza psychologiczna
MAKROEKONOMIA WYKŁAD III
Zarzadzanie strategiczne w organizacjach publicznych wyklad III listopad 2010
FARMAKOLOGIA WYKŁAD III RAT MED ST
FPP wykład III
BHP - wykład III - biomechanika, materiauy
Wyklad 8, III rok, Diagnostyka laboratoryjna, Wykłady diagnostyka
wyklad III- uklad wydalniczy, Biologia, zoologia
więcej podobnych podstron