
Reakcje estryfikacji i
estry
-Estry kwasów karboksylowych ,
-Mechanizm reakcji estryfikacji,
-Właściwości fizyczne estrów,
-Właściwości chemiczne estrów
-Woski
-Estry nieorganiczne
Estry – budowa
• Estry - produkty reakcji kwasów z
alkoholami,
w cząsteczkach których atom
H
grupy
hydroksylowej
(-O
H
) alkoholu zastąpiony jest grupą
acylową
O
//
R - C -
lub grupą pochodzącą od
kwasu
nieorganicznego
np.: H
2
SO
4
:
–SO
3
– OH
;
H
2
CO
3
:
- CO – OH
;
HNO
3
:
- NO
2
• Estry organiczne można zdefiniować także
–
to produkty reakcji kwasów
karboksylowych
z alkoholami, w cząsteczkach których
wodór grupy karboksylowej ( - COO
H
) jest
zastąpiony grupą
alkilową
(
-R
) lub
arylową
(
-Ar
)
Estry organiczne
• Ogólny wzór estru organicznego
R
1
CO
OR
2
O
//
• R
1
- C –
O – R
2
gdzie
R
1
=
R
2
lub
R
1
≠
R
2
grupa acylowa
reszta z alkoholu
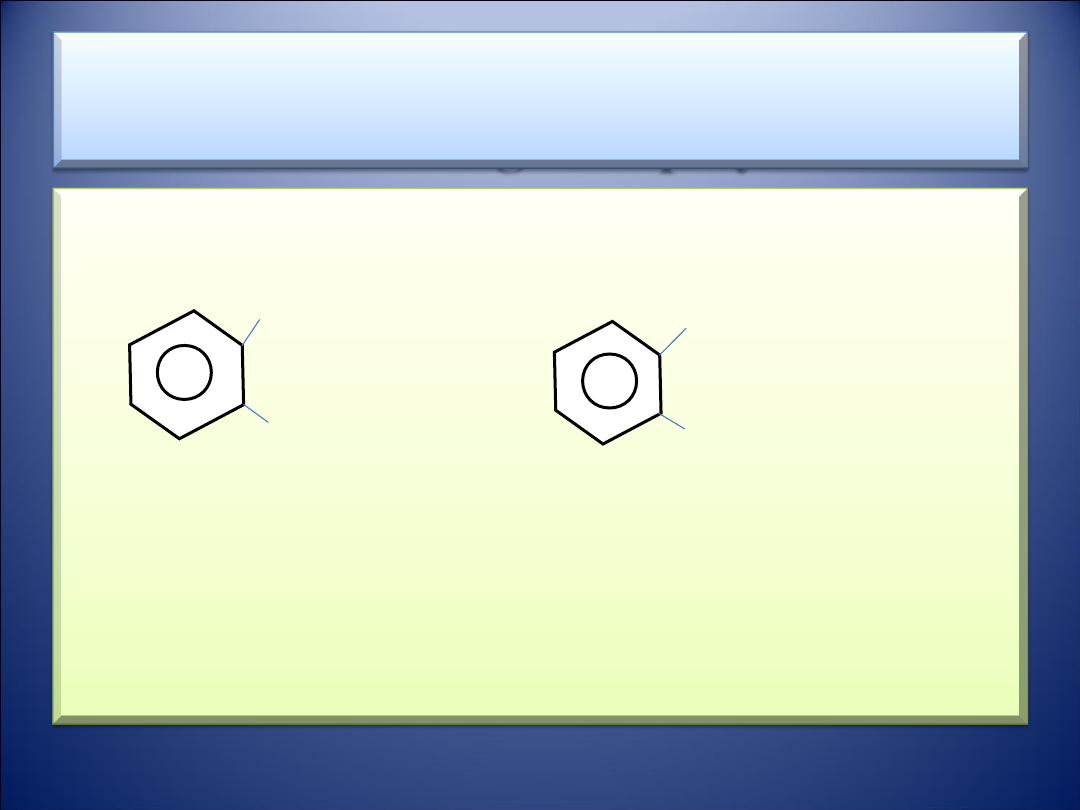
• Estrem organicznym jest również produkt reakcji między
fenolem
a kwasem karboksylowym
O
//
• R – C –
O – C
6
H
5
• Reakcji estryfikacji ulegają również hydroksykwasy
alifatyczne ( γ i δ-hydroksykwasy ulegają estryfikacji
wewnątrzcząsteczkowej, powstają laktony) oraz
aromatyczne (aspiryna jest estrem hydroksykwasu - kwasu
salicylowego i kwasu octowego)
Przykłady estrów
organicznych
• Metanian (mrówczan)
etylu
– zapach rumu
O
//
H – C
–
O – CH
2
– CH
3
• Etanian (octan)
n-propylu -
zapach gruszek
O
//
CH
3
– C
–
O – CH
2
– CH
2
– CH
3
• Etanian (octan)
fenylu
– zapach jaśminu
O
//
CH
3
– C
–
O – C
6
H
5
• Butanian (maślan)
etylu
– zapach ananasów
O
//
CH
3
– CH
2
–CH
2
– C
–
O – CH
2
– CH
3

Laktony – produkty
estryfikacji
wewnątrzcząsteczkowej
O
//
H
2
C -
C
• H
O
-
γ
CH
2
–
β
CH
2
–
α
CH
2
–
CO
OH
|
O
+
H
2
O
H
2
C - H
2
C
• kwas
γ
-hydroksybutanowy
γ
-butyrolakton
O
//
H
2
C -
C
/
• H
O
-
δ
CH
2
-
γ
CH
2
–
β
CH
2
–
α
CH
2
–
CO
OH
H
2
C
O
+
H
2
O
\
H
2
C - H
2
C
• kwas
δ-
hydroksypentanowy
δ-
pentyrolakton
Ester kwasu salicylowego
i etanowego - aspiryna
O
//
O
H
+
HO
OC-CH
3
O
-
C
- CH
3
+
H
2
O
COOH
COOH
• kwas
salicylowy
+ kwas
etanowy
kwas
acetylo
salicylowy
(aspiryna)
(
octowy
)
• Reakcja przebiega z udziałem bezwodnika kwasu etanowego
(octowego ) : (CH
3
–CO)
2
O, produktem ubocznym nie jest
woda lecz kwas etanowy (octowy)
• Aspiryna jest powszechnie stosowana jako lecz
przeciwgorączkowy i przeciwbólowy.
Reakcje estryfikacji
• Reakcja estryfikacji
– reakcja
kwasu
z
alkoholem
lub
fenolem
, której produktem
jest ester
• Reakcje przebiegają w obecności
kationów
wodorowych
–
protonów
(dodatek niewielkiej
ilości stężonego H
2
SO
4
),
które pełnią funkcję
katalizatora reakcji
O O
//
H
+
//
• CH
3
– C – OH
+
H
O – CH
3
↔
CH
3
– C
– O –
CH
3
+
H
2
O
• kwas
etanowy
+
etanol
etanian
(octan)
etylu
(octowy)
Reakcje estryfikacji cd
• Reakcje estryfikacji z alkoholami I-rzędowymi
przebiegają znacznie łatwiej niż alkoholami II
i III-rzędowymi, chociaż wykazują większą
zdolność tworzenia karbokationu.
• Reakcja przebiega z
udziałem karbokationu
–
nietrwały związek ,
który jest czynnikiem
elektrofilowym
, który może
reagować z wolną
parą elektronową atomu tlenu w grupie
hydroksylowej alkoholu
(szczegółowe
wyjaśnienie mechanizmu reakcji – patrz
repetytorium: chemia organiczna – Reakcje z
udziałem karbokationu).
• Reakcja estryfikacji jest reakcją odwracalną,
aby przesunąć stan równowagi w kierunku
produktów należy usunąć wodę
[wiąże ją
stężony kwas siarkowy(VI)],
lub należy
oddestylować ester, który ma niższą temp.
wrzenia niż kwas
i alkohol.
Hydroliza estrów
• Hydroliza w środowisku kwasowym
(odwracalna –
ustala się stan równowagi z przesunięciem w
kierunku produktów):
ester
kwas karboksylowy
+
alkohol
(zanik zapach estru, wyczuwalny zapach kwasu
karboksylowego)
H
+
• CH
3
– CO
–
O – CH
2
- CH
3
+ H
2
O ↔
CH
3
-COOH
+
CH
3
-
CH
2
– OH
•
etanian
(octan)
etylu
kwas etanowy
+
etanol
• Hydroliza w środowisku zasadowym
(nieodwracalna):
• ester
sól kwasu karboksylowego
+
alkohol
• (zanik zapachu estru, wyczuwalny zapach alkoholu)
• CH
3
– CO
–
O – CH
2
- CH
3
+
NaOH
CH
3
-COO
Na
+
CH
3
- CH
2
– OH
• etanian
(octan)
etylu
etanian
sodu
+
etanol
• W środowisku obojętnym (po ogrzaniu z wodą) nie
dostrzega się istotnych zamian w zapachu , chociaż
hydroliza również zachodzi, ustala się stan
równowagi między substratami i produktami
hydrolizy.

Pozostałe właściwości
chemiczne estrów
• Substytucja nukleofilowa
przy
karbonylowym atomie węgla.
• Redukcja wodorem
powstają
odpowiednie alkohole
• Alkoholiza (transestryfikacja)
–
przekształcenie jednego estru w inny w
reakcji z odpowiednim alkoholem, rakcja
zachodzi w środowisku kwasowym lub
zasadowym i polega na wymianie grupy
np.:
- O – CH
2
– CH
3
na
– O – CH
2
– CH
2
–CH
2
– CH
3
:
• CH
3
– CO
–
O – CH
2
– CH
3
+
OH – CH
2
– CH
2
–CH
2
– CH
3
↔
•
etanian
(octan)
etylu
butan-1-ol
CH
3
– CO
–
O – CH
2
– CH
2
– CH
2
– CH
3
+
CH
3
– CH
2
–
OH
• etanian
(octan)
butylu
etanol

Właściwości fizyczne estrów
organicznych
• Niższe estry
są lotnymi cieczami o gęstości
mniejszej
od gęstości wody i niższych temp. wrzenia
niż alkohole
i kwasy karboksylowe (
miedzy
cząsteczkami estrów nie powstają wiązania
wodorowe
), ale
niższe estry mogą tworzyć
wiązania wodorowe z cząsteczkami wody
,
stąd
ich rozpuszczalność w wodzie
, dobrze
rozpuszczają się
w rozpuszczalnikach organicznych, są
dobrymi rozpuszczalnikami zw.
organicznych, farb i lakierów, np. octan
etylu stosowany jest jako zmywacz do
paznokci.
•
W miarę wzrostu liczby atomów C
w
cząsteczce estru ich gęstość wzrasta –
przechodzą w oleiste ciecze i ciała stałe,
ich lotność maleje, wzrastają temp.
wrzenia, są trudno rozpuszczalne w
wodzie, dobrze rozpuszczają się w
rozpuszczalnikach organicznych
Właściwości fizyczne estrów
organicznych cd
• Większość estrów ma przyjemny
zapach (kwiatów, owoców) wyczuwalny
w małych stężeniach, stąd ich
zastosowanie w przemyśle
kosmetycznym
i perfumeryjnym, w przemyśle
cukierniczym
i napojów chłodzących jako dodatki
zapachowe.
• Jako rozpuszczalniki zw. organicznych
stosowane
są do produkcji farb, lakierów, są
dobrymi rozpuszczalnikami wosków,
tłuszczów (mrówczan etylu jest
rozpuszczalnikiem azotanu i octanu
celulozy, natomiast octan etylu jako
rozpuszczalnik estrów celulozy) .
Woski
• Estry wyższych kwasów karboksylowych
(np. kwas palmitynowy – C
15
H
31
COOH) i
wyższych
monohydroksylowych alkoholi
(np. mirycylowy – C
31
H
63
OH) - palmitynian
mirycylowy jest głównym składnikiem
wosku pszczelego.
• Woski przypominają tłuszcze, ich
właściwości są też podobne, ich gęstość
jest mniejsza od gęstości wody, mają niską
lepkość i niskie temp. topnienia, stopione
w odróżnieniu od tłuszczów mają
przyjemny zapach,
są odporne na działanie czynników
chemicznych.
• Stosowane są do produkcji świec
zapachowych, past,
w przemyśle farbiarskim,
farmaceutycznym, skórzanym,
kosmetycznym, spożywczym,
zbrojeniowym.

Estry nieorganiczne
• Estry kwasu siarkowego(VI)
• CH
3
– OH
+
HO-SO
2
-OH
CH
3
– O
–
SO
2
– OH
+
H
2
O
wodorosiarczan(VI)
metylu
,
• CH
3
– CH
2
– OH
+
HO – SO
2
– OH
CH
3
–CH
2
– O
–
SO
2
– OH
+
H
2
O
wodorosiarczan(VI)
etylu
• W reakcji rozpuszczonego SO
3
w H
2
SO
4
(H
2
S
2
O
7
) i
w
nadmiarze alkoholu
powstają estry
dwupodstawnikowe
• 2
CH
3
– CH
2
- OH
+
SO
3
CH
3
- CH
2
– O
– SO
2
–
O – CH
2
– CH
3
+
H
2
O
siarczan(VI)
di
etylu
• W/w estry są związkami silnie trującymi.
• Dwupodstawnikowe estry kwasu węglowego
są
związkami
o zapachu owoców, otrzymuje się je w reakcji
fosgenu i
alkoholanów: O=CCl
2
+ 2NaO-CH
3
(CH
3
-
O)
2
C=O + 2NaCl

Estry nieorganiczne cd
• Estry kwasu azotowego(V)
– triazotan(V)
glicerolu (nitrogliceryna)
H
2
C – O
H
H
2
C – O
– NO
2
| |
HC – O
H
+ 3
HO
– NO
2
HC – O
–
NO
2
+
3
H
2
O
| |
• H
2
C – O
H
H
2
C – O
– NO
2
• propano
-1,2,3-tri
ol
triazotan(V)
propano
tri
olu
• Żółtawa, lepka ciecz, wybuchająca pod wpływem
wstrząsu, nasączona ziemia okrzemkowa w/w
związkiem jest dynamitem - (A. Nobel), 1%
roztwór stosowany jest w medycynie jako lek
nasercowy i układu krążenia.
• Azotan(III) pentylu (amylu)
jest lekiem
rozkurczowym,
wodoroortofosforan(V) dimetylu
jest składnikiem pestycydów,
estrami kwasu
ortofosforowego(V) są kwasy nukleinowe
.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
Wyszukiwarka
Podobne podstrony:
kwasy i pochodne Synteza?nzoesanu?nylu reakcja estryfikacji
REAKCJA ESTRYFIKACJI ćwiczenie laboratoryjne otrzymywanie kwasu?etylosalicylowego
Estry produkty reakcji kwasów z alkoholami
więcej podobnych podstron