
Chemia
Dr inż. Jerzy Gęga
Wydział Inżynierii Procesowej,
Materiałowej i Fizyki Stosowanej
Katedra Chemii, pok. 232
E-mail: gega@wip.pcz.pl

Chemia
1. Pojęcia wstępne
–
budowa atomu, izotopy,
rozmieszczenie elektronów, powłoki walencyjne,
liczba atomowa, l. masowa, masa atomowa, mol
2. Układ okresowy pierwiastków
– odkrycie
Mendelejewa, miejsce w układzie a struktura
elektronowa,
formy
układu,
nazewnictwo
pierwiastków, grupy (nazwy) i okresy w układzie
3. Układ okresowy pierwiastków
- położenie w
układzie a właściwości chemiczne i fizyczne
pierwiastków, okresowość właściwości.
4. Związki chemiczne
- najważniejsze typy wiązań:
atomowe,
kowalencyjne,
jonowe,
wodorowe.
Własności
wynikające
z
występowania
poszczególnych rodzajów wiązań

5. Stany skupienia materii
– gazowy, ciekły, stały.
Układy koloidalne, stan szklisty
6. Procesy
fizykochemiczne
–
rozpuszczanie,
krystalizacja,
adsorpcja,
substancje
powierzchniowo-czynne
7. Reakcje chemiczne
– procesy fizyczne i
chemiczne, zapis reakcji, rodzaje reakcji, prawo
zachowania masy, stechiometria
8. Szybkość reakcji
– definicja szybkości, wpływ
czynników zewnętrznych na szybkość, równanie
Arheniusa, energia aktywacja, kataliza, katalizatory
9. Stan równowagi w reakcji chemicznej
- prawo
działania mas, reguła przekory
10.Elektrochemia
– szereg napięciowy metali,
korozja materiałów budowlanych

11.Charakterystyka wybranych pierwiastków
–
niemetale: krzem (krzemiany), węgiel (węglany),
siarka (siarczany), tlen; metale: potasowce,
wapniowce, żelazo, miedź, cynk, glin (gliniany).
12.Chemia budowlanych materiałów wiążących
–
produkcja i właściwości cementu oraz ich
modyfikacja.
13.Chemia budowlanych materiałów wiążących
–
właściwości innych spoiw mineralnych.
14.Materiały ceramiczne.
Korozja materiałów
cementowych i ceramicznych.
15.Najważniejsze
tworzywa
sztuczne
–
właściwości i zastosowanie w budownictwie.
16.Materiały bitumiczne
i ich właściwości.
17.Ekologia w budownictwie

Literatura
H.Bala, Chemia materiałów, Wyd. WIPMiFS, Częstochowa
2001
H.Bala, Podstawy chemii materiałów, WNT, Warszawa 2003
M.J.Sienko, R.A.Plane, Chemia. Podstawy i zastosowania,
WNT, Warszawa 1999
A.Bielański, Chemia ogólna i nieorganiczna, PWN, Warszawa
2010
J.D.Lee, Zwięzła chemia nieorganiczna, PWN, Warszawa 1997
L.Czarnecki, T.Broniewski, O.Henning, Chemia w
budownictwie, Wyd. „Arkady”, Warszawa 2001
J.Liwski, Chemia budowlana, PWN, Warszawa 1975
Kolokwium zaliczeniowe z wykładu
Kolokwium zaliczeniowe z ćwiczeń audytoryjnych
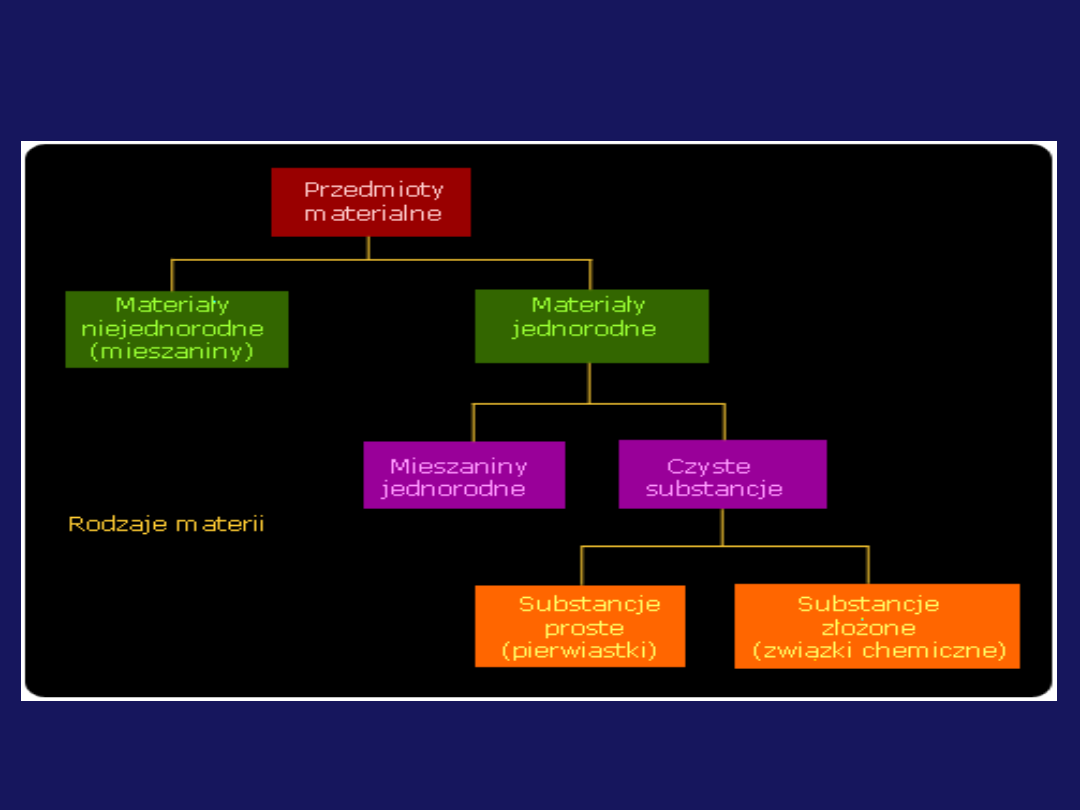
Rodzaje materii

Substancje chemiczne i ich właściwości
Substancje proste
(
pierwiastki
, tzn. substancje
proste składające się z takich samych atomów)
Substancje złożone
(
związki chemiczne
, składające
się z dwóch lub więcej różnych pierwiastków)
Każda substancja chemiczna charakteryzuje się ściśle
określonymi
i
w
danych
warunkach
stałymi
właściwościami fizycznymi i chemicznymi.
Właściwości fizyczne
: stan skupienia, barwa, gęstość,
przewodnictwo
cieplne
i
elektryczne,
rozpuszczalność, temperatura topnienia i wrzenia i
inne charakterystyczne tylko dla gazów, cieczy lub
ciał stałych.
Właściwości chemiczne
substancji: ujawniają się w
reakcjach chemicznych z jej udziałem
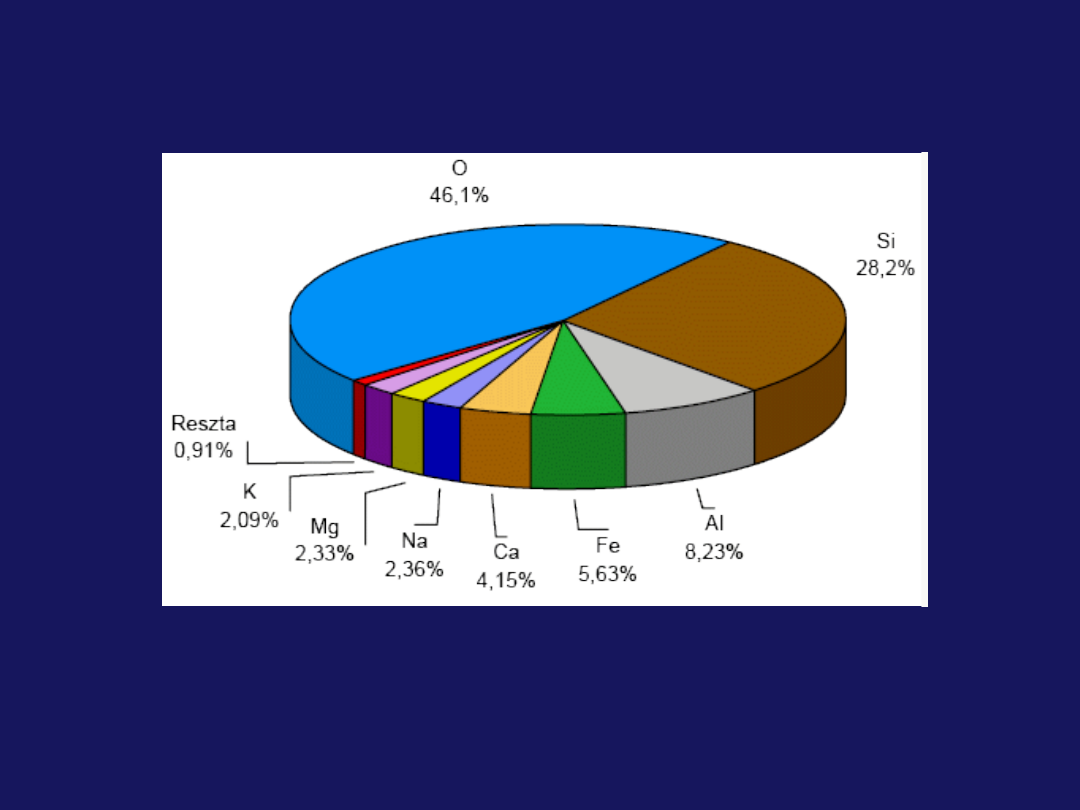
Zawartość procentowa pierwiastków
w skorupie ziemskiej
Spośród ponad 100 znanych pierwiastków 82 występują w
przyrodzie. Wszystkie najczęściej występujące pierwiastki są
wykorzystywane w budownictwie (ogółem w budownictwie jest
wykorzystywanych ok. 30 pierwiastków, w tym połowę stanowią
metale).
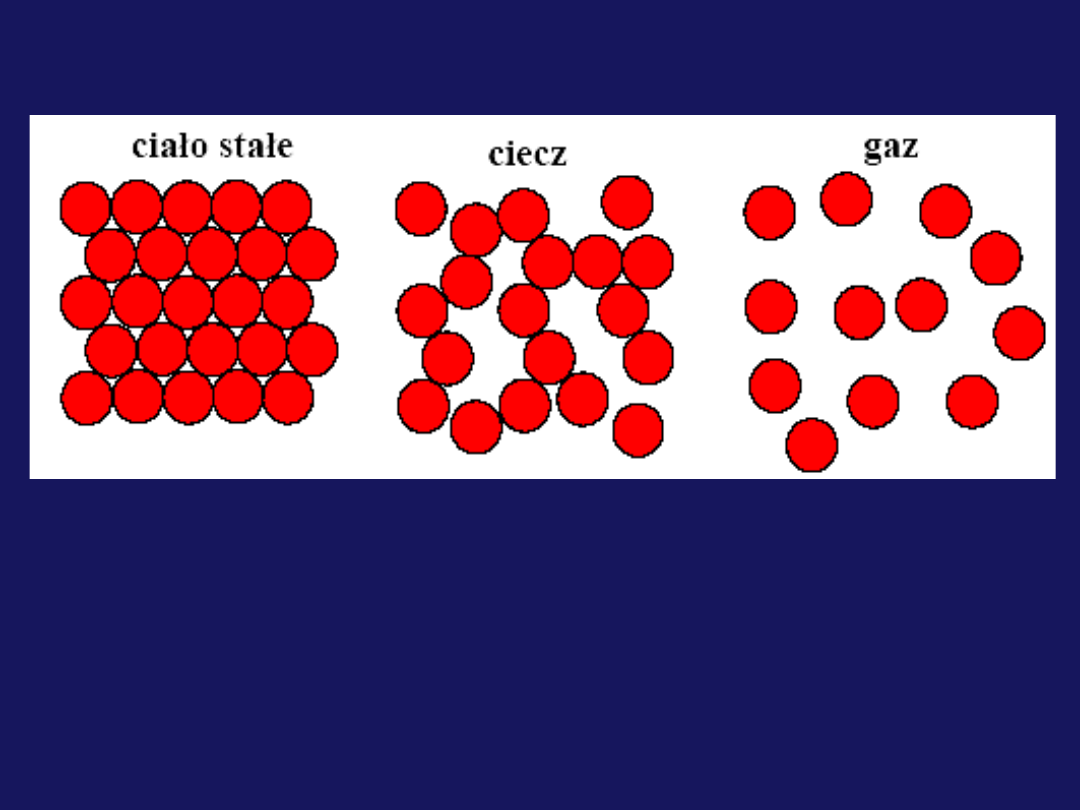
Trzy stany skupienia materii
Czym różnią się między sobą stany skupienia:
Uporządkowaniem, odległościami między cząsteczkami
Ruchem cząsteczek
Rodzajem i siłą oddziaływań między cząsteczkami i
energii wewnętrznej
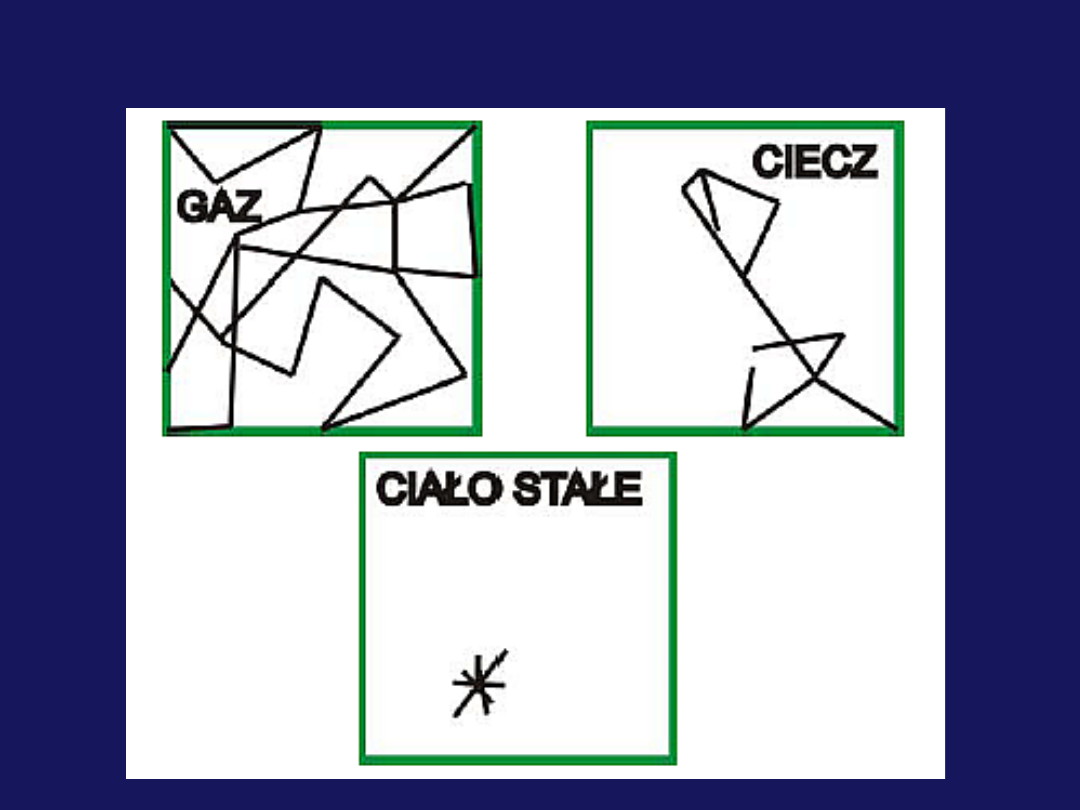
Ruch
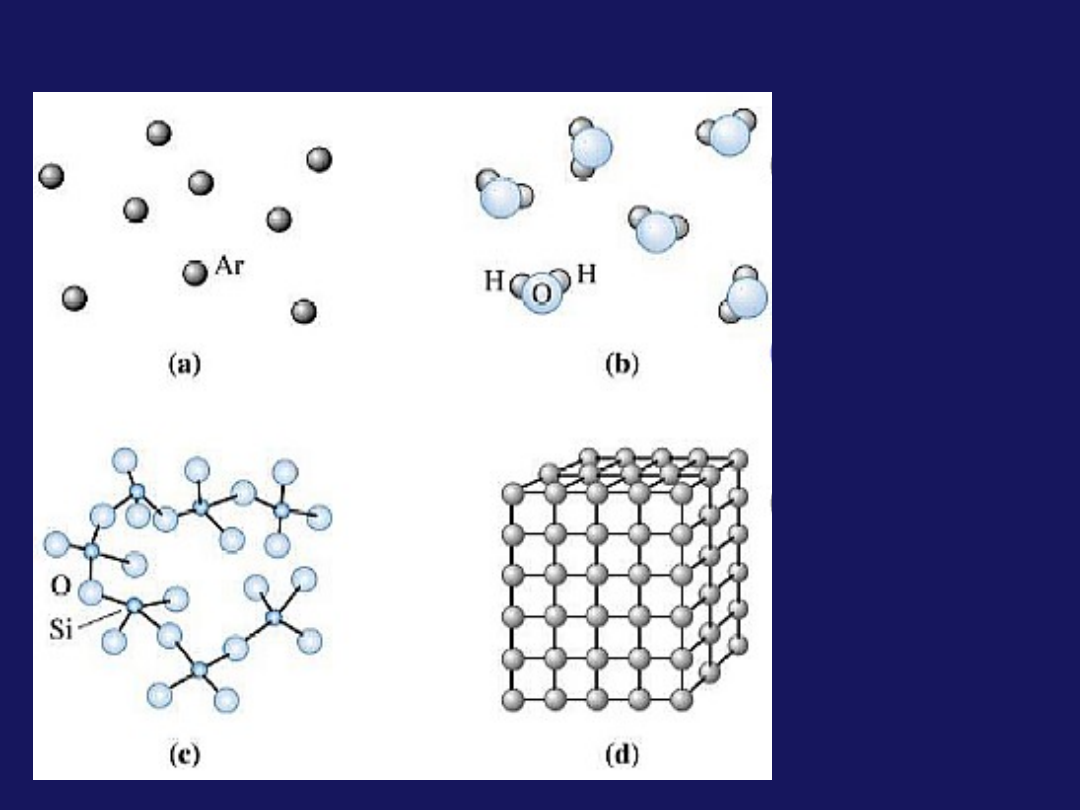
Uporządkowanie
a) Molekuły w
gazach nie są
uporządkowane
b) W cieczach
istnieje pewne
uporządkowanie (w
bliskim otoczeniu)
d) Krystaliczne
ciała stałe
charakteryzują się
największym
stopniem
uporządkowania
c) Istnieją też
niekrystaliczne
(
amorficzne
)
ciała stałe, w
których istnieje
tylko
uporządkowanie
bliskiego zasięgu
Siły i energia wewnętrzna
Siły przyciągania miedzy
cząsteczkami są
największe w ciałach
stałych, mniejsze w
cieczach i najmniejsze w
gazach
Energia wewnętrzna
ciała stałego jest
najmniejsza. W
szczególności
krystaliczne ciała stałe
mają najmniejszą energię
wewnętrzną

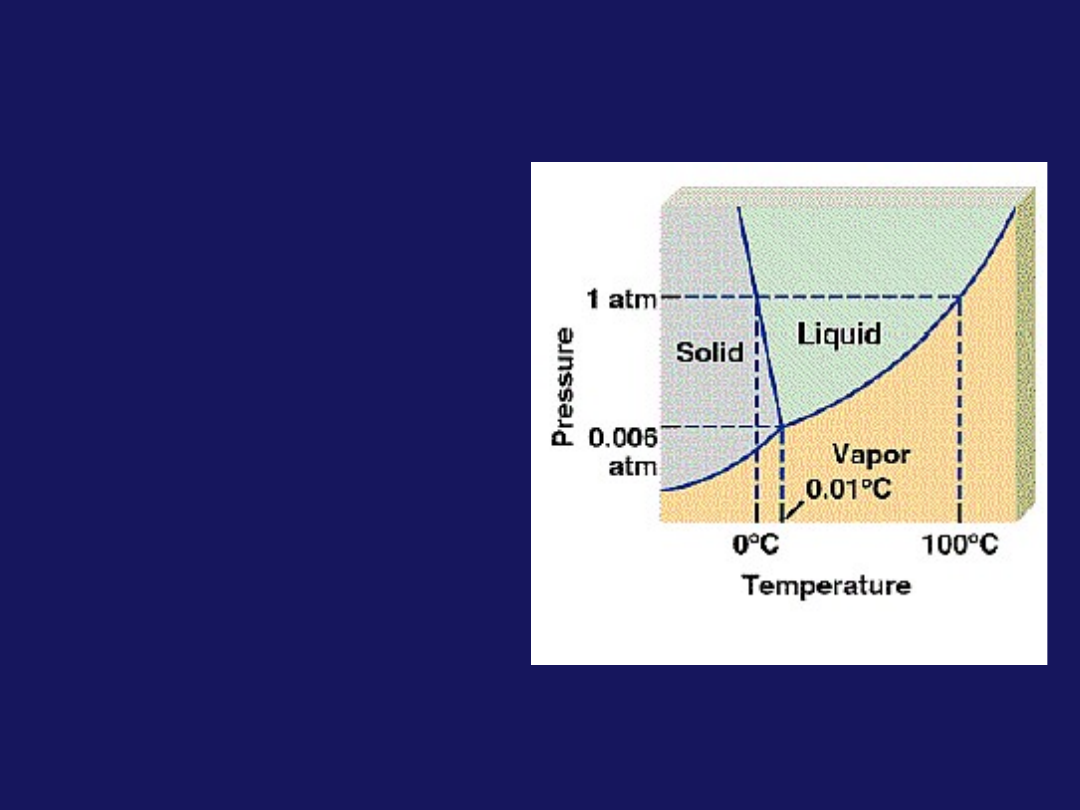
Substancja chemiczna w danych warunkach
temperaturowych występuje w określonym stanie
skupienia
Ciało stałe
Ciecz
Gaz
Drobiny są ściśle
upakowane, nie
przemieszczają się
względem siebie,
tworzą tzw. sieć
krystaliczną, w
której są
rozmieszczone w
sposób
uporządkowany
Drobiny drgają
Ma określony
kształt i objętość
Drobiny
nie
zajmują
ściśle
określonych
pozycji
Drobiny stykają się
ze sobą mając
zdolność
przemieszczania
się
Ma
określoną
objętość
Przyjmuje
kształt
naczynia, w którym
się znajduje
Brak określonego
kształtu i
objętości
Drobiny są od
siebie oddalone, a
ich wzajemne
oddziaływanie
jest bardzo słabe
Drobiny znajdują
się w ciągłym
chaotycznym
ruchu
Można go sprężać
i rozprężać

Substancje i ich mieszaniny mogą ulegać zarówno
przemianom fizycznym
jak i
przemianom chemicznym
.
W
wyniku
przemian
fizycznych
zmieniają
się
właściwości fizyczne materiału czy substancji (stan
skupienia, kształt, objętość, gęstość), ale nie zmienia
się ich skład np. ogrzewanie lodu, parowanie wody.
W
wyniku
przemiany
chemicznej
następuje
przekształcenie jednych drobin w inne czyli powstają
nowe
substancje
o
odmiennych
właściwościach
fizycznych i chemicznych, co wiąże się ze zmianą
składu.
Przemiana chemiczna określana jest jako reakcja
chemiczna.
Substancje chemiczne i ich przemiany
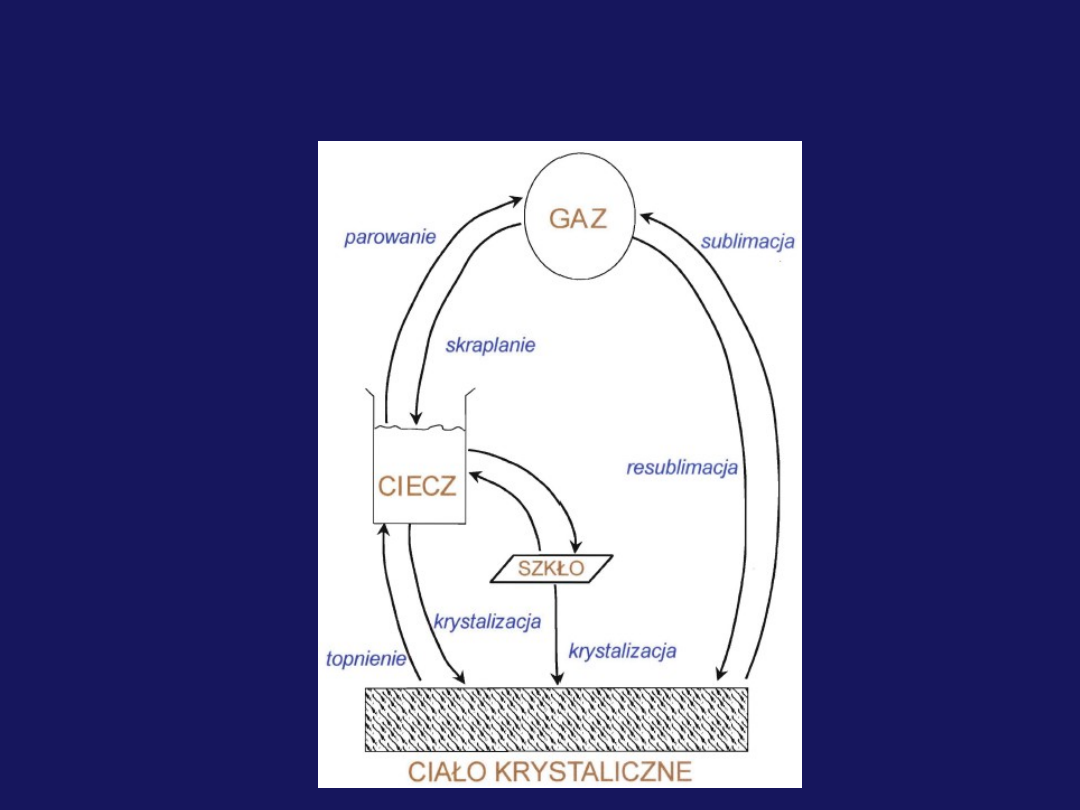
Przemiany fizyczne związane ze zmianą stanu
skupienia substancji

Budowa atomu

Wybrane modele budowy atomu (schemat ideowy)
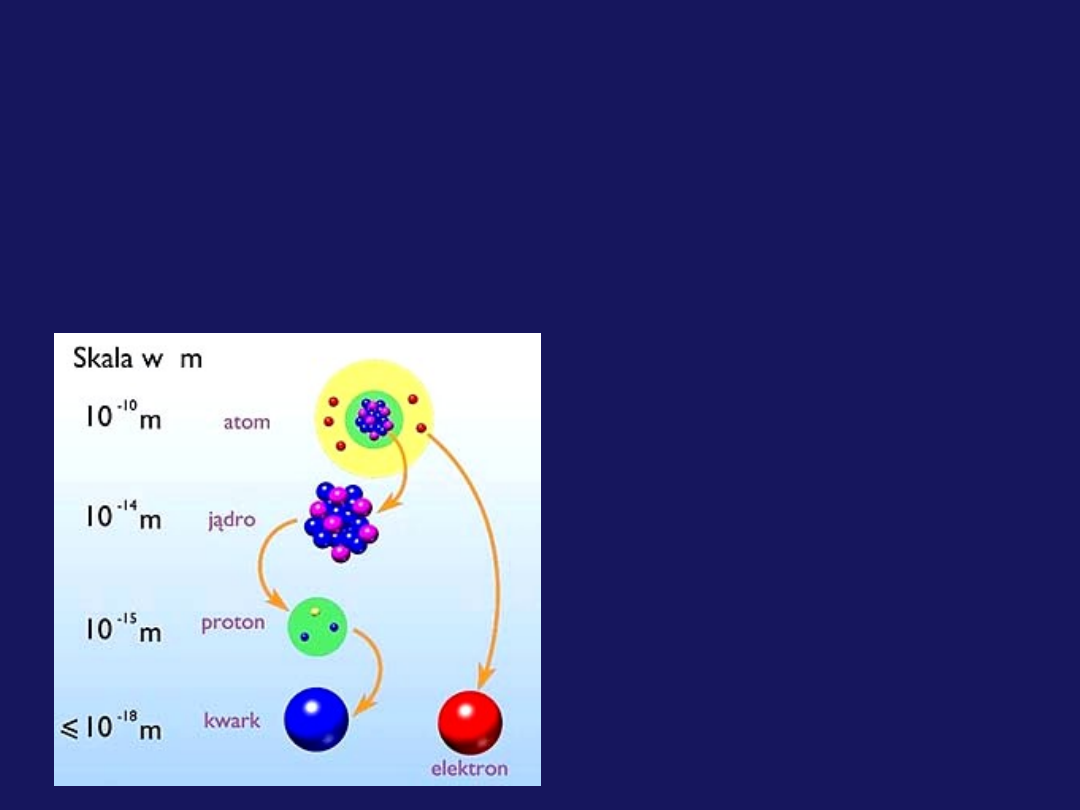
Budowa atomu
Najmniejszą częścią pierwiastka, zachowującą jego właściwości
chemiczne jest atom.
Współczesny stan wiedzy o budowie materii przyjmuje, że atom
zbudowany
jest
z
niezmiernie
małego
dodatnio
naładowanego jądra, oraz elektronów obdarzonych
ładunkiem
ujemnym,
poruszających
się
przestrzeni
otaczającej jądro.
Jądro zawiera dwa rodzaje
cząstek elementarnych:
dodatnio
naładowane
protony
i
elektrycznie
obojętne neutrony
Protony
i
neutrony
noszą wspólną nazwę
nukleonów

Ile atomów możemy rozmieścić wzdłuż
średnicy główki szpilki?
Główka szpilki ma średnicę około 1 x 10
-3
m (milimetr
długości)
Atom ma średnicę 2.5 x 10
-10
m, wtedy
(1 atom/2.5 x 10
-10
m) * (1 x 10
-3
m) = 4 x 10
6
atomów
Czyli cztery miliony atomów (4000000) można
rozmieścić wzdłuż średnicy główki szpilki!
Jeżeli ta sama główka szpilki będzie jądrem atomu, to
odpowiednio średnica atomu będzie miała wartość
10m (średnica jądra ma wymiar około 0,01% średnicy
atomu)

Lp
.
Nazwa
Symbol
Ładunek
Masa (g)
1.
Elektron
e
-
-1
9,109*10
-28
ok. 1800 razy mniejsza
od masy protonu
2.
Proton,
zbudowan
y z
kwarków
p
+1
1,673*10
-24
3.
Neutron,
zbudowan
y z
kwarków
n
0
1,675*10
-24
Właściwości cząstek elementarnych

Kwarki to obok leptonów (do których należy elektron)
cząstki elementarne budujące materię. Znanych jest sześć
rodzajów kwarków:
Górny (up, u)
Dolny (down, d)
Dziwny (strange, s)
Powabny (charm, c)
Piękny (beautiful ,b) lub denny (bottom, b)
Prawdziwy (truth, t) lub szczytowy (top, t)
Kwarki to cząstki obdarzone połówkowym spinem i
ułamkowym ładunkiem elektrycznym.
Kwarki: d,b,s -1/3; kwarki: u,c,t +2/3
Protony i neutrony zbudowane są z kwarków d (dolny-down) i
u (górny-up), które oddziałują ze sobą za pomocą
nienaładowanych cząstek zwanych gluonami.
Proton: 2u i 1d; neutron: 1u i 2d
Kwarki

Opis atomu pierwiastka
Pierwiastek chemiczny charakteryzowany jest przez jego
symbol X, liczbę atomową Z oraz liczbę masową A.
Symbole pierwiastków wywodzą się na ogół z nazw
łacińskich np.: hel - helium He, azot - nitrogenium N, tlen -
oxygenium O, sód – natrium Na, żelazo – ferrum Fe
Łączna liczba protonów i neutronów w jądrze (całkowita
liczba nukleonów w jądrze) nosi nazwę
liczby masowej (A).
Liczba atomowa (Z
)
określa liczbę protonów w jądrze
atomu. Ponieważ atom to układ elektrycznie obojętny,
liczba ta określa również liczbę elektronów.
X
A
masowa
liczba
Z
atomowa
liczba
Atomy różnych pierwiastków różnią się od siebie.
Zawierają różne ilości protonów w jądrze, a zatem
charakteryzowane są przez inną liczbą atomową

Mając podaną liczbę masową i liczbę atomową
możemy obliczyć liczbę neutronów jako
różnicę:
N = A - Z
Jądro atomu chloru zawiera 17 protonów i 35 -
17 = 18 neutronów.

Jądra atomów o takiej samej liczbie atomowej (Z) a różnej
liczbie masowej (A) to izotopy.
Wiele pierwiastków
występujących w przyrodzie posiada izotopy: wodór, węgiel,
azot, krzem, siarka, potas, wapń, ołów.
jądro atomu węgla
12
C - 6 protonów i 6 neutronów
jądro atomu węgla
14
C - 6 protonów i 8 neutronów (8=14-
6).
Te izotopy znane są jako
14
C "węgiel-14" i
12
C "węgiel-12".
Z ogólnej ilości izotopów węgla - węgla-12 jest najwięcej
(ok.99%).
Izotop

Promieniotwórczość naturalna
– samorzutny rozpad
jąder, połączony z emisją promieniowania.
Zjawisko to zostało odkryte przez Becquerela.
Energia wiązania
jądra – jest miarą trwałości jądra.
Im energia wiązania jest większa tym jądro jest
bardziej trwałe.
Defekt masy
– zjawisko polegające na tym, że
rzeczywista masa jądra jest mniejsza, niż wynika
to z obliczeń polegających na dodaniu do siebie
masy protonów i neutronów.
PROMIENIOTWÓRCZOŚĆ
PRZEMIANY JĄDROWE

Przemiany jądrowe:
naturalne – zachodzące samorzutnie
- przemiany cząstkowe (-, α )
- przemiany elektromagnetyczne (wychwyt K,
przemiana ).
sztuczne – wymuszone bombardowaniem jąder
atomowych neutronami, protonami albo cząstkami
α.

Przemiany jądrowe:
naturalne – zachodzące samorzutnie
- przemiany cząstkowe (-, α )
- przemiany elektromagnetyczne (wychwyt K,
przemiana ).
sztuczne – wymuszone bombardowaniem jąder
atomowych neutronami, protonami albo cząstkami
α.
lat
t
Th
U
4
2
/
1
4
2
234
90
238
92
10
5
,
4
dni
t
Pa
Th
5
,
24
2
/
1
0
1
234
91
234
90
n
Ba
Kr
n
U
1
0
141
56
92
36
1
0
235
92
2
p
O
N
1
1
17
8
4
2
14
7

Przemiana -
- emisja elektronu. Powoduje wzrost o 1 liczby
atomowej Z. Liczba masowa A bez zmian.
Przemiana +
- emisja pozytonu (dodatniego elektronu).
Powoduje zmniejszenie o 1 liczby atomowej Z. Liczba
masowa A bez zmian.
Przemiana α
– emisja cząstki α, czyli jądra pierwiastka helu
He. Wskutek tej przemiany maleje o 2 liczba Z oraz
maleje o 4 liczba masowa A.
Wychwyt K
– polega na pobraniu przez jądro 1 elektronu z
powłoki, która jest najbliżej jądra (K). Powoduje zmniejszenie
o 1 liczby atomowej Z. Liczba masowa A nie ulega zmianie.
Przemiana
- emisja nadmiaru energii w postaci promieniowania
elektromagnetycznego.
Reguła Fajansa i Soddy’ego:
Emisji cząstki α towarzyszy przesunięcie pierwiastka o 2
miejsca w lewo w układzie okresowym, emisji cząstki
+ towarzyszy przesunięcie o jedno miejsce w lewo, a
emisji cząstki - przesunięcie o jedno miejsce w prawo.
Okres półtrwania
(czas połowicznego zaniku,
T
1/2
) – czas, po którym polowa dowolnej próbki
izotopu ulega rozpadowi.

n
Ba
Kr
n
U
1
0
141
56
92
36
1
0
235
92
2
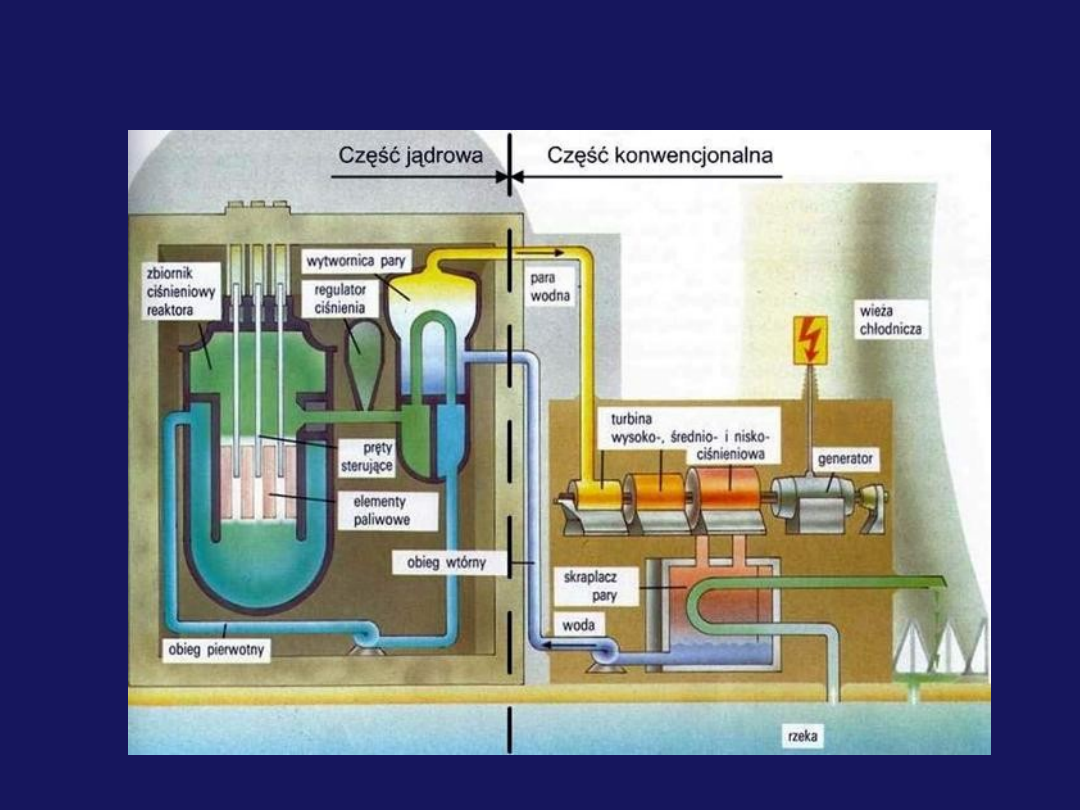
Elektrownia jądrowa
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
Wyszukiwarka
Podobne podstrony:
chemia bud 2 2012 02 28
2012 02 21 tematy Seminarium i projektów ETH
Prawo cywilne wyk.8 2012-02-21, Prawo Cywilne
2012 02 21 Ręce precz od Muchy
2012 02 21 VAT od porad prawnych
2012 02 21 Spór pod Cerro Torre
2012 02 21 Prowizorka z zerowym VAT
2012 02 21 Pracodawca nie w każdym momencie polepszy swoją pozycję
2012 02 21 Nauczyciele, uczniowie i miłosne uniesienia
2012 02 21 Niepełnosprawni Wejdę na Pałac Kultury i będę krzyczeć
BO I WYKLAD 01 3 2011 02 21
2012 02 27, ćwiczenie 1 0001
Angora 2010 02 21
2012 02 27, ćwiczenie 2
[W] Badania Operacyjne (2009 02 21) wykład
2012 02 27, ćwiczenie 2 0001
2011.02.21 - PZPN - Egzamin - I, Testy, testy sędziowskie
chemia analityczna wyklad 02
więcej podobnych podstron