
IZOLOWANIE ENZYMÓW
METODY POZWALAJĄCE NA OTRZYMANIE JEDNORODNYCH PREPARATÓW
BEZ UTRATY AKTYWNOŚCI KATALITYCZNEJ:
1. ROZDROBNIENIE TKANEK W HOMOGENIZATORZE
2. EKSTRAKCJA (WODĄ LUB ROZCIEŃCZONYMI ROZTWORAMI SOLI O
WARTOŚCIACH PH ODDALONYCH OD PUNKTU IZOELEKTRYCZNEGO
3. ODDZIELENIE ENZYMÓW MOCNO WBUDOWANYCH W ZIARNISTOŚCI
KOMÓREK LUB BŁONY KOMÓRKOWE (ZAMRAŻANIE I ODMRAŻANIE,
EKSTRAKCJA BUTANOLEM, EKSTRAKCJA
DETERGENTAMI)
4. FRAKCJONOWANIE (WYTRĄCANIE SIARCZANEM AMONU, ACETONEM,
ETANOLEM I ETEREM W NISKIEJ TEMPERATURZE)
5. KRYSTALIZACJA (DOSYCENIE R-REM SIARCZANU AMONU, DIALIZA WOBEC
WODY)
• IZOLACJA ZWYKLE W ZAKRESIE pH 5-9
• UNIKAĆ DENATURACJI CIEPLNEJ I MECHANICZNEJ
• UNIKAĆ INAKTYWACJI SOLAMI METALI CIĘŻKICH

OKREŚLANIE AKTYWNOŚCI
ENZYMATYCZNEJ
JEDNOSTKI AKTYWNOŚCI ENZYMÓW:
1 JEDNOSTKA (1 UNIT) – to taka ilość enzymu, która
w standardowych warunkach katalizuje powstawanie lub
rozpad 1mikromola substratu/produktu w ciągu 1 min
• 1 KATAL (1KAT)– to taka ilość enzymu, która w
standardowych warunkach przekształca 1 mol substratu
w ciągu 1s (jednostka zgodna z układem SI)
1 kat = 6∙10
7
U
1 U = 16,67∙10
-9
kat = 16,67 nkat
OZNACZANIE ENZYMÓW
• pomiar ilości enzymu w stanie czystym –
często trudne do osiągnięcia i
czasochłonne
• pomiar aktywności enzymu – na podstawie
szybkości katalizowanej reakcji
uzyskujemy informację o ilości enzymu (bo
szybkość ta jest proporcjonalna do ilości
enzymu)
• Jeżeli enzym otrzymano w stanie czystym
to można oznaczyć jego aktywność
właściwą w jednostkach na mg białka lub
molekularną w jednostkach na 1 mmol

STANDARYZACJA OZNACZANIE
ENZYMÓW
• stosowanie jednej jednostki aktywności reakcji
enzymatycznej - katali
• stosowanie szczegółowo opisanych metod
• aktywność enzymu musi być stała w czasie oznaczania
• mierzona aktywność enzymu musi być proporcjonalna
do rozcieńczenia próbki
• zakres roboczy metody musi odpowiadać zakresowi
wielkości aktywności enzymu mierzonej w
laboratorium
• reakcję enzymatyczną należy zawsze prowadzić
w standardowej dla danego enzymu temperaturze

ENZYMY-UKŁADY
POMIAROWE
Testy optyczne
1. Kolorymetryczne analogi naturalnych substratów
a. Fosfatazy ( p-nitrofenylofosforan, a-naftylofosforan
b. Amylaza (p-nitrofenylo-D-maltoheptozyd, 2-chloro-p-
nitrofenylo-aD-maltotriozyd
2. Substancje, z których pod wpływem enzymów powstają barwne
produkty reakcji (3,3’,5,5’-tetrametylobenzydyna (TMB))
Testy immunologiczne
(oparte o przeciwciała – metody immunoturbidymetryczne,
radioimmunologiczne, immunoenzymatyczne)
ENZYMY – WARTOŚĆ
DIAGNOSTYCZNA
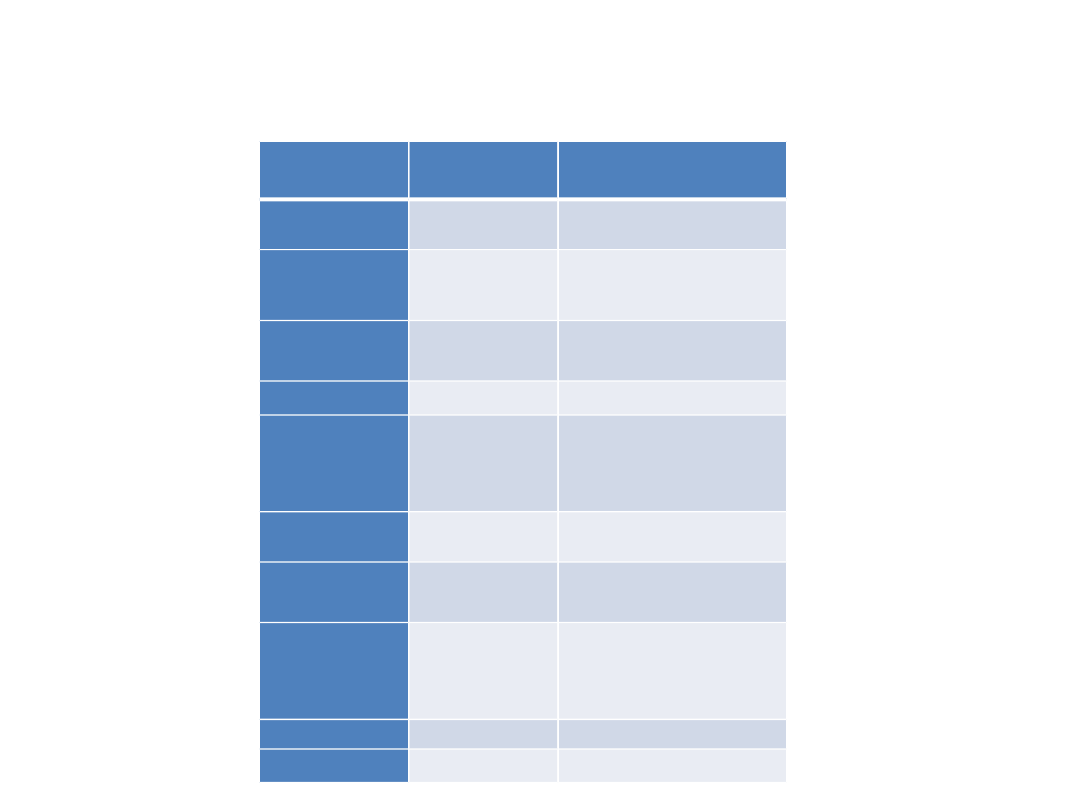
Enzym
Główne źródła
enzymu we krwi
Zastosowanie kliniczne
Aminotransferaz
a alaninowa
Wątroba
Chroroby miąższowe wątroby
Aminotransferaz
a
asparaginianowa
Wątroba, mięśnie
szkieletowe, serce,
erytocyty
Choroby miąższowe wątroby,
choroby mięśni
Fosfataza
alkaliczna
Wątroba, kości,
błona śluzowa jelit,
łożysko
Choroby kości, choroby dróg
żółciowych
Amylaza
Trzustka, ślinianki
Choroby trzustki
Cholinesteraza
Wątroba
Zatrucie związkami
fosforoorganicznymi,
nadwrażliwość na
suksametonium, choroby
miąższowe wątroby
Kinaza
kreatynowa
Mięśnie
szkieletowe, serce
Choroby mięśni (zawał serca)
g-
glutamylotransfe
raza
Wątroba
Choroby dróg żółciowych,
marker nadużycia alkoholu
Dehydrogenaza
mleczanowa
Serce, wątroba,
mięśnie
szkieletowe,
erytrocyty, płytki,
węzły chłonne
Hemoliza, choroby miąższu
wątrobowego, marker
nowotworowy
Lipaza
Trzustka
Choroby trzustki
5’-Nukleotydaza
Wątroba
Choroby dróg żółciowych

OZNACZANIE WYBRANYCH
ENZYMÓW
AMINOTRANSFERAZY
ALT: alaninowa (EC 2.6.1.2 Transferaza L-alanina:2-ketoglutaran)
AST: asparaginianowa (EC 2.6.1.1 Transferaza L-asparaginian:
ketoglutaran)
katalizują reakcję przeniesienia grupy aminowej
równowaga reakcji przesunięta w kierunku tworzenia
alaniny/asparaginianu
PLP (fosforan 5’-pirydoksalu) – koenzym
ALT – występuje w cytoplazmie
AST – występuje w cytoplazmie i mitochondrium (5-10%
aktywności AST w surowicy osób zdrowych)
Znaczenie kliniczne
aminotransferaz
Wzrost aktywności:
choroby wątroby:
- wirusowe zapalenie wątroby
- alkoholowe zapalenie wątroby
- toksyczne zapalenie wątroby
- marskość wątroby
- przerzuty do wątroby
- inne
zawał mięśnia sercowego
dystrofie mięśniowe
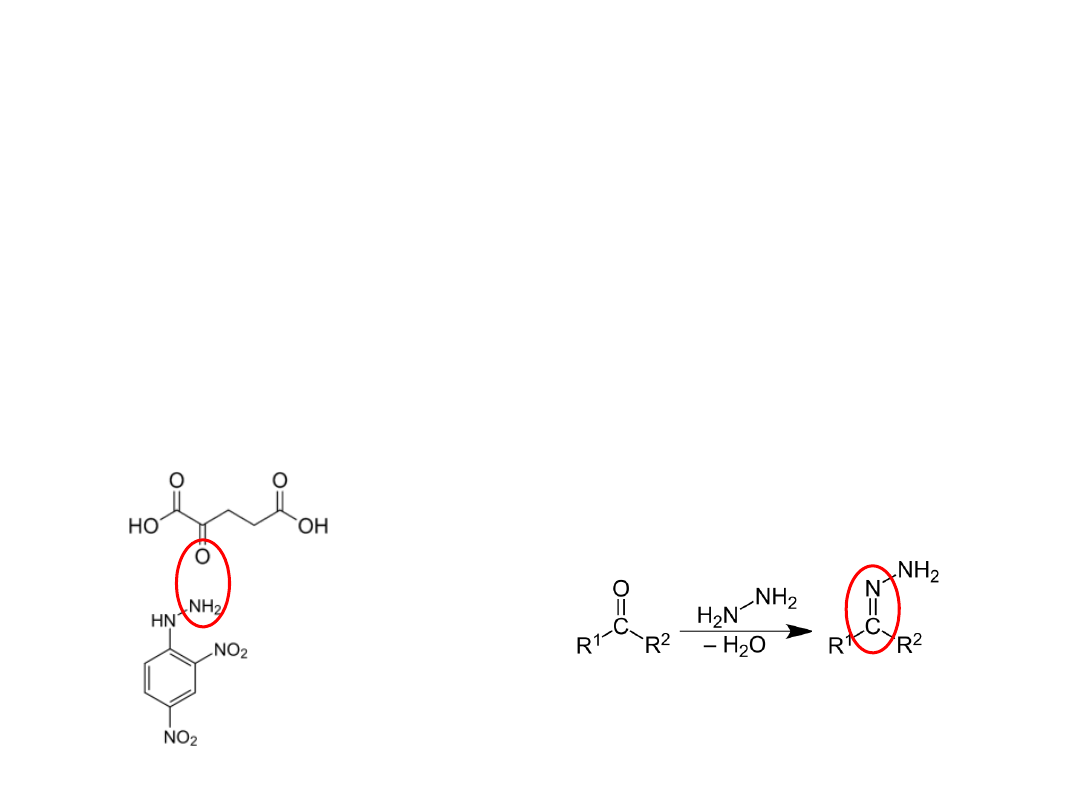
Metoda oznaczania aminotransferaz
Wg Reitmana i Frankela
Zasada metody:
Powstające w reakcji transaminacji ketokwasy przeprowadza się w
fenylohydrazony, które w środowisku alkalicznym wykazują
brunatnoczerwone zabarwienie
2,4-dinitrofenylohydrazyna
a-Ketoglutaran
GAMMA-GLUTAMYLOTRANSFERAZA (GGT)
EC 2.3.2.2 Glutamylotransferaza peptyd g-glutamylowy:aminokwas
•związana z błonami plazmatycznymi komórek
- mikrosomy
- w błonach komórkowych (transport aminokwasów lub peptydów w poprzek błony)
•enzym działa wyłącznie na peptydy lub związki peptydopodobne zawierające
końcową resztę g-glutamylową (przyłączoną do reszty związku za pośrednictwem węgla g)
Fizjologicznie katalizuje przeniesienie reszty
g-glutamylowej z glutationu lub innego
peptydu g-glutamylowego na akceptor, którym
może być aminokwas lub peptyd
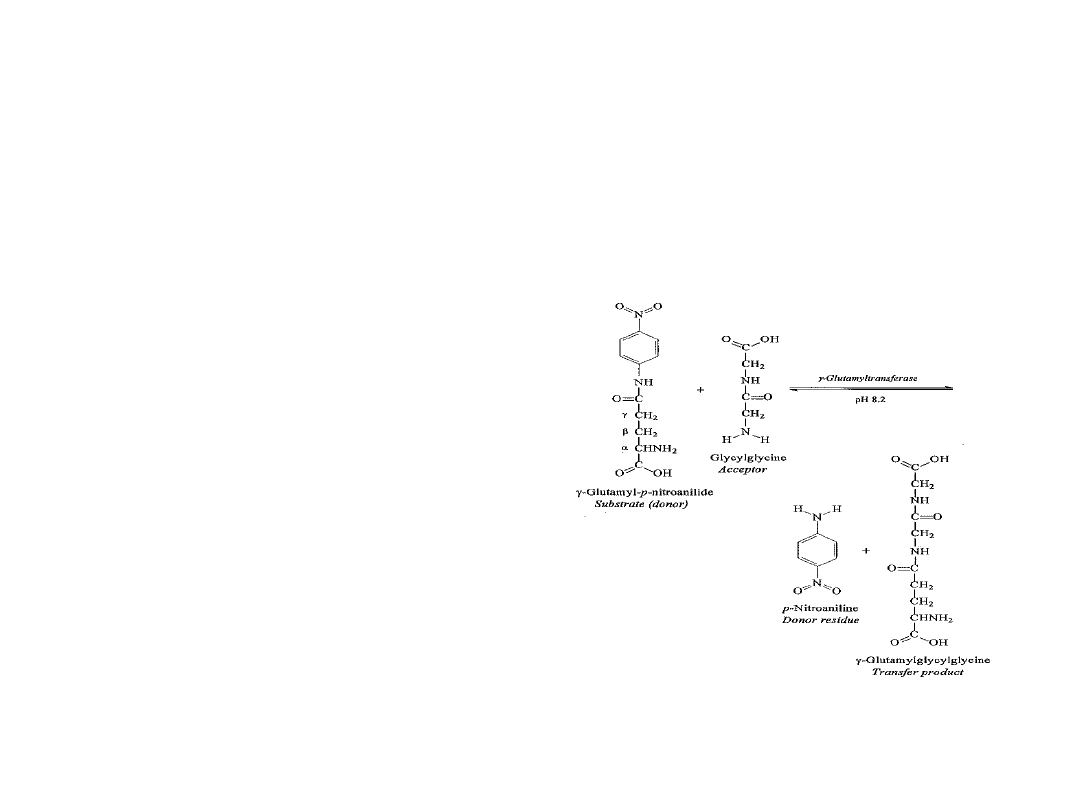
Zasada oznaczania GGT

Rozmieszczenie tkankowe GGT
nerki - kanaliki proksymalne
wątroba
trzustka
jelita
Znaczenie kliniczne GGT
Wzrost aktywności:
choroby związane z zastojem w drogach odprowadzających:
- choroby wątroby i dróg żółciowych
- choroby trzustki
indukcja lekami
- barbiturany, fenytoina, estrogeny
- alkohol (wskaźnik abstynencji - 2–5 tygodni)
pierwotny rak wątroby
przerzuty innych nowotworów do wątroby
Metody oznaczania GGT
metoda kolorymetryczna – procedura rekomendowana przez IFCC:
- L-g-glutamylo-3-karboksy-4-nitroanilid (pochodna GGPNA) – donor
- glycyloglicyna – akceptor
- produkt – 5-amino-2-nitrobenzoesan (410 nm)

FOSFATAZA ALKALICZNA (ALP)
EC 3.1.3.1 Zasadowa fosfohydrolaza monoestrów ortofosforanowych
katalizuje hydrolizę wielu naturalnych i syntetycznych substratów (w
środowisku alkalicznym)
enzym jest związany z błonami
- na zewnętrznej powierzchni błony komórkowej
- związany z białkami i fosfolipidami błonowymi
Mg
+2
, Co
+2
, Mn
+2
– aktywatory
Zn
+2
wchodzi w skład cząsteczki enzymu (metaloenzym)
inhibitory: fosforany, borany, szczawiany, cyjanki
bufory: obojętne (węglanowy, barbitalowy); hamujące (glicynowy,
propyloaminowy); aktywujące (TRIS, dietanoloaminowy)
Rozmieszczenie tkankowe ALP
błona śluzowa jelita cienkiego
nerki - kanalik proksymalny (kręty)
kości – osteoblasty
wątroba
łożysko

Znaczenie kliniczne ALP
W osoczu osób zdrowych występują izoformy – wątrobowa, kostna i jelitowa
(nie u wszystkich osób)
Fizjologiczny wzrost aktywności:
u ciężarnych – izoenzym łożyskowy
dzieci – izoforma kostna
osoby z grupą krwi B i O po posiłku – izoenzym jelitowy
kobiety w okresie menstruacji – izoenzym jelitowy
doustne leki antykoncepcyjne – izoenzym jelitowy
Patologiczny wzrost aktywności
choroby wątroby – izoforma wątrobowa
pierwotne i wtórne choroby kości – izoforma kostna
- choroba Pageta
- osteomalacja
- krzywica
- osteoporoza postmenopauzalna
- nowotwory kości
pierwotna i wtórna nadczynność przytarczyc – izoforma kostna
nowotwory - produkcja ektopowa izoenzymów łożyskowego, jelitowego i
komórek zarodkowych
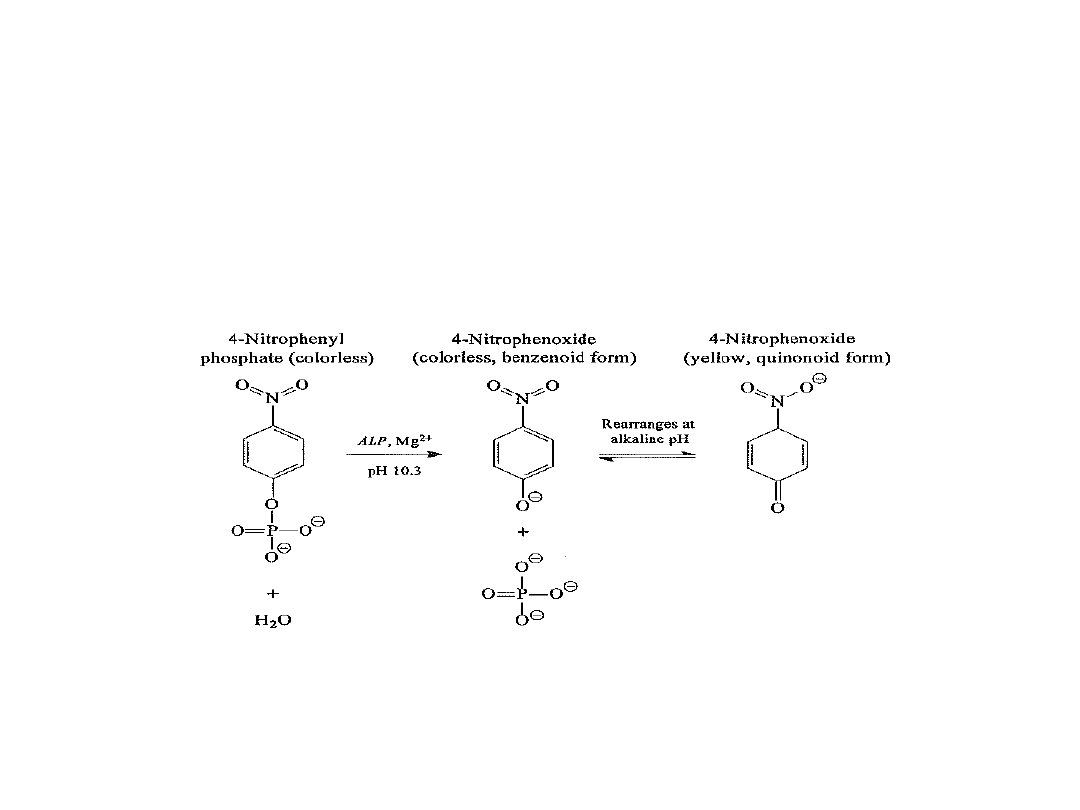
Oznaczenia aktywności ALP
metoda kolorymetryczna
- substrat fosforan 4-nitrofenylu (PNPP)
- produkt – jon 4-nitrofenoksydowy (405 nm)
- IFCC rekomenduje użycie buforu AMP (aminometylopropanolowego)
- rekomendowana temperatura oznaczenia 37°C
surowica bez hemolizy
na czczo (dieta ubogotłuszczowa)
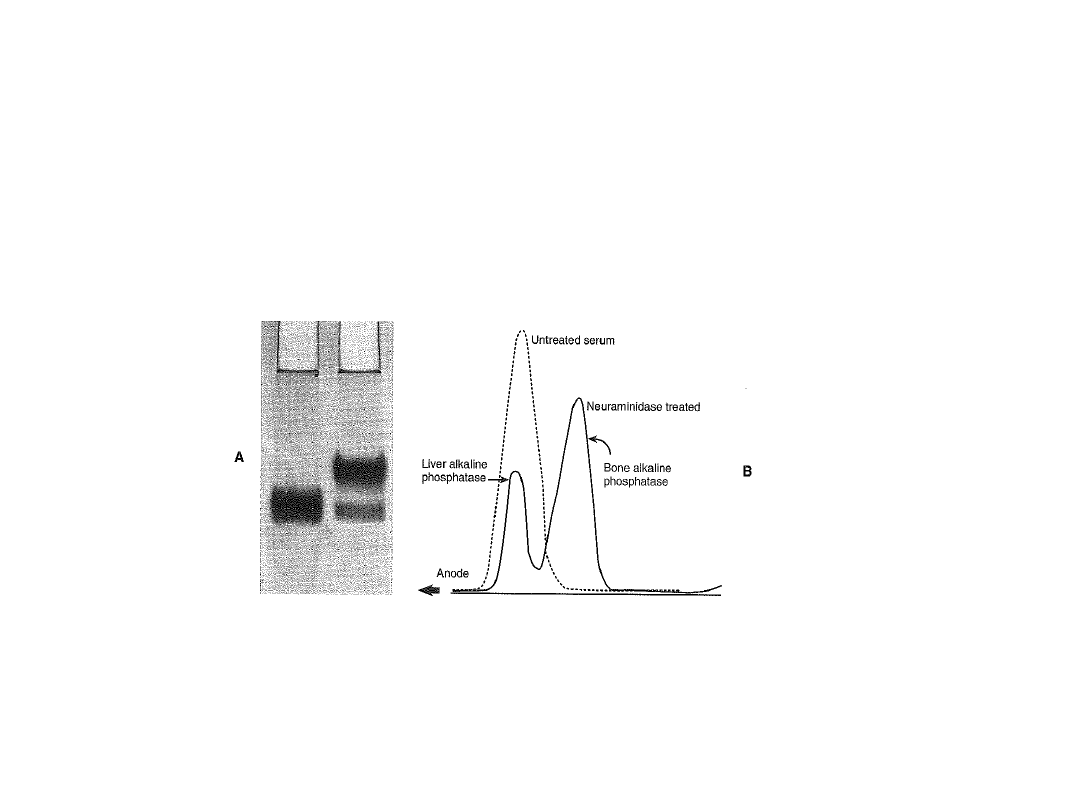
Oznaczanie izoenzymów i izoform ALP
Właściwości wykorzystywane w celu różnicowania izoenzymów i izoform:
•ruchliwość elektroforetyczna
•wrażliwość na czynniki denaturujące – temperatura (izoforma kostna), czynniki chemiczne
•wrażliwość na działanie selektywnych inhibitorów (mocznik – izofoma kostna;
L-fenyloalanina – izoenzym jelitowy i łożyskowy)
•powinowactwo lektynowe
•właściwości immunochemiczne – indukowanie produkcji specyficznych przeciwciał

AMYLAZA (AMY)
EC 3.2.1.1 Glukanohydrolaza 1,4-a-D-glukanu
hydrolizuje wiązania a-1,4-glikozydowe w łańcuchach polisacharydowych
metaloenzym – wymaga obecności Ca
+2
dla zachowania swojej aktywności
aktywatory – jony Cl
-
, Br
-
, NO
3
-
, HPO
4
-2
, cholanowe
optymalne pH: 6,9 – 7,0
54-62 kDa
jedyny enzym osoczowy fizjologicznie obecny w moczu
Rozmieszczenie tkankowe AMY
izoenzym S - produkowany w śliniankach (obecny w ślinie)
izoenzym P - produkowany w trzustce (obecny w soku trzustkowym)
aktywność AML jest także stwierdzana w:
- nasieniu, nasieniowodach
- jajnikach, jajowodach
- mięśniach poprzecznie prążkowanych
- płucach
- tkance tłuszczowej
- siarze
- łzach
- mleku
- płynach z otrzewnej i opłucnej
izoenzymy P i S podlegają modyfikacjom potranslacyjnym (glikozylacja,
deaminacja, deglikozylacja) – powstaje wiele izoform

Znaczenie kliniczne AMY
Wzrost aktywności:
zapalenie trzustki
- w ostrym zapaleniu wzrost aktywności po 5-6 godzinach od pierwszych
objawów -> maksimum po 24 godzinach -> powrót do wartości
prawidłowych po 3-4 dniach
zapalenie ślinianek
pozatrzustkowe choroby w jamie brzusznej
- choroby dróg żółciowych
- niedrożnośc jelit
- zapalenie krezki
- perforacja wrzodu żołądka
- zapalenie błony śluzowej żołądka i dwunastnicy
- pęknięcie tętniaka aorty
- ostre zapalenie wyrostka robaczkowego
- zapalenie otrzewnej
choroby układu moczowo-płciowego
- pęknięcie jajowodu (ciąża pozamaciczna)
- nowotwór jajnika
- niewydolność nerek

Oznaczenie aktywności AMY przy zastosowaniu odczynnika
Krisman
Zasada metody: Glikogen tworzy z jodem kompleks o brunatnym
zabarwieniu. W wyniku rozkładu glikogenu przez alfa-amylazę powstają
dekstryny o różnej wielkości cząsteczek i następuje zanik zabarwienia, co
wykorzystuje się w oznaczeniu kolorymetrycznym.
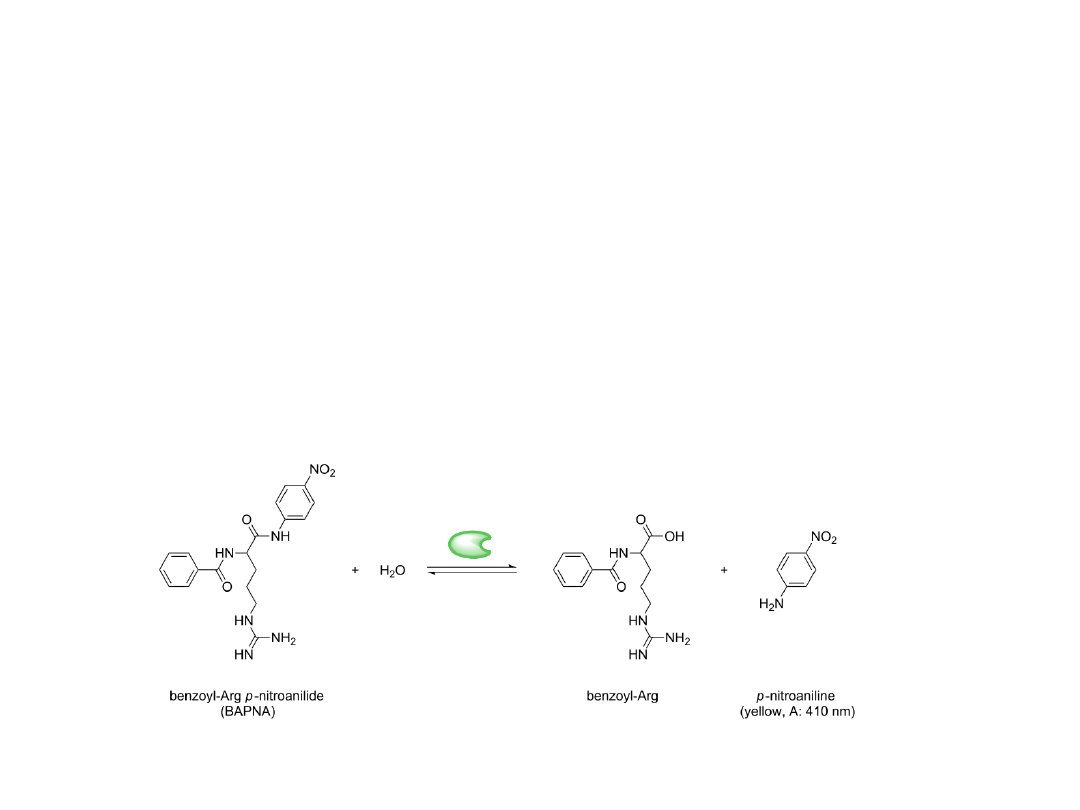
Trypsyna /E.C. 3.4.4.4/
Należy do endopeptydaz o funkcji trawiennej zawierającej w swoim centrum
katalitycznymi serynę. Prekursor trypsyny, trypsynogen wydzielany w
trzystce przekształcony jest w jelicie cienkim w trypsynę, białko o ciężarze
cząsteczkowym 24kD i optimum pH 7-9. Trypsyna rozcina wiązania utworzone
przez reszty karboksylowe argininy i lizyny.
Oznaczanie aktywności trypsyny
Do oznaczania akywności trypsyny używa się:
1. Białka (np. kazeiny)
2. Syntetycznych amidów, pochodnych argininy (np.benzoilo-DL-arginylo p-
nitroanilid /BAPNA/

Wykonanie:
Roztwory:
1. Substrat- BAPNA rozpuścić przez ogrzewanie do 85C w 0,1 M Tris-HCl
pH=8,2
2. Roztwór hamujący enzym-10% kwas octowy
3. Roztwór standardowy: szereg rozcieńczeń p-nitroaniliny 1cm3=1mikro
mol p-nitroaniliny
4. Badany r-r zawierający trypsynę
Reakcję prowadzi się w 25C przez 10 min. Poprzez zmieszanie roztworów
substratu z enzymem,
Następnie reakcję zatrzymuje się przez dodanie kw. Octowego. Gęstość
optyczną odczytuje się wobec próby ślepej (bez dodania enzymu) przy
410nm.
Wyniki pomiarów porównuje się do krzywej standardowej wyznaczonej przez
pomiar gęstości szeregu rozcieńczeń r-ru standardowego.
Oznaczanie inhibitora trypsyny
Zasada polega na pomiarze spadku aktywności trypsyny podczas krótkiej
inkubacji z surowicą krwi, zawierającą inhibitor trypsyny. Oznaczenie polega
na porównaniu aktywności w obecności i przy braku inhibitora i wyliczenie
ilości trypsyny zahamowanej.
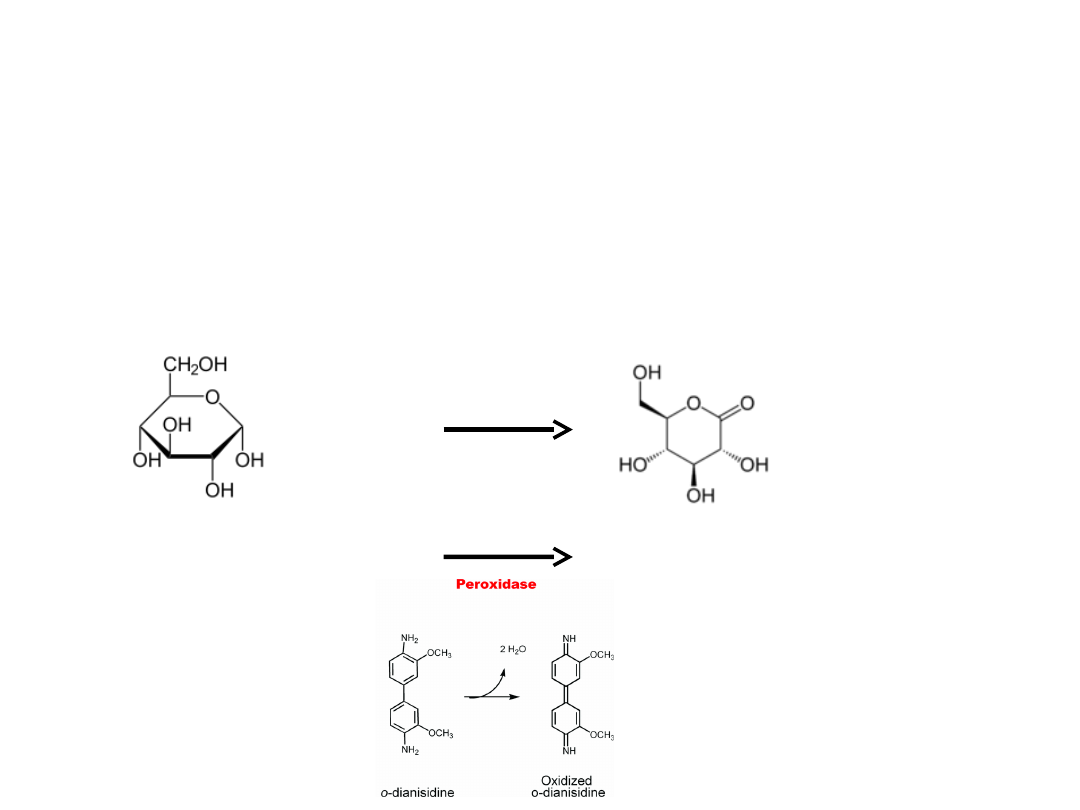
Oznaczenie glukozy przy pomocy glukozydazy
E.C.1.1.3.4
Zasada metody: Glukozydaza jest enzymem, który utlenia glukozę do
glukonolaktonu z wytworzeniem nadtlenku wodoru. Peroksydaza utlenia
o-dwuanizydynę (DH2) tlenem pochodzącym z H2O2. DH2 przekształca
się w brunatny barwnik (D), który bada się kolorymetrycznie, a jego ilość
jest proporcjonalna do ilości glukozy w próbie.
+ H
2
O
2
+ H
2
O
+O
2
H
2
O
2
+ DH2
2H
2
O + D
Document Outline
- IZOLOWANIE ENZYMÓW
- Slide 2
- Slide 3
- Slide 4
- ENZYMY-UKŁADY POMIAROWE
- ENZYMY – WARTOŚĆ DIAGNOSTYCZNA
- OZNACZANIE WYBRANYCH ENZYMÓW
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Oznaczenie glukozy przy pomocy glukozydazy E.C.1.1.3.4
Wyszukiwarka
Podobne podstrony:
Biochemia TZ wyklad 3 enzymy low
TEST Z PRZEPIS W BHP DLA STUDENT W ODBYWAJ CYCH WICZENIA W ZAK ADZIE BIOCHEMII, Biol UMCS, VIII seme
Enz-Met, Analityka Medyczna UMB, III, Biochemia kliniczna, Ćwiczenia, Enzymy
UP Bioch LIPIDY PREZENTACJA
Biochemia TZ wyklad 3 enzymy low
TEST Z PRZEPIS W BHP DLA STUDENT W ODBYWAJ CYCH WICZENIA W ZAK ADZIE BIOCHEMII, Biol UMCS, VIII seme
UP Bioch Biol 2014 wyniki kolokwiów
ENZYMY prezentacja biochemia
Prezentacja z biochemii - izoenzymy, Lekarski WLK SUM, lekarski, biochemia, enzymy
ENZYMY, Ogrodnictwo UP Lbn, Biochemia
ENZYMY OKSYDOREDUKTAZ, Ogrodnictwo UP Lbn, Biochemia
ENZYMY prezentacja biochemia 2
ENZYMY prezentacja biochemia
S up prezentacja 1 dobˇr przekroju
enzymy prezentacja
biochemia enzymy2
Kompendium pytania (3), Lekarski WLK SUM, lekarski, biochemia, enzymy
referacik, Weterynaria UP lublin, I rok, Materiały, Ochrona środowiska, referaty prezentacje
ENZYMY !!, studia, biochemia
więcej podobnych podstron