
ENZYMY
ENZYMY

Enzymy to specyficzne białka,
wytwarzane przez żywe komórki
organizmu, które umożliwiają przebieg
tysięcy reakcji chemicznych z
szybkością, wydajnością i
specyficznością trudną do osiągnięcia w
układach sztucznych. Pełnią więc rolę
katalizatorów reakcji. Ponieważ
przyspieszają reakcje co najmniej
milionkrotnie, to przy ich braku
przemiany w komórce zachodzą tak
wolno, że są niezauważalne.

Enzymy mogą być zbudowane z:
Enzymy mogą być zbudowane z:
• samego białka (np. trypsyna,
ureaza, rybonukleaza)
• części białkowej ( apoenzym)
• niebiałkowej (małocząsteczkowe
związki nieorganiczne, atomy metali,
pochodne witamin) tzw. grup
prostetycznych i koenzymów.

• Niebiałkowe części enzymu
(apoenzym) pełnią w reakcjach
enzymatycznych funkcję przenośników
elektronów, określonych atomów lub
ugrupowań chemicznych z jednego
metabolitu na drugi.
• Część białkowa jest czynna tylko w
połączeniu ze składnikiem
niebiałkowym – koenzymem i decyduje
o swoistości enzymu, a także o rodzaju
reakcji, np. dekarboksylację i
transaminację aminokwasów katalizują
enzymy o różnych apoenzymach i tych
samych koenzymach.

Swoistość enzymów
Swoistość enzymów (tj. zdolność działania
na określone substraty oraz zdolność do
katalizowania określonych reakcji) zależy od
rodzaju i sekwencji aminokwasów w
łańcuchu białka, jak również od konformacji
przestrzennej łańcucha polipeptydowego. W
części białkowej enzymu wyodrębnia się
fragment łańcucha polipeptydowego, w
którym zachodzi właściwy akt katalazy - jest
to centrum aktywne. Centrum aktywne to
fragment łańcucha polipeptydowego
(wytworzony przez reszty aminokwasów)
bezpośrednio łączący substrat w czasie
reakcji.

Tak jak wszystkie katalizatory:
enzymy nie zmieniają stanu
równowagi reakcji chemicznej, a
jedynie przyspieszają jego ustalenie.
Zazwyczaj w obecności enzymu
reakcja zachodzi w kierunku takim
samym, w jakim by zachodziła
spontanicznie, jedynie wzrasta jej
szybkość.
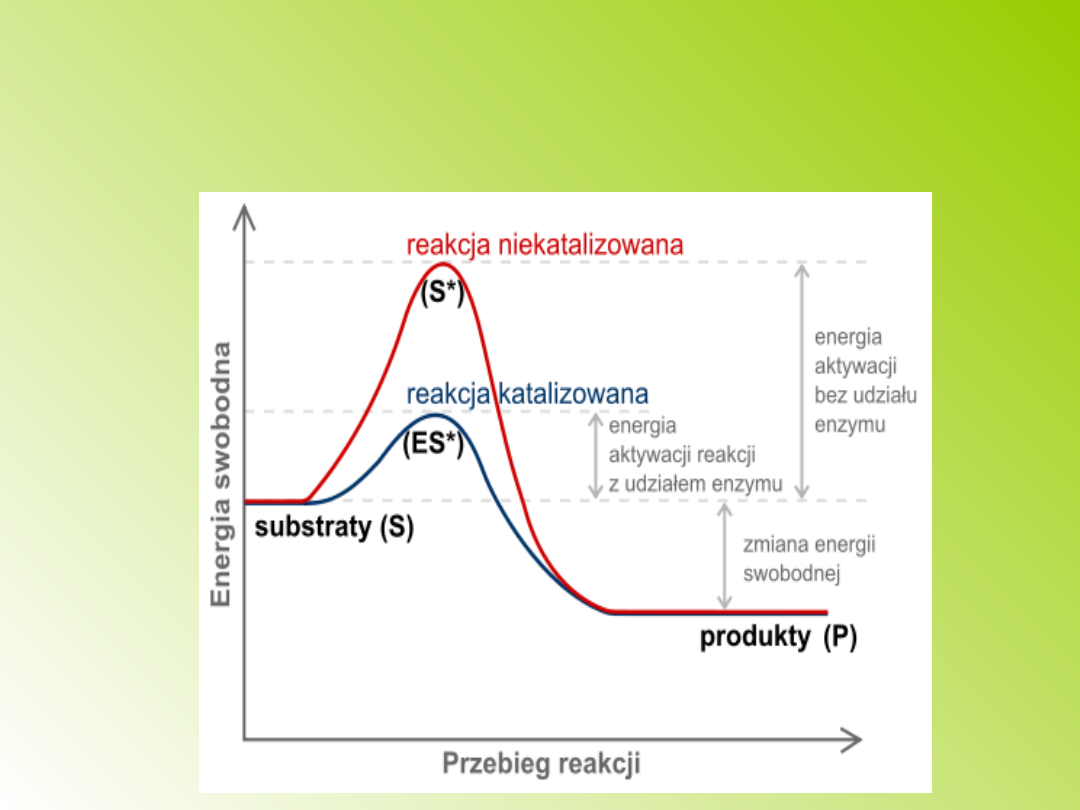
Schematyczny wykres zmian energii
swobodnej w czasie reakcji.

Mechanizm działania enzymów
W pierwszym etapie katalazy związek podlegający
przemianom (substrat) łączy się z enzymem za
pośrednictwem centrum aktywnego, tworząc
przejściowy, nietrwały kompleks enzym - substrat. W
dalszej części procesu katalazy następuje rozpad
kompleksu enzym - substrat, towarzyszy temu
wytworzenie się produktów reakcji i zregenerowanie
enzymu do jego pierwotnej postaci.
Ze względu na charakter białkowe, enzymy są bardzo
podatne na wpływ niektórych czynników zewnętrznych,
co wpływa na zmiany szybkości katalizowanych reakcji.
Tak więc, aktywność i szybkość zachodzących reakcji
enzymatycznych uzależniona jest m.in. od:
-stężenia enzymu i substratu
-temperatury
-pH

Wpływ stężenia enzymu i substratu
Zależność szybkości reakcji enzymatycznej od
stężenia substratu ilustruje tzw. krzywa Michaelisa.
Zależy ona od powinowactwa enzymu do substratu ,
którą określa stała Michaelisa-Menten
.
W miarę
wzrostu stężenia substratu szybkość reakcji rośnie,
osiągając maksymalną wydajność wtedy gdy
wszystkie cząsteczki enzymu są połączone z
substratem. Tak więc w miarę zwiększania się
stężenia substratu wysycenie centrów aktywnych
enzymu stopniowo wzrasta i przy pełnym wysyceniu
szybkość osiąga swe maksimum. Dalsze zwiększanie
ilości substratu nie powoduje zwiększenia szybkości
reakcji, może nawet ją zmniejszyć nieznacznie.
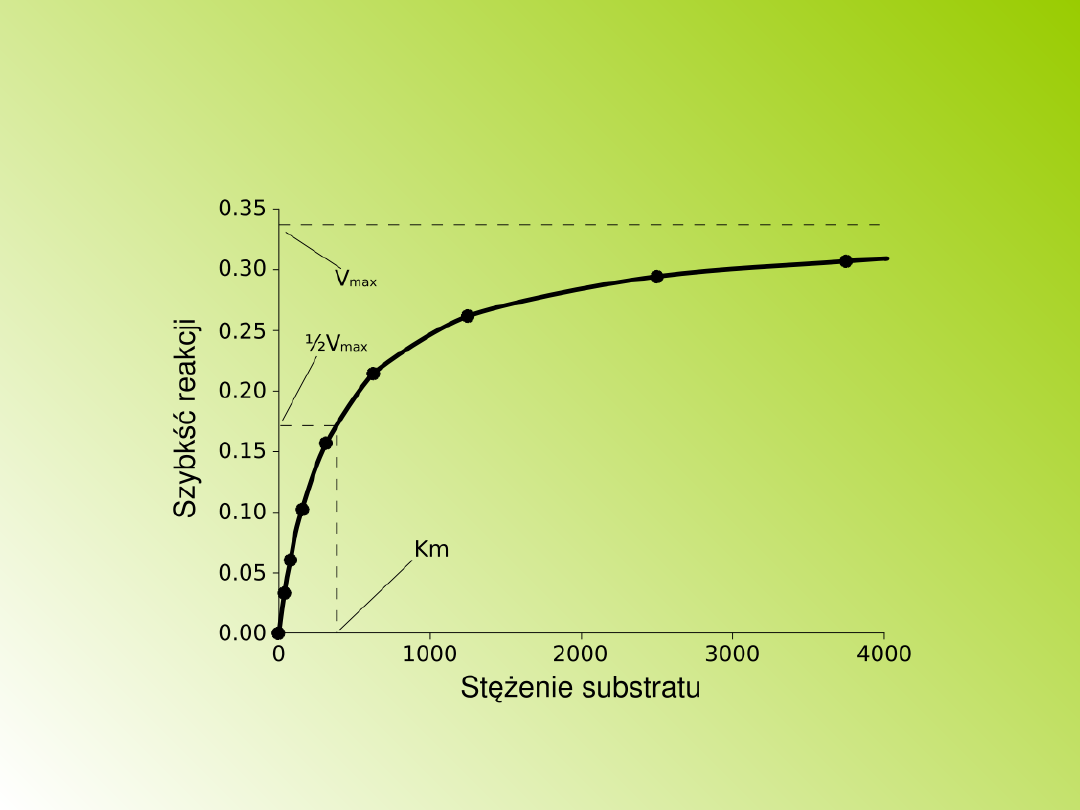
Krzywa wysycenia dla reakcji enzymatycznej
ukazująca zależność szybkości reakcji (V) od
stężenia substratu ([S])

Wpływ temperatury
Wraz ze wzrostem temperatury zwiększa się szybkość
reakcji enzymatycznej. Jednak po osiągnięciu
optimum dalszy wzrost powoduje spadek szybkości
reakcji. Wysoka temperatura niszczy nieodwracalnie
enzym, ponieważ jest on substancją białkową i wzrost
powyżej optymalnej dla jego działania temperatury
powoduje stopniową denaturację i zanik własności
katalitycznych. Temperatura optymalna dla działania
enzymów jest zależna od ich pochodzenia: dla
enzymów zwierzęcych jest zbliżona do temperatury
ciała (36-40°), dla enzymów roślinnych jej zakres
wynosi 20-30°C. Przy niskich temperaturach
aktywność enzymów ulega zahamowaniu, lecz proces
ten jest odwracalny.

Wpływ odczynu (pH)
Każdy enzym charakteryzuje się optymalnym pH, przy
którym wykazuje największą aktywność. Silnie kwaśne
czy zasadowe środowisko (skrajne wartości pH) z reguły
działają denaturująco na enzymy, które są białkami,
niszcząc nieodwracalnie ich aktywność. Niewielkie
odchylenie od wartości optymalnej nie powoduje
denaturacji, ale obniża szybkość katalizowanej reakcji.
Wpływ pH wiąże się ze zmiana stopnia dysocjacji samego
enzymu (dysocjacja grup -NH2 i -COOH obecnych w
łańcuchu polipeptydowym i głównie w centrum
aktywnym) - co wpływa negatywnie na powstanie
kompleksu enzym - substrat. Optimum pH dla większości
enzymów występuje przy wartościach bliskich odczynu
obojętnego lub słabo kwaśnego. Są jednak enzymy, które
przejawiają aktywność jedynie w środowisku kwaśnym
(pepsyna pH 1,5-2,2) lub środowisku zasadowym
(trypsyna pH 8-9).

Inhibicja
Inhibicja
Aktywność wielu enzymów może
być hamowana przez różne typy
inhibitorów. Inhibicja taka może
być odwracalna lub nieodwracalna.
Ostatnia ma miejsce wtedy, gdy
cząsteczki inhibitora wiążą się z
enzymem trwale (np.
kowalencyjnie), co doprowadza do
sytuacji zablokowania aktywności
danej cząsteczki enzymu na stałe.

Typy inhibicji
Typy inhibicji
1)
Inhibicja nieodwracalna- inhibitor łączy się z enzymem
kowalencyjnie lub wiąże się z nim tak silnie, że jego dysocjacja jest
bardzo powolna np. hamowanie aktywności acetylocholinoesterazy
– enzymu zaangażowanego w przekazywanie impulsów
nerwowych-przez gazy paraliżujące.
2)
Inhibicja odwracalna- charakteryzuje ją szybka dysocjacja
kompleksu enzym-inhibitor
•
Inhibicja kompetycyjna (współzawodnicząca)- polega na obecności
cząsteczek- inhibitorów o podobnej strukturze chemicznej co
właściwy dla danego enzymu substrat. Jeśli cząsteczek substratu
jest mało, centra aktywne enzymów zablokowane są przez
inhibitor, jeśli stężenie substratu wzrośnie, będzie on konkurował z
inhibitorem o centra aktywne i wypierał go.
•
Inhibicja niekompetycyjna (niewspółzawodnicząca) polega ona na
oddziaływaniu inhibitora z obszarem enzymu innym niż jego
centrum aktywne. Wskutek tego zmienia się kształt cząsteczki
enzymu, co wpływa na zmniejszenie się jego aktywności
katalitycznej. Zatem wiązanie inhibitora i substratu może
zachodzić jednocześnie.
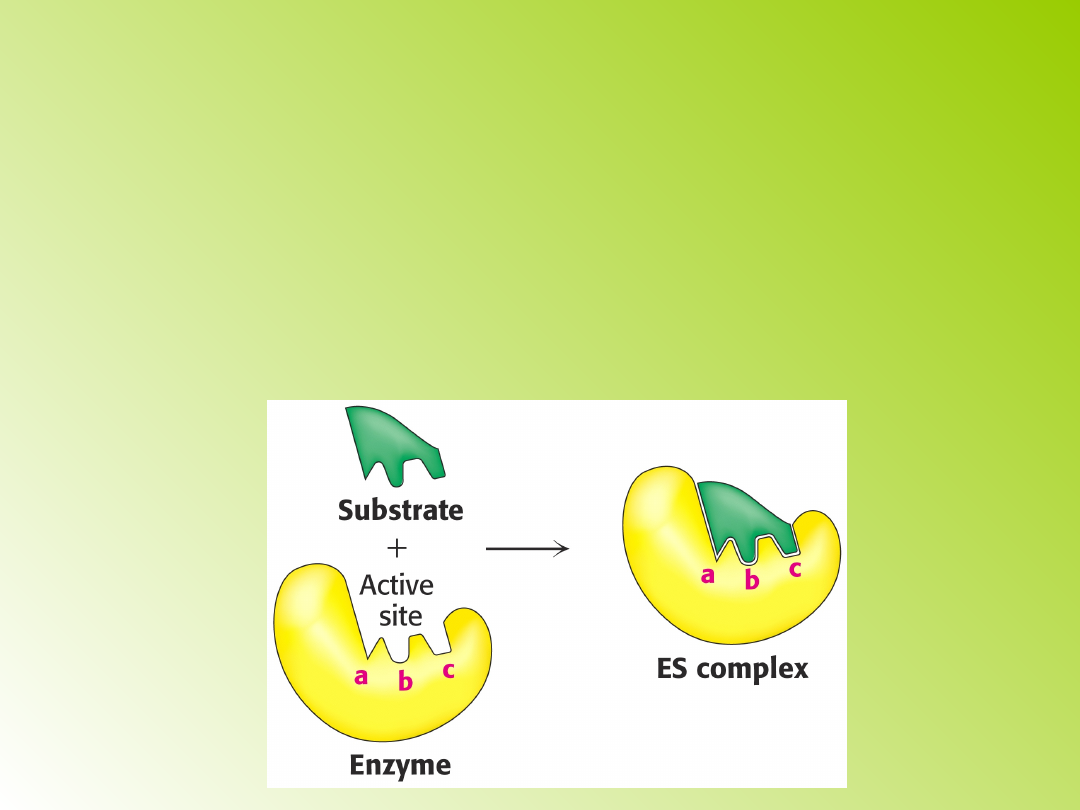
Mechanizmy łączenia się
enzymu z substratem:
1) zasada zamka i klucza (teoria
Fischera): enzym posiada określone
miejsce, które pod względem rozmiaru,
kształtu i właściwości chemicznych jest
komplementarne z cząsteczką substratu.
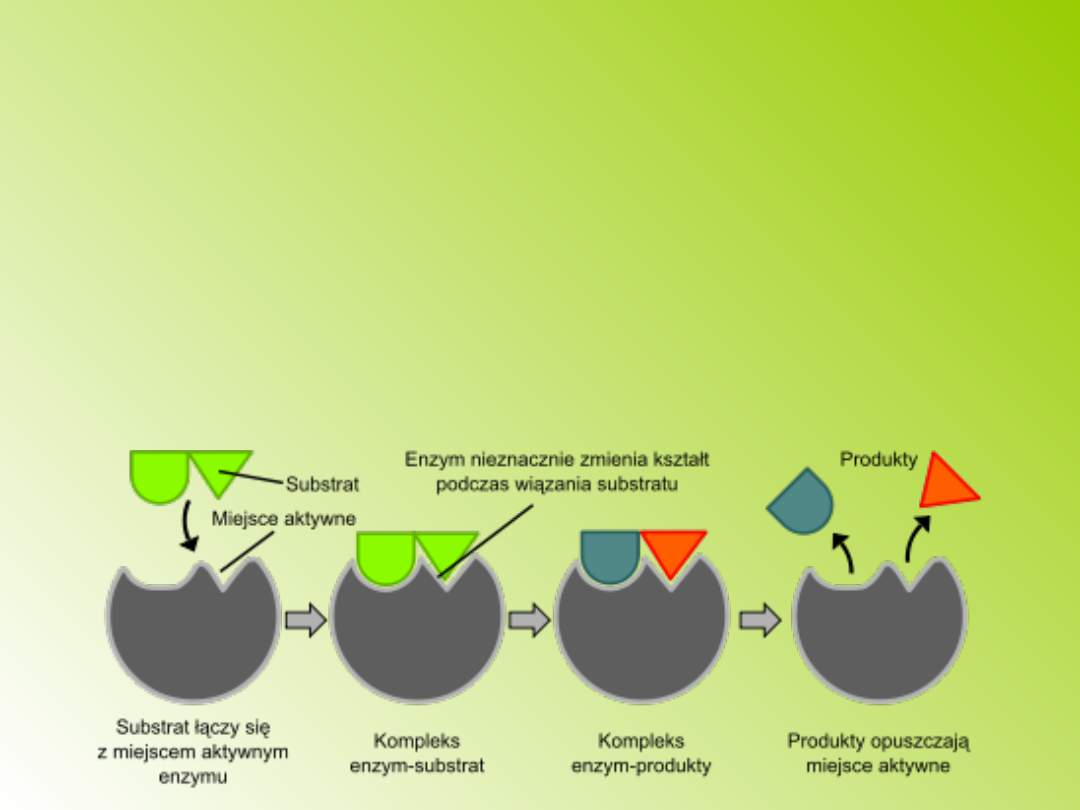
Model indukowanego dopasowania
się enzymu (teoria Koshlanda):
obszar katalityczny enzymu jest
elastyczny; obecność substratu
indukuje zmiany konformacyjne białka,
dzięki czemu następuje właściwe
ułożenie grup katalitycznych
względem grup funkcyjnych i wiązań w
cząsteczce substratu;
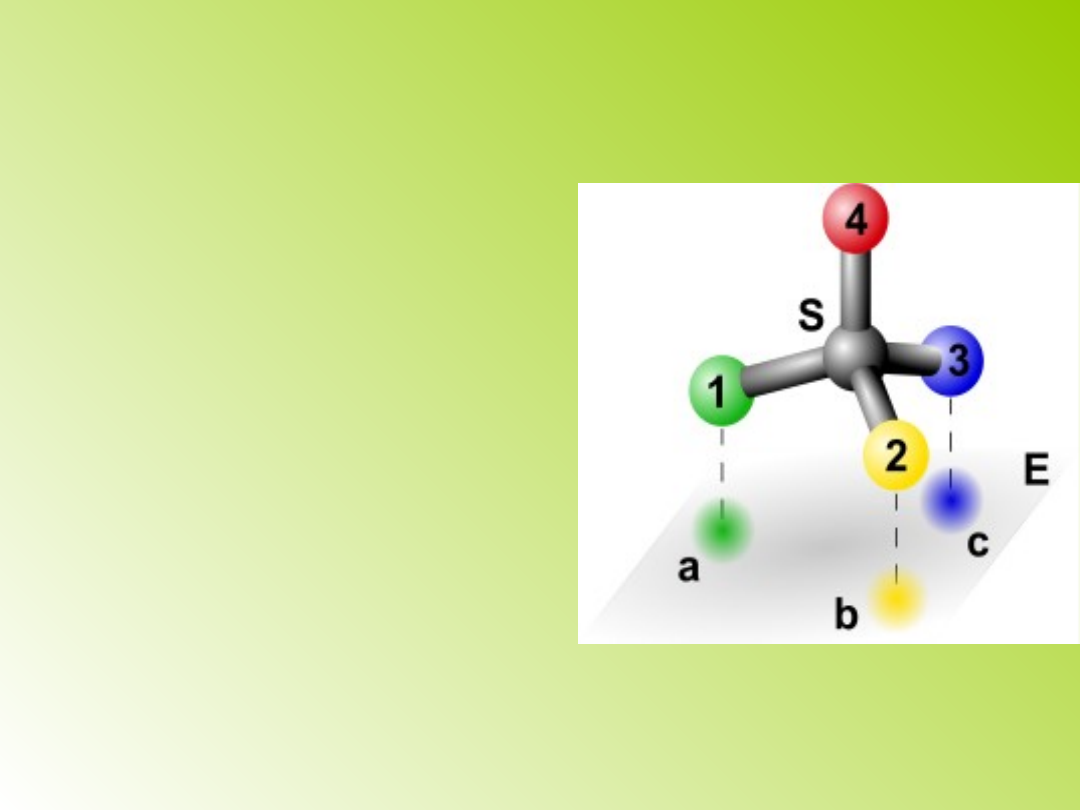
Trójpunktowe
przyłączenie substratu
(model, albo efekt (teoria)
Ogstona): substrat przyłącza
się do powierzchni enzymu
w trzech punktach;
położenie cząsteczki
substratu wobec enzymu
jest jednoznacznie
określone, a reakcja
zachodzi tylko w jednym z
trzech punktów
przyłączenia; wyjaśnia
swoistość przestrzenną
enzymów.

Ze względu na działanie enzymy podzielono na trzy
Ze względu na działanie enzymy podzielono na trzy
grupy:
grupy:
1. hydrolazy, które powodują rozkład złożonych
substancji na prostsze, przy czym zostaje przyłączona
woda. Do tej grupy należą proteazy, czyli enzymy
proteolityczne rozszczepiające białka, lipazy czyli
enzymy lipolityczne rozkładające tłuszcze, ureazy
rozkładające mocznik na amoniak i dwutlenek węgla;
2. dehydrazy odszczepiające wodór, co ma
podstawowe znaczenie dla procesów oddychania i
fermentacji;
3. desmolazy powodujące przerwanie tzw.
łańcuchów węglowych, czyli połączeń między
atomami węgla w jednej cząsteczce.

Podział enzymów ze względu na rodzaj katalizowanej reakcji:
• oksydoreduktazy - przenoszą ładunki (elektrony i jony
H3O+ - protony) z cząsteczki substratu na cząsteczkę
akceptora,
• transferazy - przenoszą daną grupę funkcyjną (tiolową,
aminową, itp.) z cząsteczki jednej substancji na cząsteczkę
innej substancji,
• hydrolazy - powodują rozpad substratu pod wpływem
wody (hydroliza); do grupy tej należy wiele enzymów
trawiennych,
• liazy - powodują rozpad substratu bez hydrolizy,
• izomerazy - zmieniają wzajemne położenie grup
chemicznych bez rozkładu szkieletu związku,
• ligazy - powodują syntezę różnych cząsteczek.

Koenzymy
Koenzymy
– są to substancje organiczne decydujące o aktywności
katalitycznej poszczególnych enzymów, biorą udział w reakcjach poprzez
oddawanie lub przyłączanie pewnych reagentów. Koenzymami są zwykle
witaminy, ATP, NADH.
• Obecność koenzymów jest często niezbędna w takich reakcjach jak:
~ przenoszenie grup atomów
~ procesy oksyredukcyjne
~ izomeryzacja zw. Chemicznych w reakcjach syntezy prowadzących do
powstania wiązań kowalencyjnych podczas powstawania różnych połączeń
w komórce
• Ponad to koenzymy pośredniczą pomiędzy różnymi enzymami, mają
szczególne znaczenie w przemianie materii, stanowią ogniwa łączące
podczas wymiany substancji ( np. wodór, kwas fosforowy ), grupy
przejmowane przez koenzym łączą się nimi wiązaniem bogatym w energię.
Grupy prostetyczne
– są to koenzymy ściśle połączone z grupami
białkowymi. W takim wypadku katalityczne działanie enzymu realizuje się w
ten sposób, że holoenzym w bardzo krótkich odstępach czasu reaguje z
dwoma różnymi substratami. Aminokwas ulega odwodornieniu, wodór
zostaje przyjęty przez grupę prostetyczną i w następnej reakcji przemiany
ma cząsteczke tlenu.

REGULACJA ALLOSTERYCZNA
:
– Modyfikacja białka enzymatycznego o charakterze NIE
kowalencyjnym ale w wyniku oddziaływania z drobną
cząsteczką.
– Enzym obok centrum aktywnego posiada miejsce
allosteryczne, do którego może przyłączać się efektor
allosteryczny, powodujący zmniejszenie lub zwiększenie
aktywności enzymu.
– Efektorem jest ściśle określony związek powodujący zmianę
konformacyjną w obrębie cząsteczki enzymu: centrum aktywne
przestaje lub zaczyna pasować do substratu.
– Efektor negatywny = ujemny: ograniczona możliwość
wytworzenia kompleksu enzym substrat, ograniczenie
możliwości zachodzenia reakcji.
– Zasadnicza różnica między zjawiskiem allosterii a zjawiskiem
modyfikacji kowalencyjnych polega na tym, że w przypadku
modyfikacji allosterycznych mamy do czynienia z sytuacją
kiedy drobna cząsteczka przyłącza się niekowalencyjne do
enzymu, ale mamy odzielne miejsce dla aktywatora i inhibitora.

– Efektorami allosterycznymi mogą być różne związki:
• cAMP (bardzo często) w przypadku kinaz
białkowych typu A. cAMP przyłącza się do
podjednostek regulatorowych w wyniku czego
następuje uwolnienie jednostek, które stają się
aktywne katalitycznie
• Regulacja allosteryczna za pomocą przyłączania
tego typu związków jest reakcją na sytuację
energetyczną w komórce. Enzymy aktywowane
przez ATP to zazwyczaj enzymy związane ze
szlakami biosyntezy, a aktywowane przez
przyłączenie AMP, ADP czy PPi to enzymy zwykle
uczestniczące w procesach katabolicznych.
• Często efektorami allosterycznymi mogą być
substraty lub produkty danego szlaku
enzymatycznego.

Zjawisko allosterii na przykładzie
hemoglobiny:
Hemoglobina- białko allosteryczne,
modyfikatory: tlen, wodór, dwutlenek
węgla, 2,3-bifosfoglicerynian. Przyłączenie
tlenu do jednego łańcucha Hb indukuje
zmiany konformacyjne i zwiększa się
zdolność przyłączania tlenu przez
pozostałe łańcuchy, wzrasta
powinowactwo Hb do tlenu.

Ewa Tomczak
Pielęgniarstwo s1, grupa 1
Dziękuję za uwagę…
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
Wyszukiwarka
Podobne podstrony:
ENZYMY prezentacja biochemia
ENZYMY prezentacja biochemia
Prezentacja z biochemii - izoenzymy, Lekarski WLK SUM, lekarski, biochemia, enzymy
enzymy prezentacja
ENZYMY !!, studia, biochemia
ENZYMY1(1), STUDIA, BIOCHEMIA
Wykład 4 biochemia enzymy, KOSMETOLOGIA, Biochemia
ENZYMY mikro, biochemia
enzymy, Dietetyka, biochemia
enzymy;), studia, biochemia
enzymy[1], STUDIA, biochemia
Prezentacja biochemia
Enzymy prezentacja
enzymy, procesy biochemiczne
enzymy1, Reakcje biochemiczne przebiegające w organizmie żywych napotykają na ogromne opory fizykoch
enzymy prezentacja
ENZYMY !!, studia, biochemia
Enzymy 2 kolo z biochemii
więcej podobnych podstron