4. ENZYMY
4.1. BUDOWA I PODZIAŁ ENZYMÓW
Enzymy to substancje o charakterze białkowym, pełniące rolę katalizatorów biologicznych.
Działają zarówno wewnątrz komórek jak i poza ich obszarem, w płynach ustrojowych, zwiększając szybkość reakcji rozkładu i biosyntezy.
Efektywnie działający enzym powinien posiadać trzy cechy:
zwiększać prawdopodobieństwo zderzeń efektywnych
zmniejszać barierę energetyczną poprzez obniżanie energii aktywacji
ukierunkowywać cząsteczki substratów względem siebie.
Enzymy dzielimy na :
proste - zbudowane z aminokwasów; należą do nich m.in. hydrolizy tj. amylaza, ureaza, aldolaza i enzymy proteolityczne,
złożone- zbudowane z części białkowej zwanej apoenzymem i części niebiałkowej , którą może być: grupa prostetyczna lub koenzym.
Różnica pomiędzy grupą prostetyczną a koenzymem polega na tym, że:
grupa prostetyczna jest zwykle małą cząsteczką np. jonem metalu Fe, Co, Mg na trwałe związana z białkiem, po utracie grupy prostetycznej enzym bezpowrotnie traci swoje zdolności biokatalityczne,
koenzym jest dużą cząsteczką (witamina, glikolipidy, NAD) związana nietrwale z częścią białkową, może oddysocjowywać i wówczas enzym jest nieaktywny, ale nie traci zdolności biokatalitycznych.
APOENZYM + KOENZYM = HOLOENZYM
APOENZYM- posiada zdolność rozpoznawania substratu, decyduje o specyficzności substratowej enzymu.
Specyficzność substratowa oznacza możliwość wyboru przez dany enzym jednego lub grupy związków, z którym wchodzi on w kompleks zdolny do dalszej reakcji.
Specyficzność substratowa:
Absolutna- enzymy są zdolne do reakcji tylko z jednym substratem (ureaza-hydroliza mocznika)
Grupowa- enzymy mogą wykorzystywać w charakterze substratów określoną grupę podobnych do siebie substancji np. esterazy - enzymy katalizujące rozkład wiązania estrowego wymagają obecności tego wiązania w cząsteczce, natomiast rodzaj kwasu i alkoholu tworzących ester nie ma znaczenia.
Przestrzenna- polega na odpowiednim dopasowaniu konfiguracji substratu do układu przestrzennego w centrum aktywnym (teoria indukcyjnego dopasowania Koshlanda, ręka do rękawiczki, klucz do zamka)
KOENZYM- określa typ katalizowanej reakcji i ją przeprowadza. Koenzym to uczestnicząca w reakcji enzymatycznej niebiałkowa część enzymu nietrwale związana z częścią białkową (apoenzymem). Bierze udział w przenoszeniu elektronów, protonów lub grup atomów w trakcie katalizowanej reakcji. Wśród koenzymów wymienić można: ATP (adenozynotrifosforan), NAD (dinukleotyd nikotynoamidoadeninowy), NADP (fosforan dinukleotydu niktynoamidoadeninowego), FMN (mononukleotyd flawinowy), FAD (dinukleotyd flawinoadeninowy), CoA (koenzym A), CoQ (koenzym Q) oraz wiele innych. Wiele z nich wykazuje pokrewieństwo do witamin. Koenzymy ulegają zużyciu podczas zachodzących z ich udziałem reakcji enzymatycznych, dlatego do organizmu dostarczane muszą być prekursory koenzymów, często w postaci witamin.
Na powierzchni cząsteczki enzymu znajduje się zagłębienie będące miejscem wiązania substratu, nazwane centrum aktywnym. Przestrzenne dopasowanie substratu do centrum aktywnego enzymu umożliwia ich związanie i wytworzenie kompleksu enzym-substrat (E-S), a w efekcie obniżenie energii aktywacji reakcji, której następnie ulegnie substrat (energia aktywacji to taka ilość energii, która jest niezbędna do zapoczątkowania reakcji chemicznej).
Enzymy są katalizatorami, które zmieniają szybkość reakcji, same nie ulegając zmianie.
Aby zaszła reakcja biochemiczna, musi być pokonana bariera energetyczna, związana z przekształceniem cząsteczki substratu w stan przejściowy. Enzymy obniżają tę barierę, co w konsekwencji prowadzi do obniżenia energii aktywacji i przyspiesza reakcję.
Reakcja chemiczna często znajduje się w stanie równowagi dynamicznej. Enzymy nie zmieniają położenia równowagi, ale przyspieszają jej osiągnięcie, zwiększając szybkość reakcji.
Ogólne równanie reakcji enzymatycznej katalizowanej przez enzym można zapisać w następujący sposób:
ENZYM + SUBSTRAT ↔ [E-S] ↔ ENZYM + PRODUKT
W połączeniu tym biorą udział reaktywne grupy substratu oraz zdolne do reagowania z nimi grupy funkcyjne występujące w aminokwasach, wchodzących w skład białka enzymu. Grupy te znajdują się w określonym układzie przestrzennym i współdziałają ze sobą w przyłączaniu substratu: taki układ nazywamy centrum aktywnym enzymu. W ustaleniu odpowiedniej konformacji centrum aktywnego umożliwiającej utworzenie kompleksu E-S często biorą udział aktywatory, których role pełnią jony metali lub koenzymy.
Enzymy są specyficzne względem substratów, co oznacza, że jeden rodzaj enzymu katalizuje tylko jeden rodzaj reakcji (pasują do siebie jak klucz do zamka). Każda cząsteczka biokatalizatora może być jednak wykorzystywana wielokrotnie, przetwarzając kolejno wiele cząsteczek substratu (nie zużywa się w czasie pojedynczej przemiany).
Zgodnie z zaleceniami Międzynarodowej Unii Biochemicznej enzymy dzielimy na 6 klas
oksydoreduktazy- katalizują reakcje utleniania i redukcji,
transferazy - przeprowadzają reakcje przenoszenia różnych grup funkcyjnych,
hydrolazy - katalizują reakcje hydrolizy,
liazy - przeprowadzają reakcje rozpadu bez udziału wody,
izomerazy - katalizują reakcje przegrupowań wewnątrzcząsteczkowych,
ligazy (syntetazy) - uczestniczą w powstawaniu nowych wiązań chemicznych kosztem energii pochodzącej z hydrolizy związków wysokoenergetycznych.
Ze względu na rozmieszczenie w komórce enzymy dzielimy na:
enzymy błony komórkowej,
enzymy cytoplazmatyczne,
enzymy mitochondrialne,
enzymy mikrosomalne,
enzymy jądra komórkowego,
enzymy lizosomalne,
enzymy połączone z innymi organellami.
Enzymy powstają w komórkach, gdzie pełnią różnorakie funkcje, a zaburzenia w ich pracy są powodem wielu chorób. Ale ich ogromne znaczenie nie ogranicza się do organizmu, w którym są syntetyzowane. Nauczono się też wykorzystywać je w przemyśle (ułatwiają przeprowadzenie różnych procesów, np. fermentacji) i w lecznictwie (pepsyna i streptokinaza są stosowane jako leki, zaś badanie zawartości pewnych enzymów w tkankach i płynach fizjologicznych jest jedną z metod diagnostyki lekarskiej).
Podział diagnostyczny obejmuje trzy grupy enzymów:
enzymy sekrecyjne (wydzielnicze,
enzymy indykatorowe (wskaźnikowe, są wskaźnikami uszkodzenia komórek przez proces chorobowy),
enzymy ekskrecyjne (wydzielane z wydalinami ustrojowymi, w przypadku utrudnionego odpływu spowodowanego guzem nowotworowym, kamieniem, obserwuje się wzrost ich aktywności).
IZOENZYMY (izozymy) są różnymi formami enzymu, które katalizują tę samą reakcję, ale wykazują odmienne właściwości fizyczne lub kinetyczne tj, punkt izoelektryczny, optimum pH, powinowactwo do substratu, wrażliwość na inhibitory. Różne formy izozymów danego enzymy pochodzą z różnych genów i często występują w różnych tkankach ciała. Wzór izoenzymu jest charakterystyczny dla danej tkanki, co ma ogromne znaczenie diagnostyczne w medycynie. Na podstawie obecności izoenzymów we krwi można postawić diagnozę np. zawału mięśnia sercowego,, żółtaczki zakaźnej, choroby mięśni.
4.2. KINETYKA REAKCJI ENZYMATYCZNYCH
Szybkość reakcji enzymatycznych zależy w znacznym stopniu od:
stężenia substratu,
stężenia enzymu,
czynników hamujących obecnych w środowisku.
Czynniki te dzieli się na:
specyficzne - inhibitory, aktywatory,
niespecyficzne-, temperatura, pH, sężenie soli.
Czynniki niespecyficzne powodują denaturację białka enzymowego, a więc działają nieodwracalnie i nazywają się inaktywatorami.
Czynniki specyficzne - działają odwracalnie, modyfikująco na określony fragment cząsteczki enzymu (z reguły na centrum aktywne), powodując zmniejszenie szybkości reakcji. Są to inhibitory, a zjawisko specyficznego hamowania jest nazywane inhibicją.
HAMOWANIE REAKCJI ENZYMATYCZNYCH
Inhibitory klasyfikuje się w zależności od mechanizmu działania na:
Współzawodniczące (kompetencyjne)
Nie współzawodniczące (niekompetencyjne)
Ad 1. Mechanizm ich działania polega na konkurencji pomiędzy inhibitorem a substratem o centrum aktywne enzymu, proces ten można cofnąć przez zwiększenie stężenia substratu.
Ad.2. W przeciwieństwie do hamowania przez współzawodnictwo nie można tego procesu cofnąć przez zwiększenie stężenia substratu. Stopień hamowania przez inhibitor zależy tylko od dwóch czynników: od jego stężenia i od powinowactwa enzymu do inhibitora. W obu przypadkach odwrócenie reakcji, a więc zniesienie inhibicji, może nastąpić jedynie przez związanie inhibitora z substancją o większym do niego powinowactwie. Czasem jednak powinowactwo enzymu do inhibitora jest tak duże, że reakcja nie jest możliwa do odwrócenia i mówi się wtedy o inhibicji nieodwracalnej.
AKTYWACJA ENZYMÓW
Większość enzymów wymaga do uzyskania pełnej aktywności różnych czynników chemicznych przyspieszających ich działania - aktywatorów.. Mogą one działać według kilku mechanizmów:
I mechanizm polega na przekształceniu formy nieaktywnej enzymu(proenzym, zymogen) w formę aktywną,
II mechanizm polega na działaniu czynników regulujących potencjał redox środowiska,
III mechanizm polega na współdziałaniu drobnocząsteczkowych związków zwanych kofaktorami z białkiem enzymu -modyfikatorów allosterycznych, które po przyłączeniu do specyficznego fragmentu białka enzymu powodują zmianę konformacji centrum aktywnego z niezdolnej do przyłączania substratu w pasującą do jego cząsteczki.
STĘŻENIE SUBSTRATU
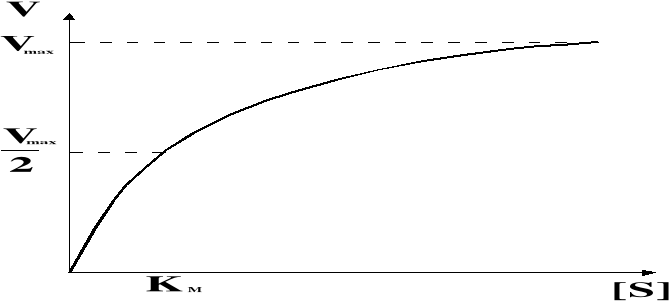
Szybkość reakcji jest proporcjonalna do stężenia cząstek reagujących. Przy stałym poziomie enzymu, początkowo wzrasta wraz ze wzrostem stężenia substratu, jednak w momencie całkowitego wysycenia enzymu substratem reakcja osiąga szybkość maksymalną Vmax. Dalsze zwiększanie stężenia substratu nie powoduje wzrostu szybkości. Niektóre reakcje enzymatyczne osiągają Vmax. Już przy niewielkich stężeniach substratu, co świadczy o dużym powinowactwie enzymu do substratu. Można je wyrazić za pomocą stałej Michaelisa KM.
Stała Michaelisa KM - określa stężenie substratu, przy którym szybkość reakcji enzymatycznej jest równa połowie szybkości maksymalnej. Dla większości enzymów jej wartość zawiera się w przedziale 10-2 do 10-7 mol/litr. Im mniejsza KM tym większe powinowactwo danego substratu do enzymu. Jeżeli enzym reaguje z kilkoma substratami, to jest najbardziej specyficzny dla tego, dla którego wartość KM jest najmniejsza.
Równaniem opisującym zależność szybkości reakcji enzymatycznej od stężenia substratu jest równanie Michaelisa-Menten:
[S]
V = V Max ------------
[S]+Km
gdzie:
V - prędkość katalizowanej reakcji
Vmax - maksymalna prędkość katalizowanej reakcji (w warunkach optymal nych)
[S] - stężenie substratu
Km - stała Michaelisa -
Z graficznego przedstawienia tego równania można wyznaczyć wartość stałej KM
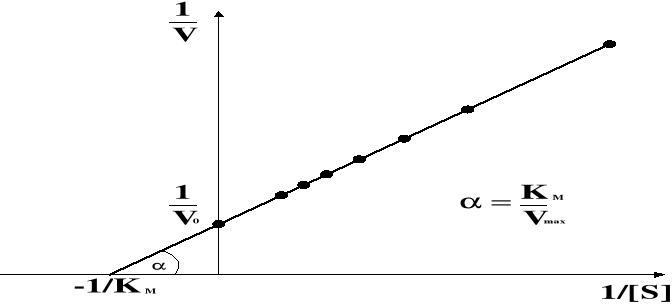
Znacznie dogodniejszym sposobem wyznaczania wartości tej stałej jest wykorzystanie równania Lineweavera-Burka, będącego odwrotnością równania Michaelisa-Menten
1/V = 1/Vmax + (KM/VMAX)[S]-1
Znajomość wartości Km ma istotne znaczenie przy opracowywaniu metod oznaczania aktywności enzymów, które wykorzystywane są w diagnostyce różnych chorób (do takich enzymów należy np. dehydrogenaza mleczanowa, aminotransferaza alaninowa, aminotransferaza asparaginianowa, kinaza kreatynowa). Są to enzymy wskaźnikowe, oznaczanie ich aktywności w surowicy krwi chorego pozwala wyciągać wnioski o stanie jego zdrowia. Szybkość każdej reakcji enzymatycznej (aktywność enzymu) należy oznaczać w takich warunkach, aby v = Vmax, gdyż tylko wtedy szybkość reakcji zależy od stężenia enzymu. Stężenie substratu musi więc być dużo większe od Km (minimum 10 razy).
4.3. CZYNNIKI WPŁYWAJĄCE NA SZYBKOŚĆ REAKCJI ENZYMATYCZNYCH
STĘŻENIE ENZYMU
W warunkach gdy substrat znajduje się w nadmiarze, szybkość reakcji katalizowanej przez enzym jest wprost proporcjonalna do stężenia enzymu.
TEMPERATURA
Wzrostowi temperatury towarzyszy przyspieszenie reakcji enzymatycznej. Po osiągnięciu pewnego optimum w danych warunkach dla konkretnego enzymu, reakcja ulega spowolnieniu w następstwie denaturacji cieplnej enzymu.
Temperatura optymalna dla większości enzymów, którą przyjęto jako standardową do przeprowadzania pomiarów aktywności enzymów 300C.
Temperatura max.: dla człowieka 400C (powyżej 420C następuje inaktywacja wielu enzymów i śmierć organizmu), dla bakterii żyjących w gorących źródłach 70-1000C, dla enzymów roślinnych 20-25 0C, enzymy bakteryjne nawet do 900C.
Podwyższenie temperatury o 100 zwiększa szybkość reakcji 2-3 krotnie.
pH
Stężenie jonów wodorowych jest czynnikiem silnie wpływającym na szybkość reakcji enzymatycznej. Dla każdego enzymu istnieje optymalne dla jego działania pH.np:
dla pepsyny pH 1,0-2,2,
dla fosfatazy kwaśnej pH 3,8-6,0
dla amylazy pH 6,7-7,2
dla fosfatazy alkalicznej pH 8,5-10,0.
W zakresie optymalnego pH szybkość reakcji enzymatycznej jest maksymalna. Zbyt kwasowe lub zbyt zasadowe środowisko może powodować denaturację białka enzymatycznego.
STĘŻENIE SOLI
Większość enzymów wymaga do rozpuszczenie obecności soli w stężeniu 0,05 - 0,2 mol/l. Zbyt duże stężenie soli prowadzi do wysolenia białka na skutek konkurencji o wodę.
4.4. JEDNOSTKI AKTYWNOŚCI ENZYMATYCZNEJ
KATAL
Katal stanowi jednostkę w układzie SI. Jest to ilość enzymu, która przekształca 1 mol substratu w ciągu 1 sekundy, w temperaturze 300C, w pH optymalnym dla działania enzymu i przy całkowitym wysyceniu enzymu substratem.
Międzynarodowa jednostka aktywności enzymu IU
IU określa taą ilość enzymu, która przekształca 1 µmol substratu w ciągu 1 minuty, w temperaturze 300C i przy całkowitym wysyceniu enzymu substratem.
Katal 1 mol-1s
IU 1µmol - 1 min
1 katal= 6 ∙107 jednostek międzynarodowych
1IU= 16,67 nanokatali
W praktyce można spotkać tzw. jednostki umowne, które ustalane były przez autorów metody wyznaczania aktywności enzymów np. jednostka Wolghemuta dla amylazy, czy Bodansky'ego dla fosfatazy.
4.5. SYSTEMY ENZYMATYCZNE DROBNOUSTROJÓW
Drobnoustroje wykazują szczególni wysoką aktywność metaboliczną, wynikającą z szybkiego rozmnażania i intensywnej przemiany materii. Pozostając w stałym kontakcie ze środowiskiem zewnętrznym, czerpiąc z tego środowiska pożywienie i energię, przystosowały się do szybkiego i precyzyjnego reagowania na wszelkie występujące w nim zmiany. Muszą one przy tym przebudowywać swoje systemy enzymatyczne. Systemy enzymatyczne drobnoustrojów można podzielić na:
Wewnątrzkomórkowe,
Pozakomórkowe
Rozmieszczone na powierzchni komórki.
W procesach metabolizmu komórkowego możemy wyróżnić dwa podstawowe kierunki przemian:
utlenianie czyli katabolizm
biosyntezę czyli anabolizm.
W przemianach katabolicznych złożone substancje organiczne są utleniane do prostych związków, w wyniku sukcesywnie następujących po sobie reakcji enzymatycznych. Procesy kataboliczne zapewniają komórce wymaganą ilość energii oraz dostarczają dużych ilości małocząsteczkowych związków do biosyntezy. Przemiany kataboliczne i anaboliczne przebiegają w komórce jednocześnie. Koordynacja poszczególnych reakcji jak również całych szlaków metabolicznych jest przypisywana enzymom komórkowym, ich aktywności katalitycznej i specyficzności działania.
Procesy regulacji metabolizmu komórkowego są wynikiem działania dwóch mechanizmów:
Regulacji aktywności enzymów
Regulacji ilości enzymów.
Mechanizm regulujący syntezę enzymów może być:
represją enzymatyczną- polegającą na hamowaniu syntezy enzymów pod wpływem nadmiernej ilości produktu reakcji, który w wyniku nagromadzenia się odgrywa rolę sygnału o przerwaniu enzymów niepotrzebnych komórce w danym momencie.
indukcją enzymatyczną- polegającą na wzmożeniu syntezy enzymów, ma miejsce wtedy, gdy w środowisku wystąpią składniki, które komórka powinna rozłożyć do substancji niezbędnych dla jej wzrostu
adaptacją enzymatyczną- jest to indukcja połączona z przystosowaniem do nowych warunków i wytworzeniem nowych enzymów (proces ten ma szczególne znaczenie w bioinżynierii sanitarnej i ochronie środowiska).
MECHANIZMY ADAPTACYJNE DROBNOUSTROJÓW
Adaptacja socjologiczna- jest to typ przystosowania polegający na naturalnym sposobie przystosowania mikroorganizmów do zmiennych warunków życia poprzez intensywny rozwój i dominację tego gatunku, który w zmienionej sytuacji ma najodpowiedniejsze warunki rozwoju.
Adaptacja fizjologiczna- polega na dostosowaniu układu enzymatycznego organizmu do specyficznej substancji, która pojawiła się w środowisku. Indukujące działanie nowego substratu powoduje powstawanie enzymów adaptacyjnych umożliwiających metabolizowanie tego związku i włączanie w łańcuch przemian wewnętrznych.
Adaptacja genetyczna- ma szczególne znaczenie w przypadku ścieków zawierających substancje toksyczne. Jest to przystosowanie w wyniku mutacji, wprowadzone są do organizmu nowe cechy związane z aktywnością fizjologiczną. Na krótkotrwałe zmiany czynników środowiskowych mikroorganizmy reagują adaptacją fizjologiczną, natomiast gdy zmiany w środowisku trwają dłużej lub gdy są bardzo silne - modyfikacją genetyczną.
Wyszukiwarka
Podobne podstrony:
Enzymy, Dietetyka CM UMK, Biochemia
ENZYMY prezentacja biochemia
ENZYMY !!, studia, biochemia
ENZYMY1(1), STUDIA, BIOCHEMIA
Wykład 4 biochemia enzymy, KOSMETOLOGIA, Biochemia
biochemia ściąga testy, Dietetyka, biochemia
ENZYMY mikro, biochemia
enzymy;), studia, biochemia
enzymy[1], STUDIA, biochemia
biochemia sciaga eg, Dietetyka, Biochemia
linum-biochemia, Dietetyka, Biochemia
enzymy, procesy biochemiczne
enzymy1, Reakcje biochemiczne przebiegające w organizmie żywych napotykają na ogromne opory fizykoch
ENZYMY prezentacja biochemia 2
ENZYMY prezentacja biochemia
ENZYMY !!, studia, biochemia
Enzymy 2 kolo z biochemii
więcej podobnych podstron