
Oporność wielolekowa związana z aktywnym
usuwaniem leków z komórek drobnoustrojów*
Efflux-mediated antimicrobial multidrug resistance
Agata Jarmuła
1
, Ewa Obłąk
1
, Donata Wawrzycka
2
, Jan Gutowicz
1
1
Instytut Genetyki i Mikrobiologii, Uniwersytet Wrocławski
2
Instytut Biologii Roślin, Uniwersytet Wrocławski
Streszczenie
Opornośćwielolekowajestpoważnymproblememwleczeniuinfekcjibakteryjnychigrzybiczych.
Jednymzgłównychmechanizmówopornościjestaktywneusuwanielekówzkomórki.Ubakte-
riieksportsubstancjitoksycznychzkomórekodbywasięzapośrednictwembiałeknależącychdo
pięciurodzin:MFS,SMR,ABC,RNDiMATE.Substratamipompmogąbyćm.in.antybiotyki,
chemioterapeutykiidetergenty.Genyopornościnatezwiązkimogąsięumiejscawiaćnachro-
mosomachbądźelementachruchomych(plazmidy,transpozony,integrony).Obecnośćgenów
opornościnaelementachruchomychumożliwiabakteriomłatweichprzekazywaniezkomórki
dokomórkiirozprzestrzenianieopornościwielolekowej.Obecnietrwająbadanianadzwiązka-
miwykazującymidziałanieinhibicyjnewzględemtransporterówwyrzutuleków.Białkawarun-
kującewielolekoopornośćwystępująrównieżugrzybów.Należągłówniedorodzinytranspor-
terówABC,dopodrodzinyPDR.BiałkatesąpowszechniebadaneudrożdżySaccharomyces
cerevisiae.
Słowa kluczowe:
systemy wyrzutu leków • oporność wielolekowa • antybiotyki
Summary
Multidrugresistanceisamajorprobleminthetreatmentofinfectiousdiseasescausedbybacte-
riaandfungi.Oneofthebasicmechanismsofresistanceisactiveeffluxofdistinctdrugsfrom
cells.Exportoftoxiccompoundsfrombacterialcellsismediatedbyproteinsof5distinctfami-
lies:MF,SMR,ABC,RNDandMATE.Thesubstratespectrumofeffluxpumpsincludesan-
tibiotics,chemotherapeuticsanddetergents.Genesthatdetermineresistancecanbelocatedon
chromosomesormobileelements(plasmids,transposons,integrons).Thepresenceofresistance
genesonmobileelementsenablesbacteriatotransferthosegenesbetweencellsandspreadthe
multidrugresistancephenotype.Thereareseveralinhibitorsofeffluxpumpsthatarecurrently
intheexperimentalphase.Proteinsthatmediatemultidrugresistancearealsopresentinfungal
cells.TheybelongmainlytotheABCsuperfamilyoftransportersandPDRsubfamily.Theseef-
fluxpumpsarewidelyinvestigatedinSaccharomyces cerevisiae.
Key words:
efflux pumps • multidrug resistance • antibiotics
Full-text PDF:
http://www.phmd.pl/fulltxt.php?ICID=937011
Received: 2010.12.20
Accepted: 2011.03.03
Published: 2011.04.01
*Pracaczęściowofinansowanaz10/16/SIGM/11/14orazzgrantuMinisterstwaNaukiiSzkolnictwaWyższego
nrNN303068534.
216
Review
www.
phmd
.pl
® Postepy Hig Med Dosw (online), 2011; 65: 216-227
e-ISSN 1732-2693
® Postepy Hig Med Dosw (online), 2011; 65
- - - - -
Electronic PDF security powered by www.IndexCopernicus.com
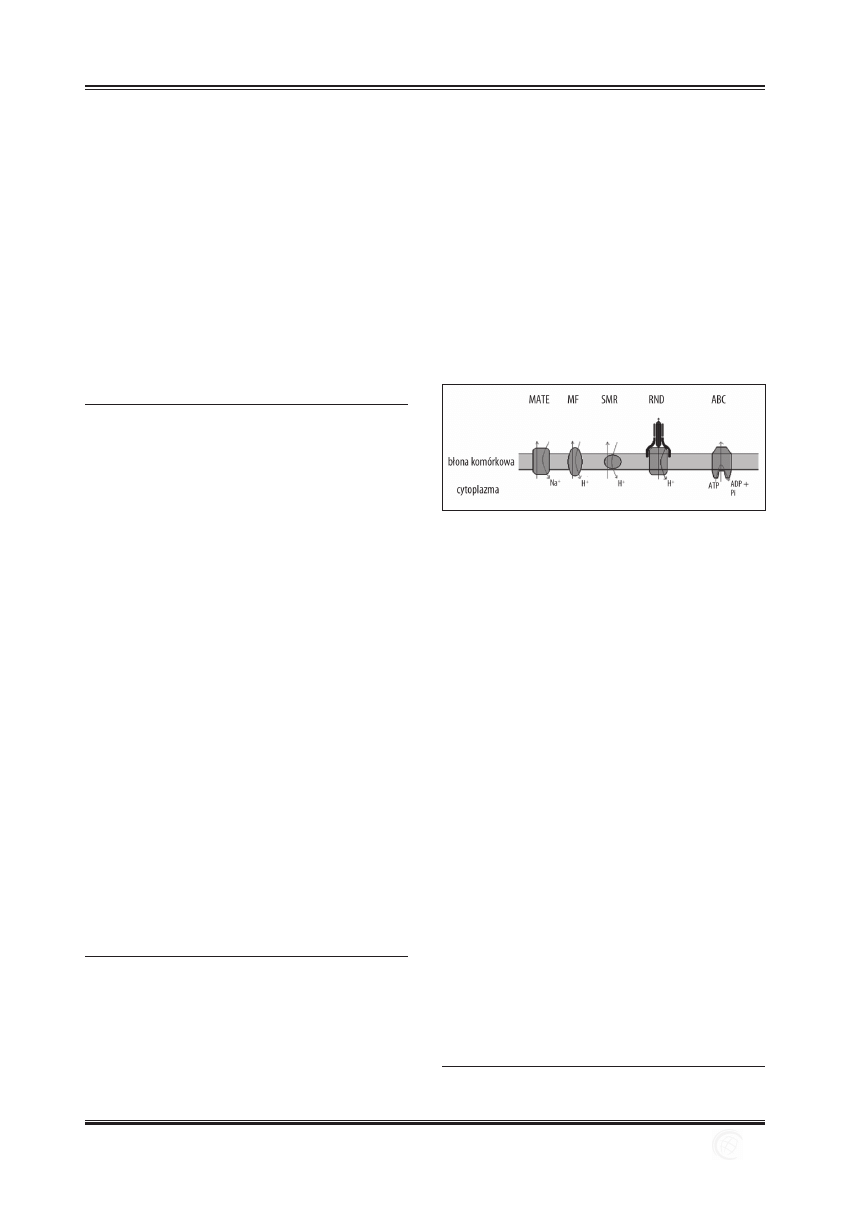
1. W
proWadzenie
Odkrycieizastosowanieantybiotykówumożliwiłowalkę
zgroźnymiinfekcjamibakteryjnymi.Jednakwrazzroz-
powszechnieniemsięantybiotyków,bakteriewykształciły
różnemechanizmyopornościnateśrodki.Jednymznich
jestaktywnywyrzutlekówzkomórki.Biorąwnimudział
białka,któreeksportująantybiotykiiinneśrodkiantybak-
teryjnezwnętrzakomórkidośrodowiskazewnętrznego.
Transporterytenależądopięciuniespokrewnionychrodzin:
MF(majorfacilitator),SMR(smallmultidrugresistance),
MATE(multidrugandtoxiccompoundextrusion),RND(re-
sistance-nodulation-celldivision)iABC(ATP-bindingcas-
sette)(ryc.1).TransporterynależącedorodzinMF,SMR
iRND,jakoźródłoenergiidoaktywnegoeksportuleków
zkomórkiwykorzystująsiłęprotonomotoryczną.Transport
lekówprzezbiałkaMATEwarunkowanyjestgradientemstę-
żeniajonówNa
+
,natomiastbiałkanależącedorodzinyABC
wykorzystująenergiępochodzącązhydrolizyATP[40].
Transporterylekowemogąmiećszerokąswoistośćsubstra-
towąiodpowiadaćzawyrzutantybiotykównależącychdo
różnychklaslubmogąbyćlekoswoisteieksportowaćkon-
kretną,charakterystycznądladanegobiałka,klasęzwiązków
antybakteryjnych.Genykodującebiałkaodpowiedzialne
zawyrzutlekówmogąwystępowaćzarównonachromo-
somiebakteryjnym,jakinamobilnychelementachgeno-
mu,takichjakplazmidyczytranspozony.
Wzwiązkuzdużąroląsystemówusuwanialekówwwarunko-
waniuwielolekoopornościdrobnoustrojówpotencjalniegroź-
nychdlazdrowialudziizwierząt,staleprowadzonesąbadania
nadichbudową,mechanizmemdziałania,fizjologicznąrolą
wkomórce,jakizwiązkamihamującymiichdziałanie[42].
2. T
ransporT
akTyWny
Opisanewpracysystemyusuwanialekównależądoukła-
dówtransportuaktywnego.Transportaktywnytotermody-
namicznieniesamorzutny,endoergicznystrumieńsubstancji
przechodzącyprzezbłonękomórkowąsprzężonyzprocesem
egzoergicznymdostarczającymenergiidlategotransportu
(np.hydrolizaATP,aleteżbiernetransportyinnychsubstan-
cji).Siłaminapędowymiegzoergicznychbiernychprocesów
transportowychmogąbyćgradientyelektrochemiczneróż-
nychjonów(np.gradientprotonowy,gradientNa
+
).System
tranportującyjednąsubstancjęnazywamyuniportem,nato-
miasttransportysprzężonedwusubstancjimogąbyćsym-
portem(wtymsamymkierunku)lubantyportem(wprzeciw-
nychkierunkach).Systemytransportuaktywnegonazywane
sąpompami,gdyżmogątranslokowaćsubstancjęwokre-
ślonymkierunku(np.wyrzutzkomórki)niezależnieodkie-
runkuichgradientuchemicznegolubelektrochemicznego.
Systemyaktywnegotransportustanowiąbiałkowo-lipidowe
układy(kompleksy)umiejscowionewbłonachkomórko-
wych.Strumieniesubstancjisąwielkościamiukierunkowa-
nymi(wektorowymi).Sprzężenieprocesówukierunko-
wanychzreakcjamichemicznymilubinnymisystemami
transportowyminiemożebyćrealizowanewśrodowisku
izotropowym,wymagaśrodowiskaanizotropowego.Błona
komórkowa,jakomiejscelokalizacjitychukładów,stanowi
barieręmiędzykomórkąijejotoczeniem,atakżetworzy
środowiskoanizotropoweniezbędnedlategosprzężenia
transportuzreakcjąchemicznąlubinnymukierunkowa-
nymtransportem.Opisanesystemytransportowewyrzutu
rozmaitychlekównależądoróżnychgrupzróżnicowanych
podwzględemrodzajówtransportuaktywnegoimechani-
zmówwykorzystaniaenergiidlaichfunkcji.
Różnepodwzględemsprzężeniazegzoergicznymiprocesami
systemytransportowemogąbyćhamowaneinhibitoramiak-
tywnościATP-azowejlubczynnikamirozprzęgającymiwspół-
transport,czylisprzężonytransportdwóchsubstancjiwtym
samymbądźprzeciwnymkierunku(symportlubantyport).
3. s
ysTemy
usuWania
lekóW
z
komórek
bakTerii
G
ram
-
dodaTnich
UbakteriiGram-dodatnichwystępujewieletransporterów
błonowychpromującychusuwanielekuzkomórki,aby
Word count:
6320
Tables:
4
Figures:
1
References:
55
Adres autorki:
dr Ewa Obłąk, Instytut Genetyki i Mikrobiologii, Uniwersytet Wrocławski, ul. S. Przybyszewskiego 63/77, 51-148
Wrocław; e-mail: ewa.oblak@microb.uni.wroc.pl
Wykaz skrótów:
ABC – kaseta wiążąca ATP (ATP-binding cassette); MATE – multidrug and toxic compound extrusion;
MF – major facilitator; MFP – białko łączące błony (membrane fusion protein); MIC – minimalne
stężenie hamujące (minimal inhibitory concentration); OMP – białko błony zewnętrznej (outer
membrane protein); PDR – oporność wielolekowa (pleiotropic drug resistance); QRDR – region
determinujący oporność na chinolony (quinolone-resistance-determining region); RND – resistance-
nodulation-cell division; SMR – small multidrug resistance.
Ryc. 1. Schemat budowy i działania błonowych transporterów lekowych
Jarmuła A. i wsp. – Oporność wielolekowa związana z aktywnym usuwaniem…
217
- - - - -
Electronic PDF security powered by www.IndexCopernicus.com

zapobiecjegoakumulacjiwkomórce,cowkonsekwencji
mogłobydoprowadzićdośmiercibakterii.Białkatrans-
portującelekiubakteriiGram-dodatnichnależądotrzech
niespokrewnionychrodzin:MF(majorfacilitator),SMR
(smallmultidrugresistance)iABC(ATP-bindingcassette)
[26].Ichobecnośćzapewniabakteriomopornośćnawiele
związkówantybakteryjnych,tj.fluorochinolonów,tetracy-
klinorazantybiotykównależącychdorodzinyMLS(ma-
krolidy,linkozamidyistreptograminy).Niektórewłasno-
ścitychbiałekzebranowtabeli1.
3.1. Rodzina MF transporterów błonowych
Wieletransporterówbłonowych,występującychubakte-
riiGram-dodatnich,należydorodzinyMF(majorfacili-
tator).Jesttodużairóżnorodnarodzina.Należącedoniej
transporterybłonowebakteriiGram-dodatnichfunkcjonu-
jąjakojednopodjednostkowapompa[23].Białkateskła-
dająsięzokoło400resztaminokwasowychzorganizo-
wanychw12lub14transbłonowychhelis[4].Pomiędzy
helisą6i7występujedużapętlacytoplazmatycznałączą-
caobiepołowytransportera[5].Transportsubstratuprzez
systemywyrzutunależącedorodzinyMFodbywasięna
zasadzieuniportu,symportuzjednoczesnymwypływem
jonówH
+
lubNa
+
,antyportuzjednoczesnymnapływem
jonówwodorowychlubantyportuzjednoczesnymnapły-
wemsubstancjirozpuszczonej[23].Energiędotranspor-
tubiałkateczerpiązgradientuprotonówpoobustronach
błony[51].Dogronatransporterówleków,należących
dorodzinyMF,zaliczasięm.in.białkoNorA.Występuje
onouStaphylococcus aureusicharakteryzujesięszero-
kąswoistościądlalekówhydrofilnych[4].Genkodujący
białkoNorAznajdujesięnachromosomie,cozapewnia
wrodzonąopornośćtegogatunkunafluorochinolony,ta-
kiejaknorfloksacynaiciprofloksacyna[44].Oporność
uzależnionajestodzwiększeniaekspresjigenunorA,któ-
ramożebyćwynikiemmutacji.Takiezjawiskowystępuje
wopornychnafluorochinolonyszczepachklinicznychS.
aureus,uktórychmutacjawystępujewpromotorzegenu
norA[30].Kolejnymprzykłademtransportera,należącego
dorodzinyMF,jestBmrwystępującyuBacillus subtilis.
Jesttotransporterwielolekowy,homologicznydoNorA.
Ekspresjategobiałkajestregulowanaprzezbiałkoregula-
toroweBmrR.Wswojejstrukturzemaonokieszeń,która
wiążekationyhydrofobowe,aktywująctymsamymeks-
presjębiałkaBmr.Każdadodatnionaładowanacząstecz-
ka,mogącadopasowaćsiędokieszeni,możebyćligan-
demdlaBmrR[38].Badaniawykazały,żetransporterBmr
odpowiadazausuwaniezkomórkiantybiotyków,takich
jakchloramfenikol,puromycynaifluorochinolony[33].
UB. subtiliswystępujerównieżbiałkotransporterowe
Blt,będącehomologiemBmr.Obabiałkamająpodobny
zakressubstratowy,jednakróżniąsiędrogamiekspresji.
Wprzeciwieństwiedogenubmr,bltnieulegaekspresji
uszczepówdzikich[42].UbakteriiGram-dodatnichpo-
wszechniewystępujerównieżtransporterMefA,opisa-
nyuStreptococcus pyogenesorazMefE,występujący
uStreptococcus pneumoniae.Genyobubiałekzidentyfi-
kowanowewnątrztranspozonu,występującegonachro-
mosomie.ZarównobiałkoMefA,jakiMefEmająwąski
zakressubstratowy,ograniczonydomakrolidów.Poznane
dotychczassystemyusuwanialekówzkomórekbakterii
Gram-dodatnichzebranowtabeli2.
DotransporterówzrodzinyMF,występującychuwie-
lubakteriiGram-dodatnich,należądwabiałkapromują-
ceeksporttetracykliny:TetKiTetL.Sąoneprzykładem
transporterówowąskiejswoistościsubstratowej.Obecność
TetLopisanouB. subtitis,natomiastTetKuS. aureus[33].
Przedstawionewyżejdeterminantyopornościnatetracy-
klinysąkodowanechromosomowo,natomiastekspresja
tychbiałekjestregulowanaprzezbiałkoTetR.Regulator
tenmakieszeń,wktórejpolarneaminokwasyizwiązane
cząsteczkiwodytworzągęstąsiećwiązańtetracyklina-Mg
2+
zapomocąwiązańwodorowychisiłvanderWaalsa[38].
Kolejnymprzykłademsystemuusuwanialeków,zaklasyfi-
kowanegodorodzinyMF,jestbiałkoLmrB.Wykazano,że
spontanicznemutantyB. subtilis,opornenalinkomycynę
ipuromycynę,wykazywałypodwyższonąekspresjęgenu
lmrB,występującegowoperoniezgenemlmrA,kodują-
cymprawdopodobniebiałkorepresorowe[42].
Rodzina transporterów
Budowa białka
Zakres substratowy
Źródło energii
MF
około 400 aminokwasów; 12 lub 14
TMS; jednopodjednostkowe
tetracykliny, fluorochinolony,
chloramfenikol, makrolidy,
linkozamidy, streptograminy
siła protonomotoryczna
(gradient pH)
SMR
około 110 aminokwasów; 4 TMS;
występują w postaci tetramerów
chloramfenikol, streptomycyna,
tetracykliny
siła protonomotoryczna
(gradient pH)
RND
około 1000 aminokwasów; 12 TMS;
współdziałają z OMP i MFP
β-laktamy, fluorochinolony,
chloramfenikol, tetracykliny,
makrolidy, sulfonamidy,
aminoglikozydy, erytromycyna
siła protonomotoryczna
(gradient pH)
MATE
około 450 aminokwasów; 12 TMS
aminoglikozydy, fluorochinolony
gradient Na
+
ABC
występuje w postaci kompleksu
wielopodjednostkowego
tetracykliny, fluorochinolony,
chloramfenikol, makrolidy,
linkozamidy, aminoglikozydy,
rifampicyna
hydroliza ATP
Tabela 1. Rodziny systemów usuwania leków z komórek bakteryjnych
Postepy Hig Med Dosw (online), 2011; tom 65: 216-227
218
- - - - -
Electronic PDF security powered by www.IndexCopernicus.com

3.2. Rodzina SMR transporterów błonowych
TransporterynależącedorodzinySMRskładająsięzokoło
110resztaminokwasowychiwswojejstrukturzezawierają
czterysegmentytransbłonowe.Wzwiązkuzniewielkimi
rozmiaramibiałeknależącychdotejrodziny,prawdopodob-
niefunkcjonująonejakokompleksyoligomeryczne[33].
Źródłemenergiidoaktywnegousuwaniasubstratówjest
siłaprotonomotoryczna[23].MimożetransporterySMR
sąwielolekowe,ichzakressubstratowyograniczonyjest
dolipofilnychleków,środkówantyseptycznychidezyn-
fekcyjnych[30].Transporterynależącedotejrodzinypo
razpierwszyopisanouS. aureus,alewystępująrównież
uinnychgronkowców.NależytubiałkoSmr,kodowane
przezgensmr,któryznajdujesięzarównonaplazmidach
koniugacyjnych,jakiniekoniugacyjnych.BiałkoSmrpo-
średniczywwymianielekunaprotonnazasadzieanty-
portu.Analizasekwencyjnaplazmidówujawniłaobecność
takżedwóchinnychbiałek,wdużymstopniuhomologicz-
nychdoSmr,QacGiQacH.PodobniejakSmr,transpor-
terytepromująeksportm.in.:bromkuetydynyiczwarto-
rzędowychsoliamonowych[44].
3.3. Rodzina ABC transporterów błonowych
Kolejnąrodzinątransporterówlekowych,występujących
ubakteriiGram-dodatnich,jestrodzinaABC.Białka
należącedotejrodzinyzbudowanesązczterechdomen:
dwóchdomenNBD(nucleotidebindingdomain)idwóch
TMD(transmembranedomain)[31].TMDwswejstruk-
turzezawierająsześćtransbłonowych
a-helisitworzą
homo-lubheterodimery.DwiedomenyNBDwiążąATP
postroniecytoplazmatycznejiwspółdziałajązdomenami
transbłonowymi[23].
CechąodróżniającątransporteryABCodpozostałychro-
dzinjestźródłoenergiidoaktywnegousuwanialeków,
energiabowiempochodzizhydrolizyATP.Związanieihy-
drolizaATPwywołujezmianykonformacyjnewstruktu-
rzetransportera,cojestniezbędnedoeksportusubstratów.
ZakressubstratowytransporterówABCobejmujetetracykli-
ny,fluorochinolony,chloramfenikol,rifampicynę,makroli-
dy,linkozamidy,aminoglikozydy[55].Białkanależącedo
rodzinyABCrzadkowystępująubakterii.Pierwszympo-
znanymbakteryjnymsystememusuwanialekówjestLmrA
występującyuL. lactis.Transportertenfunkcjonujejako
homodimerimaprzynajmniejdwamiejscawiążącelek[4].
Determinujeopornośćnachloramfenikolorazantybiotyki
MLS.HomologitegobiałkawystępujątakżeuB. subtilis
iS. aureus[33].Badaniawykazały,żeindukowanaopor-
nośćnaerytromycynęistreptograminytypuBzwiązana
jestzprzypuszczalnymmechanizmemusuwanialekówko-
dowanymprzezplazmidowygenmsrA.BiałkoMsrAnale-
żydorodzinyABCjednakniemadomenytransmembra-
nowej.GronkowcemająceMsrAwykazywałyzmniejszoną
System
wyrzutu leków
Rodzina
transporterów
Organizm
Zakres substratowy
NorA
MF
S. aureus
fluorochinolony
Bmr
MF
B. subtilis
chloramfenikol, fluorochinolony, puromycyna
Blt
MF
B. subtilis
chloramfenikol, fluorochinolony
MefA
MF
S. pyogenes
makrolidy
MefE
MF
S. pneumoniae
makrolidy
TetL
MF
B. subtilis
tetracykliny
TetK
MF
S. aureus
tetracykliny
FexA
MF
S. lentus
chloramfenikol, florfenikol
LmrB
MF
B. subtilis
linkomycyna, puromycyna
LmrP
MF
L. lactis
makrolidy, linkozamidy, streptograminy
MdeA
MF
S. aureus
makrolidy, linkozamidy, streptograminy
Smr
SMR
S. aureus
bromek etydyny, czwartorzędowe sole amonowe
LmrA
ABC
L. lactis
chloramfenikol, makrolidy, linkozamidy, streptograminy
Vga A/B
ABC
S. aureus
streptograminy
MsrA
ABC
Staphylococcus spp.
erytromycyna, streptograminy typu B
MsrC
ABC
E. faecalis
makrolidy, streptograminy B
Lsa
ABC
E. faecalis
linkozamidy, streptograminy A
LsaB
ABC
S. sciuri
klindamycyna
Tabela. 2. Systemy usuwania leków z komórek bakterii Gram-dodatnich
Jarmuła A. i wsp. – Oporność wielolekowa związana z aktywnym usuwaniem…
219
- - - - -
Electronic PDF security powered by www.IndexCopernicus.com

akumulacjęerytromycynywkomórce.Jestwięcmożliwe,
żeMsrAwspółpracujezinnymbiałkiem,dostarczającym
niezbędnądomenętransbłonową.Znalezionenamobilnych
elementachplazmidowychgenyvgaAivgaBdeterminu-
jąopornośćnamieszaninęstreptogramintypuAitypuB
uS. aureus[33].Uinnejbakterii,Enterococcus faecalis,
powszechniewystępujechromosomowygenmsrCkodu-
jącydeterminantęopornościnamakrolidyistreptogra-
minyB.E. faecaliswykazujerównieżcharakterystyczną
dlasiebie,wrodzonąopornośćnalinkozamidyistrepto-
graminyA.Zapewniająchromosomowygenlsa,kodują-
cytransporterABC,któryniemadomenytransbłonowej.
BiałkopodobnedoLsaopisanouStreptococcus sciuri.
JesttotransporterLsaBkodowanyprzezDNAplazmido-
weiwarunkującyopornośćtegogatunkunapółsyntetycz-
nyantybiotykzgrupylinkozamidów–klindamycynę[33].
4. s
ysTemy
usuWania
lekóW
z
komórek
bakTerii
G
ram
-
ujemnych
Wzwiązkuzróżnicamiwbudowiemiędzyosłonamiko-
mórekbakteriiGram-dodatnichiGram-ujemnych,różne
sąrównieżsystemyusuwanialekówwystępująceutejgru-
pybakterii.MimożeubakteriiGram-ujemnychwystępują
systemyusuwanialekównależącedowszystkichwspomnia-
nychwcześniejrodzin,najbardziejznacząceicharaktery-
stycznedlatejgrupysątransporterynależącedorodziny
RND(resistance-nodulation-celldivision).
4.1. Rodzina RND transporterów błonowych
TransporteryRND(resistance-nodulation-celldivision)są
szerokorozprzestrzenionewśródbakteriiGram-ujemnych.
Sątopompywielolekowe,kodowanezwykleprzezgeny
chromosomowe[23].TransporteryRNDwspółpracują
zbiałkamiwystępującymiwperyplazmieiwbłonieze-
wnętrznejwtakisposób,żecałysystemwyrzutuleków
składasięztrójczęściowegokompleksu.Pierwsząskłado-
wątegosystemujestbiałkotransporteroweznajdującesię
wbłoniecytoplazmatycznej.Maono12transmembrano-
wychsegmentówlub
a-helis,któremajądwiedużedome-
nycytoplazmatycznemiędzysegmentempierwszymidru-
gimorazmiędzysegmentemsiódmymiósmym.Domeny
tezawierająresztyaminokwasowe,któresąodpowie-
dzialnezarozpoznawaniesubstratu.Działanietranspor-
terówpoleganaantyporciesubstrat-proton.Kolejnączę-
ściąsystemuRNDjestperyplazmatycznebiałkołączące
błony.Białkototworzystrukturępodobnądopierścienia
imadwiedomenyhydrofoboweprzyC-końcuiN-końcu,
któreprawdopodobnieoddziałujązkomponentamibłony
zewnętrznejicytoplazmatycznej.Jegodziałanieopisują
dwamożliwemodele.Pierwszyzakładaoligomeryzację
peryplazmatycznegobiałkałączącegobłonyzbiałkiembło-
nyzewnętrznej,przezcoformowanyjestkanał,którysta-
nowidrogęsubstratuprzezperyplazmę.Funkcjonowanie
białkałączącegobłonywedługdrugiegomodeluodbywa
sięprzezpośrednictwowzestawieniubłonyzewnętrznej
icytoplazmatycznejiutworzeniuszlakutransportusub-
stratu.Białkatesąprawdopodobnieniezbędnewmontażu
ifunkcjonowaniupompRND[43].Ostatniąskładowąjest
białkowykanałbłonyzewnętrznej.Jesttotrimerskładają-
cysięzpołączonychbeczułkowatychstruktur.Jedenkoniec
tworzyporoszerokimotworzeijestosadzonywbłonieze-
wnętrznejkotwiczącdługitunelzbudowanyz12
a-helis,
siegającywperyplazmę.Jestonotwartywstronęczęści
beczułkowatej,azamkniętywkierunkubłonycytopla-
zmatycznej.Zamkniętykoniectunelumożezostaćotwar-
typoprzezruch
a-helis.Takfunkcjonującysystemwyrzu-
tumożeusuwaćantybiotykiprzezbłonęcytoplazmatyczną
isłaboprzepuszczalnąbłonęzewnętrzną.UEscherichia
coliwystępujesiedemznanychtransporterówRND,zcze-
gopięćjestdobrzescharakteryzowanych.Charakterystykę
tychbiałekprzedstawiatabela3.
NajlepiejpoznanyjestsystemAcrAB-TolC,gdzieAcrBto
białkotransporteroweznajdującesięwbłoniecytoplazma-
tycznej,AcrAjestbiałkiemperyplazmatycznym,aTolC
białkiembłonyzewnętrznej[32].TrimerAcrBskładasię
zdomenyperyplazmatycznejidomenytransmembranowej.
Wyższaczęśćdomenyperyplazmatycznejwchodziwin-
terakcjezTolC.Domenaperyplazmatycznaodgrywade-
cydującąrolęwdeterminowaniuswoistościsubstratowej.
Transportowanylekjestwiązanydokieszeniznajdującej
sięwcentrumtrimeruAcrB,jednakkażdyzrozpoznawa-
nychlekówoddziałujezinnymiresztamiaminokwasów.
TolCtobiałkowielofunkcyjne,któredziękikrótkotrwałym
interakcjomztransporteremlekowymindukowanymobec-
nościąsubstratu,możesięchwilowootwieraćiprzenosić
lekioniewielkiejmasieorazdużepolipeptydowetoksy-
ny.TolCmastrukturętrimeryczną–trzycząsteczkiTolC
formującylindrycznykanał.Koniecodstronybłonyze-
wnętrznejjestotwarty,akoniecperyplazmatycznyzwęża
się.ZamykaniekanałuTolCzależym.in.odpH[4].Geny
System wyrzutu leków
Komponenty systemu
Zakres substratowy
MFP
RND
OMP
AcrAB-TolC
AcrA
AcrB
TolC
β-laktamy, erytromycyna, chloramfenikol,
fluorochinolony, tetracykliny, nowobiocyna, linezolid
AcrD
AcrA
AcrD
TolC
aminoglikozydy, nowobiocyna
AcrEF
AcrE
AcrF
TolC
fluorochinolony, tetracykliny, linezolid, trimetoprim
YhiUV
YhiU
YhiV
TolC
doksorubicyna, nowobiocyna, erytromycyna
MdtABC
MdtA
MdtB/MdtC
TolC
nowobiocyna, β-laktamy
Tabela. 3. Systemy usuwania leków z rodziny RND występujące u E. coli
Postepy Hig Med Dosw (online), 2011; tom 65: 216-227
220
- - - - -
Electronic PDF security powered by www.IndexCopernicus.com

acrAiacrBleżąwjednymoperonieiekspresjonowane
razemodpowiadajązaopornośćnabarwniki,detergenty
iantybiotyki.Substratamitegosystemusątakielekijak:
chloramfenikol,
b-laktamy,makrolidyifluorochinolony.
SkładanieAcrA,AcrBiTolCwfunkcjonalnąpompęna-
stępujewzależnościodobecnościsubstratu.Innymsys-
tememusuwanialekówuE. colijestAcrD,któryekspor-
tujenowobiocynęiaminoglikozydy,jednakdosprawnego
funkcjonowaniawymagaobecnościAcrAiTolC.System
AcrEFniewystępujeuorganizmówdzikich,tylkoumu-
tantówopornychnafluorochinolony,któreniemająsys-
temuAcrAB.BiałkoAcrFwspółdziałazAcrAiTolC.
ZwiększonaekspresjagenówsystemuYhiUVpowoduje
opornośćtegogatunkunadoksorubicynęierytromycynę.
YhiUVjesthomologiemAcrAB.Kolejnymkompleksem
promującymeksportlekówuE. colijestMdtABC.Jestto
system,zawierającydwaróżnetransportery:MdtBiMdtC
iobecnośćichobujestkoniecznadosprawnegodziałania.
Substratamidlatychtransporterówjestnp.nowobiocyna
[23].Wszystkiewyżejwymienionesystemywspółdziała-
jązbiałkiemTolC.
Kolejnymorganizmem,uktóregowystępujewieleróż-
nychtransporterówRNDjestPseudomonas aueruginosa.
Maonokołodwanaściepomp,zczegosiedemzostałodo-
tychczasscharakteryzowanych(tabela4).Pierwsząznich
jestsystemMexAB-OprM,gdzieMexAtobiałkoperypla-
zmatycznełączącebłony,MexBjesttransporteremRND,
aOprMbiałkiembłonyzewnętrznej.Jesttosystem,które-
gotransporterymająnajszerszyzakressubstratowyutego
gatunku.Substratamidlatejpompymogąbyć
b-laktamy,
chinolony,makrolidy,tetracyklina,chloramfenikol,no-
wobiocyny,sulfonamidy,trimetoprim,tiolaktomycyna.
SystemMexCD-OprJwystępujeuszczepówP. aeruginosa
mającychmutacjęnfxB.MutantynfxBdzieląsięnadwie
grupy:AiB.MutantytypuAopornesąnaofloksacynę,
erytromycynęiniektórenowecefalosporyny(np.cefsulo-
dyna),amutantytypuBdodatkowojeszczenatetracyklinę
ichloramfenikol.Kolejnymmechanizmemeksportuleków
utegogatunkujestMexEF-OprN.Systemtenwystępuje
tylkouszczepówmającychmutacjęnfxC.Zapewniaimto
opornośćnafluorochinolony,tetracyklinę,chloramfenikol
itrimetoprim.WprzeciwieństwiedoMexAB-OprM,syste-
myMexCd-OprJorazMexEF-OprNniesąodpowiedzialne
zaopornośćna
b-laktamy.Działanietegosystemuwspo-
maganejestzmniejszonąekspresjąoprD–genukodują-
cegobiałkoporynowebłonyzewnętrznej,którejestgłów-
nymkanałemimipenemu.Mutanty,uktórychbraktego
białkasąniewrażliwenatenantybiotyk.OperonmexXY,
wprzeciwieństwiedowyżejwymienionychsystemów,
niemaotwartejramkiodczytudlagenukodującegobiał-
kobłonyzewnętrznej.ZamiasttegowykorzystujeOprM
jakokomponentbłonyzewnętrznej.DelecjagenówmexXY
skutkujezwiększonąprzepuszczalnościądlaaminogliko-
zydów,tetracyklinyierytromycyny.Ekspresjatychgenów
uE.colipowodujeopornośćnafluorochinolony,mimoże
uP. aeruginosanieprzyczyniasiędowrodzonejoporności
nateleki.MexJKjestsystemem,dlaktóregosubstratami
jesttriklosan,erytromycynaitetracyklina.Dotransportu
erytromycynyitetracyklinyMexJKwymagaobecnościbiał-
kabłonyzewnętrznejOprM,adoeksportutriklosanuwy-
korzystujebiałkoOpmH.Kolejnymmechanizmemekspor-
tulekówuP. aeruginosajestMexGHI-OpmD.Składasię
onzperyplazmatycznegobiałkałączącegobłony(MexH),
transporteraRND(MexI)ikanałubiałkowegobłonyze-
wnętrznej(OpmD).Wsystemietymwystępujedodatkowo
małebiałkointegralnebłony–MexG,któregorolaniezo-
stałajeszczepoznana.Mechanizmtenzapewniaoporność
nanorfloksacynę.MexVWwspółpracujezOprMijestod-
powiedzialnyzaeksportfluorochinolonów,tetracykliny,
chloramfenikoluierytromycyny.UNeisseria gonorrhoeae
występujesystemMtrCDE,gdzieMtrCjestbiałkiempe-
ryplazmatycznym,MtrDjesttransporteremRND,aMtrE
białkiembłonyzewnętrznej.ObecnośćMtrCiMtrEjest
koniecznadotransportuerytromycyny,penicylinyikwa-
sówtłuszczowych.Ichinaktywacjapowodowaławzrost
wrażliwościnatezwiązki[23].Burkholderia cepacia,
którajestpatogenemroślinioportunistycznympatogenem
ludzkimmasystemCeoAB-OpcM.Jestonhomologiem
MexAB-OprMipromujeaktywneusuwaniechloramfe-
nikolu,fluorochinolonówitrimetoprimu.Innyprzedsta-
wicieltegorodzaju,Burkholderia pseudomallei,madwa
System wyrzutu leków
Komponenty systemu
Zakres substratowy
MFP
RND
OMP
MexAB-OprM
MexA
MexB
OprM
β-laktamy, fluorochinolony, chloramfenikol,
makrolidy, tetracyklina, sulfonamidy, nowobiocyna
MexCD-OprJ
MexC
MexD
OprJ
cefsulodyna, nowobiocyna, fluorochinolony,
chloramfenikol, erytromycyna, tetracykliny
MexEF-OprN
MexE
MexF
OprN
fluorochinolony, chloramfenikol, trimetoprim,
tetracykliny
MexXY
MexX
MexY
OprM
tetracyklina, erytromycyna, aminoglikozydy
MexJK
MexJ
MexK
OprM/OpmH
erytromycyna, tetracykliny, triklosan
MexGHI-OpmD
MexH
MexI
OpmD
norfloksacyna
MexVW
MexV
MexW
OprM
fluorochinolony, tetracykliny, chloramfenikol,
erytromycyna
Tabela. 4. Systemy usuwania leków z rodziny RND u P. aeruginosa
Jarmuła A. i wsp. – Oporność wielolekowa związana z aktywnym usuwaniem…
221
- - - - -
Electronic PDF security powered by www.IndexCopernicus.com

systemywyrzutu:AmrAB-OprAorazBpeAB-OprB.Oba
nadająopornośćtejbakteriinaaminoglikozydyiwmniej-
szymstopniunamakrolidy.Dwamechanizmyeksportu
lekówwystępująrównieżuinnejbakteriiGram-ujemnej,
Stenotrophomonas maltophila.PierwszyznichtoSmeABC,
jednaktylkoSmeCwarunkujeopornośćna
b-laktamy,
aminoglikozydyifluorochinolony.Sugerujeto,żeSmeC
możebyćczęściąinnej,niezidentyfikowanejjeszczepom-
py.DrugimmechanizmemjestSmeDEF,dlaktóregosub-
stratamisąmakrolidy,fluorochinolony,chloramfenikol,te-
tracyklinaierytromycyna[23].Serratia marcescensma
trzymechanizmyRND,zapewniającewieloantybiotykową
oporność.SdeABodpowiadazausuwaniefluorochinolo-
nów,chloramfenikolu,barwnikówidetergentów,natomiast
SdeCDEiSdeXYeksportująnorfloksacynęitetracykli-
nę[4].UHaemophilus influenzaewystępujetrójgenowa
grupakodującaHIO893,HIO894iHIO895.Dysrupcja
(zniszczenie)genówHIO894iHIO895powodujewzrost
wrażliwościnaerytromycynę,rifampicynę,nowobiocyny,
SDSibarwnikikationowe.Acinetobacter baumanniima
dwasystemyusuwanialeków:AdeABC,którychobecność
warunkujeopornośćnaaminoglikozydy,fluorochinolony,
chloramfenikol,tetracyklinę,erytromycynęitrimetoprim,
natomiastekspresjaAdeDEpowodujespadekwrażliwo-
ścinaamikacynę,ceftazidim,chloramfenikol,ciproflok-
sacynę,erytromycynę,meropenem,rifampinitetracyklinę
[23].Salmonella entericaserotypTyphimuriumoporność
nafluorochinolony,tetracykliny,chloramfenikol,karbeni-
cylinęicefoksytynęzawdzięczaobecnościsystemuAcrAB
[42].MechanizmAcrAB-TolCwystępujeteżuEnterobacter
aerogenes,Klebsiella pneumoniaeiKlebsiella oxytoca
iwarunkujeopornośćnafluorochinolony,chloramfeni-
kolitetracyklinę.UCampylobacter jejuniobecnesądwa
mechanizmyusuwanialeków:CmeABC,odpowiedzial-
nyzaopornośćnafluorochinolony,solekwasówżółcio-
wych,bromeketydynyimetaleciężkieorazCmeDEF[23].
4.2. Rodziny MF, MATE, SMR i ABC transporterów
błonowych
UbakteriiGram-ujemnychwystępująbiałkatransportujące
lekinależącedokażdejzgłównychrodzin.Transporteryte-
tracyklinysąwwiększościbiałkamirodzinyMF.Systemy
usuwanialekówsąprzeważającymmechanizmemwarun-
kującymopornośćnatezwiązki.Występująukilkunastu
organizmówm.in.:Shigellaspp.,Salmonellaspp.,E. coli,
Chlamydia,Helicobacter pylori,alebrakichnaprzykład
uCampylobacterczyNeisseriaspp.BiałkaTetzapew-
niająopornośćnatetracyklinę,oksytetracyklinęichlor-
tetracyklinę[43].BadaniawykazałyobecnośćuE. coli
dwóchotwartychramekodczytu:emrAiemrB.Pierwsza
znichkodujebiałkotransporterowenależącedorodzi-
nyMF,adrugabiałkoperyplazmatycznełączącebłony.
Transportertenwspółdziałazbiałkiembłonyzewnętrz-
nejTolC.SystemEmrABzapewniaopornośćnaanty-
biotykihydrofobowe.Znaczącąhomologięzsystemem
EmrABwykazujeVceABwystępującyuVibrio cholerae.
Obecnośćtegotransporterawarunkujeopornośćnaróż-
netoksycznezwiązkinp.deoksycholanyorazantybioty-
ki:kwasnalidyksowyichloramfenikol[44].MdfAwystę-
pującyuE. colirównieżnależydorodzinyMFipromuje
wyrzutchloramfenikoluzkomórki.MdfAjestprzykładem
transportera,którynadajeopornośćnajednągrupęzwiąz-
ków,alezwiększawrażliwośćnadrugą.HomologiMdfA
obecnesąuwielubakteriiGram-ujemnych,np.CmlA
występującyuP. aeruginosa.Jegoobecnośćwarunku-
jeopornośćnachloramfenikoliflorfenikol.Zopornością
naobatezwiązkizwiązanejestrównieżbiałkokodowa-
neplazmidowoprzezgenpp-flowystępująceupatogenu
rybPasteurella piscicida.Prawieidentycznygenflo
St
jest
obecnyuSalmonella entericaserowarTyphimuriumirów-
nieżwarunkujeeksportchloramfenikoluiflorfenikolu[30].
DorodzinySMRnależym.in.transporterEmrEwystępu-
jącyuE. coli.Jesttohomooligomer,złożonyprawdopo-
dobnieztrzechmonomerów[7].Warunkujeopornośćna
tetracyklinęibromeketydyny.Jegodziałaniepolegana
tym,żepozwiązaniulekudwieztrzechresztGluoddają
proton.Wtedytransporterulegazmianomkonformacyj-
nym.Miejscewiązaniazamykasięiotwierapodrugiej
stroniebłony.Uwolnienielekukatalizowanejestprzez
dwaprotony.UbakteriiGram-ujemnychwystępujątakże
transporterynależącedorodzinyMATE.Usuwanieleku
jestwtymprzypadkupołączoneznapływemNa
+
doko-
mórki.PrzedstawicielemtejklasybiałekjestNorMwy-
stępującyuVibrio parahaemolyticus.Determinujeopor-
nośćnabarwniki,fluorochinolonyiaminoglikozydy[4].
JegohomologYdhEpromujeeksporttychsamychzwiąz-
kówiwystępujeuE. coli.Innymitransporteramitejro-
dzinysąHmrMuHaemophilus influenzaeorazPmpM
uP.aeruginosa.Ichobecnośćwarunkujeopornośćnaflu-
orochinolony,detergentyibarwniki[43].DorodzinyABC
należym.in.MacAB-TolC.Jesttojedynyznanysystem
usuwanialekówztejrodziny,kodowanyprzezgenychro-
mosomoweubakteriiGram-ujemnych,którydziałarazem
zperyplazmatycznymbiałkiemłączącymbłonyibiałkiem
błonyzewnętrznej.WystępujeuE. coliijestswoistydla
eksportumakrolidów[44].Transporteremnależącymdo
rodzinyABCjestEC-MsbAwystępującyuE. coli,który
eksportujelipidy.Funkcjonujejakohomodimerokształ-
ciestożka,gdziedomenywiążącenukleotydznajdująsię
przypodstawie.Każdymonomerskładasięzsześciu
a-
helis,którezapewniająwejścieiwyjściekanałupostro-
niewewnętrznejizewnętrznejbłony[4].
5. r
eGulacja
ekspresji
sysTemóW
WyrzuTu
lekóW
Ekspresjatransporterówbłonowychpromującycheks-
portlekówzkomórekmusipodlegaćścisłejkontroli.
Mechanizmyprowadzącedonadekspresjisystemówusu-
wanialekówdziałająnaróżnejzasadzie.Większośćsyste-
mówRNDznajdujesiępodkontroląlokalnegorepresora
[44].AcrR,podobniejakwieleinnychrepresorów,nale-
żydorodzinyrepresorówTetR.Wszystkiebiałkarepre-
sorowepodobnedoTetRdziałająnapodobnejzasadzie.
Represorwiążesiędooperatora,cozapobiegaekspresji
transportera.Powodujetopodatnośćkomórkibakteryjnej
natoksycznesubstancje.Jednakgdyzwiązekpasującydo
profilusubstratowegoznajdziesięwkomórce,wiążesię
dorepresora,coumożliwiaekspresjęiwytwarzaniebia-
łektransporterowych.Kontrolaekspresjisystemówwyrzu-
tulekówmożesięrównieżodbywaćnazasadzieregulacji
pozytywnejdziękiaktywatoromtranskrypcji.Przykładem
jestregulacjaoperonumexEF-oprNprzezlokalnyaktywa-
torMexT.GenmexTznajdujesiępowyżejgenówsystemu
usuwanialekówMexEF-OprNiulegatranskrypcjiwtym
samymkierunkucomexEF-oprN.NadekspresjaMexTin-
dukujeekspresjębiałektransporterowych[43].Ekspresja
operonuMexEF-OprNregulowanajestrównieżprzez
Postepy Hig Med Dosw (online), 2011; tom 65: 216-227
222
- - - - -
Electronic PDF security powered by www.IndexCopernicus.com

produktgenumexS,któryjestrepresoremtegooperonu.
MutacjewgeniemexSpowodująwzrostekspresjigenów
operonumexEF-oprN[25].Lokalnyminduktoremjest
równieżbiałkoBmrR,występująceuB. subtilisiaktywu-
jącetranskrypcjętransporteraBmr[30].Innymmechani-
zmemkontroliekspresjibiałektransporterowychsąmuta-
cjewgenachkodującychglobalneregulatory.Przykładem
mogąbyćgenysoxRimarRwystępującem.in.uE. coli
iS. enterica.Mutacjewtychgenachprowadządoichnad-
ekspresji,copowodujeaktywacjętranskrypcjiacrAB[42].
Pozytywnejregulacjiprzezglobalneregulatorypodlegają
równieżm.in.:systemyMexuP. aeruginosaorazBmriBlt
uB. subtilis[30].Innymmechanizmemkontroliekspresji
genówkodującychtransporterylekowesąmutacjewre-
gioniepromotoratychgenów.Badaniawykazały,żemu-
tacjew+5nukleotydziemRNAkodującegosystemnorA
uS. auerusprowadziłydonadekspresjitegosystemu[42].
Wwieluprzypadkachekspresjagenówkodującychbiałka
transporterowezwiększasię,gdywśrodowiskuznajduje
sięsubstratdanegobiałka.Wielolekooporneszczepykli-
niczneczęstosąotrzymywanepodczasstosowaniaterapii
antybakteryjnych.Niektórezlekówsąszczególnieistot-
newpowstawaniuiselekcjimutantówopornychnaanty-
biotykiichemioterapeutyki.Najlepiejzbadanągrupąśrod-
kówantybakteryjnychwzwiązkuzselekcjąlekoopornych
mutantówsąfluorochinolony.Badaniawykazały,żeopor-
nośćindukowanadziałaniemfluorochinolonówpowstaje
dziękimutacjomwdomenieQRDR(quinolone-resistan-
ce-determiningregion).Fluorochinolonytosubstancjesyn-
tetyczne,adocelowymmiejscemichdziałaniajestgyraza
DNA,costwarzałoogromnąszansęskutecznegoleczenia
infekcjibakteryjnych.Jednakokazałosię,żedziałanietymi
chemioterapeutykaminakomórkibakteryjnepowodowa-
łozwiększonewytwarzanietransporterówlekowych,po-
nieważjesttojedynymechanizmzapewniającybakteriom
opornośćnafluorochinolony.Możliwerównież,żezwiąz-
kiteniszcząbakteryjneDNAiinicjująwłączeniesystemu
naprawyDNA,copomagawselekcjonowaniumutantów
opornychnafluorochinolony.Przykładembakterii,która
wystawionanadziałaniefluorochinolonówzwiększaławy-
twarzanietransporterówjestP. aeruginosa.Wzależności
odużytegolekupowstałyróżnefenotypy.Naprzykładpo
zadziałaniukwasemnalidiksowymwyselekcjonowanezo-
stałymutantytypunal,natomiastnorfloksacynapowodo-
wałageneracjęmutantówtypunfx.Badanianadselekcją
lekoopornychmutantówP. aeruginosain vitrowykazały,
żeczęstodochodziłodogenerowaniamutantówpoprzez
działanienadzikieszczepy,takimiśrodkamiantybakteryj-
nymijak
b-laktamy(zwłaszczakarbenicylina),tetracykli-
na,chloramfenikolczyaminoglikozydy.Induktoramipo-
wstawaniawielolekoopornychmutantówmogąbyćrównież
środkiantyseptyczne,takiejaktriklosan[30].
6. n
aTuralne
funkcje
TransporTeróW
lekoWych
Mimoogromnejroliwwarunkowaniuopornościnaanty-
biotykiichemioterapeutyki,fizjologicznefunkcjetrans-
porterówbłonowychsąprawdopodobnieowielebardziej
złożone.Bardzoważnąrolęspełniająonewtransporciesub-
stancjiszkodliwych,cozapewniaprzetrwaniewniesprzy-
jającymśrodowisku.Wprzypadkubakteriijelitowych,ich
naturalneśrodowiskobytowaniabogatejestwżółćisole
kwasówżółciowych.Sątonaturalnesubstancjeodzia-
łaniuantymikrobiologicznym,występującewukładzie
pokarmowymptakówissaków,dlategoteżnaturalnami-
kroflorajelitowamusimiećmechanizmyochronyprzed
tymisubstancjami.Ochronętakązapewniająbiałkaeks-
porterowe,którezjednejstronyzapobiegająakumulacji
solikwasówżółciowych,azdrugiejpromująwydzielanie
metabolitówzkomórkibakteryjnej.Rolęwzwiększaniu
tolerancjinażółćisolekwasówżółciowychwykazanoba-
dającmutantyE. coli,S. entericaserowarTyphimurium
orazCampylobacter jejuni.Delecjekomponentówsyste-
muAcrAB-TolClubCmeABCskutkowaływzwiększonej
przepuszczalnościosłonkomórkowychdlasolikwasówżół-
ciowych.Natomiastmutantywykazującenadekspresjębia-
łekwyrzutubyłyopornenadużestężeniażółci.UE.coli
ekspozycjanasolekwasówżółciowych,takiejakcheno-
deoksycholanitaurocholanindukowałaaktywacjęsyste-
mówAcrABiEmrAB,natomiastwprzypadkuS. enteri-
caserowarTyphimurium,wystawienienadziałanieżółci
uaktywniałomechanizmAcrAB[42].Wieleróżnychfunk-
cjimająsystemynależącedorodzinyRND.Sąonebardzo
ważnedlapatogennościbakteriiiprzetrwaniawichniszy
ekologicznej.UP. aeruginosamechanizmMexAB-OprM
odpowiadazaeksportkilkunastuczynnikówwirulencjina
zewnątrzkomórki.Szczepywykazującenadekspresjętego
mechanizmucharakteryzowałysięmniejszązdolnościąwi-
rulencji,spowodowanązwiększonymeksportemczynników
wirulencji.FunkcjonowaniesystemuMtrCDEuNeisseria
gonorrhoeaezapewniaprzetrwaniewobecnościhydrofo-
bowychsubstancjiśluzówkowychwdrogachrodnych[42].
SystemyIefABCuAgrobacterium tumefaciensorazAcrAB
uErwinia amylovorapełniąistotnąrolęwwirulencjiiko-
lonizacjiroślin.Pompyteeksportująizoflawonoidyiza-
pewniająopornośćnafitoaleksyny.Podczasbadańhodowli
tkankowychwykazano,żeskładnikipompRNDsąbardzo
istotnewinwazji,adhezjiikolonizacjikomórekgospo-
darzaprzezbakterie.MutantyP. aeruginosaznieaktyw-
nymgenemmexBniemiałyzdolnościkolonizacjikomó-
rek.SzczepyS. entericaserowarTyphimuriumzdelecją
genutolCwykazywałysłabsząadhezjędoludzkichkomó-
rekjelitacienkiego,mysichmonocytóworazniebyłyzdol-
nedoinwazjimakrofagów[43].Systemyusuwanialeków
prawdopodobnieodgrywająteżrolęwquorum-sensing.
Obecnośćtransporterówpromujeeksportcząsteczeksy-
gnalnychdokontaktukomórka-komórka.Nawydzielanie
sygnalnegochinolonuPQSprzezP. aeruginosawpływa
nadekspresjasystemuMexEF-OprN.BiałkoSdiA,będące
regulatoremquorum-sensinguE. coli,jestpozytywnym
regulatoremsystemuAcrAB-TolC.Badaniawykazały,że
istniejezwiązekmiędzyobecnościąsystemuAcrAB-TolC
uE. coliatransportemwapnia[23].
7. i
nhibiTory
TransporTeróW
WielolekoWych
Wzwiązkuzdużymwpływemsystemówusuwanialeków
wwarunkowaniuwielolekooporności,koniecznejestza-
stosowanieśrodkówhamującychdziałanietransporterów
lekowych.Wprzeciąguostatnichlatzidentyfikowanowie-
lezwiązkówbędącychinhibitoramitransporterówwielole-
kowychwystępującychubakteriiGram-dodatnichiGram-
ujemnych.Wieleznichzostałowyizolowanychzroślinlub
mikroorganizmów.
Badaniadotycząceinhibicjipompwielolekowychwystę-
pującychubakteriiGram-dodatnichprowadzonogłów-
nienawielolekoopornychszczepachS. aureus.Związki
Jarmuła A. i wsp. – Oporność wielolekowa związana z aktywnym usuwaniem…
223
- - - - -
Electronic PDF security powered by www.IndexCopernicus.com

działającehamująconatransporterylekowepochodzą
główniezeźródełnaturalnych.Przykłademjestrezerpi-
na,alkaloidroślinnyporazpierwszywyizolowanyzko-
rzeniRauwolfia vomitoria[50].Działaonahamującona
białkoBmr,będącetransporteremlekowymuB. subtilis.
Badaniawykazały,żerezerpinaoddziałujebezpośrednio
zbiałkiemBmr,wiążącsiędokieszeniutworzonejprzez
fenyloalaninę143,walinę286ifenyloalaninę306[42].
Alkaloidtenwzmacniarównieżdziałanietetracykliny,cze-
godowodembył4-krotnyspadekMICwizolatachklinicz-
nychS. aureusmającychbiałkaTetKpromująceeksport
tetracykliny[50].Rezerpinahamujerównieżtransporter
NorA,obecnyuS. aureus,przezwzmocnieniedziałania
norfloksacyny[42].Kolejnyminhibitoremjestflawono-
lignan5’-MHC-D(5’-metoksyhydrokarpin-D).Wpołą-
czeniuzberberyną,któranaturalniewykazujeniewiel-
kiewłaściwościantybakteryjne,obserwowano16-krotny
wzrostdziałaniaantybakteryjnegoberberynyprzeciwko
S. aureus.Równieżzastosowanieniektórychmetabolitów
fenolowychwzmacniałodziałaniezarównoberberynyjak
itetracyklinyierytromycyny.Przykłademmożebyćchal-
kon,któryredukowałMICdotegostopnia,żebyłonpo-
równywalnyzwartościąMICdlamutantówS. aureusnie-
mającychbiałkaNorA.Innymifenolowymimetabolitami
sąestrykwasugalusowego.EGCG(galusanepigallokate-
chiny)wzmagadziałanietetracyklinyuszczepówS. aureus
mającychbiałkaTetK.Badaniameksykańskichgatunków
„MorningGlory”doprowadziłydoizolacjitrzecholigo-
sacharydów(orizabinXIX,XViIX),którewzmacniają
aktywnośćnorfloksacynywzględemszczepówS. aureus
charakteryzującychsięzwiększonąekspresjątransporte-
rówNorA.Kolejnyminhibitoremtransporterówlekowych
jestpiperyna,alkaloidroślinnywyizolowanym.in.zpie-
przuczarnego.Badaniawykazały,żezwiązektenzwięk-
szaakumulacjęciprofloksacynyipowoduje2-krotnyspa-
dekMICdlategochemioterapeutyku.Aktywnośćbiałek
transportującychlekihamujerównieżbaikaleina.Jestto
flawonoidwyizolowanyzliściThymus vulgaris.Wykazuje
silnedziałaniezwiększającekoncentracjętetracyklinyoraz
niektórych
b-laktamów(ampicylinyioksacyliny)wko-
mórceszczepówS. aureusopornychnametycylinę[50].
Badaniadotyczącemechanizmówusuwanialekówwystępu-
jącychubakteriiGram-ujemnychdoprowadziłydoodkrycia
iprodukcjiśrodkówwpływającychhamująconatranspor-
terylekowe.Dużąrodzinęinhibitorówbiałekeksportują-
cychlekistanowiąpeptydomimetyki.Pierwszymzidenty-
fikowanymśrodkiemhamującymtransporterylekowebył
PA
bN(fenyloalanylo-arginylo-naftyloamid),inaczejzwany
MC-207,110.Związektenzwiększaprzepuszczalnośćle-
wofloksacynyuróżnychszczepówP. aeruginosa,alerów-
nieżmożewzmagaćdziałanieinnychantybiotyków,takich
jakchloramfenikolczymakrolidy.PA
bNpasujedoprofilu
substratowegosystemówwyrzutulekówiwspółzawodni-
czyzantybiotykiemomiejscewiązanialeku.Dużympro-
blememwprzypadkuużyciategoinhibitorawterapiian-
tybakteryjnejjestjegoznacznatoksyczność.Jestjednak
używanywlaboratoriachdobadańnadinhibicjątranspor-
terówlekowych.Kolejnąklasązwiązkówhamującychsys-
temyusuwanialekówsąpochodnechinolonów.Badania
wykazały,żezwiązkitewzmagajądziałanieantybiotyków
należącychdoróżnychrodzin,poprzezzwiększenieich
akumulacjiwkomórce.Pochodnechinolonówsąaktyw-
newzględemtransporterówwielolekowychobecnychuE.
aerogenesiK. pneumoniae.Obagatunki,pozastosowaniu
tychinhibitorów,stawałysięwrażliwenachloramfenikol,
tetracyklinęinorfloksacynę,niewykazanojednakdziała-
niaprzeciwkosystemowiMexAB-OprMwystępującego
uP.aeruginosa.Mimodokładniezbadanejaktywnościpo-
chodnychchinolonówprzeciwkotransporteromwieloleko-
wym,wciążtrwająbadaniazwiązaneztoksycznościątych
środków.Innyminhibitoremtransporterówwielolekowych
jestarylopiperydyna,którawspomagaakumulacjęlinezo-
liduwkomórceE. coli.Zkoleiinhibitorynależącedoro-
dzinyarylopiperazynhamujądziałanietransporterówRND.
PrzykłademjestNMP(N-metylopirolidon),któryzwięk-
szawewnątrzkomórkowąkoncentracjęróżnychzwiązków
antybakteryjnych,m.in.:fluorochinolonów,chloramfeniko-
luilinezolidu.Jestonaktywnywobectransporterówleko-
wychwystępującychuAcinetobacter baumannii,rodziny
Enterobacteriaceae(zwyjątkiemrodzajuSerratiaspp.),
jednaknieobserwowanoaktywnościwobectransporterów
P. aeruginosa.Związkinależącedorodzinyarylopipery-
dyniarylopiperazynsąjednakzbyttoksyczne,abystoso-
waćjewleczeniuludziizwierząt[33].
Mimoistnieniatakwieluzwiązkówdziałającychhamu-
jąconasystemywyrzutuleków,żadenznichniezostał
wprowadzonydoużyciawmedycynieiweterynarii.Ze
względunapotencjalnelubrealnezagrożenietychśrod-
kówdlazdrowiakoniecznejestprzeprowadzeniejeszcze
wielubadańdotyczącychtoksycznościinhibitorówbakte-
ryjnychtransporterówlekowych.
8. T
ransporTery
WielolekoWe
u
GrzybóW
Opornośćwielolekowadrobnoustrojówstanowipoważny
problemkliniczny.Zarównobakterie,jakigrzybywyko-
rzystująróżnemechanizmyobronyprzedantybiotykami
ifungicydami.Ugrzybówgłównymmechanizmemopor-
nościjestaktywnyeksportlekówzkomórkizapomocąbia-
łektransportującychznajdującychsięwbłoniekomórko-
wej.BadaniaprzeprowadzonenadrożdżachSaccharomyces
cerevisiaewykazały,żezawyrzutlekówzkomórekgrzy-
bówodpowiadajągłówniebiałkanależącedorodzinyABC.
8.1. Transportery ABC występujące u drożdży
Saccharomyces cerevisiae
CałkowitasekwencjagenomuS. cerevisiaezostałaopubli-
kowanaw1996roku[13].Drożdżepiekarniczebyłypierw-
szymorganizmemeukariotycznym,dlaktóregowykona-
noanalizęsekwencjigenomuwceluwyszukaniagenów
wszystkichpotencjalnychtransporterówABC.Wykazano
istnienie30potencjalnychgenówtransporterówABC.
Wśródwyszukanychbiałekznalazłysie22transportery
ABCmającedomenyNBDiMSDi8białekmającychtylko
sekwencjeNBD.Wśróddrożdżowychtransporterówwy-
różniono5podrodzin:PDR,MDR,ALDP,MRP/CFTR,
YEF3iRLI[3,9,34].BiałkaABCudrożdżysązlokali-
zowanewbłonachkomórkowej,wakuoli,mitochondriów,
peroksysomówicytoplazmie.
Białkaodpowiedzialnezawielolekoopornośćnależądo
podrodzinyPDR(pleiotropicdrugresistance).Wszystkie
białkatejpodrodzinytoklasycznepełnetransporteryzbu-
dowanezdwóchdomenNBDiTMD,umiejscowione
wbłoniekomórkowej.Odpowiedzialnesązakatalizowanie
Postepy Hig Med Dosw (online), 2011; tom 65: 216-227
224
- - - - -
Electronic PDF security powered by www.IndexCopernicus.com

zależnegoodATPtransportuzwiązkówzcytoplazmyna
zewnątrzkomórki.ZaliczanedoniejtransporteryPdr5p
iSnq2pnależądonajlepiejpoznanychspośródbiałekABC.
Pdr5piSnq2ptobiałkalokalizującesięwbłoniekomór-
kowejdrożdży,mająceszerokizakressubstratowy,obej-
mującyantybiotyki,fungicydy,detergenty,jonoforyileki
przeciwnowotworowe[45].GenPDR5niejestniezbędny
dożyciakomórki,jegodelecjapowodujejednakhiper-
wrażliwośćkomóreknawieleinhibitorów.Wynikibadań
wskazują,żePdr5pjestgłównymmediatoremoporności
komórekdrożdżynaazole,powszechniestosowaneśrodki
grzybobójcze.WśródsubstratówPdr5pznalazłysierów-
nieżlekiprzeciwnowotworoweiludzkiehormonystero-
idowe.SzczepyzusuniętymgenemPDR5sąwięcwyko-
rzystywanewprojektachdotyczącychbadańtoksycznego
działaniazwiązkównakomórkidrożdży[10,22].Bliskim
homologiemPDR5jestnależącydotejsamejpodrodziny
genSNQ2(sensitivityto4nitroquinolineoxide).Początkowo
błonowebiałkoSnq2pzostałoscharakteryzowanejakona-
dającekomórkomopornośćnaN-tlenek4-nitrochinoliny
(4NQO)wpóźniejszychbadaniachwykazano,żeusunię-
ciegenuSNQ2powodujehiperwrażliwośćkomórekdroż-
dżynakilkadziesiątróżnychinhibitorów[11,21].
Zwielolekowąopornościąkomórekzwiązanejestrównież
białkoPdr12p.TransporterPdr12pzidentyfikowanojako
nadającykomórkomopornośćnasłabekwasyorganiczne.
Pdr12pjestumiejscowionywbłoniekomórkowejikatali-
zujezależnyodATPtransportanionówkarboksylowych
nazewnątrzkomórki.Wykazano,żesubstratamipompy
Pdr12psązwiązkistosowanejakokonserwantyżywności
(np.kwasbenzoesowy,kwassorbowy,kwaspropionowy),
jakiC1-C7słabekwasyorganicznepowstającewczasie
metabolizmukomórki[18,41].Najbliższymhomologiem
głównegomediatorawielorakiejopornościkomórkibiał-
kaPdr5pjestbiałkoPdr15p.TransporterPdr15pnadaje
komórkomopornośćnachloramfenikolieterlaurylowy
polioksyetylenu,któresąrównieżsubstratamiPdr5p[54].
DopodrodzinyMDRnależym.in.umiejscowionewbłonie
komórkibiałko:Ste6p,odpowiedzialnezaeksportczynni-
kaaferomonupłciowego.Byłtopierwszyodkrytytrans-
porterbłonowyudrożdżyS. cerevisiae.Komórkipozba-
wionegenuSTE6stająsiesterylne[29].Pozostałebiałka
należącedopodrodzinyMDRtozlokalizowanewbłonie
mitochondrialnejAtm1p,Mdl1piMdl2ppowiązanezusu-
waniemzmitochondriówźlesfałdowanychbiałek[17,19].
WpodrodzinieMRP/CFTRzgrupowanesąbiałka,takie
jak:Ycf1p,Bat1piBpt1p,Vmr1p,Nft1piYor1p.Białka
tejrodzinysązlokalizowanewbłoniewakuoli,jedynym
wyjątkiemjestYor1pzlokalizowanywbłoniekomórkowej
isąodpowiedzialnezadetoksyfikacjęcytoplazmypoprzez
aktywnytransportinhibitorówdowakuoli.Ycf1pzostał
scharakteryzowanyjakowakuolarnyczynnikoporności
nametalenp.kadm,rtęć,ołów,arsen[27,28].BiałkoBpt1
bierzerównieżudziałwdetoksyfikacjibilirubinyikad-
mu[39,48].Vmr1pjestzdolnydotransportuwieluróż-
nychinhibitorówwtymnp.rodaminy6G,kadmuirtęci.
Wykazano,żesubstratybiałekYcf1p,Bpt1piVmr1psą
transportowanegłówniewpostacikoniugatówglutationu
rzadziejwpostacinieskoniugowanej[53].BiałkoBat1p
bierzeudziałwtransporciekwasówżółciowych[37].Yor1p
zostałscharakteryzowanyjakotransporterwielolekowy.
MutacjeinaktywującegenYOR1powodowaływrażliwość
m.in.naoligomycynęilekianionowe.Najnowszedane
wskazująrównieżnaudziałYor1pwdetoksyfikacjikad-
mu[8,35].Niepoznanojeszczefunkcjiwszystkichtrans-
porterów.Pdr11iAus1związanesązpobieraniemstero-
li,atakżemająwpływnawzrostkomórekwwarunkach
beztlenowych.
Takróżnorodnycharaktertransportowanychprzezbiał-
kaABCzwiązkówsugerujeróżnemożliwemechanizmy
transportu.Nieudałosięjeszczedokładniescharaktery-
zowaćwjakisposóbbiałkaABCprzenoszązwiązkiprzez
błony.Zaproponowanotrzymodeletransportu:klasycz-
nejpompy,flipazyiwakuolarnegoodkurzacza[2,15,49].
Zgodniezmodelemklasycznejpompyzwiązkiprzenoszone
sązcytoplazmybezpośrednioprzezkanałcentralnytwo-
rzonywbłonieprzezbiałko(np.Pdr12p).Większośćsub-
stratówprzenoszonychprzeztransporteryABCmajednak
charakterhydrofobowy,wydajesięwięcprawdopodobne,
żesąonewyłapywanebezpośredniowbłonieiusuwane
nazewnątrzwsystemiemolekularnegoodkurzaczalubpo-
przezaktywnośćflipazowąABC(np.Pdr5p)wruchuflip-
flop.Wkażdymztychmodeliwykorzystywanajestener-
giauzyskanazrozkładudwóchcząsteczekATP.Uważa
sie,żeprzyłączeniesubstratudodomenTMDzwiększa
powinowactwobiałekdoATP,natomiastzwiązanieATP
wymuszazmianękonformacjibiałkaumożliwiającąprze-
pchnięciesubstratunadrugąstronębłony[2].
PompyABCzidentyfikowanorównieżuinnychgrzybów,
wtymupatogennychCandida albicans.Wykazano,że
substratamibiałkaCdr1p,najlepiejscharakteryzowanego
transporteraABCuC. albicans,sąm.in.cykloheksymid,
flukonazol,ketokonazol,itrakonazolioligomycyna,hor-
monysteroidowe,chloramfenikol.BiałkoCdr1pzpowo-
dzeniemekspresjonowanowS. cerevisiae[52].
8.2. Transportery MF występujące u S. cerevisiae
Wielolekoopornośćniejestzwiązanajedyniezdziałaniem
transporterówABC.Badaniawykazały,żeudrożdżywy-
stępująrównieżbiałkanależącedorodzinypompprotono-
wychMF.Transporterytepotrzebnądotransportuenergię
czerpiązgradientuprotonówpoobustronachbłony.Białka
teniemajądomenNBD.Zewzględunaliczbętransbło-
nowychdomenTMDdzielimyjena12-i14-transbłono-
we.BiałkaMFtransportująchemioterapeutyki,alerów-
nieżkatalizujątransportsubstancjiendogennych,takichjak
intermediatycykluKrebsaczyoligosacharydy[38,46,47].
NajlepiejpoznaneMFtransporteryto:Atr1p–nadają-
cykomórceopornośćnaaminotriazol,Sge1p–związany
zopornościąnakationowebarwniki,Hxt9p–transporter
heksozorazbiałkoTpo1pbędącewakuolarnymtranspor-
terempoliaminowym[12,36].
WprzypadkuCandida albicansnajlepiejpoznanymtrans-
porteremMFjestCaMDR1(BEN)odpowiedzialnyza
nadawaniekomórkomopornościnabenomyl,metotreksat
iazole.NadekspresjaFLU1przyczyniasiędooporności
komórekC. albicansnaflukonazolikwasmukofenolowy
[6,16].Podobniejakwbakteryjnychsystemachusuwania
leków,transporterydrożdżowerównieżmająswojąfizjo-
logicznąrolęniezwiązanązeksportemleków.Ichnatu-
ralnefunkcjepolegająnadwukierunkowymtransporcie
Jarmuła A. i wsp. – Oporność wielolekowa związana z aktywnym usuwaniem…
225
- - - - -
Electronic PDF security powered by www.IndexCopernicus.com

hydrofobowychsubstratówegzogennych,takichjakjony
metali,peptydy,lipidy,cholesterolczywitaminyorazen-
dogennychsteroidów,cytokinczybilirubiny[45].
8.3. Regulacja ekspresji białek PDR u drożdży
SystemyusuwanialekówtypuPDR(pleiotropicdrugresi-
stance)tworząsiećgenówobejmującągenykodującebiałka
transporterówbłonowychorazgenyPDR1iPDR3.Geny
PDR1iPDR3kodujączynnikitranskrypcyjneregulujące
ekspresjętransporterówPDR.Dominującemutacjespon-
taniczne,któreaktywujątranskrypcjęgenówPDR1lub
PDR3powodująpowstawaniefenotypuwielolekooporno-
ścipoprzezaktywnytransportlekówzkomórkilubmo-
dyfikacjebiernejdyfuzjilekówdokomórkiprzezzmianę
składulipidówbłonykomórkowej[20].Pdr1piPdr3pna-
leżądorodzinyczynnikówtranskrypcjiGAL4.Cechącha-
rakterystycznątejrodzinyjestmotywZn2Cys6wiążący
DNA.Pdr1piPdr3pprzyłączająsiędosekwencjiPDRE
(Pdr1p/Pdr3presponseelement)obecnąwpromotorachge-
nówdocelowych.Aktywujetotranskrypcjęgenówkodu-
jącychtransporteryPDR.Mimowielupodobieństwwbu-
dowieiogólnejfunkcji,białkaPdr1piPdr3prozpoznają
iaktywująróżnegeny.Strukturaobuczynnikówtrans-
krypcjijestpodobna.Obamajądomenęzpalcemcynko-
wymwiążącąDNA,znajdującąsięnaN-końcu.Wcentrum
obubiałekznajdujesięosiemmotywówhydrofobowych
(MI-MVIII).BiałkoPdr1pmadwaregionyaktywujące
(AR).ARIznajdujesięprzyN-końcu,natomiastbardziej
znaczącyARIIjestumiejscowionyprzyC-końcu.Pdr3p
majedenregionaktywujący[20].CzynnikiPdr1piPdr3p
regulujątranskrypcjęwielugenówzwiązanychzoporno-
ściąnainhibitory.Sątom.in.genykodującebiałkabło-
noweABC(Pdr5p,Pdr10p,Pdr15p,Snq2p,Yor1p),geny
kodującetransporterynależącedorodzinyMF(Hxt9p,
Hxt11p),gen IPT1/D4405,któregoproduktwpływanabio-
syntezęsfingolipidów,genPDR16kodującybiałkomające
wpływnaskładfosfolipidówisteroliwbłoniekomórkowej,
TPO1kodującywakuolarnytransporterpoliamidy,perme-
azyHXT2,RTA1,YOR049corazgenykodującebiałkaza-
angażowanewmetabolizmlipidówiścianykomórkowej.
BiałkaPdr1piPdr3pwpływająrównieżnazahamowanie
ekspresjiniektórychbiałek,np.Pdr12pbędącegotranspor-
teremtypuABC,odpowiedzialnymzaopornośćnasorbi-
nian,benzoesanioctan[20].TransporteryPDRsąrów-
nieżregulowaneprzezwieleinnychczynników.Badania
wykazały,żewkontrolętranskrypcjigenówkodujących
białkatransporterowezaangażowanyjestczynnikyAP-1.
BiałkapodlegającekontroliczynnikayAP-1zapewniają
drożdżomopornośćm.in.nakadm,cykloheksymidoraz
wieleinnychtoksycznychzwiązków[1].
9. p
odsumoWanie
Opornośćwielolekowacorazczęściejpojawiającasięwśród
bakteriiigrzybówstałasiępoważnymproblememwlecze-
niuzakażeń.Jednymzszerokorozpowszechnionychmecha-
nizmówopornościsąsystemyaktywnegousuwanialeków
zkomórek.Białkatepozwalająbakteriomigrzybomprze-
żyćwśrodowiskuzawierającymtoksycznedlanichsub-
stancje,natomiastwystępowaniewieluczynnikówregulu-
jącychichekspresjęzapewniaprawidłowefunkcjonowanie
transporterówlekowych.Znanesąsubstancjehamujące
działaniesystemówwyrzutulekówjednakwciążwymaga-
jązbadaniapodkątemtoksyczności.Poznaniedokładne-
godziałaniatransporteróworazewentualnychmożliwości
inhibicjiichdziałaniastanowikrokwkierunkupokonania
infekcjiwywoływanychprzezwielolekooporneszczepy.
p
iśmiennicTWo
[1]AlarcoA.,BalanI.,TalibiD.,MainvilleN.,RaymondM.:AP1-
mediatedmultidrugresistanceinSaccharomyces cerevisiaerequires
FLR1encodingatransporterofthemajorfacilitatorsuperfamily.J.
Biol.Chem.,1997;272:19304–19313
[2]AmbudkarS.V.,KimI.W.,SaunaZ.E.:Thepowerofthepump:me-
chanismofactionofP-glycoprotein(ABCB1).Eur.J.Pharm.Sci.,
2006;27:392–400
[3]BauerB.E.,WolfgerH.,KuchlerK.:Inventoryandfunctionofyeast
ABCproteins:aboutsex,stress,pleiotropicdrugandheavymetalre-
sistance.Biochim.Biophys.Acta.,1999;1461:217–236
[4]Borges-WalmsleyM.I.,McKeeganK.S.,WalmsleyA.R.:Structureand
functionofeffluxpumpsthatconferresistancetodrugs.Biochem.J.,
2003;376:313–338
[5]Borges-WalmsleyM.I.,WalmsleyA.R.:Thestructureandfunctionof
drugpumps.TrendsMicrobiol.,2001;9:71–79
[6]CalabreseD.,BilleJ.,SanglardD.:Anovelmultidrugeffluxtranspor-
tergeneofthemajorfacilitatorsuperfamilyfromCandida albicans
(FLU1)conferringresistancetofluconazole.Microbiology,2000;146:
2743–2745
[7]ChenY.J.,PornillosO.,LieuS.,MaC.,ChenA.P.,ChangG.:X-ray
structureofEmrEsupportsdualtopologymodel.Proc.Natl.Acad.
Sci.USA,2007;104:18999–19004
[8]CuiZ.,HirataE.,TauchiyaH.,OsadaH.,MiyakawaT.:Themulti-
drugresistanceassociatedprotein(MRP)subfamily(YRS1/Yor1)of
S. cerevisiaeisimportantforthetolerancetoabroadrangeoforga-
nicanions.J.Biol.Chem.,1996;271:14712–14716
[9]DecottigniesA.,GoffeauA.:CompleteinventoryoftheyeastABC
proteins.Nat.Gen.,1997;15:137–145
[10]DecottigniesA.,KolaczkowskiM.,BalziE.,GoffeauA.:Solubilization
andcharacterizationoftheoverexpressedPDR5multidrugresistan-
cenucleotidetriphosphataseofyeast.J.Biol.Chem.,1994;296:
12797–12803
[11]DecottigniesA.,LambertL.,CattyP.,DegandH.,EppingE.A.,Moye-
RowleyW.S.,BalziE.,GoffeauA.:Identificationandcharacteriza-
tionofSNQ2,anewmultidrugATP-bindingcassettetransporterof
theyeastplasmamembrane.J.Biol.Chem.,1995;270:18150–18157
[12]Ehrenhofer-MurrayA.E.,SeitzK.,SengstagC.:TheSge1proteinof
Saccharomyces cerevisiaeisamembraneassociatedmultidrugtrans-
porter.Yeast,1998;14:49–65
[13]GoffeauA.,BarrellB.G.,BusseyH.,DavisR.W.,DujonB.,Feldmann
H.,GalibertF.,HoheiselJ.D.,JacqC.,JohnstonM.,LouisE.J.,Mewes
H.W.,MurakamiY.,PhilippsenP.,TettelinH.,OliverS.G.:Lifewith
6000genes.Science,1996;247:546–567
[14]HieterP.,BassettD.E.Jr,ValleD.:Theyeastgenome:thecommon
currency.Nat.Genet.,1996;13:253–255
[15]HigginsC.F.,GottesmanM.M.:Isthemultidrugtransporteraflippa-
se?TrendsBiochem.Sci.,1992;17:18–21
[16]HillerD.,SanglardD.,MorschhauserJ.:OverexpressionofMDR1
geneissufficienttoconferincreasedresistancetotoxiccompounds
inCandida albicans.Antimicrob.AgentsChemother.,2006;50:
1365–1371
[17]HofackerM.,GompfS.,ZutzA.,PresentiC.,HaaseW.,vanderDoes
C.,ModelK.,TampeR.:Structuralandfunctionalfingerprintofthemi-
tochondrialATP-bindingcassettetransporterMdl1fromSaccharomyces
cerevisiae.J.Biol.Chem.,2007;282:3951–3961
[18]HolyoakC.D.,BraceyD.,PiperP.W.,KuchlerK.,CooteP.J.:The
Saccharomyces cerevisiaeweak-acid-inducibleABCtransporterPdr12
transportsfluoresceinandpreservativeanionsfromthecytosolbyan
energy-dependentmechanism.J.Bacteriol.,1999;181:4644–4652
[19]KispalG,CsereP.,GuiardB.,LillR.:TheABCtransporterAtm1pis
requiredformitochondrialironhomeostasis.FEBSLett.,1997;418:
346–350
[20]KołaczkowskaA.,GoffeauA.:Regulationofpleiotropicdrugresi-
stanceinyeast.DrugResist.Updat.,1999;2:403–414
Postepy Hig Med Dosw (online), 2011; tom 65: 216-227
226
- - - - -
Electronic PDF security powered by www.IndexCopernicus.com

[21]KolaczkowskaA.,KolaczkowskiM.,GoffeauA.,Moye-RowleyS.:
CompensatoryactivationofthemultidrugtransporterPdr5p,Snq2p,
andYor1p,byPdr1pinSaccharomyces cerevisiae.FEBSLett.,2008;
582:977–983
[22]KolaczkowskiM.,VanderRestM.,CybularzKolaczkowskaA.,
Soumillion J.P., Konings W.N., Goffeau A.: Anticancer drugs.
Ionophorericpeptidesandsteroidsassubstratesoftheyeastmulti-
drugtransporterPdr5p.J.Biol.Chem.,1996;271:31543–31548
[23]KumarA.,SchweizerH.P.:Bacterialresistancetoantibiotics:active
effluxandreduceduptake.Adv.DrugDeliv.Rev.,2005;57:1486–1513
[24]LaundyA.E.:SystemyMDR–istotnymechanizmopornościpałe-
czekgram-ujemnychnaantybiotykiichemioterapeutyki.Postępy
Mikrobiol.,2008;47:415–422
[25]LevyS.B.:Activeeffluxmechanismsforantimicrobialresistance.
Antimicrob.AgentsChemother.,1992;36:695–703
[26]LiX.Z.,NikaidoH.:Efflux-mediateddrugresistanceinbacteria.
Drugs,2004;64:159–204
[27]LiZ.S.,LuY.P.,ZhenR.G.,SzczypkaM.,ThieleD.J.,ReaP.A.:
AnewpathwayforevacuolarcadmiumsequestrationinSaccharomyces
cerevisiae:YCF1-catalyzedtransportofbis(glutathionato)cadmium.
Proc.Natl.Acad.Sci.USA,1997;94:42–47
[28]LiZ.S.,SzczypkaM.,LuY.P.,ThieleD.J.,ReaP.A.:Theyeastcad-
miumfactorprotein(YCF1)isavacuolarglutathioneS-conjugate
pump.J.Biol.Chem.,1996;271:6509–6517
[29]LoayzaD.,TamA.,SchmidtW.K.,MichaelisS.:Ste6pmutantsdefec-
tiveinexitfromtheendoplasmicreticulum(ER)revealaspectsofan
ERqualitycontrolpathwayinSaccharomyces cerevisiae.Mol.Biol.
Cell,1998;9:2767–2784
[30]LomovskayaO.,ZgurskayaH.I.,TotrovM.,WatkinsW.J.:Waltzing
transportersand‘thedancemacabre’betweenhumansandbacteria.
Nat.Rev.DrugDiscov.,2007;6:56–65
[31]LubelskiJ.,KoningsW.N.,DriessenA.J.:Distributionandphysiolo-
gyofABC-typetransporterscontributingtomultidrugresistancein
bacteria.Microbiol.Mol.Biol.Rev.,2007;71:463–476
[32]MahamoudA.,ChevalierJ.,Alibert-FrancoS.,KernW.V.,PagésJ.M.:
Antibioticeffluxpumpsingram-negativebacteria:theinhibitorre-
sponsestrategy.J.Antimicrob.Chemother.,2007;59:1223–1229
[33]MarkhamP.N.,NeyfakhA.A.:Efflux-mediateddrugresistancein
Gram-positivebacteria.Curr.Opin.Microbiol.,2001;4:509–514
[34]MichaelisS.,BerkowerC.:SequencecomparisonofyeastATP-binding
cassetteproteins.ColdSpringHarb.Symp.Quant.Biol.,1995;60:
291–307
[35]NagyZ.,MontignyC.,LeverrierP.,YehS.,GoffeauA.,GarrigosM.,
FalsonP.:RoleoftheyeastABCtransporterYor1pincadmiumdeto-
xification.Biochimie,2006;88:1665–1671
[36]NouraniA.,Wesolowski-LouvelM.,DelaveauT.,JacqC.,Delahodde
A.:Multiple-drug-resistancephenomenonintheyeastSaccharomyces
cerevisiae:involvementoftwohexosetransporters.Mol.Cell.Biol.,
1997;17:5453–5460
[37]OrtizD.F.,St-PierreM.V.,AbdulmessihA.,AriasI.M.:AyeastATP-
bindingcassette-typeproteinmediatingATP-dependentbileacidtrans-
port.J.Biol.Chem.,1997;272:15358–15365
[38]PaulsenI.T.,BrownM.H.,SkurrayR.A.:Proton-dependentmultidrug
effluxsystems.Microbiol.Rev.,1996;60:575–608
[39]PetrovicS.,PascoloL.,CupelliF.,OstrowJ.D.,GoffeauA.,Tiribelli
C.,BruschiC.V.:TheproductofYcf1andYLL015w(BPT1)coope-
ratefortheATP-dependentvacuolartransportofunconjugatedbili-
rubininSaccharomyces cerevisiae.Yeast,2000;16:561–571
[40]PiddockL.J.:Clinicallyrelevantchromosomallyencodedmultidrug
resistanceeffluxpumpsinbacteria.Clin.Microbiol.Rev.,2006;19:
382–402
[41]PiperP.,MaheY.,ThompsonS.,PandjaitanR.,HolyoakC.,Egner
R.,MulhlbauerM.,CooteP.,KuchlerK.:Thepdr12ABCtranspor-
terisrequiredforthedevelopmentofweakorganicacidresistancein
yeast.EMBOJ.,1998;17:4257–4265
[42]PooleK.:Efflux-mediatedantimicrobialresistance.J.Antimicrob.
Chemother.,2005;56:20–51
[43]PooleK.:Efflux-mediatedmultiresistanceinGram-negativebacteria.
Clin.Microbiol.Infect.,2004;10:12–26
[44]PutmanM.,vanVeenH.W.,KoningsW.N.:Molecularpropertiesof
bacterialmultidrugtransporters.Microbiol.Mol.Biol.Rev.,2000;64:
672–693
[45]RogersB.,DecottigniesA.,KołaczkowskiM.,CarvajalE.,BalziE.,
GoffeauA.:ThepleitropicdrugABCtransportersfromSaccharomyces
cerevisiae.J.Mol.Microbiol.Biotechnol.,2001;3:207–214
[46]Sá-CorreiaI.,dosSantosS.C.,TeixeiraM.C.,CabritoT.R.,Mira
N.P.:DrugH
+
antiportersinchemicalstressresponseinyeast.Trends
Microbiol.,2009;17:22–31
[47]Sa-CorreiaI.,TenreiroS.:Themultidrugresistancetransportersofthe
majorfacilitatorsuperfamily,6yearsafterdisclosureofSaccharomyces
cerevisiaegenomesequence.J.Biotechnol.,2002;98:215–226
[48]SharmaK.G.,MasonD.L.,LiuG.,ReaP.A.,BachhawatA.K.,Michaelis
S.:Localization,regulation,andsubstratetransportpropertiesofBpt1p,
aS. cerevisiaeMRP-typeABCtransporter.Eucaryot.Cell.,2002;1:
391–400
[49]SharomF.J.,LugoM.R.,EckfordP.D.:Newinsightintothedrugbin-
ding,transportandlipidflippaseactivitiesofthep-glycoproteinmul-
tidrugtransporter.J.Bioenerg.Biomembr.,2005;37:481–487
[50]StavriM.,PiddockL.J.,GibbonsS.:Bacterialeffluxpumpinhibitors
fromnaturalsources.J.Antimicrob.Chemother.,2007;59:1247–1260
[51]VanBambekeF.,BalziE.,TulkensP.M.:Antibioticeffluxpumps.
Biochem.Pharmacol.,2000;60:457–470
[52]WakiecR.,PrasadR.,MorschauserJ.,BarchiesiF.,BorowskiE.:
VoriconazoleandmultidrugresistanceinCandidaalbicans.Mycoses,
2006;50:109–115
[53]WawrzyckaD.,SobczakI.,BartoszG.,BocerT.,UłaszewskiS.,Goffeau
A.:Vmr1pisanovelvacuolarmultidrugresistanceABCtransporter
inSaccharomyces cerevisiae.FEMSYeastRes.,2010;10:828–838
[54]WolfgerH.,MamnunY.M.,KuchlerK.:TheyeastPdr15pATP-binding
cassette(ABC)proteinisageneralstressresponsefactorimplicated
incellulardetoxification.J.Biol.Chem.,2004;279;11593–11599
[55]ZgurskayaH.I.,NikaidoH.:Multidrugresistancemechanisms:drug
effluxacrosstwomembranes.Mol.Microbiol.,2000;37:219–225
Autorzydeklarująbrakpotencjalnychkonfliktówinteresów.
Jarmuła A. i wsp. – Oporność wielolekowa związana z aktywnym usuwaniem…
227
- - - - -
Electronic PDF security powered by www.IndexCopernicus.com
Wyszukiwarka
Podobne podstrony:
Oporność wielolekowa i kliniczne znaczenie polimorfizmów
Białka oporności wielolekowej w szpiczaku mnogim
Oporność wielolekowa
Oporność wielolekowa drobnoustrojow
Wykład 7 Wieloletni Plan Finansowy
Wieloletni plan doskonalenia nauczycieli, organizacja-pracy
Nabór i selekcja do uprawiania sportu jako wieloletni proces
Pomiar techniczny oporności v5
opornosc na antybiotyki wikipedia
Praca magisterska Wieloletnie Plany Finansowe Państwa a Ustawy Budżetowe 10 2013
oporność?kterii na antybiotyki
Pomiar techniczny oporności v5
2 Zal oporności met i półp od tempid!005
Pomiar techniczny oporności v4
więcej podobnych podstron