CHEMIA ORGANICZNA - REAKCJE
1.ALKANY
Otrzymywanie
Hydrogenacja alkenów:
![]()
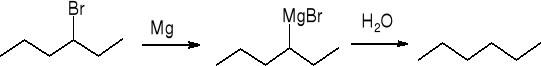
redukcja halogenków alkilów - hydroliza odczynnika Grignarda:
![]()
np.:
Redukcja halogenków alkilu metalem w środowisku kwaśnym:
RX + Zn + H+ ==> RH + Zn2+ + X-
Np.:
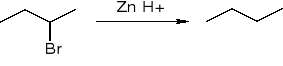
reakcja halogenków alkilu ze związkami metaloorganicznymi:
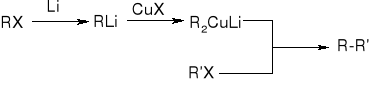
np.:
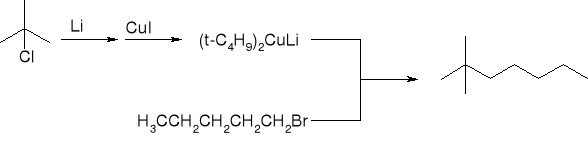
Reakcje alkanów:
Halogenowanie
Reaktywność X2 Cl2>Br2
Reaktywność protonów: 30>20>10>H3C-H
Przykład:
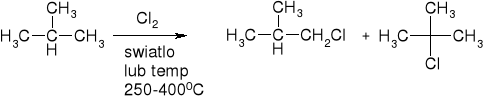
alkany ulegają również spalaniu, a za pomocą pirolizy można skrócić ich łańcuchy, otrzymać wodór i alkeny.
2. Alkeny
Otrzymywanie:
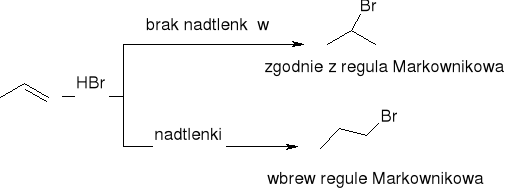
Reaktywność alkoholi i halogenków w reakcji eliminacji: 30>20>10
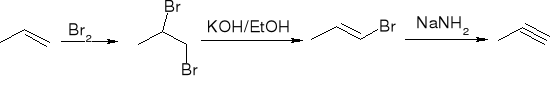
Dehydrohalogenacja halogenków alkilu:
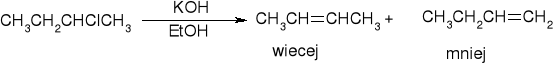
Dehydratacja alkoholi:
![]()
więcej mniej
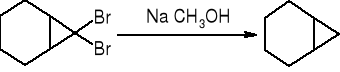
Dehalogenacja wicynalnych dihalogenopochodnych:
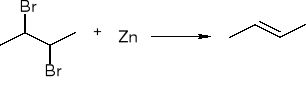
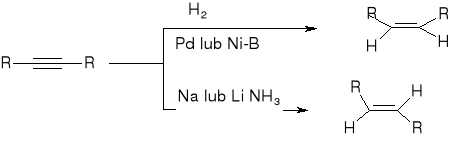
redukcja alkinów:
trwałość karbokationów:
30>20>10>CH3+
przegrupowują się w trwalsze
reakcje alkenów:
addycja wodoru:
![]()
addycja halogenu:
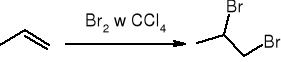
addycja halogenowodoru
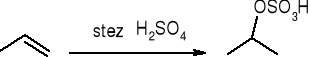
addycja kwasu siarkowego:
addycja wody:
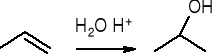
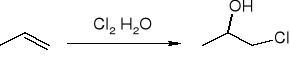
tworzenie halogenohydryn:
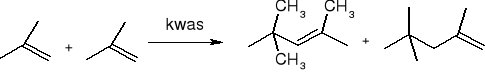
dimeryzacja:
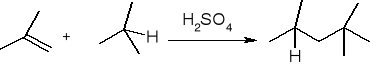
alkilowanie:
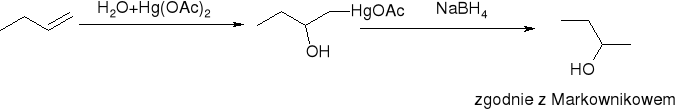
oksyrtęciowanie połączone z odrtęciowaniem:
Borowodorowanie połączone z utlenianiem:
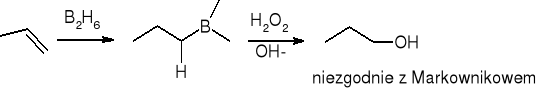
Addycja wolnych rodników:
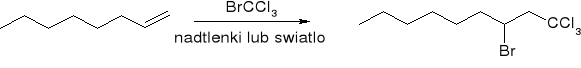
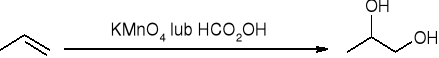
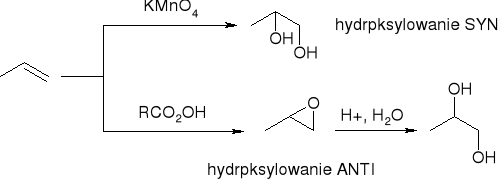
hydroksylowanie - tworzenie dioli wicynalnych:
reakcje podstawienia:
halogenowanie - substytucja w pozycji allilowej:
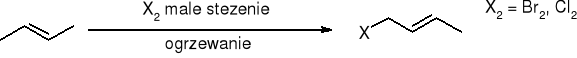
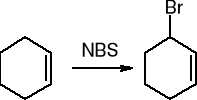
Ozonoliza:
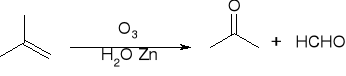
3. Alkiny
otrzymywanie:
dehydrohalogenacja dihalogenoalkanów:
reakcje acetylenków sodowych z pierwszorzędowymi halogenkami alkilów:
![]()
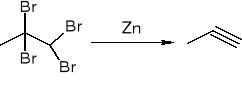
dehalogenacja tetraholegnoalkanów:
reakcje:
Addycja wodoru:
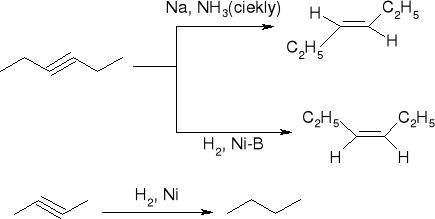
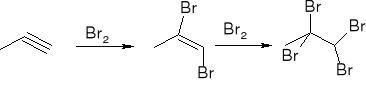
Addycja halogenów:
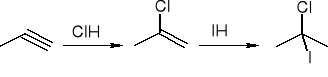
addycja halogenowodorów:
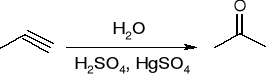
Addycja wody:
powstawanie acetylenków metali ciężkich:
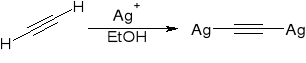
powstawanie acetylenków metali alkalicznych:
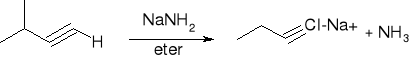
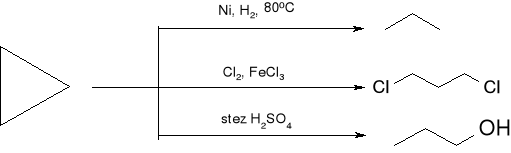
reakcje cyklopropanu:
Benzen
Nitrowanie:
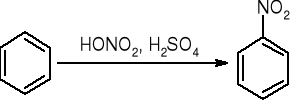
sulfonowanie:
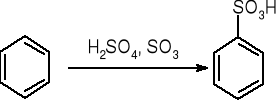
Halogenowanie:
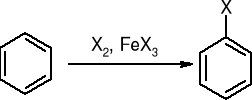
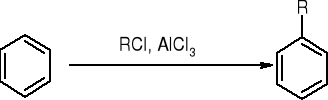
alkilowanie metodą Friedla - Craftsa:
acylowanie metodą Friedla - Craftsa:
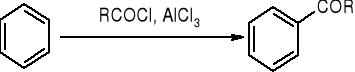
protonowanie:
a). Desulfonowanie:
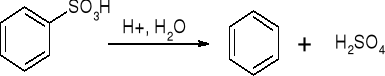
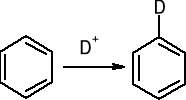
b). Wymiana protonu:
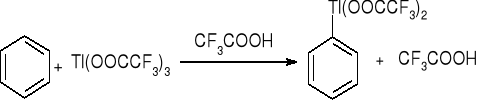
Talowanie:
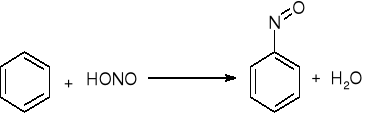
Nitrozowanie:
sprzęganie z solami diazoniowymi:
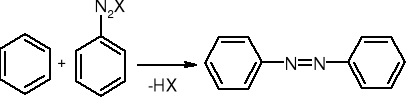
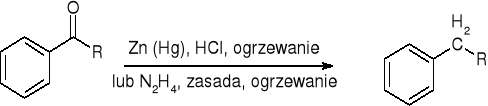
Redukcja Clemmensena lub Wolffa - Kiżnera:
wpływ skierowujący:
podstawniki aktywujące, kierujące w pozycje orto i para:
silnie aktywujące:
-NH2 (-NHR, -NR2), -OH
średnio aktywujące:
-OCH3 (-OC2H5 itd.), -NHCOCH3
słabo aktywujące:
-C6H5, -CH3 (-C2H5 itd.)
dezaktywujące, kierujące w pozycję meta:
-NO2, -N(CH3)+, -CN, -COOH (-COOR), -SO3H, -CHO, -COR,
dezaktywujące, kierujące w pozycję orto i para:
-F, -Cl, -Br, -I
ksyleny:
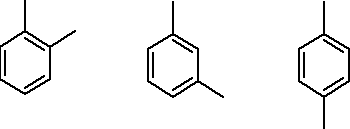
o - ksylen m - ksylen p - ksylen
Halogenki:
Otrzymywanie
Wymiana -OH na -X
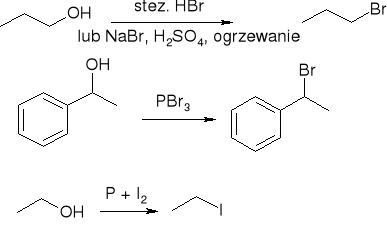
halogenowanie węglowodorów
addycja halogenowodorów do alkenów,
addycja halogenów do alkenów i alkinów
wymiana halogenu:
RX + I- RI + X-
Reakcje:
Substytucja nukleofilowa:
R:X + :Z R:Z + :X- |
Produkt |
R:X + OH- R:OH + :X- |
Alkohol |
R:X + H2O ROH |
Alkohol |
R:X + :OR'- => R:OR' |
Eter - synteza Williamsona |
R:X + -:C≡CR' => R:C≡CR' |
Alkin |
R:X + R'-M => R:R' |
ALKAN (SPRZĘGANIE) |
R:X + :I- => R:I |
Jodek alkilu |
R:X + :CN- => R:CN |
Nitryl |
R:X + R'COO:- => R'COOR |
Ester |
R:X + NH3 => R:NH2 |
Amina pierwszorzędowa |
R:X + :NH2R => R:NHR' |
Amina drugorzędowa |
R:X + NHR'R“ => R:NR'R“ |
Amina trzeciorzędowa |
R:X + :P(C6H5)3+X- => [R:P(C6H5)3]+X- |
Sól fosfoniowa |
R:X + SH- => R:SH |
Tiol (tioalkohol) |
R:X + :SR' => R:SR' |
Sulfid (tioeter) |
R:X + [CH3(COOC2H5)2]- => RCH3(COOC2H5)2 |
Synteza z estru malonowego |
|
|
Dehydrohalogenacja:
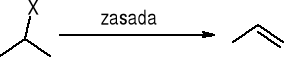
otrzymywanie odczynnika Grignarda:
RX + Mg (w bezwodnym eterze dietylowym) => RMgX
Redukcja:
SN1 - powstanie karbokation
SN2 - nukleofil atakuje cząsteczkę od tyłu
Alkohole:
Otrzymywanie:
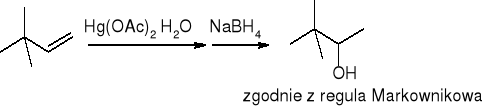
Hydroksyrtęciowanie połączone z odrtęciowaniem:
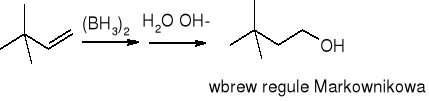
borowodorowanie połączone z utlenianiem:
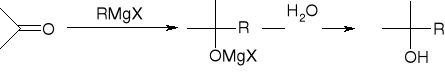
synteza Grignarda:
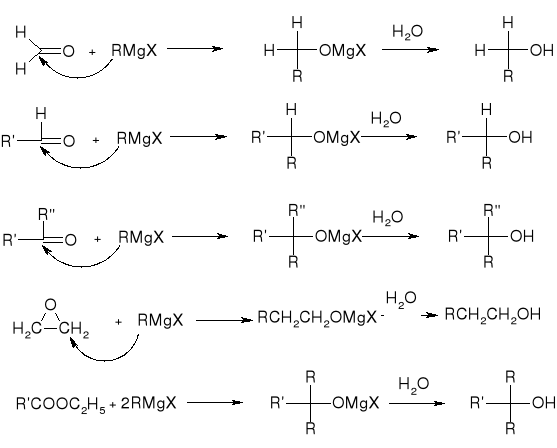
hydroliza halogenków alkilu:
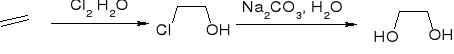
hydroksylowanie alkenów:
reakcje alkoholi:
ROZERWANIE WIĄZANIA R-OH
Reakcja z halogenowodorami:
R-OH + HX => RX + H2O
Gdzie R może ulec przegrupowaniu,
Reaktywność HX: HI>HBr>HCl
Reaktywność ROH: allilowy, benzylowy> 30> 20> 10
Reakcja z trójhalogenkami fosforu:
R-OH + PX3 => RX + H3PO3 (X = , Br, I)
Dehydratacja:
![]()
ROZERWANIE WIĄZANIA RO-H
Reakcje z metalami aktywnymi
CH3CH2OH + Na => CH3CH2Ona + ½ H2
Tworzenie estrów:
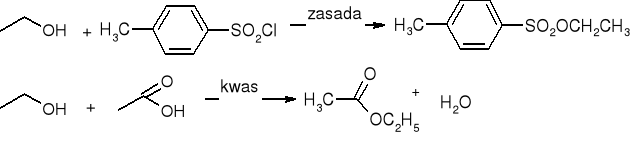
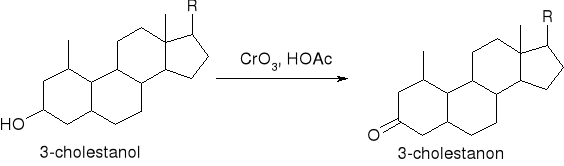
Utlanianie:
Alkohole 10:
alkohole drugorzędowe:
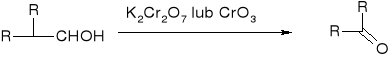
przykładowo:
ETERY
Otrzymywanie:
Synteza Williamsona:
alkoksyrtęciowanie połączone z odrtęciowaniem:
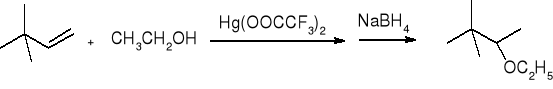
EPOKSYDY:
Otrzymywanie:
Z halogenohydryn:
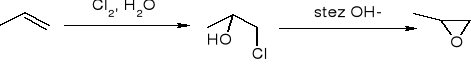
utlenianie C=C za pomocą nadtlenokwasów:

reakcje epoksydów:
rozszczepienie katalizowane przez kwas:
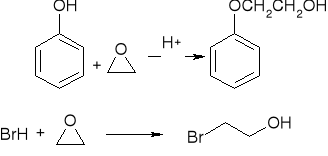
rozszczepienie katalizowane przez zasadę:
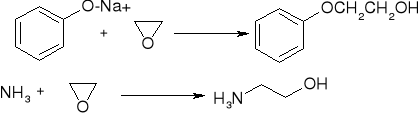
reakcja ze związkami Grignarda:
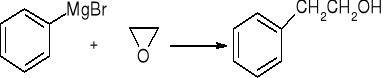
KWASY KARBOKSYLOWE
Otrzymywanie:
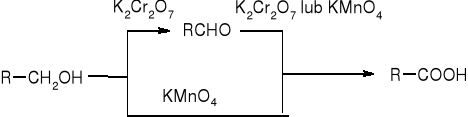
Utlenianie alkoholi pierwszorzędowych:
![]()
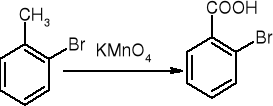
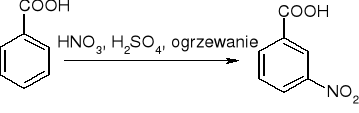
utlenianie alkilowych pochodnych beznenu:
reakcja związków Grignarda z CO2
![]()
Hydroliza nitryli:
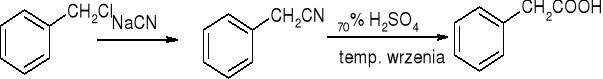
reakcje:
tworzenie soli
przekształcenie -OH na -Cl, -OR', -NH2
przekształcenie w chlorki kwasowe:

przekształcenie w estry - estryfikacja
przekształcenie w amidy:
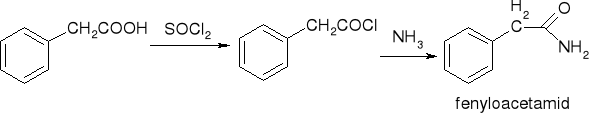
redukcja:
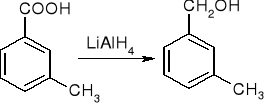
substytucja w grupie arylowej lub alkilowej:
reakcja Hella - Volharda - Zielińskiego:
![]()
substytucja w pierścieniu -COOH dezaktywuje:
ALDEHYDY I KETONY:
Otrzymywanie aldehydów:
Utlenianie alkoholi pierwszorzędowych:
RCH2OH + K2Cr2O7 => RCHO
Utlenianie metylowych pochodnych benzenu:
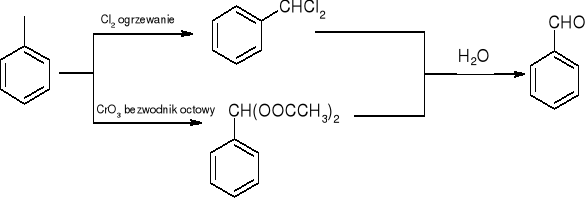
redukcja chlorków kwasowych:
RCOCl lub ArCOCl + LiAlH(OBu-t)3 => RCHO LUB ArCHO
Otrzymywanie ketonów:
Utlenianie alkoholi drugorzędowych:
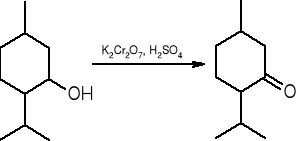
mentol menton
acylowanie metodą Friedla - Craftsa
reakcja chlorków kwasowych ze związkami kadmoorganicznymi:
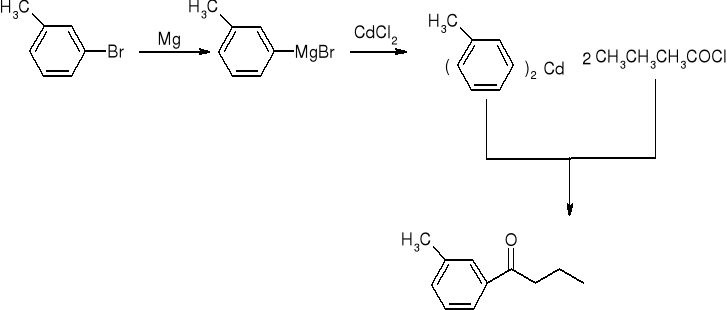
reakcje aldehydów i ketonów:
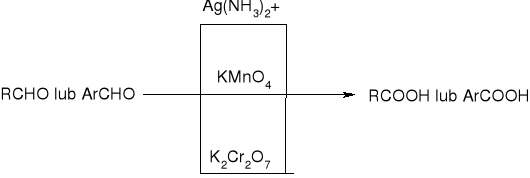
utlenianie aldehydów:
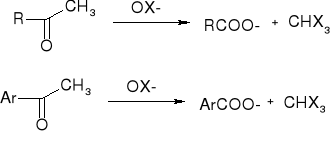
ketony metylowe - reakcja haloformowa
redukcja do alkoholi:
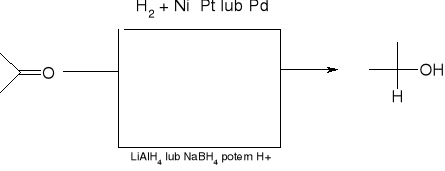
redukcja Clemmensena (dla związków wrażliwych na działanie zasad):
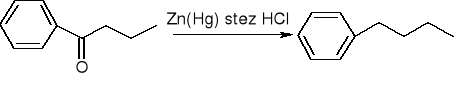
redukcja Wolffa - Kiżnera (dla związków wrażliwych na działanie zasad):
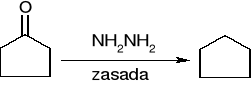
addycja związków Grignarda:
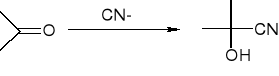
addycja cyjanowodoru - tworzenie cyjanohydryn
addycja wodorosiarczynu:
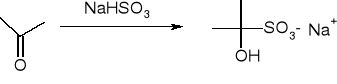
addycja pochodnych amoniaku:
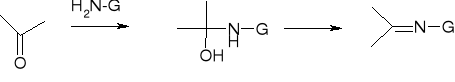
H2N-G |
produkt |
H2N-OH hydroksyloamina |
=C=NOH oksym |
H2N-NH2 hydrazyna |
=C=NNH2 hydrazon |
H2N-NHC6H5 fenylohydrazyna |
=C=NNHC6H5 fenylohydrazon |
H2N-NHCONH2 semikarbazyd |
=C=NNHCONH2 semikarbazon |
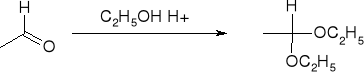
Addycja alkoholi - tworzenie acetali:
reakcja Cannizzaro:
ulegają jej aldehydy bez wodorów :
![]()
krzyżowa reakcja Cannizzaro:
-halogenowanie ketonów:

reakcje bezwodników kwasowych:
hydroliza - przemiana w kwasy
amonoliza - przemiana w amidy:
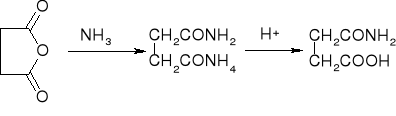
alkoholiza - przemiana w estry:
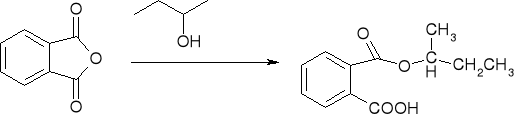
acylowanie metodą Friedla Craftsa:
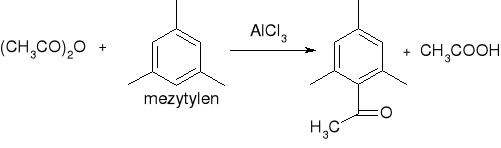
reakcje amidów:
hydroliza (kwasowa lub zasadowa)
degradacja Hofmanna:
RCONH2 lub ArCONH2 + OBr- => RNH2 lub ArNH2 + CO32-
Estry - kondensacja Claisena:
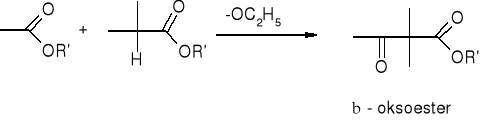
kondensacja aldolowa:

związek -hydroksykarbonylowy
Aminy
Otrzymywanie:
Redukcja związków nitrowych:
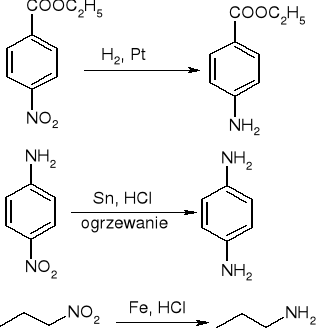
reakcja halogenków z amoniakiem lub aminami:
NH3 + RX => RNH2 + RX => R2NH + RX => R3N +RX => R4N+X-
Aminowanie redukcyjne
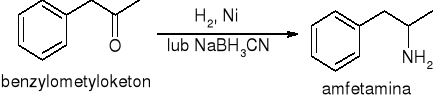
redukcja nitryli
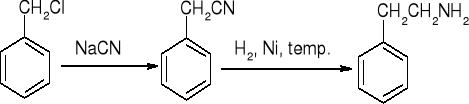
Degradacja amidów Hofmanna:
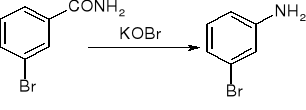
reakcje amin:
tworzenie soli
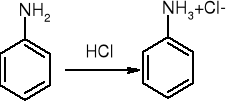
alkilowanie:
RNH2 + RX => R2NH + RX => R3N + RX => R4N+X-
Przemiana w amidy:
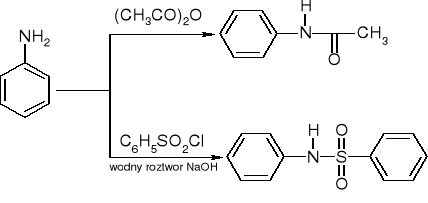
reakcje czwartorzędowych soli amoniowych - eliminacja Hofmanna:

reakcje z kwasem azotawym:
ArNH2 + HONO => Ar-N2+
RNH2 + HONO => R-N2+ +H2O => N2 + mieszanina alkoholi i alkenów
ArNHR lub R2NH + HONO => (ArR)N-N=O lub R2N-N=O N-nitrozoaminy
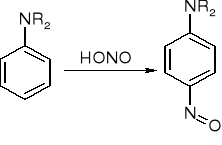
p - nitrozopochodna
otrzymywanie soli diazoniowych:
ArNH2 + NaNO2 + 2HX => ArN2+X- + NaX + 2H2O
Sól diazoniowa
REAKCJE SOLI DIAZONIOWYCH:
Wymiana -N2 na -Cl, -Br lub -CN - reakcja Sandmeyera:
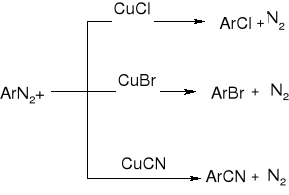
wymiana na -I
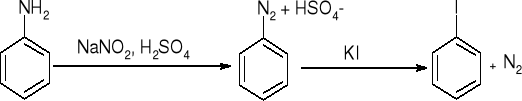
wymiana na -F
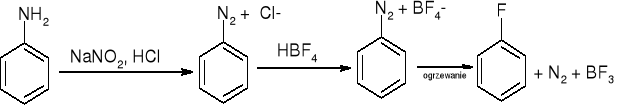
wymiana na -OH
ArN2+ + H2O (w H+)=> ArOH + N2
Sprzęganie soli diazoniowych:
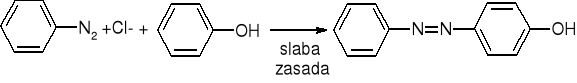
Fenole:
Otrzymywanie:
Hydroliza soli diazoniowych:
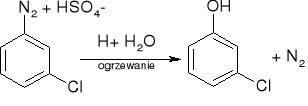
utlenianie związków arylotalowych:
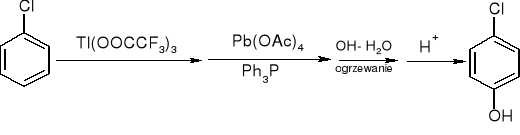
jedyny powstający izomer
reakcje:
tworzenie soli (jak kwasy)
tworzenie eterów - synteza Williamsona:
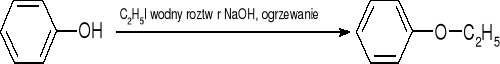
tworzenie estrów - fenole zachowują się jak alkohole
substytucja w pierścieniu - grupy -O- i -OH- są silnie aktywującymi i kierują w pozycje orto i para. Bromowanie fenolu prowadzi to 2,4,6 - tribromofenolu.
Alkilowanie Friedla - Craftsa
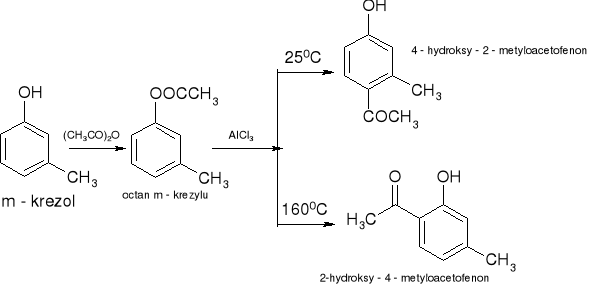
Acylowanie Freidla - Craftsa - przegrupowanie Firesa:
Nitrozowanie
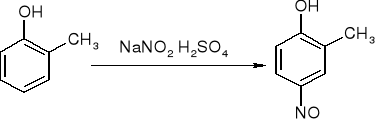
m - krezol 2 - metylo - 4 - nitrozofenol
karboksylowanie - reakcja Kolbego:
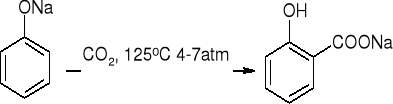
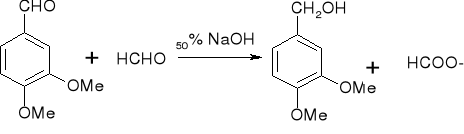
tworzenie aldehydów - reakcja Reimera - Teimanna:
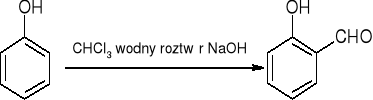
reakcje halogenków arylu:
tworzenie związków Grignarda:
ArBr + Mg w suchym eterze => ArMgBr
ArCl + Mg w tetrahydrofuranie (THF) => ArMgCl
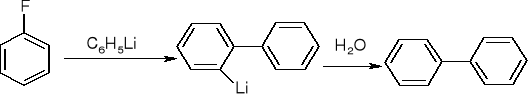
Substytucja elektrofilowa - halogenek dezaktywuje pierścień i kieruje podstawnik w pozycje orto i para.
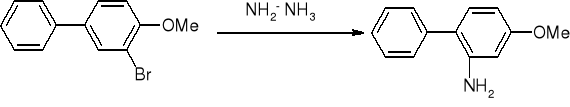
Substytucja nukleofilowa:
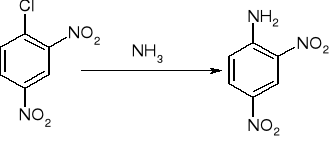
substytucja nukleofilowa - eliminacja połączona z addycją:
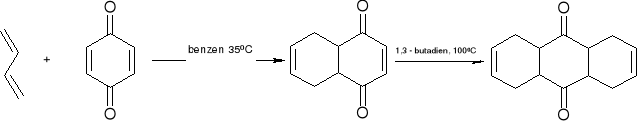
cykloaddycja 4+2 - reakcja Dielsa - Aldera”
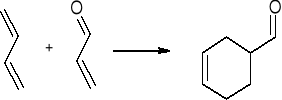
1,3 butadien
akroleina 1,2,3,6 - tetrahydrobenzaldehyd
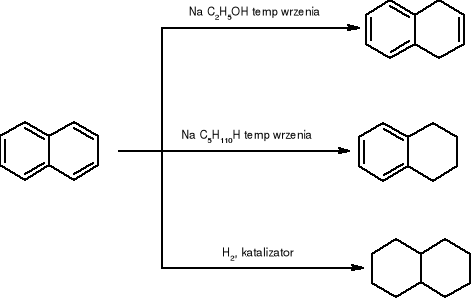
reakcje naftalenu:
utlenianie
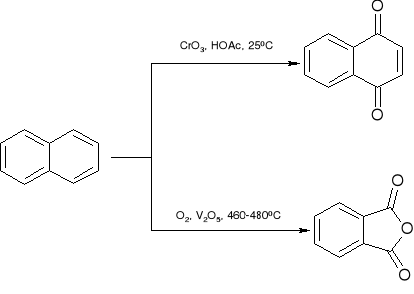
redukcja:
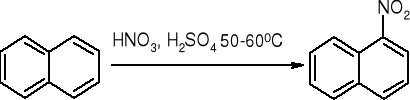
substytucja elektrofilowa:
nitrowanie
halogenowanie:
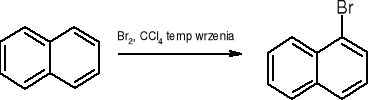
-bromonaftalen
sulfonowanie:
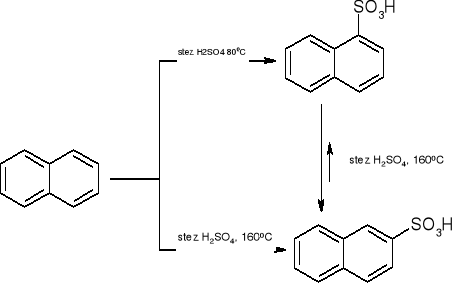
acylowanie wg Friedla - Craftsa:
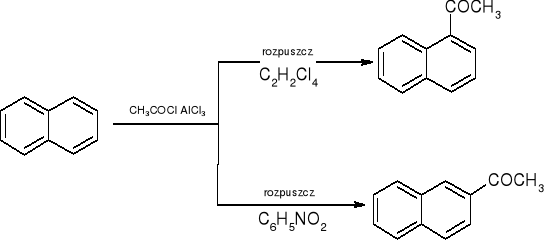
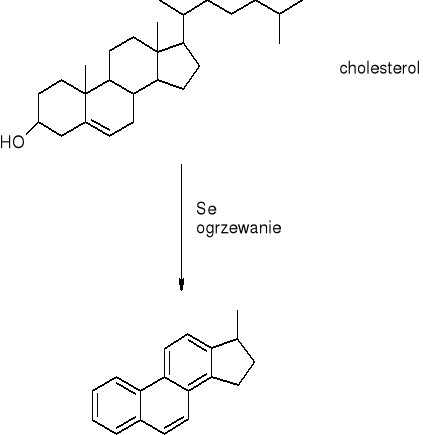
aromatyzacja:
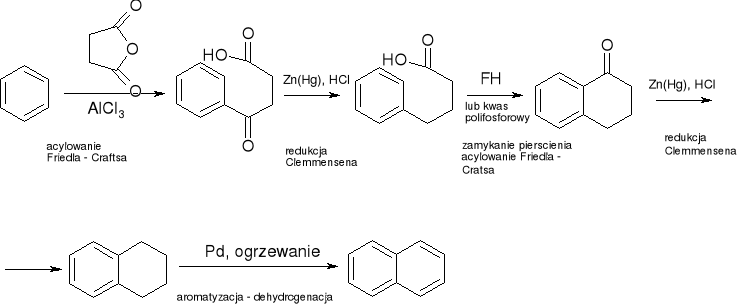
synteza Hawortha:
heterocykle:
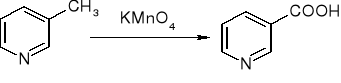
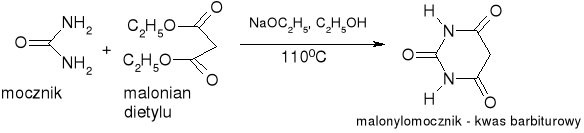
otrzymywanie kwasu nikotynowego:
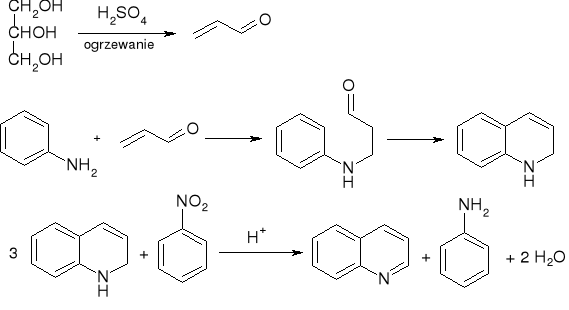
synteza chinoliny - synteza Skraupa:
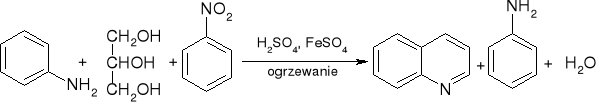
a właściwie:
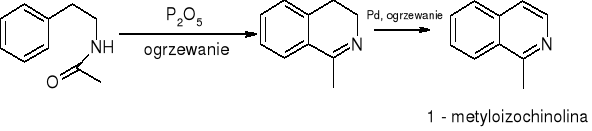
Izochinolina - synteza Bischlera - Napieralskiego
synteza kwasu barbiturowego:
Aminokwasy:
Rozpoznawanie aminokwasów metodą Edmana:
Białko reagując z C6H5NCS (izotiocyjanianem fenylu) daje:
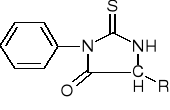
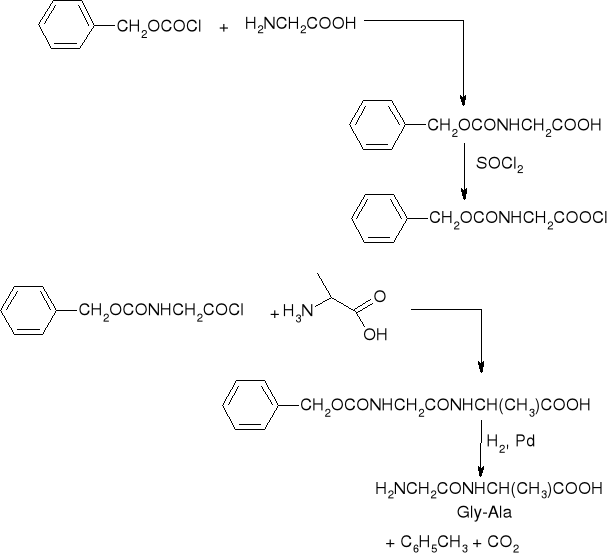
synteza dipeptydów metodą karbobenzoksylową:
synteza Glicynoalaniny (Gly-Ala)
Wyszukiwarka
Podobne podstrony:
CHEMIA ORGANICZNA REAKCJE
Cw10 Reakcje utleniania i redukcji, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia
7322604 CHEMIA ORGANICZNA REAKCJE
Chemia organiczna Tabela otrzymywania i reakcji związków od alkanów do amidów
kolokwium-reakcja addycji, chemia organiczna
Chemia org - Mech. reakcji i izom. opt, Studia WNOŻ SGGW 2008-2013, Inżynierskie, Semestr 2, Chemia
Cw9 Reakcje kompleksowania II, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogoln
Cw8 Reakcje kompleksowania I, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna
CHEMIA ORGANICZNA REAKCJE sciaga 111, Technologia chemiczna, 3 semestr, Chemia organiczna, wykłady
Mechanizmy reakcji chemicznych, Studia, Chemia organiczna i nieorganiczna
Reakcje chemia organiczna
Typy reakcji związków chemicznych, Studia, Chemia organiczna i nieorganiczna
reakcje kompleksowania 111, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna n
Mechanizm reakcji wolnorodnikowego podstawienia WNoZ 2010, Wydział Nauk o Żywności, chemia organiczn
Gancarz, Chemia organiczna mechanizmy reakcji S, podstawy, ładunek formalny, hybrydyzacja
CHEMIA ORGANICZNA REAKCJE
więcej podobnych podstron