1
BUDOWA CZ
Ą
STECZEK
BUDOWA CZ
Ą
STECZEK
2
WI
Ą
ZANIA W CZ
Ą
STECZKACH O RÓ
ś
NYM CHARAKTERZE
Proste
Zło
ż
one
Kowalencyjne
Jonowe
symetryczne
niesymetryczne
substancje
wi
ą
zania
cz
ą
steczki
H
2
H
2
CH
4
H
2
O
CH
4
, H
2
O
NaCl
NaCl

2
3
Pierwiastki mog
ą
uzyskiwa
ć
trwał
ą
konfiguracj
ę
walencyjn
ą
dwiema drogami :
-poprzez
wymian
ę
elektronów
–prowadzi to do
wi
ą
za
ń
jonowych (heteropolarnych),
-poprzez
uwspólnienie elektronów
– co prowadzi
do wi
ą
za
ń
kowalencyjnych (homopolarnych).
WI
Ą
ZANIA MI
Ę
DZY ATOMAMI
4
Powinowactwo chemiczne zachodzi mi
ę
dzy
atomami elektrododatnimi i elektroujemnymi.
Oktet elektronowy uzyskiwany jest poprzez
mi
ę
dzyatomow
ą
wymian
ę
elektronów.
Przykładowo dla wi
ą
zania NaCl, sód oddaje jeden
elektron i staje si
ę
jonem dodatnim, natomiast
chlor przyjmuje jeden elektron i staje si
ę
jonem
ujemnym. Chlor uzyskuje w ten sposób osiem
elektronów na powłoce walencyjnej (pozorny
oktet elektronowy).
Siła wi
ą
zania polega na elektrostatycznym
przyci
ą
ganiu si
ę
jonów (siłami Coulomba).
WI
Ą
ZANIA JONOWE
3
5
Siła elektrycznego oddziaływania s
ą
bardzo
du
ż
e. Przykładowo gdyby dwa ziarenka
piasku, le
żą
ce w odległo
ś
ci 30 m
oddziaływałyby na siebie w ten sposób, ze
wszystkie ładunki w jednym przyci
ą
gałyby
wszystkie ładunki w drugim ziarnku, to siła
wynosiłaby 3 000 000 ton. St
ą
d niewielki
nadmiar lub niedomiar ładunku wystarczy by
spowodowa
ć
dostrzegalne efekty
elektryczne.
WI
Ą
ZANIA JONOWE
6
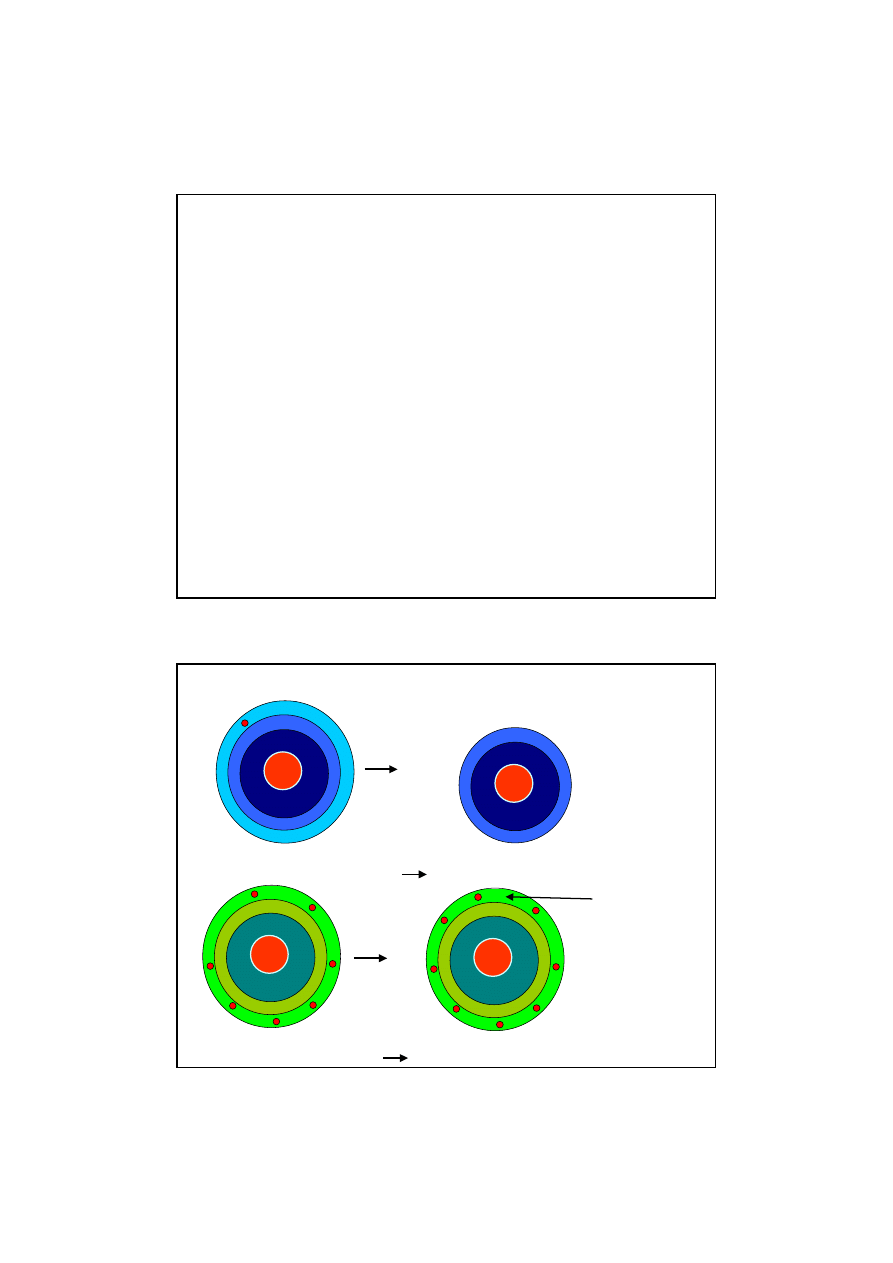
Mechanizm tworzenia wi
ą
zania jonowego w cz
ą
steczkach NaCl
Atom sodu (Na) oddaje elektron i staje si
ę
kationem (Na+)
Na (2,8,1) - e-
Na+ (2,8)
8e
+11
2e
1e
-1e
8e
+11
2e
+1
Atom chloru (Cl) przyjmuje elektron i staje sie anionem (Cl-)
Cl (2,8,7) + e-
Cl- (2,8,8)
8e
+17
2e
7e
+1e
8e
+17
2e
8e
-1e
atom sodu
jon sodu
atom chloru
jon choru
oktet
elektronowy
4
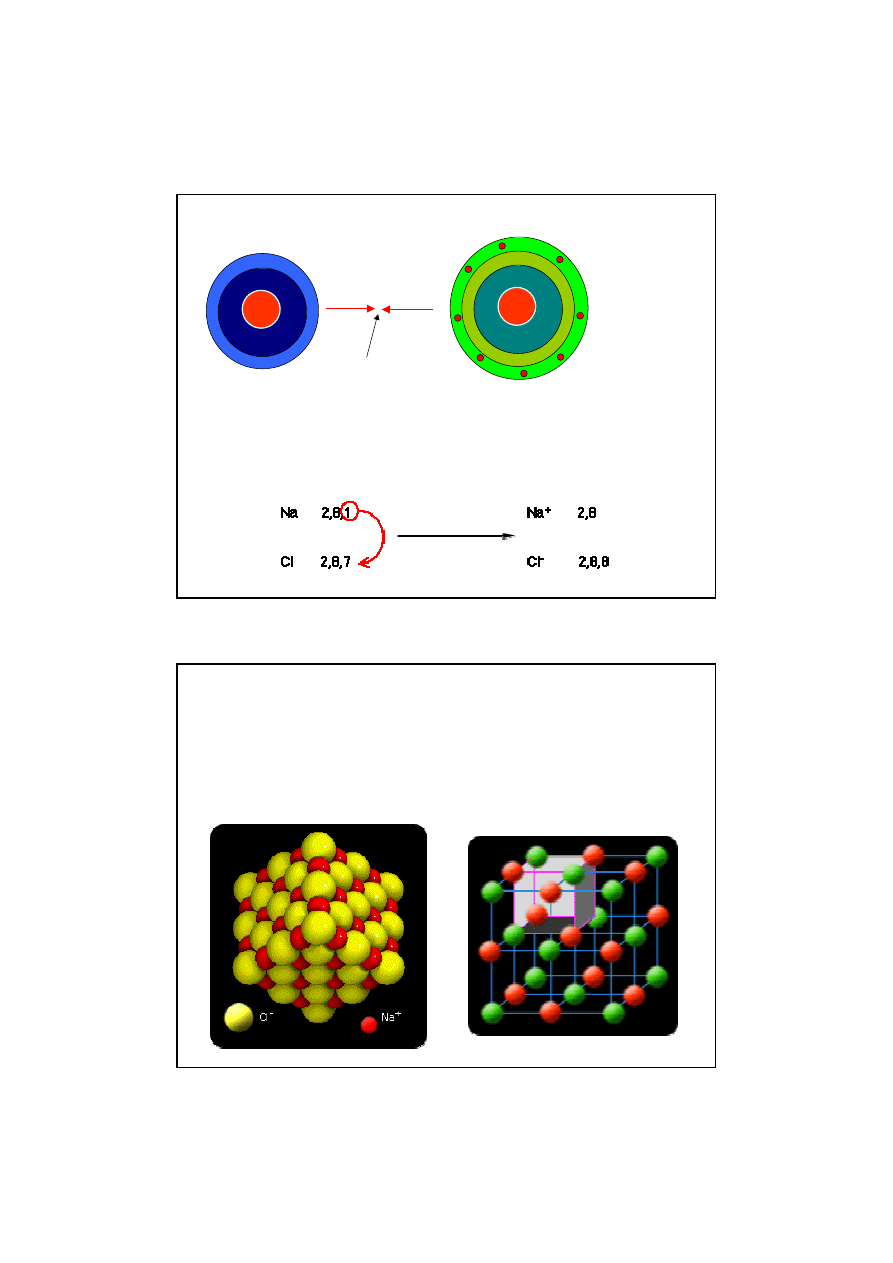
7
Siły elektrostatycznego przyci
ą
gania utrzymuj
ą
w trwało
ś
ci cz
ą
steczk
ę
.
8e
+11
2e
+1
jon sodu
8e
+17
2e
8e
-1e
jon choru
Na+ Cl-
siła elektrostatycznego
przyci
ą
gania
8
Struktura kryształu NaCl
Zwi
ą
zki tworz
ą
ce sieci jonowe składaj
ą
si
ę
z dodatnich
i ujemnych jonów rozmieszczonych na przemian
w przestrzeni a siły oddziaływania elektrostatycznego
pomi
ę
dzy jonami s
ą
równomiernie rozło
ż
one we
wszystkich kierunkach uprzywilejowanych.
5
9
Wyst
ę
puj
ą
w cz
ą
steczkach zło
ż
onych z tego
samego pierwiastka (substancje proste np. H
2
,
O
2
,N
2
). Powstaj
ą
wskutek
uwspólnienia elektronów
,
które tworz
ą
dublet elektronowy
. Dublet tworzy
wspóln
ą
dla całej cz
ą
steczki, całkowicie zapełnion
ą
powłok
ę
elektronow
ą
. Para elektronów nale
ż
y do
obu atomów i kr
ąż
y po torze eliptycznym wokół
obu j
ą
der. Dublet mo
ż
e by
ć
utworzony przez
elektrony posiadaj
ą
ce trzy takie same liczby
kwantowe, ró
ż
ni
ą
ce si
ę
spinem.
WI
Ą
ZANIA KOWALENCYJNE
10
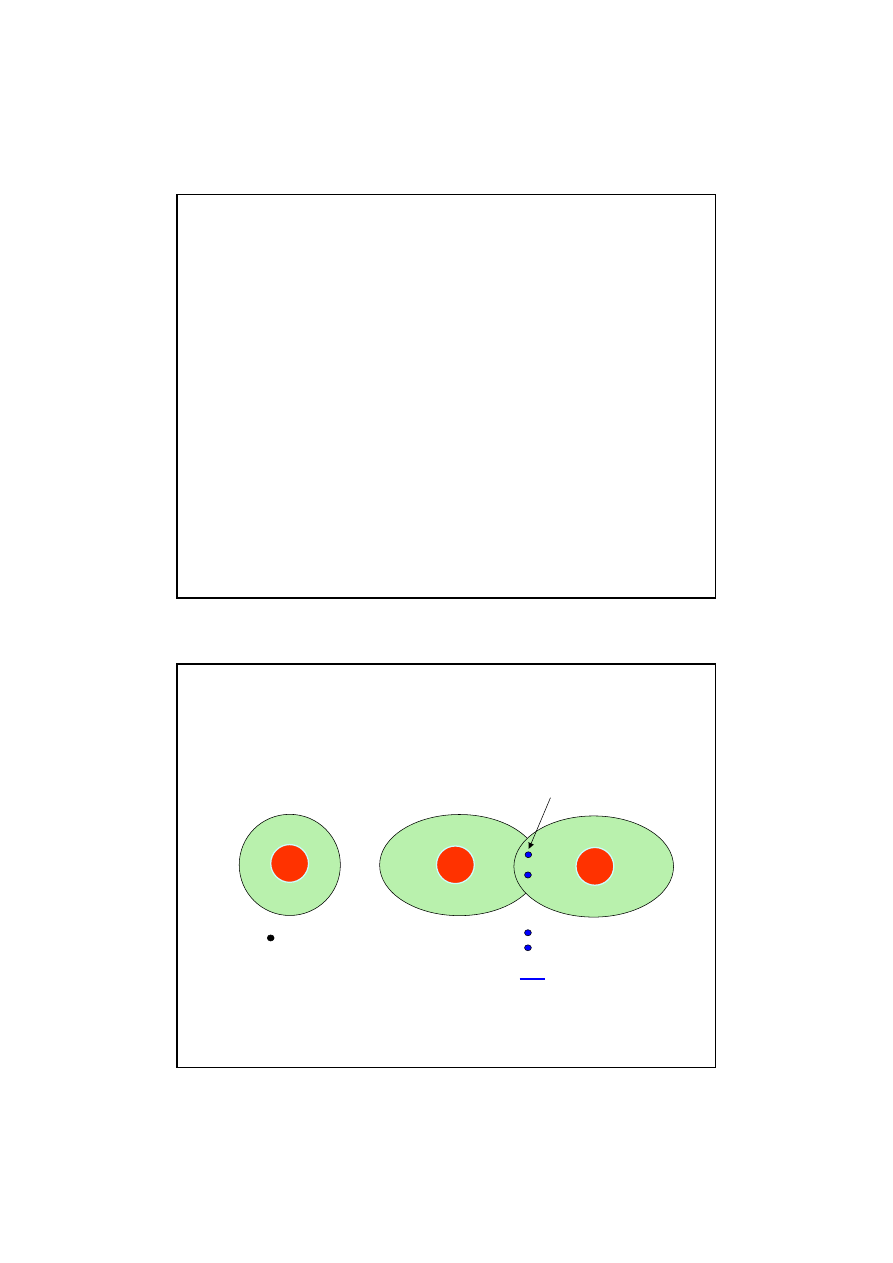
Mechanizm powstawania wi
ą
zania
kowalencyjnego w cz
ą
steczce wodoru
CZ
Ą
STECZKI HOMOJ
Ą
DROWE
Wi
ą
zanie pojedyncze oboj
ę
tne
1e
+1
+1
+1
2e
H
H
H
H
H
dublet
elektronowy
6
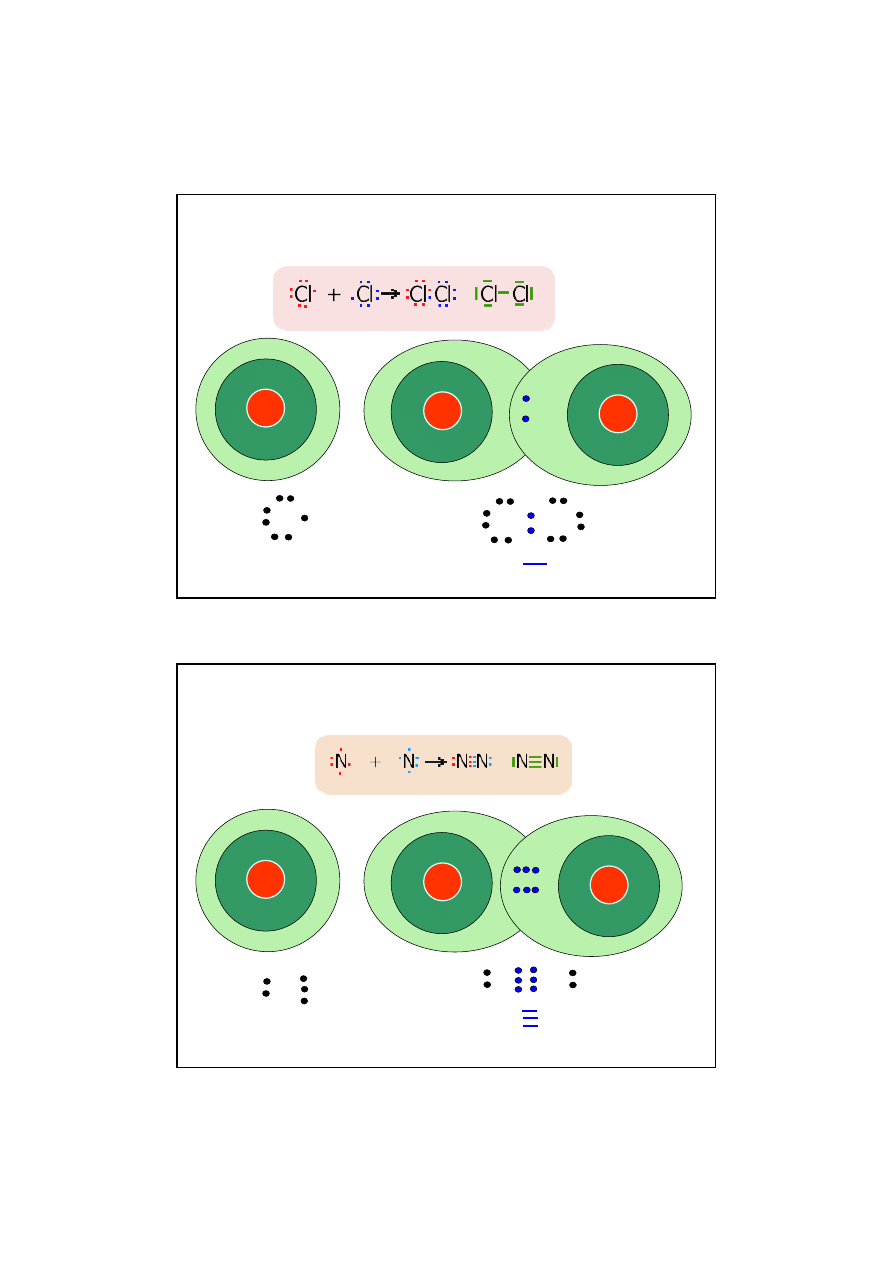
11
Mechanizm powstawania wi
ą
zania kowalencyjnego
w cz
ą
steczce chloru
CZ
Ą
STECZKI HOMOJ
Ą
DROWE
Wi
ą
zanie pojedyncze oboj
ę
tne
+17
Cl
7e
+17
6e
10e
10e
+17
6e
10e
2e
Cl
Cl
Cl
Cl
12
Mechanizm powstawania wi
ą
zania kowalencyjnego
w cz
ą
steczce azotu
CZ
Ą
STECZKI HOMOJ
Ą
DROWE
Wi
ą
zanie potrójne oboj
ę
tne
+7
N
5e
+7
2e
2e
2e
+7
2e
2e
6e
N
N
N
N
7
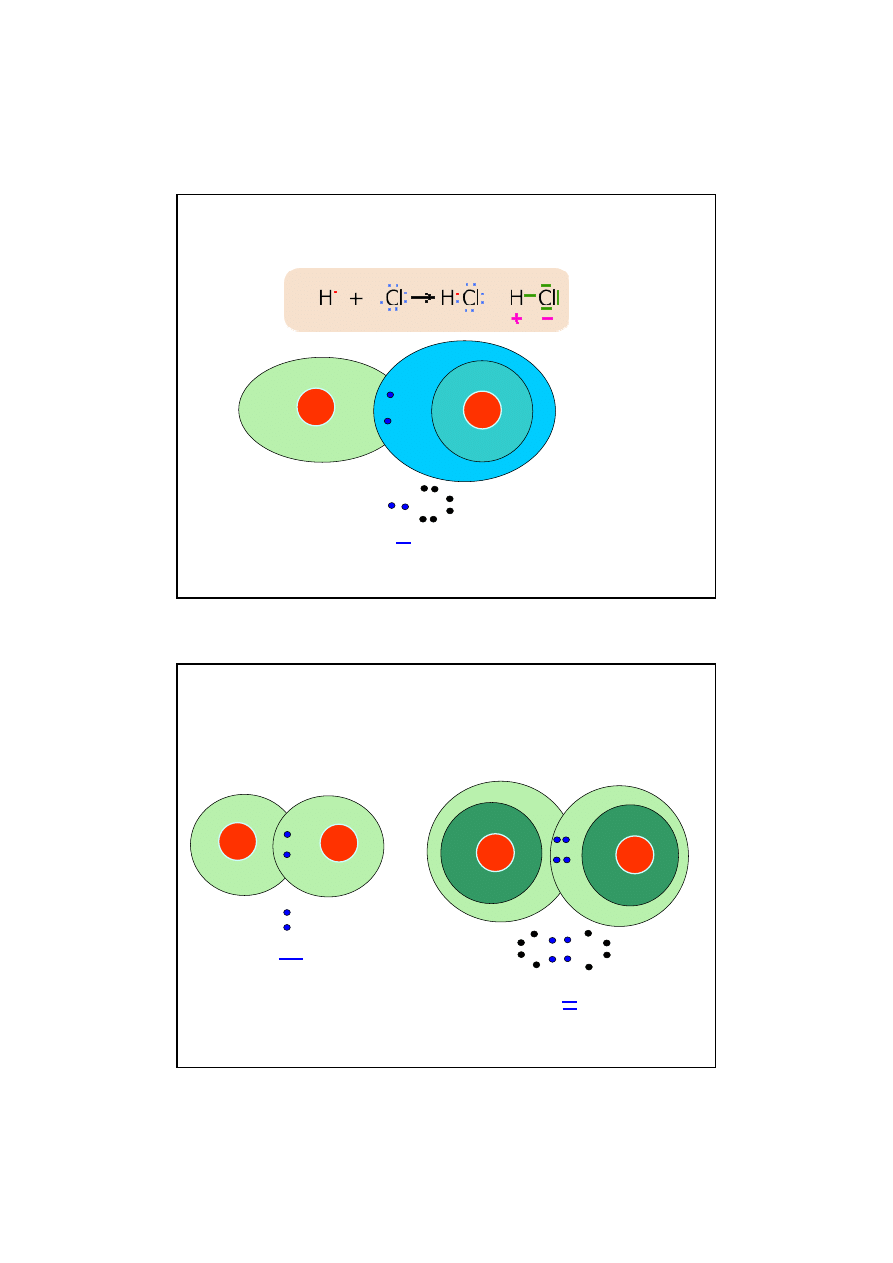
13
Mechanizm powstawania wi
ą
zania kowalencyjnego
spolaryzowanego w cz
ą
steczce chlorowodoru.
CZ
Ą
STECZKI HETEROJ
Ą
DROWE
Wi
ą
zanie pojedyncze spolaryzowane
+1
+17
6e
10e
2e
H
Cl
H
Cl
14
WI
Ą
ZANIE KOWALENCYJNE – CZ
Ą
STECZKI
HOMOJ
Ą
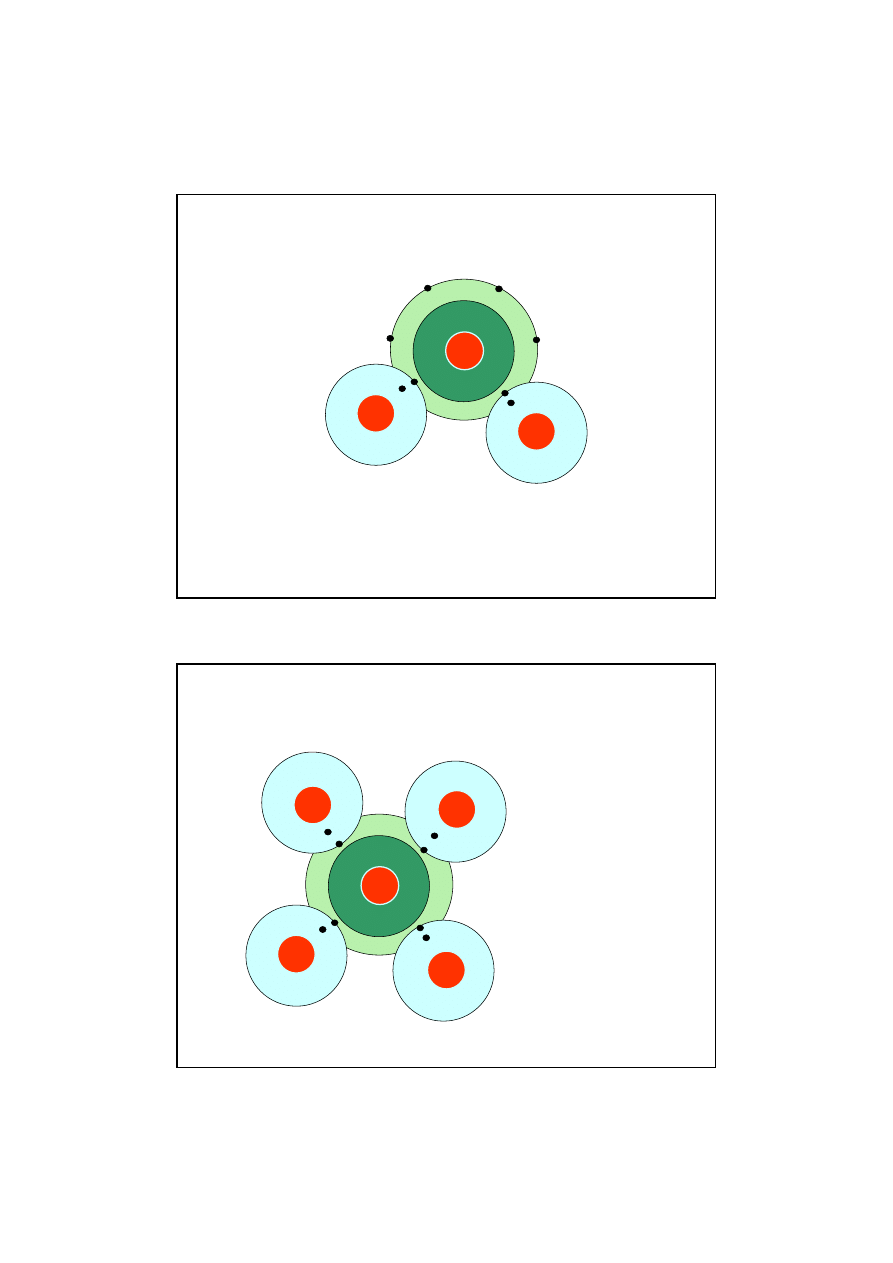
DROWE -przykłady
Wi
ą
zanie pojedyncze oboj
ę
tne
Wi
ą
zanie podwójne oboj
ę
tne
+1
+1
2e
H
H
H
H
+8
4e
2e
+8
4e
2e
4e
O
O
O
O
8
15
Wi
ą
zanie podwójne spolaryzowane
WI
Ą
ZANIE KOWALENCYJNE – CZ
Ą
STECZKI
HETEROJ
Ą
DROWE - przykłady
+8
2e
+1
+1
H
2
O
O
H
H
16
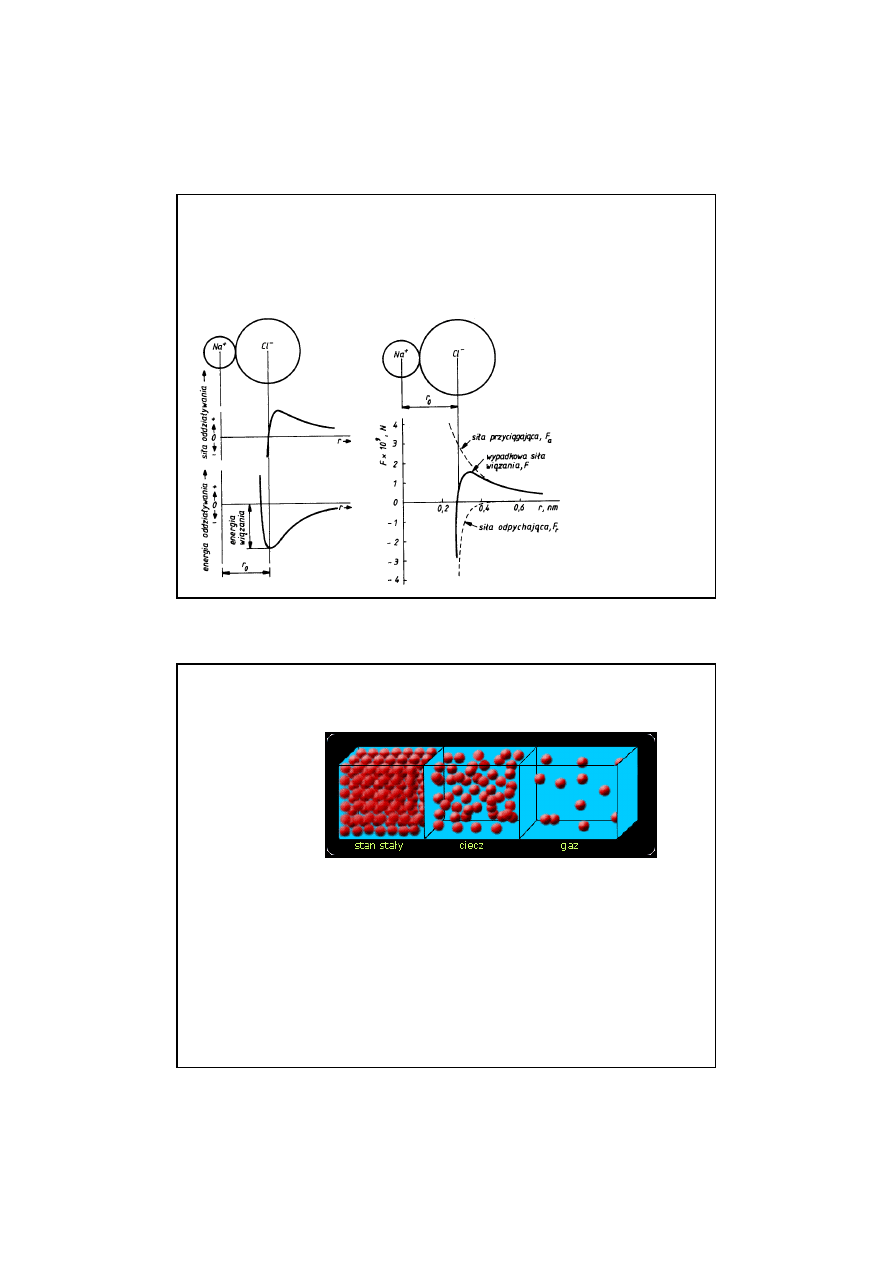
Wi
ą
zanie poczwórne oboj
ę
tne
WI
Ą
ZANIE KOWALENCYJNE – CZ
Ą
STECZKI
HETEROJ
Ą
DROWE - przykłady
+6
2e
+1
+1
CH
4
H
H
C
+1
+1
H
H
9
17
Mi
ę
dzy atomami w cz
ą
steczce istniej
ą
siły przyci
ą
gaj
ą
ce oraz
odpychaj
ą
ce. Siły przyci
ą
gaj
ą
ce s
ą
spowodowane np. oddziaływaniem
elektrostatycznym. Siły odpychaj
ą
ce powstaj
ą
wskutek odpychania si
ę
chmur elektronów przy zbli
ż
aniu si
ę
atomów na blisk
ą
odległo
ść
.
Energie i siły
oddziaływania
mi
ę
dzy par
ą
jonów Na
+
i Cl
-
ENERGIA WI
Ą
ZANIA
18
Pierwiastki i zwi
ą
zki chemiczne mog
ą
wyst
ę
powa
ć
w nast
ę
puj
ą
cych stanach skupienia:
-stałym,
-ciekłym,
-gazowym
.
STANY SKUPIENIA
Istnieje równie
ż
czwarty stan skupienia, stan plazmy, który istnieje
jedynie w zakresie niezwykle wysokich temperatur.
Stan stały
charakteryzuje si
ę
utrzymaniem kształtu, postaci i obj
ę
to
ś
ci
próbki.
Stan ciekły
odznacza sie tym,
ż
e próbka zachowuje swoj
ą
okre
ś
lon
ą
obj
ę
to
ść
podczas przelewania z jednego zbiornika do drugiego, ale
przyjmuje kształt mieszcz
ą
cego j
ą
naczynia
Stan gazowy
charakteryzuje si
ę
tym,
ż
e próbka nie ma ani własnego
kształtu, ani obj
ę
to
ś
ci i mo
ż
e rozprzestrzenia
ć
si
ę
po całej obj
ę
to
ś
ci
naczynia, w której jest zawarta.

10
19
Stan skupienia zale
ż
y od wzajemnego stosunku
energii potencjalnej odpowiadaj
ą
cej przyci
ą
ganiu
mi
ę
dzy cz
ą
steczkami do energii kinetycznej ruchu
cieplnego cz
ą
steczek.
W stanie gazowym przewa
ż
a energia ruchu
cieplnego, który jest ograniczony zderzeniami.
W stanie ciekłym siły wewn
ę
trzne działaj
ą
ce na
cz
ą
steczki we wszystkich kierunkach równowa
żą
si
ę
.
Pozostaje jedynie działanie pola grawitacyjnego
i sił na granicy substancji.
W stanie stałym, wyst
ę
puj
ą
cym w dostatecznie niskiej dla
danej substancji temperaturze, ruchy cz
ą
steczek ograniczaj
ą
si
ę
jedynie do drga
ń
zlokalizowanych. Przewa
ż
a energia
potencjalna wi
ą
za
ń
.
20
STANY SKUPIENIA
Stan gazowy
charakteryzuje si
ę
bardzo du
ż
ym
współczynnikiem
ś
ci
ś
liwo
ś
ci, a tak
ż
e brakiem
spr
ęż
ysto
ś
ci, uporz
ą
dkowania cz
ą
steczek i stacjonarnych
wi
ą
za
ń
. W gazach znajduje si
ę
ś
rednio
2,7
·
10
25
cz
ą
steczek/m
3
, co daje odległo
ść
mi
ę
dzy cz
ą
steczkami
rz
ę
du
30 angstremów
(1Ä=10
-8
cm).
W
cieczach
w porównaniu z gazami, odległo
ś
ci
mi
ę
dzycz
ą
steczkowe s
ą
mniejsze, a siły wzajemnego
oddziaływania wi
ę
ksze. Dlatego ciecze zachowuj
ą
własn
ą
obj
ę
to
ść
, wykazuj
ą
niewielk
ą
ś
ci
ś
liwo
ść
i w porównaniu z
gazami mniejsz
ą
rozszerzalno
ść
termiczn
ą
.Ka
ż
da cz
ą
steczka
cieczy przebywa stale w sferze oddziaływania sił
przyci
ą
gaj
ą
cych pochodz
ą
cych od otaczaj
ą
cych j
ą
innych
cz
ą
steczek. Przy mniejszych odległo
ś
ciach pojawiaj
ą
si
ę
siły
wzajemnego odpychania.
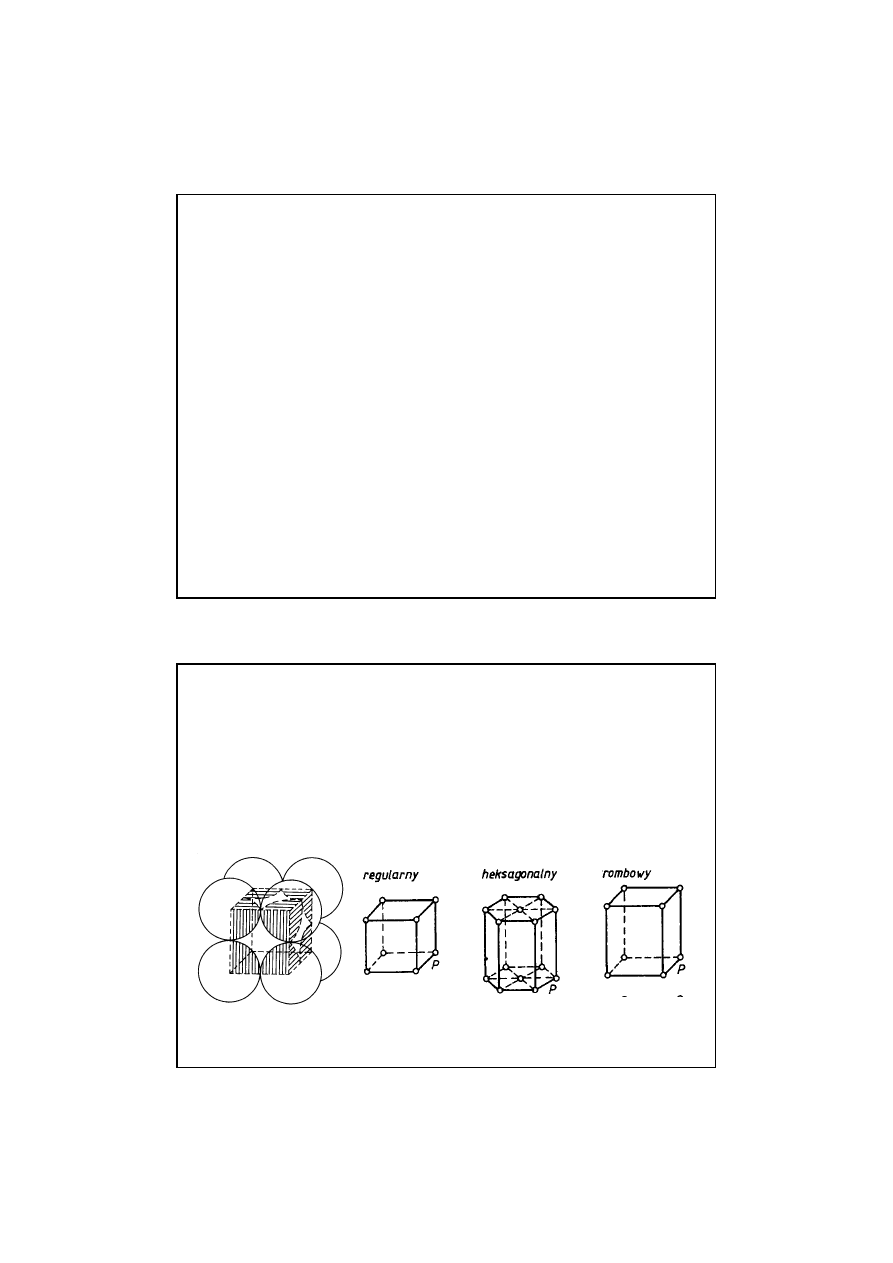
11
21
STANY SKUPIENIA
W stanie
stałym
odległo
ść
mi
ę
dzy s
ą
siednim atomami wynosi
ś
rednio
kilka angstremów
, w
1 m
3
znajduje si
ę
ok.
10
29
atomów
. W ciałach stałych cz
ą
steczki s
ą
ze sob
ą
zwi
ą
zane
trwałymi, stacjonarnymi wi
ą
zaniami i zajmuj
ą
stałe wzgl
ę
dem
siebie poło
ż
enia.
Stan stały
W odró
ż
nieniu od gazów i cieczy, ciała stałe maj
ą
w danej
temperaturze okre
ś
lony kształt i obj
ę
to
ść
. Dzi
ę
ki bardziej
zwartej budowie maj
ą
one du
żą
sztywno
ść
, ich g
ę
sto
ść
jest
mniej zale
ż
na od temperatury i ci
ś
nienia ni
ż
g
ę
sto
ść
cieczy i
gazów.
Odległo
ść
mi
ę
dzy s
ą
siednim atomami wynosi
ś
rednio
kilka
angstremów
, w
1 m
3
znajduje si
ę
ok..
10
28
atomów
. Cz
ą
steczki
nie s
ą
zwi
ą
zane ze sob
ą
stacjonarnymi, trwałymi wi
ą
zaniami.
Wzgl
ę
dne poło
ż
enia cz
ą
steczek zmieniaj
ą
si
ę
.
22
STRUKTURY KRYSTALICZNE
– tworzone przez
zespół powtarzaj
ą
cych si
ę
regularnie identycznych
elementów nazywanych
komórkami elementarnymi
.
Struktury te s
ą
anizotropowe
.
Przykłady: metale, półprzewodniki
Uproszczony schemat komórki elementarnej
RODZAJE STRUKTUR ATOMOWYCH
12
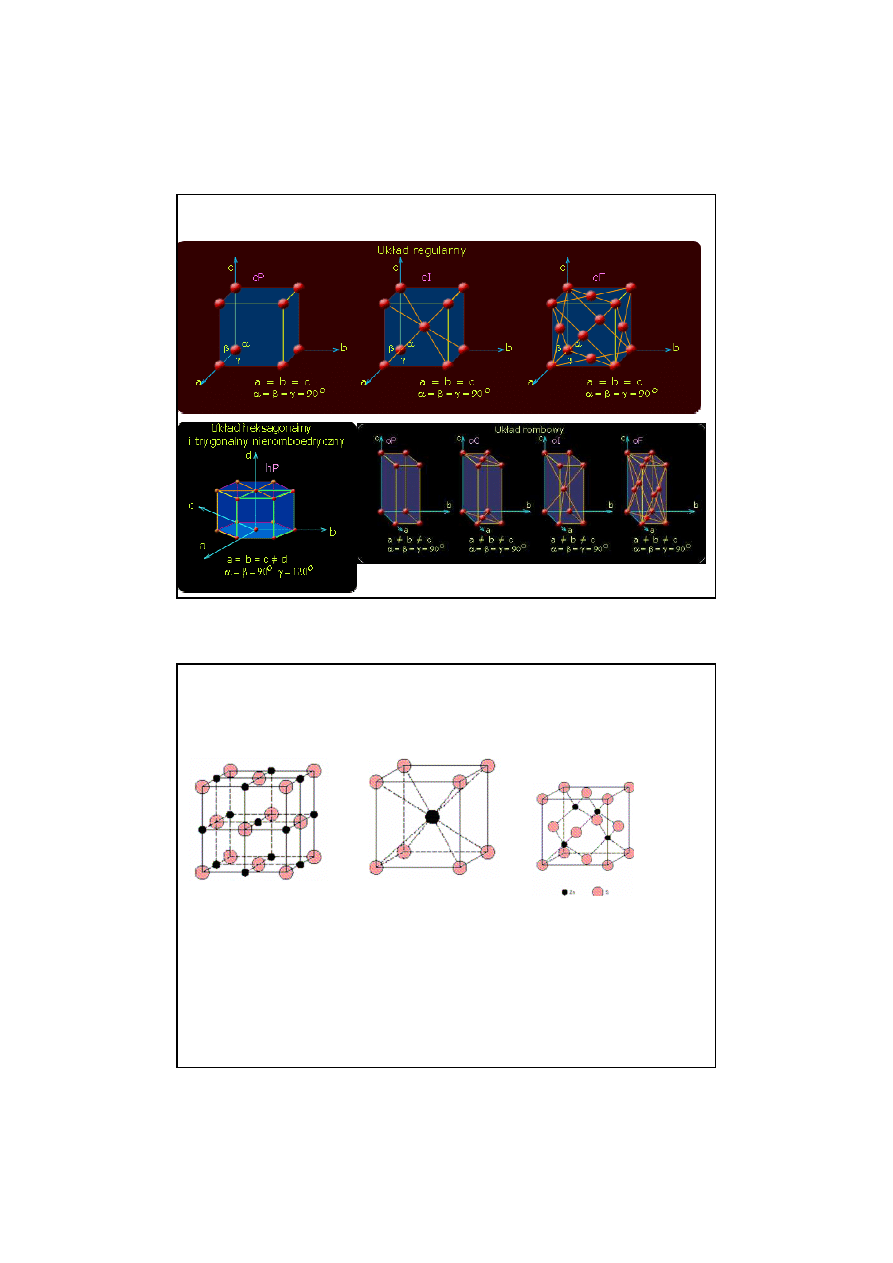
23
STRUKTURY KRYSTALICZNE
24
STRUKTURY KRYSTALICZNE
NaCl, MgO,
MnS, LiF, FeO
CsCl
ZnS, ZnTe

13
25
Struktura polikrystaliczna
Al
2
O
3
26
STRUKTURY AMORFICZNE (bezpostaciowe)–
tworzone s
ą
z
atomów drgaj
ą
cych wokół punktów rozmieszczonych
chaotycznie w wi
ę
kszej przestrzeni. Nie s
ą
rozmieszczone w
prawidłowej sieci przestrzennej. Brak w nich powtarzalno
ś
ci
budowy.
Substancje te, okre
ś
lone cz
ę
sto jako ciecze przechłodzone o
du
ż
ej lepko
ś
ci, wykazuj
ą
niektóre cechy charakterystyczne
dla ciał stałych, jak twardo
ść
i zdolno
ść
zachowania nie
zmienionego kształtu. najłatwiej dostrzegaln
ą
wł
ąś
ciwo
ś
ci
ą
fizyczn
ą
odró
ż
niaj
ą
c
ą
ciał
ą
bezpostaciowe od krystalicznego
jest brak okre
ś
lonej temperatury topnienie. Ciała
bezpostaciowe ogrzewane stopniowo mi
ę
kn
ą
i rozpływaj
ą
si
ę
. Charakteryzuj
ą
si
ę
izotropowo
ś
ci
ą
.
Przykłady: ciecze, smoła, tworzywa sztuczne, szkło, stopiona
i ochłodzona krzemionka,
ż
ywice polimetakrylowe.
STRUKTURY AMORFICZNE
Wyszukiwarka
Podobne podstrony:
Budowa cząsteczki wody
koło 1 budowa cząsteczek
hydrogeologia, Hydra, BUDOWA CZĄSTECZKOWA: Woda zbudowana jest z 2 atomów wodoru i 1 atomu tlenu
Budowa cząsteczki wody biochemia 1sem
wiazania-chemiczne-i-budowa-czasteczek
Budowa cząsteczek enzymów
Biłyk,chemia wody, Budowa cząsteczki wody
ciężkowski,hydrogeologia, BUDOWA CZĄSTECZKOWA I WLAŚCIWOŚCI FIZYCZNE WODY
Budowa cząsteczki chlorofilu ściaga
Chemia labolatorium, Tłuszcze, Skład i budowa cząsteczek tłuszczu - tłuszcze są to estry gliceryny (
Budowa cząsteczki wody
Budowa czastek(1)
Cząsteczkowa budowa materii
ITIL Podstawy W2 Budowa i optymalizacja procesów i serwisów ITIL
czasteczkowa budowa cial 3ZB6SPIWLXANIS5ZRTR27FOU5PVPCYOEPO45MCQ
FP W2 Budowa syst fins publ 20 09 13
budowa atomow i czasteczek , Budowa atomów i cząsteczek
budowa atomów i cząsteczek sprawdzian, VIII L.O
budowa atomów i cząsteczek sprawdzian VIII L O
więcej podobnych podstron