
Druga zasada termodynamiki
Z doświadczenia wiemy, że są procesy zgodne z zasadą zachowania energii,
które nigdy nie występują w przyrodzie. Na przykład, nigdy nie obserwujemy,
by kamień leżący na podłodze spontanicznie się oziębił i wzniósł do sufitu,
uzyskując kosztem ciepła energię potencjalną. Nie spodziewamy się też, by w
słoneczny letni dzień zamarzł staw, oddawszy energię wewnętrzną otoczeniu.
Zadaniem drugiej zasady termodynamiki jest włączyć do termodynamiki takie
fakty doświadczalne, jej podstawą jest zdrowy rozsądek [Huang].

Wszystkie poniższe sformułowania drugiej zasady termodynamiki są
równoważne:
Clausius (1850)
: Nie istnieje proces termodynamiczny, którego jedynym
wynikiem byłoby pobranie ciepła ze zbiornika chłodniejszego i przekazanie go
do zbiornika cieplejszego (nie jest możliwe zbudowanie idealnej maszyny
chłodzącej)
Kelvin (1851)
: Nie istnieje proces termodynamiczny, którego jedynym
wynikiem byłoby pobranie ciepła ze zbiornika i całkowita zamiana tego ciepła
na pracę mechaniczną.
Późniejsze od sformułowania Kelvina jest sformułowanie podane przy pomocy
pojęcia silnika termodynamicznego

Planck
: Niemożliwe jest zbudowanie silnika termodynamicznego pracującego
cyklicznie, który całe pobrane ciepło zamieniałby na pracę (nie jest możliwe
zbudowanie idealnego silnika cieplnego
– czyli perpetuum mobile drugiego
rodzaju).
Dla sprawności silnika cieplnego, z teorią których druga zasada jest związana,
oznacza to, że sprawność silników cieplnych jest mniejsza od jedności
Druga zasada termodynami
ki pozwala na zdefiniowanie bezwzględnej skali
temperatur Kelvina identycznej ze skalą temperatury gazu doskonałego.
Pozwala ona też na wprowadzenie użytecznej funkcji stanu nazywanej
entropią. Związana jest z pojęciem procesów odwracalnych i nieodwracalnych,
z kierunkiem procesów zachodzących samorzutnie w układach izolowanych, z

kierunkowością zjawisk w przyrodzie. Za pomocą pojęcia entropii druga
zasada termodynamiki ma brzmienie następujące:
Boltzmann:
Entropia układu izolowanego nie maleje.
Druga zasad
a termodynamiki nie jest ścisłym prawem przyrody, ma jedynie
charakter statystyczny. Zdarzenia sprzeczne z nią mogą w rzeczywistości
zajść, lecz są mało prawdopodobne. Ściślej mówiąc są tym mniej
prawdopodobne, im więcej cząstek liczy układ termodynamiczny. II zasada
termodynamiki dobrze sprawdza się w skali makro, gorzej w skali mikro. W
zaawansowanym wykładzie mechaniki statystycznej dowodzi się nawet, że
pewne wydarzenia sprzeczne z drugą zasadą termodynamiki z pewnością
będą miały miejsce (np. twierdzenie Poincare’go o powrocie). Jednak czas,
jaki przychodzi czekać na tego typu zajście w makroskopowym układzie,
znacznie przekracza wiek wszechświata, możemy się więc „nie doczekać”...
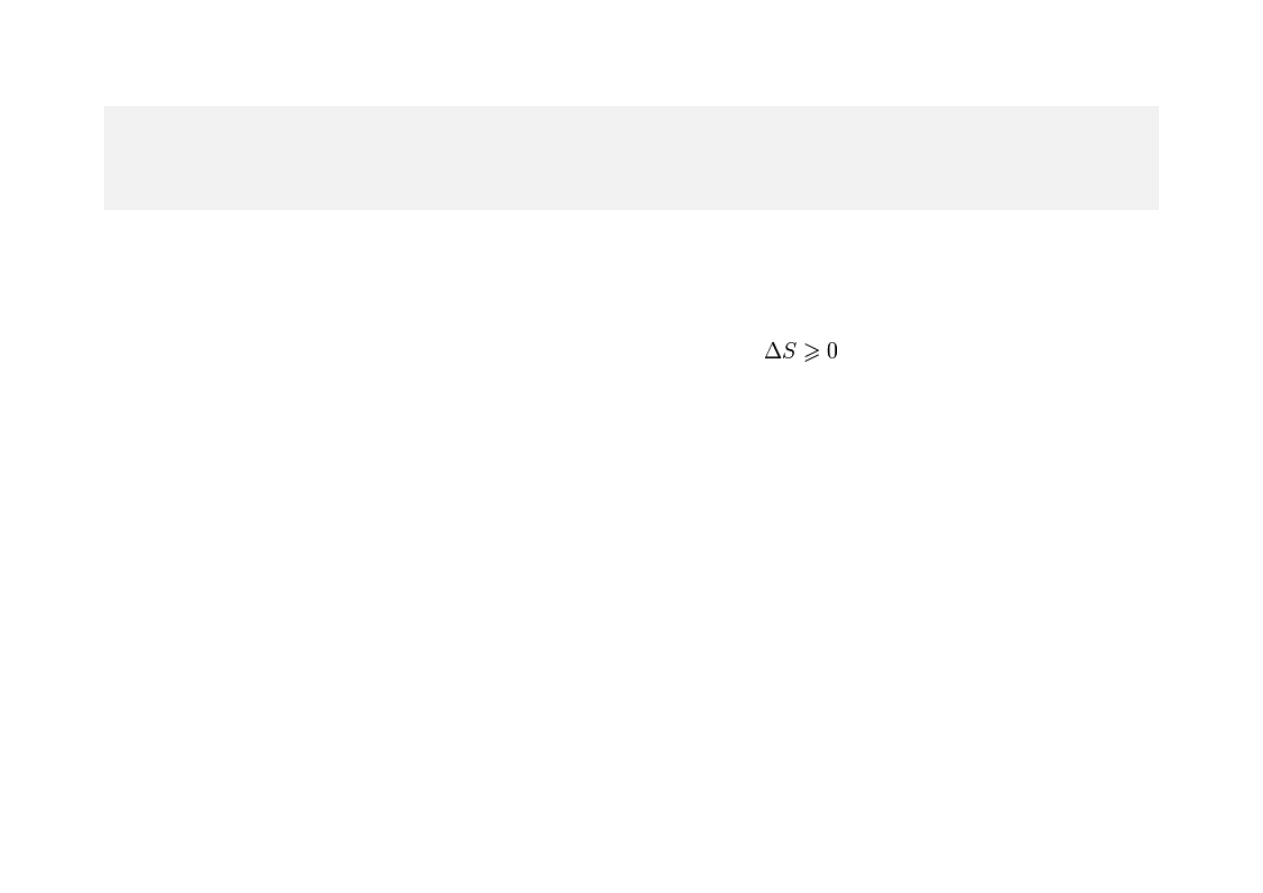
Druga zasada termodynamiki
stwierdza, że w układzie termodynamicznie
izolowanym istnieje funkcja stanu zwana entropi
ą S, której zmiana ΔS w
spełnia nierówność
, przy czym równość
zachodzi wtedy i tylko wtedy, gdy proces jest odwracalny.
W uproszczeniu
można to wyrazić też tak:
układzie termodynamicznie izolowanym w dowolnym procesie entropia
nigdy nie maleje"
Uwaga!
W wielu opracowa
niach pojawia się błąd, polegający na stwierdzeniu, że druga zasada termodynamiki zapewnia
formie ciepła istnienie czynnika całkującego. Jest to tylko część treści tej zasady. Najlepiej się o tym przekonać
wybierając prosty układ opisany dwoma parametrami. Z matematyki wiadomo, że w takim układzie
(dwuwymiarowa przestrzeń stanów), każda forma liniowa ma czynnik całkujący! A zatem tak rozumiana zasada
termodynamiki nic by nie wnosiła do takich układów.
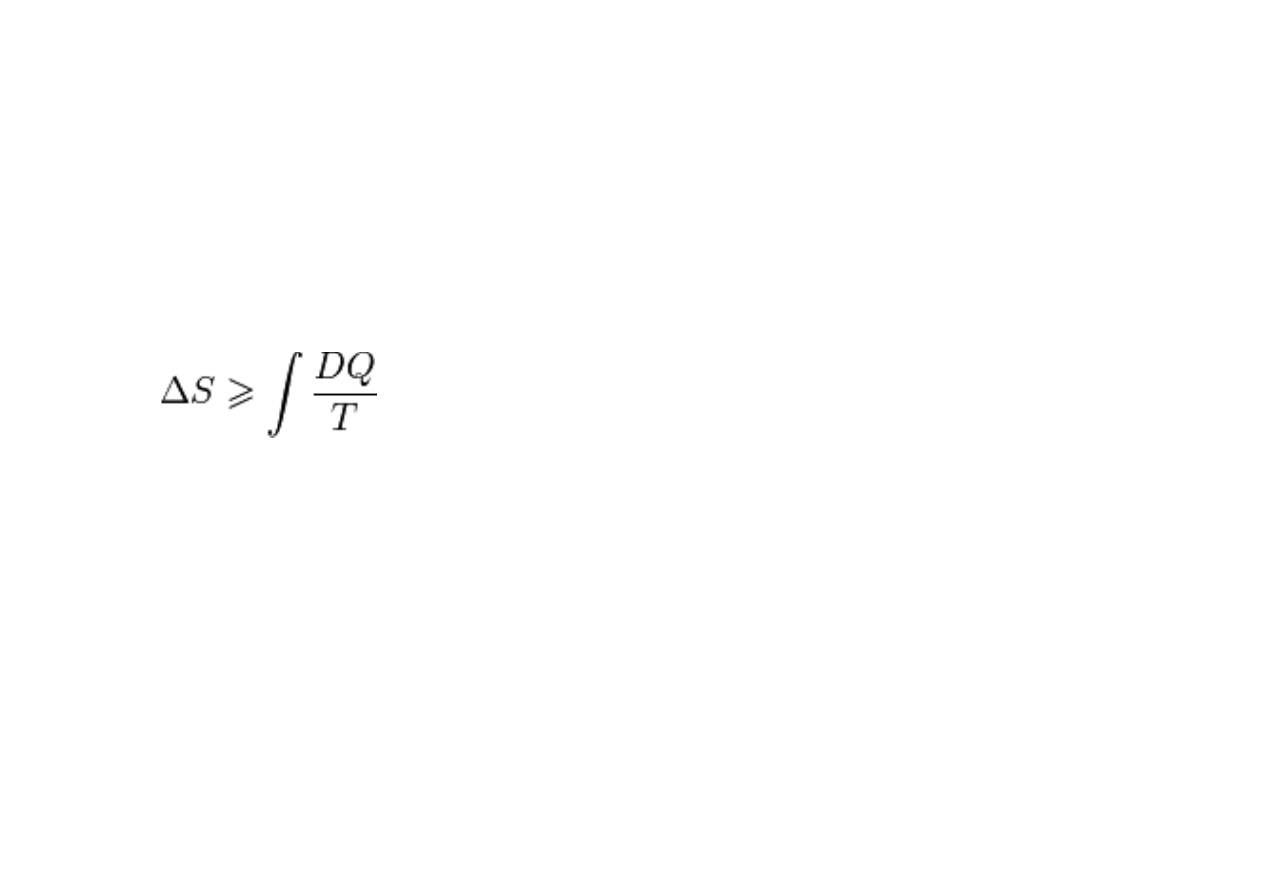
===========================================================
Matematyczny zapis tego faktu to następujące sformułowanie: zmiana entropii
ΔS w dowolnym procesie odwracalnym jest równa całce z przekazu ciepła DQ
podzielonego przez
temperaturę T. W procesie nieodwracalnym natomiast
zmiana entropii jest większa od tej całki. Forma całkowa II zasady
termodynami
ki wygląda następująco:
Różnica ta jest miarą nieodwracalności procesu i jest związana z
rozpraszaniem energii. Oznaczenie DQ
użyte do zapisu przyrostu ciepła ma
na celu odróżnienie tego przyrostu od różniczki (ozn. dX), ponieważ przyrost
ciepła nie jest różniczką żadnej funkcji. Gdyby był różniczką, ciepło byłoby
funkcją stanu.
Alternatywne sformułowania
Druga zasada termodynamiki może być sformułowana na wiele równoważnych
sposobów. Wiele z nich nie wymaga odwoływania się do abstrakcyjnych pojęć,

takich jak entropia, umożliwiając łatwiejsze zrozumienie fizycznej istoty tego
prawa.
Najszerzej znane alternatywne sformułowania pochodzą od Clausiusa:
"Ciepło nie może samorzutnie przepływać od ciała o temperaturze
niższej do ciała o temperaturze wyższej"
"Nie jest możliwy proces, którego jedynym skutkiem byłoby pobranie
pewnej ilości ciepła ze zbiornika i zamiana go w równoważną ilość
pracy"
Można udowodnić równoważność tych stwierdzeń z powyższym
sformułowaniem.
Wprowadzając pojęcie perpetuum mobile drugiego rodzaju, jako silnik cieplny
pobierający energię cieplną z układu i w całości przekształcający ją na pracę,
można sformułować drugą zasadę termodynamiki w następujący sposób:
"Nie istnieje perpetuum mobile drugiego rodzaju"

Definicja w terminach termodynamiki statystycznej
Entropia (S) jest
funkcją stanu będąca miarą liczby sposobów (W) na
jakie może być zrealizowany określony stan termodynamiczny danego
układu w określonej temperaturze (T)
Układ dąży do stanu, który może byd w danych warunkach zrealizowany na jak
najwięcej sposobów; dąży więc on do maksymalizacji entropii.
Entropia jest ciągłą, różniczkowalną i monotonicznie rosnącą funkcją energii
wewnętrznej (U), co zapisuje się matematycznie jako:
Entropia jest wielkością ekstensywną, addytywną w danym stanie układu, tj.
entropia całego układu jest wówczas sumą entropii wszystkich jego części,
będących rozdzielnymi układami makroskopowymi.
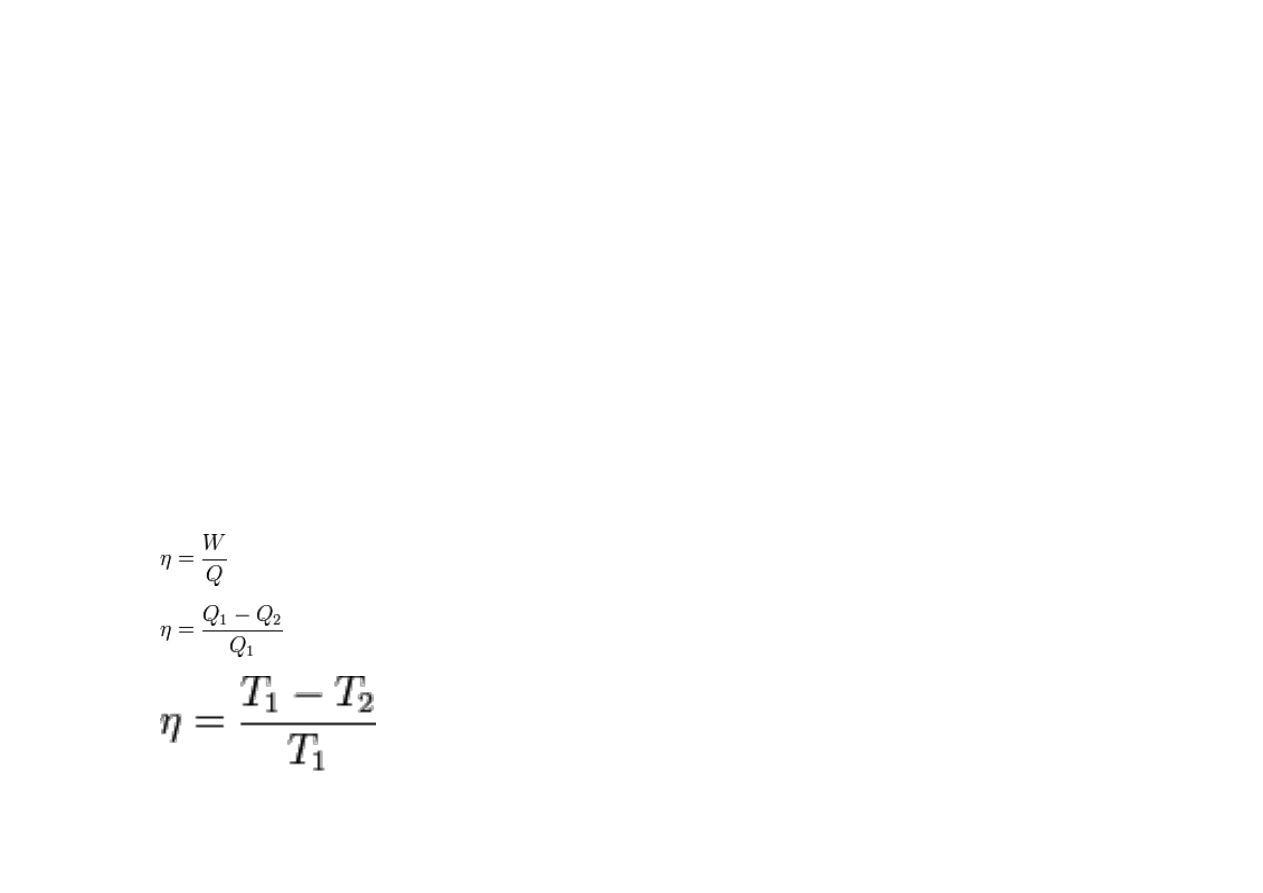
W przypadku połączenia tych części (np. zmieszanie płynów), entropia nie spełnia
warunku addytywności.
Wnioski z II zasady Termodynamiki
Silnik cieplny nie może działać bez różnic temperatury
Inne, równoważne, sformułowanie drugiej zasady termodynamiki wiąże się z silnikiem
cieplnym, czyli urządzeniem zamieniającym ciepło na pracę. Zgodnie z tym
sformułowaniem, spontaniczny przekaz ciepła może się dokonywać tylko od ciała
cieplejszego do zimniejszego. Idealny silnik, pracujący w cyklu przemian
odwracalnych, ma sprawnośćη ograniczoną różnicą temperatur ciał, pomiędzy którymi
przekazywane jest ciepło:

gdzie ciepło jest przekazywane od ciała o temperaturze T
1
do ciała o temperaturze T
2
.
Silnik spełniający tę regułę jest nazywany silnikiem Carnota.
Z II zasady termodynamiki zastosowanej do silników cieplnych wynika, że nie można
ciepła zamieniać na pracę bez ograniczeń, choć jest to zgodne z I zasadą
termodynamiki. Nie można bez wkładu pracy przesyłać energii termicznej między
ciałami mającymi tę samą temperaturę. Oznacza to, że perpetuum mobile II rodzaju nie
istnieje.
Prowadzi to do dalszego wniosku - nie da się w pełni kontrolować procesów
statystycznych, np. nie można czerpać energii z przypadkowych ruchów cząstek,
takich jak ruchy Browna. Z II zasady wynika, że przyrządy do czerpania tego rodzaju
energii po pewnym czasie też zaczną się zachowywać przypadkowo, a więc staną się
bezużyteczne. Miarą tej przypadkowości jest właśnie temperatura. Aby czerpać
energię termiczną z układu, trzeba dysponować czymś zimniejszym niż ten układ.
Śmierć cieplna Wszechświata
Z II zasady termodynamiki wynika też hipoteza tzw. śmierci cieplnej Wszechświata.
Miałaby ona polegać na tym, iż po jakimś czasie Wszechświat, jako całość, dojdzie do
stanu równowagi termodynamicznej, czyli będzie miał jednakową temperaturę w

każdym punkcie i wymiana energii termicznej całkowicie zaniknie, a co za tym idzie
zanikną wszelkie inne rodzaje wymiany energii, które w ten czy inny sposób są zawsze
związane ze zmianą temperatury. Teoria śmierci cieplnej jest jednak nadinterpretacją,
wynikającą z przeniesienia rozumowania pochodzącego z fizyki fenomenologicznej w
dziedzinę przekraczającą zakres jej stosowalności – do kosmologii. Taka interpretacja
II zasady termodynamiki zakłada bowiem, że Wszechświat jako całość jest układem
izolowanym, co jest nieprawdą, gdyż rozszerzający się wszechświat jest układem
otwartym
Paradoks nieodwracalności
Z interpretacją II zasady termodynamiki jest też związany swoisty paradoks. Z jednej
strony wynika z niej, że wiele zjawisk, obserwowanych w skali makroskopowej może
być nieodwracalne. Z drugiej strony termodynamika statystyczna, z której ta zasada się
wywodzi, zakłada, że każde jednostkowe zjawisko w skali mikroskopowej, czyli w
skali pojedynczych cząstek jest odwracalne. Mimo że wszystkie zjawiska
makroskopowe są sumą odwracalnych zjawisk mikroskopowych, przyjmuje się jednak
- wbrew zdrowemu rozsądkowi - możliwość ich nieodwracalności. Paradoks ten
przyczynił się do początkowego odrzucenia równania Boltzmanna, opisującego
procesy nierównowagowe.

Ten paradoks wskazuje na ścisły związek między teorią a pomiarem w fizyce.
Interpretacja pomiaru układów wielocząstkowych jest oparta na teoriach tworzonych
dla układów makroskopowych. Można powiedzieć, że pomiary te dotyczą sum
uśrednionych zjawisk mikroskopowych. Dla takich pomiarów koncepcja entropii jest
niezbędna teoretycznie. Gdyby jednak dało się w jakiś sposób przejść do pomiaru tych
zjawisk na poziomie pojedynczych cząstek, koncepcja entropii przestałaby być
potrzebna. Liczba cząstek w rzeczywistych, makroskopowych układach
doświadczalnych jest jednak bardzo duża (rzędu stałej Avogadra) i dlatego pomiar
większości zjawisk fizycznych na poziomie mikroskopowym jeszcze długo pozostanie
poza zasięgiem nauki.
Entropia – termodynamiczna funkcja stanu, określająca kierunek przebiegu procesów
spontanicznych (samorzutnych) w odosobnionym układzie termodynamicznym.
Entropia jest miarą stopnia nieuporządkowania układu. Jest wielkością ekstensywną
Zgodnie z drugą zasadą termodynamiki, jeżeli układ termodynamiczny przechodzi od
jednego stanu równowagi do drugiego, bez udziału czynników zewnętrznych (a więc
spontanicznie), to jego entropia zawsze rośnie. Pojęcie entropii wprowadził niemiecki
uczony Rudolf Clausius.
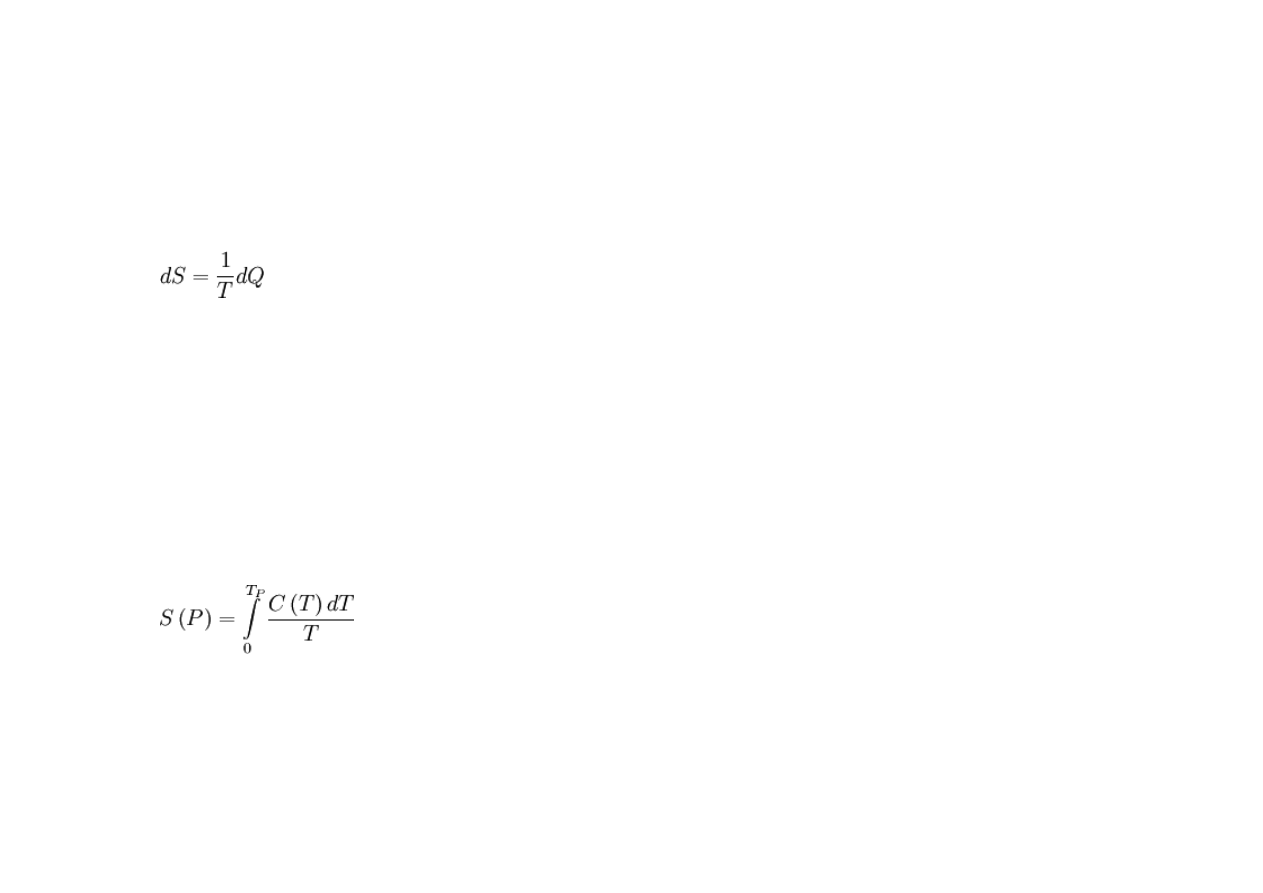
W termodynamice klasycznej
W ramach II zasady termodynamiki zmiana entropii (w procesach kwazistatycznych)
jest zdefiniowana przez swoją różniczkę zupełną jako:
gdzie:
T – temperatura bezwzględna,
dQ – ciepło elementarne, czyli niewielka ilośd ciepła dostarczona do układu
(wyrażenie Pfaffa).
Entropię pewnego stanu termodynamicznego P można wyznaczyć ze wzoru:
gdzie
C — pojemnośd cieplna, T
P
— temperatura w stanie P.

Podstawowe równanie termodynamiki fenomenologicznej, w którym występuje
entropia, ma postać
gdzie:
k – liczba różnych składników,
T – temperatura
p – ciśnienie
μ
i
– potencjał chemiczny i-tego składnika
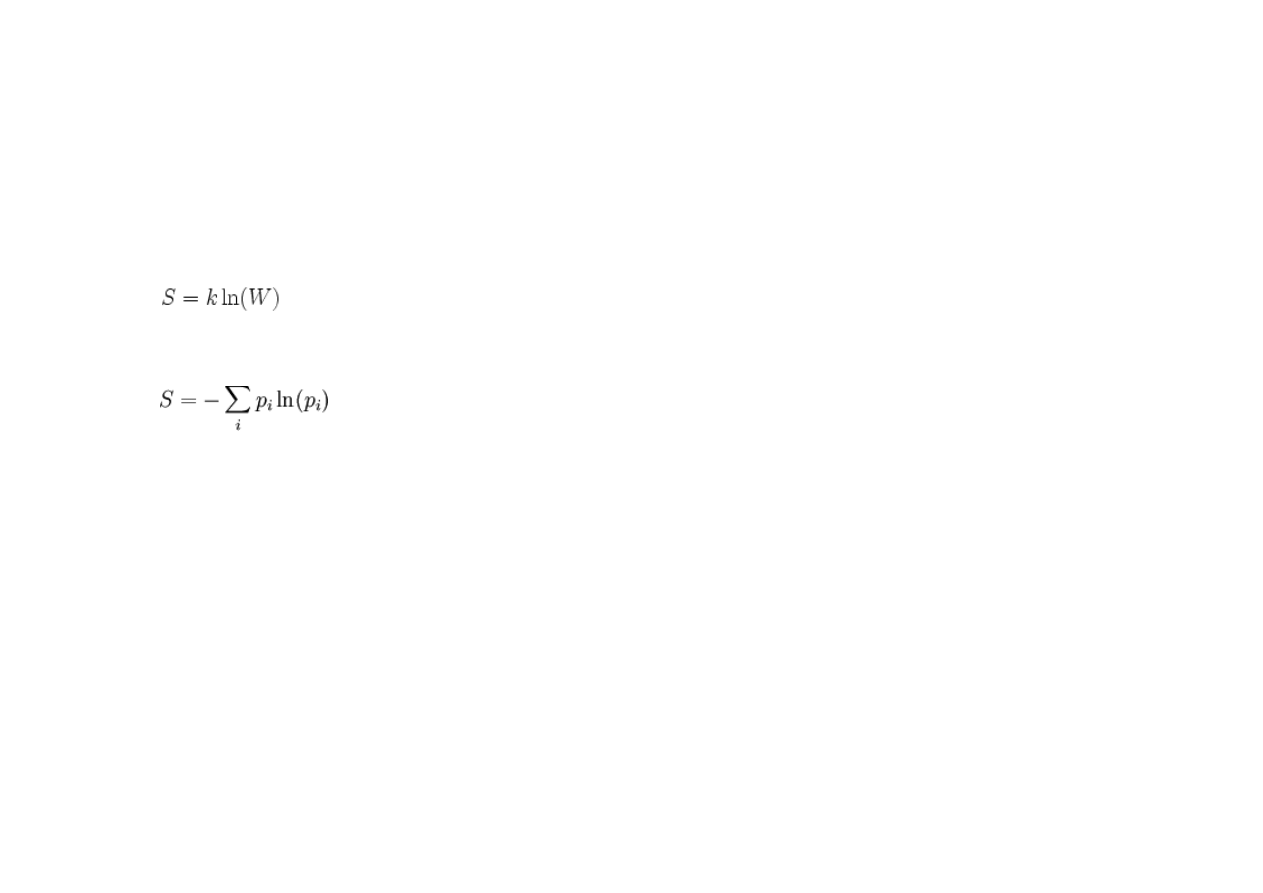
W termodynamice statystycznej
Całkowita entropia układu makroskopowego jest równa:
lub
gdzie:
W – liczba sposobów, na jakie makroskopowy stan termodynamiczny układu
(makrostan) może byd zrealizowany poprzez stany mikroskopowe (mikrostany),
p
i
– prawdopodobieostwo i-tego mikrostanu.
Zatem

jest liczbą bitów potrzebnych do pełnego określenia, którą realizację przyjął dany układ.
Praktyczne obliczenie W jest w większości przypadków technicznie niemożliwe,
można jednak oszacowywać całkowitą entropię układów poprzez wyznaczenie ich
całkowitej pojemności cieplnej poczynając od temperatury 0 K do aktualnej
temperatury układu i podzielenie jej przez temperaturę układu.
Ciało pozbawione niedoskonałości, zwane kryształem doskonałym, ma w temperaturze
0 bezwzględnego (0 K) entropię równą 0, gdyż jego stan może być zrealizowany tylko
na jeden sposób (każda cząsteczka wykonuje drgania zerowe i zajmuje miejsce o
najmniejszej energii). Jest to jedno ze sformułowań trzeciej zasady termodynamiki.
Oznacza to, że każde rzeczywiste ciało ma w temperaturze większej od zera
bezwzględnego entropię większą od zera.
Entropia czarnej dziury
W ogólnej teorii względności, aby opisać czarną dziurę wystarczy podać jej masę,
moment pędu i ładunek elektryczny. Zgodnie z tą teorią czarna dziura nie zawiera
żadnej informacji ponad te parametry. Żargonowo fizycy mówią, że czarna dziura "nie
ma włosów". Jednak oznacza to, że entropia czarnej dziury jest równa 0. Do czarnej
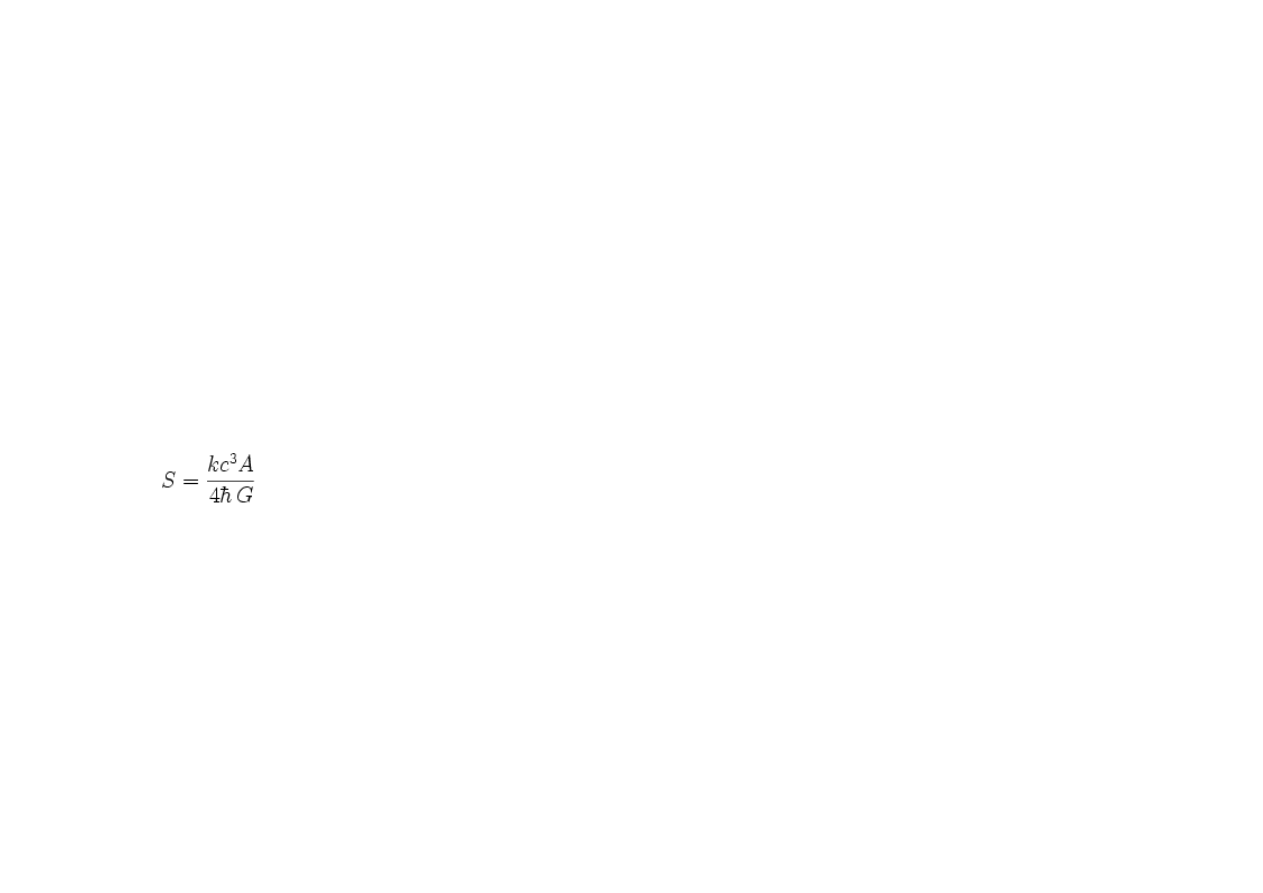
dziury wpada materia o niezerowej entropii, zatem przy wpadaniu entropia całego
układu się zmniejsza. Wynika z tego, że ogólna teoria względności łamie drugą zasadę
termodynamiki. Fizycy zaczęli więc poszukiwać uogólnienia teorii czarnych dziur, tak,
żeby pozostawała w zgodzie z termodynamiką. Owocne okazało się rozważenie
efektów kwantowych.
Wzór na entropię czarnej dziury powstał przy założeniu, że podczas spadania ciała do
czarnej dziury jej masa rośnie i rośnie też jej entropia; proporcjonalny do masy jest
horyzont zdarzeń, czyli promień Schwarzschilda. Ścisły wzór wg Stephena Hawkinga
ma postać:
gdzie:
k – stała Boltzmanna,
A – powierzchnia horyzontu zdarzeo czarnej dziury,

– stała Plancka dzielona,
G – stała grawitacyjna.
Wnioski
Według II zasady termodynamiki, każdy układ izolowany dąży do stanu równowagi, w
którym entropia osiąga maksimum. Zakładając, że Wszechświat jako całość jest
układem zamkniętym, powinien on również dążyć do równowagi. Stwierdzenie tego
faktu jest jednak stosunkowo trudne do zaobserwowania i dlatego prowadzi się liczne
dyskusje czy Wszechświat jest, czy nie jest układem zamkniętym oraz czy
rzeczywiście dąży jako całość do równowagi. Przeciwnicy tej koncepcji głoszą, że
rozszerzającego się Wszechświata nie można traktować jako układu zamkniętego,
gdyż nie można wyznaczyć obszaru, z którego nie wychodziłoby promieniowanie.
Wiadomo jedynie, że entropia olbrzymiej większości znanych układów zamkniętych
rośnie w kierunku, który nazywamy przyszłością. Tak więc, z tego punktu widzenia,
termodynamika określa kierunek upływu czasu (tzw. termodynamiczna strzałka czasu).
Według Boltzmanna aktualna entropia Wszechświata jest jeszcze bardzo niska, w
porównaniu z wartością "docelową", na co dowodem miały być wysokie wartości
fluktuacji statystycznych zjawisk obserwowanych w skali kosmosu – np. bardzo

nierównomierne rozmieszczenie gwiazd w przestrzeni. Współcześnie taka interpretacja
entropii jest jednak uważana za całkowicie nieuprawnioną z kosmologicznego punktu
widzenia.
Trzecia zasada termodynamiki
Trzecia zasada termodynamiki (zasada Nernsta) może być sformułowana jako
postulat: nie można za pomocą skończonej liczby kroków uzyskać temperatury zera
bezwzględnego (zero kelwinów), jeżeli za punkt wyjścia obierzemy niezerową
temperaturę bezwzględną.
Inne sformułowanie głosi, że entropia substancji tworzących doskonałe kryształy dąży
do 0 gdy temperatura dąży do 0 K.
Mówiąc jaśniej, gdyby udało się schłodzić jakąś substancję do 0 K i gdyby ona
utworzyła kryształ doskonały to jej entropia musiałaby przyjąć wartość 0. Jest to

jednak technicznie, a także formalnie niewykonalne, dlatego definicja trzeciej zasady
termodynamiki w formie:
entropia kryształu doskonałego w temperaturze zera bezwzględnego jest równa 0
nie jest poprawna, choć intuicyjnie akceptowalna.
II zasada termodynamiki.
Według I zasady termodynamiki nie jest do pomyślenia proces, w którym
energia
wewnętrzna układu doznałaby zmiany innej, niż wynosi suma
algebraiczna energii wymienionych z otoczeniem.
II zasada termodynamiki
określa warunki , jakie muszą być spełnione, by
niesprzeczny z I zasadą proces mógł rzeczywiście zachodzić.
Podstawowymi pojęciami w II zasadzie termodynamiki są: procesy
odwracalne nieodwracalne.
Proces, w którym parametry stanu (zmienne układu) zmieniają swe wartości
od X1, X2,X3... do X1 , X2 , X3
jest odwracalny, jeżeli istnieje proces

odwrotny,
w wyniku którego zmienne przyjmą z powrotem wartości X1, X2, X3,
...., przy czym proces
odwrotny spełnia następujące warunki:
1) układ przechodzi w nim poprzez te same stany pośrednie, co w procesie
pierwotnym, lecz w odwrotnej kolejności,
2) układ wymienia w tym procesie z otoczeniem ilości masy, ciepła i pracy
różniące się jedynie znakiem od wymienionych w procesie pierwotnym.
3) po
zakończeniu procesu odwrotnego nie pozostanie żaden ślad ani w
układzie, ani też w jego otoczeniu.
Proces, który nie spełnia chociażby jednego z tych warunków, nazywamy
procesem
nieodwracalnym. Układowi, w którym przebiegł proces
nieodwracalny, można wprawdzie na ogół przywrócić stan pierwotny, lecz
dokonując tego wywoła się z konieczności trwałe zmiany w otoczeniu.
Procesy samorzutne, nieodwracalne
Procesy samorzutne np:
rozprężanie gazu przeciwko stałemu ciśnieniu lub do próżni (przy
powtórnym sprężaniu trzeba użyć więcej pracy niż jej zyskuje w procesie
rozprężania),
przepływ ciepła między dwiema częściami układu o różnych temperaturach,

-
przepływ masy pomiędzy dwoma obszarami, w których stężenia są różne
(dyfuzja),
- reakcja chemiczna np. samorzutne utlenianie metali
są procesami nieodwracalnymi.
Chcąc przywrócić stan pierwotny należałoby dokonać ingerencji z zewnątrz,
która musiałaby pozostawić trwały ślad w otoczeniu.
Proces odwracalny, mimo że w praktyce nie daje się zrealizować, jest
pomyślany, jako graniczny przypadek procesu rzeczywistego. Procesem
odwracalnym będzie każdy proces quasi-statyczny, w którym układ zmienia
swój stan poprzez nieskończony ciąg stanów równowagi.
Siłą napędową procesów samorzutnych jest tendencja energii i materii do
zwiększania stanu nieuporządkowania.
Miarą stopnia nieuporządkowania materii i energii jest funkcja stanu zwana
entropią, S .
Matematyczne ujęcie II zasady termodynamiki za pomocą nowej funkcji
stanu, entropii S,
wprowadził (R.Clausius 1852)
Zmia
nę entropii S układu definiuje się jako stosunek ciepła, odwracalnie
wymienionego z otoczeniem, do temperatury w której odbywa się wymiana.

Entropia jest jednoznaczną funkcją parametrów stanu, tzn. zmiana entropii
spowodowana przebiegiem jakiegoś procesu określona jest wartościami
zmiennych stanu
układu na początku i na końcu procesu niezależnie od tego,
czy proces był odwracalny , czy nieodwracalny.
Wprowadzenie pojęcia funkcji S - entropii daje możliwości odróżnienia
procesów odwracalnych i nieodwracalnych. Kryterium , umożliwiającym takie
rozpoznanie jest
porównania zmian jakich doznała entropia układu S w
wyniku procesu z obliczoną dla tego procesu całką z ilorazu Q
el
/T.
1. W procesach odwracalnych produkcja entropii jest równa zeru i
zmiana entropii
układu jest równa transportowi entropii, a zatem równa
co do wielkości i przeciwna co do znaku zmianie entropii otoczenia.
Sumaryczna zmiana entropii układu i otoczenia jest równa zeru.
dS
ukł
+ dS
ot
= 0
2. W procesach nieodwracalnych produkcja entropii jest zawsze dodatnia
i sumaryczna zmiana entropii układu i otoczenia, razem wziętych jest
większa od zera.
dS
ukł
+ dS
o
t 0
3. W układzie izolowanym adiabatycznie mogą przebiegać samorzutnie
tylko takie procesy,
które zwiększają jego entropię.

4. Entropia
układu nieizolowanego może w wyniku procesu
samorzutnego maleć, równocześnie jak rośnie (bardziej) entropia
otoczenia; sumaryczna entropia układu i otoczenia, razem wziętych
zwiększa się.
Teoremat Nernsta i postulat Plancka - III zasada termodynamiki
War
tości entropii w temperaturze zera bezwzględnego rozwiązuje teoremat
Nernsta i Postulat Plancka zwany
III zasadą termodynamiki.
Teoremat mówi, że w temperaturze zera bezwzględnego, entropia
każdego ciała doskonale jednolitego i o skończonej gęstości wynosi zero
Są to tzw. ciała plankowskie (kryształy mieszane, szkła, przechłodzone ciecze
nie spełniają tego warunku).
===========================================================
• Procesy kołowe – zjawiska, w których układ termodynamiczny,
po cyklu różnego rodzaju przemian, wraca do stanu o początkowych
parametrach. Oznacza to, że dla każdego procesu kołowego
obowiązują zależności:
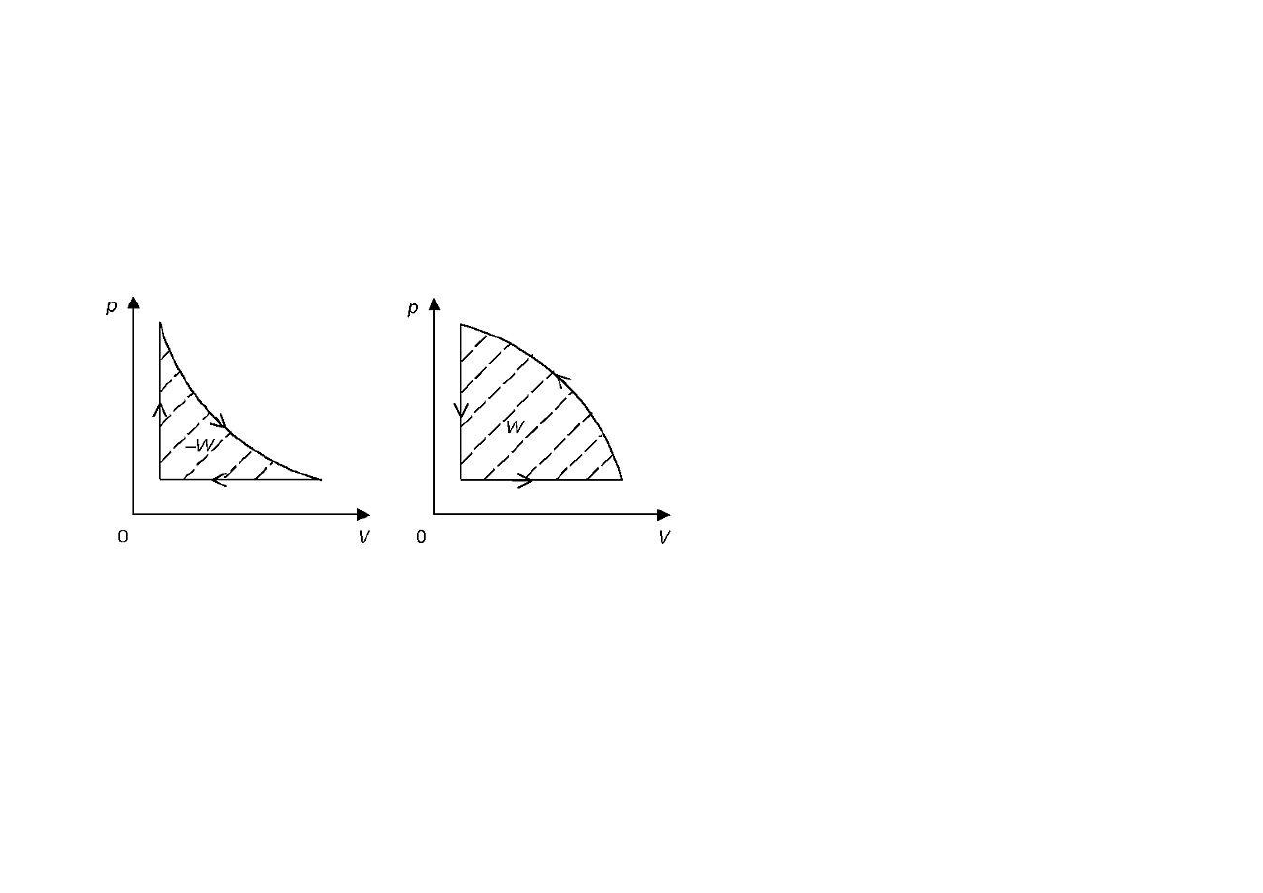
ΔU = 0, ΔT = 0, ΔV = 0, Δp= 0
Przykłady dwóch procesów kołowych: prawostronnego (1) i
lewostronnego (2) przedstawiono na wykresach:
Proces 1 jest typowy dla silników cieplnych. Zakreskowane pole
jest równe pracy użytecznej wykonanej przez układ (–W).

Proces 2 jest typowy dla chłodziarki. Zakreskowane pole jest równe
pracy wykonanej nad układem (W).
• Silnik cieplny – urządzenie pracujące wg cyklu kołowego
pomiędzy dwoma źródłami ciepła: grzejnicą i chłodnicą. Różnica
pomiędzy ciepłem pobranym z grzejnicyQ
1
i oddanym do chłodnicy
Q
2
jest równa pracy użytecznej W
U
wykonanej przez silnik.
• Sprawność silnika cieplnego ηto stosunek pracy użytecznej
wykonanej przez silnik do ciepła pobranego z grzejnicy.
Przy aktualnych możliwościach technicznych sprawność silnika
cieplnego nie może być większa niż 67%.

• Silnik Carnota – idealny silnik cieplny o maksymalnej możliwej
sprawności. Silnik Carnota nie istnieje w praktyce, wyznacza jednak
pewien fizyczny, wzorcowy model, do którego mogą dążyć
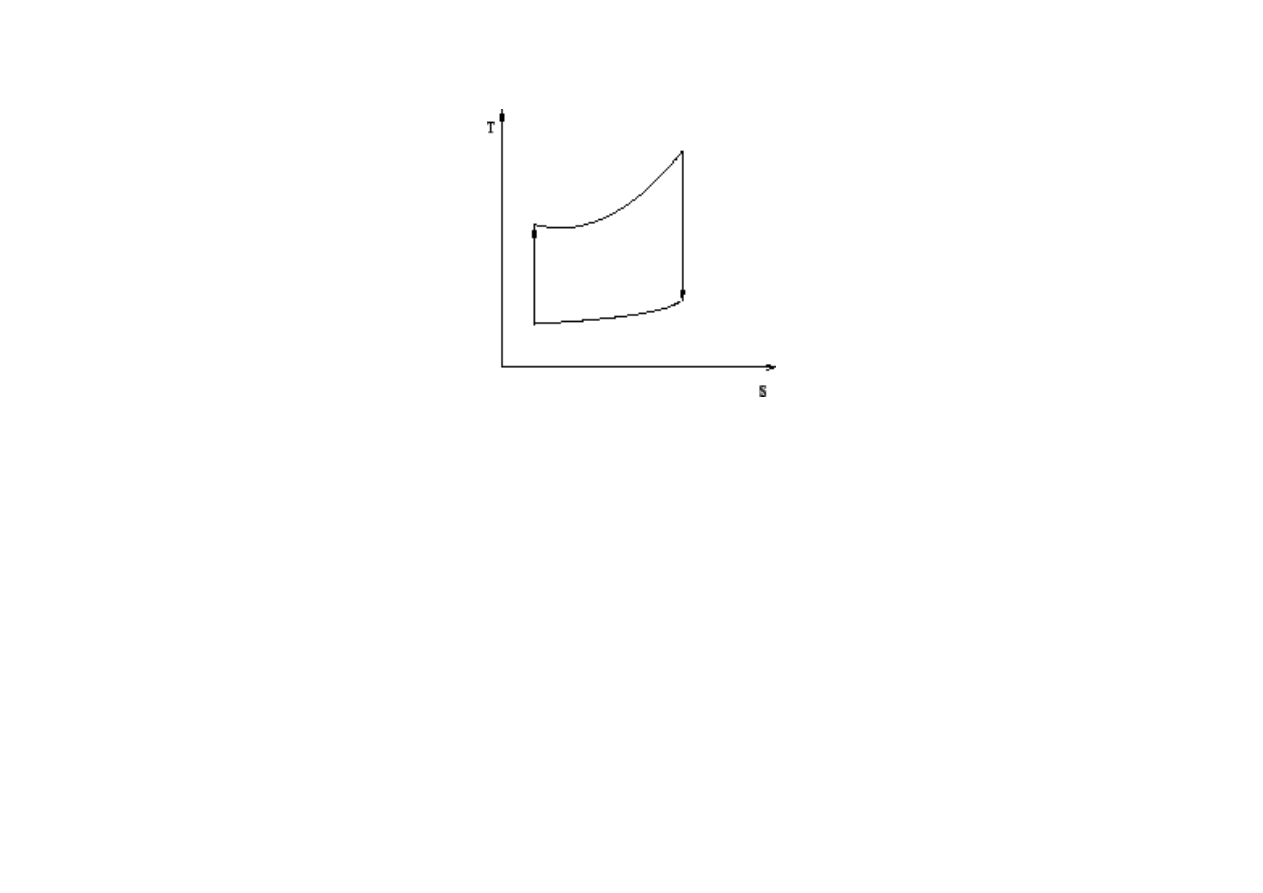
konstruktorzy realnych silników. Cykl silnika Carnota w układzie p-V
został przedstawiony za pomocą wykresu:
Cykl składa się z 4 procesów:

1-2 – rozprężanie izotermiczne (układ pobiera ciepło Q
1
i wykonuje
pracę W
1
),
2-3 – rozprężanie adiabatyczne (układ wykonuje pracę W
2
kosztem
energii wewnętrznej),
3-4 – sprężanie izotermiczne (praca W
1
jest wykonywana nad
układem, a układ oddaje ciepło Q
2
),
4-1 – sprężanie adiabatyczne (praca W
2
jest wykonywana nad
układem, a energia wewnętrzna rośnie).
Sprawność idealnego silnika cieplnego η wyraża się wzorem:
gdzie: T
1
– temperatura grzejnicy (źródła ciepła), T
2
– temperatura
chłodnicy.
Rysunek: Obieg w silniku iskrowym-obieg Otto
Wyszukiwarka
Podobne podstrony:
Pierwsza i druga zasada termodynamiki (entropia, zjawiska odwracalne)
2 4 druga zasada termodynamiki
Pierwsza i druga zasada termodynamiki (entropia, zjawiska odwracalne)
Pierwsza i druga zasada termodynamiki (entropia, zjawiska odwracalne)
Wyklad 14 druga zasada termodynamiki
zasada termodynamiki druga
zasada termodynamiki(druga)
5 DRUGA I TRZECIA ZASADA TERMODYNAMIKI
I zasada Termodynamiki
2 Bilans energii Pierwsza zasada termodynamiki
Praca absolutna, ciepło właściwe, I zasada termodynamiki
18 entropia i II zasada termodynamiki
16 I zasada termodynamiki
I Zasada Termodynamiki rozszerzenie id 208487
Ściągi z fizyki-2003 r, Druga zasada dynamiki Newtona
zasada termodynamiki Nernsta (twierdzenie Nernsta)
16Pierwsza zasada termodynamiki
II Zasada Termodynamiki
02 Zerowa zasada termodynamikiid 3864 ppt
więcej podobnych podstron