1
KRYSTALIZACJA, ADSORPCJA
1
TERMODYNAMIKA TECHNICZNA
TERMODYNAMIKA TECHNICZNA
I CHEMICZNA
I CHEMICZNA
WYKŁAD XI
WYKŁAD XI
RÓWNOWAGA FAZOWA W UKŁADZIE CIAŁO
RÓWNOWAGA FAZOWA W UKŁADZIE CIAŁO
STAŁE
STAŁE--CIECZ (krystalizacja)
CIECZ (krystalizacja)
ADSORPCJA
ADSORPCJA
KRYSTALIZACJA, ADSORPCJA
2
RÓWNOWAGA FAZOWA W UKŁADZIE CIAŁO
RÓWNOWAGA FAZOWA W UKŁADZIE CIAŁO
STAŁE
STAŁE--CIECZ (krystalizacja)
CIECZ (krystalizacja)
Obliczanie
Obliczanie rozpuszczalno
ś
ci
rozpuszczalno
ś
ci ciała
ciała stałego
stałego w
w cieczy
cieczy
Rozpuszczalnik – 1; ciało stałe – 2
Zał.: w f. stałej TYLKO substancja 2 (x
2
s
=1)
Równanie
Równanie równowagi
równowagi::
2
2
c
,
0
2
s
2
x
f
f
γγγγ
====
c
2
s
2
f
f
====
KRYSTALIZACJA, ADSORPCJA
3
je
ż
eli
obie
obie
fazy s
ą
doskonałe to:
•
γγγγ
2
=1
•
fugatywno
ś
ci
s
ą
równe
odpowiednim
ci
ś
nieniom
c
czyli
zyli::
c
2
s
2
2
p
p
x
====
uwaga
uwaga::
p
2
c
dotyczy
HIPOTETYCZNEJ
HIPOTETYCZNEJ
fazy ciekłej
ciała stałego 2 w temperaturze roztworu.
Wyznacza si
ę
przez ekstrapolacj
ę
ci
ś
nienia pary
nad ciecz
ą
do obszaru ciała stałego dla wykresu
3-fazowgo.
T
T
p
p
–
– temperatura
temperatura punktu
punktu potrójnego
potrójnego
KRYSTALIZACJA, ADSORPCJA
4
p
T
para
T
p
T
ciecz
c. stałe
C
p
2
S
p
2
KRYSTALIZACJA, ADSORPCJA
5
Mo
ż
na
Mo
ż
na udowodni
ć
,
udowodni
ć
,
ż
e
ż
e::
st
ą
d
st
ą
d wynika,
wynika,
ż
e
ż
e::
•
rozpuszczalno
ść
(x
2
)
ro
ś
nie
wraz
ze
wzrostem T
•
dla
2
substancji
o
identycznym
L
t
rozpuszczalno
ść
jest wi
ę
ksza dla tej, która
ma wy
ż
sz
ą
T
•
dla 2 substancji o identycznej temperaturze
rozpuszczalno
ść
jest wi
ę
ksza dla tej, która
ma mniejsze L
t
−−−−
====
T
T
T
T
R
L
x
ln
p
p
t
2
−−−−
KRYSTALIZACJA, ADSORPCJA
6
D
Dla
la
roztworów
roztworów
silnie
silnie
rozcie
ń
czonych
rozcie
ń
czonych
wzór
wzór
(*)
(*)
mo
ż
na
mo
ż
na upro
ś
ci
ć
upro
ś
ci
ć
do
do::
2
1
1
t
2
RT
T
L
x
∆∆∆∆
====
g
gdzie
dzie
podwy
ż
szenie temperatury topnienia roztworu
s
st
ą
d
t
ą
d::
1
T
T
T
−−−−
====
∆∆∆∆
2
1
t
2
1
x
L
RT
T
====
∆∆∆∆

2
KRYSTALIZACJA, ADSORPCJA
7
dla
dla rozpuszczalnika
rozpuszczalnika zachodzi
zachodzi te
ż
te
ż
::
Z
tego
r-nia
mo
ż
na
oblicza
ć
współczynniki
aktywno
ś
ci na podstawie bada
ń
do
ś
wiadczalnych
((((
))))
−−−−
====
γγγγ
−−−−
T
T
T
T
R
L
x
ln
1
1
1
t
1
1
KRYSTALIZACJA, ADSORPCJA
8
Do obliczania rozpuszczalno
ś
ci w praktyce stosuje
si
ę
prost
ą
zale
ż
no
ść
wynikaj
ą
ca z podobie
ń
stwa
zmian własno
ś
ci fizykochemicznych.
gdzie
gdzie::
T
T
2
2
,,
(T
(T
2
2
))
I,II
I,II
–
temperatury
rozpuszczalno
ś
ci
substancji 2
T
T
w
w
,,
(T
(T
w
w
))
I,II
I,II
–
temperatury
rozpuszczalno
ś
ci
substancji wzorcowej (w)
II
w
w
II
2
2
II
w
I
w
II
2
I
2
)
T
(
T
)
T
(
T
)
T
(
)
T
(
)
T
(
)
T
(
K
−−−−
−−−−
====
−−−−
−−−−
====
(*)
KRYSTALIZACJA, ADSORPCJA
9
Dane
Dane::
(u
2
)
I,II
, (T
2
)
I,II
oraz u
w
=f (T
w
) {w – substancja
wzorcowa
wykazuj
ą
ca
podobie
ń
stwo
zmian
rozpuszczalno
ś
ci w stosunku do substancji 2}
Obliczy
ć
Obliczy
ć
u
2
w T
2
Algorytm
Algorytm::
1)
obliczamy stał
ą
K znaj
ą
c: (T
2
)
I,II
, (T
w
)
I,II
przy czym
s
ą
to punkty odpowiadaj
ą
ce sobie czyli takie
temperatury,
ż
e (u
2
)
I
= (u
w
)
I
oraz (u
2
)
II
= (u
w
)
II
2)
obliczamy z (*) T
w
czyli odpowiadaj
ą
c
ą
tak
ą
,
ż
e
u
2
=u
w
3)
z zale
ż
no
ś
ci u
w
=f(T
w
) obliczamy u
w
w T
w
-
poszukiwana warto
ść
u
2
jest równa u
w
KRYSTALIZACJA, ADSORPCJA
10
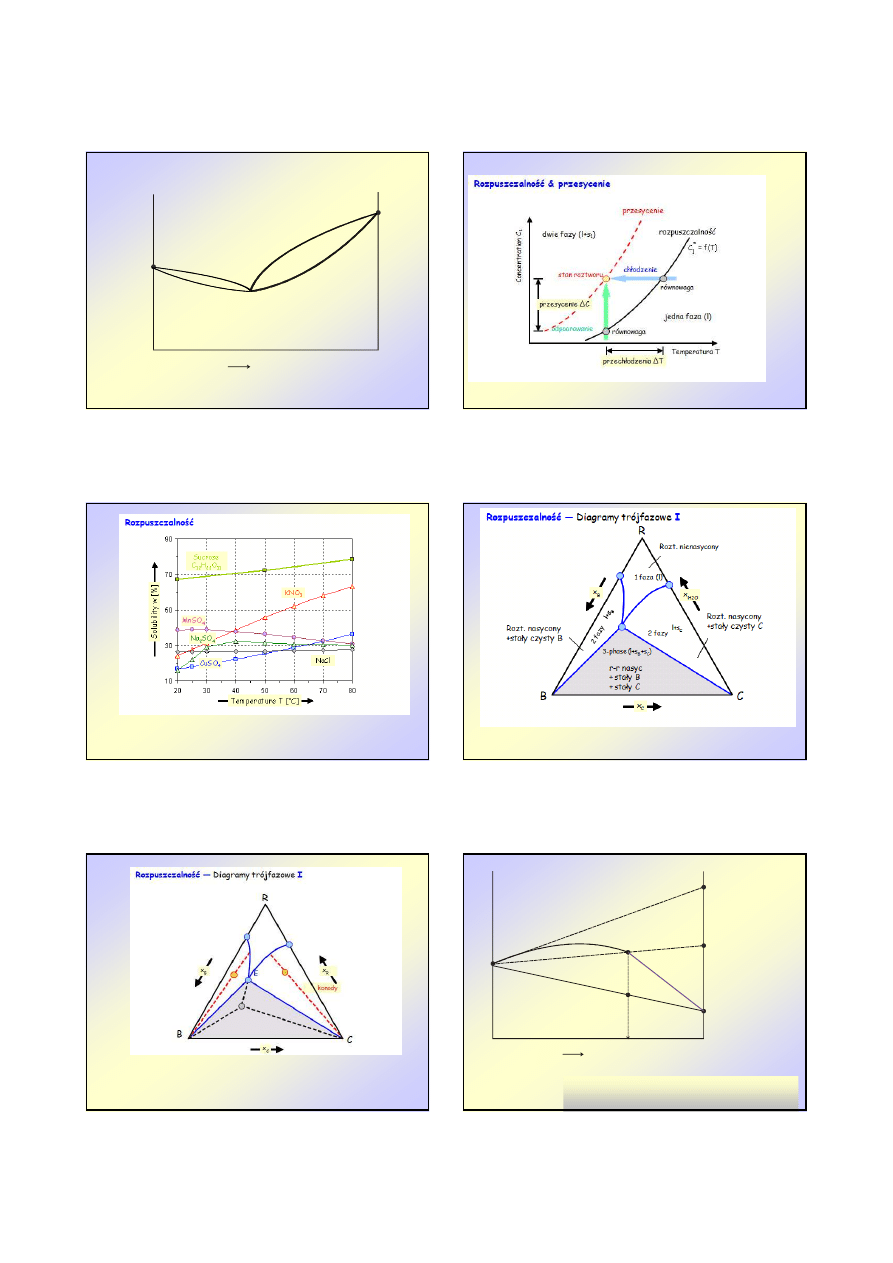
Wykresy
Wykresy fazowe
fazowe –
– ciecz
ciecz--ciało
ciało stałe
stałe
u
2
t
A
B
C
I
II
III
IV
AB- linia rozpuszczalno
ś
ci 2 w 1
AB- linia rozpuszczalno
ś
ci 1 w 2
B – punkt eutektyczny
I - c.st. 2 + roztwór
II - c.st. 2 + roztwór
III – roztwór nienasycony
IV – kryształy 1 + 2
KRYSTALIZACJA, ADSORPCJA
11
u
2
t
A
B
C
I
II
III
V
III
IV
KRYSTALIZACJA, ADSORPCJA
12
u
2
t
A
B
ciecz
ciało stałe
Roztwór stały
3
KRYSTALIZACJA, ADSORPCJA
13
u
2
t
A
B
ciecz
ciało stałe
Roztwór stały
KRYSTALIZACJA, ADSORPCJA
14
Wykresy
Wykresy fazowe
fazowe –
– rozpuszczalnik+s
rozpuszczalnik+s..rozpuszczona
rozpuszczona
KRYSTALIZACJA, ADSORPCJA
15
KRYSTALIZACJA, ADSORPCJA
16
KRYSTALIZACJA, ADSORPCJA
17
KRYSTALIZACJA, ADSORPCJA
18
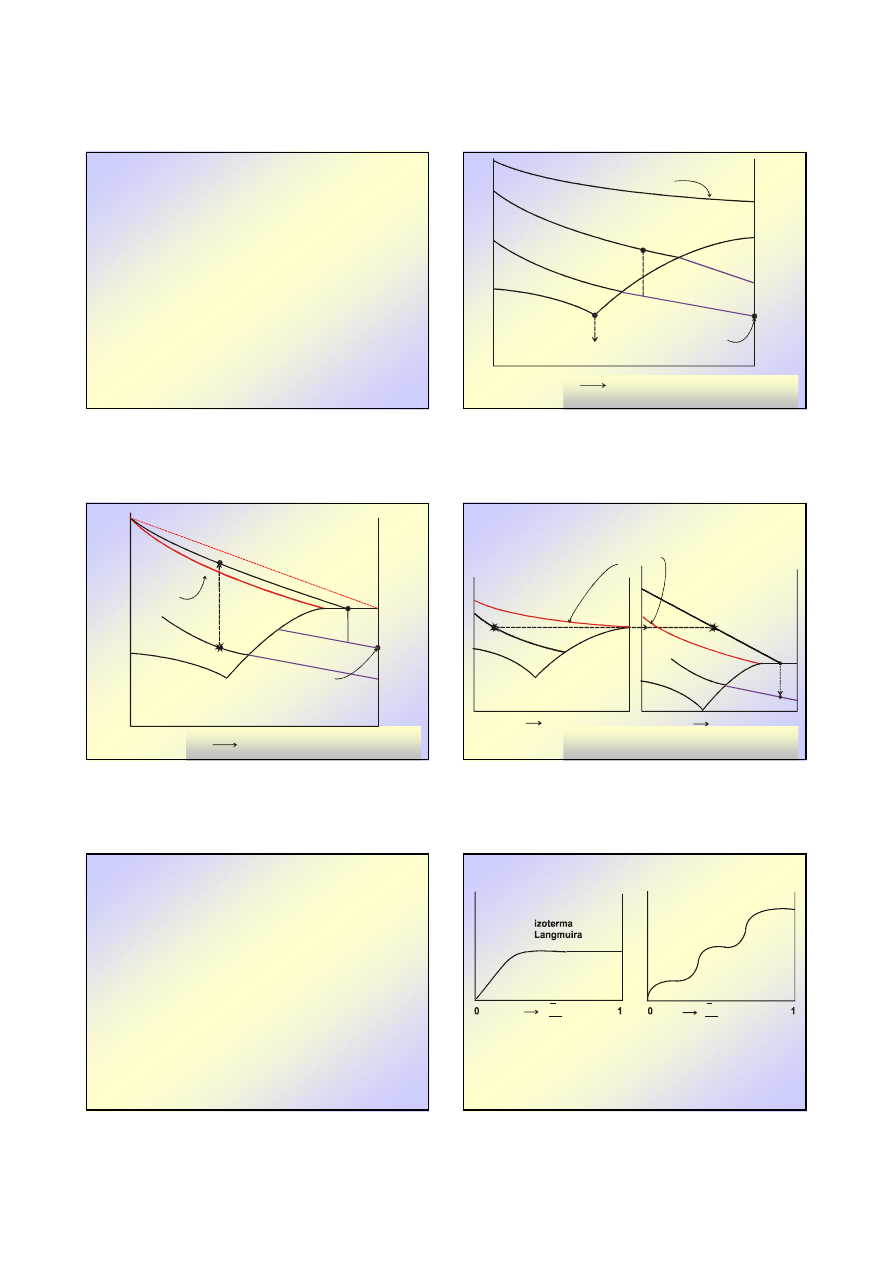
Wykresy
Wykresy entalpowe
entalpowe
u
2
h
A
B
C
F
E
D
n
A – entalpia rozpuszczalnika 1
AB- izoterma w obszarze nienasyconym
BC- izoterma w obszarze przesyconym
C – entalpia c.st. 2
BD – ciepło rozpuszczania c.st. 2 do stanu
nasycenia (na 1 kg roztworu)
EC – ciepło rozpuszczania c.st. 2 do stanu
nasycenia (na 1 kg substancji 2)
CF – ciepło rozcie
ń
czania substancji 2 do
stanu niesko
ń
czenie wielkiego
rozcie
ń
czenia (na 1 kg substancji 2)
4
KRYSTALIZACJA, ADSORPCJA
19
Metody krystalizacji
Metody krystalizacji
•
przez ochłodzenie
•
przez odparowanie rozpuszczalnika
•
przez samo-odparowanie
KRYSTALIZACJA, ADSORPCJA
20
u
2
h
T
1
kryształy
izobara wrzenia
KRYSTALIZACJA, ADSORPCJA
21
u
2
u
2
h
T
kryształy
T
izobara
wrzenia
A
K
L
B
P
O
KRYSTALIZACJA, ADSORPCJA
22
P
O
u
2
h
T
1
u
2
h
T
1
T
k
izobara wrzenia
p
1
p
2
p>>
1
p
2
KRYSTALIZACJA, ADSORPCJA
23
RÓWNOWAGA CIECZ
RÓWNOWAGA CIECZ--C.STAŁE (ADSORPCJA)
C.STAŁE (ADSORPCJA)
ADSORBAT,
ADSORBAT, ADSORBENT
ADSORBENT
ADSOPCJA
ADSOPCJA FIZYCZNA,
FIZYCZNA, CHEMICZNA
CHEMICZNA..
Wykresy fazowe
Ogólne
Ogólne równanie
równanie równowagi
równowagi::
F(u
2
, p, y
2
, T) = 0
u
u
2
2
– ułamek wagowy 2 w adsorbacie
y
y
2
2
– ułamek molowy (wagowy) w f. Gazowej
KRYSTALIZACJA, ADSORPCJA
24
Przykłady
Przykłady wykresów
wykresów
u
2
u
2
C
p
p
2
2
C
p
p
2
2
wiele warstw
adsorbatu

5
KRYSTALIZACJA, ADSORPCJA
25
Przykłady
Przykłady modeli
modeli równowagi
równowagi
Stała równowagi adsorbatu 2
Jest
to
równanie
podobne
do
równania
Henry’ego
Henry’ego
gdzie stała
k
k
2
2
zale
ż
y od
T
T
i rodzaju
układu.
dla układu idealnego:
(*)
p
2
s
2
2
a
a
k
====
2
2
2
u
p
k
−−−−
====
KRYSTALIZACJA, ADSORPCJA
26
Stopie
ń
Stopie
ń
pokrycia
pokrycia powierzchni
powierzchni adsorbenta
adsorbenta
θθθθθθθθ
(**)
z (*) i (**)
(inna posta
ć
prawa Henry’ego)
m
,
2
2
2
u
u
≡≡≡≡
θθθθ
−−−−
≡≡≡≡
θθθθ
2
m
,
2
2
2
p
u
k
KRYSTALIZACJA, ADSORPCJA
27
IIzoterma Freundlicha (empiryczna)
zoterma Freundlicha (empiryczna)
stałe
k,
k, n
n
zale
żą
od
układu
układu ii T
T
n
2
2
p
k
u
−−−−
====
Model Langmuira
Model Langmuira
Zał
Zało
ż
enie
o
ż
enie::
Adsorbat tworzy warstw
ę
mono-molekularn
ą
(bo
ekranuje ona dalsze oddziaływania).
Równowaga jest dynamiczna; szybko
ść
adsorpcji
jest proporcjonalna do pr
ęż
no
ś
ci parcjalnej oraz
ułamka
powierzchni
wolnej
(nie
zaj
ę
tej
przez
adsorbat); szybko
ść
desorpcji jest proporcjonalna
do powierzchni zaj
ę
tej.
KRYSTALIZACJA, ADSORPCJA
28
W
W stanie
stanie równowagi
równowagi::
−−−−
θθθθ
−−−−
====
θθθθ
2
a
d
p
)
1
(
k
k
czyli
czyli::
a
d
2
2
2
2
2
k
k
k
:
gdzie
;
p
k
1
p
k
====
++++
====
θθθθ
−−−−
−−−−
po
po uwzgl
ę
dnieniu
uwzgl
ę
dnieniu definicji
definicji
θθθθθθθθ
::
;
p
k
1
p
k
u
u
2
2
2
2
m
2
2
−−−−
−−−−
++++
====
Model
Model Langmuira
Langmuira opisuje
opisuje dobrze
dobrze adsorpcj
ę
adsorpcj
ę
du
ż
ych
du
ż
ych molekuł
molekuł..
Wyszukiwarka
Podobne podstrony:
Bazy Danych cz III [tryb zgodności]
termodynamika czesc vi [tryb zgodnosci]
Bazy Danych cz II [tryb zgodnos Nieznany (2)
termodynamika czesc iii [tryb zgodnosci]
termodynamika czesc vii [tryb zgodnosci]
termodynamika czesc viii [tryb zgodnosci]
termodynamika cz x [tryb zgodnosci]
(W7a Stale do kszta t na zimno cz I [tryb zgodno ci])
cz 1c projektowanie systemow czasu rzeczywistego tryb zgodnosci
termodynamika czesc v [tryb zgodnosci]
cz 1d zarzadzanie projektem informatycznym tryb zgodnosci
cz 1b wybrane problemy programomerii tryb zgodnosci
(W7a Stale do kszta t na zimno cz I [tryb zgodno ci])
cz 1c projektowanie systemow czasu rzeczywistego tryb zgodnosci
(Fizyka II Termodynamika [tryb zgodności])
więcej podobnych podstron