1
ABSORPCJA, ZATĘŻANIE
1
TERMODYNAMIKA TECHNICZNA
TERMODYNAMIKA TECHNICZNA
I CHEMICZNA
I CHEMICZNA
WYKŁAD X
WYKŁAD X
ABSORPCJA
ABSORPCJA,
, ZAT
Ę
ZAT
Ę
ż
ż
ANIE
ANIE
ABSORPCJA, ZATĘŻANIE
2
ROZPUSZCZALNO
ŚĆ
GAZU W CIECZACH
ROZPUSZCZALNO
ŚĆ
GAZU W CIECZACH
(ABSORPCJA)
(ABSORPCJA)
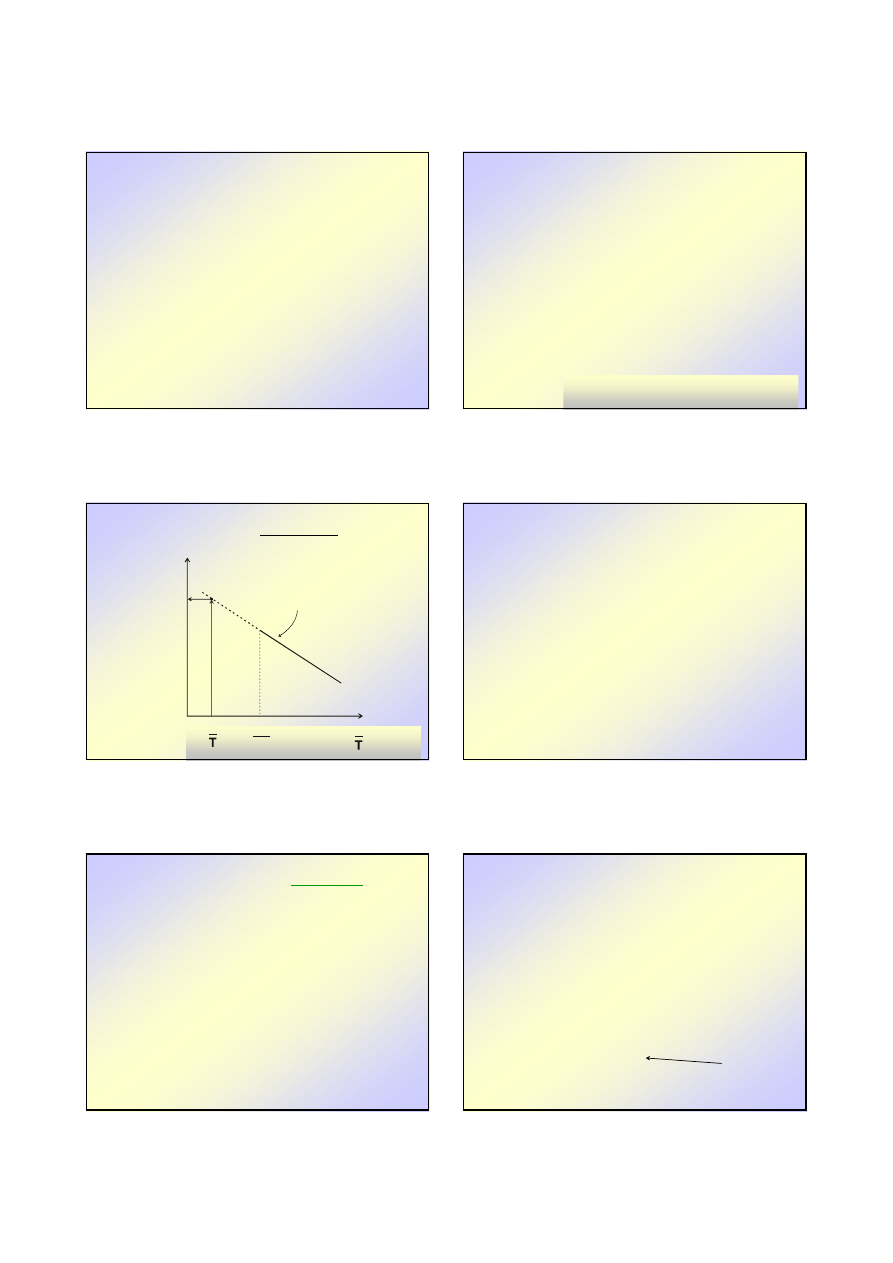
Równanie
Równanie idealnej
idealnej rozpuszczalno
ś
ci
rozpuszczalno
ś
ci
Przyjmuj
ą
c idealno
ść
obu faz otrzymujemy
prawo Raoulta zwane „równaniem idealnej
rozpuszczalno
ś
ci”
2
,
1
i
;
x
p
p
i
c
i
i
====
====
−−−−
(
1
1--rozpuszczalnik
rozpuszczalnik ciekły
ciekły;; 2
2-- gaz
gaz
)
uwaga
uwaga::
p
2
c
oznacza ci
ś
nienie pary nasyconej nad
HIPOTETYCZN
Ą
faz
ą
ciekł
ą
gazu
2
w
temperaturze równowagi (absorpcji)
ABSORPCJA, ZATĘŻANIE
3
Ci
ś
nienie
p
p
2
2
c
c
wyznacza si
ę
poprzez ekstrapolacj
ę
ci
ś
nienia pary nasyconej rzeczywistej fazy ciekłej
(czyli powy
ż
ej T
kr
) substancji zaabsorbowanej 2
równanie
Antoine’a
C
p
lg
2
1
1
kr
T
1
ABSORPCJA, ZATĘŻANIE
4
Analiza
równania
idealnej
rozpuszczalno
ś
ci
pokazuje,
ż
e:
••
x
2
(rozpuszczalno
ść
)
NIE
NIE
zale
ż
y od rodzaju fazy
ciekłej,
•
dla ustalonej warto
ś
ci pr
ęż
no
ś
ci parcjalnej (
)
st
ęż
enie rozpuszczalnika maleje ze wzrostem
temperatury
T
⇑
⇑
⇑
⇑
⇑
⇑
⇑
⇑
to 1/T
⇓
⇓
⇓
⇓
⇓
⇓
⇓
⇓
to lg (p
2
c
)
⇑
⇑
⇑
⇑
⇑
⇑
⇑
⇑
czyli p
2
c
⇑
⇑
⇑
⇑
⇑
⇑
⇑
⇑
Wobec tego x
2
⇓
⇓
⇓
⇓
⇓
⇓
⇓
⇓
−−−−
2
p
ABSORPCJA, ZATĘŻANIE
5
komentarz
komentarz::
rozpuszczalno
ść
przewa
ż
nie
przewa
ż
nie
maleje
wraz ze wzrostem temperatury ale s
ą
wyj
ą
tki
(np. wodór, azot) w pewnym zakresie T.
Poza tym rozpuszczalno
ść
ZALE
Ż
Y
ZALE
Ż
Y
od rodzaju
rozpuszczalnika.
czyli
czyli::
r-nie idealnej rozpuszczalno
ś
ci jest zbyt
niedokładne
ABSORPCJA, ZATĘŻANIE
6
Równanie Henry’ego
Równanie Henry’ego
i
i
x
H
p
====
−−−−
H – stała Henry’ego; zale
ż
y od: T, rodzaju cieczy,
rodzaju gazu,
czyli
H
H
2
2,,1
1
dla pary
1
1,, 2
2
0
x
2
c
2
1
,
2
2
)
x
/
f
lim(
H
→
→
→
→
−−−−
====
2
g
2
f
f
====
−−−−
−−−−
c
2
ABSORPCJA, ZATĘŻANIE
7
interpretacja H:
interpretacja H:
γγγγγγγγ
nie zale
ż
y od
x
x
dla roztworów (niesko
ń
czenie)
rozcie
ń
czonych - podobnie
H
H
2
2,,1
1
czyli
czyli ::
prawo
prawo
Henry’ego
Henry’ego
stosuje
stosuje
si
ę
si
ę
dla
dla
roztworów
roztworów
rozcie
ń
czonych
rozcie
ń
czonych
2
1
,
2
2
x
H
p
====
−−−−
czyli
czyli::
f
f
2
2
2
c
2
c
2
x
f
f
γγγγ
====
−−−−
g
−−−−
====
2
c
2
1
,
2
f
H
γγγγ
≈≈≈≈
ABSORPCJA, ZATĘŻANIE
8
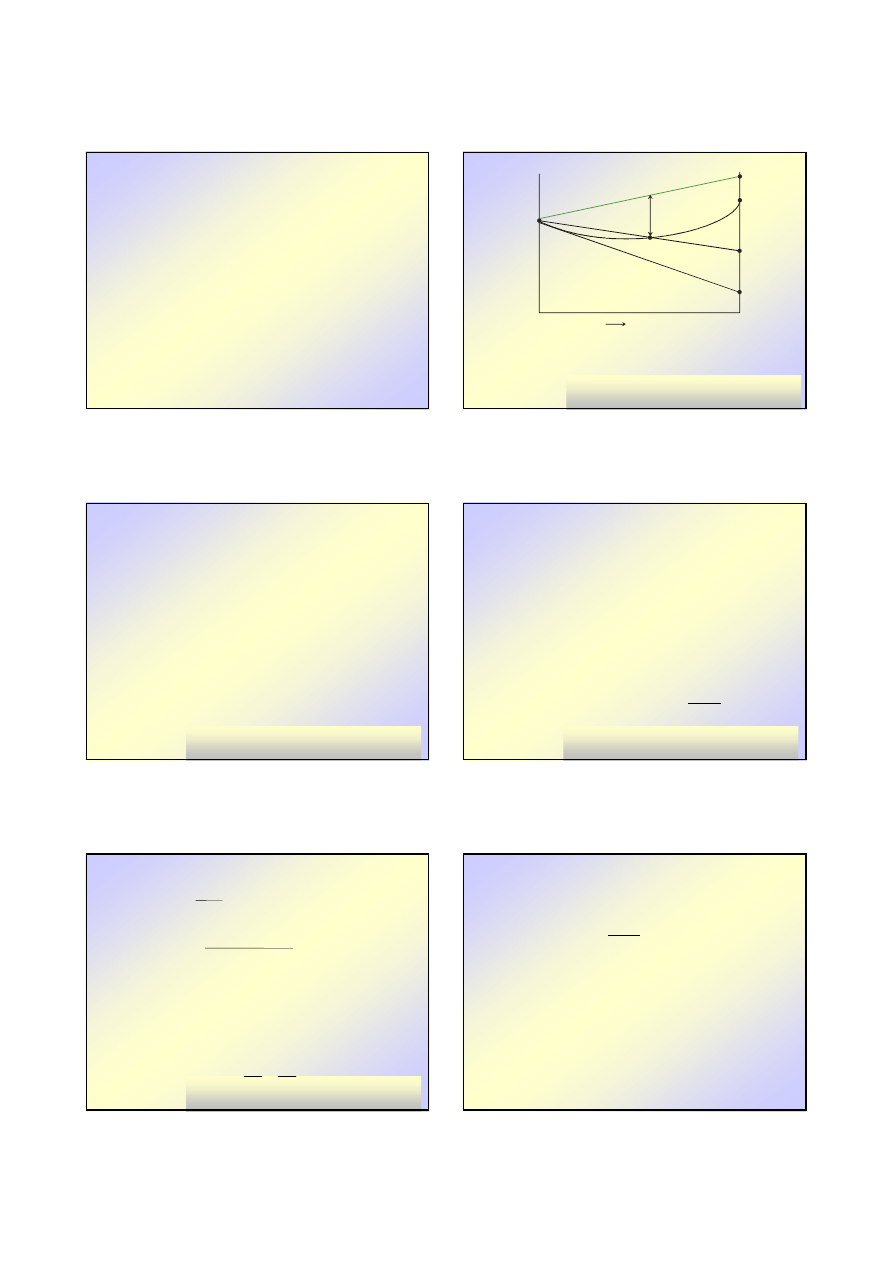
EFEKTY CIEPLNE ROZPUSZCZANIA GAZÓW
EFEKTY CIEPLNE ROZPUSZCZANIA GAZÓW
A – entalpia rozpuszczalnika
B – entalpia gazu
BC – ciepło skraplania gazu (Lp
2
)
Q – całkowe ciepło rozpuszczania
BD – ciepło rozpuszczania na 1 mol substancji 2 (Q
2
)
BE - ciepło rozpuszczania od stanu pocz
ą
tkowego do niesko
ń
czenie
wielkiego rozcie
ń
czenia (ciepło rozcie
ń
czenia) Q
2
⇒
⇒
⇒
⇒
∞
∞
∞
∞
x
2
H
Q
A
B
C
D
E
ABSORPCJA, ZATĘŻANIE
9
RÓWNOWAGA: ROZTWÓR CIECZY Z
RÓWNOWAGA: ROZTWÓR CIECZY Z
NIELOTN
Ą
SUBSTANCJ
Ą
NIELOTN
Ą
SUBSTANCJ
Ą
–
– PARA
PARA (zat
ęż
anie)
(zat
ęż
anie)
Rozpuszczalnik –
1
1
; substancja nielotna –
2
2
Uwaga
Uwaga:: w
w fazie
fazie parowej
parowej TYLKO
TYLKO rozpuszczalnik
rozpuszczalnik
Wykresy
Wykresy fazowe
fazowe
Równanie równowagi (dla doskonałej fazy parowej)
1
1
c
1
1
x
p
p
γγγγ
====
−−−−
ró
ż
nica
ró
ż
nica pr
ęż
no
ś
ci
pr
ęż
no
ś
ci::
rozpuszczalnik
czysty
–
rozpuszczalnik
w
roztworze
)
x
1
(
p
p
p
p
1
1
c
1
1
c
1
γγγγ
−−−−
====
∆∆∆∆
≡≡≡≡
−−−−
−−−−
ABSORPCJA, ZATĘŻANIE
10
Czyli
Czyli::
temperatura
temperatura wrzenia
wrzenia roztworu
roztworu jest
jest wy
ż
sza
wy
ż
sza ni
ż
ni
ż
temperatura
temperatura wrzenia
wrzenia rozpuszczalnika
rozpuszczalnika
Najcz
ęś
ciej
Najcz
ęś
ciej współczynnik
współczynnik jest
jest taki,
taki,
ż
e
ż
e::
Na
podstawie
zale
ż
no
ś
ci
współczynnika
równowagi
k
k
od
T
T
równowagi dla warunków
izobarycznych (p=const.) dochodzi si
ę
do:
uwaga
uwaga::
y
y
1
1
=
=1
1!!
!!
−−−−
>>>>
1
c
1
p
p
dT
RT
L
p
])
a
/
1
(ln[
d
)
k
(ln
d
2
1
c
1
1
====
====
ABSORPCJA, ZATĘŻANIE
11
Całkujemy od T do T
1
dla małych
x
x
2
2
– r-ry silnie rozcie
ń
czone:
2
2
1
c
1
x
)
x
1
ln(
x
ln
)
a
ln(
−−−−
≈≈≈≈
−−−−
====
====
bo
bo rozwini
ę
cie
rozwini
ę
cie w
w szereg
szereg::
....
!
3
x
!
2
x
x
)
x
1
ln(
3
2
2
2
2
2
−−−−
−−−−
−−−−
−−−−
====
−−−−
1
T
T
1
c
1
)
T
/
1
(
R
L
p
)
a
ln(
b
−−−−
====
1
1
1
c
1
T
T
R
)
T
T
(
L
p
)
a
ln(
−−−−
−−−−
====
ABSORPCJA, ZATĘŻANIE
12
w ko
ń
cu:
wzór
wzór
na
na
podwy
ż
szenie
podwy
ż
szenie
temperatury
temperatury
wrzenia
wrzenia
roztworu
roztworu
uwaga
uwaga::
Ten
Ten
wzór
wzór
stosuje
stosuje
si
ę
si
ę
przy
przy
niewysokich
niewysokich
warto
ś
ciach
warto
ś
ciach ci
ś
nienia
ci
ś
nienia (ok
(ok.. atmosferycznego)
atmosferycznego)..
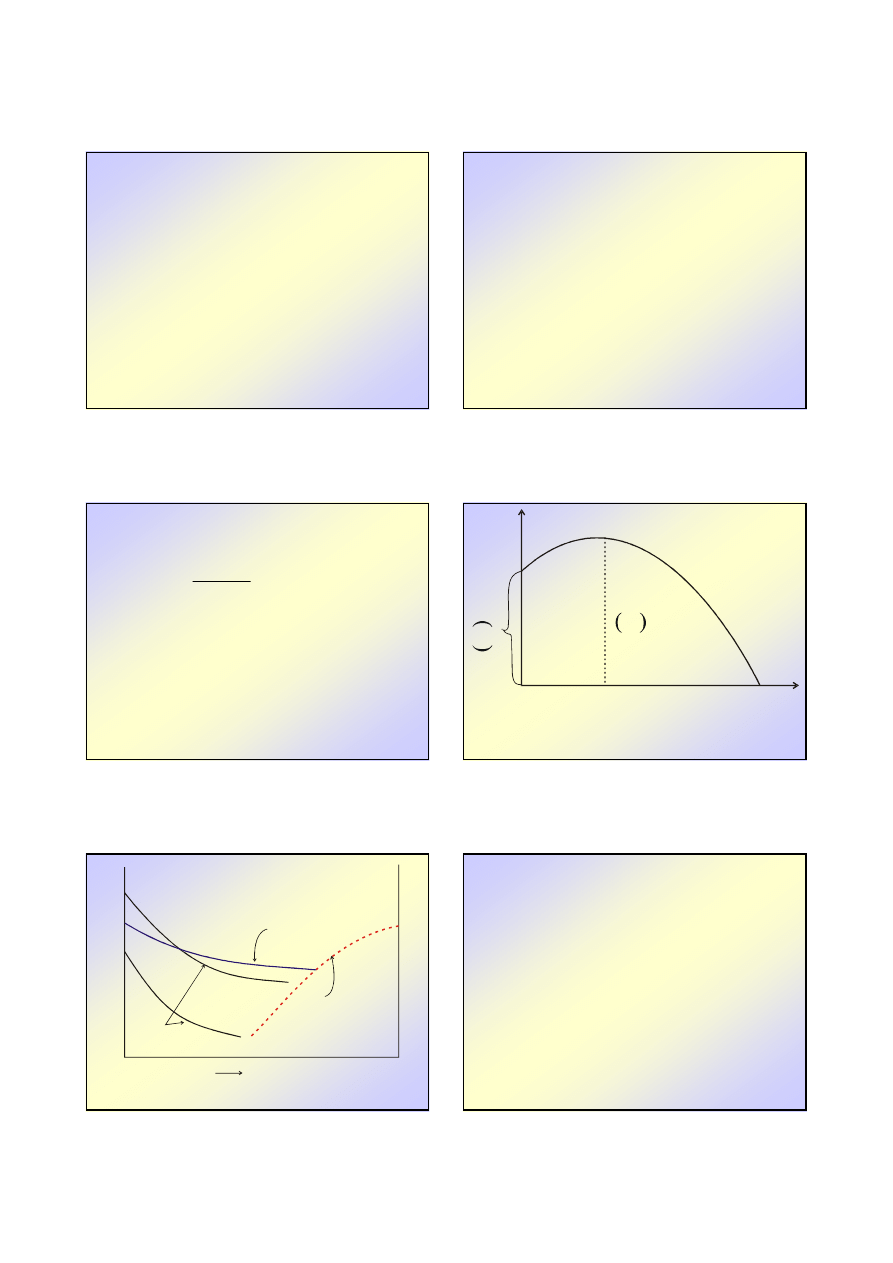
Dla
Dla wy
ż
szych
wy
ż
szych ,, metoda
metoda graficzna
graficzna..
przy zało
ż
eniu:
2
1
1
T
T
T
≅≅≅≅
2
1
2
1
1
w
x
L
p
RT
T
T
T
====
−−−−
≡≡≡≡
∆∆∆∆
3
ABSORPCJA, ZATĘŻANIE
13
WYKRESY
WYKRESY ENTALPOWE
ENTALPOWE
Bilans
energetyczny
procesu
izotermicznego
rozcie
ń
czania od stanu
p
p
do
k
k
takiego,
ż
e
osi
ą
gni
ę
to niesko
ń
czenie wielkie rozcie
ń
czenie
(u
(u
2
2
→
→
→
→
→
→
→
→
0
0))::
•
ciepło rozpuszczania w T
S
•
stany odniesienia: h
1
=0 w T
0
, p
0
dla substancji
czystej;
h
2
=
0
dla
niesko
ń
czenie
wielkiego
rozcie
ń
czenia w T
s
=18/20/25 C i p
s
Konstrukcja izotermy na wykresie h=f(x
2
)
Dane
Dane ii zało
ż
enia
zało
ż
enia::
ABSORPCJA, ZATĘŻANIE
14
gdzie
q
q
c
c
– ciepło potrzebne do zachowania
warunku izotermiczno
ś
ci
m
m
1
1,p
,p
;; m
m
1
1,k
,k
– masa rozpuszczalnika w stanie p, k
h
h
s
s
,, h
h
1
1
,, h
h
2
2,,
∝
∝
∝
∝
∝
∝
∝
∝
- entalpie odpowiednio: jednostki
masy roztworu, rozpuszczalnika i substancji 2 w
stanie niesko
ń
czenie wielkiego rozcie
ń
czenia
k
,
1
,
2
2
c
p
,
1
k
,
1
1
s
2
p
,
1
m
h
m
q
)
m
m
(
h
h
)
m
m
(
++++
====
====
−−−−
−−−−
++++
++++
∞
∞
∞
∞
h
1
ABSORPCJA, ZATĘŻANIE
15
Ciepło
jest efektem cieplnym rozcie
ń
czania
izotermicznego od stanu pocz
ą
tkowego do
u
u
2
2
→
→
→
→
→
→
→
→
0
0
(na 1 kg roztworu).
je
ż
eli
je
ż
eli h
h
2
2,,
∝
∝
∝
∝
∝
∝
∝
∝
=
=0
0 to
to::
g
gdzie
dzie::
2
p
,
1
c
p
m
m
q
q
++++
====
∞
∞
∞
∞
→
→
→
→
Parametr
jest
podawany
w
literaturze
„bezpo
ś
rednio” lub mo
ż
na go odczyta
ć
z ró
ż
nych
innych danych i wykresów. Np. wykres zale
ż
no
ś
ci
ciepła rozcie
ń
czania od stanu p do stanu k.
∞
∞
∞
∞
→
→
→
→
++++
−−−−
====
p
1
2
s
q
h
)
u
1
(
h
ABSORPCJA, ZATĘŻANIE
16
k
p
q
2
∞
→
p
q
2
k
p
q
→
2
2
u
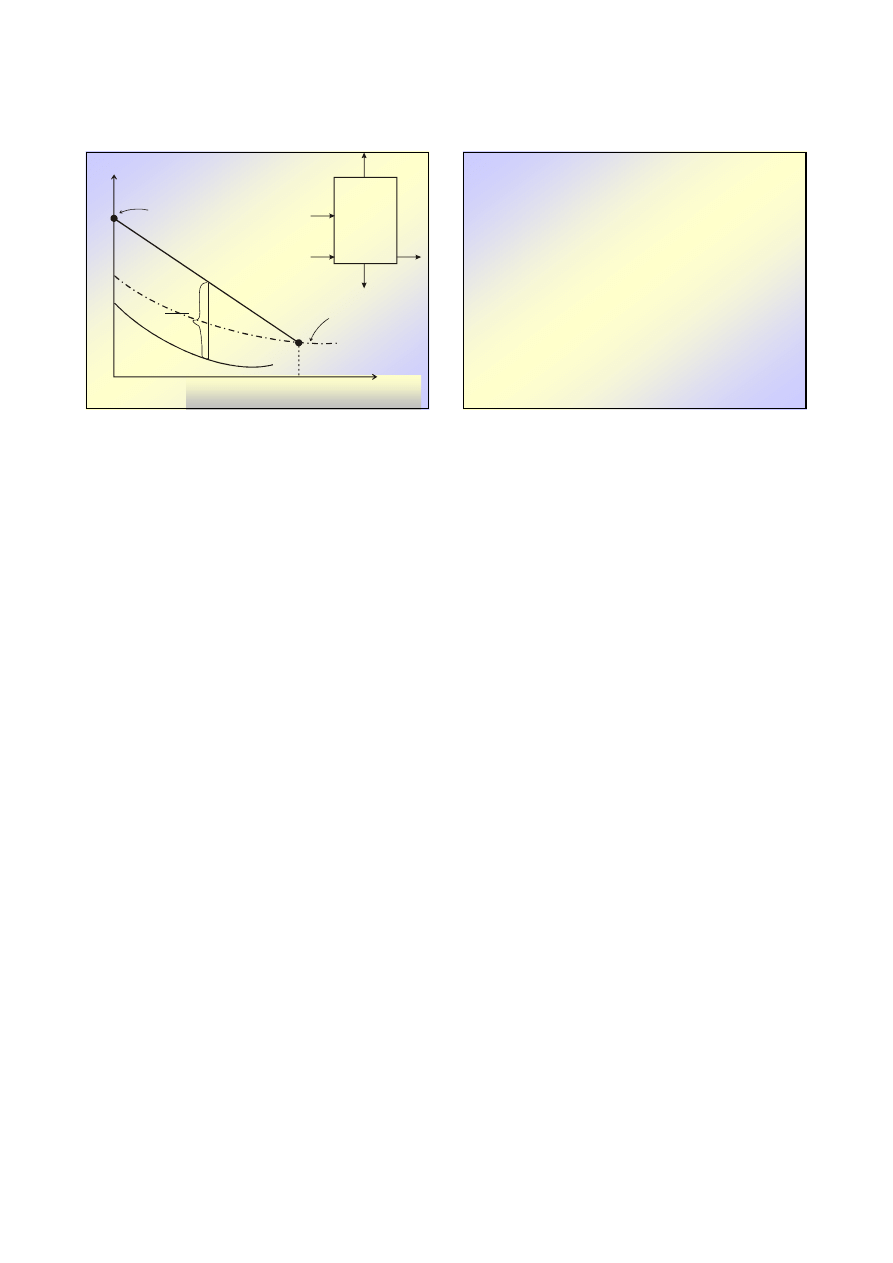
ABSORPCJA, ZATĘŻANIE
17
u
2
h
izobara
wrzenia
krzywa
nasycenia
izotermy
ABSORPCJA, ZATĘŻANIE
18
Izotermy dla T
≠≠≠≠
T
s
oblicza si
ę
z:
Dane
Dane::
ciepło wła
ś
ciwe roztworu w funkcji składu
dla
T
T
Wykres
Wykres entalpowy
entalpowy
Obszary (rozdzielone izobar
ą
wrzenia):
•
ciekły
nienasycony
i
przesycony
–
izotermy
krzywoliniowe
w
obszarze
nienasyconym,
prostoliniowe w przesyconym
•
parowy – izotermy prostoliniowe
∫∫∫∫
++++
====
T
T
pM
s
s
dT
c
h
h
4
ABSORPCJA, ZATĘŻANIE
19
opary
para
grzewcza
u
2,S
u
2,W
h
u
2
u
2,W
u
2,S
opary
rozpuszczalnika
T
s
S
C
m
q
p
ABSORPCJA, ZATĘŻANIE
20
Metody zat
ęż
ania roztworów
Metody zat
ęż
ania roztworów
procesy
procesy wyparne
wyparne
•
ogrzewanie przeponowe (par
ą
wodn
ą
,...) –
typowa wyparka
•
ogrzewanie bezprzeponowe (mieszanie z par
ą
wodn
ą
)
•
samo-odparowanie
Wyszukiwarka
Podobne podstrony:
(W7a Stale do kszta t na zimno cz I [tryb zgodno ci])
termodynamika czesc v [tryb zgodnosci]
(W7a Stale do kszta t na zimno cz I [tryb zgodno ci])
termodynamika cz xi [tryb zgodnosci]
cz 1c projektowanie systemow czasu rzeczywistego tryb zgodnosci
Bazy Danych cz III [tryb zgodności]
termodynamika czesc vi [tryb zgodnosci]
Bazy Danych cz II [tryb zgodnos Nieznany (2)
cz 1d zarzadzanie projektem informatycznym tryb zgodnosci
cz 1b wybrane problemy programomerii tryb zgodnosci
cz 1c projektowanie systemow czasu rzeczywistego tryb zgodnosci
termodynamika czesc iii [tryb zgodnosci]
termodynamika czesc vii [tryb zgodnosci]
termodynamika czesc viii [tryb zgodnosci]
(Fizyka II Termodynamika [tryb zgodności])
więcej podobnych podstron