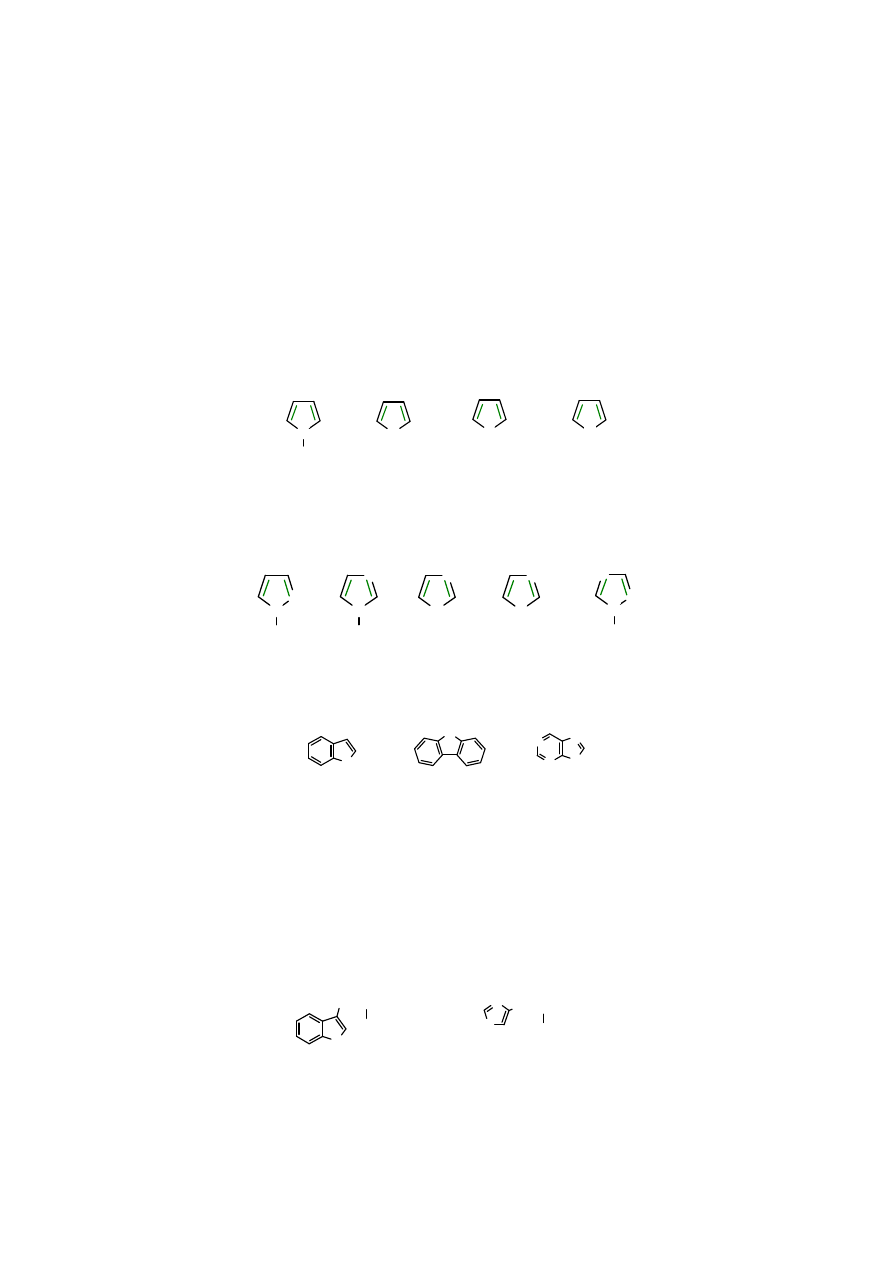
1
H E T E R O C Y K L I C Z N E
Z W I Ą Z K I A R O M A T Y C Z N E
Aleksander Kołodziejczyk styczeń 2007
Cykliczne związki zawierające heteroatom (tzn. atom inny niż atom węgla, najczęściej N, O lub
S) oraz odpowiednią liczbę podwójnych wiązań, tak żeby razem z wolną parą heteroatomu
spełniać regułę Hückla wykazują właściwości aromatyczne.
Należą do nich heterocykle
pięciocio- lub sześcioczłonowe
.
Pięcioczłonowe heterocykle aromatyczne
Przykłady pięcioczłonowych heterocykli aromatycznych.
N
O
S
H
..
..
..
..
C
-
..
..
pirol furan tiofen
anion cyklopendienowy
Warto zwrócić uwagę, że podobną, spełniającą regułę Hückla strukturę elektronową ma anion
cyklopentadienowy. Oczywiście wszystkie przedstawione pierścienie są płaskie.
Heterocykle aromatyczne mogą zawierać więcej heteroatomów.
N
N
O
N
S
N
H
N
N
H
N
N
N
H
..
..
..
..
..
..
..
oksazol
tiazol
imidazol pirazol triazol
[
(1,3,5)triazol
]
Znane są też heterocykle pięcioczłonowe skondensowane z innymi pierścieniami homo- lub
heterocyklicznymi.
N
H
N
H
N
N
N
H
N
indol karbazol puryna
Występowanie
Pięcioczłonowe, heterocykliczne pierścienie znajdują się w wielu związkach naturalnych.
Przykładem mogą być aminokwasy –
tryptofan
i
histydyna
, aminy biogenne, np.
tryptamina
,
histamina
czy
skatol
, alkaloidy, np. alkaloidy sporyszu (pochodne
kwasu lizerginowego
), LSD-
25 (pochodna
kwasu lizerginowego
),
johimbina
,
strychnina
(układ indolowy), alkaloidy
purynowe (
kofeina
i analogi), aminy wchodzące w skład kwasów nukleinowych, np.
guanina
,
związki zawierające
hem
, np.
hemoglobina
,
chlorofil
,
tiamina
(witamina B
1
) i wiele innych.
aminokwasy:
N
H
N CH
2
CHCOOH
NH
2
N
H
CH
2
CHCOOH
NH
2
tryptofan
histydyna
2
aminy biogenne:
N
H
CH
2
CH
2
NH
2
N
H
N CH
2
CH
2
NH
2
N
H
CH
3
N
H
CH
2
N(CH
3
)
2
N
H
CH
2
CH
2
NH
2
O
H
tryptamina
histamina
skatol
gramina
serotonina
Histamina
powstaje z
histydyny
w trakcie
dekarboksylacji
białek. Należy do hormonów
tkankowych, pojawia się w skórze, płucach i komórkach tucznych. Jest składnikiem wielu
toksyn, np. os, pszczół, niektórych toksycznych ryb. Wywołuje reakcje alergiczne, oraz obniża
ciśnienie krwi. Tego rodzaju objawy wymagają podania leków antyhistaminowych.
Skatol
tworzy się z
tryptofanu
z procesach gnilnych. Występuje w kale. Ma niezwykle
nieprzyjemny zapach. Jego zapach wyczuwalny jest przy stężeniu 10 ppb, w roztworze wodnym.
Znajduje się także w aromacie niektórych serów.
Tryptamina
należy do produktów degradacji biologicznej
tryptofanu
, powstaje również ze
strychniny
pod wpływem silnych zasad. Jest szeroko rozpowszechniona w przyrodzie.
Znaleziono ją w grzybach, wyższych roślina i u zwierząt. Znajduje się w owocach jadalnych, np.
ananasach, pomarańczach, śliwkach czy pomidorach.
Gramina
należy do alkaloidów grupy indoliloalkiloamin. Została wyodrębniona ze zbóż (z
jęczmienia). Powstaje w wyniku biodegradacji
tryptofanu
. Jest toksyczna.
Serotonina
jest aminą biogenną szeroko rozpowszechnioną zarówno w roślinach, jak i u
zwierząt. Znajduje się w owocach jadalnych, np. bananach, ananasach, a także w groźnych
toksynach. U saków w tym u ludzi pełni rolę
neuroprzekaźnika
działającego w ośrodkowym
układzie nerwowym i układzie pokarmowym, występuje też w trombocytach.
Niektóre czynności związane z odczuwaniem przyjemnych, np. jedzenie czekolady wywołują
zwiększone wydzielanie
serotoniny
.
Serotonina
bierze aktywny udział w procesie zasypiania - u
zwierząt doświadczalnych blokowanie jej syntezy wywoływało bezsenność. Wpływa na popęd
seksualny, zachowania impulsywne i apetyt. Niektóre narkotyki, w tym opioidy, meskalina i
LSD zwiększają syntezę i uwalnianie
serotoniny
w mózgu lub ją zastępują w roli
neuroprzekaźnika.
alkaloidy sporyszu:
N
N
H
COOH
CH
3
N
N
H
CO
CH
3
NH CH CH
2
OH
CH
3
H
H
kwas
lizerginowy
ergometryna
3
LSD-25 i
strychnina
N
N
H
CON(Et)
2
CH
3
N
N
O
O
H
H
H
H
H
LSD-25
strychnina
alkaloidy purynowe
N
N
N
N
N
N
N
N
OH
OH
O
H
N
N
N
N
O
O
O
N
N
N
N
O
O
O
CH
3
C
H
3
CH
3
H
H
H
puryna
H
H
H
H
kwas moczowy
kofeina
hem
i
chlorofil
:
N
N
N
N
N
N
N
N
COOH
COOH
..
..
H
H
tetrapirol
Fe
hem
chlorofil
i
tiamina
:
..
..
N
N
N
N
O
OC
CO
O
C
20
H
39
O
N
S
N
N
NH
3
OH
Mg
CH
3
+
-
Cl
chlorofil a
tiamina
Zadanie: wskaż i nazwij heterocykliczne ugrupowania w związków naturalnych, podanych powyżej.
Otrzymywanie
Ogólna metoda tworzenia heterocyklicznych, pięcioczłonowych pierścieni zarówno
pirolu
,
furanu
,
tiofenu
, jak i ich analogów polega na ogrzewaniu związków 1,4-dikarbonylowych
odpowiednimi reagentami.
Furan
i jego homologi powstają pod wpływem odwodnienia, np. za
pomocą P
2
O
5
. Do otrzymania pierścienia pirolowego potrzebny jest amoniak lub jego sole, a
tiofen
i jego analogi tworzą się w obecności siarczków fosforu, np. pentasiarczku fosforu –
P
4
S
10
.
R
R
z
O
R
R
O
∆
Z
związki
1.4-dikarbonylowe
związki
heterocykliczne
4
Z
acetonyloacetonu
(
heksa-2,5-dionu
) można w ten sposób otrzymać 2,5-dimetylowe pochodne
pięcioczłonowych heterocykli.
O
CH
3
C
H
3
O
CH
3
C
H
3
O
N
H
CH
3
C
H
3
S
CH
3
C
H
3
acetonyloaceton
P
2
O
5
,
∆
(NH
4
)
2
CO
3
∆
100
o
C
P
4
S
10
2,4-dimetylofuran
2,4-dimetylopirol
2,4-dimetylotiofen
Pirol
występuje w smole węglowej i z niej jest wyodrębniany. Powstaje także w trakcie
pirolizy
produktów naturalnych zawierających białko. Można go otrzymać z
furanu
w reakcji z
amoniakiem w temp. 400
o
C, wobec katalizatora jakim jest tlenek glinu.
O
N
H
NH
3
.
aq
Al
2
O
3
, 400
o
C
furan
pirol
Polecaną metodą otrzymywania
pirolu
jest
piroliza
galaktaronianu amonu
(soli amonowej
kwasu
galaktarowego
, zwanego inaczej
kwasem śluzowym
).
N
H
CH(OH)
CH
(OH)HC
CH(OH)
NH
4
OOC
O
O
pirol
(OH)
C
H
4
N
∆
- 2 CO
2
, - NH
3
, - HOH
37%
+
-
galaktoronianu amonu
N-metylowane pochodne pirolu powstają w podobnej jak wyżej reakcji z
soli metyloamoniowej
kwasu arowego
.
C-Alkilowe pochodne pirolu tworzą się w reakcji kondensacji
αααα
-aminoketonów (aldehydów) ze
związkami karbonylowymi.
CH
O
NH
2
H
H
O
N
H
C
C
+
C
- 2 HOH
pirol
αααα
-aminoketon keton
Furan
powstaje w reakcji
dekarbonylowania
(
eliminacji
CO)
furfuralu
.
Furfural
natomiast jest
produktem
pirolizy
pentoz.
O
CHOH
CH
HOC
CHOH
O
O
CHO
furan
HO
CH
∆
,
kat.
- CO
H
2
- HOH
+
H,
∆
furfural
pentoza
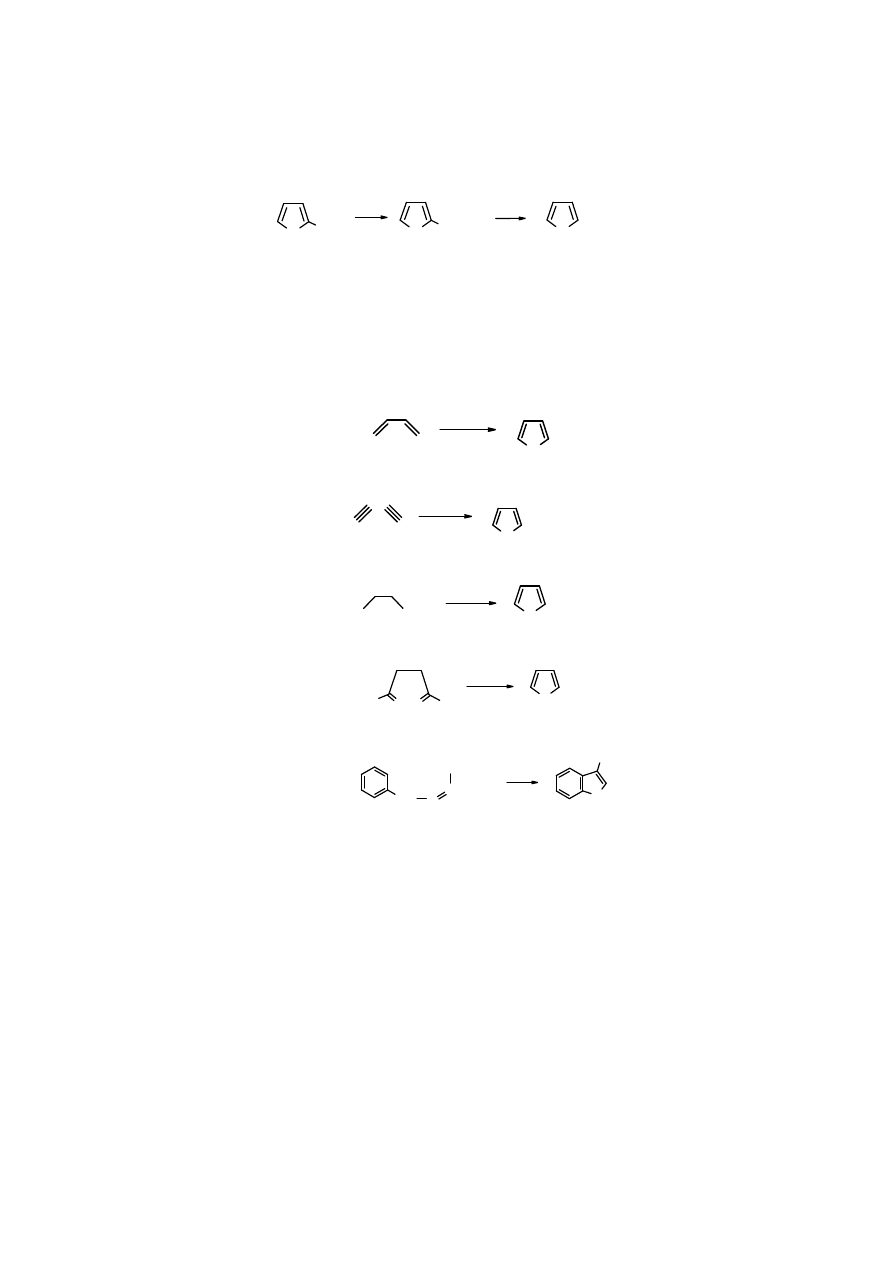
5
Z
furfuralu
można otrzymać
kwas pirośluzowy
, z niego zaś w reakcji
dekarboksylacji
tworzy się
furan
.
O
O
CHO
O
COOH
furan
∆
,
kat.
- CO
2
[O]
furfural kwas pirośluzowy
Tiofen
także występuje w smole węglowej, towarzyszy surowemu benzenowi z uwagi na
zbliżone temperatury wrzenia tych cieczy. Oczyszczenie benzenu poprzez usunięcie tiofenu
wymaga metod opartych na reakcjach chemicznych – podczas
sulfonowania
tej mieszaniny w
łagodnych łagodnego powstaje jedynie
kwas tiofenosulfonowy
, który jest łatwo usuwalny
poprzez przemycie wodą.
Tiofen
syntezuje się poprzez ogrzewanie
1,3-butadien
u z siarką.
S
S, 600
o
C
1,3-butadien
tiofen
- H
2
S
Do otrzymywania
tiofenu
można również wykorzystać
etyn
.
S
S, 300
o
C
tiofen
+
etyn
Przemysłowa metoda otrzymywania
tiofenu
polega ogrzewaniu
n-butanu
z siarką.
S
S
n-butan
tiofen
560
o
C
Także z
kwasu bursztynowego
powstaje
tiofen
.
S
O
OH
O
H
O
∆
P
4
S
10
kwas
bursztynowy
tiofen
Skatol
otrzymuje się syntetycznie z fenylohydrazonu propanalu.
NH N
CH
CH
2
CH
3
N
H
CH
3
∆
- NH
3
skatol
fenylohydrazon
propanalu
Właściwości fizyczne i fizjologiczne
Pirol
,
furan
i
tiofen
są bezbarwnymi, hydrofobowymi (trudno rozpuszczalnymi w wodzie)
cieczami, o temperaturach wrzenia odpowiednio: 130, 31 i 84
o
C. Temperatura wrzenia furanu
odpowiada tw. wrzenia
eteru dietylowego
(34,5
o
C). Wysoka tw.
pirolu
jest rezultatem jego
zdolności do tworzenia wiązań wodorowych, podobnie jak i innych amin 1
o
i 2
o
; wrze wyżej niż
dietyloamina (56
o
C). Wyższa tw.
tiofenu
w porównaniu z
furanem
wynika z jego wyższej masy
cząsteczkowej (tw.
sulfidu dietylowego
wynosi 92
o
C).
Wszystkie trzy omawiane związki i ich homologi mieszają się z większością popularnych
rozpuszczalników organicznych.
Pirol
pod wpływem światła i powietrza szybko ciemnie. Jest bardzo słabą zasadą, pod wpływem
mocnych kwasów polimeryzuje.

6
Zapach
tiofenu
jest słaby, mało charakterystyczny. Zapach
furanu
jest również słaby, przypomina
chloroform
. Charakterystyczny zapach ma
pirol
.
Skatol
należy do związków o bardzo
nieprzyjemnym zapachu, jest głównym składnikiem zapachowym kału.
Właściwości chemiczne
Pomimo istnienia układu dwóch sprzężonych podwójnych wiązań w pięcioczłonowych
związkach heterocyklicznych, nie wykazują one charakterystycznych właściwości dla
sprzężonych dienów, tzn.
nie polimeryzują
i nie wchodzą w reakcję dienofilami. Jedynie
pirol
w
ś
rodowisku mocnych kwasów szybko polimeryzuje, jakby pod ich wpływem tracił jakąś osłonę
zabezpieczającą go przez polimeryzacją. Te nadzwyczajne właściwości heterocykli wynikają z
ich charakteru aromatycznego. Dwa sprzężone wiązania
ππππ
z wolną parą elektronową na
heteroatomie tworzą sekstet elektronowy. Jest to jak wiadomo warunkiem zaistnienia
aromatyczności. Również drugi warunek reguły Hückla jest spełniony, ponieważ te hetrocykle
są płaskie.
Wolna para elektronowa na heteroatomie zajmuje tak jak elektrony na atomach węgla orbital p,
prostopadły do płaszczyzny pierścienia. Jest to możliwe dzięki hybrydyzacji sp
2
heteroatomu.
N
H
H
H
H
H
N
H
H
H
H
H
.
.
.
.
..
Rys. Aromatyczne sprzężenie elektronów
π
i wolnej pary elektronowej w
pirolu
Podobnie jest w
furanie
i
tiofenie
. Druga wolna para elektronów nie przeszkadza w sprzężeniu.
O
H
H
H
H
S
H
H
H
H
.
.
.
.
..
.
.
.
.
..
:
:
furan
tiofen
Wzory mezomeryczne, wynikające ze sprzężenia elektronów
π
i wolnej pary elektronów
przypominają wzory mezomeryczne
benzenu
; nie są one jednak równocenne.
z
z
z
z
z
..
..
+
-
..
+
-
..
+
-
..
+
-
Z powyższej przedstawionych wzorów mezomerycznych wynika, że cząsteczki heterocykli, w
przeciwieństwie do cząsteczki
benzenu
, powinny wykazywać moment dipolowy, ponieważ w
położeniach
αααα
i
ββββ
zgromadzony jest ładunek ujemny, a na heteroatomie dodatni. Faktycznie
furan
, np. wykazuje moment dipolowy równy 0,7D, skierowany zgodnie z oczekiwaniem, tzn. z
biegunem dodatnim na atomie tlenu.
O
O
..
..
µ
= 0,7D 1,7D
furan
..
..
tetrahydrofuran
Warto zwrócić uwagę, że
tetrahydrofuran
, uwodorniony analog
furanu
, ma biegun ujemny
zlokalizowany na atomie tlenu, jako że atom tlenu jest w tej cząsteczce najbardziej
elektroujemny, a żadne efekty nie zakłócają rozmieszczenia elektronów.
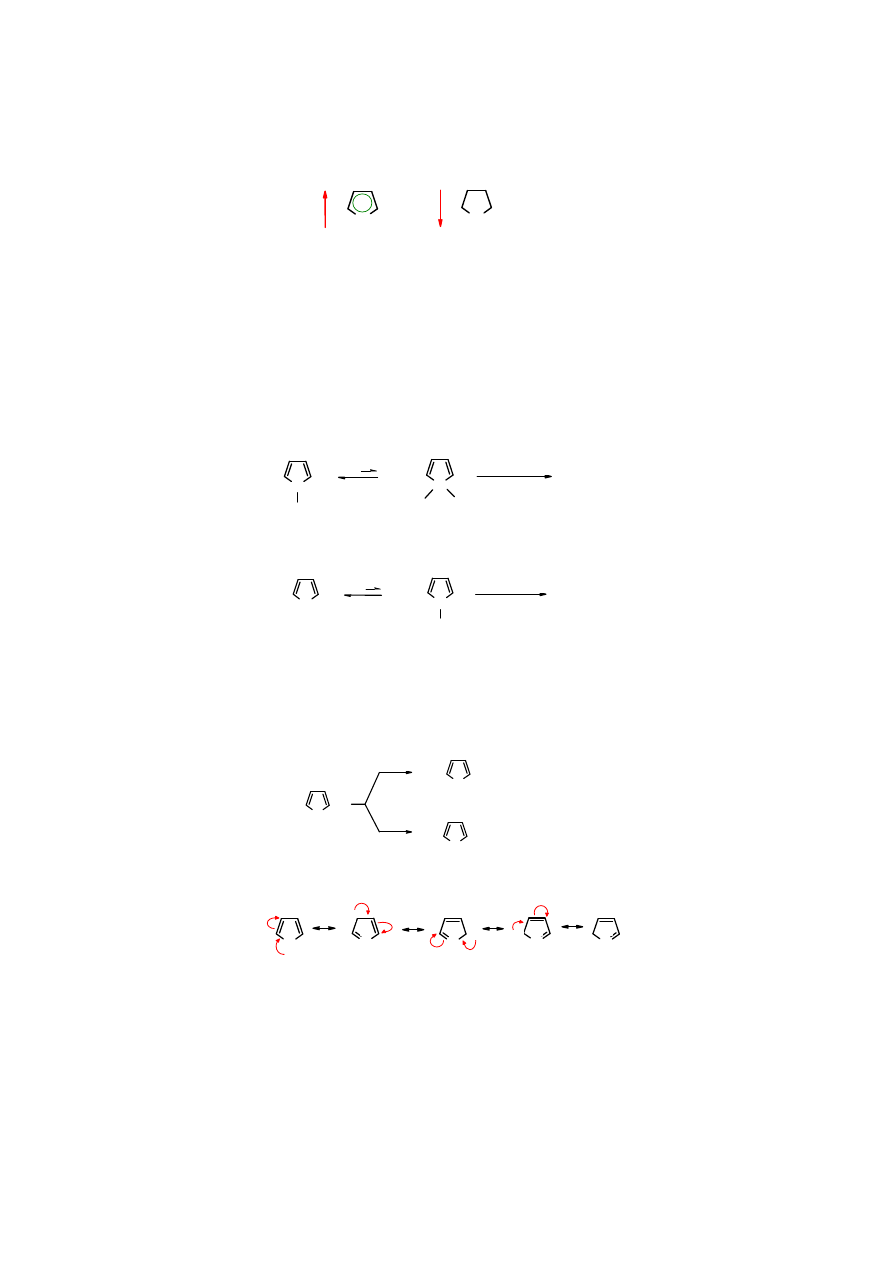
7
O
O
..
furan
..
..
tetrahydrofuran
+
δδδδ
+
δδδδ
+
δδδδ
-
δδδδ
-
δδδδ
-
δδδδ
-
δδδδ
-
δδδδ
1. Właściwości kwasowo-zasadowe
1.1. Zasadowość
Pirol
z uwagi na wolna parę elektronową przy atomie azotu powinien, jak wszystkie aminy,
wykazywać właściwości zasadowe, tzn. powinien być akceptorem protonów. Elektrony te jednak
wchodzą w skład aromatycznego sekstetu, są więc mocna zaangażowane i nie przejawiają
powinowactwa do protonów. Utworzenie przez nie wiązania z protonem wiąże się z utratą
energii rezonansu, która dla układów aromatycznych jest rzędu wartości energii wiązania
kowalencyjnego. Pod wpływem silnych kwasów
pirol
ulega jednak protonowaniu, tracąc przy
tym aromatyczność odzyskuje właściwości sprzężonego dienu i szybko polimeryzuje.
N
H
N
H
H
..
polimeryzacja
polimer
+
H
+
Z silnymi kwasami etery też tworzą sole (oksoniowe), dlatego
furan
pod ich wpływem również
polimeryzuje
.
O
O
H
..
polimeryzacja
polimer
+
H
+
..
..
furan
1.2 Kwasowość
Atom wodoru związany z atomem azotu
pirolu
jest znacznie bardziej kwaśny niż w amoniaku,
czy aminach. pK
a
Pirolu
wynosi 17,5; dla porównania pK
a
amoniaku dochodzi do 36.
Pirol
tworzy sole z wodorotlenkami metali alkalicznych, a ze związkami Grignarda reaguje, tak jak
kwasy czy związki o właściwościach kwasowych.
N
H
N
N
..
..
KOH
CH
3
MgBr
..
-
K
+
+ HOH
..
..
-
MgBr
+
+ CH
4
pirol
metan
pK
a
= 17,5
Jak wynika ze struktur mezomerycznych anion powstały z
pirolu
jest ambidentnym nukleofilem.
N
N
N
N
N
..
..
-
..
..
-
..
..
-
.. ..
-
..
..
-
struktury mezomeryczne anionu
pirolu
Ambidentny
charakter anionu
pirolu
przejawia się w tym, że ulega on zarówno N, jak i C
alkilowaniu
. Kierunek reakcji zależy głównie od właściwości odczynnika alkilującego, a także
od rodzaju rozpuszczalnika oraz towarzyszącego kationu.
Acylowanie
anionu
pirolu
prowadzi
do pochodnej zawierającej resztę acylową w pozycji 2.
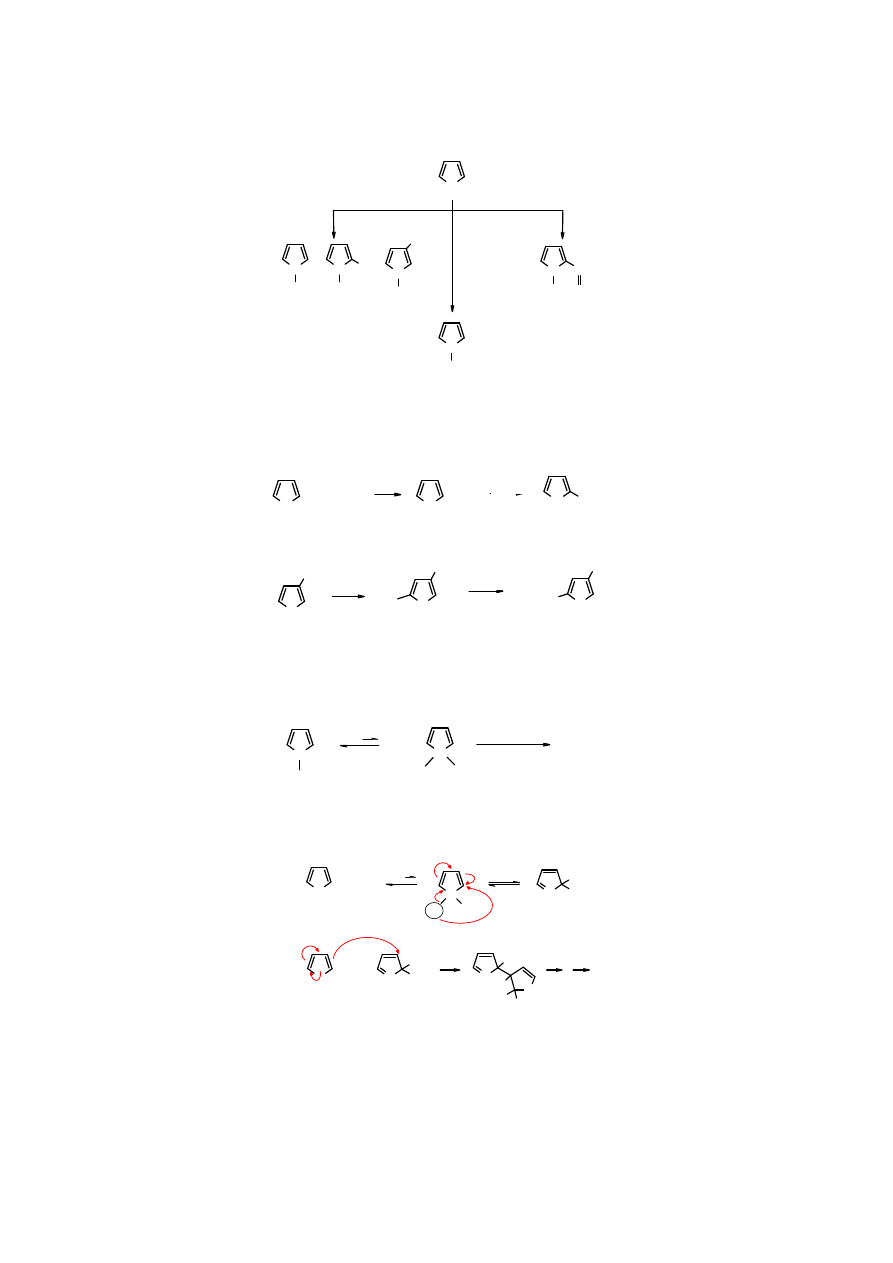
8
N
N
Me
N
H
Me
N
H
Me
N
Me
N
H
C-CH
3
O
..
..
-
MgBr
+
TosOMe
MeI
AcCl
..
..
..
..
..
N-metylopirol
2-metylopirol
3-metylopirol
2-acetylopirol
N-metylopirol
Silne zasady (BuLi, PhNa itp.) są w stanie oderwać protony z pierścienia N-alkilopirolu,
furanu
i
tiofenu
. Oderwaniu (deprotonacji) w pierwszej kolejności ulega proton w pozycji 2, a następnie
4. Deprotonowane heterocykle (aniony) wchodzą w typowe reakcje, np.
acylowania
czy
alkilowania
.
O
O
O
COOH
..
..
+ PhNa
..
..
:
Na
+
-
- C
6
H
6
1.
CO
2
2.
H
+
..
..
furan fenylosód kwas furano-2-karboksylowy
S
CH
3
S
CH
3
Li
S
CH
3
HOOC
..
..
BuLi
..
..
..
..
1.
CO
2
2.
H
+
3-metylotiofen 3-metylotiofenylo-5-lit kwas 3-metylotiofeno-5-karboksylowy
2. Polimeryzacja
Pod wpływem silnych kwasów
pirol
i
furan
tracą właściwości aromatyczne i szybko
polimeryzują
, czyli ulegają reakcji charakterystycznej dla sprzężonych dienów.
N
H
N
H
H
..
polimeryzacja
polimer
+
H
+
Mechanizm polimeryzacji
Protonowany
pirol
staje się elektrofilem i reaguje z drugą cząsteczką
pirolu
wg typowego
mechanizmu reakcji S
E
.
N
H
N
H
H
N
H
H
N
H
N
H
H
N
H
N
H
H
H
H
..
+ H
+
+
+
H
..
+
+
H
+
H
tautomeria
Zadanie: przedstaw mechanizm
polimeryzacji
furanu
.
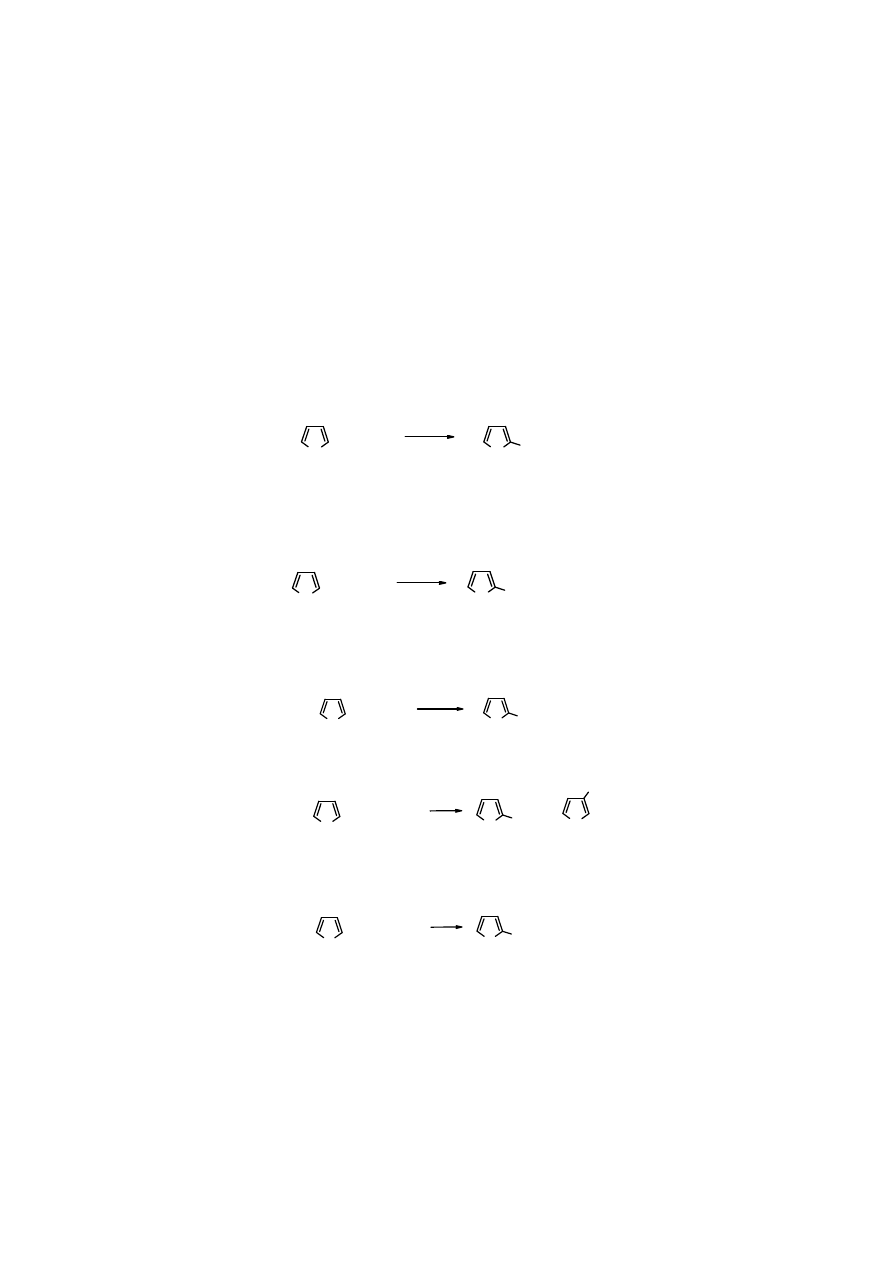
9
3. Substytucja elektrofilowa S
E
Właściwości aromatyczne heterocykli pięcioczłonowych przejawiają się w ich podatności na
substytucję elektrofilową.
Pirol
,
furan
i
tiofen
ulegają reakcją S
E
znacznie łatwiej niż
benzen
.
Obecność heteroatomu w pierścieniu aktywuje te związki w reakcjach S
E
podobnie jak
przyłączona do pierścienia benzenowego grupa aminowa czy fenolowa.
Halogenowanie
,
nitrowanie
,
sulfonowanie
czy
acylowanie
heterocykli pięcioczłonowych prowadzi się w niskich
temperaturach, po to żeby zapewnić selektywność reakcji (ograniczyć podstawienie kolejnych
atomów wodoru). Monopodstawienie następuje w pozycji 2, pod warunkiem, że nie jest ona
zajęta. Reaktywność heterocykli pięcioczłonowych zmienia się wg następującego szeregu:
tiofen
>
pirol
>
furan
.
3.1 Halogenowanie
Halogenowanie
, podobnie jak w przypadku
aniliny
i
fenolu
nie wymaga stosowania katalizatora.
O
O
Br
+ Br
2
dioksan
0
o
C
+ HBr
furan 2-bromofuran
(90%)
3.2 Sulfonowanie
Najdogodniejszym czynnikiem sulfonującym jest tritlenek siarki. Kwas siarkowy powoduje
polimeryzację
pirolu
i
furanu
.
O
O
SO
3
H
+ SO
3
pirydyna
0
o
C
furan
kwas furano-2-
-karboksylowy
3.3 Nitrowanie
W mieszaninie nitrującej zamiast kwasu siarkowego stosuje się
bezwodnik octowy
, którego
głównym zadaniem jest wiązanie wydzielającej się wody.
N
H
N
H
NO
2
+ HNO
3
Ac
2
O
0
o
C
pirol
2-nitropirol
(83%)
Można również do tego celu wykorzystać
octan nitrozylu
.
N
H
N
H
NO
2
N
H
NO
2
+ AcONO
2
-10
o
C
pirol
(61%)
(13%)
+
2-nitropirol 3-nitropirol
Nitrowanie
tiofenu
daje jeden izomer.
S
S
NO
2
+ AcONO
2
0
o
C
tiofen
2-nitrotiofen
3.4 Acylowanie
Acylowanie
heterocykli pięcioczłonowych prowadzi się typowymi odczynnikami acylującymi, a
więc chlorkami kwasowymi i bezwodnikami, można jednak stosować inne niż chlorek glinu
katalizatory.
10
O
O
C-CH
3
O
Ac
2
O
BF
3
furan
2-acetylofuran
S
S
O
PhCOCl
SnCl
4
tiofen
2-benzoilotiofen
C
3.5 Sprzęganie
Sole diazoniowe łatwo
sprzęgają
się z pięcioczłonowymi heterocyklami. Podstawienie grupą
azową następuje w najbardziej reaktywnym miejscu, czyli w pozycji 2.
N
H
N
H
N N
N N
SnCl
4
pirol
2-(fenyloazo)pirol
+
-
Cl
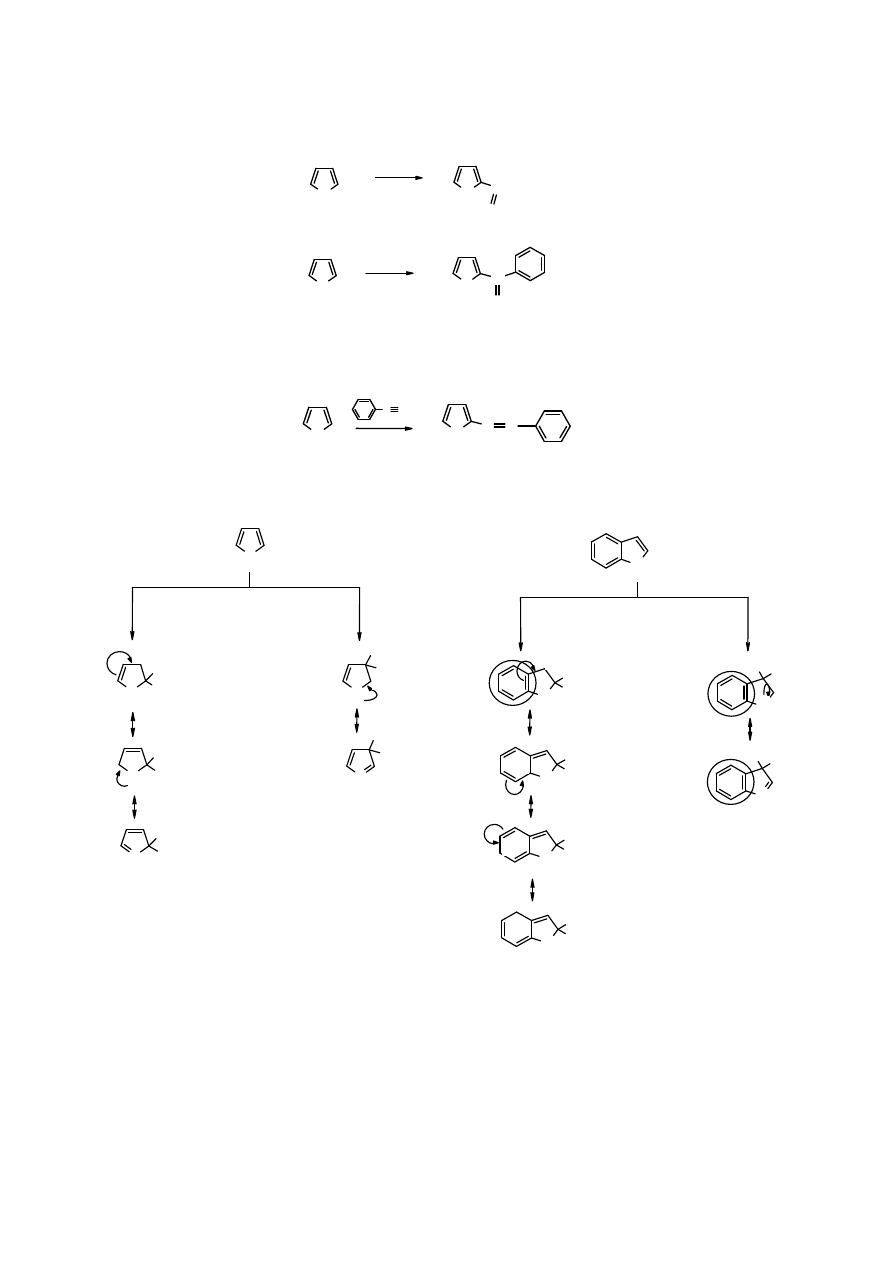
Analiza stanów granicznych adduktu po przyłączeniu elektrofila do pięcioczłonowego związku z
jednym heteroatomem wyjaśnia dlaczego do substytucji dochodzi w pozycji 2.
z
z
Y
H
z
Y
H
z
Y
H
z
Y
H
z
Y
H
N
N
Y
H
N
H Y
N
H Y
N
Y
H
N
Y
H
N
Y
H
Z: O; S lub NH
atak na
pozycję 2
atak na
pozycję 3
..
Y
+
+
+
+
+
+
..
..
..
atak na
pozycję 2
atak na
pozycję 3
Y
+
+
.. H
.. H
..
H
+
H
+
+
.. H
+
.. H
+
.. H
Dla adduktu w pozycji 3 można napisać tylko 2 wzory mezomeryczne, przy czym drugi jest
niekorzystny energetycznie, ponieważ ładunek dodatni jest zlokalizowany na heteroatomie, czyli
bardziej elektroujemnym atomie niż atom węgla.
W
indolu
, analogu
pirolu
sybstytucja S
E
dokonuje się w pozycji 3 pierścienia heterocyklicznego,
ponieważ addukt w tej pozycji zapewnia pełny sekstet eletronów
π
w pierścieniu benzenowym.
11
4. Barwnik pirolowe
4.1 Barwniki dipirylometenowe
Reakcja
metanalu
z
pirolem
(podobnie jak z
fenolem
) prowadzi do produktów kondensacji.
Kondensaty liniowe są wykorzystywane jako barwniki, tzw.
pirometany
(inaczej
barwniki
dipirylometenowe
); mają one zabarwienie żółte lub pomarańczowe. W środowisku zasadowym
z
pirolu
i jego pochodnych powstają alkohole 1
o
.
N
H
N
H
CH
2
OH
+ CHO
-
OH
pirol
2-hydroksy-
metylopirol
W środowisku kwaśnym powstały alkohol 1
o
reaguje z drugą cząsteczką
pirolu
lub jego
homologiem tworząc odpowiedni dipirylometan.
N
H
CH
2
OH
C
H
3
CH
3
N
H
CH
3
C
H
3
N
H
CH
2
C
H
3
CH
3
N
H
CH
3
H
+
+
CH3
2,5-dimetylopirol 2-hydroksy-3,5-dimetylopirol 2,5,2
’,5’-tetrametylopirylometan
Dipirylometany łatwo ulegają odwodornieniu do dipirylometenów. Siłą napędową tej reakcji
odwodornienia jest rozszerzenie układu sprzężenia.
N
H
CH
2
C
H
3
CH
3
N
H
CH
3
N
H
CH
C
H
3
CH
3
N
CH
3
[O]
CH
3
CH
3
2,5,2
’,5’-tetrametylopirylomet
an
2,5,2
’,5’-tetrametylopirylomet
en
Inny kolor końcówek nazw pokazuje różnice w budowie tych związków.
Dipirylometeny są silnymi zasadami; z kwasami dają łatwo krystalizujące sole. Kation tych soli
jest stabilizowany mezomerycznie.
N
H
CH
R
R
N
R
N
CH
R
R
N
H
R
N
H
CH
R
R
N
R
-
..
HBr
H
H
..
+
+
Br
dipirylometen
R
R
R
bromek dipirylometeniowy
4.2 Barwniki porfirynowe
Pirol
i jego pochodne tworzą makrocykliczne pierścienie składające się z czterech reszt
pirolowych. Noszą one nazwę
porfiryn
. Najprostszą
porfirynę
można otrzymać w wyniku
kondensacji
pirolo-2-karboaldehydu
.
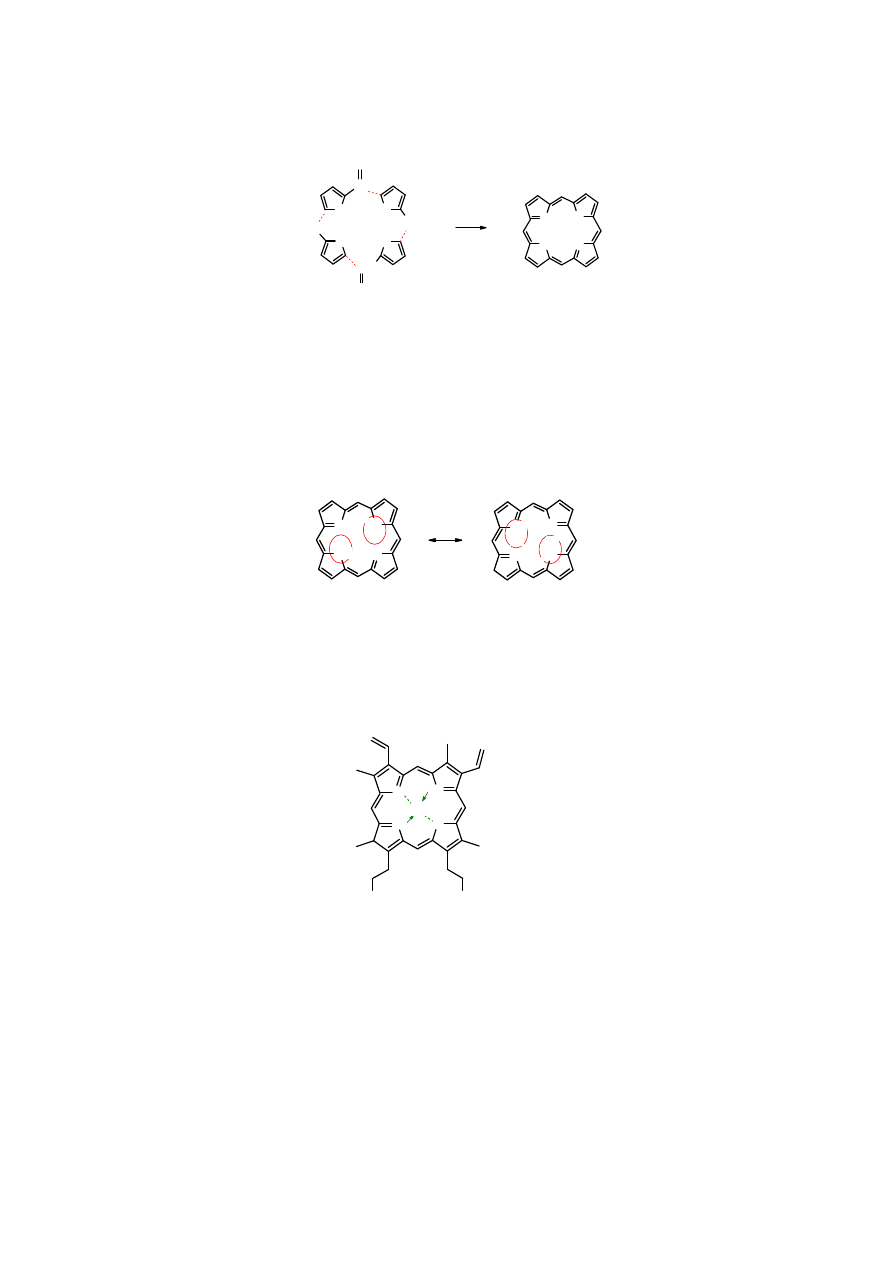
12
N
CH
N
H
CHO
N
CH
N
H
OHC
O
O
N
N
H
N
H
N
- 4 HOH
porfiryna
H
H
+
pirolo-2-
-karboaldehyd
:
:
:
:
Porfiryna jest związkiem krystalicznym, który nie topnieje lecz rozkłada się w temperaturze
360
o
C. Ma zabarwienie ciemnoczerwone. Jest cząsteczką płaską, w której 11 wiązań podwójnych
C=C lub C=N i 4 wolne pary elektronów atomu azotu tworzą nieprzerwaną sieć układu
sprzężonego, składającą się w sumie z 30 elektronów. Liczba ta spełnia regułę aromatyczności
Hückla (n = 7). Sprzężenie elektronów w
porfirynie
daje energię rezonansu równą 250 kcal.
Cztery pierścienie pirolowe są równocenne
, a atomy wodoru przy atomach azotu zajmują
miejsce nieokreślone. Można napisać szereg struktur mezomerycznych, przy czym dwie są
najważniejsze, wykazują bowiem równocenność pierścieni pirolowych i nieokreśloną pozycję
atomów wodoru.
N
N
H
N
H
N
N
N
N
N
:
:
:
:
:
:
:
:
H
H
Układ porfiryny znajduje się w wielu związkach biologicznie czynnych, takich jak hemoglobina
(w części zwanej hemem), chlorofil, witaminia B
12
i inne.
Hemoglobina
jest białkiem złożonym. W jej skład wchodzą cztery elementy zbudowane jedynie z
aminokwasów, zwane globulinami i
hem
, – pochodna
porfiryny
zawierająca dodatkowo
podstawniki i grupy funkcyjne oraz skoordynowany kation Fe
+2
.
N
N
N
N
COOH
COOH
:
Fe
:
hem
Cztery atomy azotu
hemu
są równocenne. Rola hemoglobiny polega na przenoszeniu tlenu z
płuc, gdzie jego stężenie jest wysokie do komórek, gdzie jego stężenie jest niższe. Tlen z
hemoglobiny
przekazywany jest do
mioglobiny
, która stanowi magazyn tlenu w komórkach i w
miarę potrzeby przekazuje go do reakcji utleniania.
Hemoglobina
odbiera z komórki CO
2
i w
płucach wymienia go na tlen. śelazo w trakcie tych procesów nie zmienia stopnia utlenienia; tlen
i CO
2
łączy się koordynacyjnie z atomem żelazem
hemu
.
Hemoglobina
zawierająca cząsteczkę
tlenu nazywa się
hemoglobiną utlenowaną
lub
oksyhemoglobiną
(
nie utlenioną
).
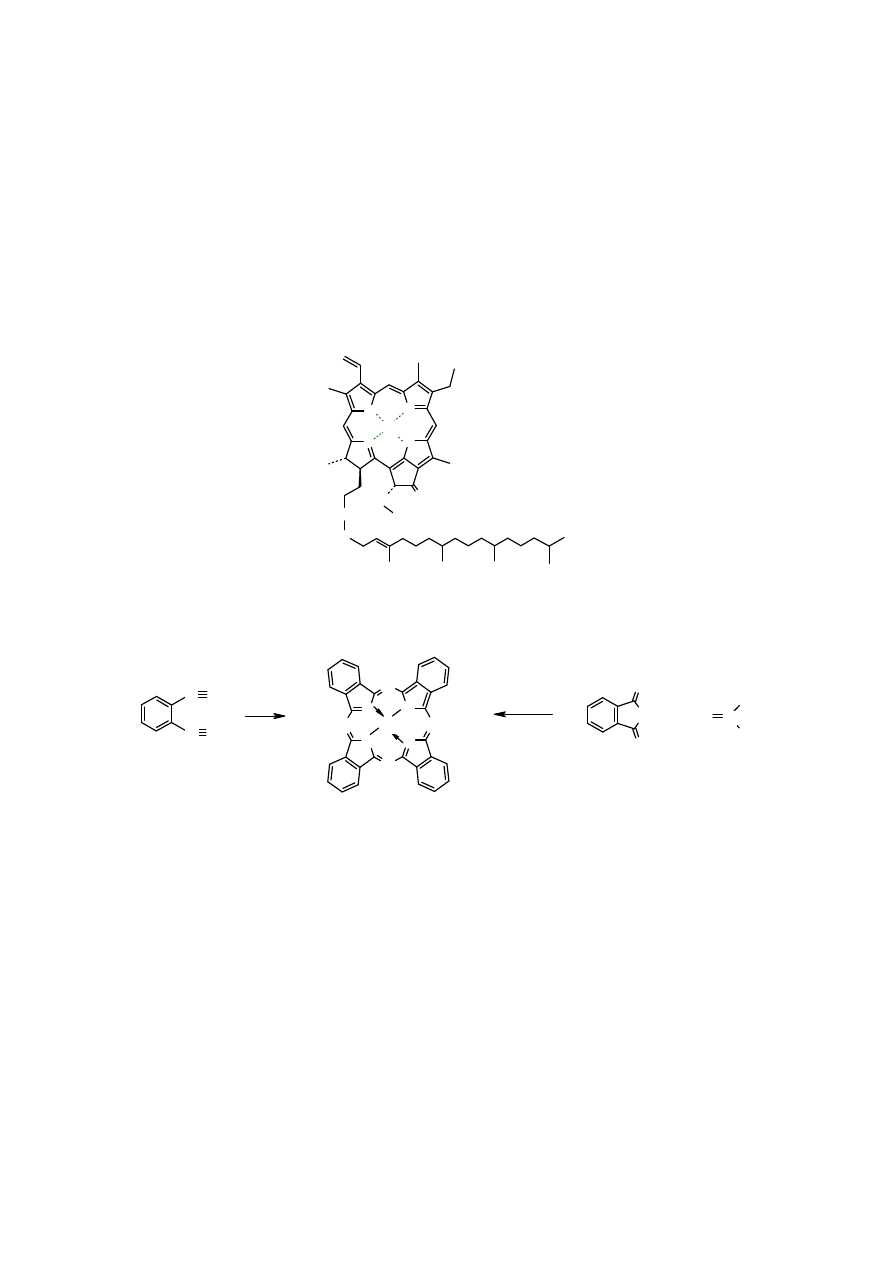
13
Hem
można wyizolować, tworzy on brunatne krystaliczne igły. Łatwo ulega utlenieniu. Po
utlenieniu jonu żelaza do Fe
+3
produkt nosi nazwę
met
hemoglobiny
lub
ferri
hemoglobiny
, w
odróżnieniu od
hemu
nazywanego również
ferro
hemiglobiną
.
Methemoglobina
jest nieczynna w
procesie przenoszenia tlenu.
Hem
w zależności od otaczających go białek może pełnić różne funkcje, oprócz przenoszenia
tlenu i ditlenku węgla (w
hemoglobinie
), magazynowaniu tlenu (w
mioglobinie
), jest także
przenośnikiem elektronów (w
cytrochromie c
), bierze też udział w rozkładzie nadtlenku wodoru
(w
katalazie
). W
chlorofilu
znajduje się
magnezoporfiryna
, która bierze udział w procesach
fotosyntezy
(jest fotoakceptorem).
O
N
N
N
N
C=O
O
O=C
Mg
chlorofil a
OCH
3
Syntetyczne analogi porfiryn znalazły zastosowanie jako barwniki. Należą do nich ftalocyjaniny.
Niebieski barwnik z tej grupy powstaje w reakcji ogrzewania
dinitrylu kwasy ftalowego
z solami
miedzi. Można je otrzymać także z
bezwodnika ftalowego
pod wpływem mocznika.
N
N
N
N
N
N
N
N
N
N
O
O
O
O
NH
2
NH
2
C
C
4
Cu
2
Cl
2
lub Cu
Cu
Cu
2
Cl
2
H
3
BO
3
+ 8
C
dinitryl kwasu ftalowego
ftalocyjanina
bezwodnik ftalowy
Ftalocyjaniny są stosowane jako pigmenty do wyrobu farb poligraficznych, olejnych, do
barwienia
kauczuku
i tworzyw syntetycznych.
Indygo
należy do naturalnych barwników. Było stosowane w starożytnym Egipcie i w dawnych
Indiach. Do Europy zaczęto je sprowadzać w XVI wieku. Wydobywało się je z roślin gatunku
Indigofera. Od XIX w.
indygo
stało się popularnym barwnikiem, ponieważ opracowano
syntetyczne metody jego otrzymywania. Służy między innymi do barwienia niebieskich dżinsów.
W stanie naturalnym występuje w postaci glukozydu, który jest enzymatycznie rozkładany do
indoksylu
.
Indoksyl
pod wpływem powietrza łatwo
utlenia się
do rodnika, po czym jego
następuje
dimeryzacja
i tworzy się bezbarwny
indoksyl
, a z niego w dalszym procesie
utleniania
powstaje barwne
indygo
.
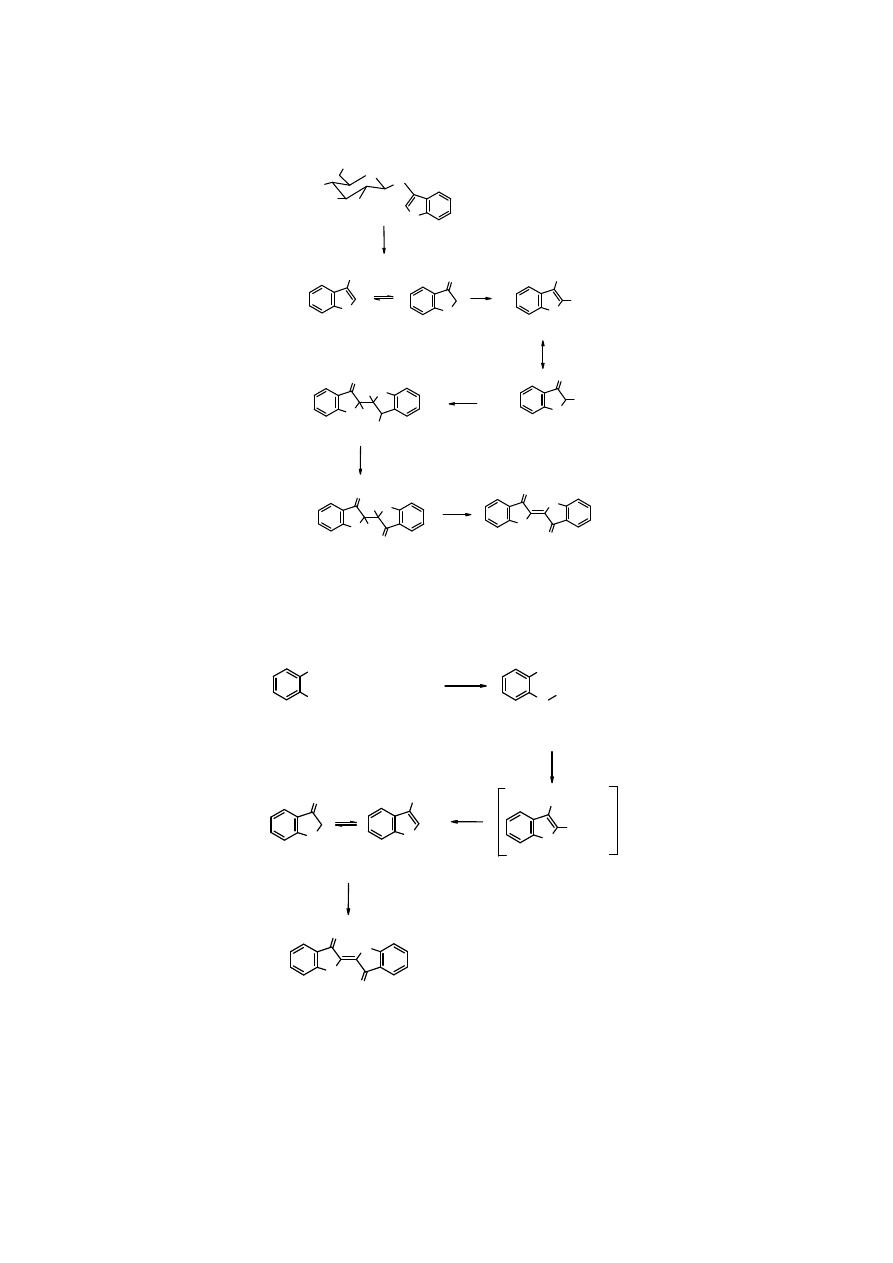
14
O
O
H
O
H
OH
O
N
H
N
H
OH
N
H
O
N
H
O
H
N
H
O
H
N
H
O
H
N
H
O
H
H
N
H
O
N
H
O
H
H
N
H
O
N
H
O
indykan
hydroliza
enzymatyczna
lub kwa
ś
na
O
2
.
.
rodnik
indoksyl
O
2
dimeryzacja
0,5 O
2
- HOH
odwodornienie
indygo
(glukozyd indoksylu)
OH
Rys. Przekształcanie surowca roślinnego zawierającego surowiec indygo w barwnik
Opracowano wiele metod syntezy
indygo
. W jednej z nich surowcem jest
kwas antranilowy
,
który w reakcji
N-alkilowania
solą
kwasu chlorooctowego
zostaje przekształcony w
o-
karboksyfenyloglicynę
.
Z niej z kolei po
cyklizacji
i
dekarboksylacji
tworzy się
indoksyl
, który
po utlenieniu przechodzi
indygo
.
N
H
OH
N
H
O
N
H
O
N
H
O
NH
2
COOH
N
COOH
CH
2
COOH
N
H
OH
COOK
O
2
indoksyl
indygo
+ ClCH
2
COOH
1.
Na
2
CO
3
KOH
260
o
C
H
2.
H
+
- CO
2
o-karboksy-N-fenyloglicyna
kwas antranilowy
(39%)
(55%)
Barwienie za pomocą
indygo
dokonuje się
technika kadziową
. Najpierw nierozpuszczalne w
wodzie
indygo
redukuje się za pomocą ditionianu sodu do rozpuszczalnej formy, która nosi
nazwę
leukoindygo
. Klarownym roztworem
leukoindygo
(
kadź
) nasącza się tkaniny, które
schnąc na powietrzu zabarwiaja się w wyniku utleniania
leukoindygo
do
indygo
.
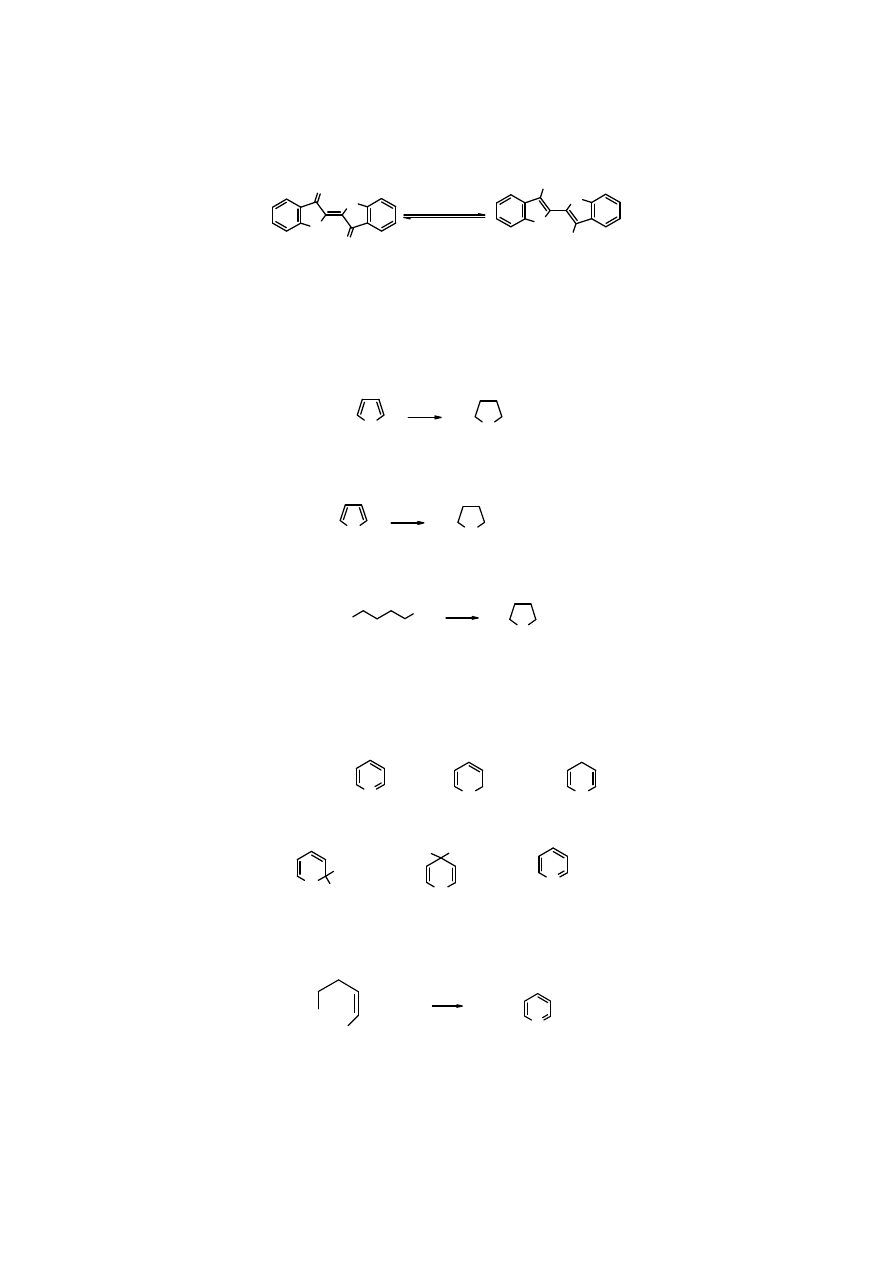
15
N
H
O
N
H
O
N
H
O
N
H
O
indygo
-
-
leukoindygo
Na
2
S
2
O
4
[H]
powietrze [O]
Zanik barwy w
leukoindygo
jest skutkiem zmiany układu sprzężonych wiązań podwójnych.
Nasycone, pięcioczłonowe związki heterocykliczne
Pirol
redukowany wodorem na Ni traci aromatyczność i przekształca się w cykliczną aminę
alifatyczną –
pirolidynę
. Widoczna jest ogromna różnica w zasadowości obu związków.
N
H
N
H
H
2
/Ni
pirol
pirolidyna
pK
a
~14 ~ 3
Podobnie z
furanu
powstaje
tetrahydrofuran
(THF), popularny rozpuszczalnik eterowy.
O
O
H
2
/Ni
furan
tetrahydrofuran
Tetrahydrotiofen
najłatwiej otrzymać w reakcji
1,4-dibromobutanu
z siarczkiem sodu.
Tetrahydrotiofen
ma typowe właściwości jak inne sulfidy.
Br
Br
S
Na
2
S
1,4-dibromo-
butan
tetrahydrotiofen
Sześcioczłonowe heterocykle aromatyczne
Głównym przedstawicielem tej grupy związków jest
pirydyna
. Jej analog tlenowy –
piran
– jest
nietrwały, nie ma właściwości aromatycznych – szybko polimeryzuje.
N
O
O
pirydyna
α
αα
α
-piran
γγγγ
-piran
..
..
..
..
..
Znane są dialkilowe pochodne piranów i
kation piryliowy
, który ma właściwości aromatyczne.
O
R
R
O
R
R
O
..
..
..
..
..
+
X
-
dialkilowe pochodne piranów kation piryliowy
Sole kationu pirylowego powstają w wyniku
odwodnienia
odpowiednich 1,5-dialdehydów lub
1,5-diketonów.
O
CHO
O
H
..
+
Cl
-
POCl
3
- 2 HOH
aldehyd glutakonowy chlorek piryliowy
(
penta-2,4-dien-1,5-dial
)
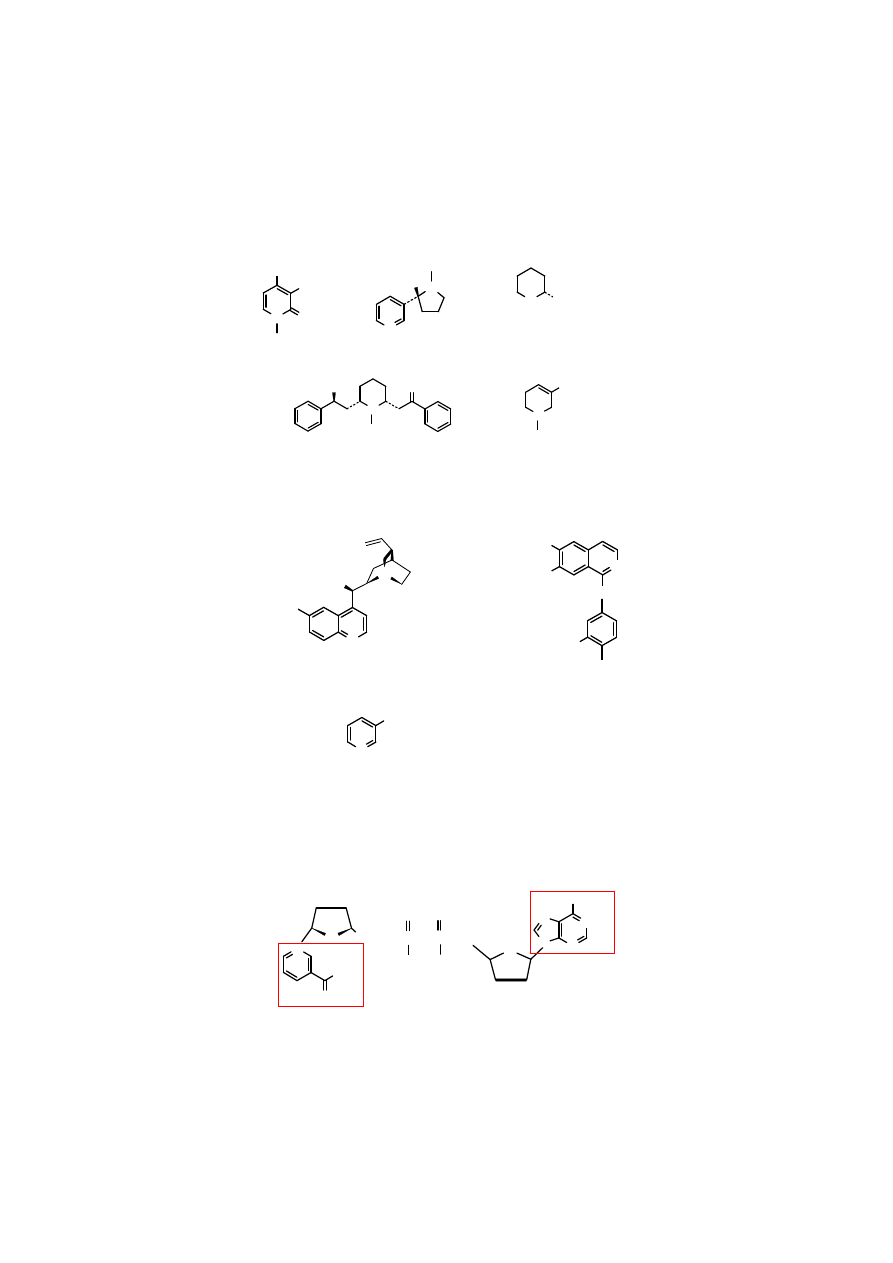
16
Występowanie
Pirydyna
znajduje się w smole pogazowej, natomiast wiele jej analogów i pochodnych występuje
w naturze. Pierścień pirydynowy wchodzi skład wielu alkaloidów, np.
rycyniny
(w nasionach
olejodajnej rośliny – rącznika) czy w
nikotynie
. Uwodorniony pierścień odnajdujemy w
koniinie
,
lobelinie
(w stroiczce rozdętej) czy w alkaloidach palmy areki (np.
arekaidyna
).
N
O
CH
3
CN
N
N
H
CH
3
N
H
CH
2
CH
2
CH
3
OCH
3
rycynina
(-)-(S)-nikotyna
(+)-(S)-koniina
N
OH
O
CH
3
N
COOH
CH
3
lobelina arekaidyna
Pierścień pirydynowy znajduje się w
chinolinie
i
izochinolinie
. Pochodnymi tych związków są
między innymi takie alkaloidy jak
chinina
i
papaweryna
.
N
N
O
H
CH
2
CH
3
O
N
CH
3
O
CH
3
O
CH
3
O
OCH
3
chinina
papaweryna
Kwas nikotynowy
i jego
amid
należą do grupy witaminy B.
N
COOH
kwas nikotynowy
Nazwa powyższego kwasu wywodzi się od jednego ze sposobu jego otrzymywania.
Kwas
nikotynowy
powstaje w reakcji utlenienia
nikotyny
.
Nikotynamid
wchodzi w skład dinukleotydu nikotynoamidoadeninowego (NAD
+
), koenzymu
ATP. NAD
+
jest ważnym biochemicznym utleniaczem. W trakcie utlenienia przekształca się w
zredukowany dinukleotyd nikotynoamidoadeninowy (NADH).
N
O
CH
2
-O-P-O-P-O-CH
2
NH
2
O
O
O
O
O
O
N
N
N
N
NH
2
+
-
-
nikotynamid
adenina
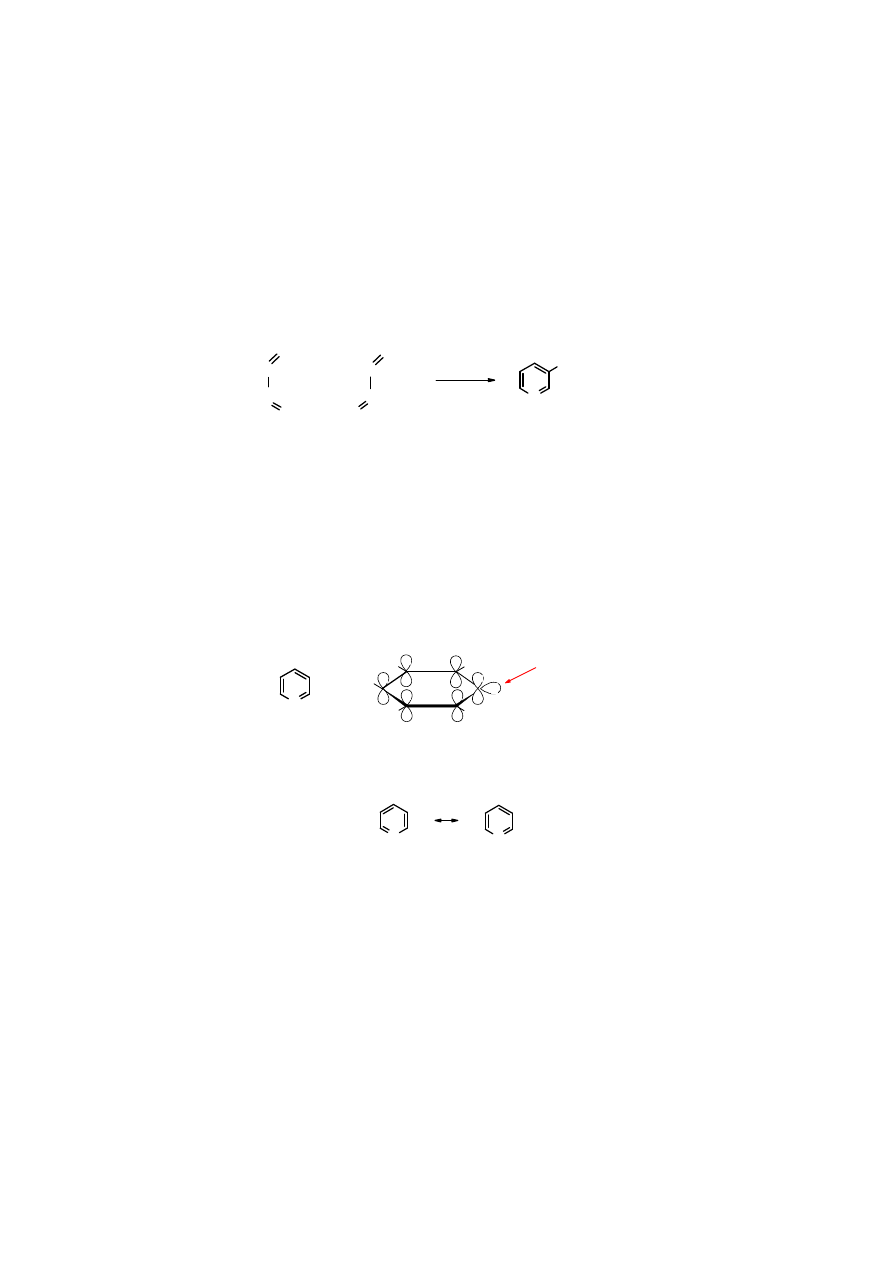
17
Otrzymywanie pirydyny
Głównym, a właściwie jedynym źródłem
pirydyny
jest smoła pogazowa, w której jej zawartość
dochodzi do 0,1%. Wyodrębnia się ją za pomocą destylacji. We frakcji zwanej olejem lekkim
pirydynie
towarzyszą jej homologi: trzy metylopirydyny, zwane pikolinami, dimetylopirydyny,
tzw. lutydyny i kolidyny, czyli trimetylopirydyny.
Zadanie: narysuj wzory i nazwij homologi pirydyny.
Nie ma prostej syntezy
pirydyny
.
3-Pikolina
powstaje w reakcji
akroleiny
z amoniakiem w
temperaturze 350
o
C w obecności katalizatorów.
CH
CH
CH
2
O
CH
CH
CH
2
O
N
CH
3
NH
3
+
350
o
C, kat.
- 2 HOH
3-pikolina
akroleina
Właściwości fizyczne pirydyny
Pirydyna jest cieczą wrzącą w temperaturze 115
o
C, topnieje przy -41
o
C. Miesza się całkowicie z
wodą. Ma nieprzyjemny zapach, trochę przypominający tytoń.
Właściwości chemiczne pirydyny
Pirydyna
ma właściwości związków aromatycznych. Pięć atomów węgla i atom azotu w
pierścieniu
pirydyny
mają hybrydyzację sp
2
. Aromatyczność
pirydyny
wynikają z planarnej
budowy cząsteczki i sprzężenia 6 elektronów
ππππ.
Wolna para elektronów atomu azotu znajduje się
na orbitalu sp
2
, a więc inaczej niż w
pirolu
i nie bierze udziału w sprzężeniu.
N
H
H
N
H
H
H
.
.
.
.
.
.
:
wolna para
na orbitalu sp
2
pirydyna
Kąty pomiędzy wiązaniami C-C i C-N wynoszą po 120
o
, wiązania tworzące pierścień są
jednakowej długości – 1,39 Å.
Pirydynę
można przedstawić za pomocą wzorów
mezomerycznych.
N
N
Reakcje substytucji elektrofilowej, S
E
Pirydyna
jest znacznie mniej aktywna w reakcjach
substytucji elektrofilowej
, nie tylko w
porównaniu z aromatycznymi heterocyklami pięcioczłonowymi, ale również w porównaniu z
benzenem
. Reakcje S
E
pirydyny
wymagają drastycznych warunków (wysokiej temperatury). W
reakcjach Friedel-Craftsa
pirydyna
jest nieaktywna.
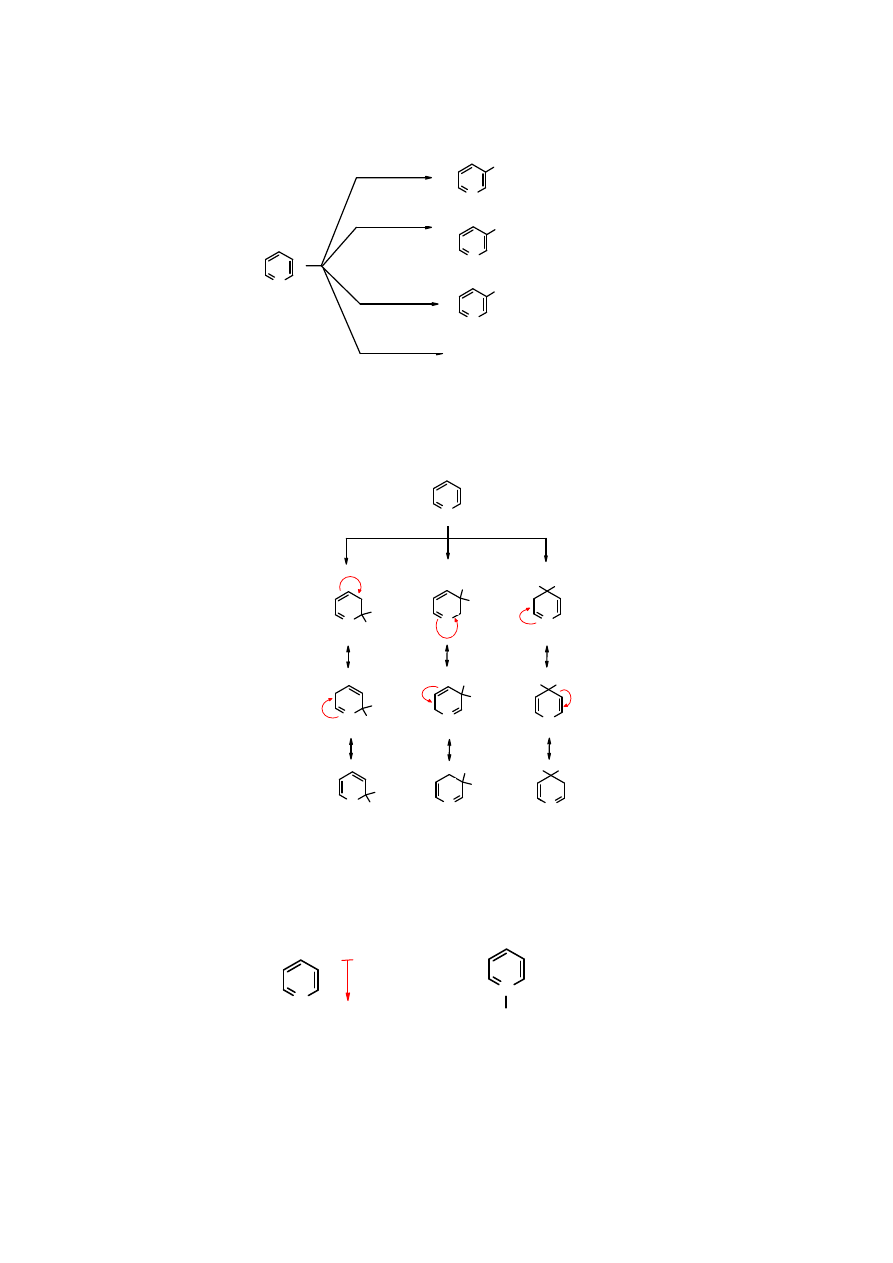
18
N
N
Br
N
SO
3
H
N
NO
2
Br
2
300
o
C
+ HBr
SO
3
, HgSO
4
H
2
SO
4
,220
o
C
HNO
3
NaNO
3
, 370
o
C
RX lub RCOX
AlCl
3
brak reakcji
+ HOH
3-bromopirydyna
30%
kwas
3-pirydynosulfonowy
70%
3-nitropirydyna
5%
pirydyna
Substytucja elektrofilowa
w
pirydynie
zachodzi w pozycji 3, ponieważ pozycja 2 jest
dezaktywowana. We wzorach mezomerycznych po ataku odczynnika elektrofilowego w pozycji
2 i 4 obserwuje się ładunek dodatni na atomie azotu, co jest niekorzystne, z uwagi na to, że atom
azotu jest bardziej elektroujemny od atomu węgla.
N
N
Y
H
N
Y
H
N
H
Y
N
Y
H
N
H
Y
N
Y
H
N
Y
H
N
Y
H
N
H
Y
Y
+
2
3
4
+
+
..
..
..
..
+
..
+
+
..
..
+
+
..
..
+
+
..
Obniżona reaktywność
pirydyny
spowodowana jest również wyciąganiem elektronów z
pierścienia i skupienie się ładunku ujemnego na atomie azotu, co dezaktywuje pierścień na atak
nukleofilowy. Stosunkowo do najmniejszej utraty elektronów dochodzi w położeniu 3 oraz 5 i w
tych miejscach następuje substytucja. Duża wartość momentu dipolowego, z ujemnym biegunem
na atomie azotu, świadczy o przesunięciu elektronów w stronę atomu azotu.
N
N
H
µµµµ
= 2,26D
δ
-
δ
+
δ
+
δ
+
δ
+
δ
+
..
+
pirydyna
protonowana
Ponadto reakcje S
E
biegną często w środowisku kwaśnym, co powoduje
protonowanie
atomu
azotu i utworzenie ładunku dodatniego, a więc jeszcze silniejsza dezaktywację.
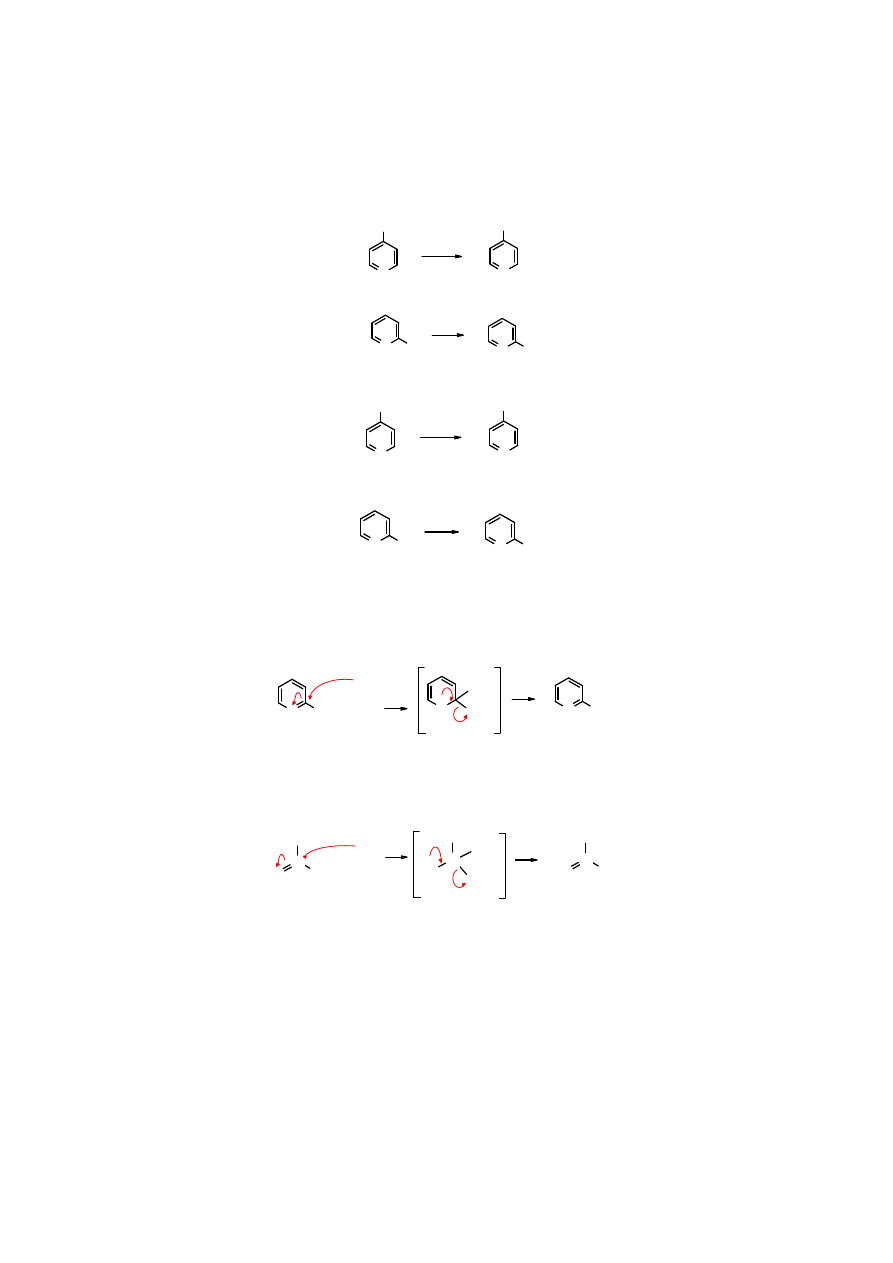
19
Reakcje substytucji nukleofilowej
Częściowy ładunek dodatni w cząsteczce
pirydyny
w położeniach 2, 4 i 6 czyni te miejsca
podatne na atak silnych nukleofili. Odpowiednie pochodne reagują z nukleofilami.
N
Cl
N
OC
2
H
5
Na
+
OEt
-
EtOH
4-chloropirydyna
4-etoksypirydyna
(75%)
N
Br
N
NH
2
NaNH
2
NH
3
2-bromopirydyna
2-aminopirydyna
(67%)
W podwyższonej temperaturze nawet sam amoniak jest zdolny wymieć atom halogenu.
N
Cl
N
NH
2
NH
3
180
o
C
4-chloropirydyna
4-aminopirydyna
N
Cl
N
NH
2
NH
3
2-chloropirydyna
2-aminopirydyna
180
o
C
Mechanizm reakcji
Powyższe reakcje biegną wg typowego mechanizmu
aromatycznej substytucji nukleofilowej
–
addycja-eliminacja. Obecność atomu azotu w pierścieniu
pirydyny
aktywuje położenie 2 na atak
nukleofilowy. Po
addycji
nukleofila następuje
eliminacja
halogenu.
N
Cl
N
Cl
NH
2
N
NH
2
+ NH
2
:
..
..
-
..
-
..
..
- Cl
-
2-chloropirydyna 2-aminopirydyna
Warto zwrócić uwagę na to, że powyższy mechanizm przypomina mechanizm reakcji substytucji
w grupie karbonylowej pochodnych kwasów karboksylowych, np.
amonolizę
chlorków
kwasowych do amidów.
R
Cl
O
R
Cl
O
NH
2
R
NH
2
O
C
+ NH
2
:
..
..
-
..
..
- Cl
-
C
:
:
-
C
..
:
chlorek kwasowy amid
Oczywiście chlorki kwasowe są znacznie aktywniejsze niż
2-chloropirydyna
i dla ich
amonolizy
wystarczy amoniak; nie trzeba tak silnych nukleofili jak amidki.
Substytucji nukleofilowej
nie ulegają pochodne
pirydyny
zawierające grupę odchodząca w
położeniu 3.
Reakcja Cziczibabina
Pod wpływem silnych nukleofili dochodzi do podstawienia atomu wodoru w samej
pirydynie
.
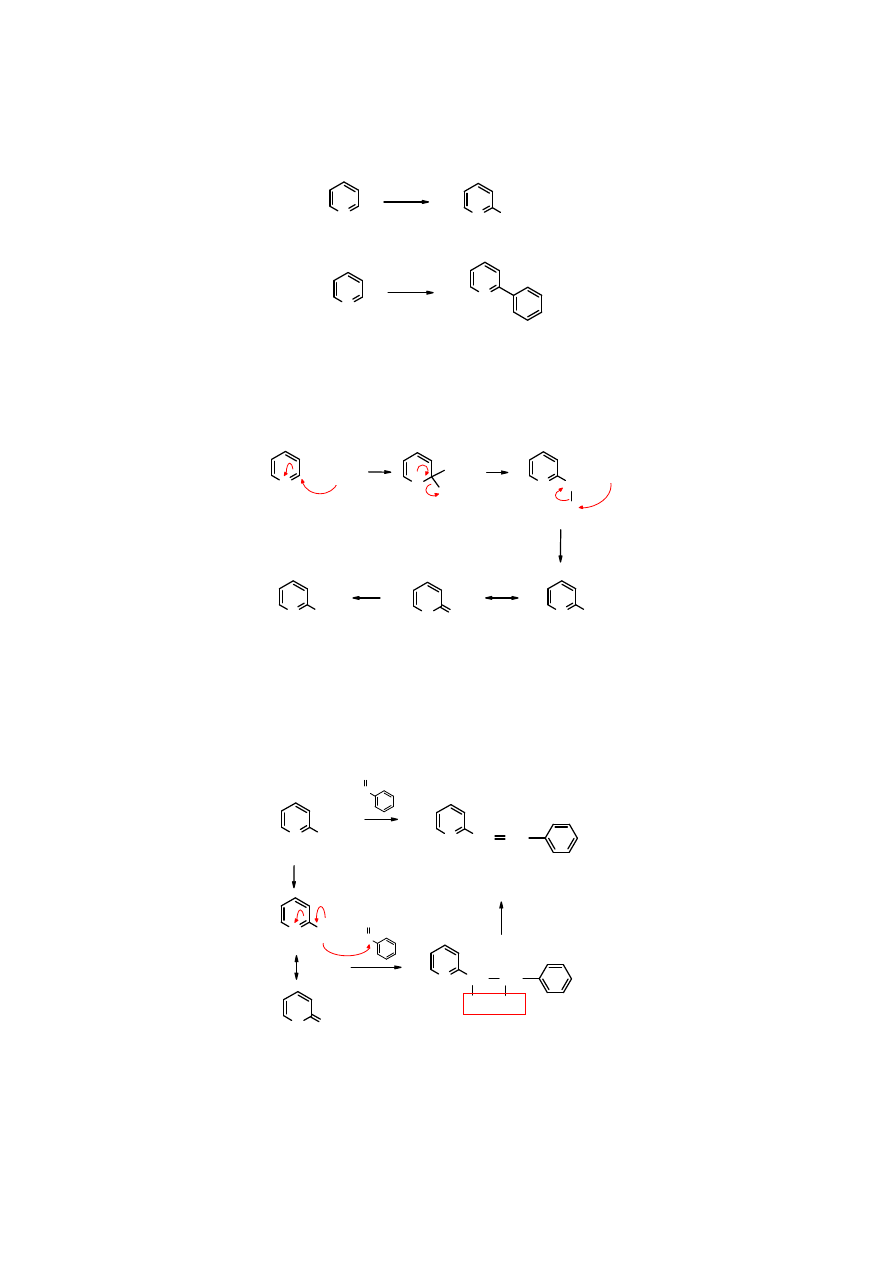
20
N
N
NH
2
..
1.
NaNH
2
2.
HOH
+ H
2
N
N
..
1.
PhLi
100
o
C
pirydyna
2-fenylopirydyna
Mechanizm reakcji
Reakcja polega na
addycji
nukleofila w pozycji 2
pirydyny
, odszczepienie jonu wodorkowego,
utworzenie cząsteczki H
2
z protonem oderwanym z grupy aminowej i przekształcenie adduktu w
stabilizowany mezomerycznie anion aminopirydyniowy. Pod wpływem wody z anionu powstaje
2-aminopirydyna
.
N
N
NH
2
H
N
NH
H
N
NH
N
NH
N
NH
2
..
- H
2
..
+ NH
2
: ..
-
..
..
..
..
+ H
-
:
..
..
..
-
..
..
..
-
-
..
pirydyna
HOH
2-aminopirydyna
Reakcja 2-pikoliny z aldehydami
Atomy
α
-wodoru w alkilopirydynach mają właściwości kwasowe i pod wpływem zasad ulegają
odszczepieniu. Powstały w ten sposób karboanion reaguje ze związkami karbonylowymi jako
donor elektronów. Produkty addycji – hydroksypochodne – łatwo tracą cząsteczkę wody tworząc
nowe wiązanie C=C, sprzężone z aromatycznymi elektronami
ππππ
.
N
CH
3
HC
O
N
CH CH
N
CH
2
N
CH
2
HC
O
N
CH CH
H
OH
NaOH
..
..
..
-
OH
..
-
..
..
-
..
- HOH
2-pikolina
1-fenylo-2-(2-pirydylo)eten
1-fenylo-1-hydroksy-2(2-pirydylo)etan
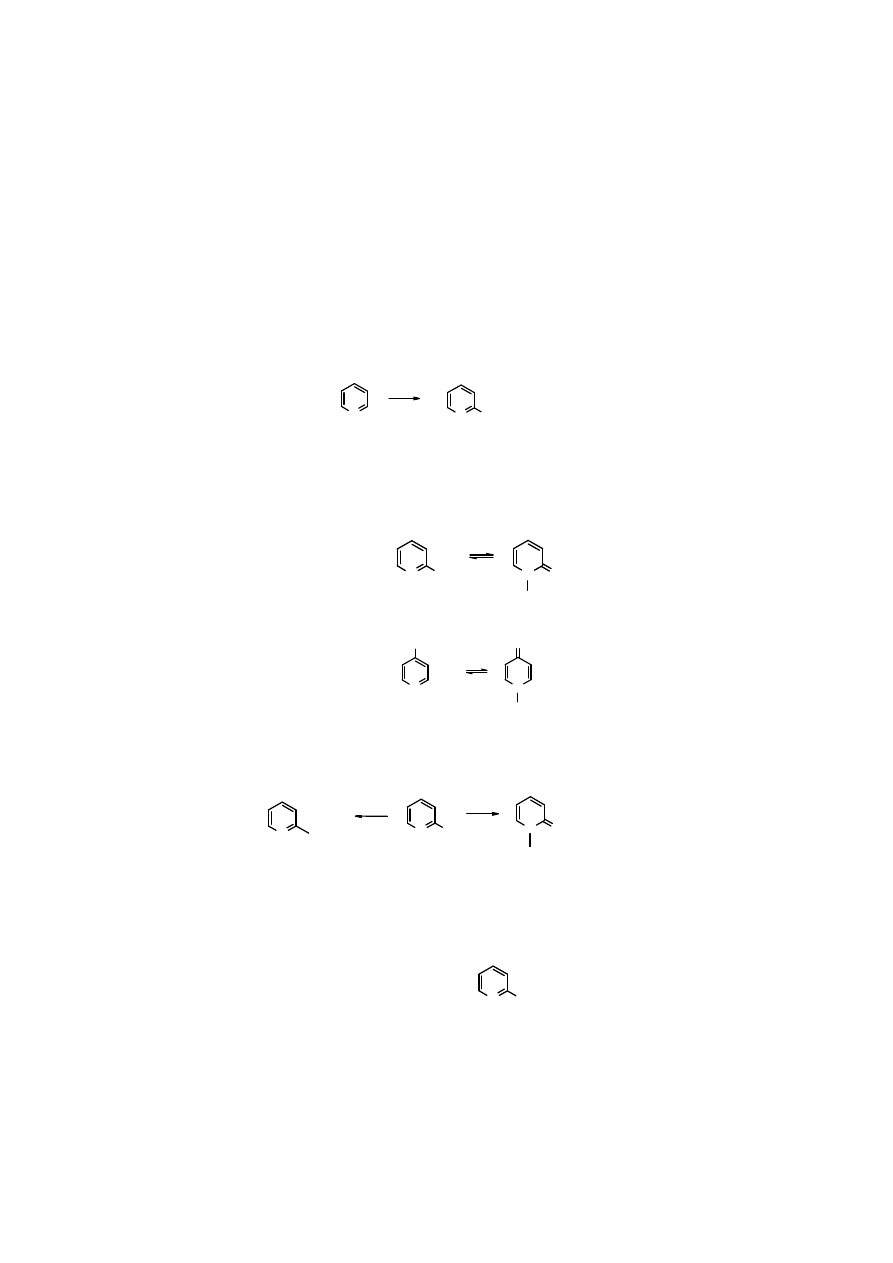
21
Hydroksypirydyny
Znane są trzy hydroksypirydyny –
2-hydroksypirydyna
,
3-hydroksypirydyna
i
4-
hydroksypirydyna
. Izomery 2- i 3- można otrzymać podobnie jak
fenol
poprzez
diazowanie
aminopirydyn i
reakcję
zagotowania
lub w wyniku
stapiania
kwasów pirydynosulfonowych z
wodorotlenkiem sodu.
Zadanie: napisz schematy reakcji otrzymywania hydroksypirydyn za pomocą
reakcji zagotowania
i
reakcji
stapiania
.
Hydroksypirydyny powstają również w wyniku bezpośredniego
hydroksylowania
pirydyny
wodorotlenkiem sodu w podwyższonej temperaturze. Jest to reakcja zbliżona do reakcji
Cziczibabina.
N
N
OH
NaOH
..
pirydyna
..
∆
2-hydroksypirydyna
Synteza izomeru 3 jest bardziej skomplikowana.
Wszystkie hydroksypirydyny mają właściwości zbliżone do
fenolu
. Łatwiej ulegają reakcjom
substytucji elektrofilowej niż sama
pirydyna
.
2-
i
4-Hydroksypirydyny
są w równowadze
tautomerycznej z odpowiednimi pirydonami.
N
O
N
OH
H
piryd-2-on
..
2-hydroksypirydyna
(pirydyn-2-ol)
N
O
N
OH
H
(pirydyn-4-ol)
piryd-4-on
..
4-hydroksypirydyna
Z
hydroksypirydyny
można otrzymać pochodne obu tautomerów.
Diazometan
przekształca
2-
hydroksypirydynę
w
2-metoksypirydynę
, a alkilowanie
jodkiem metylu
prowadzi do
N-
metylopiryd-2-onu
.
N
OH
N
N
O
CH
2
N
2
OCH
3
OCH
3
2-metoksypirydyna
2-hydroksypirydyna
N-metylo-
piryd-2-on
CH
3
I
Znane są również tiolowe pochodne
pirydyny
. One również są w stanie równowagi z formą
tautomeryczną.
Zadanie: narysuj wzór tiolowej pochodnej
pirydyny
i przedstaw przemianę tautomeryczną.
N
SH
..
2-merkaptopirydyna
(pirydyno-2-tiol)
Utlenianie pirydyny i jej pochodnych
Pirydyna
jest odporna na działanie wielu utleniaczy. Podobnie jak w arenach homocyklicznych
łatwo daje się utlenić jej łańcuch boczny.
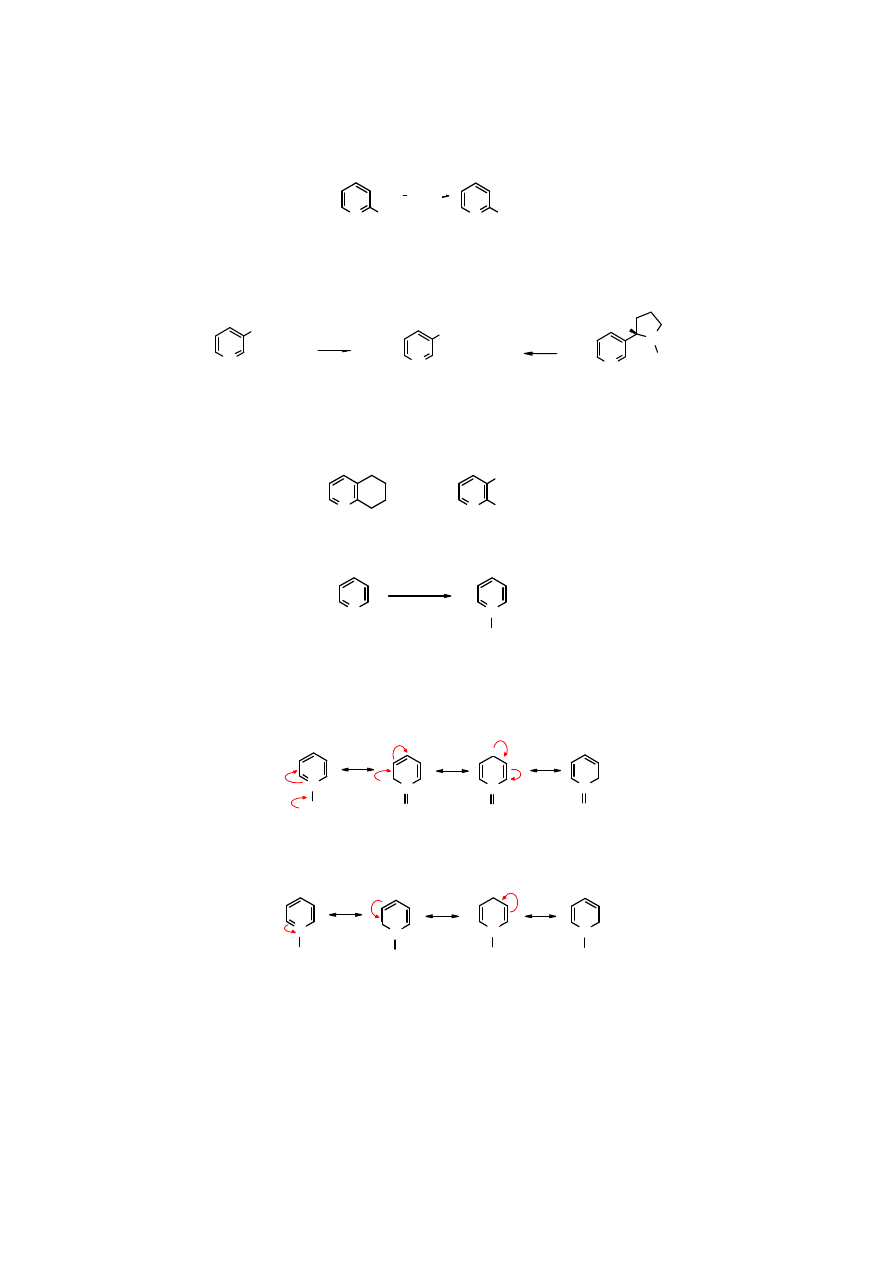
22
N
CH
3
N
COOH
KMnO
4
1-pikolona
kwas 1-pikolinowy
Kwas 3-pikolinowy
znany pod nazwą
kwasu nikotynowego
, ponieważ powstaje w wyniku
utlenienia nie tylko
3-pikoliny
, ale i z
nikotyny
, z której zresztą został otrzymany po raz
pierwszy.
N
CH
3
N
COOH
N
N
CH
3
H
KMnO
4
KMnO
4
4-pikolina kwas nikotynowy
(
kwas 3-pikolinowy
)
nikotyna
Pirydyna
jest bardziej odporna na utlenienie niż
benzen
, dlatego z chinoliny pod wpływem
działania nadmanganianu potasu powstaje
kwas chinolinowy
, w którym zostaje zachowany
pierścień heterocykliczny.
N
N
COOH
COOH
KMnO
4
chinolina
kwas
chinolinowy
Pirydyna
w obecności nadkwasów ulega utlenieniu i zostaje przekształcona w
1-tlenek pirydyny
(
N-tlenek pirydyny
).
N
N
O
CH
3
COOOH
-
+
- CH
3
COOH
pirydyna
1-tlenek pirydyny
1-Tlenek pirydyny
zachowuje właściwości aromatyczne, z tym że rozkład ładunków w
pierścieniu jest inny niż w
pirydynie
. Z poniżej przedstawionych wzorów mezomerycznych
wynika, że reakcje
substytucji elektrofilowej
1-tlenku pirydyny
powinny zachodzić w
pozycjach 2 i 4 (inaczej niż w
pirydynie
).
N
O
N
O
N
O
N
O
-
+
-
+
:
:
..
..
-
+
..
: :
:
:
-
+
..
: :
1-tlenek pirydyny
Z innych wzorów mezomerycznych wynika, że
1-tlenek pirydyny
powinien być aktywniejszy niż
pirydyny
w reakcjach
substytucji nukleofilowej
.
N
O
N
O
N
O
N
O
-
+
-
+
:
:
..
..
:
:
..
+
..
:
:
..
+
..
:
:
..
-
-
1-tlenek pirydyny
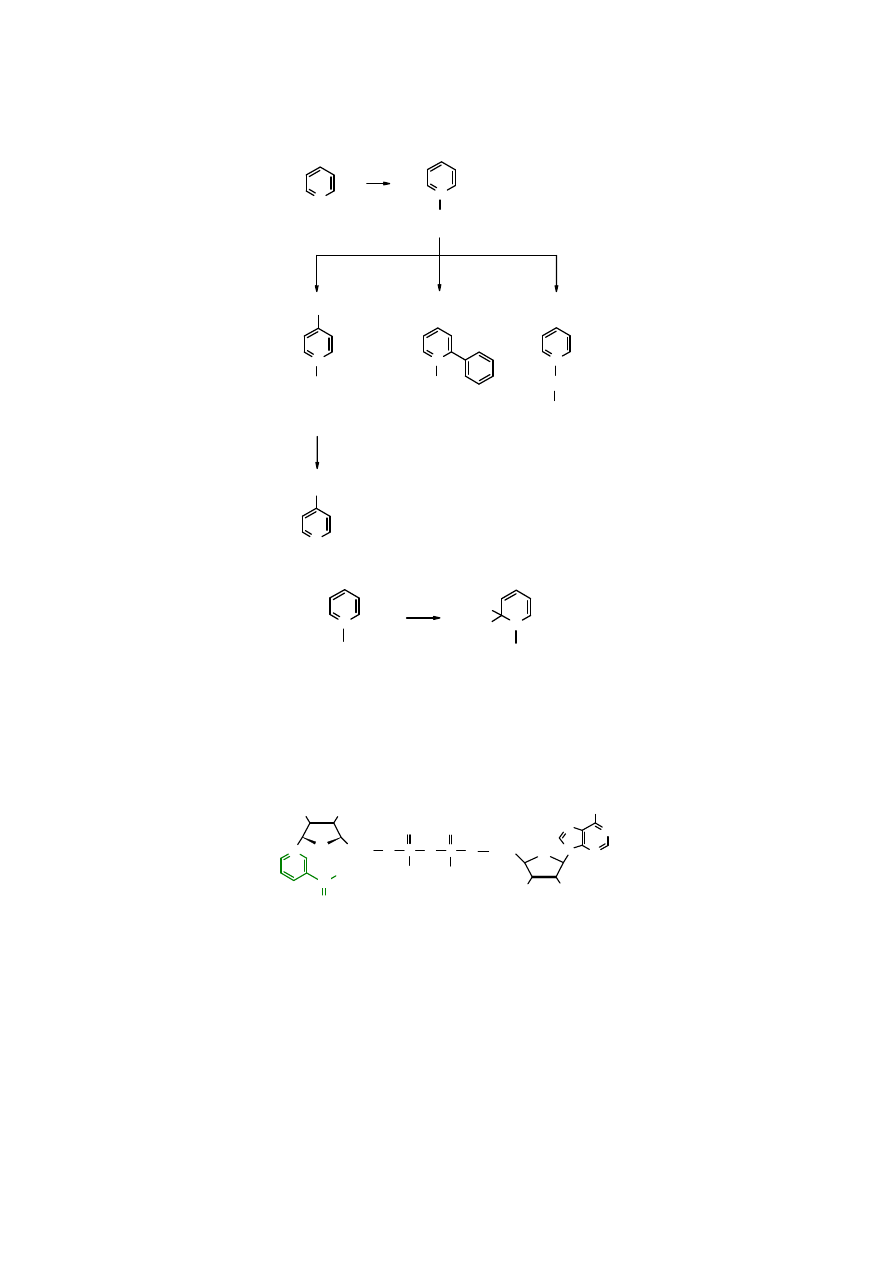
Poprzez utlenienie
pirydyny
do jej N-tlenku można zsyntezować wiele pochodnych
niemożliwych do otrzymania bezpośrednio z
pirydyny
. Powrót z
tlenku pirydyny
(lub tlenku jej
pochodnych) do
pirydyny
(jej pochodnych) dokonuje się w reakcji z PCl
3
.
23
N
N
O
N
NO
2
O
O
N
O
CH
3
N
N
NO
2
: :
..
+
-
[O]
HNO
3
/
H
2
SO
4
100
o
C
PhMgBr
CH
3
I
: :
..
+
-
: :
..
+
-
: :
+
-
I
PCl
3
1-tlenek
4-nitropirydyny
pirydyna
1-tlenek pirydyny
1-tlenek
2-fenylopirydyny
jodek
1-metoksy-
pirydyniowy
4-nitropirydyna
Sole pirydyniowe stosunkowo łatwo
redukują
się do pochodnych 1,2-dihydropirydyny.
N
R
N
R
H
H
+
X
-
NaBH
4
- HX
..
N-alkilo-1,2-di-
hydropirydyna
kation
N-alkilo-
pirydyniowy
Reakcje
utleniania
kationu N-alkilopirydyniowego do
N-alkilo-1,2-dihydropirydyny
i odwrotnej
redukcji
są wykorzystywane w procesach biochemicznych. Bierze w nich udział koenzym
zwany
dinukleotydem nikotynoamidoadeninowym
(NAD
+
) i jego zredukowana forma –
zredukowany dinukleotyd nikotynoamidoadeninowy
(NADH). NAD
+
utlenia alkohole do
aldehydów lub ketonów, a także uczestniczy w „spalaniu” (w metabolizmie) kwasów
tłuszczowych.
N
O
OH
O
H
CH
2
O P O P O
O
O
H
OH
CH
2
N
N
N
N
NH
2
O
NH
2
O
O
O
O
C
+
-
-
nikotynoamid
dinukleotyd nikotynoamidoedeniny (NAD
+
)
adenina
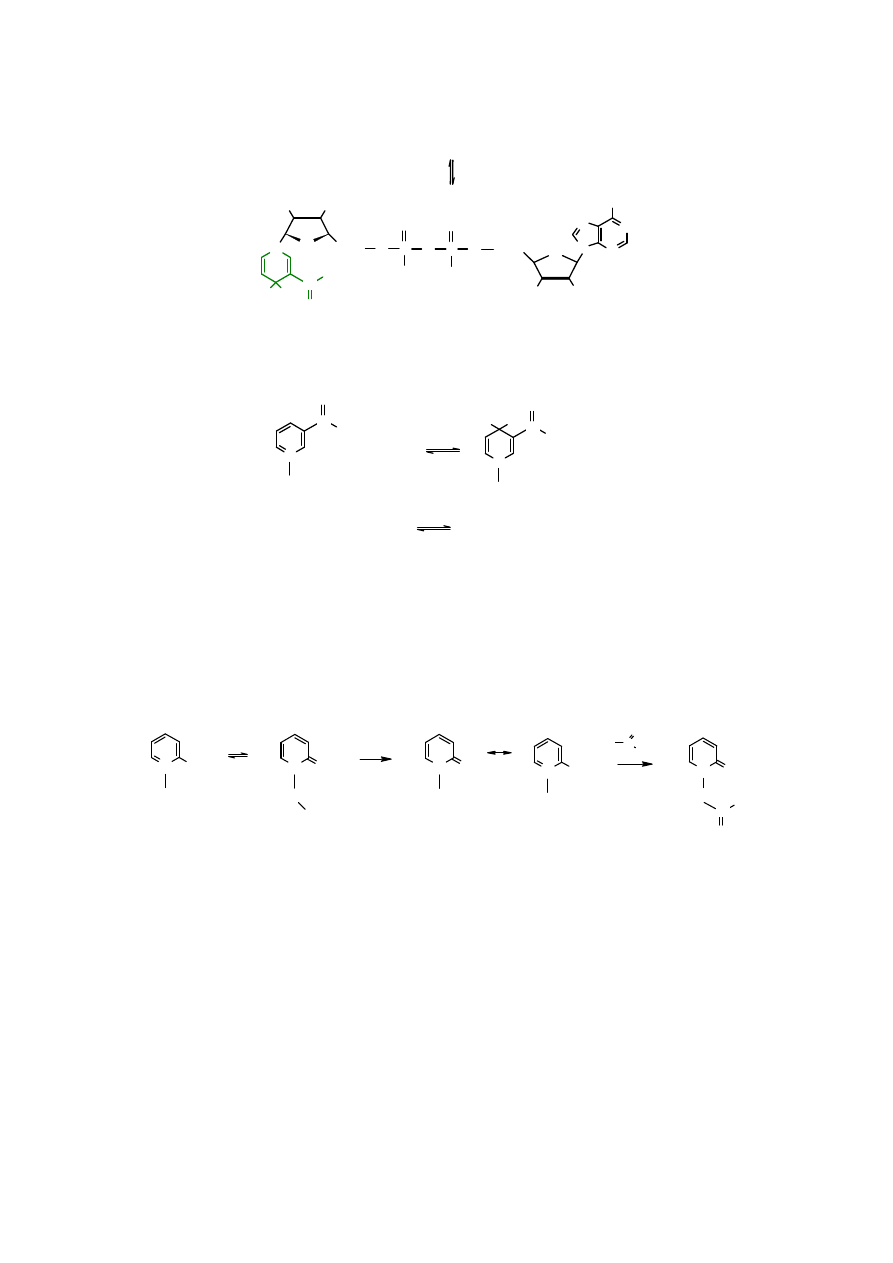
24
N
O
OH
O
H
CH
2
H H
O P O P O
O
O
H
OH
CH
2
N
N
N
N
NH
2
O
NH
2
O
O
O
O
[H]
[O]
C
-
-
dihydronikotynoamid
zredukowany dinukleotyd nikotynoamidoedeniny (NADH)
H
+
+
Zmiany zachodzą na reszcie
amidu kwasu nikotynowego
.
N
R
O
NH
2
N
H
H
R
O
NH
2
..
+
C
+ 2 H
+
C
+ H
NAD
+
+ 2 H
NADH + H
+
Dinukleotyd nikotynoamidoadeninowy
(NAD
+
) jest głównym akceptorem elektronów
(utleniaczem) w procesach utleniania substratów oddechowych.
Na podobnej zasadzie co NAD
+
działa regent nazwany
estrem Bartona
.
Sir Derek H. R. Barton (ur. w 1918 r. w Gravelsend, Anglia); doktorat i habilitacja w Londynie; prof. w Birkbeck
College, Harvard, Glasgow, Imperial College, Institut de Chimie des Substances Naturelles, Texas A&M,; Nagroda
Nobla (1969).
Estrem Bartona nazywany jest
O-acetylo 1-tlenek 2-pirydynotiolu
.
N
SH
O
N
S
O
H
N
S
O
N
S
O
O
Cl
N
S
O
O
R
+
-
: :
..
-
: :
..
..
..
..
:
NaH
+
-
: :
..
..
..
:
: :
..:
..
-
R
C
: :
..:
C
ester Bartona
1-tlenek
pirydyno-2-tiolu
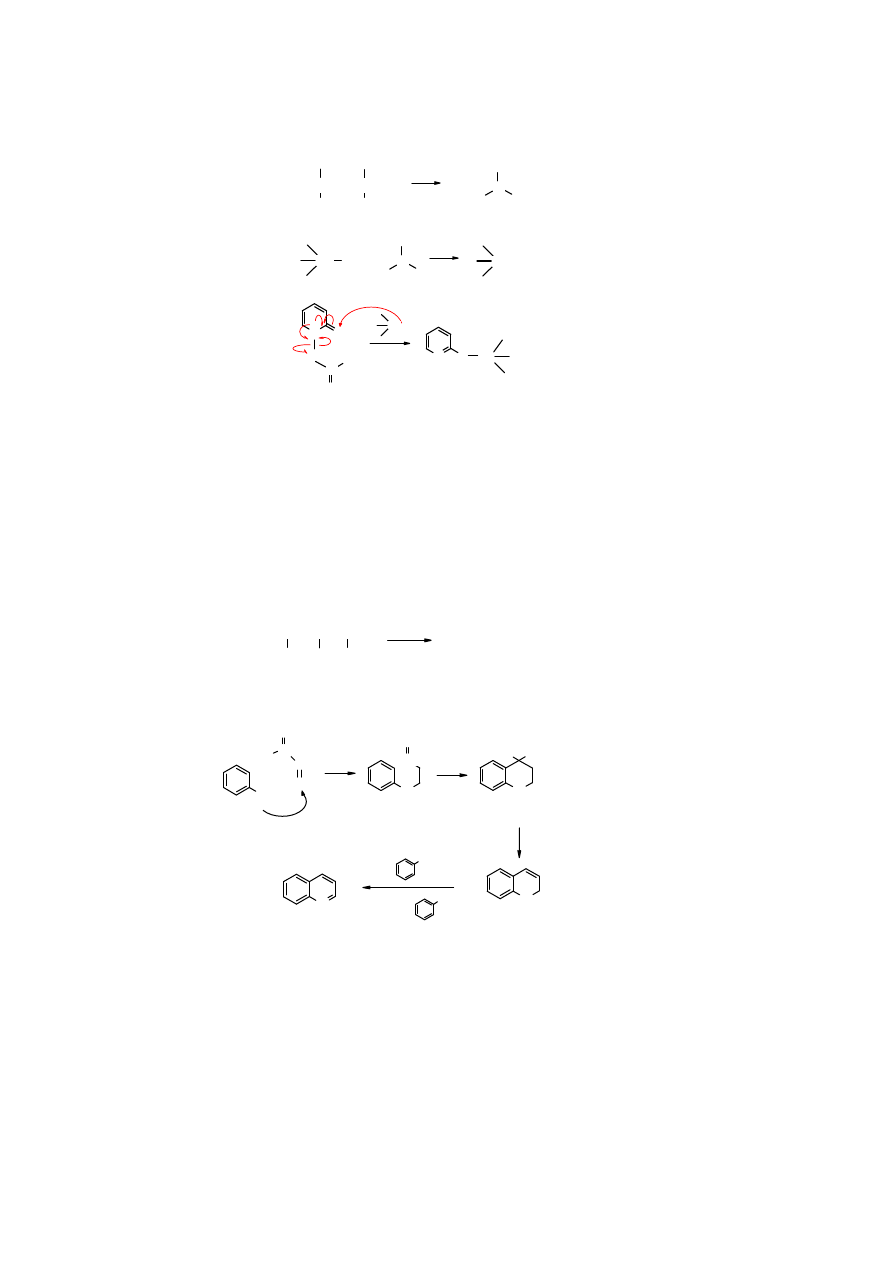
Ester Bartona służy między innymi do otrzymywania pochodnych cynoorganicznych.
Trialkilocyna pod wpływem czynników rodnikotwórczych zostaje przekształcona w rodnik,
który z kolei ulega addycji do estru Bartona. Stabilizacja adduktu następuje poprzez eliminację
rodnika acyliowego i jego rozkład na CO
2
i rodnik alkilowy.
25
N
S
O
O
R
CN
CN
CH
3
CH
3
CN
C
H
3
CH
3
H
CN
C
H
3
CH
3
N
S Sn
..
..
:
:
..:
C
CH
3
-C-N=N-C-CH
3
80
o
C
2
C
+ N
2
.
Sn
+
C.
Sn. + (CH
3
)
2
CHCN
Sn.
..
..
..
+ CO
2
+
.
R
Chinolina
Chinolina
jest syropowatą, trudno rozpuszczalną w wodzie cieczą, wrząca w temperaturze 238
o
C,
ma żółtawe zabarwienie. Pod wpływem światła i powietrza brunatnieje. Z silnymi kwasami
tworzy sole; jest słabszą zasadą niż
anilina
.
Chinolinę
otrzymuje się za pomocą syntezy Skraupa. Powstaje ona w reakcji Michaela
aniliny
z
akroleiną
.
Akroleina
tworzy się in situ z
glicerolu
pod wpływem kwasu siarkowego i
podwyższonej temperatury. Produkt addycji
akroleiny
do
aniliny
ulega
cyklizacji
, a potem
dehydratacji
do
1,2-dihydrochinoliny
, którą
nitrobenzen
utlenia (reakcja
odwodornienia
) do
chinoliny
. Mogą być stosowane inne utleniacze, np. kwas azotowy.
OH OH OH
CH
2
-CH-CH
2
H
2
SO
4
∆
CH
2
=CH-CHO + 2 HOH
glicerol akroleina
NH
2
CH
CH
2
O
H
N
H
O
N
H
O
H
H
N
H
NO
2
NH
2
N
+
C
H
+
∆
CH
..
∆
∆
- HOH
anilina
akrolein
4-hydroksy-1,2,3,4-
tetrahydrochinolina
-
- HOH,
chinolina
(88%)
1,2-dihydrochinolina
Zadanie: napisz stechiometrycznie równanie przekształcenia 1,2-dihydrochinoliny w chinolinę.
Substytucja elektrofilowa chinoliny
Pierścień benzenowy jest bardziej podatny na reakcje S
E
niż pirydynowy, dlatego też do
podstawienia atomów wodoru elektrofilami w
chinolinie
dochodzi w części homocyklicznej.
Chinolina
w reakcjach S
E
jest mniej aktywna niż
benzen
.
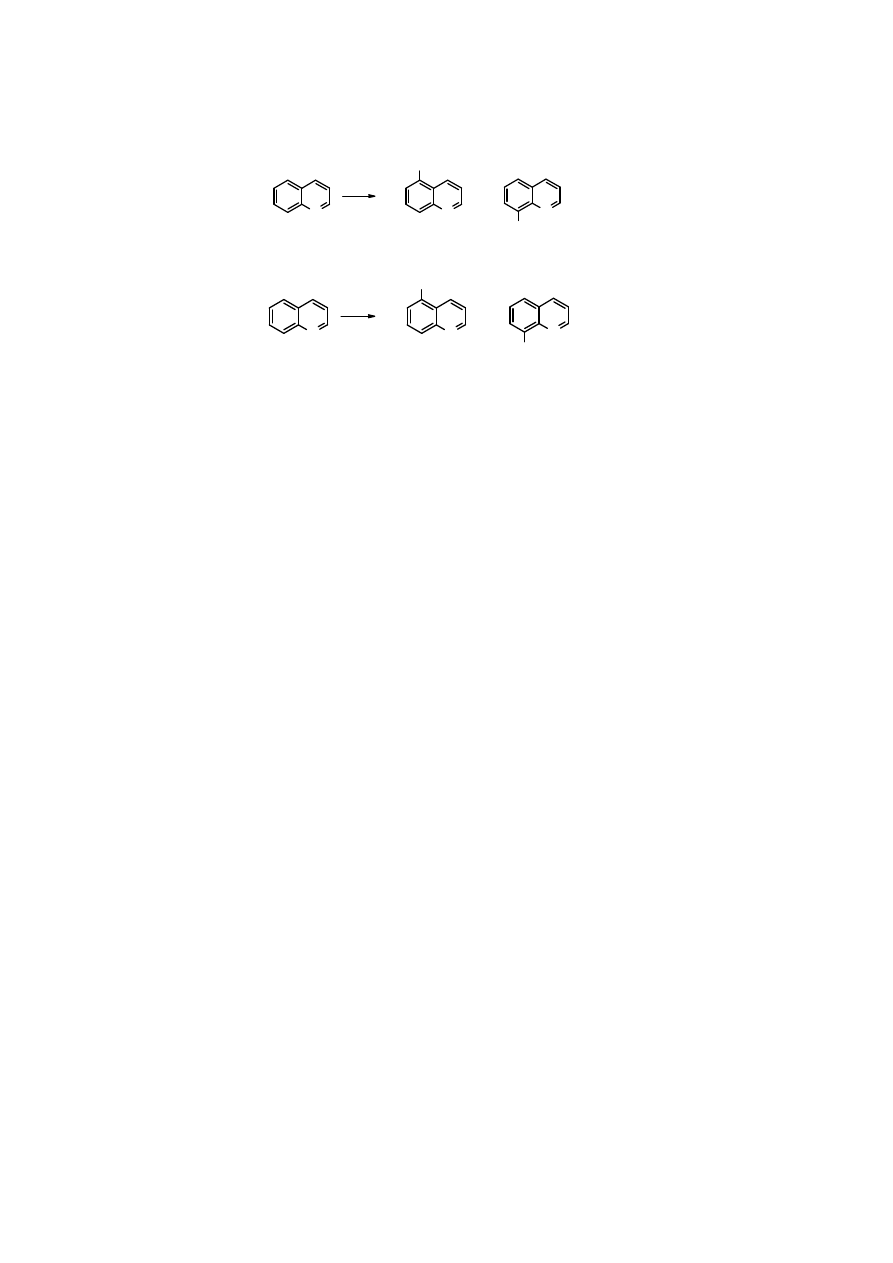
26
N
N
Br
N
Br
chinolina
Br
2
H
2
SO
4
+
5-bromochinolina
8-bromo-
chinolina
Oba izomery bromochinoliny powstają prawie w jednakowych ilościach.
N
N
NO
2
N
NO
2
chinolina
HNO
3
H
2
SO
4
+
5-nitrochinolina
8-nitro-
chinolina
10 : 1
5-Nitrochinolina
powstaje ze znacznie większą wydajnością niż izomer 8.
Wyszukiwarka
Podobne podstrony:
26 Heterocykliczne zwiazki aromatyczne
22 Heterocykliczne związki aromatyczne
Inhibitory aromatazy w leczeniu uzupełniającym raka piersi
ZWIAZKI AROMATYCZNE
wyk 4 węglow aromat
Aromaterapia Brown
Homo i heteroglikany 2012 2013
ANOMALIE HETEROCHROMOSOMÓW
Aromatyczne tagliatelle z parmezanem
Rodzaje zabiegów aromaterapeutycznych, Kosmetologia
Pytania z AROMATU-barwniki, 2 rok, OGÓLNA TECHNOLOGIA ŻYWNOŚCI, cw, pytania
ściągi aromaterapia, AROMATERAPIA(1)
aromaterapia
Związki heterocykliczne, Chemia
Olejki i hydrolaty, Aromaterapia
więcej podobnych podstron