
DIAGNOSTYKA
WETERYNARIA W PRAKTYCE
77
www.weterynaria.elamed.pl
STYCZEŃLUTY • 12/2013
Badanie cytologiczne
Badanie cytologiczne jest bardzo po-
mocne w diagnozowaniu wielu cho-
rób u zwierząt, szczególnie nowotworo-
wych i przebiegających z zapaleniem.
Na podstawie oceny morfologicznej
pobranych komórek można stwierdzić
istotę procesu chorobowego. Ma to bar-
dzo istotne znaczenie w określaniu zło-
śliwości komórek nowotworowych, ich
klasyfi kacji do nowotworów wywodzą-
cych się z nabłonka (np. raki), z tkanki
mezenchymalnej (np. mięsaki, włóknia-
ki) oraz do nowotworów o różnym po-
chodzeniu, zbudowanych z komórek
okrągłych (np. chłoniaki, mastocytoma
czy histiocytoma). Stosunkowo prosta
technika pobierania materiału do ba-
dania, mała inwazyjność oraz niedługi
czas oczekiwania na wynik sprawiają,
że metoda ta jest cennym narzędziem
pomocniczym dla lekarza klinicysty.
Należy jednak pamiętać, że ma tak-
że ograniczenia w możliwości posta-
wienia właściwego rozpoznania. Wy-
nikają one z często przypadkowego
składu pobranych komórek, nadmier-
nego pobrania krwi i powstania skrze-
pów w rozmazach. Nie bez znaczenia
jest także dobre przygotowanie mery-
toryczne patomorfologa oceniającego
cechy morfologiczne komórek i wy-
suwanie właściwych wniosków dia-
gnostycznych. W wielu przypadkach
sumują się błędy w pobraniu i przesy-
łaniu materiału do badania oraz pra-
cowni, uniemożliwiając uzyskanie wła-
ściwego rozpoznania. Należy również
Badania cytologiczne i histopatologicz-
ne są niezbędnymi badaniami laborato-
ryjnymi, które uzupełniają lub są decy-
dujące w diagnostyce klinicznej wielu
chorób zwierząt. Współczesna meto-
dyka badań mikroskopowych pozwala
stosować w rozmazach lub skrawkach
uzyskanych z tkanek chorobowo zmie-
nionych różnorodne reakcje chemiczne
lub immunohistochemiczne, co umoż-
liwia precyzyjne rozpoznanie choroby
i ukierunkowanie leczenia. Uzyskanie
dobrego wyniku w jak najkrótszym cza-
sie nie zależy wyłącznie od rzetelności
i sprawnego funkcjonowania laborato-
rium histopatologicznego. W dużym
stopniu zależy od współpracy patomor-
fologów z lekarzem kierującym próbki
do badania oraz od przepływu niezbęd-
nych informacji.
Pierwszym i bardzo ważnym etapem
w procesie badawczym jest właściwe
pobranie przez lekarza klinicystę ma-
teriału biologicznego do badania cy-
tologicznego lub histopatologicznego,
jego właściwe zabezpieczenie oraz opi-
sanie przed wysłaniem do pracowni.
Niniejsze opracowanie stanowi krót-
ką instrukcję właściwego postępowa-
nia dla lekarzy klinicystów. Z licznych
kontaktów z lekarzami można wnio-
skować, że obawa przed niewłaściwym
pobraniem materiału biologicznego
i niewłaściwym sposobem przesyłania
powstrzymuje wielu z nich przed ko-
rzystaniem z możliwości diagnostycz-
nych badania cytologicznego lub histo-
patologicznego.
lek. wet. Katarzyna Paździor, dr wet. Iwona Otrocka-Domagała, dr wet. Michał Gesek, prof. dr hab. Tadeusz Rotkiewicz
Katedra Anatomii Patologicznej Wydziału Medycyny Weterynaryjnej Uniwersytetu Warmińsko-Mazurskiego w Olsztynie
Cytology and histopathology: guidelines for proper sampling, describing
and securing during sending to a laboratory
Badanie cytologiczne
i histopatologiczne
– zasady prawidłowego pobierania, opisywania
i przesyłania materiału do badań
Streszczenie
Badanie cytologiczne to nieinwazyjna me-
toda diagnostyczna pozwalająca w krót-
kim czasie ukierunkować leczenie lub
dalszą diagnostykę. Prawidłowy sposób
pobrania, opisania i zabezpieczania ma-
teriału gwarantuje otrzymanie miarodaj-
nego wyniku. Badanie histopatologicz-
ne w większości przypadków pozwala
ostateczne zdiagnozować zmiany, pod
warunkiem, że materiał został pobrany
i utrwalony prawidłowo.
Słowa kluczowe
badanie cytologiczne, badanie histo-
patologiczne, biopsja aspiracyjna cien-
koigłowa
Abstract
Cytology is a non-invasive diagnostic tool
which promptly allows for determining
a proper treatment or further diagnosis.
Only properly sampled, described and
secured cytological material guarante-
es putting a proper diagnosis. The histo-
pathological examination in most cases
makes an adequate diagnosis possible,
on condition that the tissue has been
properly sampled and fi xed.
Key words
cytology, histopathology, fine-needle
aspiration biopsy

DIAGNOSTYKA
WETERYNARIA W PRAKTYCE
78
www.weterynaria.elamed.pl
STYCZEŃLUTY • 12/2013
pamiętać, że badanie cytologiczne po-
zwala jedynie określić rodzaj komórek
obecnych w danej zmianie i ich cechy
morfologiczne, dlatego w wielu przy-
padkach konieczna jest weryfi kacja
wyniku badania cytologicznego bada-
niem histopatologicznym.
Pobieranie materiału
W zależności od lokalizacji, rozmia-
rów i cech makroskopowych zmiany
dostępne są różne metody pobierania
materiału do badania cytologicznego.
Biopsja aspiracyjna cienkoigłowa
(BAC). Najczęściej wybieraną przez
klinicystów metodą jest biopsja aspi-
racyjna cienkoigłowa (BAC), która po-
zwala pobrać materiał ze zmian łatwo
dostępnych, np. guzów występujących
w skórze, tkance podskórnej, ze zmie-
nionych węzłów chłonnych, gruczołu
mlekowego, ślinianek itd. Zaletą tej me-
tody jest możliwość pobrania materia-
łu komórkowego z głębi zmiany z unik-
nięciem zanieczyszczeń obecnych
na powierzchni, które mogą utrudniać
postawienie rozpoznania (1). Do po-
bierania materiału używa się igieł
o średnicy poniżej 1 mm (najczęściej
0,7-0,9 mm) i strzykawek o pojemno-
ści 5-20 ml.
Dobór średnicy igły i wielkości strzy-
kawki uzależniony jest od spoistości
zmiany. W przypadku zmian miękkich
wybieramy igły o mniejszej średnicy
i mniejsze strzykawki, a w przypadku
zmian bardziej spoistych (twardych)
stosujemy igły o średnicy większej
i większe strzykawki (1, 2). Przed wy-
konaniem nakłucia powierzchnię zmia-
ny należy oczyścić i zdezynfekować.
Po nakłuciu, odciągając tłok strzykaw-
ki do ok. 3/4 wysokości, wytwarzamy
podciśnienie zasysające materiał ko-
mórkowy do wnętrza igły. Kilkakrotnie
zmieniamy umiejscowienie igły w gu-
zie, pociągając za tłok strzykawki, nie
wyciągając igły całkowicie ze zmiany.
Należy pamiętać o tym, by zwolnić
tłok strzykawki przed wyciągnięciem
igły z tkanek; w przeciwnym razie
materiał zostanie zassany do wnę-
trza strzykawki, skąd może być trud-
ny do wydobycia. Po wyjęciu igły wraz
ze strzykawką ze zmiany odłączamy
strzykawkę od igły, do wnętrza strzy-
kawki aspirujemy powietrze, nakłada-
my ponownie igłę z materiałem znaj-
dującym się w jej wnętrzu i energicznie
wypychamy zawartość z igły na szkieł-
ko podstawowe. Odległość między igłą
a szkiełkiem nie może być zbyt duża,
ponieważ spowoduje to rozpryśnięcie
się materiału w postaci małych kro-
pel, które wyschną, zanim zdążymy
wykonać rozmaz. Gdy igła prawie do-
tyka szkiełka, materiał wydostaje się
w postaci jednej kropli, którą natych-
miast rozmazujemy za pomocą drugie-
go szkiełka. W przypadku pozyskania
dużej ilości materiału należy umieścić
go na kilku szkiełkach, po jednej kro-
pli na szkiełko; w przeciwnym razie nie
uda się wykonać odpowiednio cien-
kiego rozmazu. Warto wykonać kilka
nakłuć z różnych obszarów badanej
zmiany, ponieważ pozwoli to zmniej-
szyć ryzyko przypadkowego pominię-
cia obszaru diagnostycznego. Rozma-
zy pozostawiamy do wyschnięcia.
Szkiełka podstawowe są jednorazo-
wego użytku, nie należy ich myć ani
używać wielokrotnie, ponieważ może
to spowodować zmniejszenie adhe-
zji komórek do szkiełka i otrzymanie
próbki niediagnostycznej (1). Sposób
utrwalania otrzymanego rozmazu za-
leży od metody barwienia stosowanej
w danym laboratorium histopatolo-
gicznym, dlatego w tej sprawie należy
uprzednio skontaktować się z pato-
morfologiem. Większość tzw. szybkich
testów nie wymaga uprzedniego stoso-
wania utrwalaczy, ale rozmazy przed
wysłaniem koniecznie trzeba wysuszyć
na powietrzu.
Biopsja cienkoigłowa nieaspiracyjna.
W przypadku zmian silnie ukrwionych
materiał można pobrać za pomocą
biopsji cienkoigłowej nieaspiracyjnej.
Igłę ze strzykawką z zaaspirowanym
powietrzem wkłuwamy w zmianę, kilka-
krotnie ją przemieszczając tam i z po-
wrotem, unikając całkowitego jej wy-
ciągnięcia, następnie wyciągamy igłę
i natychmiast usuwamy materiał z igły
na szkiełko podstawowe za pomocą
strzykawki (1). Gdy chcemy poddać ba-
daniu materiał płynny, wykonujemy roz-
maz bezpośredni oraz (jeśli to możliwe)
po odwirowaniu (rozmaz sedymentu).
Materiał płynny można również bez-
pośrednio przesłać do laboratorium;
wtedy płyn pobieramy do próbówki
z EDTA, by zapobiec krzepnięciu (3).
Próbka musi zostać dostarczona na-
tychmiast ze względu na brak możli-
wości utrwalenia materiału.
Biopsja odciskowa. Biopsja odcisko-
wa jest rzadziej wybieraną metodą po-
bierania materiału do badania. Można
ją zastosować w przypadku pobie-
rania materiału ze skórnych zmian
sączących oraz przyżyciowego lub
pośmiertnego badania narządów we-
wnętrznych. Najczęściej ma charakter
uzupełniający w stosunku do biopsji
aspiracyjnej cienkoigłowej. Pobrany
materiał pozwala ocenić rodzaj mikro-
organizmów i komórek występujących
w zmienionych tkankach. Przy pomocy
tej metody potwierdza się głównie pro-
ces zapalny, który w zmianach nowo-
tworowych ma charakter wtórny.
Biopsję odciskową stosuje się często
do oceny ran wrzodziejących, trudno
gojących się. Pobiera się materiał od-
ciskowy przed i po oczyszczeniu miej-
sca chorobowego, jednak bez użycia
środków dezynfekujących. Gdy biop-
sję odciskową wykonuje się pośmiert-
nie z narządów wewnętrznych, nale-
ży je najpierw przekroić, aby uzyskać
świeżą powierzchnię. Nadmiar krwi
trzeba usunąć za pomocą materiału
absorbującego. Zmienione tkanki lub
części narządów przykłada się do czy-
stego szkiełka podstawowego, kilka-
krotnie w różnych miejscach, unikając
nadmiernego naciskania i rozsmaro-
wywania (1).
Badanie zeskrobin. Zeskrobiny uzy-
skuje się przy użyciu skalpela lub
szkiełka podstawowego ze zmian skór-
nych, z których nie można pobrać ma-
teriału drogą biopsji cienkoigłowej ani
też wykonać prawidłowej biopsji odci-
skowej, gdyż zmienione tkanki są zbyt
płaskie i nie ma wysięku na powierzch-
ni zmiany. Technika ta jest szczególnie
przydatna w diagnozowaniu pasożytni-
czych i grzybiczych chorób skórnych.
Badanie wymazów. Wymazy wyko-
nuje się z miejsc niedostępnych dla
innych technik pobierania materia-
łu cytologicznego (pochwa, ucho ze-
wnętrzne), przy użyciu wymazówek,
szczoteczek cytologicznych lub szpa-
tułek. Przed pobraniem materiału z ob-
szarów suchych należy zwilżyć wy-
mazówkę, a przygotowując rozmaz,
trzeba delikatnie dotykać szkiełka wy-
mazówką, unikając nadmiernego na-
cisku (1).
Przy pobieraniu materiału mogą po-
wstać błędy, które utrudniają postawie-
nie właściwej diagnozy lub powodują,

DIAGNOSTYKA
WETERYNARIA W PRAKTYCE
80
www.weterynaria.elamed.pl
STYCZEŃLUTY • 12/2013
że pobrany materiał staje się niedia-
gnostyczny. Najczęściej popełniane
błędy i praktyczne porady zamiesz-
czono w tab. 1.
Przesyłanie materiału
Do laboratorium histopatologicznego
przesyła się wyłącznie próbki opisane
i z odpowiednim pismem przewodnim
– skierowaniem. Materiał przesyłany
do badania cytologicznego ma zwy-
kle formę szkiełek z rozmazami. Wy-
bór odpowiedniego szkiełka podsta-
wowego ułatwi późniejsze prawidłowe
opisanie próbki. Najlepsze są szkiełka
podstawowe o grubości nie większej
niż 1 mm (przy grubszych szkiełkach
trudniej jest właściwie ustawić ostrość
w mikroskopie), dwustronne, z mato-
wym polem do opisu (ryc. 3, s. 82).
Szkiełko z rozmazem opisujemy
na matowym polu za pomocą ołów-
ka. Do opisywania szkiełek nie wolno
używać długopisów, pisaków i nakle-
jek, gdyż podczas utrwalania i bar-
wienia ulegają one rozpuszczeniu
i zmyciu, dodatkowo zanieczyszcza-
jąc odczynniki i powodując powsta-
wanie artefaktów utrudniających po-
stawienie rozpoznania. Informacje,
które muszą znaleźć się na szkiełku,
to: nazwisko właściciela/imię zwie-
rzęcia oraz oznaczenie szczegółowe,
jeśli przesyła się większą liczbę szkie-
łek z różnych zmian. Niezwykle istot-
ne jest, by szkiełko opisać na tej samej
stronie, na której wykonano rozmaz –
w przeciwnym razie materiał zostanie
zmyty podczas barwienia. Opisane
szkiełka należy przed wysłaniem od-
powiednio zabezpieczyć, dbając o to,
by rozmazy nigdy się nie stykały. Na-
leży bezwzględnie unikać sklejania
szkiełek, szczególnie skierowanymi
ku sobie stronami, na których wyko-
nane były rozmazy, jak również owi-
jania szkiełek materiałem, który może
przykleić się do rozmazu lub pozosta-
wić artefakty (np. bibuła). Do zabezpie-
czenia szkiełek najlepiej użyć plastiko-
wego pudełka z przegródkami (ryc. 3,
s. 82). Pudełko również można podpi-
sać, by uniknąć pomyłek przy przesy-
łaniu większej liczby pudełek w jednej
kopercie. Podpisanie pudełka ułatwi
jego zwrot wraz z wynikiem.
Opis materiału
Do przesyłanego materiału należy do-
łączyć skierowanie – pismo przewod-
nie zawierające informacje pozwalające
zidentyfi kować próbkę oraz właściwie
zinterpretować jej zawartość (ryc. 1).
Poza danymi lekarza kierującego mate-
riał do badania klinicznego konieczne
jest umieszczenie danych właściciela
zwierzęcia oraz dokładny opis pacjen-
ta, uwzględniający gatunek, wiek, płeć,
rasę oraz – w celach identyfi kacyjnych
– imię (ewentualnie nr – mikrochip lub
tatuaż). Dodatkowo należy dokładnie
opisać pobrany materiał, biorąc pod
uwagę przede wszystkim:
– tkankę, z której został pobrany (skó-
ra, tkanka podskórna itp.);
– okolicę ciała, w której znajduje się
badana zmiana (używając topogra-
fi cznej terminologii weterynaryjnej
celem uniknięcia nieporozumień);
– sposób pobrania (biopsja aspiracyj-
na cienkoigłowa, biopsja odciskowa,
wymaz);
– morfologię zmiany: wielkość, kształt,
barwę, konsystencję, przesuwalność
względem skóry i podłoża;
Materiał niediagnostyczny
lub fałszywie ujemny
Błędy w pobieraniu materiału do badania
cytologicznego
Praktyczne porady
Brak komórek typowych dla danej
zmiany – wynik fałszywie ujemny
przesłanie do badania zbyt małej liczby rozmazów
należy przesyłać ok. 4-5 szkiełek (liczba ta umożliwia
zastosowanie różnych metod barwienia rozmazów)
ominięcie badanej zmiany podczas wykonania
nakłucia
należy wykonywać kilka nakłuć
znajdowanie się materiału diagnostycznego
na brzegu szkiełka podstawowego (niemożliwe
do obejrzenia pod mikroskopem)
zawsze powinno się umieszczać materiał na środku
szkiełka podstawowego, bliżej matowego pola do opisu,
i rozmazywać w kierunku przeciwległym
zbyt małe ciśnienie w strzykawce podczas aspiracji
trzeba odciągać tłok w 3/4 wysokości strzykawki
Gruby rozmaz
wady w technice wykonania rozmazu
wykonany rozmaz powinien być transparentny (ryc. 2, s. 82)
Obecne skrzepy krwi, zanieczysz-
czenie krwią
zbyt gruba igła, zbyt długa i intensywna aspiracja
podczas aspiracji naczynia krwionośne mogą pękać; gdy
stwierdzimy obecność krwi w strzykawce, koniecznie
powtarzamy nakłucie
silnie unaczyniona zmiana
należy rozważyć biopsję cienkoigłową bez aspiracji
Obecność artefaktów
niedokładne usunięcie żelu do USG ze zmiany;
używanie rękawiczek pudrowanych
należy zawsze dokładnie oczyścić zmianę przed
wykonaniem wkłucia i nie dotykać miejsca wkłucia
używanie rękawiczek pudrowanych
przechowywanie niezabezpieczonego rozmazu
i narażenie go na wtórne zanieczyszczenia (sierść,
szczątki organiczne)
trzeba odpowiednio zabezpieczyć rozmaz w czasie
wysychania – po wyschnięciu lub utrwaleniu rozmazy
przechowujemy w odpowiednich pudełkach
Zniekształcenie komórek
zbyt duże podciśnienie podczas wykonywania
biopsji aspiracyjnej cienkoigłowej
należy dokonywać ostrożnej aspiracji materiału
zbyt mocne przyciskanie szkiełka w czasie
wykonywania rozmazu
należy delikatnie wykonywać rozmaz
Obraz nieczytelny
wyschnięcie materiału na szkiełku zanim zrobiono
rozmaz
zawartość igły trzeba przenosić na szkiełko z niewielkiej
odległości, w niewielkiej ilości (jedna kropla) i natych-
miast rozmazywać
narażenie szkiełek z rozmazem na działanie oparów
formaliny, co spowodowało uszkodzenie komórek,
uniemożliwiające ich prawidłowe zabarwienie
zarówno w lecznicy, jak i w transporcie szkiełka z materia-
łem biopsyjnym nie powinny znajdować się w sąsiedztwie
z pojemnikami z formaliną
Tab. 1. Najczęstsze błędy popełniane podczas pobierania materiału do badania cytologicznego, uniemożliwiające ocenę próbki, oraz propozycje, jak ich uniknąć (1)

DIAGNOSTYKA
WETERYNARIA W PRAKTYCE
81
www.weterynaria.elamed.pl
STYCZEŃLUTY • 12/2013
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
– historię choroby, a przede wszystkim
to, kiedy zmiana się pojawiła i jak
dynamiczny był jej wzrost, wyniki
wykonanych badań diagnostycznych
(biochemia, morfologia, badanie
USG itp.) oraz podjęte leczenie.
Wiele leków, głównie (ale nie tyl-
ko) stosowanych miejscowo na skó-
rę, może spowodować powstawanie
określonych zmian skórnych, dlatego
należy w skierowaniu wyszczególnić,
jaki rodzaj leku podano zwierzęciu
i przez jak długi okres był on stosowa-
ny. Pozwoli to lepiej rozróżnić zmia-
ny wtórne, jatrogenne, od zmian pier-
wotnych.
Badanie histopatologiczne
W przeciwieństwie do badania cyto-
logicznego, które nie zawsze pozwala
zdiagnozować badaną zmianę i często
jedynie ukierunkowuje dalsze badania,
badanie histopatologiczne w większo-
ści przypadków daje ostateczną odpo-
wiedź. Pozwala ocenić nie tylko poje-
dyncze komórki, ale architektonikę
tkanki i określić dokładny typ zmiany
nowotworowej oraz stopień złośliwo-
ści komórek (4). Także w tym badaniu
najistotniejszy jest etap wstępny, pole-
gający na odpowiednim pobraniu ma-
teriału, jego utrwaleniu, zabezpiecze-
niu i opisaniu.
Pobieranie materiału
Przyżyciowo do badania histopatolo-
gicznego materiał pobiera się metodą
biopsji gruboigłowej (igła o średnicy
powyżej 1,2 mm), trepanobiopsji (igła
o średnicy 1-8 mm) lub biopsji chi-
rurgicznej wycinkowej. Możliwe jest
także pobranie materiału pośmiert-
ne (2). Najczęściej stosowana metoda
to biopsja chirurgiczna wycinkowa,
związana z całkowitym usunięciem
danej zmiany lub narządu. Zmiany
niewielkie – 2-3-centymetrowe – po-
bierane są do badania w całości. Je-
śli guz jest znacznych rozmiarów lub
mamy do czynienia z całym zmienio-
nym narządem, np. śledzioną, w cało-
ści usuniętą listwą mleczną, do bada-
nia pobieramy odpowiednie fragmenty
tkanki, w których występują widoczne
zmiany morfologiczne. Pobrana prób-
ka powinna być reprezentatywna dla
całości zmiany, dlatego jeśli zmiana
ma charakter niejednorodny, należy
pobrać fragment z każdego odrębnie
wyglądającego miejsca narządu lub
guza (ryc. 4, s. 82).
Przy pobieraniu materiału omija się
obszary objęte martwicą, wybierając
miejsca w jak najmniejszym stopniu do-
tknięte zmianami wtórnymi. Jeśli chce-
my uzyskać ocenę marginesów cięcia
chirurgicznego, należy je wyraźnie za-
znaczyć na próbce, np. za pomocą nici
chirurgicznej, zwłaszcza gdy do bada-
nia przesyłamy fragment zmiany (ryc. 5,
s. 82). Materiał natychmiast po pobra-
niu należy utrwalić w 10-procentowym
zbuforowanym roztworze formaliny.
Roztwór sporządza się w następujący
sposób: do 100 ml 40-procentowego
roztworu formaldehydu dostępne-
go w sklepach chemicznych (ryc. 6,
s. 83) dodaje się 900 ml wody (najle-
piej destylowanej), otrzymując w ten
sposób 10-procentowy roztwór forma-
liny. Roztwór ten ma odczyn kwaśny,
co powoduje niekorzystną hydrolizę
wielu składników tkanek i dlatego na-
leży go zneutralizować. W tym celu do-
dajemy do roztworu tabletki buforujące
dostępne w sprzedaży lub na dno na-
czynia wsypujemy 6,5 g Na
2
HPO
4
oraz
4 g jednowodnego NaH
2
PO
4
.
Ryc. 1. Przykładowy wzór skierowania zawierający wszystkie niezbędne informacje
DIAGNOSTYKA
WETERYNARIA W PRAKTYCE
82
www.weterynaria.elamed.pl
STYCZEŃLUTY • 12/2013
staci dużych wycinków, można ponaci-
nać skalpelem zmienione tkanki, aby
ułatwić i przyspieszyć penetrację pły-
nu utrwalającego. Pojemników z wycin-
kami w formalinie nie należy wkładać
do lodówki, ponieważ szybkość utrwa-
lania rośnie wraz ze wzrostem tempe-
ratury. Istnieje też niebezpieczeństwo
zamarznięcia płynu i tkanek, co spo-
woduje znaczne uszkodzenie komórek
i struktury wycinków i uniemożliwi lub
utrudni wykonanie preparatów diagno-
stycznych. Pobrane wycinki zanurzone
w formalinie mogą być przechowywane
w temperaturze pokojowej przez wiele
lat, nie tracąc przydatności do badania
histopatologicznego.
Jeśli pobieramy fragmenty wielu
zmian, należy każdy umieścić w osob-
nym pojemniku, a pojemniki odpo-
wycinki staną się sztywne, twarde i wy-
jęcie ich z naczynia będzie niemożliwe
bez uszkodzenia pojemnika i próbki,
poza tym tkanki ulegną zniekształce-
niu (ryc. 7). Należy unikać wkładania
materiału do pojemnika i późniejszego
zalewania go formaliną, ponieważ wte-
dy przykleja się on do ścianek, a utrwa-
lacz ma utrudnioną penetrację na tym
obszarze. Ilość formaliny w pojemniku
powinna 10-20-krotnie przewyższać ob-
jętość utrwalanej tkanki. Pobrane wy-
cinki wkładane do pojemnika z forma-
liną nie powinny być grubsze niż 2 cm,
ponieważ w proces utrwalania zbyt
grubych wycinków znacznie się wy-
dłuża (ryc. 8). Formalina penetruje ok.
6-9 mm tkanki w ciągu doby w tempe-
raturze pokojowej. Jeśli niezbędne jest
utrwalenie zmienionych tkanek w po-
Roztwór należy kilkakrotnie wstrzą-
snąć i pozostawić do sklarowania
na 48 godzin. Tak przygotowana zbu-
forowana 10-procentowa formalina na-
daje się do użytku, jest trwała, wymaga
jednak przechowywania w naczyniach
szczelnie zamkniętych. Poza formaliną
stosowane są różne utrwalacze tkanek,
zarówno proste, jak i złożone z wielu
składników. Dobór właściwego utrwa-
lacza należy w szczególnych przypad-
kach uzgodnić z pracownią histopato-
logiczną.
Pobrane wycinki wkładamy luźno
do pojemnika z 10-procentową forma-
liną zbuforowaną tak, aby tkanki były
luźno umieszczone w naczyniu i nie
dotykały ścianek. Jeśli do pojemnika
z formaliną, np. słoika, włożymy zbyt
duży fragment guza, to po utrwaleniu
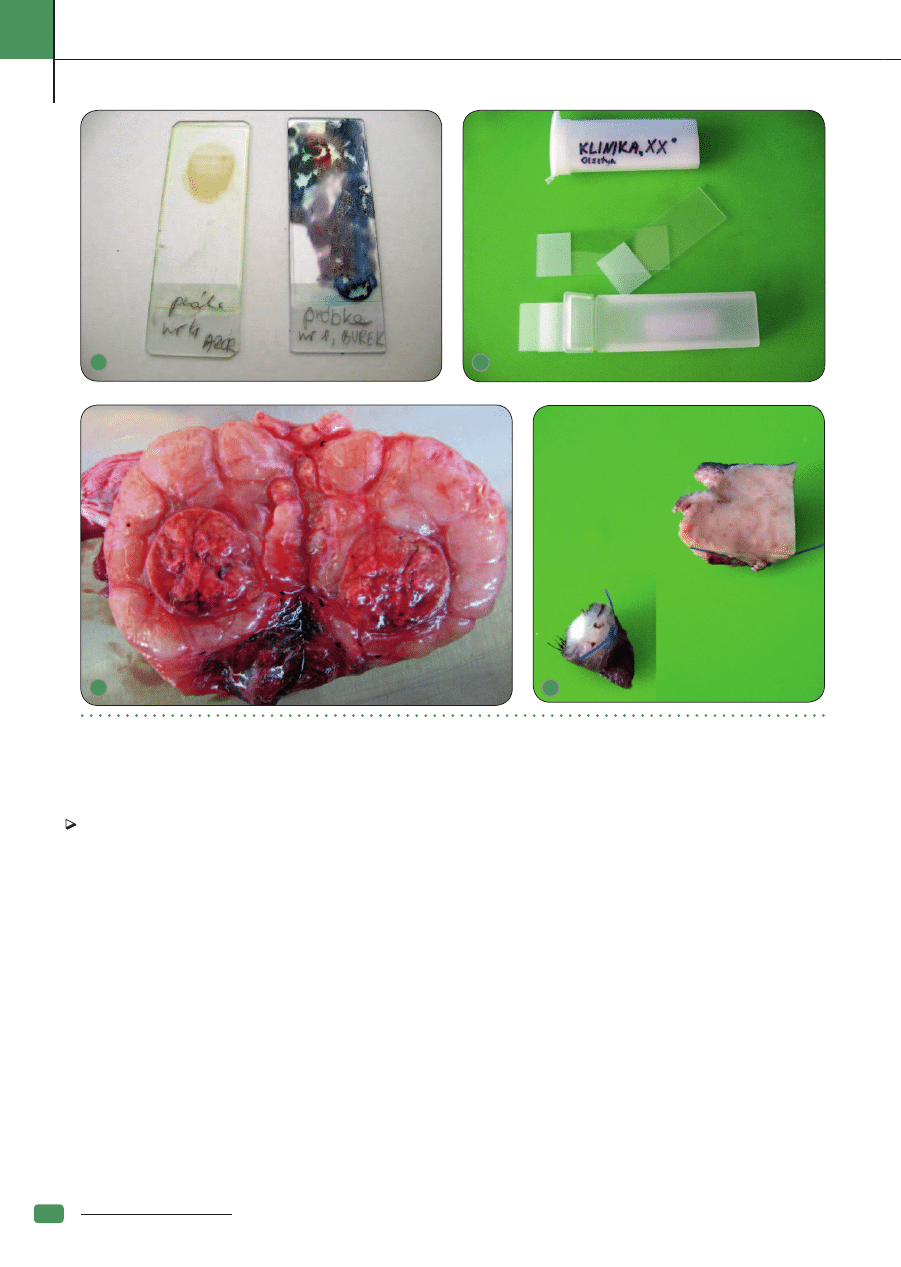
Ryc. 2. Prawidłowo wykonany rozmaz powinien być transparentny (po lewej). Wykonanie zbyt grubego rozmazu (po prawej) może spowodować całkowitą nieczytelność próbki;
Ryc. 3. Plastikowe pudełka na szkiełka z materiałem biopsyjnym powinny zawierać przegródki, tak by szkiełka nie stykały się. Należy używać szkiełek podstawowych z matowym polem
do opisu. Podpisanie pudełka umożliwi jego zwrot wraz z wynikiem; Ryc. 4. Jądro psa; miąższ narządu o strukturze zrazikowej z obecnością wyraźnie odgraniczonej, otorebkowanej
zmiany w centrum gruczołu. Do badania histopatologicznego należy pobrać fragment zarówno miąższu gruczołowego, jak i zmiany; Ryc. 5. Fragmenty guzów skórnych przesłane do
badania z zaznaczonym nicią chirurgiczną marginesem cięcia, który chcemy zbadać
2
4
5
3

DIAGNOSTYKA
WETERYNARIA W PRAKTYCE
83
www.weterynaria.elamed.pl
STYCZEŃLUTY • 12/2013
Ryc. 6. Dostępna w wielu sklepach chemicznych stężona formalina, czyli ok. 40-procentowy roztwór formaldehydu;
Ryc. 7. Tkanka włożona do pojemnika z formaliną nie powinna dotykać ścianek, a objętość formaliny powinna być
dziesięciokrotnie wyższa niż objętość tkanki (po lewej). Tkanka wciśnięta do zbyt wąskiego pojemnika „na siłę” ulegnie
odkształceniu oraz będzie się utrwalała znacznie wolniej ze względu na ograniczony dostęp utrwalacza do tkanek;
Ryc. 8. Tej wielkości guz przesłany w całości będzie się bardzo długo utrwalał, a czas oczekiwania na wynik może wydłużyć
się nawet o 2-3 tygodnie. Przed wysłaniem należy pobrać reprezentatywny fragment/fragmenty guza; Ryc. 9. Prawidłowo
zabezpieczony materiał przygotowany do wysłania do laboratorium histopatologicznego. Mniejszy opisany pojemnik
zawiera materiał zawieszony w formalinie, większy zamortyzuje ewentualne wstrząsy podczas transportu i zabezpieczy
przed wydostaniem się utrwalacza, jak również ograniczy jego parowanie
wiednio oznaczyć. Próbki znajdujące
się w jednym pojemniku są traktowa-
ne w laboratorium jako fragment jed-
nej zmiany.
Przesyłanie materiału
Przesyłany materiał powinien być od-
powiednio zapakowany i zabezpieczo-
ny, tj. naczynie z formaliną szczelnie za-
mknięte i włożone w większe pudełko,
również szczelnie zamknięte (ryc. 9).
Należy unikać szklanych słoików, chy-
ba że materiał dostarczany jest osobi-
ście lub przez posłańca. W przypadku
stłuczenia takiego pojemnika nie tyl-
ko utracimy przesyłany materiał, ale
również narazimy osoby mające kon-
takt z formaliną na podrażnienie skóry,
spojówek i górnych dróg oddechowych.
Ze względu na przenikanie par forma-
liny przez większość opakowań nie na-
leży wysyłać szkiełek z materiałem cy-
tologicznym obok pudełek z formaliną,
ponieważ może to prowadzić do uszko-
dzenia materiału cytologicznego (1, 2).
Pudełko z próbką należy opisać nie-
zmywalnym markerem z boku, nie
na nakrętce, ponieważ stwarza to ryzy-
ko pomyłki w laboratorium. Przy prze-
syłaniu materiału biologicznego należy
skorzystać z usług profesjonalnych fi rm
oferujących tego rodzaju usługi, stosu-
jąc się do ich zaleceń w kwestii przygo-
towywania pakunku.
Opis materiału
Do przesyłanego materiału dołącza-
my skierowanie, czyli pismo przewod-
nie, które powinno zawierać dokładnie
te same informacje, co przy przesy-
łaniu materiału cytologicznego. Gdy
chcemy uzyskać ocenę marginesów
cięcia chirurgicznego, należy to wy-
raźnie zaznaczyć w skierowaniu oraz
napisać, jaką metodą zaznaczyliśmy
miejsce cięcia.
Zarówno klinicystom, jak i patomor-
fologom zależy na tym, by diagnoza
była prawidłowa. Zdarza się jednak,
że wynik badania cytologicznego lub
histopatologicznego jest przyczyną
frustracji klinicysty, jak i właściciela
zwierzęcia, gdyż nie odpowiada ich
oczekiwaniom. Odpowiednie opisanie
materiału i profi lu oczekiwanych ba-
dań przez lekarza kierującego pozwo-
li w dużej mierze uniknąć tego typu
nieporozumień, a właściwe pobranie
materiału i jego zabezpieczenie zmi-
6
7
9
8
nimalizuje ryzyko uzyskania próbki
niediagnostycznej, utraty materiału lub
pomyłek laboratoryjno-administracyj-
nych.
Piśmiennictwo
1. Cowell R.L., Tyler R.D., Meinkoth J.H.:
Diagnostic cytology and hematology of the
dog and cat. Mosby Elsevier, St. Louis,
Missouri 2008.
2. Rotkiewicz T., Otrocka-Domagała I.,
Wiśniewska M.: Patomorfologia komórek
i tkanek zwierząt. Wydawnictwo UWM,
Olsztyn 2010.
3. Raskin R.E., Meyer D.J.: Canine and feline
cytology. A color atlas and interpretation
guide. Saunders Elsevier, St. Louis, Mis-
souri 2010.
4. Madej J.A., Rotkiewicz T.: Patologia ogólna
zwierząt. Wydawnictwo UWM, Olsztyn
2011.
lek. wet. Katarzyna Paździor
Katedra Anatomii Patologicznej
Wydział Medycyny Weterynaryjnej
Uniwersytet Warmińsko-Mazurski
w Olsztynie
10-719 Olsztyn
ul. Michała Oczapowskiego 13
Document Outline
Wyszukiwarka
Podobne podstrony:
pobieranie i przesyłanie materiałów do badań mikrobiologicznych, mikrobiologia
Pobieranie i przesyłanie materiału do badań, UM Wrocław - Stomatologia, Mikrobiologia i mikrobiolog
Pobieranie materiału do badań laboratoryjnych
SUROWIEC JAROSLAW Zasady pobierania i przesyłania materiałów do diagnostyki mikrobiologicznej(1)
Pobieranie materiałów do badań
więcej podobnych podstron