
P
OBIERANIE
M
ATERIAŁU
D
O
B
ADAŃ
L
ABORATORYJNYCH
U
P
ACJENTÓW
W S
TANACH
N
AGŁEGO
Z
AGROŻENIA
Z
DROWOTNEGO
.

NAGŁE
ZAGROŻENIE ZDROWOTNE
DEFINICJA
Stan nagłego zagrożenia zdrowotnego to stan
polegający na nagłym lub przewidywanym w
krótkim czasie pojawieniu się objawów
pogarszania zdrowia, którego bezpośrednim
następstwem
może
być
poważne
uszkodzenie
funkcji
organizmu
lub
uszkodzenie
ciała
lub
utrata
życia,
wymagający
podjęcia
natychmiastowych
medycznych
czynności
ratunkowych
i
leczenia.

INTERPRETACJA
BADAŃ
DODATKOWYCH W STANACH
KRYTYCZNYCH
Stan
krytycznych-istotne
znaczenie
rokownicze ma zdolność wychwytywania tlenu
przez
tkanki
oraz
kierunek
przemian
metabolicznych w komórkach
Wstrząs,
sepsa,
niewydolności
wielonarządowa - upośledzenie pobierania
tlenu przez tkanki, w następstwie zaburzeń
perfuzji narządowej i hipowolemii
Prowadzi to do niedotlenienia tkanek i
zapoczątkowania metabolizmu beztlenowego.
Dochodzi do zachwiania równowagi kwasowo–
zasadowej i rozwoju kwasicy metabolicznej.

2. RÓWNOWAGA KWASOWO-
ZASADOWA
W
warunkach
fizjologicznych
procesy
metaboliczne
zachodzące
w
komórce
sprowadzają
się
do
ciągłej
produkcji
dwutlenku węgla i kwasów, które są źródłem
jonów wodorowych. Jednocześnie układy
buforowe
organizmu
mają
zapewnić
równowagę
kwasowo-zasadową
przez
utrzymywanie
stałego
stężenia
jonów
wodorowych (H+) we krwi. Aby zapobiec
gromadzeniu w nadmiarze jonów H+
organizm
usuwa
kwasy
przez
płuca
(komponent
oddechowy)
lub/i
nerki
(komponent metaboliczny).

RÓWNOWAGA KWASOWO-
ZASADOWA CD.
Analiza równowagi kwasowo-zasadowej
jest podstawową umiejętnością lekarza
medycyny
ratunkowej
oraz
ratownika
medycznego związaną z poszukiwaniem
przyczyny kwasicy.
Badanie gazometryczne krwi tętniczej
dostarcza cennych informacji o parametrach
równowagi kwasowo-zasadowej, a pH krwi
umożliwia wstępną ocenę rodzaju zaburzeń.
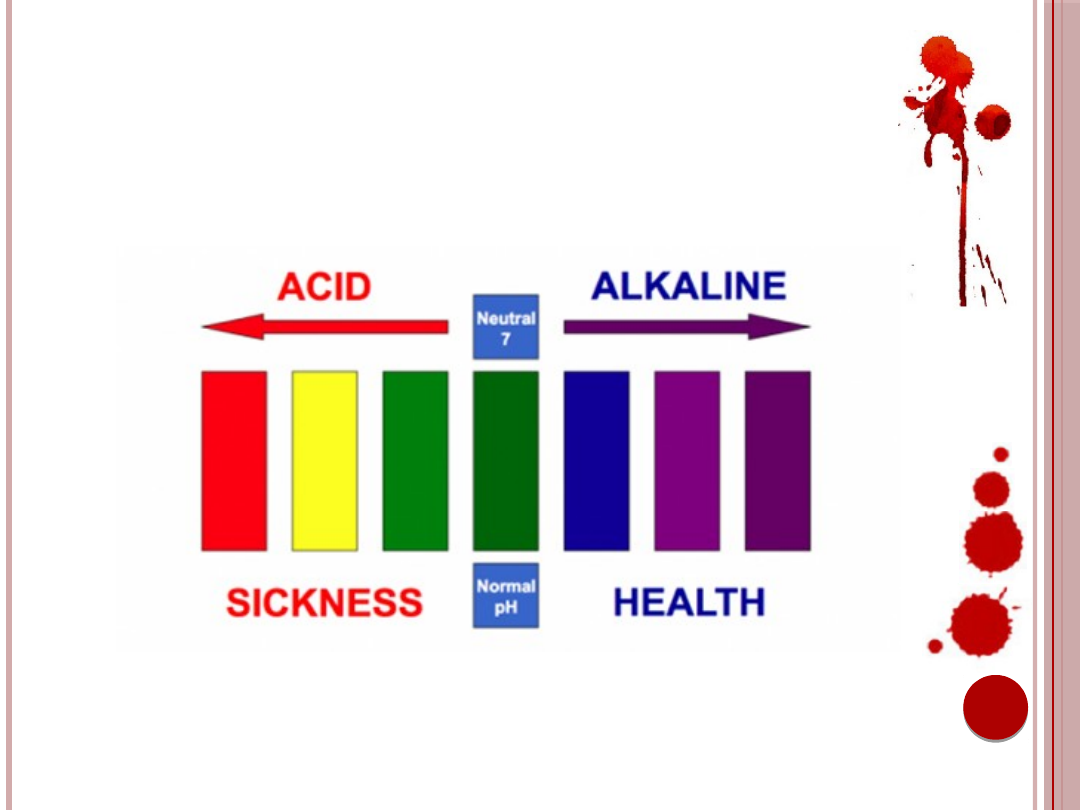
ZABURZENIA RÓWNOWAGI
KWASOWO-ZASADOWEJ
Ryc. 2. Ilustracja równowagi kwasowo-zasadowej.
Źródło: http://mrvitaminsnews.com.au/wp-content/uploads/2011/09/acid-alkaline.png

ZABURZENIA RÓWNOWAGI
KWASOWO-ZASADOWEJ CD.
Zaburzenia
równowagi
kwasowo-
zasadowej można podzielić na:
Oddechowe (pierwotne zmiany dotyczą
prężności CO
2
);
Metaboliczne (pierwotne zmiany dotyczą
prężności HCO
3
);
Złożone metaboliczno-oddechowe.

ZABURZENIA RÓWNOWAGI
KWASOWO-ZASADOWEJ CD.
Prężność CO
2
odzwierciedla stężenie kwasu
węglowego we krwi.
Organizm ma możliwość kompensowania
zaburzeń RKZ w określonych granicach.
Funkcjonowanie organizmu zostaje bardzo
poważnie zakłócone, gdy
pH
obniża się
poniżej
7,0
lub wzrasta powyżej
7,6
.

3. BADANIE G
AZOMETRYCZNE
KRWI
TĘTNICZEJ
Badanie RKZ jest powszechnie zlecanym
badaniem u chorych w stanach nagłego
zagrożenia
zdrowotnego.
Umiejętność
interpretacji tego badania ma istotne
znaczenie
dla
zrozumienia
zaburzeń
występujących u poszkodowanego. Badanie
wykonuje
się
z
krwi
tętniczej
lub
arterializowanej krwi włośniczkowej (pobranej
np. z opuszki palca).

BADANIE G
AZOMETRYCZNE
–
WARTOŚCI
REFERENCYJNE:
PaO
2
(powietrza) > 9 kPa (40 mmHg);
pH 7,36-7,45;
H+ 35-45 mmol/l;
pCO
2
4,7-6,0 kPa;
HCO
3
21-28 mmol/l;
BE od -2 do 2 mmol/l;
SpO
2
95-99%.

UŁATWIENIE ROZUMIENIA ZMIAN W
RÓWNOWADZE KWASOWO-ZASADOWEJ:
Ocena PaO
2
w stosunku do wydychanego
stężenia O
2
(FiO
2
);
Określenie
pH
lub
stężenia
jonów
wodorowych: pH > 7,45 (zasadowica), pH <
7,36 (kwasica);
Określenie składowej oddechowej:
PaCO
2
> 6 kPa (45 mmHg) – kwasica
oddechowa (lub skompensowana zasadowica
metaboliczna),
PaCO
2
< 5 kPa (35 mmHg) – zasadowica
oddechowa (lub skompensowana kwasica
metaboliczna);

UŁATWIENIE ROZUMIENIA ZMIAN W
RÓWNOWADZE KWASOWO-ZASADOWEJ CD.:
Określenie składowej metabolicznej:
HCO
3
> 27 mmol/l – zasadowica metaboliczna
(lub
kompensacja
nerkowa
kwasicy
oddechowej),
HCO
3
< 22 mmol/l – kwasica metaboliczna (lub
kompensacja
nerkowa
zasadowicy
oddechowej);
Określenie pierwotnego zaburzenia oraz
stwierdzenie czy występuje kompensacja
metaboliczna bądź oddechowa.

KWASICA…
Metaboliczna: występuje m.in. w zatruciu
alkoholem etylowym, alkoholem metylowym,
salicylanami, niewydolności nerek, biegunce.
Oddechowa:
występuje
m.in.
w
niewydolności
oddechowej,
ostrych
chorobach płuc, POCHP.

ZASADOWICA…
Metaboliczna: występuje m.in. podczas
wymiotów, drenażu żołądka, w zespole
Cushinga oraz niedoborze potasu.
Oddechowa:
występuje
m.in.
w
hiperwentylacji, w chorobie wysokościowej.

UWAGA!
Wyniki badań gazometrycznych należy
zawsze interpretować w odniesieniu do stanu
klinicznego chorego. Pozwoli to na właściwą
ocenę stanu zagrożenia poszkodowanego i
podjęcie ukierunkowanego leczenia.

4. RÓWNOWAGA WODNO-
ELEKTROLITOWA
Woda jest głównym składnikiem organizmu i
stanowi ok. 45-80% masy ciała. Jej zawartość
w
ustroju
maleje
wraz
z
wiekiem.
Rozmieszczenie wody w organizmie dotyczy
3 przedziałów płynowych:
Płyn wewnątrzkomórkowy: 40% m.c. (ok.
25l);
Płyn śródmiąższowy: 20% m.c. (ok. 15l);
Płyn wewnątrznaczyniowy: 5% m.c. (ok. 5l).

RÓWNOWAGA WODNO-
ELEKTROLITOWA CD.
Utrata 10% całkowitej wody w ustroju
powoduje groźne dla życia konsekwencje,
natomiast utrata 20% prowadzi do śmierci.
Do
utraty
wody
prowadzą:
wymioty,
biegunka, oparzenia, ciężkie uszkodzenie
nerek,
diureza
wodna
i
osmotyczna,
moczówka prosta. Do utraty wody dochodzi
również w warunkach homeostazy przez
płuca i skórę (perspiratio insensibilis) tj. 0,6
ml/kg m.c./h (ok. 400-1000 ml/d).

JONY
Głównymi jonami przestrzeni wewnątrz- i
zewnątrzkomórkowej są jony sodu i potasu.
Istnienie
pompy
sodowo-potasowej
powoduje, że stężenie sodu jest wysokie w
przestrzeni pozakomórkowej i w osoczu krwi,
a
jon
potasu
jest
głównym
jonem
wewnątrzkomórkowym.
Skład
płynu
przestrzeni wewnątrz- i zewnątrzkomórkowej
jest
znany
i
określany
stężeniem
elektrolitów
po
obu
stronach
błony
komórkowej.

SÓD
Wartości referencyjne 135-145 mmol/l.
Wzrost stężenia sodu powyżej normy
(hipernatremia)
powoduje
ciężkie
zaburzenia
gospodarki
wodnej
–
odwodnienie hipertoniczne, które może
wystąpić
w
przebiegu
następujących
schorzeń: cukrzyca, biegunki u niemowląt,
niewydolność nerek, zespół nerczycowy,
moczówka prosta.

SÓD CD.
Niedobór sodu (hiponatremia) w organizmie
występuje w stanach nadmiernej utraty sodu
przez nerki i przewód pokarmowy (wymioty,
biegunki, przetoki), a także w oparzeniach,
obfitych potach.
W wyniku nieprawidłowej terapii płynami może
wystąpić tzw. przewodnienie hipotoniczne
(spadek stężenia sodu). Każdemu zwiększeniu
wydalania
sodu
towarzyszy
zwiększone
wydalanie wody i zmniejszenie objętości płynu
pozakomórkowego.

POTAS
Wartości referencyjne 3,5-5,5 mmol/l.
Hiperkaliemia, czyli wzrost stężenia potasu
we krwi, jest powodowana nadmiernym
uwalnianiem tego jonu z komórek oraz
upośledzeniem
wydalania
z
moczem.
Występuje w przebiegu wstrząsu, zespołach
zmiażdżenia, w rozległej martwicy tkanek,
oparzeniach, rabdomiolizie, niewyrównanej
cukrzycy,
kwasicy
metabolicznej
lub
oddechowej czy niewydolności nerek.

POTAS CD.
Hiperkaliemia rzekoma
występuje w
przypadkach:
hemolizy
erytrocytów,
niewłaściwego pobierania krwi, dłuższego
przechowywania pełnej krwi po pobraniu.
Hipokaliemia jest wynikiem nadmiernej
utraty potasu przez przewód pokarmowy lub
nerki.
W
uporczywych
wymiotach,
biegunkach,
przetokach
dochodzi
do
znacznych
strat
potasu.
Wiele
leków
moczopędnych powoduje spadek stężenia
potasu.

POTAS CD.
Zaburzenia gospodarki potasowej prowadzą
do ciężkich zaburzeń czynności serca (rytmu
lub przewodzenia) do zatrzymania krążenia
włącznie.

ANALITYKA CELOWANA
POSZKODOWANYCH W
STANACH NAGŁEGO ZAGROŻENIA
ZDROWOTNEGO
Badania
biochemiczne
wykonywane
w
stanach nagłego zagrożenia zdrowotnego
powinny być zawsze
interpretowane w
aspekcie danych klinicznych.
W przypadkach
wątpliwych gdy czas i możliwości na to
pozwalają badania należy powtórzyć.
Pojedyncze
nieprawidłowe
wartości
badań biochemicznych nie powinny być
jedynym kryterium oceny ciężkości
stanu chorego.

PROFIL BADAŃ W SOR
Powszechnie wykonywanym profilem badań
w oddziałach ratunkowych są:
Morfologia krwi obwodowej;
Próba krzyżowa (próba zgodności);
Profil nerkowy (mocznik, kreatynina, sód, potas);
Profil wątrobowy (aminotransferazy, fosfataza
zasadowa, bilirubina, albumina, glukoza);
Profil sercowy (troponiny, kinaza kreatynowa,
dehydrogenaza mleczanowa, potas);
Profil hematologiczny (zaburzenia uk. Krzepnięcia
i fibrynolizy);
Profil
toksykologiczny
oraz
badanie
gazometryczne.
S
ZPITALNY
O
DDZIAŁ
R
ATUNKOWY
USK NR.1 W ŁODZI
Ryc. 3. Poszkodowany w stanie nagłego zagrożenia zdrowotnego.
Źródło: opracowanie własne

P
OBIERANIE
M
ATERIAŁU
D
O
B
ADAŃ
L
ABORATORYJNYCH

PROCEDURA:
POBIERANIE
MATERIAŁU DO BADAŃ
LABORATORYJNYCH
Każdy rodzaj materiału pobrany od pacjenta
jest uważany za materiał zakaźny i musi być
traktowany
jako
potencjalne
źródło
zakażenia.
Wszystkie
odpady
powstające
podczas
pobierania materiału są traktowane jako
materiał zakaźny i utylizowane zgodnie z
procedurą
„Utylizacja
odpadów
medycznych”.

POBIERANIE MATERIAŁU DO BADAŃ
OD POSZKODOWANEGO
Każdorazowo przy pobieraniu materiału od
poszkodowanego osoba pobierająca:
Stosuje
nową
parę
rękawiczek
jednorazowego użytku;
Weryfikuje tożsamość pacjenta;
Oznakowuje pojemnik z pobraną próbką
materiału zgodnie z zaleceniami;
Dołącza
wniosek
ze
zleceniem
na
przeprowadzenie określonych badań.
Składa na zleceniu podpis potwierdzający
pobranie materiału.

POBIERANIE KRWI
ŻYLNEJ
Większość
badań
laboratoryjnych
wykonywanych
jest
we
krwi.
Do
pobierania próbek należy używać zestawów
próżniowych
jednorazowego
użytku.
Używanie zestawów próżniowych zapewnia
właściwą jakość próbek oraz zmniejsza
ryzyko
kontaktu
osób
pobierających,
transportujących oraz wykonujących analizy
z materiałem potencjalnie zakaźnym.

POBIERANIE KRWI
ŻYLNEJ
CD.
Uwaga:
Ponieważ najczęstszym błędem
przed- laboratoryjnym jest błąd podmiany
próbek, nalepki na probówkach przed
pobraniem muszą zostać opatrzone danymi
identyfikującymi pacjenta zawierającymi imię
i nazwisko i datę urodzenia (optymalnie).
Pobieranie krwi do strzykawek lekarskich
przeznaczonych
do
iniekcji
i
"przestrzykiwanie" do probówek lub innych
pojemników uszkadza krwinki i może być
przyczyną hemolizy.

POBIERANIE KRWI
ŻYLNEJ
CD.
Do pobierania krwi do badań laboratoryjnych
wykorzystuje się jednorazowe zamknięte
zestawy aspiracyjno-próżniowe. Zestawy te
umożliwiają pobranie krwi na dwa sposoby:
Metodą podciśnieniową
Metodą aspiracyjną

POBIERANIE KRWI
ŻYLNEJ
CD.
Niezależnie od sposobu pobrania probówka
musi być wypełniona krwią do określonej
objętości,
zgodnie
ze
wskazaniami
producenta. Pożądana objętość jest określona
na każdej probówce kreską na naklejce do
wpisania danych identyfikacyjnych pacjenta.
Czas napełniania probówki zależy od metody
pobrania.
W metodzie podciśnieniowej należy odczekać
do momentu samoistnego ustania napływu
krwi do probówki.

POBIERANIE KRWI
ŻYLNEJ
CD.
W metodzie aspiracyjnej czas pobrania zależy
od szybkości odciągania tłoka, przy czym ruch
ten powinien być płynny i łagodny. W obu
metodach czas napełniania probówki wynosi
minimum kilka sekund.
Probówki występują w kilku rodzajach
różniących się objętością i kolorem nakrętki.
Kolor nakrętki określa rodzaj substancji
(najczęściej antykoagulantu) znajdującej się w
probówce. Niezmiernie ważne jest, aby kolor
probówki, czyli rodzaj pobieranego materiału,
odpowiadał
konkretnemu
badaniu
laboratoryjnemu.

P
RÓBÓWKI
S-MONOVETTE FIRMY
SARSTEDT
Kolor nakrętki:
Biały
Materiał dodany:
Aktywator krzepnięcia
Rodzaj próbki:
Surowica
Zastosowanie:
Chemia kliniczna
Bakteriologia
Serologia

P
RÓBÓWKI
S-MONOVETTE FIRMY
SARSTEDT
Kolor nakrętki:
Brązowy
Materiał dodany:
Aktywator krzepnięcia
+
Żel separujący
Rodzaj próbki:
Surowica
Zastosowanie:
Chemia kliniczna

P
RÓBÓWKI
S-MONOVETTE FIRMY
SARSTEDT
Kolor nakrętki:
Pomarańczowy
Materiał dodany:
Heparyna litowa
Rodzaj próbki:
Osocze
Zastosowanie:
Chemia kliniczna

P
RÓBÓWKI
S-MONOVETTE FIRMY
SARSTEDT
Kolor nakrętki:
Czerwony
Materiał dodany:
Kalium-EDTA
Rodzaj próbki:
Krew pełna
wersenianowa
Zastosowanie:
Morfologia krwi

P
RÓBÓWKI
S-MONOVETTE FIRMY
SARSTEDT
Kolor nakrętki:
Żółty
Materiał dodany:
Heparyna litowa +
Fluorek sodu
Rodzaj próbki:
Osocze
Zastosowanie:
Oznaczanie stężenia
glukozy

P
RÓBÓWKI
S-MONOVETTE FIRMY
SARSTEDT
Kolor nakrętki:
Zielony
Materiał dodany:
Cytrynian trójsodowy
1:10
Rodzaj próbki:
Osocze cytrynianowe
Zastosowanie:
Badania układu
krzepnięcia

P
RÓBÓWKI
S-MONOVETTE FIRMY
SARSTEDT
Kolor nakrętki:
Fioletowy
Materiał dodany:
Cytrynian trójsodowy
1:5
Rodzaj próbki:
Krew pełna
cytrynianowa
Zastosowanie:
OB

POBIERANIE KRWI METODĄ
PODCIŚNIENIOWĄ
Ryc. 4. Pobieranie krwi żylnej metodą podciśnieniową.
Źródło: Materiały informacyjne firmy Sarstedt

POBIERANIE KRWI METODĄ
PODCIŚNIENIOWĄ - P
ROCEDURA
1. Umyć ręce.
2. Zgromadzić odpowiedni sprzęt.
3. Przygotować poszkodowanego.
4. Wybrać miejsce wkłucia.
5. Odkazić preparatem antyseptycznym skórę w
miejscu planowanego wkłucia.
6. Odczekać około 30 sekund do momentu
wyschnięcia
preparatu
antyseptycznego
(optymalnie).
7. Umyć i zdezynfekować ręce.
8. Założyć stazę.
9. Ubrać rękawiczki jednorazowe.
10. Odpakować igłę z opakowania.

POBIERANIE KRWI METODĄ
PODCIŚNIENIOWĄ – P
ROCEDURA
CD.
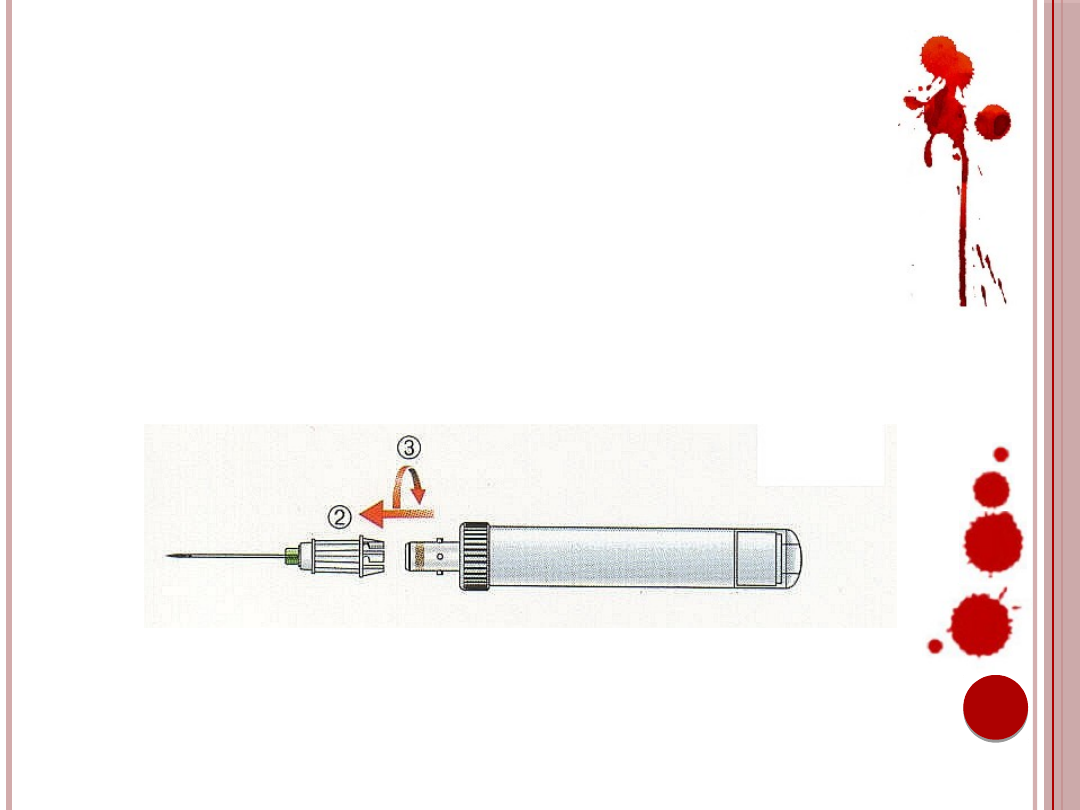
11. Bezpośrednio przed pobraniem krwi należy
odciągnąć maksymalnie tłok SMonovette, aż
do wyczuwalnego zatrzaśnięcia, po czym tłok
musi zostać odłamany (1).
Ryc. 5. Odciąganie i odłamanie tłoka próbówki.
Źródło: Materiały informacyjne firmy Sarstedt
POBIERANIE KRWI METODĄ
PODCIŚNIENIOWĄ – P
ROCEDURA
CD.
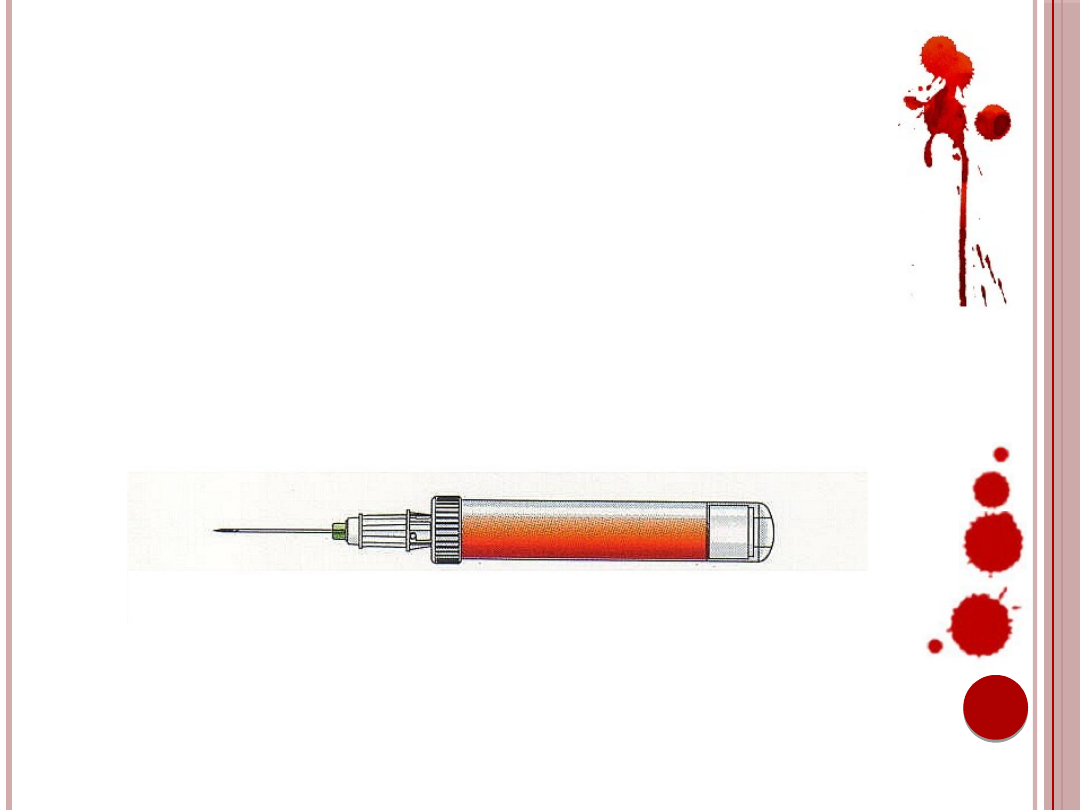
12. Wkłuć igłę do naczynia.
13. Podłączyć S-Monovette do igły i umocować
poprzez lekki obrót w prawo (2 +3).
14. Poluzować stazę.
Ryc. 6. Podłączanie próbówki do igły.
Źródło: Materiały informacyjne firmy Sarstedt
POBIERANIE KRWI METODĄ
PODCIŚNIENIOWĄ – P
ROCEDURA
CD.
15. Odczekać, aż ustanie napływ krwi.
Ryc. 7. Napełnianie próbówki krwią.
Źródło: Materiały informacyjne firmy Sarstedt
POBIERANIE KRWI METODĄ
PODCIŚNIENIOWĄ – P
ROCEDURA
CD.
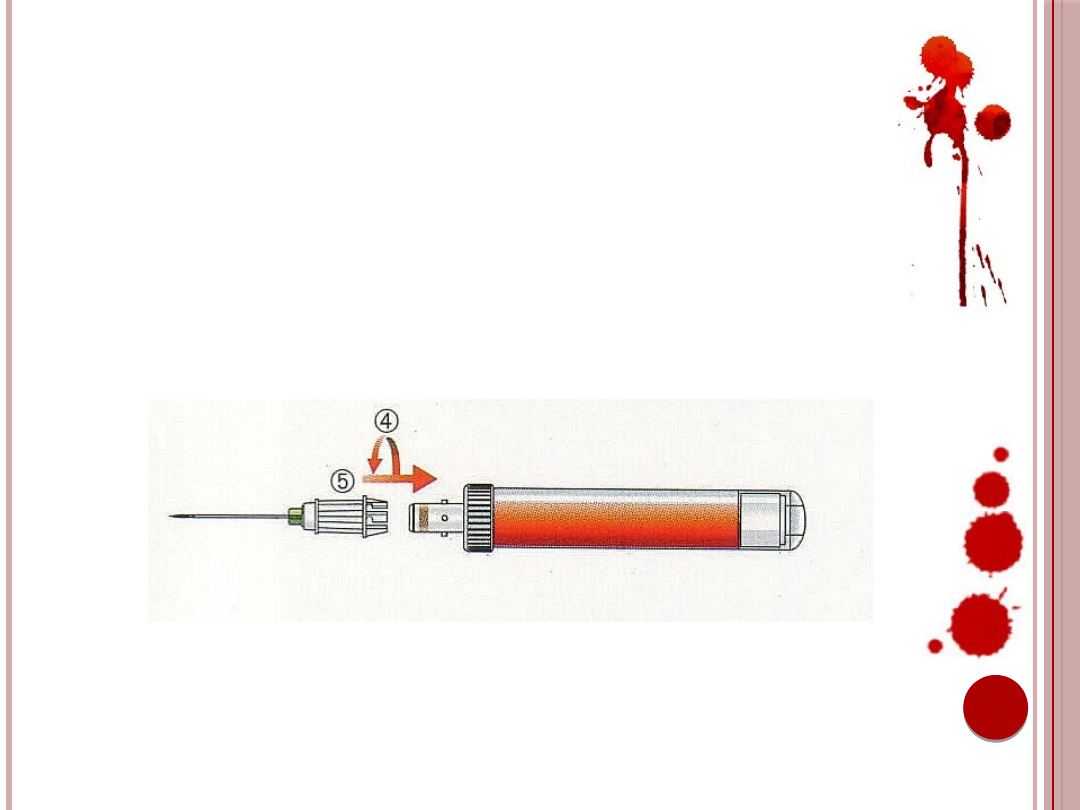
16. Odłączyć S-Monovette poprzez lekki obrót
w lewo (4). Igłę pozostawić w żyle (5).
Ryc. 8. Odłączanie próbówki.
Źródło: Materiały informacyjne firmy Sarstedt

POBIERANIE KRWI METODĄ
PODCIŚNIENIOWĄ – P
ROCEDURA
CD.
17. W razie potrzeby pobrania dalszych próbek
podłączyć kolejno następne S-Monovette i
pobierać krew tak jak opisano w punktach 11-
14.
18. Aby zakończyć pobieranie krwi należy
najpierw odłączyć S-Monovette (krok 4 na
rysunku), a dopiero potem wycofać igłę z żyły
(krok 5 na rysunku).
19. Po usunięciu igłę należy umieścić w
pojemniku odpornym na przekłucie.
20. Po usunięciu igły miejsce wkłucia należy
ucisnąć jałowym gazikiem.

POBIERANIE KRWI METODĄ
PODCIŚNIENIOWĄ – P
ROCEDURA
CD.
21. Zdjąć rękawiczki jednorazowe i umieścić je w
pojemniku na odpady medyczne.
22.
Probówki
z
antykoagulantem
(kolor
pomarańczowy, czerwony, zielony, żółty i
fioletowy) należy po pobraniu delikatnie wymieszać
poprzez kilkukrotne obrócenie
probówki do góry nogami. Probówek bez
antykoagulantu (kolor biały i brązowy) nie należy
mieszać.
23. Probówki należy zidentyfikować poprzez
napisanie na naklejce imienia i nazwiska pacjenta.
24. Umyć i zdezynfekować ręce.

POBIERANIE KRWI METODĄ
ASPIRACYJNĄ
Ryc. 9. Pobieranie krwi żylnej metodą aspiracyjną.
Źródło: Materiały informacyjne firmy Sarstedt

POBIERANIE KRWI METODĄ
ASPIRACYJNĄ - PROCEDURA
1. Umyć ręce.
2. Zgromadzić odpowiedni sprzęt.
3. Przygotować pacjenta.
4. Wybrać miejsce wkłucia.
5. Odkazić preparatem antyseptycznym skórę w
miejscu planowanego wkłucia.
6. Odczekać około 30 sekund do momentu
wyschnięcia preparatu antyseptycznego.
7. Umyć i zdezynfekować ręce.
8. Założyć stazę.
9. Ubrać rękawiczki jednorazowe.
10. Odpakować igłę z opakowania.
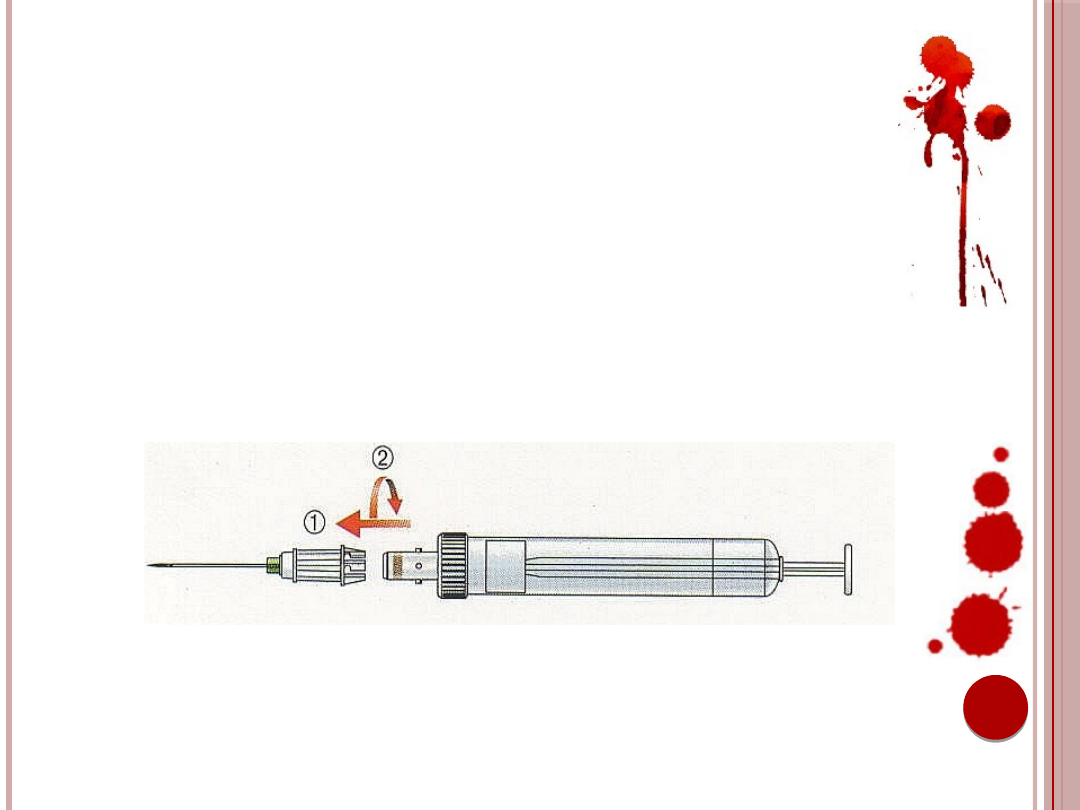
POBIERANIE KRWI METODĄ
ASPIRACYJNĄ – PROCEDURA CD.
11. Bezpośrednio przed pobraniem krwi igłę
nakłada się końcówkę S-Monovette i mocuje
przez lekki obrót w prawo (1 + 2).
Ryc. 10. Mocowanie próbówki poprzez lekki obrót w prawo.
Źródło: Materiały informacyjne firmy Sarstedt

POBIERANIE KRWI METODĄ
ASPIRACYJNĄ – PROCEDURA CD.
12. Nakłuć żyłę, poluzować stazę i powoli
odciągać tłok. Odczekać aż ustanie napływ
krwi.
Ryc. 11. Kierunek odciągania tłoka.
Źródło: Materiały informacyjne firmy Sarstedt


POBIERANIE KRWI METODĄ
ASPIRACYJNĄ – PROCEDURA CD.
14. W razie potrzeby pobierania dalszych próbek
podłączyć kolejno następne Smonovette do igły i
pobierać krew tak jak opisano w punktach 11-13.
15. Aby zakończyć pobieranie krwi należy najpierw
odłączyć S-Monovette (krok 3 na rysunku), a
dopiero potem wycofać igłę z żyły (krok 4 na
rysunku).
16. Po usunięciu igłę należy umieścić w pojemniku
odpornym na przekłucie.
17. Po usunięciu igły miejsce wkłucia należy
ucisnąć jałowym gazikiem.
18. Do transportu lub wirowania należy odciągnąć
tłok, aż do zatrzaśnięcia, po czym go odłamać.

POBIERANIE KRWI METODĄ
ASPIRACYJNĄ – PROCEDURA CD.
19. Zdjąć rękawiczki jednorazowe i umieścić je w
pojemniku na odpady medyczne.
20.
Probówki
z
antykoagulantem
(kolor
pomarańczowy, czerwony, zielony, żółty i
fioletowy)
należy
po
pobraniu
delikatnie
wymieszać
poprzez
kilkukrotne
obrócenie
probówki do góry nogami. Probówek bez
antykoagulantu (kolor biały i brązowy) nie należy
mieszać.
21. Probówki należy zidentyfikować poprzez
napisanie na naklejce imienia i nazwiska
pacjenta.
22. Umyć i zdezynfekować ręce.
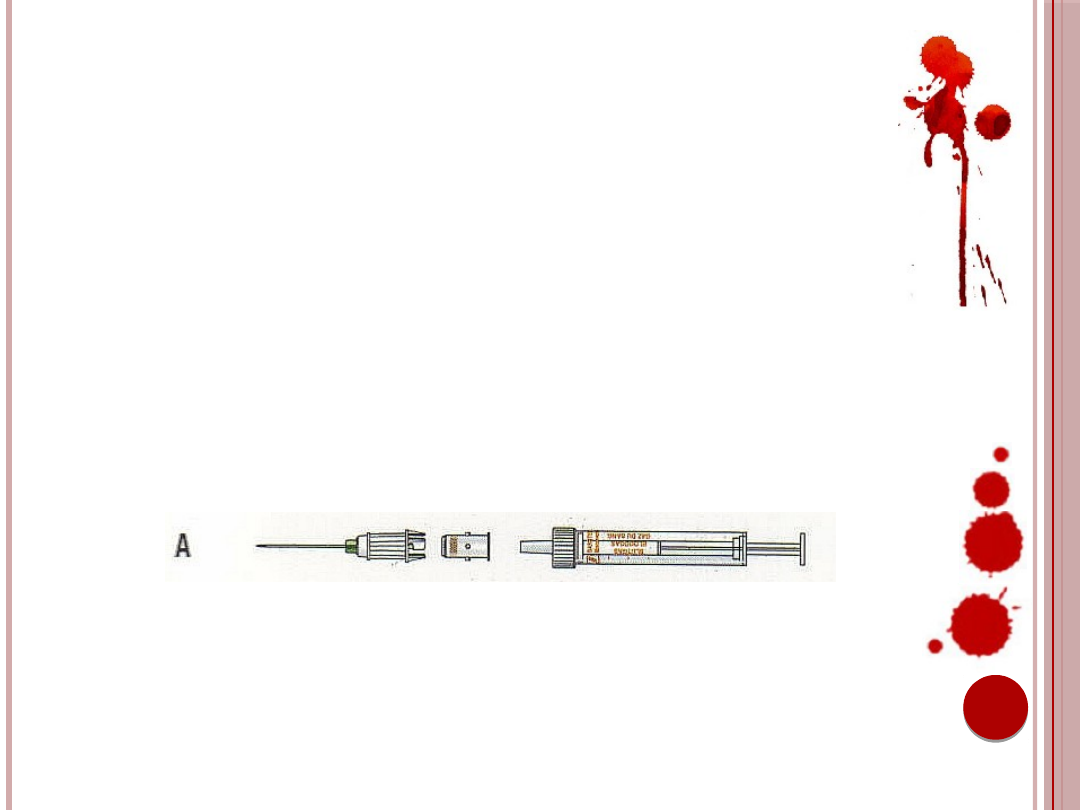
POBIERANIE KRWI INNYMI
SPOSOBAMI
A. W przypadku konieczności pobrania krwi za
pomocą Luer-Monovette (np. zestawy do
gazometrii)
można
użyć
adaptera
membranowego.
Ryc. 13. Użycie adaptera membranowego.
Źródło: Materiały informacyjne firmy Sarstedt


POBIERANIE KRWI INNYMI
SPOSOBAMI CD.
C. W wypadku potrzeby użycia igły typu
motylek można zastosować igłę Multifly ze
zintegrowanym multi adapterem.
Ryc. 15. Zastosowanie multi zintegrowanego adaptera.
Źródło: Materiały informacyjne firmy Sarstedt

POZYSKIWANIE
SUROWICY
Surowicę uzyskuje się w wyniku odwirowania
skrzepu krwi żylnej pobranej do suchej
probówki.
Z
uwagi
na
możliwość
otrzymywania
nieprawidłowych
wyników
zaleca się pobieranie krwi na „skrzep”
wyłącznie do probówek z białym korkiem
zawierających aktywator krzepnięcia. Przy
wykonywaniu większej liczby badań z tej
samej próbki krwi ilość surowicy niezbędna
dla każdego z badań ulega zmniejszeniu, tak,
że
dla
większości
zestawów
badań
wystarczające jest pobranie tylko jednej
porcji krwi (5 ml).

KREW PEŁNA
(MORFOLOGIA,
GAZOMETRIA, OB)
Krew pełna używana jest do badań morfologii
krwi, badań gazometrycznych, OB. i czasem
do oznaczania stężenia glukozy. Probówki do
badań morfologicznych zawierające jako
antykoagulant wersenian sodowo-potasowy
(EDTA) oznaczone są kolorem czerwonym
korka. Po pobraniu ok. 2 ml krwi należy ją
delikatnie wymieszać w celu rozpuszczenia
antykoagulantu. Przy mieszaniu należy
unikać pienienia się krwi powodującego
hemolizę oraz nieprawidłowe wymieszanie z
antykoagulantem i w efekcie powstanie
skrzepu.

KREW PEŁNA
(MORFOLOGIA,
GAZOMETRIA, OB) CD.
Do
badań
gazometrycznych
właściwym
materiałem jest zabezpieczona przed dostępem
powietrza pełna krew tętnicza, pobierana z
tętnicy do strzykawek gazometrycznych z
pomarańczowym korkiem i napisem Bloodgas.
Zawierają one jako antykoagulant heparynę.
Dopuszczalne jest pobranie krwi włośniczkowej
arterializowanej z opuszki palca lub płatka ucha.
Krew do badań gazometrycznych powinna być
niezwłocznie (w ciągu 15 minut) dostarczona do
laboratorium, w przeciwnym wypadku należy ją
przechowywać i transportować w łaźni lodowej.
Specjalne probówki do badań OB zawierające
odpowiednią ilość cytrynianu są oznaczone
kolorem fioletowym korka.

OSOCZE
W BADANIU UKŁADU
KRZEPNIĘCIA
Do pobierania materiału należy używać
probówek z zielonym korkiem. Badanie
układu hemostazy wykonuje się w osoczu
uzyskanym drogą odwirowania pełnej krwi
żylnej pobranej na 3,2% cytrynian sodu,
dokładnie w stosunku 1:10 (tj. np. 0.2 ml
cytrynianu + 1.8 ml krwi). Odpowiedni
poziom
napełnienia
probówki
zaznaczony jest na nalepce. Brak
odpowiednich proporcji w poważnym
stopniu zaburza wynik badania! Materiał
powinien być dostarczony do Punktu Przyjęć
maksymalnie do 2 godzin po pobraniu.

MOCZ
Mocz do badania ogólnego moczu
powinien być dostarczony w specjalnym
pojemniku w porcji moczu około 100 ml.
Należy pamiętać, że składniki morfologiczne
moczu są nietrwałe i badanie osadu moczu
powinno być wykonane do 2-3 godzin od
chwili pobrania próbki. Mocz zatem musi być
dostarczony do Punktu Przyjęć niezwłocznie
po uzyskaniu próbki. Próbkę moczu można
uzyskać
np.
poprzez
zaaspirowanie
odpowiedniej ilości z pęcherza moczowego
przy użyciu cewnika.

BADANIE OGÓLNE MOCZU
Ryc. 16. Specjalny pojemnik służący do gromadzenia próbek moczu do badań.
Źródło: opracowanie własne



PŁYN MÓZGOWO-RDZENIOWY
Do podstawowych badań biochemicznych oraz
oceny pleocytozy należy dostarczyć minimum
2 ml świeżo pobranego płynu mózgowo-
rdzeniowego.
Uwaga: Źle pobrany płyn, zmieszany z krwią
nie nadaje się do pełnego badania.
Pobrany płyn wstrzyknąć sterylnie do 2
jałowych
probówek
–
pierwszą
próbkę
przeznaczyć do badań analitycznych, drugą
dostarczyć na badania bakteriologiczne.
Natychmiast przesłać próbówkę do badań
zachowując temp. 37ºC. Czas transportu nie
powinien przekraczać 5 minut od pobrania.

PROFIL BADAŃ DODATKOWYCH W
S
TANACH
N
AGŁEGO
Z
AGROŻENIA
Z
DROWOTNEGO
Stosowanie profili badań laboratoryjnych
znacznie zwiększa liczbę informacji o
pacjencie.
Uzupełnieniem
badań
biochemicznych mogą być badania materiału
biologicznego, badania histopatologiczne,
badania morfologiczne i cytologiczne płynu
mózgowo-rdzeniowego, płynu z jam ciała
(opłucnowego,
otrzewnowego,
owodniowego), pobranych podczas zabiegów
wykonywanych na oddziale ratunkowym czy
w pomocy przedszpitalnej.

PODSUMOWANIE
U chorych w stanach zagrożenia życia
wykonywane
są
różnorodne
badania
laboratoryjne w celu rozpoznania choroby,
monitorowania jej przebiegu, określenia
skuteczności leczenia i dalszego rokowania.
Prawidłowa
interpretacja
uzyskanych
wyników wymaga zrozumienia celowości
zlecanych
badań,
znajomości
wartości
referencyjnych, a także analizowania danych
laboratoryjnych
w
aspekcie
obrazu
klinicznego.

PYTANIA?

BIBLIOGRAFIA
Rozporządzenie Ministra Zdrowia z dn. 23.03.2006 w sprawie standardów
jakości dla medycznych laboratoriów diagnostycznych i mikrobiologicznych
(Dz.U.06.61.435) Norma PN-EN ISO/IEC 15189:2003 “Laboratoria medyczne
– specyficzne wymagania dotyczące jakości i kompetencji.”
European Urinanalysis Group of the European Confederation of Laboratory
Medicine “European Urinanalysis Guidelines” Scandinavian Journal of
Clinical and Laboratory Investigation 2000; 60 (suppl. 231).
Zbiór Rekomendacji i Procedur dla Polskich Szpitali, Warszawa 2000.
Plantz S.H.: Medycyna Ratunkowa. Wydawnictwo ELSEVIER, Wrocław, 2008.
Zawadzki A.: Medycyna Ratunkowa i Katastrof. Wydawnictwo Lekarskie
PZWL, Warszawa, 2010.
Kaim S.M.: Medycyna Ratunkowa na Dyżurze (Kokot F. – red. polskiego
wydania). Wydawnictwo Lekarskie PZWL, Warszawa, 2007.
Słownik Poprawnej Polszczyzny. Wydawnictwo Naukowe PWN, Warszawa,
1980.
Materiały informacyjne firmy Sarstedt.
Procedura „Zlecanie badań laboratoryjnych”.
Procedura „Utylizacja odpadów medycznych”.

DZIĘKUJĘ ZA
UWAGĘ
Document Outline
- Slide 1
- Nagłe zagrożenie zdrowotne Definicja
- Interpretacja badań dodatkowych w stanach krytycznych
- 2. Równowaga Kwasowo-Zasadowa
- Równowaga Kwasowo-Zasadowa cd.
- Zaburzenia Równowagi Kwasowo-Zasadowej
- Zaburzenia Równowagi Kwasowo-Zasadowej Cd.
- Zaburzenia Równowagi Kwasowo-Zasadowej Cd.
- 3. Badanie Gazometryczne Krwi Tętniczej
- Badanie Gazometryczne – wartości referencyjne:
- Ułatwienie rozumienia zmian w Równowadze Kwasowo-Zasadowej:
- Ułatwienie rozumienia zmian w Równowadze Kwasowo-Zasadowej Cd.:
- Kwasica…
- Zasadowica…
- Uwaga!
- 4. Równowaga Wodno-Elektrolitowa
- Równowaga Wodno-Elektrolitowa Cd.
- Jony
- Sód
- Sód Cd.
- Potas
- Potas Cd.
- Potas Cd.
- Slide 24
- Profil Badań w SOR
- Szpitalny Oddział Ratunkowy USK Nr.1 w Łodzi
- Pobieranie Materiału Do Badań Laboratoryjnych
- Procedura: Pobieranie Materiału Do Badań Laboratoryjnych
- Pobieranie Materiału Do Badań Od Poszkodowanego
- Pobieranie Krwi Żylnej
- Pobieranie Krwi Żylnej Cd.
- Pobieranie Krwi Żylnej Cd.
- Pobieranie Krwi Żylnej Cd.
- Pobieranie Krwi Żylnej Cd.
- Próbówki S-Monovette firmy Sarstedt
- Próbówki S-Monovette firmy Sarstedt
- Próbówki S-Monovette firmy Sarstedt
- Próbówki S-Monovette firmy Sarstedt
- Próbówki S-Monovette firmy Sarstedt
- Próbówki S-Monovette firmy Sarstedt
- Próbówki S-Monovette firmy Sarstedt
- Pobieranie Krwi Metodą Podciśnieniową
- Pobieranie Krwi Metodą Podciśnieniową - Procedura
- Pobieranie Krwi Metodą Podciśnieniową – Procedura Cd.
- Pobieranie Krwi Metodą Podciśnieniową – Procedura Cd.
- Pobieranie Krwi Metodą Podciśnieniową – Procedura Cd.
- Pobieranie Krwi Metodą Podciśnieniową – Procedura Cd.
- Pobieranie Krwi Metodą Podciśnieniową – Procedura Cd.
- Pobieranie Krwi Metodą Podciśnieniową – Procedura Cd.
- Pobieranie Krwi Metodą Aspiracyjną
- Pobieranie Krwi Metodą Aspiracyjną - Procedura
- Pobieranie Krwi Metodą Aspiracyjną – Procedura Cd.
- Pobieranie Krwi Metodą Aspiracyjną – Procedura Cd.
- Slide 54
- Pobieranie Krwi Metodą Aspiracyjną – Procedura Cd.
- Pobieranie Krwi Metodą Aspiracyjną – Procedura Cd.
- Pobieranie Krwi Innymi Sposobami
- Slide 58
- Pobieranie Krwi Innymi Sposobami Cd.
- Pozyskiwanie Surowicy
- Krew pełna (morfologia, gazometria, OB)
- Krew pełna (morfologia, gazometria, OB) Cd.
- Osocze w badaniu układu krzepnięcia
- Mocz
- Badanie Ogólne Moczu
- Slide 66
- Slide 67
- Płyn Mózgowo-Rdzeniowy
- Slide 69
- Podsumowanie
- Pytania?
- Bibliografia
- DZIĘKUJĘ ZA UWAGĘ
Wyszukiwarka
Podobne podstrony:
Badanie cytologiczne i histopatologiczne Zasady prawidłowego pobierania, opisywania i przesyłania ma
Pobieranie materiałów do badań
POBIERANIE MATERIALOW DO BADAN MIKROBIOLOGICZNYCH ppt
pobieranie materiału d do badań
pobieranie materiału do badań
technika pobierania materiału do badań
Pobieranie materiału do badań biologicznych, Ratownicto Medyczne, MIKROBIOLOGIA
Procedura Przyjmowanie materiału do badań laboratoryjnych
pobieranie materialu do badań morfologicznych wyklady
Pobieranie materiałów do badań
POBIERANIE MATERIALOW DO BADAN MIKROBIOLOGICZNYCH ppt
Pobieranie materiałów do badań
Procedura pobierania prob, PROCEDURA POBIERANIA I PRZESYŁANIA PRÓBEK MATERIAŁU BIOLOGICZNEGO DO BADA
POBIERANIE I PRZECHOWYWANIE MATERIAŁÓW DO BADAŃ wiRUSOLOGICZNYCH prezentacja
pobieranie i przesyłanie materiałów do badań mikrobiologicznych, mikrobiologia
Pobieranie i przesyłanie materiału do badań, UM Wrocław - Stomatologia, Mikrobiologia i mikrobiolog
POBIERANIE I PRZECHOWYWANIE MATERIAŁÓW DO BADAŃ wiRUSOLOGICZNYCH prezentacja
genetyka cw 9 materiał do badan
materialy do zajec laboratoryjn Nieznany
więcej podobnych podstron