
1
Wydział Inżynierii Materiałowej i Ceramiki
Akademii Górniczo-Hutniczej w Krakowie
Materiały pomocnicze do zajęć seminaryjnych z przedmiotu
„CHEMIA ORGANICZNA”
kierunek: Inżynieria materiałowa
część I
Opracowanie:
dr inż. Edyta Stochmal
dr hab. inż. Magdalena Hasik
Kraków 2009

2
SPIS TREŚCI
Str.
1. Wskazówki dotycz
ące nazewnictwa wybranych grup
zwi
ązków organicznych ............................................................................... 3
2. Seminarium, cz
ęść I: Budowa i nazewnictwo związków organicznych ..... 17

Zasady nazewnictwa
3
1. WSKAZÓWKI DOTYCZĄCE NAZEWNICTWA
WYBRANYCH GRUP ZWIĄZKÓW ORGANICZNYCH
1. Alkany
(zawieraj
ą jedynie wiązania pojedyncze C-H i C-C)
Nazwy alkanów maj
ą końcówkę –an. Ich ogólny wzór to C
n
H
2n+2
(n-dowolna liczba
całkowita).
Nazwy pierwszych dziesi
ęciu alkanów normalnych (o strukturze prostołańcuchowej):
Liczba atomów
Nazwa
Wzór C
n
H
2n+2
w
ęgla (n)
1
metan
CH
4
CH
4
2
etan
C
2
H
6
CH
3
CH
3
3
propan
C
3
H
8
CH
3
CH
2
CH
3
4
butan
C
4
H
10
CH
3
CH
2
CH
2
CH
3
5
pentan
C
5
H
12
CH
3
CH
2
CH
2
CH
2
CH
3
6
heksan
C
6
H
14
CH
3
CH
2
CH
2
CH
2
CH
2
CH
3
7
heptan
C
7
H
16
CH
3
CH
2
CH
2
CH
2
CH
2
CH
2
CH
3
8
oktan
C
8
H
18
CH
3
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
3
9
nonan
C
9
H
20
CH
3
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
3
10
dekan
C
10
H
22
CH
3
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
3
Nazwy niektórych grup alkilowych:
–CH
3
metyl (Me)
–CH
2
CH
3
etyl (Et)
–CH
2
CH
2
CH
3
propyl (Pr)
–CH
2
CH
2
CH
2
CH
3
butyl (Bu)
|
CH
3
CHCH
3
izopropyl (i-Pr)
CH
3
CH
3
CH
3
C
tert-butyl (t-Bu)
Zasady nazewnictwa
4
Alkany rozgałęzione
Ogólne zasady nazewnictwa alkanów rozgał
ęzionych:
1. Nale
ży znaleźć najdłuższy łańcuch węglowy – łańcuch główny.
2. Ponumerowa
ć atomy węgla w łańcuchu głównym rozpoczynając od końca najbliższego
rozgał
ęzienia. W przypadku usytuowania pierwszych rozgałęzień w równych
odległo
ściach od obydwu końców kierować się pozycją kolejnego rozgałęzienia.
3. Poda
ć położenie i nazwę podstawników wymieniając je w kolejności alfabetycznej.
4. Dla identycznych podstawników poda
ć krotność ich występowania za pomocą
odpowiednich przedrostków: di-, tri-, tetra- itd.
5. Podstawnikom alkilowym nada
ć odpowiednie nazwy reszt węglowodorowych:
etylo-, metylo- itp.
6. Podstawnik zło
żony nazywany jest tak, jak gdyby sam był związkiem, zgodnie
z powy
ższymi regułami, rozpoczynając numerowanie od punktu dołączenia do łańcucha
głównego. Nazw
ę tego podstawnika umieszcza się w nawiasie poprzedzonym zapisem
numeru okre
ślającego jego położenie w łańcuchu głównym.
2. Cykloalkany
Do nazwy macierzystego w
ęglowodoru o budowie łańcuchowej dodaje się przedrostek cyklo-.
Podstawniki wymienia si
ę w kolejności alfabetycznej ze wskazaniem ich położenia podając
numer w
ęgla, przy którym są położone.
CH
3
CH
2
CCH
2
CHCH
3
CH
3
CH
3
CH
2
CH
3
4-etylo-2,4-dimetyloheksan
CH
3
CH
2
CHCHCH
2
CHCH
2
CH
3
CH
3
CH
2
CH
3
CH
2
CH
3
3,6-dietylo-4-metylooktan
CH
3
CH
2
CH
3
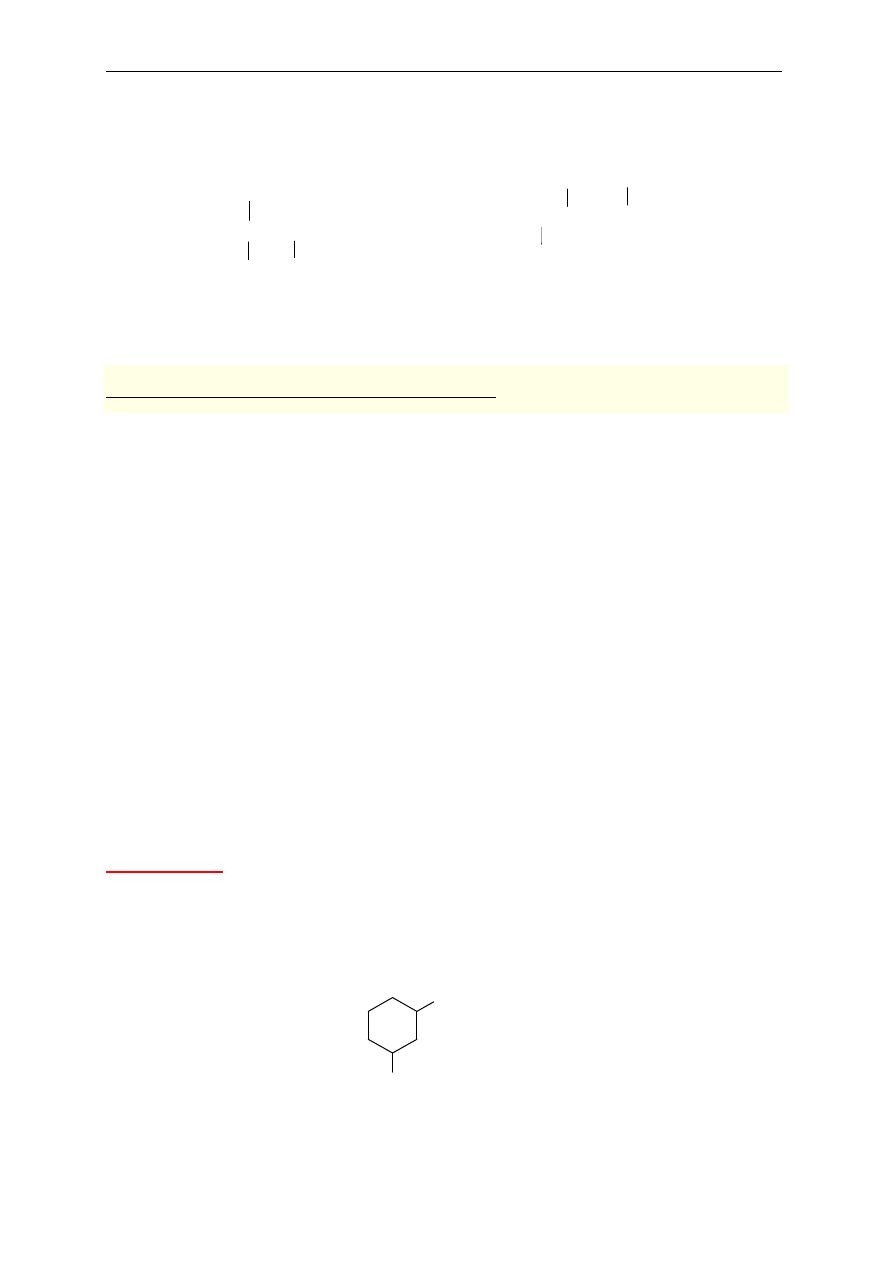
1-etylo-3-metylocykloheksan

Zasady nazewnictwa
5
3. Alkeny
(zawieraj
ą wiązanie podwójne C=C)
(Reguły podobne jak dla alkanów)
Nazwy alkenów maj
ą przyrostek –en poprzedzony numerem atomu węgla wskazującego
poło
żenie wiązania podwójnego i są pochodnymi nazw alkanów. Ich ogólny wzór to C
n
H
2n
.
Przy numerowaniu ła
ńcucha głównego pierwszeństwo ma położenie wiązania podwójnego.
Atomy w
ęgla przy podwójnym wiązaniu otrzymują możliwie najniższe numery, a pozycję
wi
ązania podwójnego wskazuje się umieszczając w nazwie numer atomu węgla o niższym
indeksie.
Nazwy zwi
ązków z dwoma podwójnymi wiązaniami mają końcówkę –dien, z trzema
–trien z okre
śleniem położenia.
4. Cykloalkeny
(Reguły podobne jak dla cykloalkanów)
Numerowanie rozpoczyna si
ę tak, by wiązanie podwójne było miedzy węglem C1 i C2 i aby
pierwszy podstawnik miał jak najni
ższy numer.
5. Alkiny
(zawieraj
ą wiązanie potrójne C
≡
C)
(Reguły podobne jak dla alkanów i alkenów)
Nazwy alkinów maj
ą przyrostek –in lub –yn poprzedzony numerem atomu węgla
wskazuj
ącego położenie wiązania potrójnego i są pochodnymi nazw alkanów. Ich ogólny
wzór to C
n
H
2n-2
.
CH
2
CHCHCH
3
CH
3
3-metylobut-1-en
CH
3
CH
CHCH
2
CH
2
CH
3
heks-2-en
CH
3
1-metylocyklopenten
CH
3
C
CCH
3
but-2-yn
CH
3
CHCH
2
CH
2
C
CH
CH
3
5-metyloheks-1-yn

Zasady nazewnictwa
6
W przypadku zwi
ązków zawierających wiązanie podwójne i potrójne numerowanie łańcucha
rozpoczyna si
ę od końca bliższego pierwszego wiązania wielokrotnego, bez różnicy, czy jest
to wi
ązanie podwójne, czy potrójne.
6. Halogenki alkilowe, R-X
(X = F, Cl, Br, I)
(Reguły podobne jak dla węglowodorów alifatycznych)
Fluorowiec traktowany jest jako podstawnik. Numerowanie ła
ńcucha głównego rozpoczyna
si
ę od końca bliższego pierwszego podstawnika, obojętne czy jest to alkil, czy fluorowiec.
Je
żeli w cząsteczce obecne jest wiązanie podwójne lub potrójne, to musi ono znaleźć się
w ła
ńcuchy głównym.
Halogenki alkilowe mo
żna również nazywać traktując atom fluorowca jako grupę funkcyjną;
wówczas zamiast np. chlorometanu b
ędzie chlorek metylu, chloroetanu – chlorek etylu, 2-
bromobutanu – bromek izopropylu, itp.
7. Związki aromatyczne
(w
ęglowodory aromatyczne, halogenki arylowe i inne pochodne
benzenu)
Nazwy zwi
ązków aromatycznych jednopierścieniowych tworzy się w zależności od liczby
podstawników w pier
ścieniu.
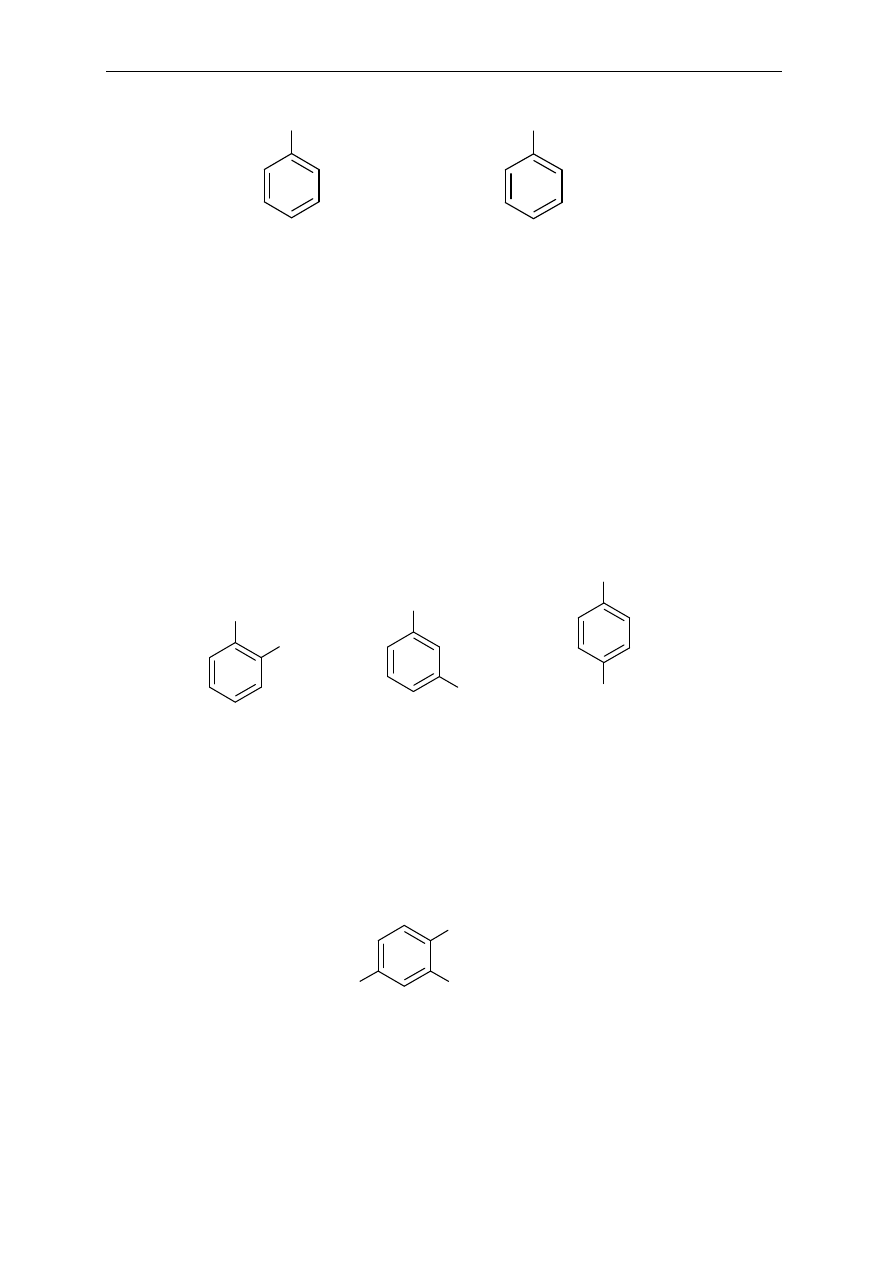
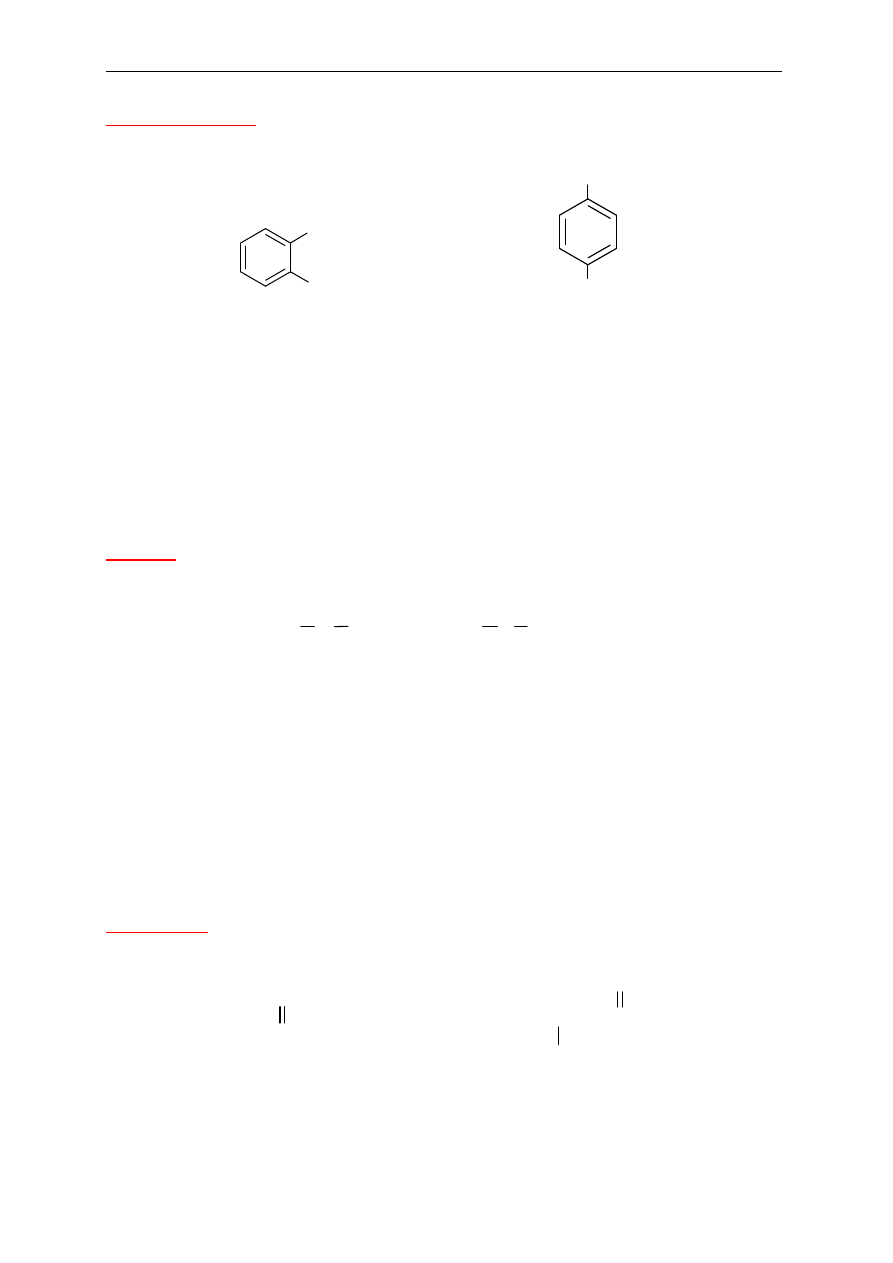
Jednopodstawione pochodne benzenu
Do podstawowej nazwy - benzen dodaje si
ę nazwę podstawnika.
CH
3
CH
CHCH
2
CHCH
2
C
CH
CH
3
4-metylookt-6-en-1-yn
CH
3
CHCH
2
CH
2
CHCH
3
CH
3
Br
2-bromo-5-metyloheksan
ClCH
2
CH
2
CHCHCH
2
CHCH
2
CH
3
CH
3
CH
2
CH
3
CH
2
CH
2
Cl
1,8-dichloro-3,6-dietylo-4-metylooktan
Zasady nazewnictwa
7
W przypadku niektórych grup jak: X = CH
3
, OH, COOH, NH
2
cz
ęsto stosuje się nazwy
zwyczajowe, odpowiednio: toluen, fenol, kwas benzoesowy, anilina.
Dipodstawione pochodne benzenu
Poło
żenia podstawników oznacza się dwojako: za pomocą liczb lub przedrostków: orto (o),
meta (
m), para (p).
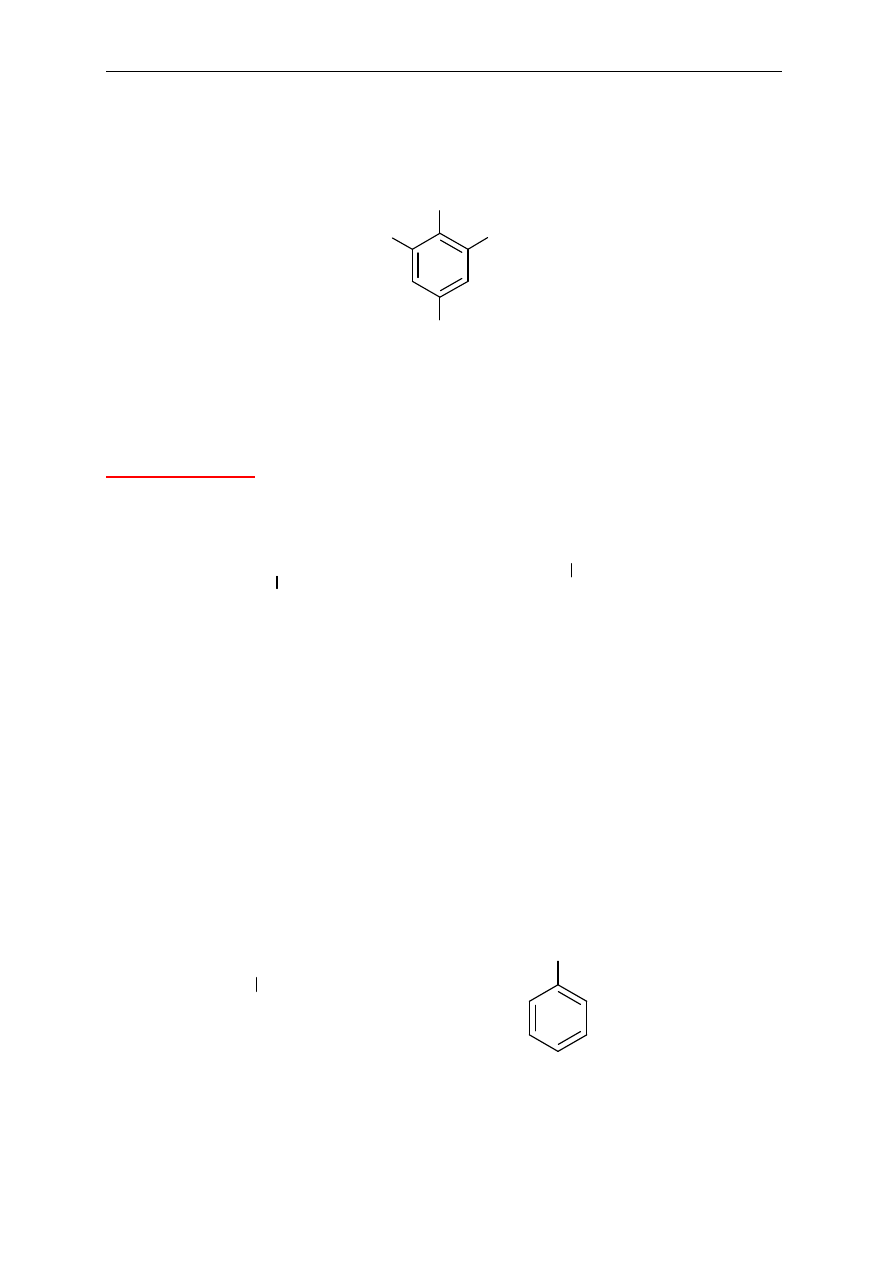
Pochodne benzenu podstawione więcej niż dwoma podstawnikami
Podstawniki wymienia si
ę w porządku alfabetycznym poprzedzając ich nazwy liczbami
wskazuj
ącymi pozycje podstawienia. Ważne jest, aby indeksy liczbowe węgli, przy których
Br
bromobenzen
Cl
Cl
Cl
CH
3
I
Br
1,2-dichlorobenzen
o-dichlorobenzen
1-bromo-4-jodobenzen
p-bromojodobenzen
3-chlorotoluen
m-chlorotoluen
Cl
NO
2
O
2
N
2-chloro-1,4-dinitrobenzen
CH
3
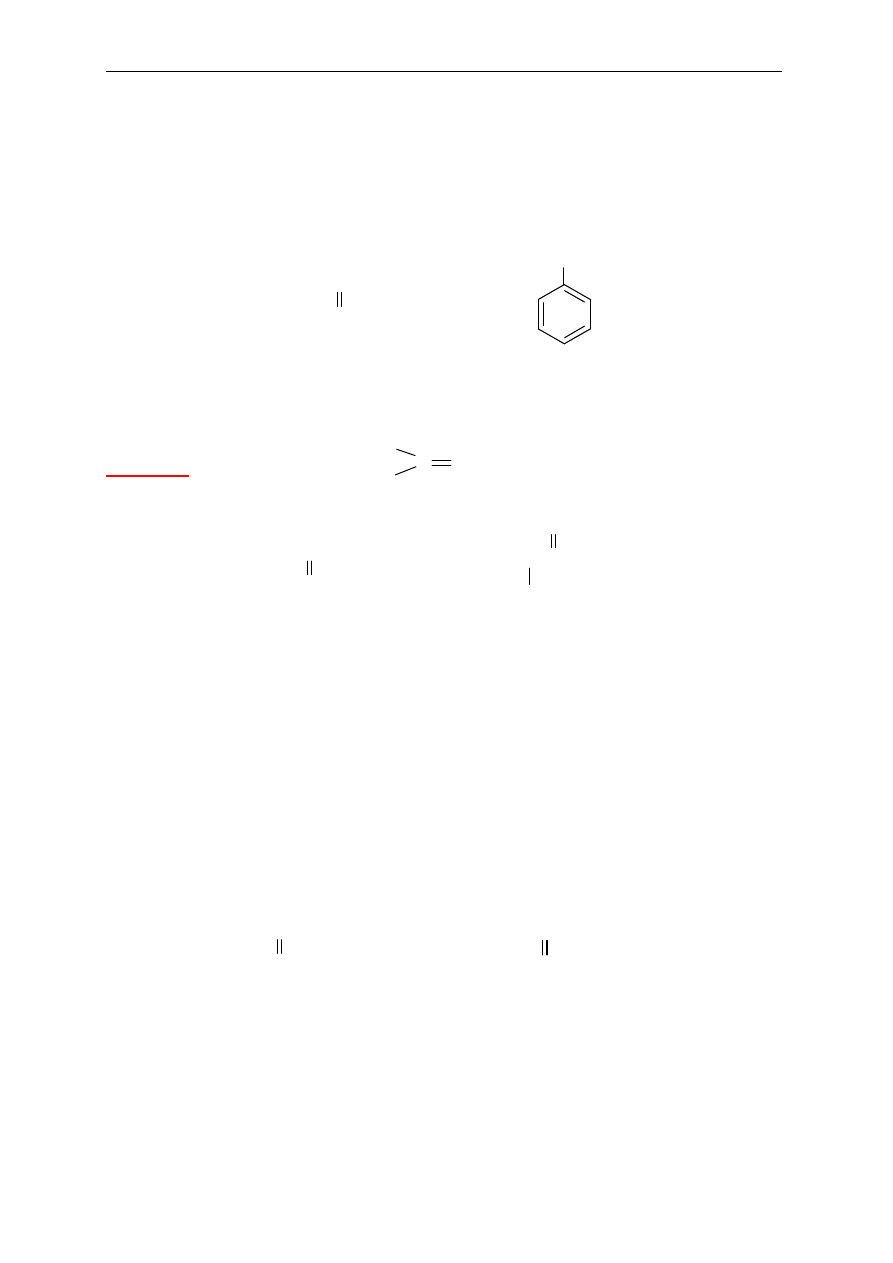
metylobenzen
(toluen)
Zasady nazewnictwa
8
s
ą podstawniki, były jak najniższe. W niektórych przypadkach jednopodstawiona pochodna
benzenu mo
że służyć jako nazwa podstawowa, a charakterystyczna grupa znajduje się przy
atomie w
ęgla C1.
8. Alkohole, R-OH
(charakterystyczna grupa –OH przył
ączona jest do nasyconego atomu
w
ęgla w łańcuchu alkilowym)
Tworz
ąc nazwę alkoholu za podstawową strukturę wybiera się najdłuższy łańcuch węglowy
z grup
ą hydroksylową. Do nazwy macierzystej dodaje się przyrostek –ol poprzedzony
numerem atomu w
ęgla, do którego przyłączona jest grupa –OH. Określając położenie tej
grupy istotne jest, aby indeks atomu w
ęgla był jak najniższy.
W przypadku niektórych prostych alkoholi stosuje si
ę nazwy zwyczajowe. Do słowa alkohol
dodaje si
ę nazwę grupy alkilowej lub arylowej połączonej z grupą hydroksylową, np.: alkohol
metylowy, alkohol etylowy, alkohol izopropylowy, alkohol benzylowy.
NH
2
Br
Br
Br
2,4,6-tribromoanilina
CH
3
CHCH
2
CH
3
OH
butan-2-ol
CH
3
CH
2
CHCH
2
OH
CH
3
2-metylobutan-1-ol
CH
3
CHCH
3
OH
alkohol izopropylowy
CH
2
OH
alkohol benzylowy
Zasady nazewnictwa
9
9. Fenole, ArOH
(charakterystyczna grupa –OH przył
ączona jest do pierścienia
aromatycznego)
Nazwy systematyczne fenoli tworzy si
ę dodając przedrostek hydroksy- do nazwy
w
ęglowodoru. Często używane są, w przypadku tej grupy związków, nazwy zwyczajowe.
10. Etery
(charakterystyczne wi
ązanie –C–O–C– w cząsteczce)
Etery proste, nie zawieraj
ące żadnych innych grup funkcyjnych – po słowie eter wymienia się
nazwy grup alkilowych poł
ączonych z atomem tlenu.
Etery o bardziej zło
żonej budowie – nazwę tworzy się jako pochodną macierzystego alkanu
i dodaje nazw
ę grupy alkilowej przyłączonej do atomu tlenu z końcówką –oksy.
11. Aldehydy
(charakterystyczna grupa –CHO w cz
ąsteczce)
OH
Cl
o-chlorohydroksybenzen
(o-chlorofenol)
NH
2
OH
p-aminohydroksybenzen
(p-aminofenol)
CH
3
O CH
3
CH
3
O CH
2
CH
2
Cl
eter dimetylowy
1-chloro-2-metoksyetan
CH
3
CH
2
CH
O
propanal
CH
3
CH
3
CH
2
CHCH
2
CH
O
3-metylopentanal
Zasady nazewnictwa
10
Nazw
ę aldehydu tworzy się dodając do nazwy macierzystego alkanu przyrostek –al.
Najdłu
ższy łańcuch z grupą –CHO stanowi strukturę podstawową, a atom węgla z tej grupy
oznacza si
ę jako C1.
W przypadku niektórych prostych aldehydów stosuje si
ę nazwy zwyczajowe, np.:
formaldehyd, benzaldehyd.
12. Ketony
(charakterystyczna grupa
w cz
ąsteczce)
Nazw
ę ketonów tworzy się od nazwy macierzystego alkanu dodając przyrostek –on
poprzedzony numerem atomu w
ęgla z grupą karbonylową. Najdłuższy łańcuch z grupą
ketonow
ą uznaje się za strukturę podstawową, a numerowanie atomów węgla rozpoczyna się
od ko
ńca bliższego karbonylowego atomu węgla.
W przypadku niektórych prostszych zwi
ązków z tej grupy nazwy tworzy się wymieniając
w kolejno
ści alfabetycznej nazwy grup połączonych z grupą karbonylową poprzedzając je
słowem „keton”.
CHO
benzaldehyd
HCH
O
formaldehyd
CH
3
CH
2
CH
2
CCH
3
O
pentan-2-on
CH
3
CH
2
CCH
3
O
butan-2-on
(keton etylowo-metylowy)
CH
3
CHCCH
3
O
CH
3
3-metylobutan-2-on
O
C
CH
3
CCH
3
O
propanon
(keton dimetylowy,
aceton)
Zasady nazewnictwa
11
13. Kwasy karboksylowe
(charakterystyczna grupa –COOH w cz
ąsteczce)
Nazwy systematyczne kwasów karboksylowych tworzy si
ę dwojako:
1
o
sposób
Do nazwy macierzystego alkanu z ko
ńcówką –owy dodaje się słowo kwas, a atom węgla
w grupie karboksylowej jest oznaczany jako C1.
2
o
sposób
Nazwa ła
ńcucha głównego nie obejmuje grupy karboksylowej, a atom węgla, do którego
przyczepiona jest grupa karboksylowa, jest oznaczany jako C1. Do nazwy macierzystego
alkanu dodaje si
ę wówczas słowo kwas i końcówkę -karboksylowy.
W przypadku tej grupy zwi
ązków stosowane są często nazwy zwyczajowe, np.: kwas
mrówkowy, octowy, propionowy, benzoesowy.
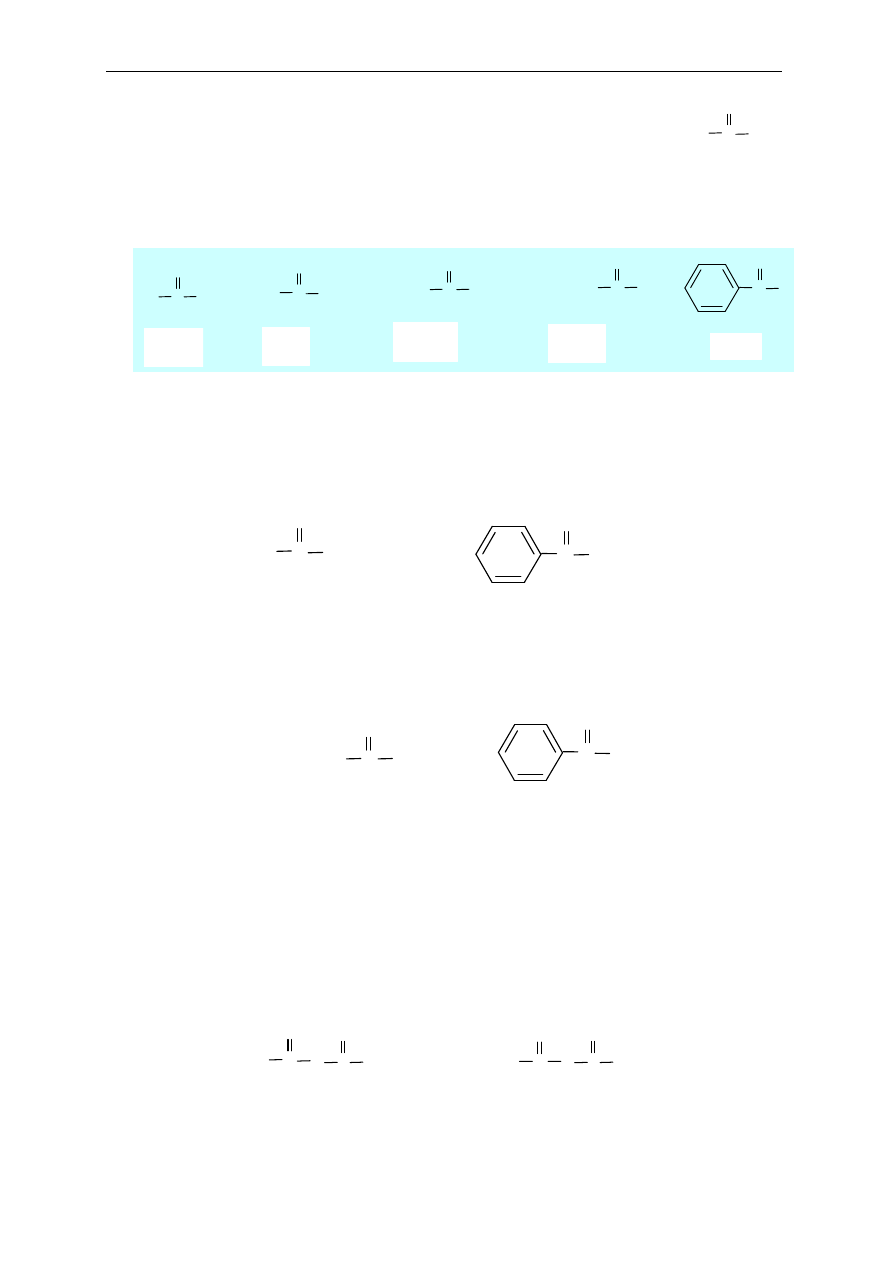
14. Pochodne kwasów karboksylowych
(halogenki kwasowe, bezwodniki kwasowe, estry,
amidy)
CH
3
CH
3
CHCH
2
COOH
kwas 3-metylobutanowy
kwas 2-metylopropanokarboksylowy
COOH
kwas benzoesowy
HCOOH
kwas mrówkowy
CH
3
COOH
kwas octowy
R C
O
OH
R C
O
X
R C
O
O
O
R
C
R C
O
O R'
R C
O
NH
2
Kwas
Halogenek
kwasowy
Bezwodnik
kwasowy
Ester
Amid
Zasady nazewnictwa
12
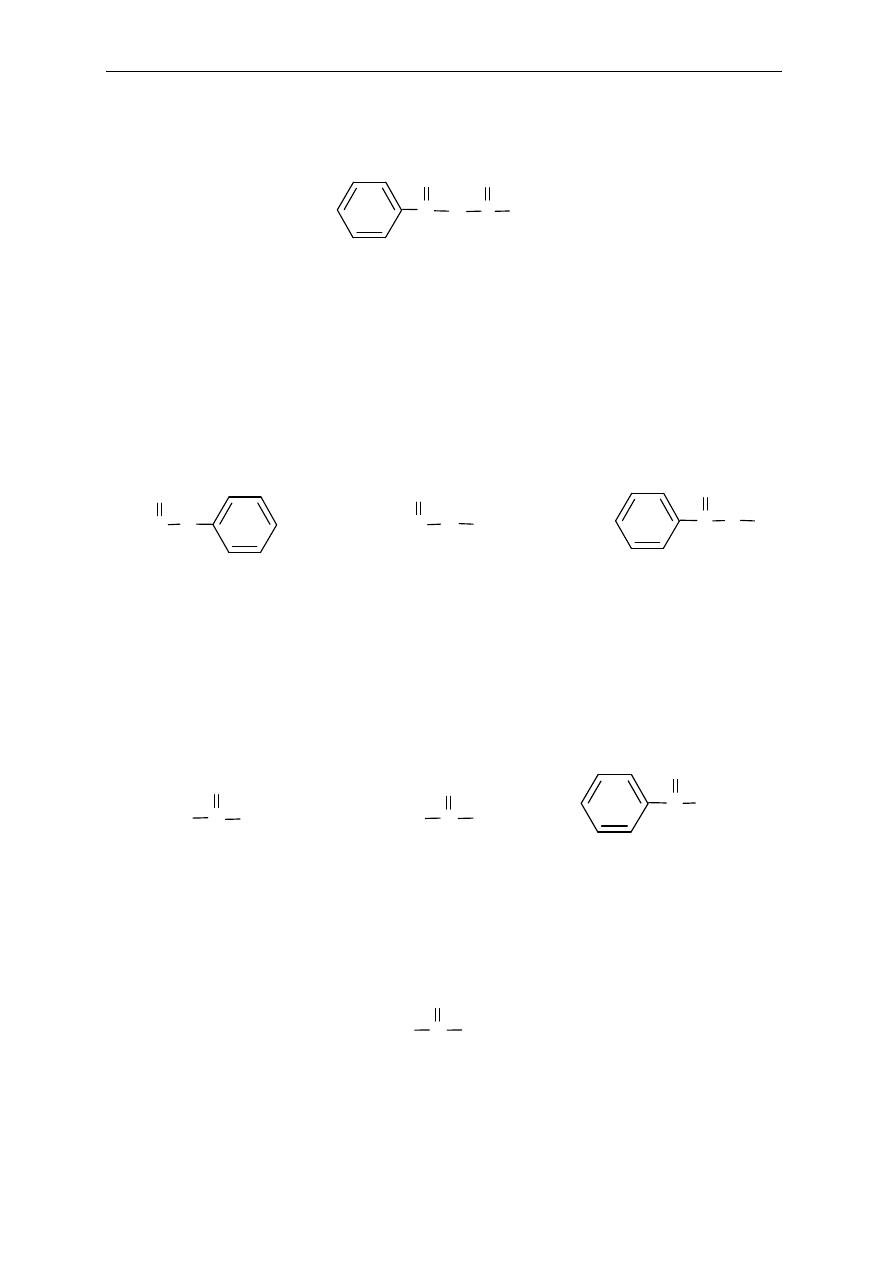
Pochodne kwasów karboksylowych zawieraj
ą charakterystyczną grupę acylową
.....
Nazw
ę tej grupy tworzy się od nazwy macierzystego alkanu dodając końcówkę –oil lub
stosuj
ąc nazwy zwyczajowe.
Przykłady grup acylowych:
Halogenki kwasowe
Nazwy halogenków kwasowych tworzy si
ę podając nazwę odpowiedniego halogenku i grupy
acylowej (systematyczn
ą lub zwyczajową).
Zwi
ązki te można również nazywać w oparciu o nazwę kwasu macierzystego poprzedzając ją
nazw
ą odpowiedniego halogenku.
Bezwodniki kwasowe
W przypadku bezwodników symetrycznych (otrzymywanych z takiego samego kwasu
karboksylowego) nazwy tworzy si
ę, zastępując słowo kwas słowem bezwodnik lub dodając
słowo bezwodnik do nazwy macierzystego kwasu.
R C
O
CH
3
C
O
O
C
Cl
Br
Chlorek etanoilu
Chlorek acetylu
Bromek benzoilu
CH
3
CH
2
C
O
Br
O
C Cl
Bromek kwasu
propanowego
Chlorek kwasu
benzoesowego
CH
3
CH
2
C
O
O C CH
2
CH
3
O
CH
3
C
O
O C CH
3
O
Bezwodnik kwasu propanowego
Bezwodnik octowy
CH
3
CH
2
C
O
CH
3
C
O
H C
O
CH
3
CH
2
CH
2
C
O
O
C
Metanoil
Formyl
Etanoil
Acetyl
Propanoil
Propionyl
Butanoil
Butyryl
Benzoil
Zasady nazewnictwa
13
Bezwodniki niesymetryczne (otrzymywane z ró
żnych kwasów karboksylowych) nazywa się
podobnie, przy czym nazwy kwasów podaje si
ę w porządku alfabetycznym.
Estry
W nazwie estru okre
śla się część kwasową i alkilową (wprowadzoną w miejsce atomu
wodoru w kwasie). Cz
ęść kwasowa ma końcówkę –an lub –ian zamiast końcówki –owy
wyst
ępującej w nazwie kwasu macierzystego, część alkilowa natomiast podawana jest
w dopełniaczu.
Amidy
Nazwy amidów tworzy si
ę, dodając do nazwy macierzystego alkanu końcówkę –oamid
lub zamieniaj
ąc końcówkę –yl (-oil) w nazwie grupy acylowej na przyrostek –amid.
Zwi
ązki te można także określać poprzedzając nazwę macierzystego kwasu karboksylowego
słowem
amid.
O
C
O C CH
3
O
Bezwodnik benzoesowo-octowy
CH
3
CH
2
C
O
O
CH
2
CH
3
O
C
CH
3
O
CH
3
C
O
O
Propanian etylu
Benzoesan metylu
Octan fenylu
CH
3
CH
2
CH
2
C
O
CH
3
C
O
NH
2
NH
2
O
C NH
2
Acetamid
Butanoamid
Benzamid
CH
3
CH
2
C
O
NH
2
Amid kwasu propanowego
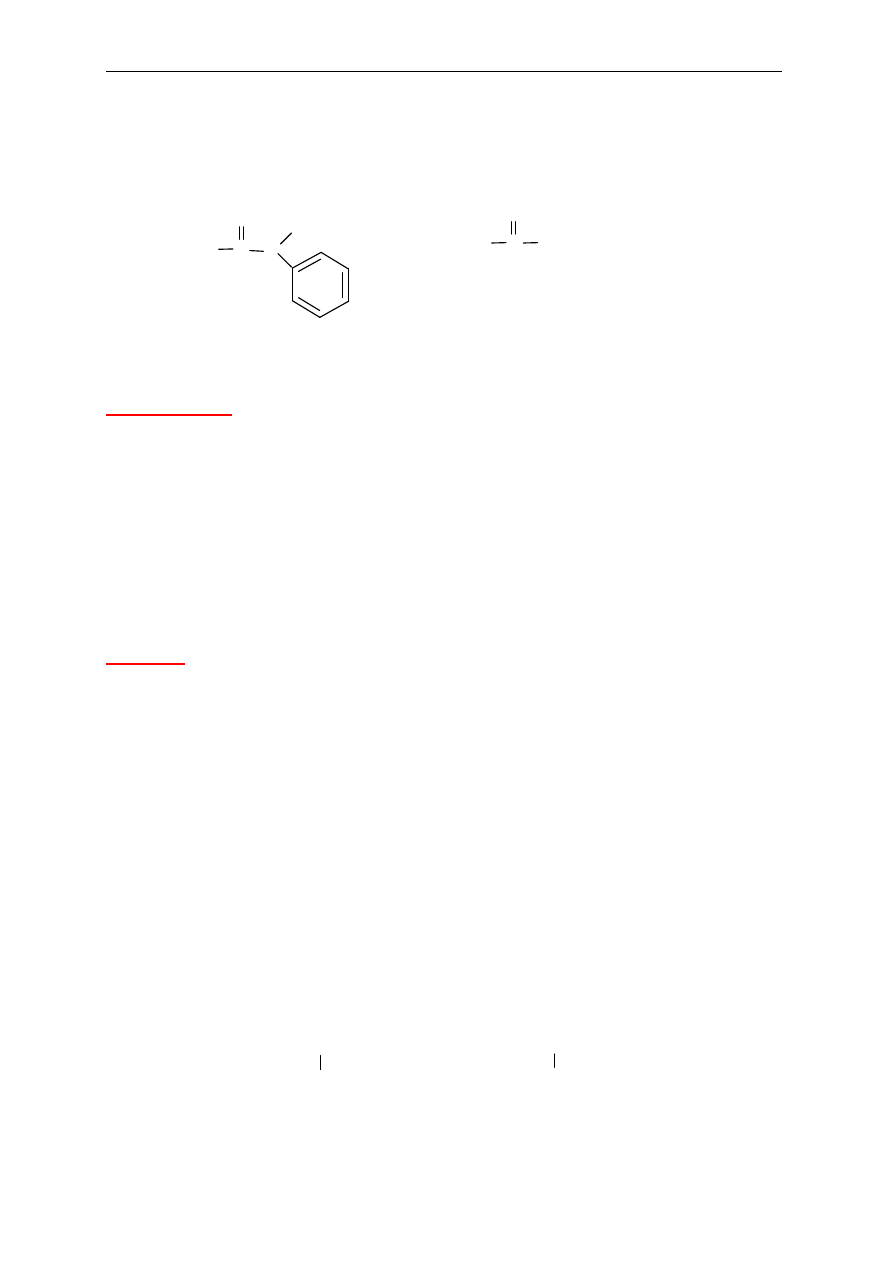
Zasady nazewnictwa
14
W przypadku amidów podstawionych najpierw okre
śla się podstawniki przy atomie azotu
a nast
ępnie podaje nazwę amidu macierzystego. Nazwę podstawników poprzedza się
lokantem „N” co oznacza bezpo
średnie podstawienie przy atomie azotu.
14. Nitrozwiązki
(charakterystyczna grupa –NO
2
w cz
ąsteczce)
Do nazwy macierzystego w
ęglowodoru dodaje się przedrostek nitro-. Grupę nitrową traktuje
si
ę jako podstawnik, a jej pozycję podaje się wymieniając numer atomu węgla,
z którym jest ona zwi
ązana.
15. Aminy
Aminy alifatyczne
Aminy pierwszorzędowe (charakterystyczna grupa —NH
2
w cz
ąsteczce)
Nazwy tworzy si
ę przez dodanie przyrostka –amina do nazwy podstawnika alkilowego.
Amin
ę można potraktować również jako pochodną węglowodoru, zwłaszcza
w przypadku amin zawieraj
ących inne grupy funkcyjne. Wówczas grupę -NH
2
mo
żna
wymieni
ć jako podstawnik aminowy oraz określić jego pozycję w związku macierzystym.
CH
3
CH
2
CH
2
NO
2
1-nitropropan
CH
2
CH
2
NH
2
etyloamina
CH
3
CH
2
CHCOOH
NH
2
kwas 2-aminobutanowy
CH
3
CH
2
CH
2
CHCH
3
NH
2
2-aminopentan
CH
3
C
O
N
H
H C
O
N(CH
3
)
2
N-fenyloacetamid
N,N-dimetyloformamid (DMF)
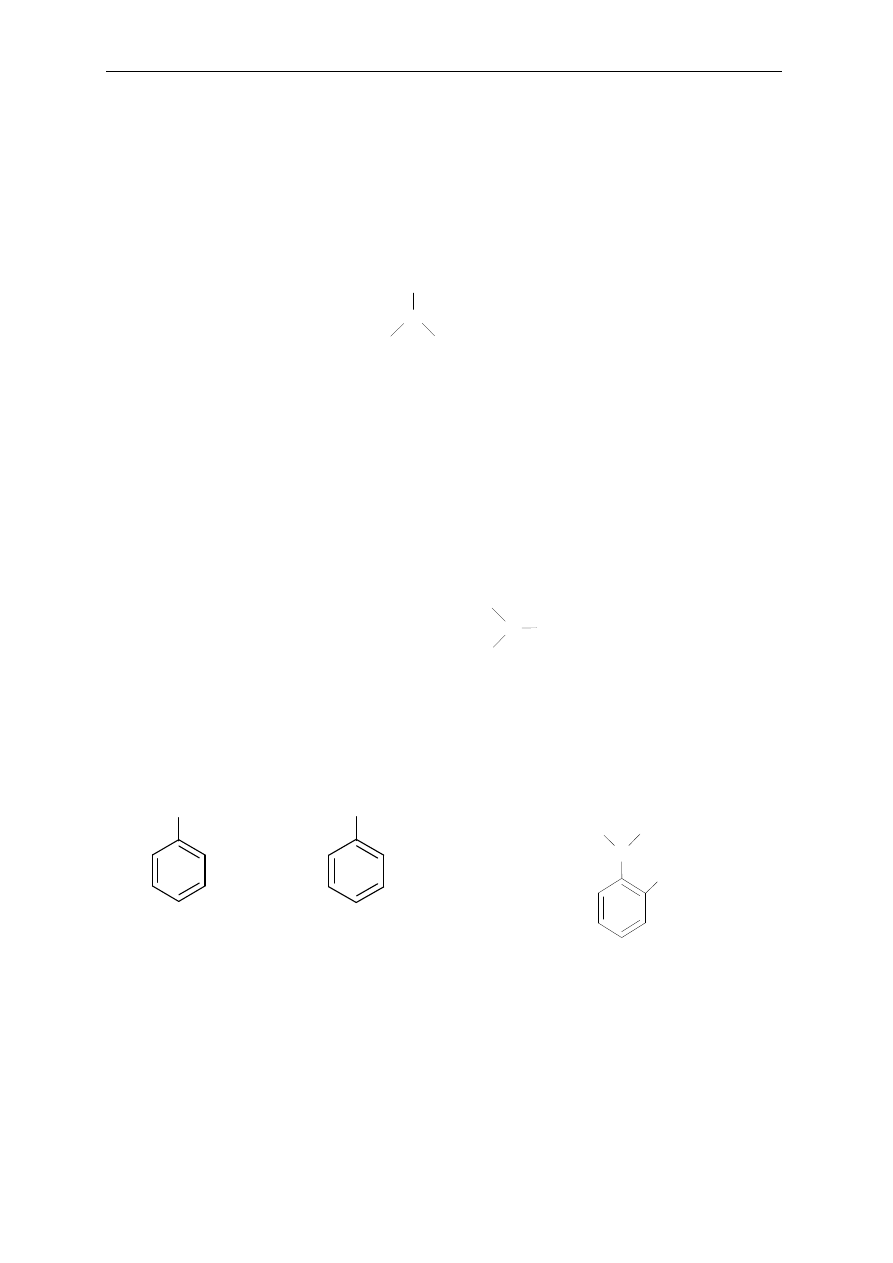
Zasady nazewnictwa
15
Aminy drugorzędowe i trzeciorzędowe (charakterystyczne grupy w cząsteczce,
odpowiednio: —NH— lub —N— )
│
W przypadku symetrycznych amin do nazwy dodaje si
ę przedrostek di- lub tri-, np.:
difenyloamina, trietyloamina.
Aminy niesymetryczne drugorz
ędowe i trzeciorzędowe nazywa się jako N-podstawione
aminy pierwszorz
ędowe. Nazwę największej grupy alkilowej wybiera się za nazwę
macierzyst
ą, a pozostałe grupy traktuje jako N-podstawniki (dołączone do atomu azotu).
Aminy aromatyczne
Aminy aromatyczne traktuje si
ę jako pochodne aniliny (aminobenzen), a pozostałe grupy
jako N-podstawniki.
CH
3
CH
2
CH
2
NHCH
3
N-metylopropyloamina
CH
3
CH
N
CHCH
2
CH
2
CH
3
CH
3
N-etylo-N-metylobutyloamina
N
Br
CH
3
CHCH
3
2-bromo-N-etylo-N-metyloanilina
NH
2
anilina
NHCH
3
N-metyloanilina
CH
2
CH
3
N
CH
2
CH
3
CH
3
CH
2
trietyloamin

Zasady nazewnictwa
16
16. Związki zawierające w cząsteczkach różne grupy funkcyjne
Je
żeli w cząsteczce związku organicznego znajduje się kilka różnych grup funkcyjnych, to
nazw
ę systematyczną tworzy się w oparciu o zasady obowiązujące dla grupy związków o
grupie funkcyjnej maj
ącej pierwszeństwo, a inne grupy funkcyjne traktuje się jak
podstawniki.
Wybrane grupy funkcyjne, wyst
ępujące w cząsteczkach związków organicznych ułożone
według pierwsze
ństwa przedstawiono w Tabeli 1. Tabela zawiera również nazwy tych grup,
traktowanych jako podstawniki.
Przykłady:
Tabela 1. Wybrane grupy funkcyjne wyst
ępujące w związkach organicznych uszeregowane
według ich pierwsze
ństwa oraz nazwy tych grup traktowanych jako podstawniki.
Grupa funkcyjna
Klasa zwi
ązku
Nazwa podstawnika
-COOH
kwasy karboksylowe
karboksy
-COOR
estry
R-oksykarbonylo
np.
metoksykarbonylo
(R=CH
3
), etoksykarbonylo (R=C
2
H
5
) itd.
-CONH
2
amidy
karbamoilo
-CHO
aldehydy
formylo
>C=O
ketony
okso
-OH
alkohole, fenole
hydroksy
-NH
2
aminy
amino
-OR
etery
R-oksy, np. metoksy (R=CH
3
), etoksy
(R=C
2
H
5
) itd.
CH
3
CH
2
CHCOOH
NH
2
kwas 2-aminobutanowy
CH
3
CHCOOH
OH
kwas 2-hydroksypropanowy
(nazwa zwyczajowa: kwas mlekowy)
CH
2
CHCOOH
OH
NH
2
kwas 2-amino-3-hydroksypropanowy
CH
3
CHCH
2
CHCOOH
OH
OH
kwas 2,4-dihydroksypentanowy

Seminarium cz. I
17
2.
Seminarium, część I:
Zagadnienia
1. Klasyfikacja zwi
ązków organicznych na podstawie charakterystycznych grup
funkcyjnych.
2. Ogólne zasady nazewnictwa wybranych grup zwi
ązków organicznych:
- W
ęglowodory alifatyczne nasycone i nienasycone: alkany, alkeny, alkiny, cykloalkany,
cykloalkeny
- W
ęglowodory aromatyczne (areny)
- Halogenopochodne alkilowe i arylowe
- Alkohole, fenole, etery
- Aldehydy i ketony
- Kwasy karboksylowe i ich pochodne
- Zwi
ązki zawierające azot: związki nitrowe, aminy
3. Rz
ędowość atomów węgla w związkach organicznych, rzędowość alkoholi i amin.
4. Polaryzacja wi
ązań w związkach organicznych: efekty indukcyjny i mezomeryczny.
5. Izomeria zwi
ązków organicznych:
- izomeria konstytucyjna (ła
ńcuchowa, położeniowa, grup funkcyjnych)
- izomeria geometryczna (izomery
cis-trans, konfiguracja podstawników Z-E)
BUDOWA I NAZEWNICTWO ZWIĄZKÓW ORGANICZNYCH
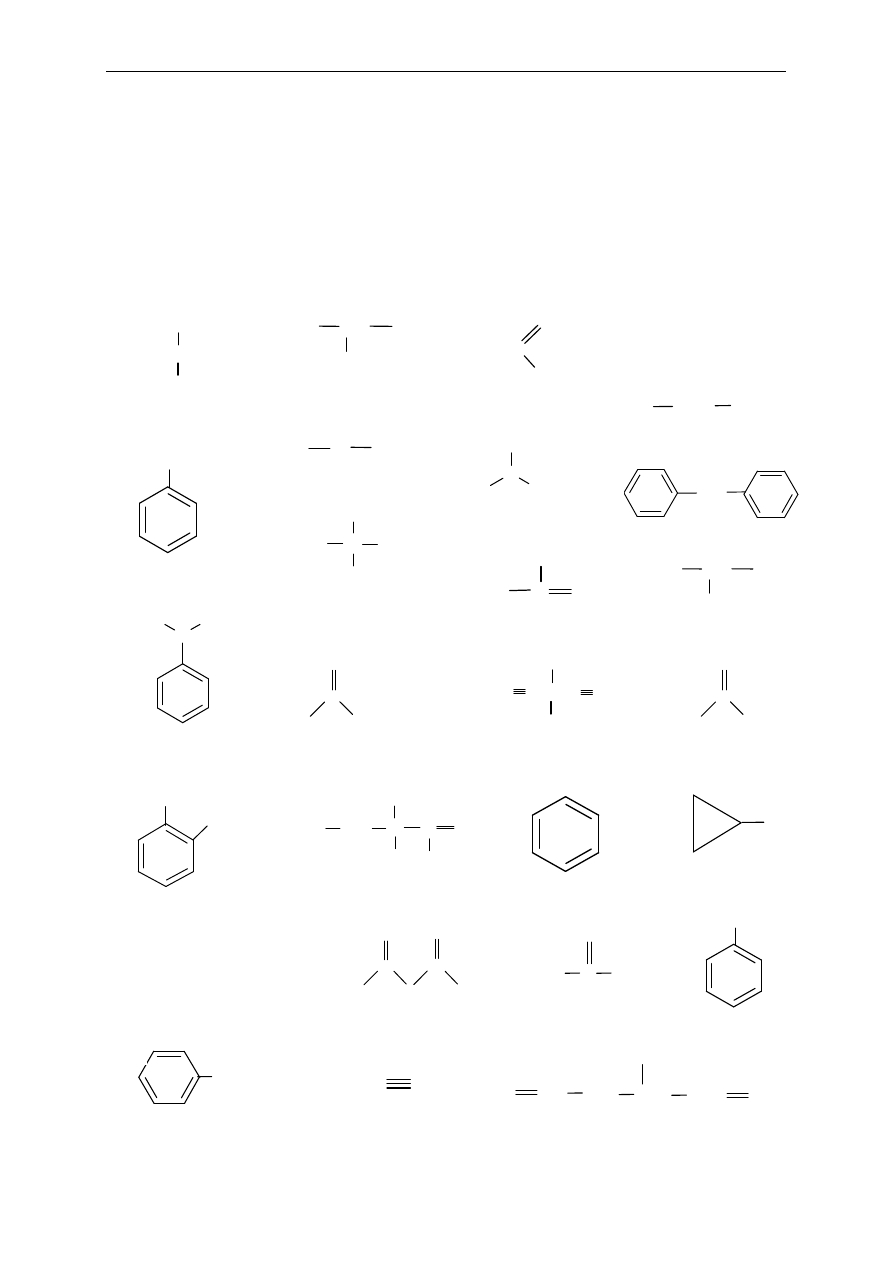
Seminarium cz. I
18
KLASYFIKACJA ZWIĄZKÓW ORGANICZNYCH
Zadania
1. Do jakich klas zwi
ązków organicznych należą te, których wzory pokazano poniżej?
Zaznacz i nazwij grupy funkcyjne wyst
ępujące w niektórych spośród podanych związków.
CH
3
CH
3
CH
3
-C-CH
3
H
3
C
CH
3
NH
2
CH
Cl
CH
3
C
O
NH
2
H
3
C
O
C
2
H
5
H
3
C
CH
3
CH
3
NH
2
C
CH
3
CH
2
COOH
CH
3
-CH
2
-NO
2
CH
3
N
CH
3
CH
3
CH
3
H
C
O
N
CH
3
C
H
3
CH
3
C-C-C
CH
3
CH
3
-C
CH
C
O
H
3
C
CH
2
CH
3
C
O
H
3
C
OCH
3
CH
2
H
3
C
CH
3
Br
CH
CH
3
OH
CH
3
H
3
C
C
CH
2
Cl
C
O
CH
3
CH
3
-CH=CH-CH
3
Cl
C
O
H
5
C
2
O
C
O
C
2
H
5
CH
2
OH
CHO
CH
3
C
N
C
O
H
H
CH
2
CH CH
2
CH
CH
CH
2
CH
2
Cl
a)
b)
c)
d)
e)
f)
g)
h)
i)
j)
k)
l)
m)
n)
o)
p)
r)
s)
t)
u)
w)
y)
z)
aa)
bb)
cc)
dd)
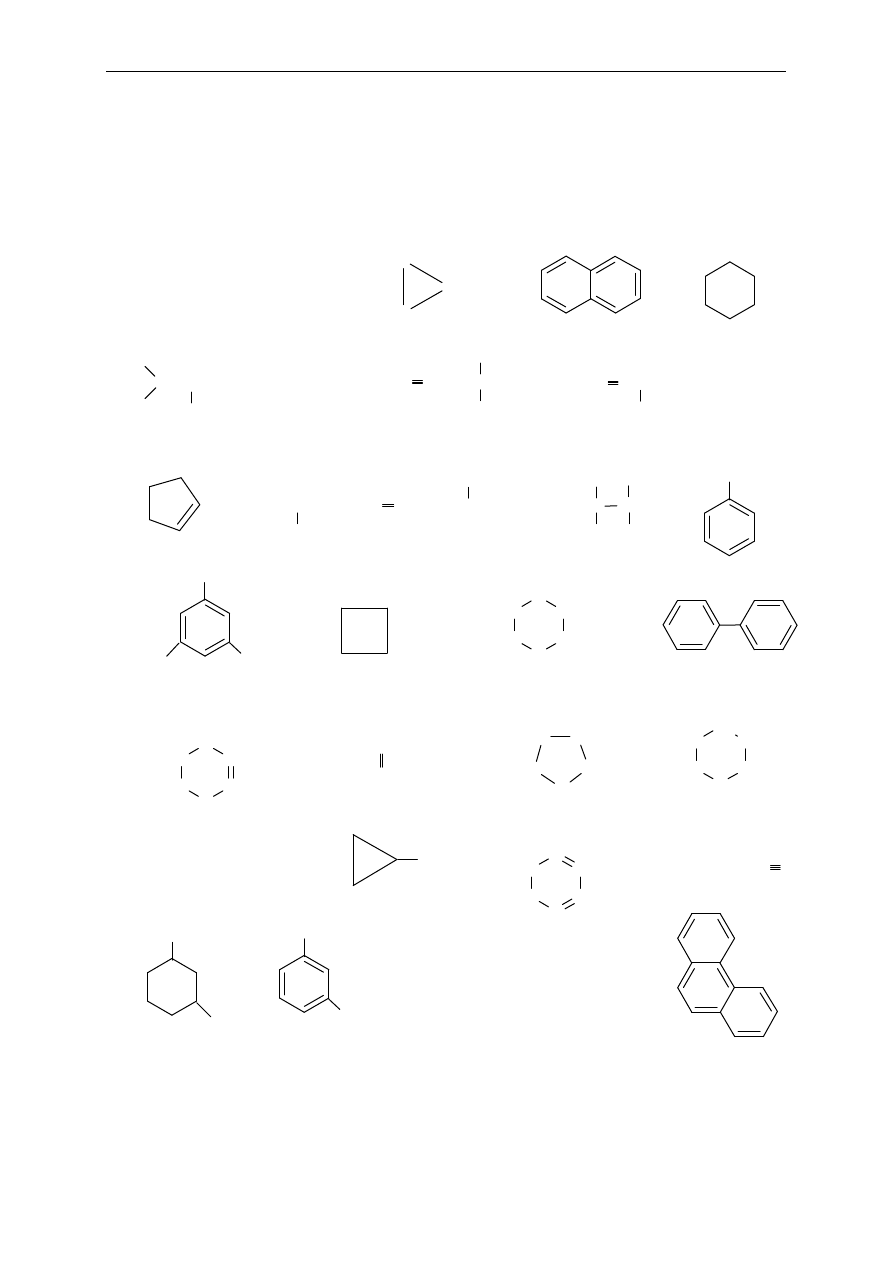
Seminarium cz. I
19
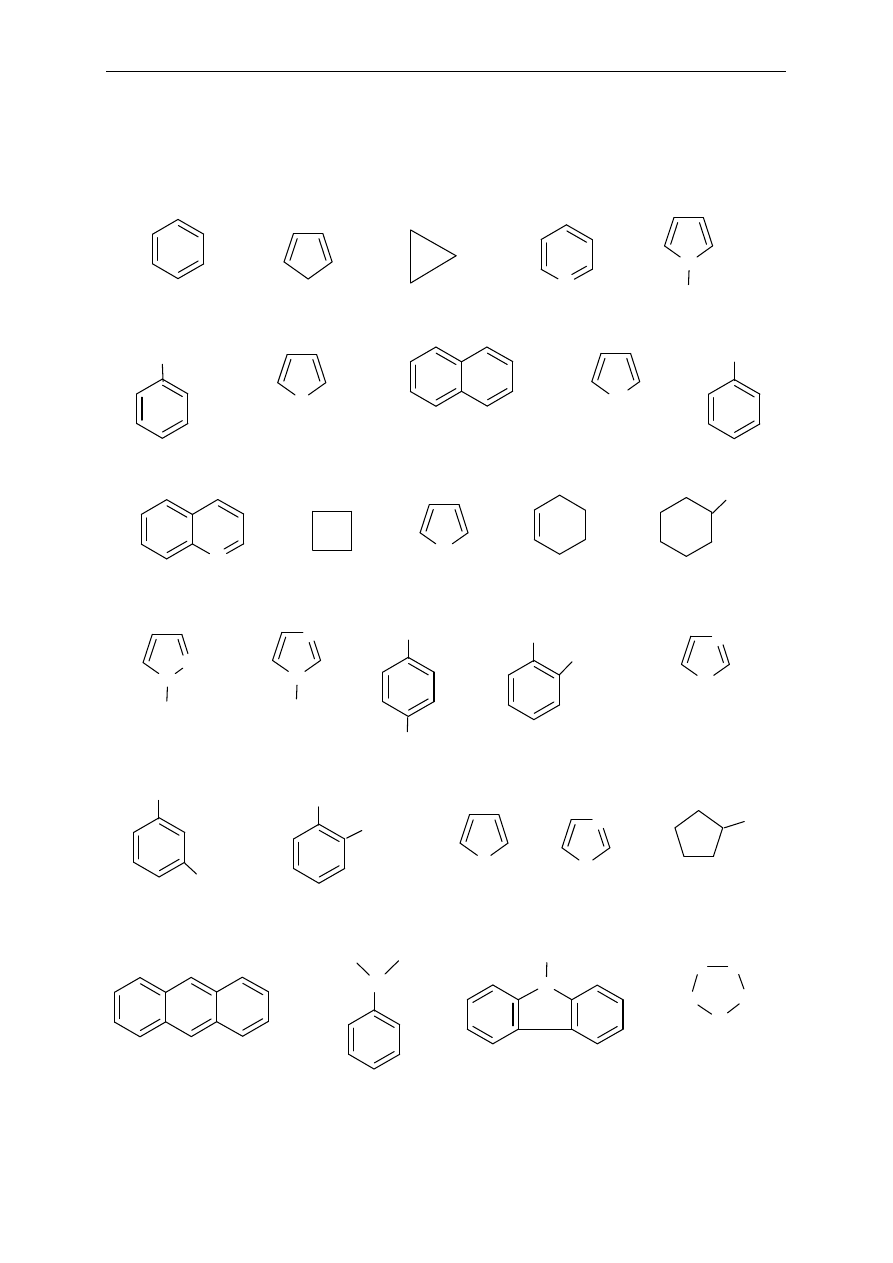
2. Poda ne wz o r y prz eds taw iaj
ą cząsteczki różnych węglowodorów. Jak można
je
z a kla s yf iko w a
ć? Podaj jak najwięcej informacji o każdym
z prz edst a wion yc h z wi
ązków (nasycony, nienasycony, łańcuchowy,
c yk licz n y, a rom at yc z n y, al ka n, alk en , alki n, it d. ).
CH
3
CH C-CH-CH
2
-CH
3
CH
3
CH
3
CH
3
-C
CH
2
=CH-CH=CH
2
CH
3
CH
3
CH
3
CH
3
C-CH
3
CH
2
CH
3
-CH
2
-C-CH
2
-CH
3
CH
3
CH-CH-CH
3
CH
3
C-CH
2
-C-CH
3
CH
3
CH
3
-CH
2
-CH
2
-C
C
H
2
C
H
2
CH
2
CH
CH
C
H
2
C
H
2
C
H
2
C
H
2
C
H
2
C
H
2
CH
2
CH
2
C
H
2
C
H
2
CH
2
C
H
2
C
H
2
C
H
2
C
H
2
CH
3
H
3
C
CH
3
CH
3
CH
3
C
H
2
C
H
2
CH
2
CH-CH
3
C
H
2
CH-CH
3
CH
3
-CH
2
-CH
2
-CH
2
-CH
2
-CH
3
CH
3
CH-CH
2
-CH-CH
3
CH
3
CH
3
-CH-CH
2
-CH
C
H
C
H
CH
CH
C
H
2
C
H
2
CH
CH
3
-CH=CH-C
CH
3
CH
3
CH
3
CH
3
CH
2
=CH-CH=CH-CH=CH
2
a)
b)
c)
d)
e)
f)
g)
u)
w)
m)
n)
o)
p)
r)
s)
t)
h)
i)
j)
k)
l)
y)
z)
aa)
bb)
cc)
dd)
Seminarium cz. I
20
3. Poda ne wz or y p rz e dsta wi aj
ą związki pierścieniowe (cykliczne). Które
z nic h s
ą związkami homocyklicznymi (karbocyklicznymi), a które
het e ro c ykl icz n ym i? W
śród karbocyklicznych wskaż związki aromatyczne.
NH
2
NO
2
NO
2
N
H
N
N
O
N
N
H
N
N
H
O
N
NH
2
CH
3
NO
2
CH
3
S
Se
CH
Br
Br
H
3
C
CH
3
S
S
N
N
H
Br
CHCl
C
H
2
C
H
2
C
H
2
C
H
2
OH
CH
3
a)
b)
c)
d)
e)
f)
g)
h)
i)
j)
k)
l)
ł)
m)
n)
o)
p)
r)
s)
t)
u)
w)
y)
z)
aa)
bb)
cc)
dd)
ee)

Seminarium cz. I
21
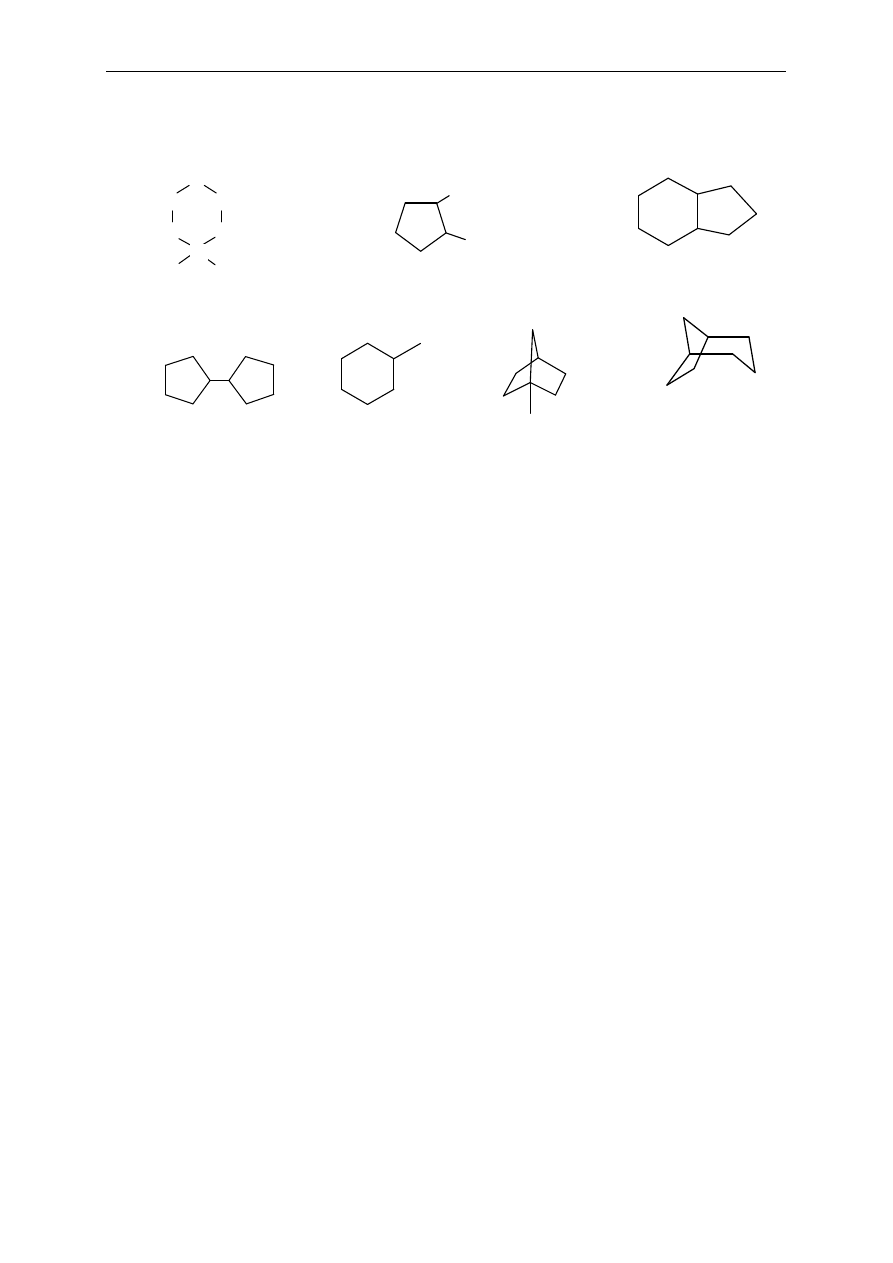
4. W
ęglowodory to podstawowe związki organiczne. Wszystkie bardziej
zło
żone związki można traktować jako ich pochodne. W cząsteczkach
pod an ych w
ęglowodorów zastąp atom (lub atomy) wodoru odpowiednimi
atom ami lub grup am i fu nk c yj n ymi t ak, ab y p ows tał y z ni ch inn e zwi
ązki
or gani czn e.
W ka
żdym przypadku sprawdź, czy istnieje kilka możliwości.
Uwagi : 1 ) Li cz ba at omów węgla w prz ekształ con ych cz ąst ecz ka ch powin na
być ta ka sama, j ak w czą stecz ka ch wyj ś ciow ych w ęgl owod or ów;2 )zwi ąz ki
łań cu chow e
po
p r zekszt ał cenia ch
po winn y
pozo sta ć
ł ańcuchow ymi,
pier ścieniow e - pi erści en iow ym, nas ycone-n as ycon ymi , a nienas ycon e–
nienas ycon ymi.
a)
alk en o 5 atom ach w
ęgla przekształć w alkohol;
b) alk an o 5 atom ach w
ęgla przekształć w kwas karboksylowy;
c)
alk an o 3 atom ach w
ęgla przekształć w eter;
d) c yk lo alk an o 6 atom ach w
ęgla przekształć w chloropochodną;
e)
alk an o 3 atom ach w
ęgla przekształć w ester;
f)
alk an o 3 atom ach w
ęgla przekształć w keton;
g) alk an o 4 atom ach w
ęgla przekształć w amid kwasowy;
h) c yk lo alk an o 5 atom ach w
ęgla przekształć w diol;
i)
benz en prz ek ształ
ć w aminę pierwszorzędową;
j)
alk en o 4 atom ach w
ęgla przekształć w bromopochodną;
k) alk an o 2 atom ach w
ęgla przekształć w chlorek kwasowy;
l)
alk an o 3 atom ach w
ęgla przekształć w nitryl;
m) alk an o 6 atom ach w
ęgla przekształć w bezwodnik kwasowy;
n) alk en o 9 atom ach w
ęgla przekształć w bromochloropochodną
o) alk an o 5 atom ach w
ęgla przekształć aminę II-rzędową;
p) alk an o 3 atom ach w
ęgla przekształć w triol;
q) benz en prz ek ształ
ć w dichloropochodną;
r)
alk an o 4 atom ach w
ęgla przekształć w hydroksykwas;
s)
benz en prz ek ształ
ć w dibromochloropochodną;
t)
alk an o 7 atom ach w
ęgla przekształć w aminokwas;
u) c yk lo alk an o 3 atom ach w
ęgla przekształć w związek nitrowy;
v) alk an o 5 atom ach w
ęgla przekształć w aminę trzeciorzędową
w) alk an o 1 atomi e w
ęgla przekształć w aldehyd.

Seminarium cz. I
22
NAZEWNICTWO ZWIĄZKÓW ORGANICZNYCH
Zadania
1. Węglowodory
1. Narysuj zwi
ązki zgodnie z nazwą:
a) 3-etylo-4,4-dimetyloheptan
b) 2,2,3,3–tetrametylopentan
c) 2,3,5-trimetylo-4-propyloheptan
d) 4–etylo–3,4,7,8–tetrametylodekan
e) 3-izopropylo-2-metylooktan
f) 1-etylo-2-metylocyklopentan
g) 2,3–dimetylobut-2-en
h) pent-2-yn
i) 2,4,4-trimetylopent-2-en
j) 3,6-dimetylookt-1-en
k) hept-3-yn
l) 5-(1,2-dimetylobutylo)-2,3,3,9-tetrametylodek-1-en
m) 3-metylocykloheksen
n) 3,4-dimetylocyklopenten
o) 1,3,5–trimetylobenzen
p) 1,3-dietylobenzen
q)
p-ksylen
2. Podaj nazwy systematyczne nast
ępujących węglowodorów:
a) (CH
3
)
2
CHCH
2
CH
2
CH(C
2
H
5
)
2
,
b) (C
2
H
5
)
2
C(CH
3
)CH
2
CH
3
,
c) CH
3
CH
2
CH(CH
3
)CH(CH
3
)CH(CH
3
)
2
,
d) CH
3
CH
2
CH(CH
3
)CH
2
C(CH
2
CH
2
CH
3
)(CH
2
CH
3
)
2
,
e) CH
3
CH
2
C(CH
3
)
2
(CH
2
)
4
CH
3
,
f) (CH
3
)
3
CCH
2
CH
3
,
g) (CH
3
CH
2
)
2
C=CH
2
,
h) CH
3
CH
2
CH=CHCH
2
CH
3
,
i) (CH
3
)
3
CCH=CH
2
,
j) (CH
3
)
2
CHCH=CHCH(CH
3
)
2
,

Seminarium cz. I
23
k) (CH
3
)
2
CHCH
2
CH=C(CH
3
)
2
,
l) CH
3
CH(CH
3
)C
≡
CCH(CH
3
)CH
3
,
m)
HC
≡
CC(CH
3
)
3
.
3. Poni
ższe nazwy nie są prawidłowe. Narysuj wzory strukturalne związków
odpowiadaj
ące każdej z tych nazw i podaj nazwy właściwe.
a) 2,2-dimetylo-6-etyloheptan,
b) 3-etylo-4,4-dimetyloheksan,
c) 2-izopropylo-4-metyloheptan,
d) 5,5,6-trimetylooktan,
e) 2-metylopent-3-en,
f) 2-etyloheks-4-en,
g) 3-etylo-2-metylocyklopenten.
4. Nazwij nast
ępujące związki i podaj rzędowość atomów węgla:
a) C(CH
3
)
4
b) (CH
3
)
2
CHCH
2
CH
2
CH
3
,
c) (CH
3
)
2
CHCH(CH
2
CH
3
)
2
,
d)
(CH
3
)
2
CHC(CH
3
)
2
CH
2
CH
3
,
e)
(CH
3
)
3
CCH
2
CH
2
CH(CH
3
)
2
,
f)
CH
3
CH
2
CH
2
CH(CH
3
)CH
2
C(CH
3
)
2
CH
2
CH
3
,
g) CH
3
CH
2
CH(CH
3
)CH
2
C(CH
3
)(CH
2
CH
3
)CH
2
CH
2
CH
3
,
h) CH
3
CH
2
CH
2
C(CH
3
)(CH(CH
3
)
2
)CH(CH
3
)CH
2
CH
3
.
5. Podaj przykład alkanu, który:
a) ma tylko pierwszorz
ędowe atomy węgla,
b) ma jedynie pierwszorz
ędowe i trzeciorzędowe atomy węgla,
c) ma jeden czwartorz
ędowy i jeden drugorzędowy atom węgla,
d) ma dwa trzeciorz
ędowe atomy węgla, a nie ma w ogóle drugorzędowych.
Seminarium cz. I
24
6. Okre
śl rzędowość atomów węgla w następujących związkach:
.
7. Narysuj wzory strukturalne cykloalkanów o podanym wzorze sumarycznym spełniaj
ących
poni
ższe kryteria:
a) w
ęglowodór C
6
H
12
, który ma jeden pierwszorz
ędowy i jeden trzeciorzędowy atom węgla,
b) w
ęglowodór C
6
H
12
, który ma dwa pierwszorz
ędowe i jeden czwartorzędowy atom węgla,
c) w
ęglowodór C
6
H
12
, który ma dwa pierwszorz
ędowe i dwa drugorzędowe atomy węgla.
2. Halogenopochodne węglowodorów
8. Narysuj zwi
ązki zgodnie z nazwą:
a)
chloroetan
b)
2-bromopropan
c)
2-bromo-2-metylopentan
d)
3-bromo-2,3-dimetylopentan
e)
2,3,3,4–tetrachloroheksan
f)
1–bromo–3–chloro–2,2–dimetylobutan
g)
3,3,5,5–tetrachloro-2,6–dimetyloheptan
h)
1,6–dichloro–3,4,4,5,6–pentametylooktan
i)
5-(1-chloroetylo)-5-chloro-3,4-dimetylooktan
j)
1-bromo-2-metylocyklobutan
k)
3-chloroprop-1-en
l)
3-bromobut-1-en
m)
2-chloroheks-3-yn
n)
5-chloro-4,7-dietylo-3,3,8-trimetylodek-1-en
o)
p-bromotoluen (1-bromo-4-metylobenzen)
c.
g.
f.
e.
a.
CH
3
H
3
C
CHCH
2
CH
3
CHCH
3
CH
2
H
2
C
H
2
C
C
d.
b.
CH
3
C(CH
3
)
3

Seminarium cz. I
25
p)
chlorobenzen
q)
o-dibromobenzen
r)
m-dichlorobenzen
s)
3,5-dibromotoluen
9. Podaj nazwy systematyczne poni
ższych związków:
a) (CH
3
)
2
CHCH
2
CH
2
CH(Br)CH
3
b) CH
3
CH(Br)CH
2
CH
2
CH(Cl)CH
3
c) CH
3
CH(Br)CH
2
CH
2
C(Cl)
2
CH
3
d) CH
3
CH=CHCH
2
Br
e) CH
2
(Br)CH=CHCH
2
I
f) CH(Cl)
2
C
≡
CCH
2
CH
3
g) (CH
3
)
2
C=CHCCl
3
h) CH
3
CH=C(Cl)CH(CH
2
CCl
3
)CH
2
CH
3
3. Inne grupy związków organicznych
10. Narysuj zwi
ązki zgodnie z nazwą:
a)
propan-2-ol
b)
3-metylobutan-1-ol
c)
2,2-dimetylopropan-1-ol
d)
m–jodofenol (1-hydroksy-3-jodobenzen)
e)
2,4,6–trinitrofenol (1-hydroksy-2,4,6-trinitrobenzen)
f)
3-chloropentan-2-ol
g)
p-metoksyfenol
h)
eter dimetylowy (metoksymetan)
i)
eter etylowo-metylowy (metoksyetan)
j)
eter butylowo-propylowy (propoksybutan)
k)
eter fenylowo-metylowy (metoksybenzen)
l)
2-metylobutanal
m)
pentan-3-on (keton dietylowy)
n)
2,2-dimetylocyklopentanon
o)
2-hydroksybenzenokarboaldehyd (aldehyd o-hydroksybenzoesowy)
p)
fenyloetanal
q)
1-fenylopropan-2-on (keton benzylowo-metylowy)
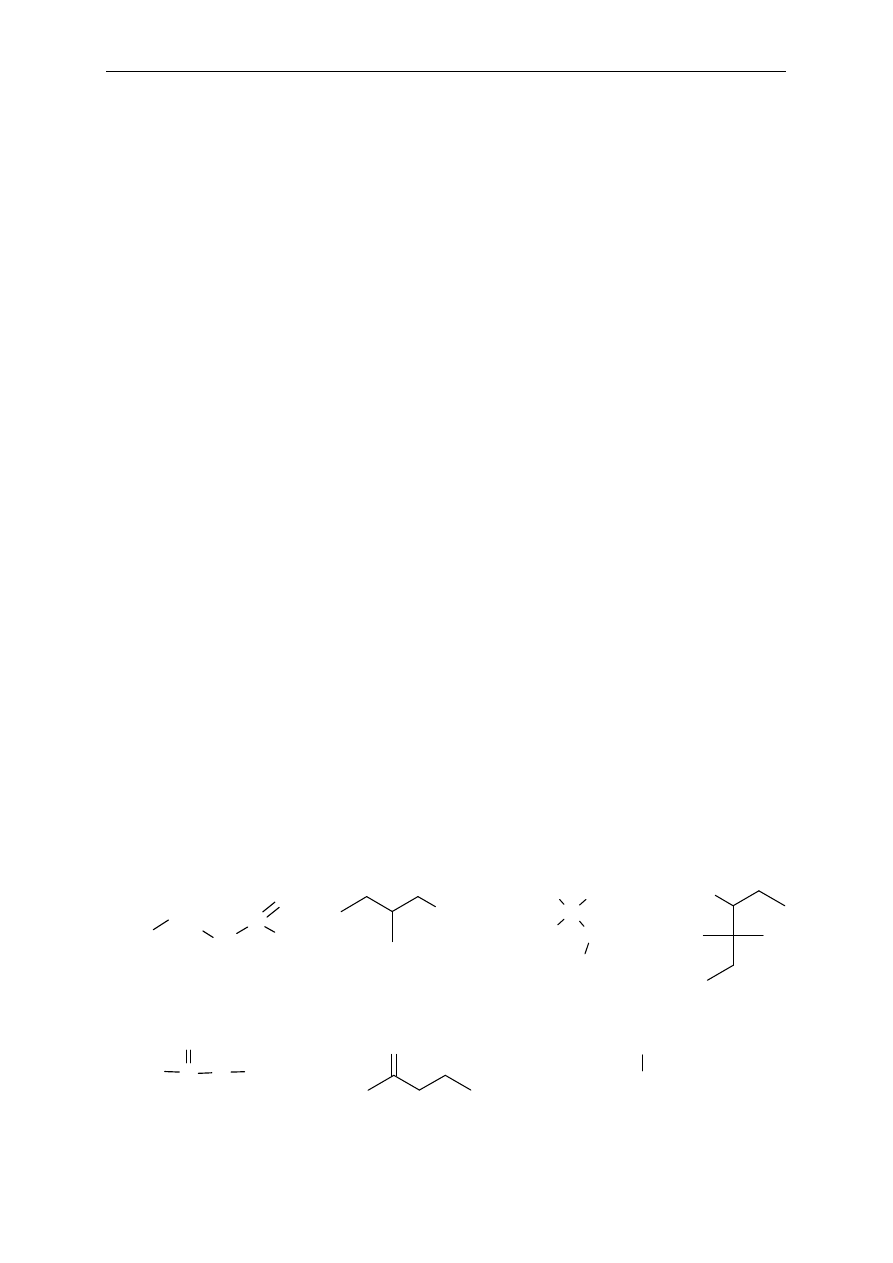
Seminarium cz. I
26
r)
kwas propionowy (kwas propanowy)
s)
kwas 3-chloro-2,2-dimetylopropanowy
t)
chlorek butanoilu,
u)
bromek formylu
v)
bezwodnik propanowy
w)
kwas
o-aminobenzoesowy
x)
kwas
o–chlorobenzoesowy
y)
kwas
p–hydroksybenzoesowy
z)
bezwodnik benzoesowy
aa)
bezwodnik mrówkowo-pentanowy
bb)
benzoesan fenylu
cc)
mrówczan butylu
dd)
heksanoamid
ee)
kwas 2–amino–5–bromo–3–nitrobenzoesowy
ff)
kwas 3,5–dinitrobenzenosulfonowy
gg)
N-etylo-N-metylopropanoamid
hh)
N-metylo-3-chlorobutanoamid
ii)
nitrometan
jj)
2-chloro-1-nitropropan
kk)
2-(N-metylo-N-propyloamino)butan
ll)
trietyloamina
mm) difenyloamina
nn)
2-metylopropyloamina (izobutyloamina)
oo)
N,N-dimetylopropyloamina
pp)
p-dinitrobenzen
qq)
m–bromonitrobenzen
rr)
m–nitrotoluen (1-metylo-3-nitrobenzen)
ss)
p–bromoanilina
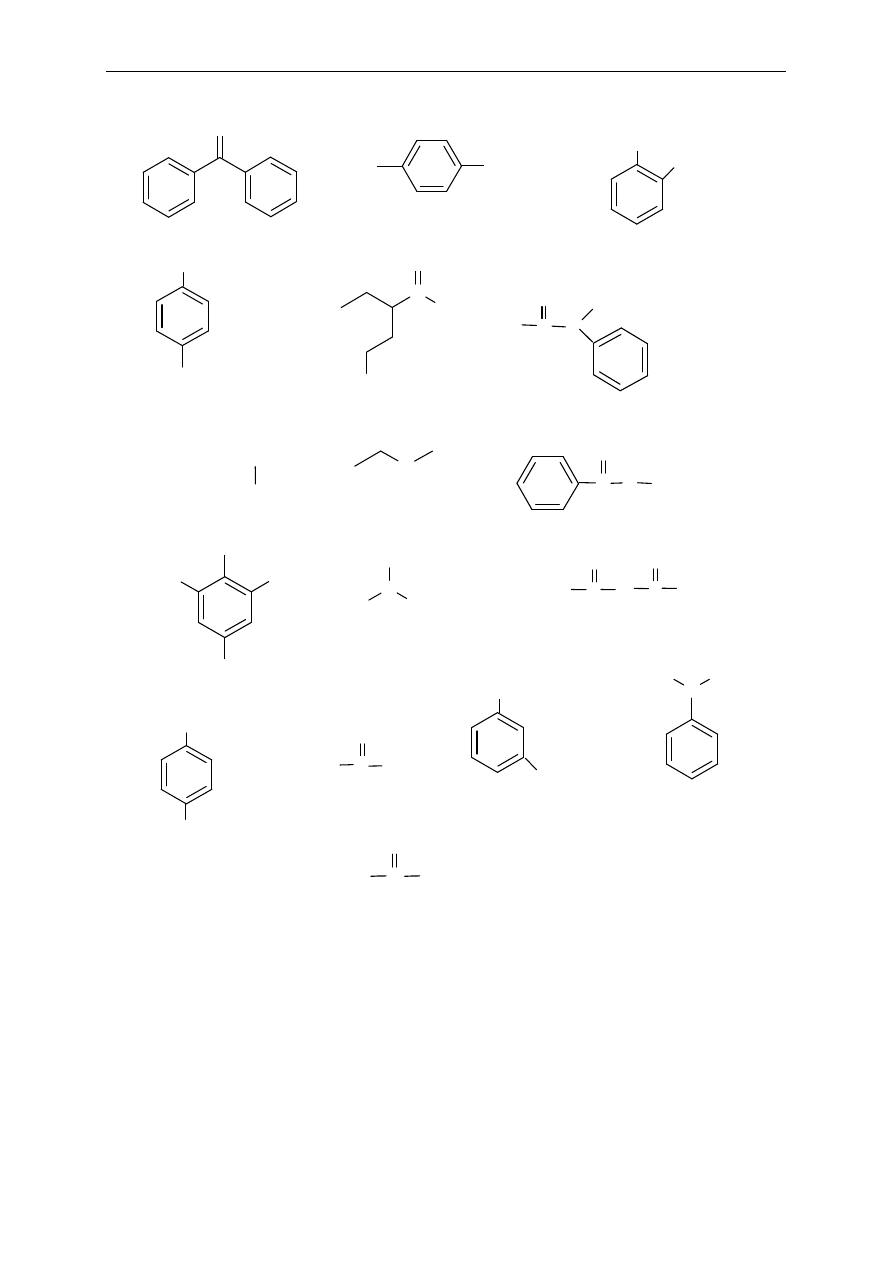
11. Nazwij poni
ższe związki:
a.
CH
3
CH
2
CH
2
C
H
O
f.
O
c.
CH
3
CH
2
C
CH
3
CH
3
O
2
N
g.
CH
3
CH
2
CH
2
CHNH
2
CH
2
CH
3
d.
O
2
N
b.
COOH
e.
CH
3
C
O
O
CH
2
CH
3
Seminarium cz. I
27
12. Podaj nazwy alkoholi i okre
śl ich rzędowość:
a) CH
3
CH
2
CH
2
OH,
b) CH
3
CH(OH)CH
2
CH
3
,
c) (CH
3
)
2
C(OH)CH
3
,
d) CH
3
CHClCH(OH)CH(CH
3
)
2
,
e) CH
3
CHClCH(CH3)CH(CH
3
)CH
2
OH.
h.
O
j.
OH
COOH
i.
Br
COOH
n.
(CH
3
)
2
CHCH
2
CHC
6
H
5
OH
l.
C
H
O
Cl
v.
SO
3
H
NO
2
x.
N
CH
3
C
H
3
q.
CH
3
N
CH
3
CH
3
k.
SO
3
H
CH
3
r.
OH
NO
2
NO
2
O
2
N
o.
N
H
t
NO
2
CH
3
p.
O
C
CH
2
CH
2
CH
3
O
u.
CH
3
CH
2
C
O
Br
m.
H C
O
N
H
w.
CH
3
(CH
2
)
3
C
O
N(CH
3
)
2
s.
CH
3
CH
2
C
O
O
C CH
2
CH
2
CH
3
O
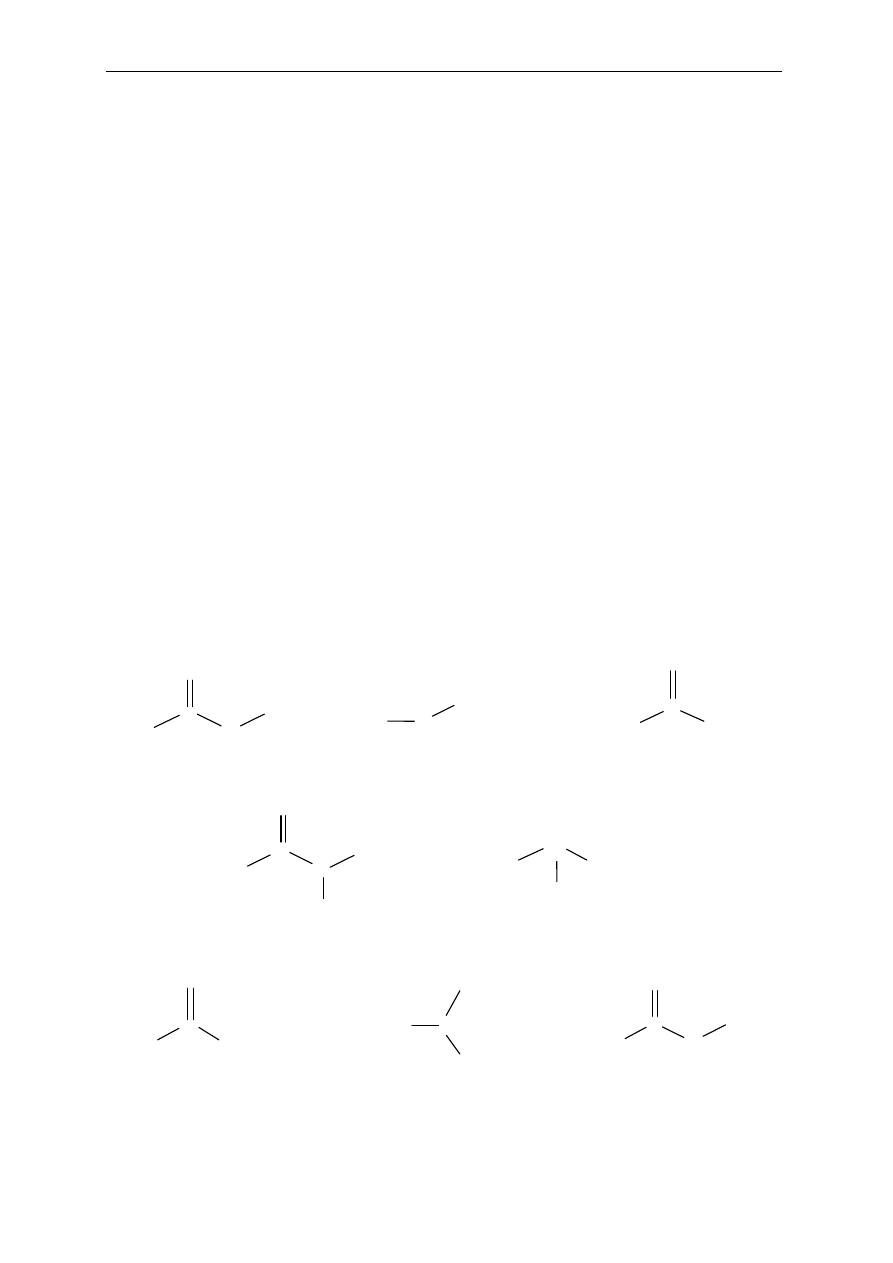
Seminarium, część I
28
13. Podaj nazwy amin i okre
śl ich rzędowość:
a) C
6
H
5
NHCH
3
,
b) CH
3
CH
2
CH
2
N(CH
3
)
2
,
c) CH
3
CH
2
CH
2
CH(CH
2
CH
3
)NH
2
,
d) (CH
3
)
3
CNH
2
,
e) C
6
H
5
CH
2
NHCH
3
.
POLARYZACJA WIĄZAŃ W ZWIĄZKACH ORGANICZNYCH:
EFEKTY INDUKCYJNY I MEZOMERYCZNY
Zadania
1. Na przykładzie cz
ąsteczki fluoroetanu (CH
3
CH
2
F) wyja
śnij pojęcie efektu indukcyjnego.
2. Na przykładzie cz
ąsteczki propenalu (CH
2
=CH-CHO) wyja
śnij pojęcie efektu
mezomerycznego. Podaj przykład zwiazku, w którego cz
ąsteczce efekt mezomeryczny
skierowany jest w przeciwna stron
ę niż w cząsteczce propenalu.
3. Wska
ż kierunek polaryzacji wiązań w podanych związkach, zaznaczając atomy
obdarzone cz
ąstkowym ładunkiem ujemnym i atomy obdarzone cząstkowym ładunkiem
dodatnim. Jakie efekty elektronowe odpowiadaj
ą za polaryzację tych wiązań?
W przypadku efektu mezomerycznego narysuj struktury rezonansowe zwi
ązku.
N
CH
2
CH
3
O
Cl
H
C
CH
3
CH
3
C
O
C
O
H
3
C
H
3
C
O
CH
CH
3
C
O
H
3
C
O
H
C
O
H
3
C
N
H
H
3
C
H
3
C
CH
2
CH
3
O
CH
2
CH
3
H
CH
3
CH
3
a)
b)
c)
d)
e)
f)
g)
h)
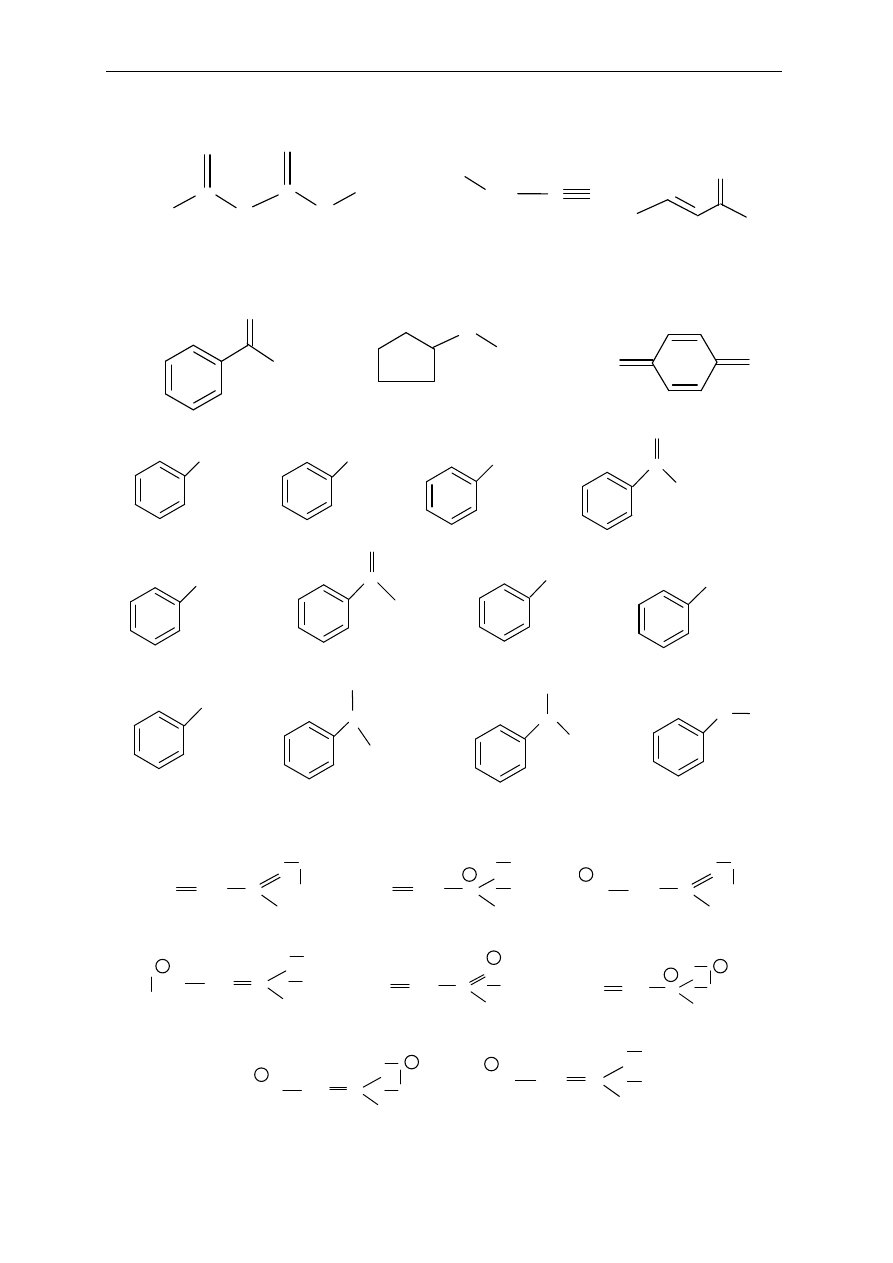
Seminarium, część I
29
O
C
O
NH
2
O
H
3
C
H
3
C
CH
2
O
O
CH
3
O
H
O
C
O
O
CH
3
C
N
i)
j)
k)
l)
m)
n)
OH
CH
2
CH
3
NH
2
CH
3
C
O
CH
3
C
O
OH
Cl
CH
CH
3
CH
3
I
Br
O
CH
3
N
H
CH
3
p)
r)
s)
t)
u)
w)
y)
z)
aa)
bb)
cc)
o)
4. Które z podanych wzorów przedstawiaj
ą struktury rezonansowe tych samych związków?
CH
2
CH
C
O
H
CH
2
CH
C
OH
H
_
CH
2
CH
C
OH
H
+
CH
2
CH
C
O
H
+
CH
2
CH
C
OH
H
+
CH
2
CH
C
O
H
+
_
CH
2
CH
C
O
H
+
_
CH
2
CH
C
OH
H
+
a)
b)
c)
d)
e)
f)
g)
h)

Seminarium, część I
30
IZOMERIA ZWIĄZKÓW ORGANICZNYCH
Zadania
1. Narysuj wzory strukturalne oraz podaj nazwy pi
ęciu izomerów związku o wzorze
sumarycznym C
6
H
14
. Jakimi izomerami s
ą względem siebie narysowane związki?
2. Narysuj i nazwij wszystkie monobromopochodne pentanu, C
5
H
11
Br (3).
3. Narysuj i nazwij wszystkie mo
żliwe izomery podanych związków. Jakiego typu
izomerami s
ą one względem siebie?
a. dichlorobutan (5),
b. dichlorocyklobutan (3).
4. Narysuj zwi
ązki zgodnie z nazwą. Jakiego typu izomerię wykazują te związki?
a.
trans-4-metyloheks-2-en
b.
cis–2,5–dimetyloheks-3-en
c.
trans–2–metylohept-3-en
d.
trans-3,4-dimetyloheks-3-en
e. (
Z)-3-chloro-4-metyloheks-2-en
f. (
E)-2-bromobut-2-en
g. (
E)-2,5-dibromo-3-etylopent-2-en
h. (Z)-3-bromo-2,2- dimetyloheks-3-en
5. Które z podanych zwi
ązków mogą występować w postaci izomerów cis-trans? Narysuj
ka
żdą parę izomerów.
a) but-2-en,
b) 2–metylobut-1-en,
c) pent-1-en,
d) 1,1-dichloroeten,
e) but-1-en,
f) 2–metylobut-2-en,
g) pent-2-en,
h) 1,2-dichloroeten.
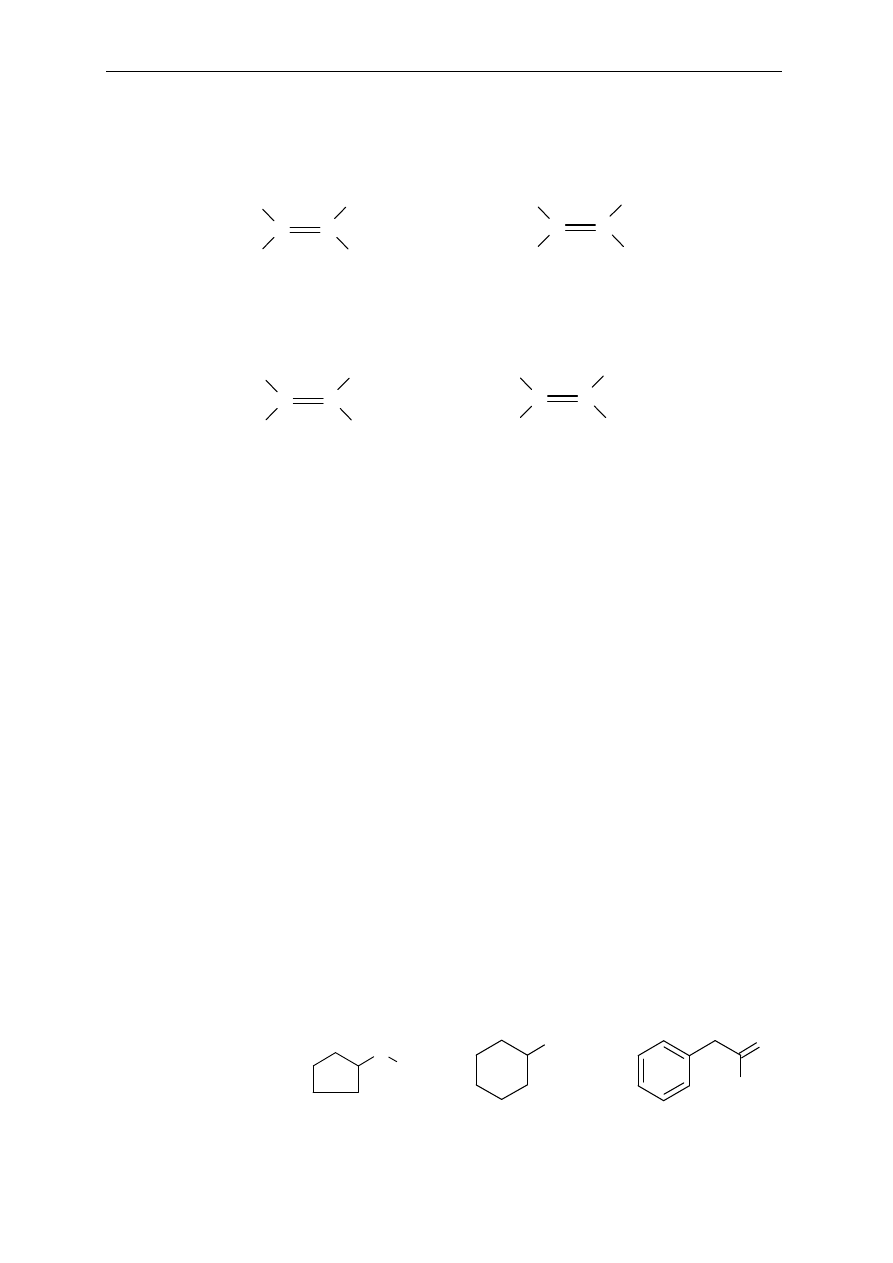
6. Które z podanych zwi
ązków wykazują izomerię geometryczną (cis-trans lub Z-E)?
Narysuj wzory strukturalne izomerów i przypisz ka
żdej strukturze konfigurację Z lub E.
i. prop-1-en,
j. 1-chloroprop-1-en,
k. 1,2-dibromoprop-1-en,
l. 1-bromo-2-chloroeten,
m. 2,3-dichlorobut-2-en,
n. 3–metylopent-2-en,
o. 1-chloro-2-metylobut-2-en,
p. 2,3-dimetylopent-2-en,
q. pent-2-yn,
r. 4-etylo-3-metyloheks-3-en.
Seminarium, część I
31
7. Przypisz konfiguracj
ę E lub Z następującym związkom:
a)
H
C
C
H
3
C
CN
CH
2
NH
2
CH
3
H
COOH
Cl
C
C
C
C
CH
3
CH
2
Cl
CH
2
OH
H
3
C
H
3
C
Br
COOH
CH
2
Br
C
C
a.
b.
c.
d.
8. Okre
śli, ile par izomerów geometrycznych tworzy związek o wzorze sumarycznym
C
3
H
4
Cl
2
. Narysuj wzory wszystkich izomerów
cis-trans.
9. Narysuj wzory strukturalne i podaj nazwy wszystkich mo
żliwych izomerów:
a) ksylenu (dimetylobenzenu),
b) trimetylobenzenu,
c) kwasu aminobenzoesowego,
d) dibromonitrobenzenu,
e) trinitrofenolu.
10. Zaproponuj wzory strukturalne zwi
ązków spełniających następujące opisy:
a) alkohole o wzorze C
3
H
8
O,
b) alkohole o wzorze C
4
H
10
O,
c) ketony o wzorze C
5
H
10
O,
d) aldehydy o wzorze C
5
H
10
O.
11. Dla ka
żdego z poniższych związków narysuj wzór izomeru posiadającego takie same
grupy funkcyjne:
c.
OH
d.
O
OH
b.
O
CH
3
a.
CH
3
CH
2
CH
2
C
≡
N

Seminarium, część I
32
12. Zaproponuj wzory strukturalne cz
ąsteczek o podanych wzorach sumarycznych. Jakiego
typu izomerami s
ą względem siebie zaproponowane związki?
a) C
3
H
8
b) C
2
H
4
O (trzy zwi
ązki)
c) C
2
H
6
O (dwa zwi
ązki)
d) CH
5
N
e) C
3
H
7
Br (dwa zwi
ązki)
f) C
3
H
9
N (cztery zwi
ązki)
g) C
4
H
6
h) C
3
H
5
Cl
i) C
3
H
6
ClBr
Wyszukiwarka
Podobne podstrony:
Materialy do seminarium IM 2009 10 czesc I
Materialy do seminarium inz mat 09 10 czesc III
Materialy do seminarium inz mat 09 10 czesc III
Materialy do seminarium inz mat 09 10 czesc III
Materialy do seminarium inz mat 09 10 czesc II
4 konta ksiegowe cwiczenia, Semestr V, Finanse i Rachunkowosc, Wyklady i materialy do seminarium
Materialy do seminarium tech chem 13 14 id 284873
Materialy do seminarium inz mat Nieznany
Moja litania do Ducha Świętego - 2009 10 17 - A4, Religijne, Różne
zestaw pytan inf III sem, do uczenia, materialy do nauczania, egzamin 2009, EXCEL
ZAKRES MATERIAŁU z mikrobiologii farmaceutycznej-leki 2009-10, materiały farmacja, Materiały 3 rok,
niemiecki materiały do egzaminu, abc1 uebungen 10
4 konta ksiegowe cwiczenia, Semestr V, Finanse i Rachunkowosc, Wyklady i materialy do seminarium
Materialy do seminarium TCh 2011 12
Materiały do wykładu 4 (27 10 2011)
Materiały do wykładu 4 (28 10 2011)
więcej podobnych podstron