Węglowce
Pierwiastki grupy 14
(Grupy IVA „głównej”)
Węglowce
Konfiguracja elektronowa powłoki walencyjnej ns
2
np
2
Elektroujemność
Promień at. (pm)
C
Si
Ge
Sn
Pb
2,5
1,7
2,0
1,7
1,5
77
118
122
140
147
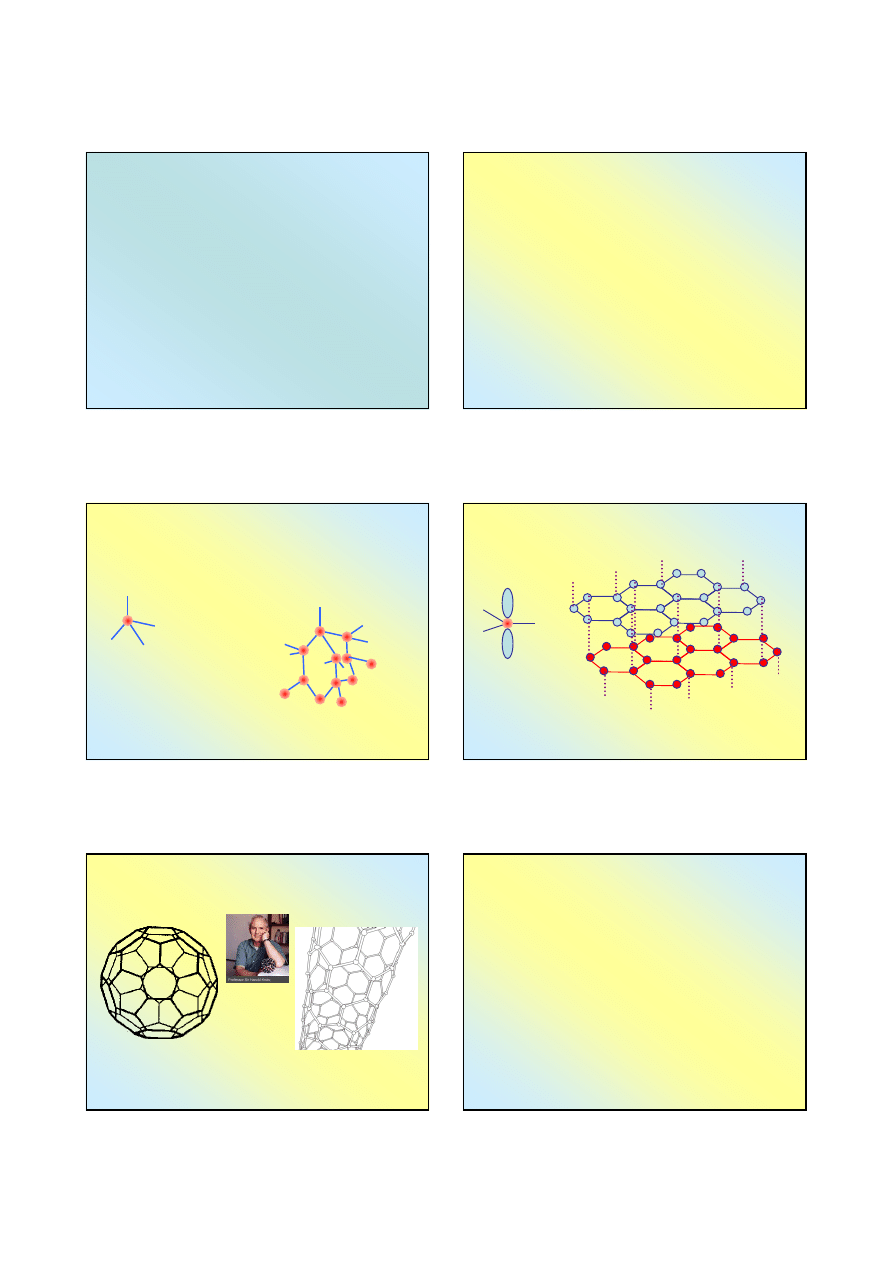
Alotropia węgla
Węgiel występuje w 3 odmianach alotropowych, znacznie
różniących się właściwościami fizycznymi;
Diamen
t i
grafit
są kryształami kowalencyjnymi (C
∞
∞
∞
∞
), a
fuleren
składa się z cząsteczek węgla
Atom węgla ulega
hybrydyzacji sp
3
Diament
tworzy kryształy o wysokiej symetrii (układ
regularny), a wszystkie elektrony są zlokalizowane, gdyż
tworzą wiązania typu σ pomiędzy atomami C
Alotropia węgla – grafit
W graficie każdy atom węgla ulega hybrydyzacji sp
3
, czyli
może tworzyć trzy wiązania typu σ leżące w jednej
płaszczyźnie, pozostaje orbital p
z
, prostopadły do
płaszczyzny
Grafit
tworzy kryształy o posiadające sześciokrotną oś
symetrii (układ heksagonalny); 3 elektrony są
zlokalizowane, gdyż tworzą wiązania typu σ pomiędzy
atomami C, pozostałe elektrony tworzą zdelokalizowany
orbital typu π, rozciągający się na cały kryształ
Alotropia węgla – fuleren i nanorurki
Fuleren jest odmianą cząsteczkową węgla – znane są
cząsteczki zawierające 28, 32, 60, 70 (do 1500) atomów
węgla
fuleren,
hybrydyzacja sp
2
kształt kulisty, podobny
do piłki futbolowej
nanorurka,
hybrydyzacja sp
2
kształt walca „zwinięta” sieć
grafitu, długość do 100 µm
Alotropia węgla – diament i grafit
Konsekwencją różnic w strukturze elektronowej i budowie
kryształu są znaczne różnice właściwości fizycznych
Diament
Grafit
Gęstość
3,5
2,1 – 2,3
[g
⋅
cm
-1
]
Odległość C-C
154
142
[pm]
340
Twardość
10
1
skala Mohsa
Właściwości
przezroczysty
nieprzezroczysty
optyczne
Właściwości
izoloator
przewodnik
elektryczne
Właściwości
izotropowy
anizotropowy
kierunkowe
4 zlokalizowane
3 zlokalizowane wiązania
wiązania typu σ
typu σ + zdelokalizowane π
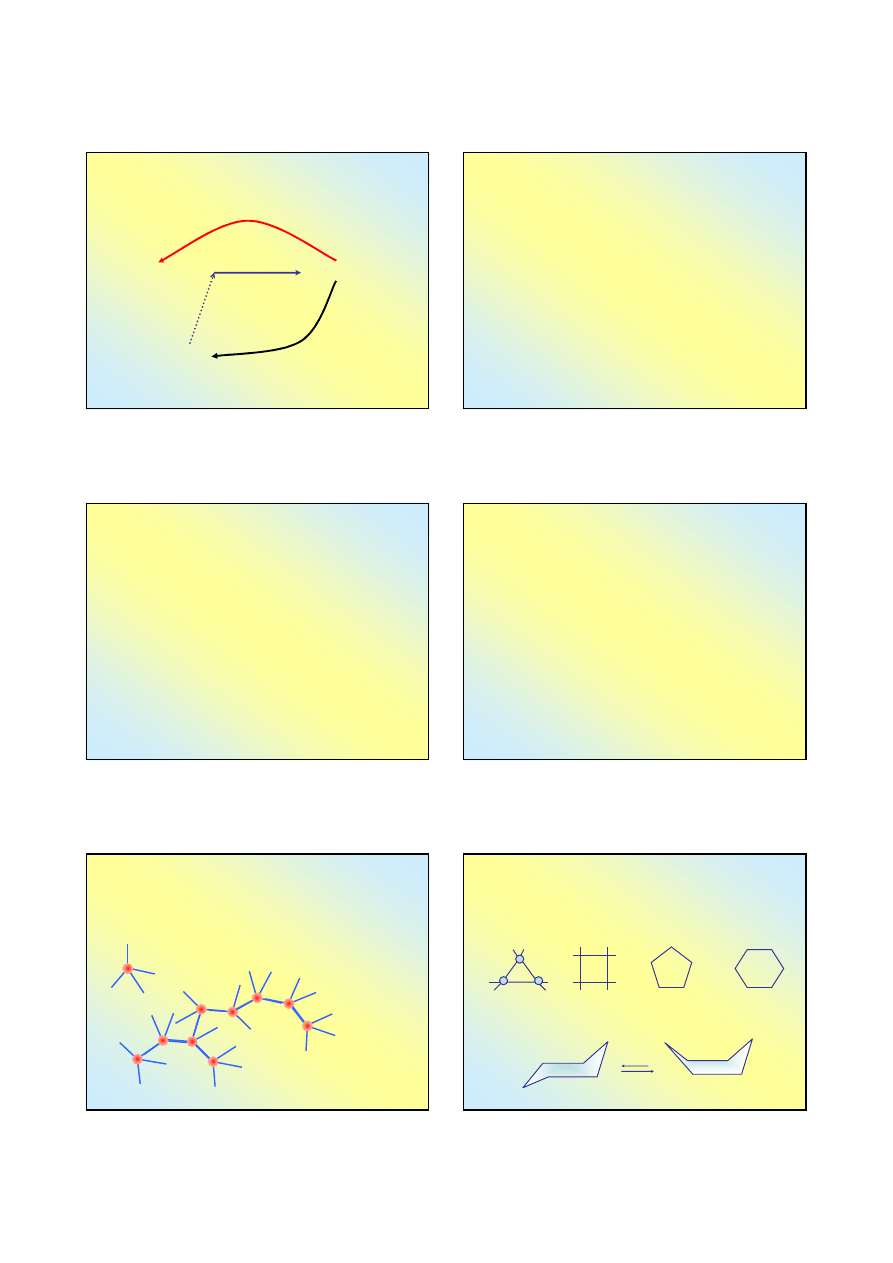
Przemiany alotropowe węgla
Najtrwalszą odmianą alotropową węgla jest grafit. Jednak
wszystkie odmiany alotropowe mogą istnieć w warunkach
normalnego ciśnienia i temperatury
GRAFIT
DIAMENT
ogrzewanie
bez dostępu
powietrza
wysoka temperatura,
wysokie ciśnienie
FULERENY,
nanorurki
odparowanie w łuku
elektrycznym
Krzem, german, cyna, ołow
Węglowce tworzą zawsze wiązania kowalencyjne,
przyjmując stopnie utlenienia od
–IV
do
+IV
Kształt izolowanych cząsteczek, a także wiązania w
kryształach dobrze tłumaczą reguły hybrydyzacji ...
Charakter połączeń ulega zmianie ze wzrostem masy
atomowej, np. tlenek węgla (IV), tlenki krzemu i
germanu mają charakter
kwasowy
, tlenki cyny -
amfoteryczny
, ołowiu –
zasadowy
W miarę wzrostu masy atomowej oddalają się od
siebie poziomy walencyjne s i p, dlatego Pb łatwiej
tworzy trwałe związki o dużym udziale wiązania
jonowego na +2 stopniu utlenienia (bez udziału
elektronów poziomu 6s)
Właściwości chemiczne węglowców
∅
Krzem
i
german
występują tylko w jednej odmianie
krystalograficznej (sieć typu diamentu, hybrydyzacja sp
3
).
Elektrony są jednak słabiej zlokalizowane (większa
odległość Si – Si niż C – C). Oba pierwiastki są
połprzewodnikami.
∅
Cyna
ma trzy odmiany alotropowe.
∅
Ołów
występuje tylko w jednej odmianie
krystalograficznej, o strukturze charakterystycznej dla
metali
Sn
α
cyna szara,
regularna
Sn
β
cyna biała
Sn
λ
cyna λ
Sn
stop
286 K
↔
↔
↔
↔
434 K
↔
↔
↔
↔
505 K
↔
↔
↔
↔
Połączenia węgla z wodorem – węglowodory
Węgiel tworzy z wodorem dużą ilość bardzo różnych
związków;
Ze względu na ich budowę i charakter chemiczny zostały
podzielone na szeregi homologiczne;
Węglowodory – ze względu na istniejący w ich
strukturze szkielet węglowy – są zaliczane do związków
organicznych;
Można je podzielić na węglowodory łańcuchowe
(alifatyczne, acykliczne) i cykliczne
Pierwszy szereg homologiczny (wśród węglowodorów
alifatycznych) stanowią alkany, o wzorze ogólnym
C
n
H
2n+2
, w których występują wyłącznie wiązania
pojedyncze (węglowodory nasycone) węgiel – węgiel;
Wszystkie atomy węgla ulegają hybrydyzacji sp
3
Alkany C
n
H
2n+2
W alkanach, o wzorze ogólnym
C
n
H
2n+2
, wartość n waha
się od 1 do kilkadziesiąt
Cząsteczki alkanów o n≥ 3
nie są liniowe!
Cykloalkany C
n
H
2n
W cykloalkanach, o wzorze ogólnym
C
n
H
2n
, wartość n
waha się od 1 do kilkadziesiąt;
Z pierścieniem może być połączony łańcuch alifatyczny
Cząsteczki cykloalkanów nie są płaskie! Konformacje ...
cyklopropan
cyklobutan
cyklopentan
cyklokeksan
„krzesełko”
„łódeczka”
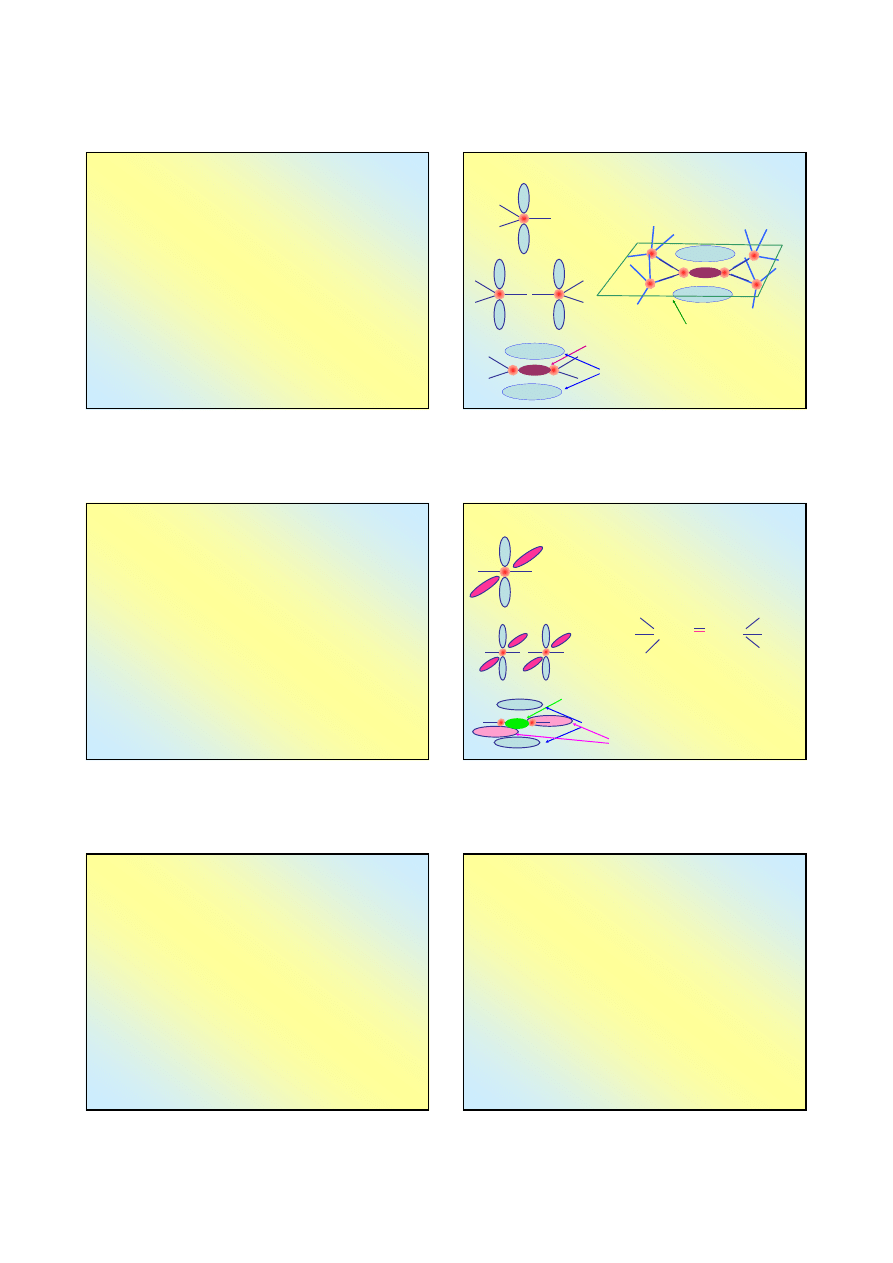
Alkeny C
n
H
2n
, alkadieny C
n
H
2n-2
itd.
Węglowodory, w których obok wiązań pojedynczych
występują wiązania podwójne, nazywamy nienasyconymi;
W szeregu homologicznym alkenów, węglowodorów
alifatycznych o wzorze ogólnym
C
n
H
2n
, wartość n waha
się od 1 do kilkadziesiąt, występuje jedno wiązanie
podwójne węgiel – węgiel;
Jeśli występują dwa wiązania podwójne, mówimy a
alkadienach o wzorze ogólnym
C
n
H
2n-2
, jeśli trzy
wiązania podówjne – mamy do czynienia z alkatrienami o
wzorze ogólnym
C
n
H
2n-4
, itd ...
Wiązanie podwójne węgiel – węgiel wiąże się z
hybrydyzacją typu sp
2
dwóch sąsiednich atomów węgla;
Tworzą się orbitale molekularne typu σ oraz typu π –
wiązania węgiel – węgiel są nierównocenne
Alkeny C
n
H
2n
, alkadieny C
n
H
2n-2
itd.
p
z
orbital σ
orbital π
płaszczyzna, w której
leży 6 atomów węgla
Alkiny C
n
H
2n-2
Węglowodory, w których obok wiązań pojedynczych
występują wiązania podtrójne, nazywamy nienasyconymi;
W szeregu homologicznym alkinów, węglowodorów
alifatycznych o wzorze ogólnym
C
n
H
2n-2
, wartość n waha
się od 1 do kilkadziesiąt, występuje jedno wiązanie
podwójne węgiel – węgiel;
Wiązanie podtrójne węgiel – węgiel wiąże się z
hybrydyzacją typu sp dwóch sąsiednich atomów węgla;
Tworzą się orbitale molekularne: jeden typu σ oraz dwa
orbitale typu π – wiązania węgiel – węgiel są
nierównocenne
Alkeny C
n
H
2n
, alkadieny C
n
H
2n-2
itd.
p
z
p
y
orbital σ
orbital π
2pz
orbital π
2py
4 atomy węgla leżą na
jednej linii prostej
C ─ C ─ C ─ C
Węglowodory cykliczne nienasycone
Węglowodory cykliczne, w których obok wiązań
pojedynczych występują wiązania podwójne lub podtrójne,
nazywamy nienasyconymi;
W cyklobutenie, cyklopentenie itd. występuje jedno
wiązanie podwójne – orbital typu σ oraz orbital typu π –
wiązania węgiel – węgiel są nierównocenne
W cyklobutadienie, cyklopentadienie itd. występują po
dwa wiązania podwójne, może wystąpić zjawisko
koniugacji czyli sprzężenia wiązań podwójnych
Węglowodory aromatyczne
Węglowodory aromatyczne są grupą węglowodorów
cyklicznych, w których występują wiązania π, a które nie
przejawiają własności węglowodorów nienasyconych;
Do węglowodrów aromatycznych należą np:
benzen C
6
H
6
,
naftalen C
10
H
8
,
antracen C
14
H
10
, fenantren C
14
H
10
, itd.
Należą do nich także węglowodory, w których z
podstawową strukturą pierścienia aromatycznego związane
są rodniki alkilowe lub łańcuchy alifatyczne, np:
toluen C
6
H
6
CH
3
;
ksyleny C
6
H
6
(CH
3
)
2
, itd .
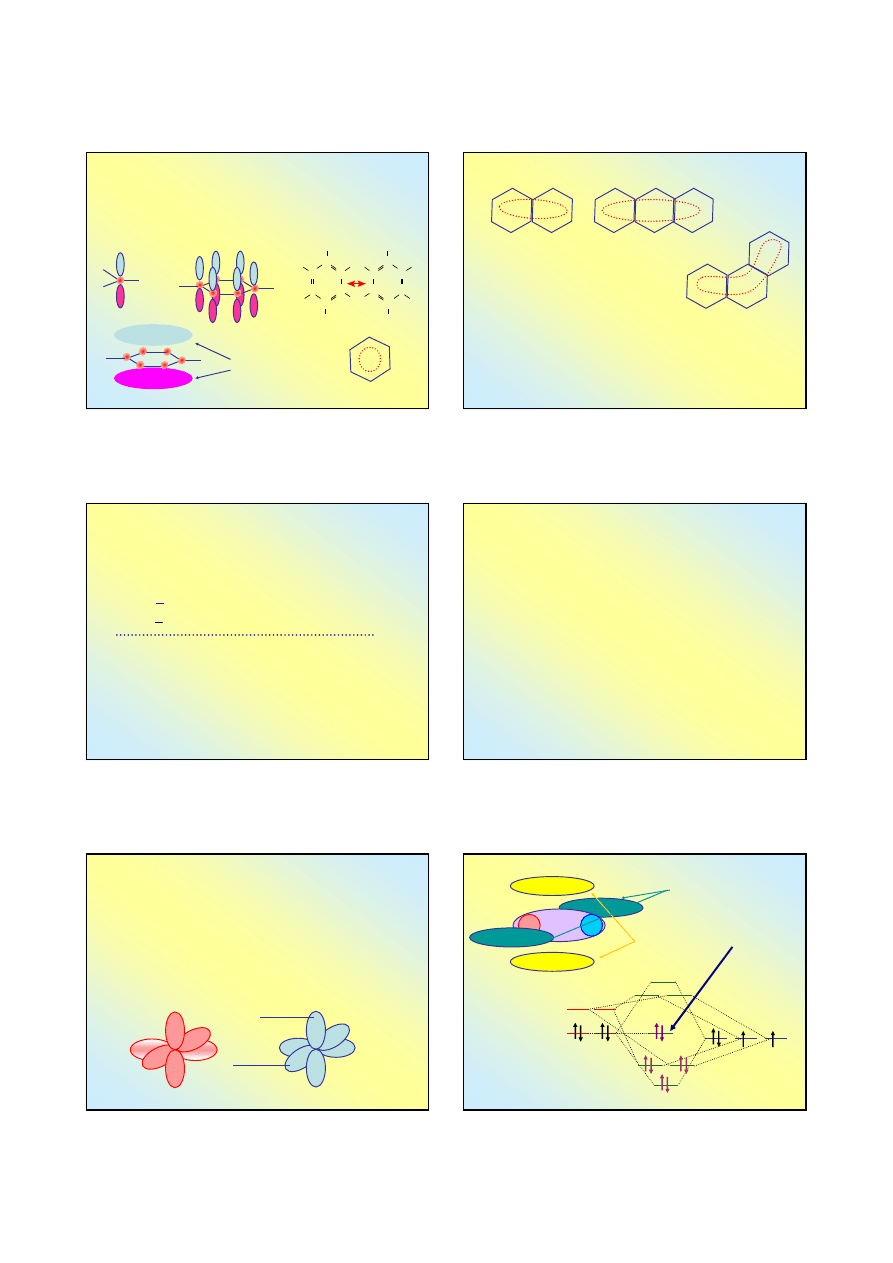
Struktura pierścienia aromatycznego
Wzór beznenu C
6
H
6
znano o wiele wcześniej niż potrafiono
wyjaśnić w jaki sposób połączone są w cząstecze atomy węgla
Wg teorii orbitali molekularnych za strukturę tę odpowiada
hybrydyzacji typu sp
2
wszystkich atomów węgla w cząsteczce
sześciocentrowy
zdelokalizowany
orbital π
C
C
C
C
C
C
C
C
C
C
C
C
Cząsteczka benzenu jest płaska
Węglowodory aromatyczne
Wszystkie atomy węgla leżą w jednej płaszczyźnie –
cząsteczki są płaskie
Orbital zdelokalizowny typu π rozciąga się na całą
cząsteczkę
naftalen
C
10
H
8
antracen
C
14
H
10
fenantren
C
14
H
10
Połączenia węgla z tlenem
Węgiel tworzy z tlenem dwa połączenia:
o
Tlenek węgla (II) (d. tlenek węgla, czad) o wzorze CO
o
Tlenek węgla (IV) (d. dwutlenek węgla) o wzorze CO
2
Ponieważ ustalają się równocześnie obydwie powyższe
równowagi, produktem spalania węgla jest zawsze
mieszanina obu tlenków, której skład zależy od
temperatury i ciśnienia;
CO
O
C
2
2
1
→
←
+
∆H=-110 kJ
⋅⋅⋅⋅
mol
-1
2
2
2
1
CO
O
CO
→
←
+
∆H=-283 kJ
⋅⋅⋅⋅
mol
-1
2
2
CO
O
C
→
←
+
∆H=-393 kJ
⋅⋅⋅⋅
mol
-1
Tlenki węgla
Tlenki węgla można również otrzymać na drodze
odpowiednich reakcji:
Rozkład termiczny kwasu mrówkowego:
O
H
CO
HCOOH
2
+
→
Rozkład termiczny naturalnych węglanów i soli organicznych:
2
4
2
2
3
CO
2
Ni
O
NiC
CO
CaO
CaCO
+
→
+
→
ogrzewanie
ogrzewanie
Inne reakcje (wielki piec):
2
3
2
CO
Fe
CO
FeO
CO
2FeO
C
O
Fe
+
→
←
+
+
→
←
+
2p
z
2p
y
t
2
t
1
C
Tlenek węgla (II)
Tlenek węgla (II),
CO
, ma charakter obojętny, tzn. nie
jest ani bezwodnikiem kwasowym, ani zasadowym, ani
nie ma charakteru amfoterycznego;
Struktura elektronowa – cząsteczka
CO
jest
izoelektronowa z cząsteczką
N
2
, czyli powinna mieć
taką samą strukturę elektronową i znaczny moment
dipolowy, wynikający z różnicy elektroujemności.
Cząsteczka
CO
ma znikomy moment dipolowy, co
przypisujemy hybrydyzacji typu sp atomu węgla:
2p
z
2p
x
2p
y
O
π
z
σ
π
y
Tlenek węgla (II)
σ
C
O
π
z
π
y
t
2
t
1
2p
z
2p
y
C
2p
x
2p
y
2p
z
O
CO
σ
σ
*
π
y
π
y
*
π
z
π
z
*
„wolna para”
elektronowa przy
atomie węgla
ze strunktury
elektronowej
CO
wynika, że jest on
zasadą Lewisa i
może być ligandem
w kompleksach

Struktura elektronowa tlenku węgla (IV)
Hybrydyzacja sp atomu
węgla powoduje, że
cząsteczka CO
2
jest liniowa;
Tworzą się dwa
zlokalizowane orbitale σ –
wiązania C-O oraz dwa
orbitale zdelokalizowane π,
które rozciągają się na całą
cząsteczkę O ─ C ─ O;
Cząsteczka jest
izoelektronowa i ma taką
samą strukturę elektronową
jak jon N
3
-
i cząsteczka N
2
O
C
O
O
σ
σ
Kwas węglowy i jego sole
CO
2
jest bezwodnikiem kwasu węglowego H
2
CO
3
3
2
2
2
CO
H
O
H
CO
→
←
+
−
+
+
→
←
+
3
3
2
3
2
HCO
O
H
O
H
CO
H
−
+
−
+
→
←
+
2
3
3
2
3
CO
O
H
O
H
HCO
]
[
]
[
]
[
3
2
3
3
1
CO
H
O
H
HCO
K
+
−
⋅
=
]
[
]
[
]
[
3
3
2
3
2
−
+
−
⋅
=
HCO
O
H
CO
K
K
1
=4,3
⋅⋅⋅⋅
10
-7
K
2
=5,6
⋅⋅⋅⋅
10
-11
Kwas węglowy tworzy dwie grupy soli o różnych
właściwościach: węglany (z anionem
CO
3
2-
) oraz
wodorowęglany (z anionem
HCO
3
-
). Różnią się one np.
rozpuszczalnością w wodzie, dla większości kationów.
Anion węglanowy jest płaski i izoelektronowy z
NO
3
-
.
Związki węgla z azotem. Cyjanki
↑
+
→
←
+
2HCN
SO
K
SO
H
2KCN
4
2
4
2
Cyjanowodór jest w roztworach wodnych bardzo
słabym kwasem, a jego sole ulegają hydrolizie:
10
3
3
2
10
2
,
7
[HCN]
]
CN
[
]
O
H
[
CN
O
H
O
H
HCN
−
−
+
−
+
⋅
=
⋅
=
+
→
←
+
K
Jon cyjankowy tworzy z wieloma kationami metali
kompleksy o wysokiej stałej trwałości
Węgliki
Węgliki są związkami węgla z metalami oraz
krzemem i borem;
Węgliki dzielimy na:
węgliki jonowe (typu soli);
węgliki międzywęzłowe;
węgliki kowalencyjne (z niemetalami)
Węgliki jonowe (typu soli)
... należą do nich węgliki metali I, II i III (1,2,13) grupy
układu okresowego ...
.. zawierają aniony z węglem na różnych stopniach
utlenienia:
– C
4-
(metanki, stopień utlenienia węgla -
-IV
);
– C
2
2-
(acetylenki, stopień utlenienia węgla -
-I
);
– C
3
4-
(allilki, stopień utlenienia węgla -
-4/3
).
nazwy pochodzą og gazu wydzielającego się w czasie
hydrolizy:
metanek: Al
4
C
3
↑
+
→
+
4
3
2
2
3
4
3CH
O
2Al
O
6H
C
Al
acetylenki: Na
2
C
2
, BaC
2
, CaC
2
(karbid).. :
2
2
2
2
H
C
CaO
O
H
CaC
+
→
+
allilek: Mg
2
C
3
:
↑
=
=
+
→
+
2
2
2
3
2
CH
C
CH
2MgO
O
2H
C
Mg
Węgliki międzywęzłowe
Należą do nich węgliki metali o promieniu atomowym
wększymi niż 130 pm – 4, 5 i 6 (IV B,V B,VI B) grupy
układu okresowego ...
Atomy węgla o promieniu ~77 pm mieszczą się pomiędzy
atomami metali (w pozycjach międzywęzłowych):
Węgliki o wzorze ogólnym
MeC
, np.
TiC, MoC, WC
...
Węgliki o wzorze ogólnym Me
2
C, np.
V
2
C, W
2
C
...
Węgliki metali o promieni jonowym < 130 pm mają
charakter jonowo-międzywęzłowych (Fe, Co, Ni, Mn ... )
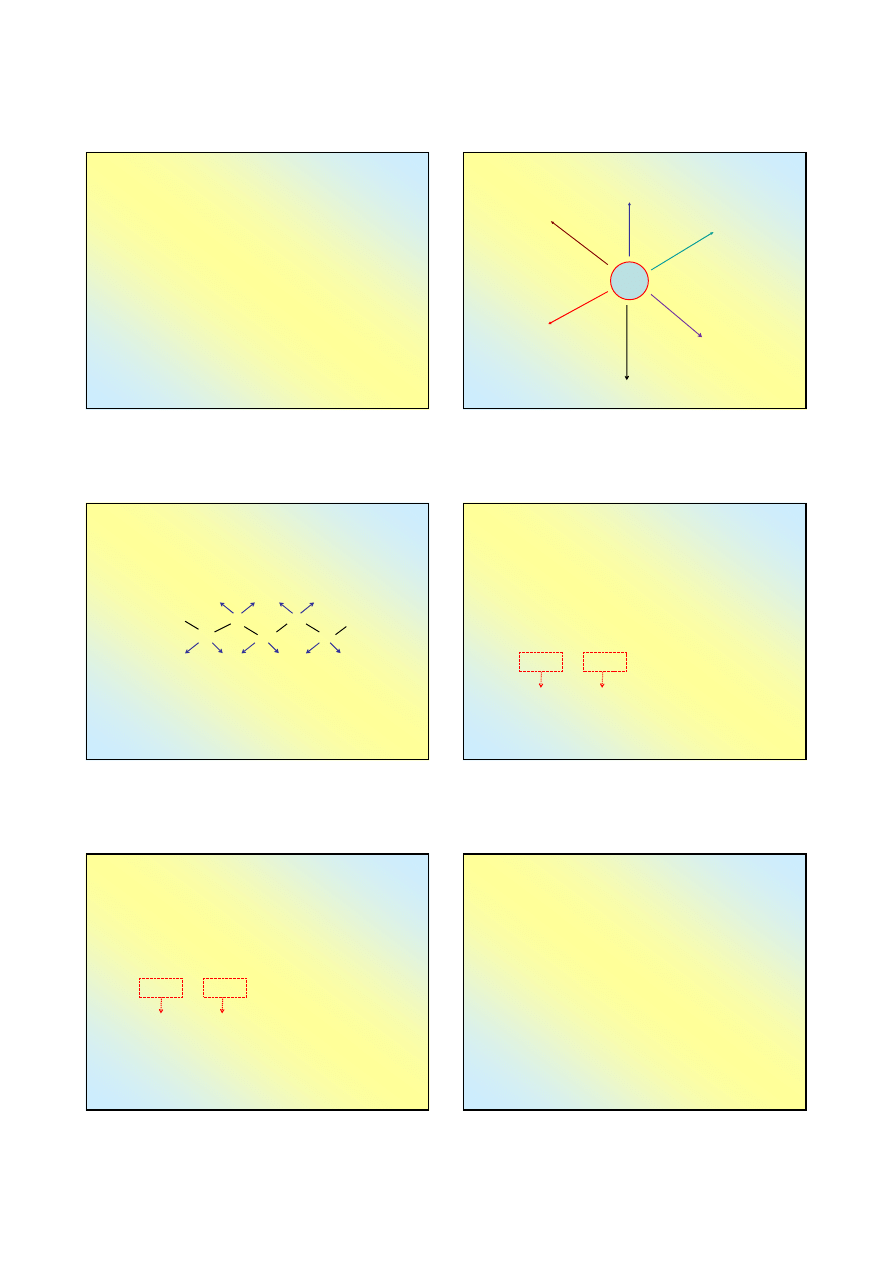
Węgliki kowalencyjne
Tworzy je węgiel z pierwiastkami o zbliżonej
elektroujemności:
Węglik krzemu,
SiC
(karborund) jest bardzo twardym
materiałem o strukturze diamentu – atomy
Si
i
C
ulegają
hybrydyzacji
sp
3
– każdy atom krzemu jest otoczony
czterema atomami węgla i na odwrót;
Weglik boru
B
4
C
jest bardzo twardym materiałem –
atomy
B
i
C
ulegają hybrydyzacji
sp
3
– każdy atom
węgla
jest otoczony czterema atomami
boru
; każdy
atom
boru
ma jako sąsiadów 1 atom
węgla
i trzy atomy
boru
.
Reakcje krzemu
Si
O
2
700 K
SiO
2
stopione
metale
Krzemki metali:
Mg
2
Si, MgSi,
Ca
2
Si ...
HF+HNO
3
SiF
4
+NaOH
Na
2
SiO
3
Cl
2
SiCl
4
Halogenopochodne
węglowodorów, (C
6
H
5
)Br
(C
6
H
5
)
2
SiBr
2
Połączenia krzemu z wodorem
Si
Si
Si
Si
Si
H
H H
H
H
H
H
H H
H
Krzem tworzy z wodorem tylko jeden szereg
homologiczny, składający się z prostych łańcuchów o
wzorze ogólnym Si
n
H2
n+2
;
Ponieważ wodór jest bardziej elektroujemny niż
krzem, ładunki są wyciągane na zewnątrz łańcucha,
co zmniejsza jego stabilność – silany są mniej trwałe
od odpowiednich węglowodorów
Chlorosilany i siloksany
Chlor i inne halogeny mogą zastępować atomy
wodoru w silanach, np. :
SiH
3
Cl, SiH
2
Cl
2
, SiHCl
3,
….
Chlorosilany ulegają hydrolizie:
3
4
4
4
AlCl
LiCl
SiH
LiAlH
SiCl
+
+
→
+
H
3
Si─Cl + H─
O
─H + Cl─SiH
3
HCl
HCl
→ H
3
Si─
O
─SiH
3
siloksan
Obecność tlenu w łańcuchu pomiędzy atomami krzemu
stabilizuje łańcuch.
Siloksany
są trwalsze od silanów …
Silikony (1)
Wodór w silanach może być również zastępowany
przez łańcuchy węglowodorowe:
SiR
3
Cl, SiR
2
Cl
2
, SiRCl
3,
…. Gdzie R = ─CH
3
,
─C
2
H
5
, ─C
6
H
5
, ….
R
1
R
4
R
2
Si─Cl + H─
O
─H + Cl─SiR
5
R
3
R
6
R
1
R
4
→ R
2
Si─
O
─SiR
5
R
3
R
6
HCl
HCl
silikon
Silikony (2)
Dla R
2
SiCl
2
:
R
x
Cl─ Si─Cl + n H
2
O
R
y
R
x
R
x
R
x
R
x
→
─Si─
O
─Si─
O
─Si─
O
─Si ─
R
y
R
y
R
y
R
y
Dla RSiCl
3
:
R
x
Cl─ Si─Cl + n H
2
O
Cl
R
x
R
x
R
x
R
x
─Si─
O
─Si─
O
─Si─
O
─Si ─
→
O
O O
O
─ Si─
O
─Si─
O
─Si─
O
─Si ─
R
x
R
x
R
x
R
x
„polimer krzemoorganiczny”
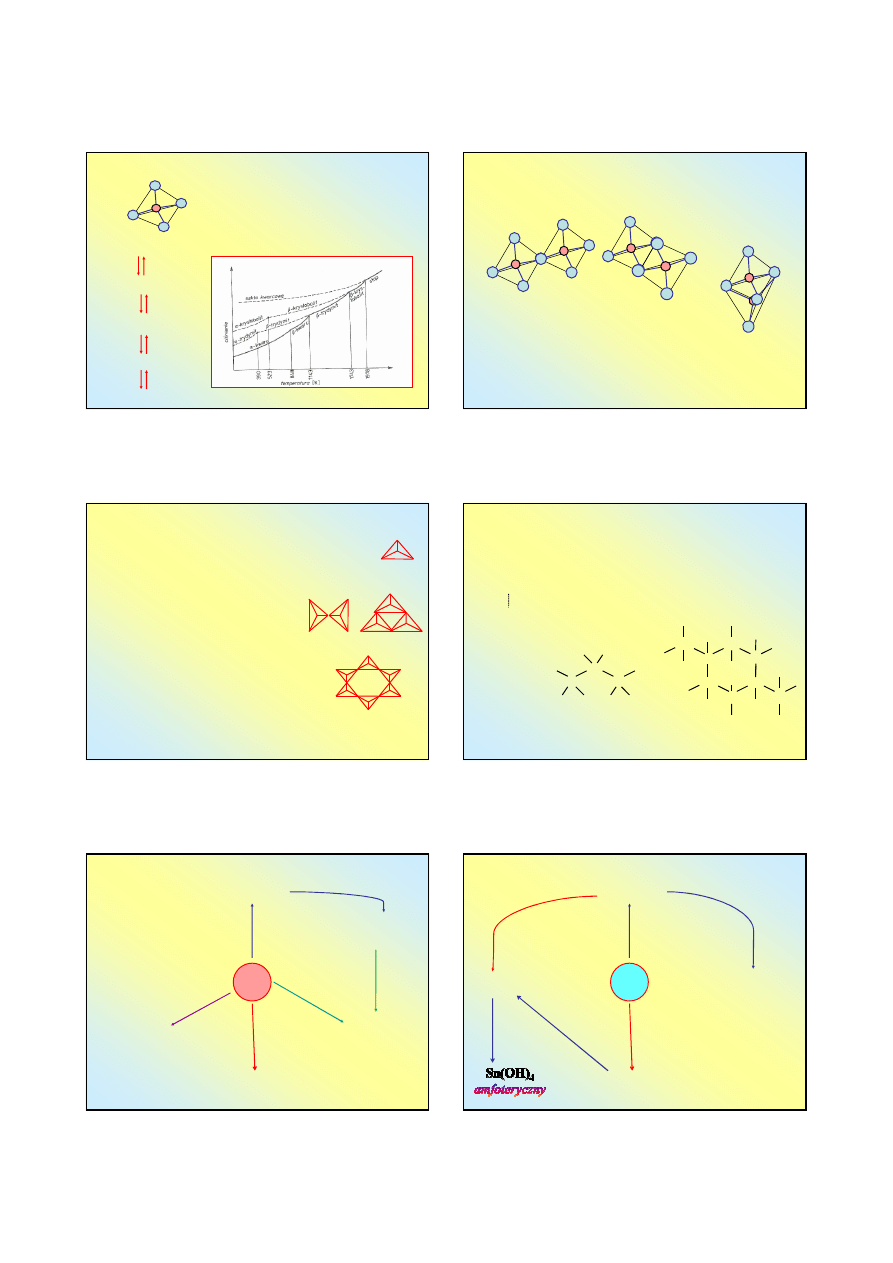
Dwutlenek krzemu SiO
2
o
Podstawową jednostką struktury
wszystkich odmian SiO
2
oraz
krzemianów jest tetraedr
krzemowo-tlenowy
SiO
4
4-
:
kwarc α
846 K
kwarc β
1143 K
trydymit β
1743 K
krystobalit β
1943 K
stop
Kwasy krzemowe i ich kondensacja
4NaCl
SiO
H
4HCl
SiO
Na
4
4
4
4
+
→
+
wspólne naroże
Si
2
O
7
6-
wspólna krawędź
Si
2
O
6
4-
wspólna ściana
Si
2
O
5
2-
Kondensacja kwasów krzemowych
stwarza znacznie szersze możliwości niż
kondensacja kwasów fosforowych …
Krzemiany
ortokrzemiany zawierają izolowane aniony SiO
4
4-
Krzemiany wyspowe zawierają aniony Si
2
O
7
6-
,
Si
3
O
9
6-
, Si
6
O
18
12-
, …
Wspólne krawędzie i wspólne
ś
ciany stwarzają wiele możliwości
strukturalnych w krzemianach
wstęgowych, łańcuchowych i
warstwowych …
Są one składnikami wielu
minerałów, np. zeolitów, a także
glin, niektórych skał …
Połączenia germanu, cyny i ołowiu z
wodorem
Ge
Sn
Pb
(GeH
2
)
∞
GeH
2
Ge
2
H
6
Ge
n
H
2n+2
(GeH)
∞
Ge
Ge
Ge
H H
H H
H H
Ge
Ge
Ge
H
H
H
Ge
H
Ge
Ge
Ge
H
H
H
Ge
H
SnH
4
Sn
2
H
6
PbH
4
Reakcje germanu
Ge
O
2
GeO, GeO
2
+NaOH
GeX
2
X
2
HF+hydroliza
H
2
GeO
3
H
2
GeO
4
+NaOH
germaniany
S
2
GeS
2
Reakcje cyny
Ge
O
2
SnO, SnO
2
SnO
2
+2NaOH
stapianie
Na
2
SnO
2
cynian (IV)
sodowy
HCl
SnCl
2
SnO
2
+4 HCl
nie zachodzi
SnCl
4
utle
nia
nie
hydroliza

Reakcje ołowiu
Pb
O
2
PbO,
PbO
2
,
Pb
3
O
4
HNO
3
Pb(NO
3
)
2
2 NaOH + 2 H
2
O
Na
2
[Pb(OH)
4
]
Pb
3
O
4
Pb
2
II
Pb
IV
O
4
CH
3
COOH
Pb(CH
3
COO)
2
Wyszukiwarka
Podobne podstrony:
chemia lato 09 07 08 id 112430 Nieznany
chemia lato 12 07 08 id 112433 Nieznany
chemia lato 01 07 08
chemia lato 13 07 08
chemia lato 03 07 08
chemia lato 10 07 08
chemia lato 05 07 08 id 112417 Nieznany
chemia lato 06 07 08
chemia lato 11 07 08
chemia lato 12 07 08 id 112433 Nieznany
chemia lato 10 07 08
chemia lato 04 07 08
podst chemii 09 07 08
więcej podobnych podstron