
Gazy rzeczywiste, ciecze,
ciała stałe – właściwości,
struktury.

Stany skupienia

Ciała stałe
• Określony kształt i objętość
• Duża sztywność materii w stanie
stałym
• Nie wykazują płynności pod wpływem
przyłożonej siły
• Gęstość mniej zależna od
temperatury i ciśnienia niż w
przypadku cieczy a zwłaszcza gazów

Ciecze
• Brak stałej postaci, przybierają
kształt naczynia w którym się
znajdują
• Zachowując swą objętość nie
wypełniają całej objętości naczynia,
w którym się znajdują tzn. mają
„swobodną powierzchnię właściwą”

Gazy
• Zajmują cała objętość zbiornika, w
którym się znajdują; nie mają
swobodnej powierzchni granicznej
• Gęstość w bardzo dużym stopniu
zależy od zmian ciśnienia i
temperatury

GAZY

Gaz doskonały
• Brak oddziaływań
międzycząsteczkowych (za
wyjątkiem odpychania w momencie
zderzeń)
• Objętość cząsteczek jest znikoma w
stosunku do objętości gazu
• Zderzenia są doskonale sprężyste

pV = nRT
p - ciśnienie
V - objętość
n – ilość gazu (w molach)
R – stała gazowa
8,31 [JK
-1
mol
-1
]
T - temperatura
Gaz doskonały
Równanie stanu gazu doskonałego (równanie Clapeyrona)
Dla gazu doskonałego spełnione w całym zakresie temperatury i ciśnienia

• Gaz doskonały: model słuszny dla
rozrzedzonych gazów
• W warunkach normalnych może być
stosowany do wszystkich gazów
WARUNKI NORMALNE
p = 101325 Pa = 1atm
T = 273,15 K = 0 C
Gaz doskonały
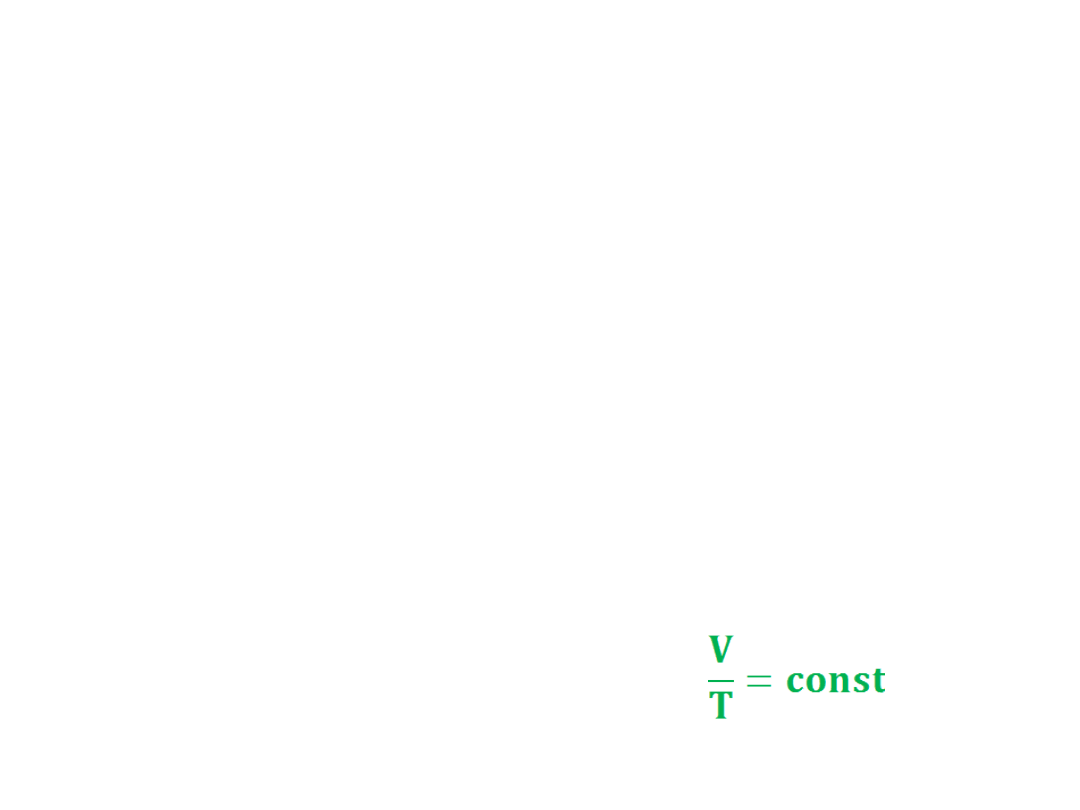
• PRAWO BOYLE’A
W warunkach ustalonej temperatury
pV = const
• PRAWO GAY-LUSSACA
W warunkach ustalonego ciśnienia
objętość gazu zmienia się wprost
proporcjonalnie do temperatury
bezwzględnej
V~T
Gaz doskonały

• Gazy rzeczywiste
: model gazu
doskonałego w dostatecznie
wysokich temperaturach pod
dostatecznie niskim ciśnieniem
• Obniżanie temperatury oraz
zwiększanie ciśnienia powoduje
odstępstwa od prawa gazu
doskonałego
Gaz doskonały

Odstępstwa od stanu gazu
doskonałego
Johannes van der Waals (1873 r.)
Nagroda Nobla z fizyki 1910 r
Oddziaływania międzycząsteczkowe
W przypadku zmniejszania objętości (wzrostu
ciśnienia)odgrywają rolę siły przyciągania
pomiędzy cząsteczkami.
TO SIŁY VAN DER WAALSA
Dzięki nim możliwe jest skroplenie gazu
Siły zanikają w miarę oddalania się
cząsteczek od siebie

Cząsteczki gazu mają określoną
skończoną objętość
Gdyby było inaczej w miarę
obniżania temperatury objętość
gazu malałaby do zera!
Odstępstwa od stanu gazu
doskonałego

Oddziaływania
międzycząsteczkowe
Energia wiązań kowalencyjnych
100-1000 kJ/mol
Energia oddziaływań
międzycząsteczkowych
5-40 kJ/mol
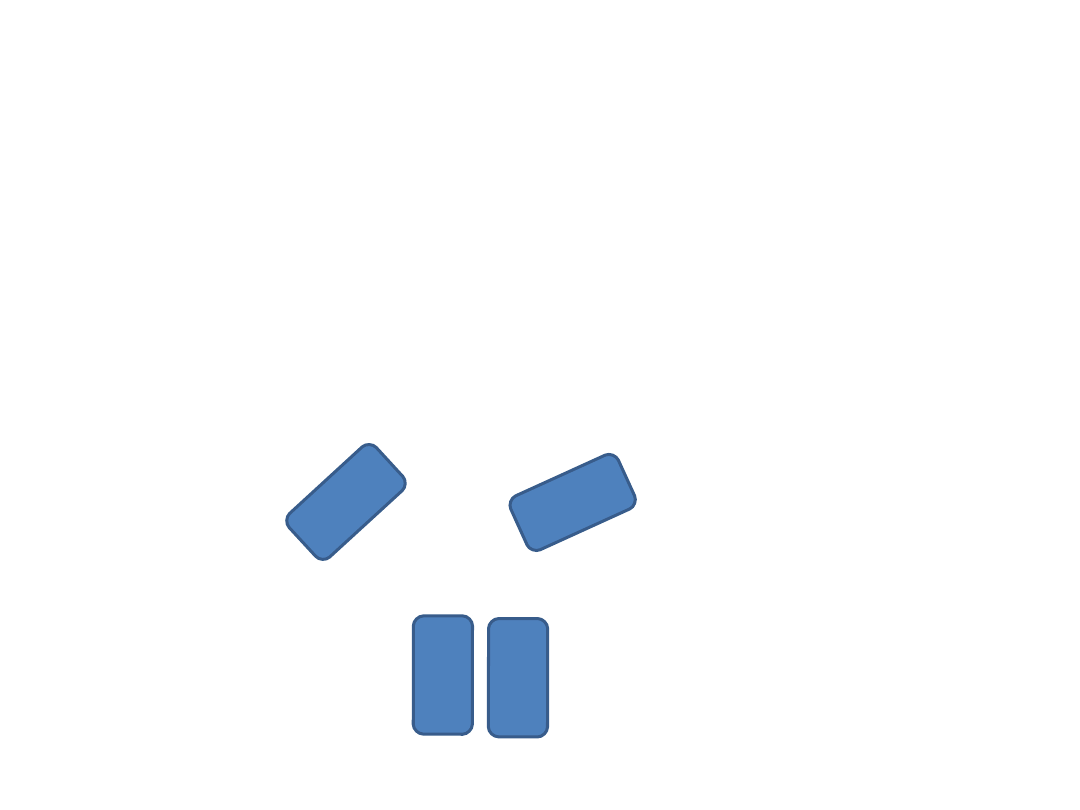
DIPOL TRWAŁY –DIPOL TRWAŁY
(efekt orientacji)
Substancje polarne
Wzajemne przyciąganie się
różnoimiennych biegunów dipoli
sąsiadujących ze sobą cząsteczek
Oddziaływania
międzycząsteczkowe
+
-
+ -
+
-
-
+
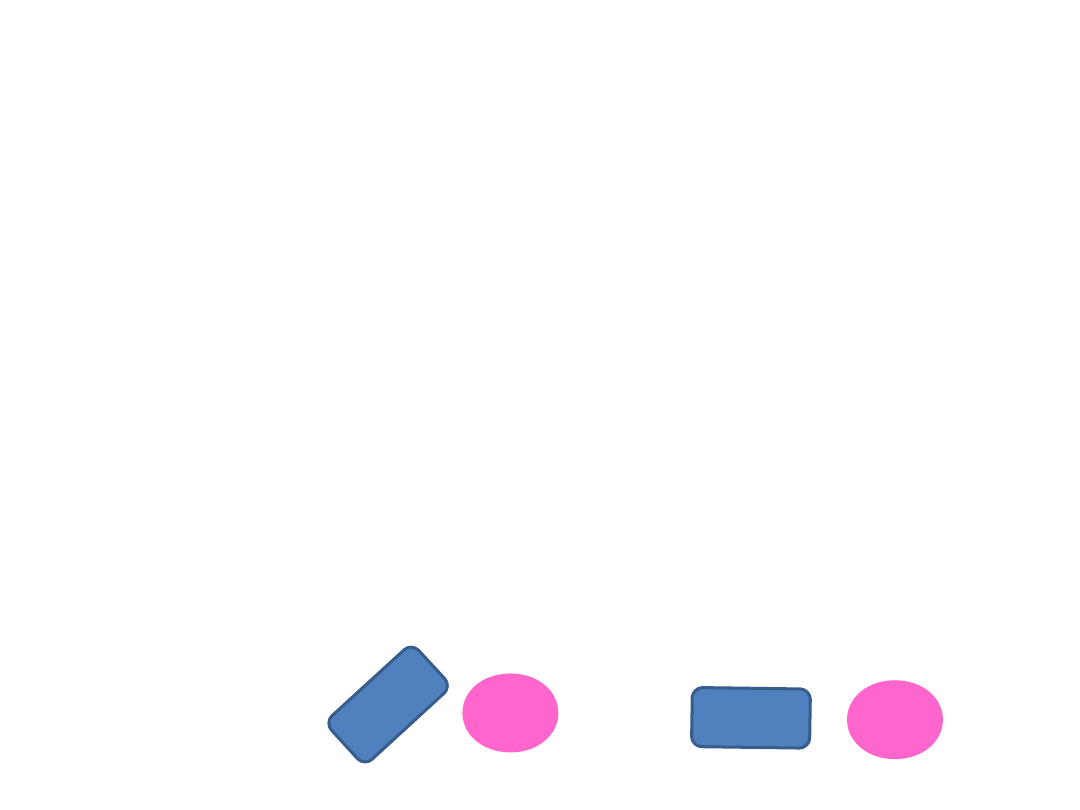
DIPOL TRWAŁY –DIPOL INDUKOWANY
(efekt indukcji)
Pomiędzy cząsteczką obdarzoną trwałym
momentem dipolowym a cząsteczką (lub
atomem),który w polu elektrycznym łatwo
ulega polaryzacji.
POLARYZACJA
– przesunięcie ładunków
elektrycznych wewnątrz cząsteczki pod
działaniem zewnętrznego pla elektrycznego.
Powstaje moment dipolowy indukowany
(wzbudzony)
Oddziaływania
międzycząsteczkowe
+
-
+ -
+ -

ODDZIAŁYWANIA DYSPERSYJNE
(efekt dyspersji)
Istnieją zawsze niezależnie od tego czy
cząsteczki o trwałych momentach
dipolowych są obecne czy nie.
Źródłem sił dyspersyjnych jest
przyciąganie pomiędzy chwilowymi
dipolami
Oddziaływania
międzycząsteczkowe

WIĄZANIA WODOROWE
Tworzą się gdy atom wodoru H jest
związany z silnie elektroujemnym atomem
X (F, O, N) i oddziałuje z niewiążącą parą
elektronową innego również silnie
elektroujemnego atomu Y w sąsiedniej
cząsteczce
HX Y
Oddziaływania
międzycząsteczkowe

CIAŁA STAŁE

Ciała stałe
Gazy – nieuporządkowane cząsteczki,
poruszające się w sposób chaotyczny
Ciała stałe – uporządkowane struktury

CIAŁA KRYSTALICZNE
• Atomy ułożone w sposób regularnym,
materia osiąga najwyższy stopień
uporządkowania!
• Sposób uporządkowania przedstawiamy za
pomocą sieci przestrzennej
• Atomy w sieci krystalicznej mogą być
związane z różną siłą w różnych jej
miejscach: charakterystyczna łupliwość w
określonym kierunku
• Od struktury zależą: rozszerzalność cieplna,
właściwości optyczne, magnetyczne i
elektryczne
• Ciała jednorodne, których właściwości zależą
od kierunku przyłożenia siły to ciała
ANIZOTROPOWE
Ciała stałe

Ciała stałe
POLIMORFIZM
ta sama substancja,
zależnie od warunków występuje w
dwóch lub więcej odmianach
różniących się postacią krystaliczną i
strukturą sieci przestrzennej.
Odmiany polimorficzne mają różne
właściwości fizyczne.
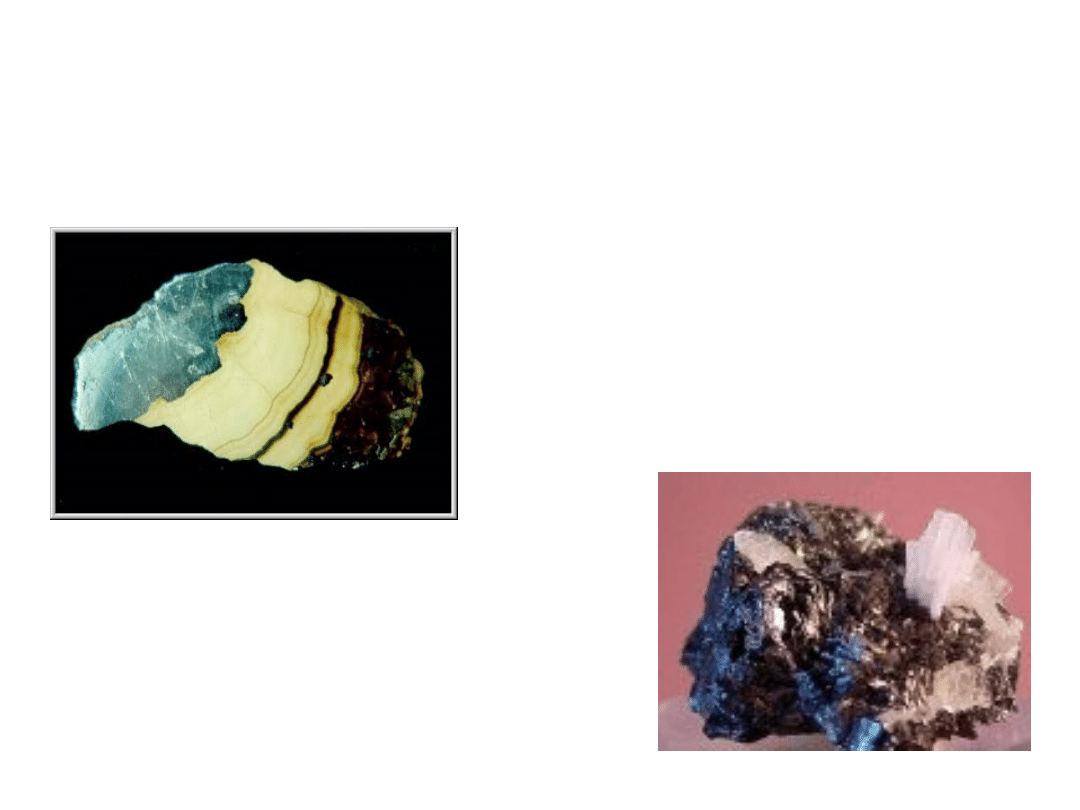
ZnS
Blenda cynkowa (sfaleryt)
krystalizuje w układzie regularnym
Blenda skorupowa. Kopalnia rud
cynku i ołowiu "Pomorzany" k/Olkusza
Fot.: J. Sylwestrzak
www.pgi.gov.pl/.../sfaleryt/sfaler
yt.htm
Wurcyt
Krystalizuje w układzie heksagonalnym

• ALOTROPIA
- odnosi się do
polimorfizmu pierwiastków.
• Mówimy o odmianach alotropowych
Termin nie dotyczy tylko pierwiastków
w stanie stałym!
Przykłady:
Tlen O
2
Tlen O
3
(ozon)
Ciała stałe
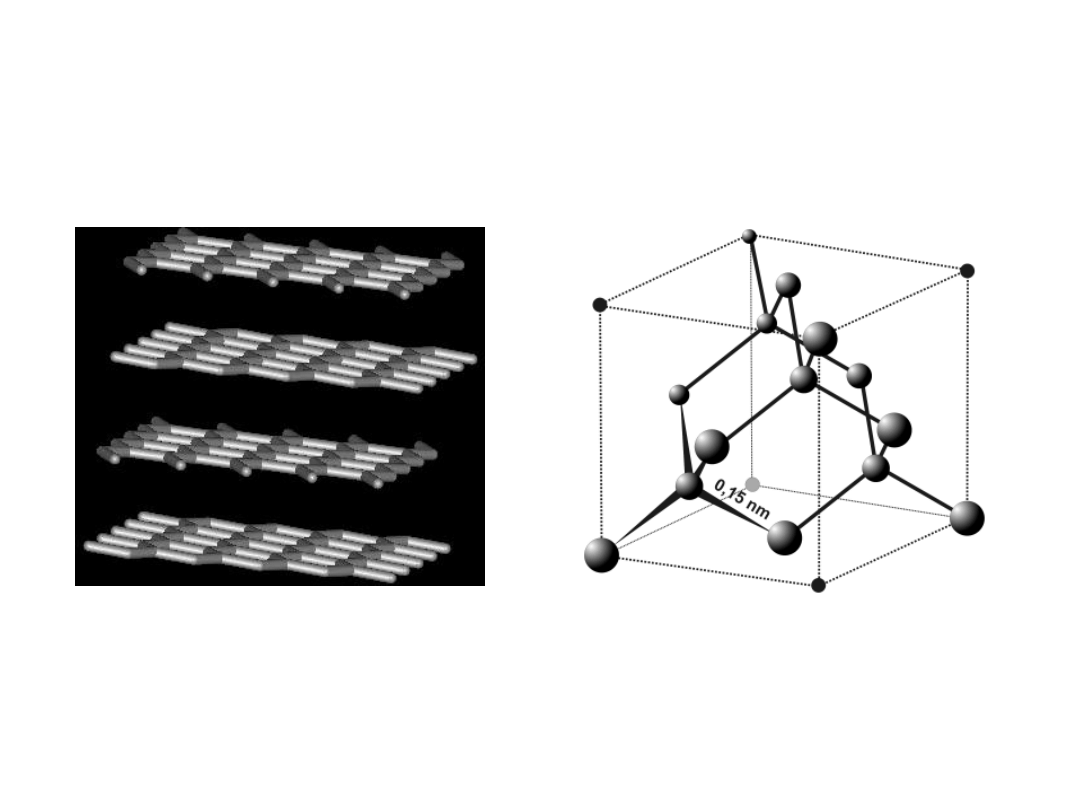
Ciała stałe
GRAF
IT
DIAME
NT
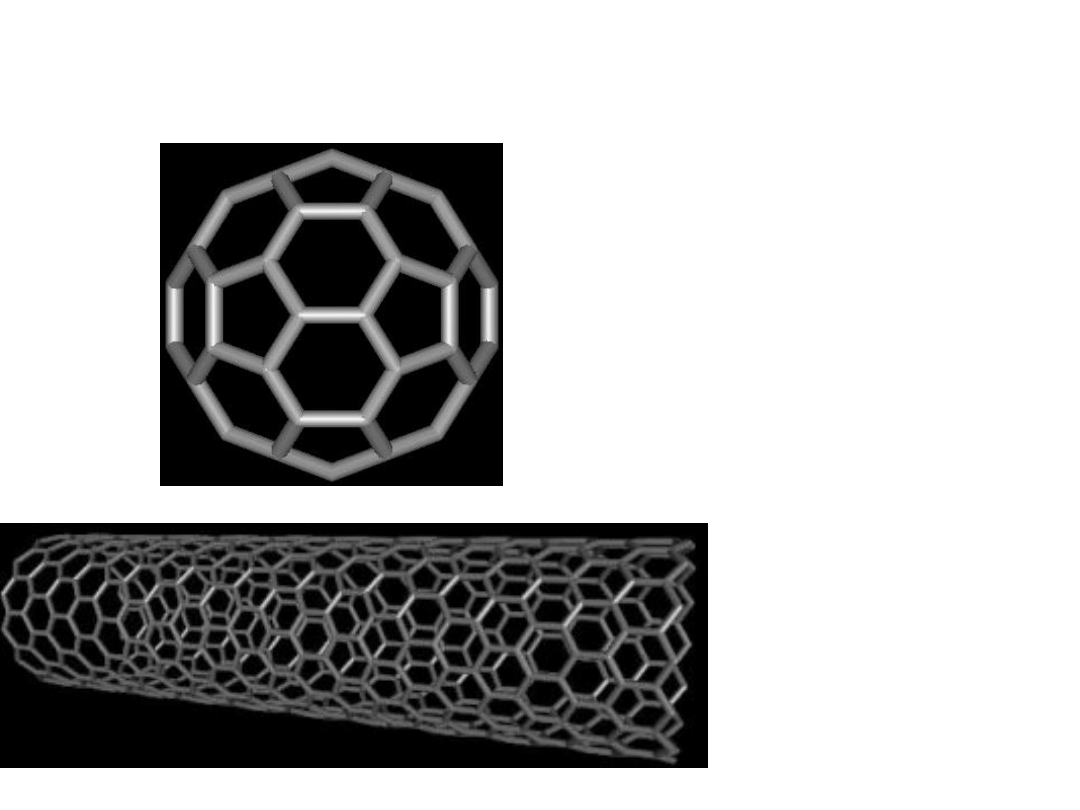
Ciała stałe
NANORURK
A
WĘGLOWA
FULLEREN

SUBSTANCJE IZOMORFICZNE
–
substancje o tym samym typie wzoru
chemicznego, tworzące ten sam typ sieci
przestrzennej o takich samych lub bardzo
zbliżonych rozmiarach komórki
elementarnej.
Tworzą roztwory stałe (kryształy
mieszane)
Z roztworów wodnych można otrzymać
kryształy zawierające np. KClO
4
oraz KMnO
4
Ciała stałe

CIAŁA BEZPOSTACIOWE
Typowy przedstawiciel: szkło
Nie mają prawidłowej budowy
wewnętrznej oraz wynikających z tej
budowy właściwości takich jak: ściśle
określone temperatury topnienia,
łupliwość.
Nie wykazują więc zależności
właściwości od kierunku. Są to ciała
IZOTROPOWE.
Ciała stałe

CIAŁA BEZPOSTACIOWE
Dwa główne typy ciał bezpostaciowych
występujących w naturze:
• Przechłodzone ciecze (szkliwa)-
zakrzepły gwałtownie w temperaturze
niższej od temperatury krzepnięcia
danej substancji (układu)
• Nieprzekrystalizowane osady
koloidalne
Ciała stałe

Zgodnie z przyjętą umową terminem
ciała stałe określamy tylko ciała
krystaliczne. Nie obejmuje on ciał
bezpostaciowych, mimo ich sztywnej
postaci.
Ciała stałe

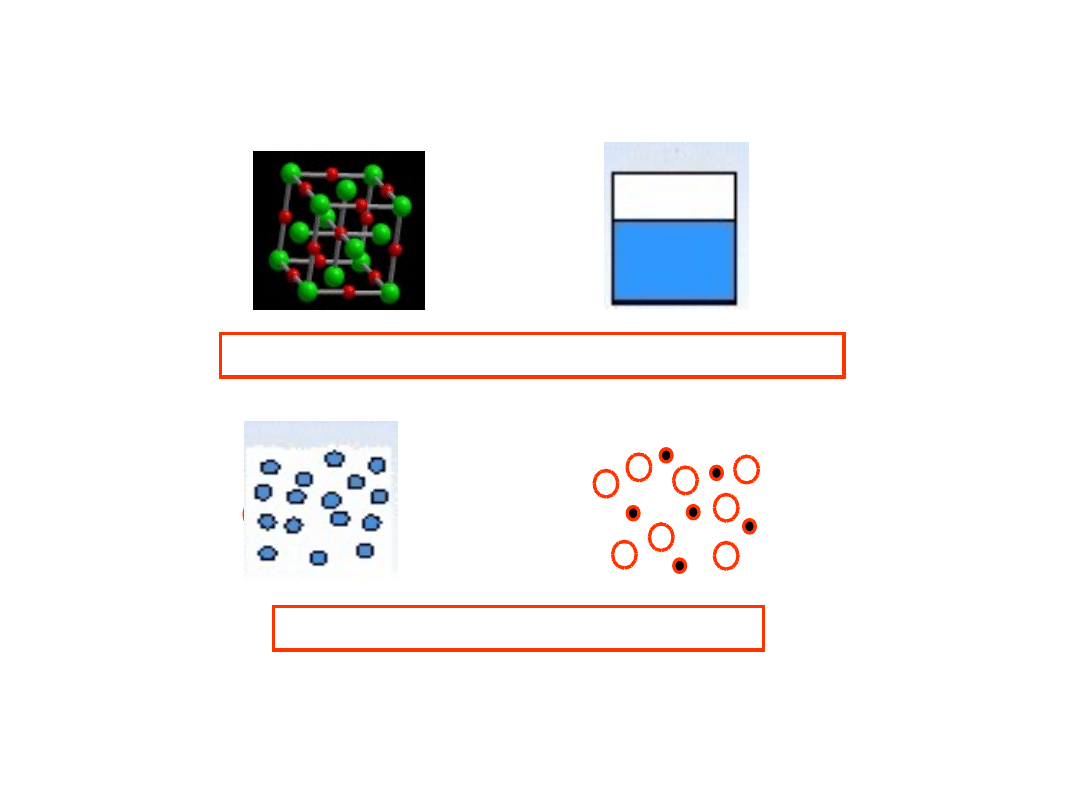
CIECZE
Ciała
stałe
Gazy
Ciecze
Siły przyciągania większe niż w gazach
Praktycznie nieściśliwe
Nie tworzą uporządkowanej struktury (sieci krystalicznej)

Ciecze anizotropowe
• Niektóre substancje organiczne o
wydłużonych cząsteczkach topiąc się
przechodzą ze stanu krystalicznego
w ciecz fizycznie anizotropową o
różnych właściwościach zależnie od
kierunku.
• Są to
CIEKŁE KRYSZTAŁY
(ciecze
krystaliczne).

Ciało stał e
(kryształ)
Ciekłe kryształy
Ciecz
ANIZOTROPOWE
IZOTROPOWE

PLAZMA
Ciało stałe
Ciecz
Gaz
Plazma
users.uj.edu.pl/~kulessa/Wyk1_term.ppt
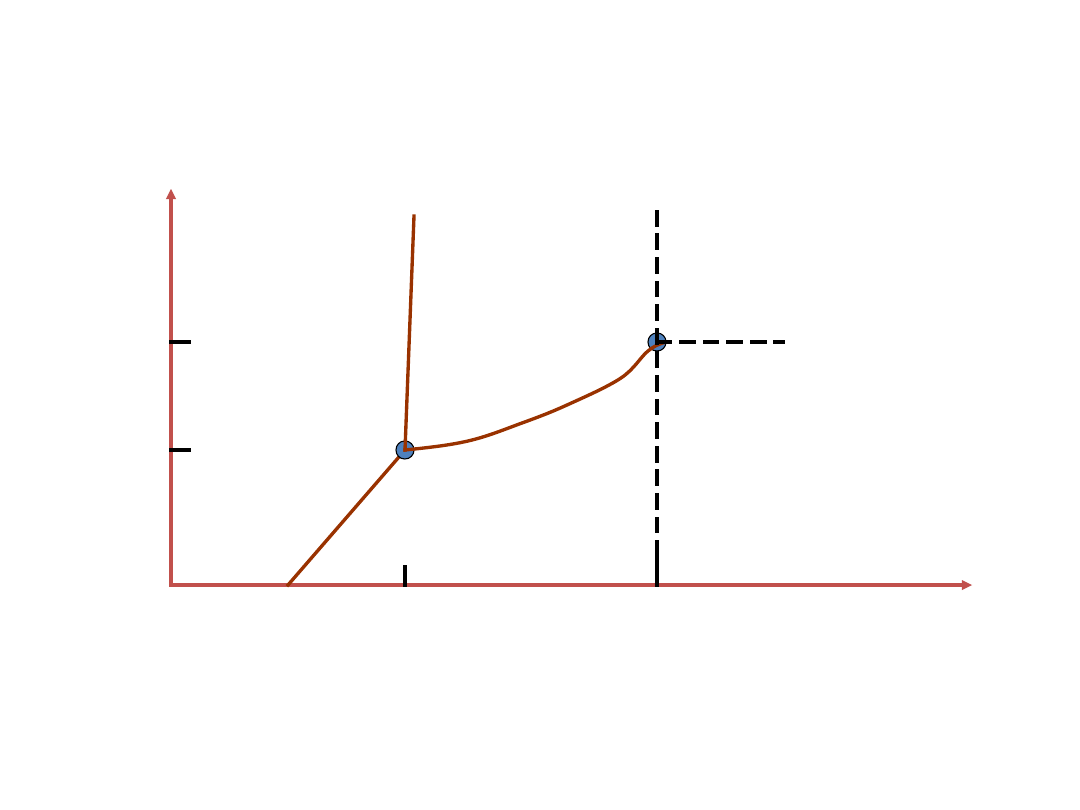
Stany skupienia materii ściśle zależą od wartości
określonych współrzędnych termodynamicznych. Są
nimi ciśnienie i temperatura.
T
p
Punkt
Potrój
ny
Punkt
Krytycz
ny
T
K
T
P
p
K
p
P
Ciało
stałe
Ciecz
Para
Gaz
Plazma
users.uj.edu.pl/~kulessa/Wyk1_term.ppt

Plazma- nie jest to ani ciecz
ani gaz. Traktujemy ją jako
czwarty stan skupienia
materii

Plazma
• Plazma to zjonizowany gaz o odpowiednio
dużej koncentracji cząstek naładowanych w
postaci jonów i elektronów.
• Każda substancja w odpowiednio wysokiej
temperaturze może przejść w stan plazmy w
wyniku termicznej jonizacji.
• Plazma silnie oddziaływuje z zewnętrznym
polem elektrycznym i magnetycznym. Jest
również dobrym przewodnikiem prądu
elektrycznego. Opór elektryczny plazmy
maleje wraz ze wzrostem temperatury i w
wysokich temperaturach plazma jest lepszym
przewodnikiem niż metale.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
Wyszukiwarka
Podobne podstrony:
09 Wsp�czynnik za�amania �wiat�a dla cia� sta�ych
05 Budowa ciała stałego ppt
02, WST$P, Jedn˙ z podstawowych metod laboratoryjnych wyznaczania g˙sto˙ci cia˙ sta˙ych i cieczy jes
wyznaczanie ciepa waciwego cia staych2
gazy rzeczywiste01
Ciecz-cia-o sta-e, technologia chemiczna, chemia fizyczna, srawozdania
gazy rzeczywiste
Wyznaczanie ciep a w a ciwego cia sta ych, PRACOWNIA ZAK˙ADU FIZYKI PL
Pary I Gazy Rzeczywiste
18 Organy wladzy Rzeczypospolitej Polskiej Rada Ministrowid 17662 ppt
hydraulika 5b, Straty energetyczne powstaj˙ w skutek tego, ˙e ciecz rzeczywista ma lepko˙˙, a w zwi
Wniosek o zorganizowanie sta�u lub przygotowania zawodowego
wyznaczanie wsp˘czynnika rozszerzalnoci cia staych
11 Poziomy energetyczne atomu wodoru Sta�a Rydberga
13 Sta┬│a dysocjacji
ZPW gazy pary i ciecze
więcej podobnych podstron