ZESTAWIENIE WYNIKÓW
temp. [st.C] |
temp. [K] |
SEM [V] |
25 |
298 |
0,4667 |
30 |
303 |
0,4633 |
35 |
308 |
0,4620 |
40 |
313 |
0,4586 |
1. W ogniwie chemicznym o budowie zachodzą nastepujące procesy:
na anodzie: 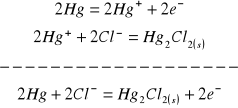
na katodzie: ![]()
co sumarycznie daje: ![]()
2. Używane w pomiarach ogniwo można przedstawić schematycznie w następujący sposób:
(-) ![]()
(+)
3. Równanie Nersta na SEM badanego ogniwa:
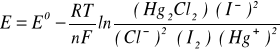
[V]
Ponieważ aktywność ciał stałych jest równa 1, więc (I2)=1 i (Hg2Cl2)=1. Wartość aktywności jonów Hg+ pomijamy ze względu na bardzo małe stężenie.
Stąd:
![]()
[V]
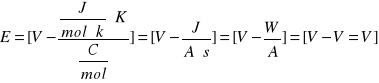
gdzie:
E- siła elektromotorczna [V]
E0 - normalna siła elektromotoryczna [v]
R - stała gazowa - 8,314 [J/mol.K]
T - temperatura bezwzględna [K]
n - liczba elektronów biorących udział w reakcji
F - stała Faradaya - 96485,3 C/mol
4. Dane literaturowe na temat potencjałów normalnych elektrod używanych w doświadczeniach:
Elektroda |
Reakcja elektrodowa |
Potencjał E0 [V] |
I-/I2,Pt |
I2+2e-= 2I- |
+0,5360 |
Cl-/Hg2Cl2,Hg |
2Hg ++2 Cl-= Hg2Cl2 |
+0,2680 |
5. Obliczenia normalnej siły elektromotorycznej ogniwa ( dla aktywności reagentów równych jedności) - ΔE0:
![]()
[V]
gdzie: E01 - potencjał normalny elektrody dodatniej [V]
E02 - potencjał normalny elektrody ujemnej [V]
ΔE0=0,5360-0,2680=0,2680 [V]
6. Obliczenie stosunku aktywności jonów I-/Cl- w ogniwie na podstawie zmierzonej wartości SEM ogniwa (napięcia ogniwa w warunkach bezprądowych) w warunkach standardowych i obliczonej wartości normalnej siły elektromotorycznej ogniwa:
Stosunek aktywności jonów I-/Cl- wyznaczamy z równania Nersta na SEM badanego ogniwa
![]()
po przekształceniu:
![]()
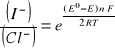
otrzymujemy:

7. Wartość współczynnika temperaturowego.
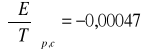
![]()
8. Z równania Gibbsa-Helmholtza obliczamy efekt cieplny ΔH, zmianę entalpii swobodnej ΔG oraz zmianę entropii ΔS w określonych warunkach temperatury, ciśnienia i stężenia reagentów. Obliczenia przeprowadzamy dla temperatury końcowej (najwyższej), w której badaliśmy dane ogniwo SEM - 400C:
Obliczamy entalpię swobodną :
![]()
= z .F .E
z = 2
F = 96485,31 [C/mol]
E = 0,4586 [V]
![]()
= - 2 . 96485,31 . 0,4586 = - 88496,326[![]()
]
![]()
=![]()
b) Obliczamy entropię:
![]()
= z .F .![]()
z = 2
F = 96485,31 [C/mol]
![]()
= -0,00047 [V/K]
ΔS= 2 . 96485,31 .(-0,00047) = -90,696 [J/mol . K]
ΔS= ![]()
c) Obliczamy entalpię :
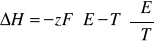
![]()
ΔH = - 88496,326 + 313 . (-90,696) = -116884,174 [![]()
]
ΔH = ![]()
1
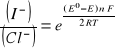
Wyszukiwarka
Podobne podstrony:
Ćwiczenia zestaw nr (2)
Zestawienie wyników
ZESTAWIENIE WYNIKÓW
cwiczenia zestaw2(1) Nieznany
Statyka - Przestrzenny Układ Sił, sem II, Mechanika Techniczna I - Wykład.Ćwiczenia, Zestaw V (oce)
Zestawienie wyników pomiarów
testy sprawdzajace, Zbiorcze zestawienie wyników testy sprawdzającego poziom wiedzy dzieci 3 - letni
ZESTAWIENIE WYNIKÓW, Politechnika, Sprawozdania, projekty, wyklady, Techniki wytwarzania
Zestawienie wyników odciążenie wykopem
4 Zestawienie wyników
Ćwiczenia zestaw nr (1)
zestawienie wyników
Ćwiczenia zestaw nr (7)
Zbiorcze zestawienie wynikow obserwacji w oparciu o arkusz obserwacyjny GE, Zoo i zwierzęta egzotycz
cw 5 - przyklad, biotechnologia inż, sem3, BiB, ćwiczenia, zestawy
cw ogolem, biotechnologia inż, sem3, BiB, ćwiczenia, zestawy
cw 4 - przyklad, biotechnologia inż, sem3, BiB, ćwiczenia, zestawy
cw 12 - statystyka przyklad, biotechnologia inż, sem3, BiB, ćwiczenia, zestawy
cw 6 - przyklad, biotechnologia inż, sem3, BiB, ćwiczenia, zestawy
więcej podobnych podstron