WSTĘP TEORETYCZNY:
Dokładny pomiar ciepła reakcji możliwy jest tylko dla nielicznych spośród wielu istniejących reakcji chemicznych. Precyzyjne pomiary kalorymetryczne można wykonać jedynie w przypadku reakcji przebiegających szybko, do końca i bez procesów ubocznych.
Szczególnie dogodne do pomiarów kalorymetrycznych są organiczne reakcje spalania. Źródłem większości istniejących danych termochemicznych dotyczących związków organicznych są reakcje spalania.
Celem ćwiczenia jest wyznaczenie pojemności cieplnej bomby kalorymetrycznej oraz oznaczenie ciepła spalania badanej substancji.
Ciepło spalania wyznacza się zwykle w „bombie kalorymetrycznej”. Naczyńko z odważoną próbką umieszcza się w bombie kalorymetrycznej, którą następnie wypełnia się tlenem pod ciśnieniem około 20 atmosfer. Rozżarzone prądem elektrycznym cienkiego drucika zanurzonego w próbce powoduje zapoczątkowanie reakcji. Zainicjowana reakcja przebiega w sposób gwałtowny z wydzieleniem dużej ilości ciepła. Ciepło to wyznacza się na podstawie przyrostu temperatury wody, otaczającej kalorymetr.
Podstawowe pojęcia termochemii są prostymi konsekwencjami I zasady termodynamiki: zmiana energii wewnętrznej układu (U) może dokonać się w wyniku wymiany z otoczeniem na sposób ciepła (q) lub w inny (W):
ΔU = q - W
Ciepła:
Rozpuszczania (Qn) jest to ilość ciepła wydzielana lub pochłonięta podczas rozpuszczania 1 mola substancji w n molach rozpuszczalnika
Pełne ciepło rozpuszczania (Qnas) występuje wówczas, gdy do rozpuszczenia 1 mola substancji użyjemy takiej ilości rozpuszczalnika, że powstaje roztwór nasycony
Pierwsze ciepło rozpuszczania (Qaq) towarzyszy rozpuszczaniu 1 mola substancji w nieskończonej ilości rozpuszczalnika (powstaje roztwór nieskończenie rozcieńczony)
Cząstkowe ciepło rozpuszczania towarzyszy rozpuszczaniu 1 mola substancji w tak dużej ilości roztworu o określonym stężeniu, że stężenie to nie ulega zmianie
Spalania jest to ilość ciepła wydzielana lub pochłaniana podczas spalania 1 mola substancji w n molach innej substancji
Molowe jest to ilość ciepła potrzebna do ogrzania 1 mola substancji o 1 stopień
Cp = (δH/δT)p
Cv - ciepło molowe o stałej objętości Cv = (δU/δT)v
OPRACOWANIE WYNIKÓW:
W oparciu o wyniki pomiarów wykonuję wykres zależności temperatury od czasu (wykres nr 1). Z wykresu graficznie wyznaczam przyrost temperatury i poprawkę na promieniowanie (Δt+∑V). Pojemność cieplną wyznaczam ze wzoru:
K = ![]()
gdzie: K - pojemność cieplna bomby
c - gramowe ciepło spalania tabletki wzorcowej, c = 26,469 KJ/g
m - masa substancji spalonej, m = 0,9590 g
(Δt + ∑V) - wyznaczony graficznie przyrost temperatury i poprawka na
promieniowanie (wartość odczytana z poniższego wykresu)
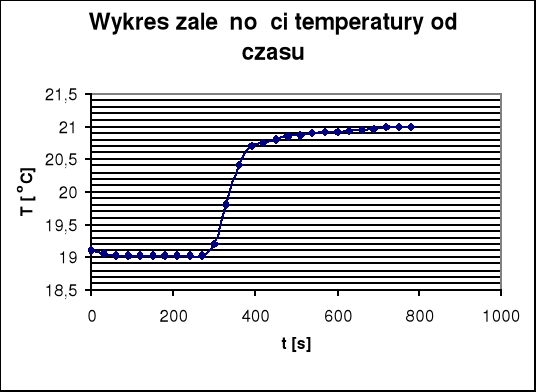
(Δt + ∑V) = 1,54
K = 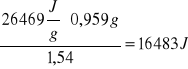
Następnie obliczam ciepło spalania badanej substancji ze wzoru:
K = ![]()
→ c = ![]()
K - pojemność cieplna bomby, K = ![]()
c - gramowe ciepło spalania badanej substancji
m - masa badanej substancji, m = 0,9940 g
(Δt+∑V) - wyznaczony graficznie przyrost temperatury i poprawka na promieniowanie (wartość odczytana z poniższego wykresu)
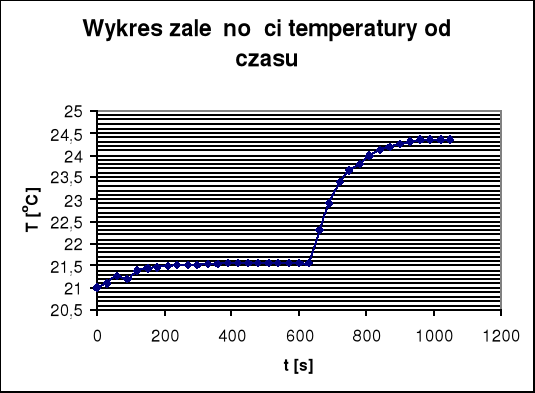
(Δt+∑V) = 3
c = ![]()
OPIS WYKONYWANEGO ĆWICZENIA:
Wyznaczenie pojemności cieplnej bomby kalorymetrycznej:
Na wadze analitycznej zważyłam pastylkę substancji wzorcowej. Następnie przygotowałam bombę do pomiaru. Głowicę bomby umieściłam w statywie, pastylkę włożyłam do tygielka i końce drucika połączyłam z elektrodami. Głowicę włożyłam do dolnej części bomby, zakręciłam bombę i zaniosłam do pokoju laboranckiego w celu napełnienia bomby tlenem. Bombę umieściłam w kalorymetrze. Następnie nakryłam kalorymetr pokrywą i włożyłam w nią termometr Beckmana. Włączyłam mieszadło i co 30 sekund odczytywałam wartość temperatury aż do momentu jej ustalenia. Następnie spaliłam próbkę naciskając przez chwilkę przycisk „zapłon”, potem co 30 sekund odczytywałam wartość temperatury aż do momentu jej ustalenia.
Oznaczenie ciepła spalania:
Z drucika do spalań wykonałam spiralkę. Następnie umieściłam ją wewnątrz naczynia do prasowania pastylek, tak aby końce drucika znajdowały się na zewnątrz. Do naczynia nasypałam (małą łyżeczkę) badanej substancji i wykonałam pastylkę, którą zważyłam potem na wadze analitycznej. Dalej wykonywałam wszystkie czynności tak jak już pisałam w przypadku wyznaczania pojemności cieplnej bomby kalorymetrycznej.
WNIOSKI:
Celem ćwiczenia było oznaczenie ciepła spalania badanej substancji i w tym celu konieczne było wyznaczenie pojemności cieplnej bomby kalorymetrycznej (obliczyłam, że K = ![]()
) znając ciepło spalania substancji wzorcowej (c = 26469 ![]()
). Tak więc pojemność cieplną bomby kalorymetrycznej wyznaczyłam ze wzoru:
K = ![]()
c - była to wartość znanego przeze mnie ciepła spalania tabletki wzorcowej, m - to masa tej tabletki, która wynosiła 0,9590 g oraz (Δt+∑V) - to przyrost temperatury i poprawka na promieniowanie, którą to wartość wyznaczyłam graficznie z pierwszego wykresu i która wyniosła 1,54.
Druga część mojego doświadczenia dotyczyła oznaczenia ciepła spalania tabletki z badanej substancji i ów część przeprowadziłam w tej samej bombie kalorymetrycznej. Dzięki znanej już pojemności cieplnej (K) mogłam następnie obliczyć ciepło spalania (obliczyłam, że c = ![]()
) tabletki z substancji badanej ze wzoru:
c = ![]()
m - była to masa tabletki z substancji badanej, która wynosiła 0,9940 g a (Δt+∑V) - to przyrost temperatury i poprawka na promieniowanie, którą to wartość wyznaczyłam graficznie z drugiego wykresu i która wyniosła 3.
Tabletką, którą spalałam była tabletka z naftalenu. Literaturowe ciepło spalania tej substancji wynosi 40,23![]()
, a więc mój błąd wynosi:
![]()
Myślę, że mogę powiedzieć, że popełniony przeze mnie błąd nie jest duży.
G-woli formalności muszę nadmienić, iż sprawozdanie to może zawierać pewne błędy, a wynikać one mogą z nieprecyzyjnego odczytu wartości temperatur z termometru (niedokładność ludzkiego oka, ja - osoba przeprowadzająca ćwiczenie posiadam wadę wzroku). To oczywiście mogło doprowadzić do błędnych wyliczeń. Z całą pewnością mogę powiedzieć, że doświadczenie przeprowadziłam prawidłowo - zgodnie z instrukcją.
2
Wyszukiwarka
Podobne podstrony:
SEM ogniwa1, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, SEM ogniwa
wpływ stężenia i temperatury na lepkość roztworów, Chemia fizyczna, laboratorium, Chemia fizyczna
Ćwiczenie 1 - oznaczanie stalej i stopnia dysocjacji, Biotechnologia PWR, Semestr 3, Chemia fizyczna
chem.fiz.równowagi fazowe, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna, laboratorium
chemia fizyczna laboratoria, iwona chem. fiz. ćw. 91
Badanie równowagi fazowej w układzie trójskładnikowym 8.3, Technologia chemiczna, Chemia fizyczna, l
elektrolityzadania st, Technologia chemiczna, Chemia fizyczna, laboratorium
chemia fizyczna laboratoria, 95,94, 97
chemia fizyczna laboratoria, 31,32,33vigora, 97
chemia fizyczna laboratoria, KOND42, 97
chemia fizyczna laboratoria, KOND42, 97
22, chemia fizyczna laboratorium, 22
Pytanianakolosach, Akademia Górniczo - Hutnicza, Technologia Chemiczna, Studia stacjonarne I stopnia
Ćwiczenie 10 - katalityczny rozpad wody utlenionej, Biotechnologia PWR, Semestr 3, Chemia fizyczna -
chemia fizyczna laboratoria, 12Ania, cccccccc
cwiczenie 34, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, chemia fizyczna
więcej podobnych podstron