Zadania ze stężeń
Ile wody należy dodać do 100cm3 kwasu azotowego HNO3 o gęstości d = 1,34 g/m3 i stężeniu Cp = 55% aby otrzymać roztwór o stężeniu Cm = 0,1mol/dm3. Kontrakcję pominąć.
Cp stężenie = ms / mv x 100%
Cm = nliczba moli substancji / Vobjętość rotworu
dgęstość = mv / Vr 1,34 g/cm3 = mr / 100cm3
mr = dgęstość x Vr mr = 1,34g/cm3 x 100cm3 = 134g
podstawić do wzoru na Cp:
Cp stężenie = ms / mv x 100% 55% = ms / 134g x 100%
ms = Cp stężenie x mv / 100% ms = 55% x 134g / 100% = 73,7g
MHNO3 = 1+14+48 = 63 g/mol ( masa molowa z tablic )
n = ms / M
n = 73,7 g / 63 g/mol = 1,17 mola
Cm stężenie molowe = n / V mol/dm3
V = n / Cm V = 1,17mola / 0,1mol / dm3 = 11,70dm3 ( objętość końcowa )
11,7dm3 - 0,1dm3 = 11,6dm3
Odp.: 11,59dm3
Ile cm3 Cp = 36% roztworu HCl o gęstości d = 1,18g/cm3 należy rozcieńczyć wodą aby przygotować V2 = 5 dm3 roztworu o stężeniu Cm2 = 0,15 mol/dm3.
Cp = 36% d = 1,18g/cm3 V2 = 5 dm3 Cm2 = 0,15 mol/dm3
V1 = ?
Cm2 = n / V2 0,15mol/dm3 = n / 5dm3 nilość moli = 0,15mol/dm3 x 5dm3 = 0,75mola
MHCL = 1 + 35,5 = 36,5 g/mol ( masa molowa z tablic )
n = ms / M 0,75mola = ms / 36,5 g/mol ms = 0,75g/mol x 36,5g/mol = 27,38g
Cp stężenie = mv substancji / mroztworu x 100%
mroztworu = mv substancji x 100% / Cp stężenie mv = 27,38g x 100% / 36% = 76,06g
dgęstość = mv / Vr 1,18g/cm3 = 76,06g / Vr
Vr = 76,06g / 1,18g/mol = 64,46cm3
Odp. 64,35 cm3
Zadania z iloczynu rozpuszczalności
[AgCl] [Ag+] [Cl-] = Kir = x*x =x2
[PbJ2] [Pb2+] [2j-] = Kir = x*2x2 = 4x3
[CoS] [Co2+] [S2-] = Kir = x*x = x2
W ilu dm3 wody można rozpuścić 0,2 g CaC2O4.
Kir = 2,57*10-9 M =
CaC2O4 → Ca2+ C2O42-
Kir = x*x = x2
x = pierwiastek z Kir
pierwiastek z 2,57*10-9 = 5,0695*10-5
w 1 dm3 → m=x*M = 5,0695*10-5 *M = wynik
wynik - 1dm3
0,2g - x
x = 1dm3 * 0,2g / wynik
W ilu dm3 wody można rozpuścić 0,2g Ć=CaCO3?
Kir = 4,7*10-9 M=100g/mol
CaCO3 Ca2+ +CO2-3
Kir = x*x=x2
![]()
W 1dm3 m=x*M = 6,8557*10-5 *100g/mol = 6,8557*10-3 mol/dm3
0,0068557 mol/dm3 ---- 1dm3
0,2g ----- x
x=1dm3 * 0,2g / 0,0068557mol/dm3 = 0,00137
Zadania z wytrąceniem osadu.
Czy powstanie osad jeżeli zmieszamy ze sobą 100cm3 roztworu NaCl o stężeniu 0,01 mol/dm3 i 150 cm3 Na2SO4?
KiRNa2SO4 = 6,26x10-5
Odp.: Nie wytraci się.
Czy wytrąci się osad CaSO4 gdy 100cm3 CaCl2 o stężeniu 0,1 mol/dm3 i 150cm3NaSO4 o takim samym stężeniu a Kir = 6,26*10-5
CaCl2 + NaSO4CaSO4 + 2NaCl
nCa2+ = nCaCl2 = C*V = 0,01mol/dm3*0,1dm3 = 0,001mol
nSO4 = nNa2SO4 = C*V = 0,01mol/dm3*0,15dm3 = 0,0015mol
po zmieszaniu V=(100 + 150) = 250cm3=0,25dm3
CCa2+ = 0,001/0,25=4*10-3mol/dm3
CSO42- = 0,001/0,25 = 6 *10-mol/dm3
Kir = 4*10-3*6*10-3=2,4*10-5
2,4*10-5<6,16 *10-5
osad się nie wytrąci!!!
Czy powstanie osad jeżeli zostaną zmieszane jednakowe objętości 0,10 molowego Pb(NO3)2 i 0,40 molowego NaCl.
KiR PbCl2 = 1,7x10-5
Odp.: Tak
Zadania z wydajności reakcji
Wwydajność% = masa produktu / masa produktu teoretyczna *100%
3,8g octanu ołowiu Pb(CH3COO)2 rozpuszczono w 30cm3 ciepłej wody destylowanej zakwaszonej CH3COOH
2g KCr2O7 rozpuszczono w 30cm3 wody destylowanej
Suchy osad 3,17g
MK2Cr2O7 = 294g/mol
MPb(CH3COO)2 = 379g/mol
2Pb(CH3COO)2 * 3H2O + K2CrO7 → 2PbCrO4 + 2CH3COOH + 5H2O + 2CH3COOK
n octanu = 3,8g / 379g/mol = 0,01mola
n dwuchromianu = 2g / 294g/mol = 0,007mola
dwuchromianu użyto w nadmiarze
2 mole octanu - 2 mole dwuchromianu
0,01 mola - x
x = 0,01mola
mPbCrO4 = n * M = 0,01mola * 323g/mol = 3,23g
Wydajność reakcji
3,23g - 100%
3,17g - x
x = 97,53%
Zadania z PH:
Jakie jest pH roztworu kwasu siarkowego o stężeniu Cm=0,005 mol/dm3.
pH = -log[H+] stężenie molowe jonów H
H2SO4 → 2H+ + SO42-
stężenie [H+] = 2 (liczba jonów H+) x Cm = 2 x 0,005 mol/dm3 = 0,01 mol/dm3
pH = -log 0,01 = 2
Jakie jest pH roztworu zawierającego 0,365 g HCl w 1 dm3?
ms HCL = 0,365g Cm = ? (stężenie molowe) Vr = 1 dm3
Cm = n / Vr n = ms / M M = 36,5
n = 0,365g / 36,5 g/mol = 0,01 mola
Cm = 0,01 mola / 36,5 dm3 = 0,01 mol/dm3
stężenie [H+] = 1 (liczba jonów H+) x Cm = 1 x 0,01 mol/dm3 = 0,01 mol/dm3
pH = -log 0,01 = 2
Obliczyć pH roztworu HNO2 o stężeniu 0,3206 mol/dm3 zdysocjowanego w 5%
HNO2 → H+ + NO2-
[H+] = α * c = 0,05 * 0,3206 mol/dm3 = 0,01603 mol/dm3
pH-H 1,603*10-2 = 2 - 0,2041 = 1,80
Kompleksometria
Obliczenia
NEDTA=NMg2+ CEDTA*VEDTA=CAl2+ + VMg2+ CMg2+=(CEDTA*VEDTA)/Val2+
Musimy dysponować mianowanym roztworem EDTA o dokładnie określonym stężeniu
Masa molowa EDTA 372,24 g/mol
Stężenie molowe roztworu EDTA C = n / V = mnaważki EDTA / Mmasa molowa EDTA * Vkolby =
Masa Mg2+ 24,31g/mol
nEDTA / nMg2+ = 1 / 1
CEDTA * VEDTA / CMg2+ * VMg2+ = 1 / 1 → CMg2+ = CEDTA * VEDTA / VMg2+
Stężenie molowe EDTA
Masa Mg2+
MMg2+ = CMg2+ * MMg2+ * VMg2+
Zadanie 1
Ile procent miedzi zawierała analizowana próbka miedzi po rozpuszczeniu 0,7585g i zamaskowaniu innych składników. Na zmiareczkowanie Cu zużyto 28,9cm3 0,00934 molowego roztworu EDTA.
Masa próbki 0,7585g
M =63,5 g/mol
NCu = NEDTA = CEDTA * VEDTA = 0,00934mo/dm3 * 0,0289dm3 = 2,7*10-4mola
mcu=n*M = 2,7*10-4mola * 63,5g/mol = 0,01714g
C%Cu=(mcu*100%)/mpr =(0,012114*100)/0,7585 = 2,26%
Zadanie 2
Wyrazić twardość wody w stopniach mini molowych i niemiecki jeżeli na zmiareczkowanie próbki 100cm3 wody zużyto 35cm3 EDTA w stężeniu 0,024 mol/dm3
Cw*Vw= CEDTA*VEDTA
![]()
10mmol - 0,5mmol/dm3 10mmol = 2,80N
x - 8,4mol/dm3 x=16,80mmol 16,80mol = x = 47,04N
Zadanie 3
Jaka objętość 0,002 molowego roztworu EDTA została zużyta na zmiareczkowanie próbki wody o objętości wody 500cm3, jeśli jej twardość wody wynosi 50N.
NEDTA = Njonów
0,5mmol/dm3 = 2,80N
x = 50N x = 0,8929mmol/dm3
0,8929*10-3mol/dm3=8,93*10-4mol/dm3
![]()
Zadanie 4
Oblicz ile gramów wersanianu sodowego należy rozpuścić w kolbie na 500cm3, aby 103 roztworu EDTA, reagowało z jonami wapnia i magnezu zawartymi w 20cm3 wody o twardości 120mmol.
CEDTA*VEDTA = Cjonów*Vwody
120mmol - x
10mmol - 0,5mmol/dm3 x= 6mmol/dm3 = 0,006mol/dm3
![]()
M=375,24g/mol
m = n * M = CEDTA*VEDTA*MEDTA = 0,012ml/dm3 * 0,5dm3 * 372,24g/mol = 2,2334g
Zadania na 1 punkt:
W jakim stosunku należy zmieszać dwa roztwory, np. 40% i 12% aby końcowy miał 18%.
Cp1 = 40%
Cp2 = 12%
CpK = 18%
mr1 / mr2 = Cp2 - CpK / Cp1 - CpK = 12 - 18 / 40 - 18 = 6 / 22 = 3 / 11
gdyby był roztwór z H2O to 0%
Cp1 Cp2 - CpK
CpK
Cp2 Cp1 - CpK
![]()
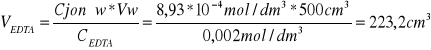
![]()
Wyszukiwarka
Podobne podstrony:
Zadania - sprzężenia, Pomoce naukowe, biologia, zadania GENETYKA
ZADANIA GENETYCZNE part II, Pomoce naukowe, biologia, zadania GENETYKA
Chemia pomoce naukowe, Chemia zadania2, Chemia zadania
Chemia pomoce naukowe, Chemia test2
Kwas karbosylowe, Pomoce naukowe, chemia
kwasy, Testy i pomoce naukowe, Chemia
WOS zadania samorządu terytorialnego, Szkoła- pomoce naukowe ;P, Ściągi;)
zadania z postaw z weglowodanów, Pomoce naukowe, podstawy żywienia człowieka
Edukacja chorego na cukrzycę jako zadanie lekarza rodzinnego, Pomoce naukowe, studia, medycyna
fotosynteza i metabolizm-ściąga, Pomoce naukowe, studia, biologia
więcej podobnych podstron