Wstęp teoretyczny
Szybkość reakcji jest funkcją stężenia poszczególnych reagentów A, B, C ... i jeżeli reakcja jest jednokierunkowa
(1) v = k [A]a [B]b [C]c ...
to współczynniki potęgowe a, b, c, są charakterystyczne dla reakcji i określają rząd reakcji względem danych reagentów. Suma współczynników potęgowych określa sumaryczny rząd reakcji. Poznanie rzędu reakcji ma istotne znaczenie w badaniach mechanizmów przemian chemicznych, toteż ich wyznaczenie w kinetyce chemicznej należy do podstawowych zadań.
Rząd reakcji można wyznaczyć między innymi metodą graficzną . Polega ona na wykorzystaniu scałkowanych postaci równań kinetycznych i graficznej prezentacji wyników pomiarów . Wiemy , że dla dla reakcji I rzędu spełniona jest liniowa zależność między lg c a czasem , dla II rzędu między odwrotnością stężenia a czasem , wreszcie dla reakcji III rzędu - między odwrotnością kwadratu stężenia a czasem. Spełnienie jednej z podanych relacji wskazuje na właściwie dobrany rząd.
Zadanie ćwiczenia polega na zbadaniu szybkości rozpadu kompleksowego anionu szczawianu manganu , zachodzącego wg reakcji :
[Mn(C2O4)3]3- ![]()
Mn2+ + ![]()
C2O42- + CO2
Kinetykę rozpadu barwnego anionu na bezbarwne produkty śledzimy metodą spektrofotometryczną przez pomiar zmian ekstynkcji w czasie . Ponieważ ekstynkcja jest proporcjonalna do stężenia , dlatego zamiast stężenia możemy używać wprost ekstynkcji . Tak więc równanie opisujące reakcję I rzędu ma postać :
lg E = lg E0 - k1t/2,303
Część doświadczalna :
t[min] |
EI |
lgEI*10-2 Seria I |
EII |
lgEII*10-2 Seria II |
EIII |
lgEIII*10-2 Seria III |
2 |
1,25 |
0,0969 |
1,40 |
0,1461 |
1,40 |
0,1461 |
3 |
1,20 |
0,0792 |
1,25 |
0,0969 |
1,25 |
0,0969 |
4 |
1,10 |
0,0414 |
1,10 |
0,0414 |
1,15 |
0,0607 |
5 |
1,00 |
0,0000 |
1,00 |
0,0000 |
1,10 |
0,0414 |
6 |
0,96 |
-0,0177 |
0,94 |
-0,0269 |
0,96 |
-0,0177 |
7 |
0,84 |
-0,0757 |
0,88 |
-0,0555 |
0,88 |
-0,0555 |
8 |
0,80 |
-0,0969 |
0,80 |
-0,0969 |
0,82 |
-0,0862 |
9 |
0,78 |
-0,1079 |
0,75 |
-0,1249 |
0,76 |
-0,1192 |
10 |
0,70 |
-0,1549 |
0,72 |
-0,1427 |
0,71 |
-0,1487 |
Otrzymane wyniki pomiarów przedstawione na wykresie są ściśle liniową zależnością , co wskazuje jednoznacznie , że mamy do czynienia z reakcją I rzędu .
Wyznaczam stałą szybkości reakcji przez określenie parametrów równania metodą najmniejszych kwadratów.
lg E = - k1t/2,303 + lg E0
Seria I y = -0,0320 x + 0,1659
Seria II y = -0,0359 x + 0,1972
Seria III y = -0,0370 x + 0,2127
Końcowe rezultaty są następujące :
|
k [s-1] |
kśr. [s-1] |
Seria I |
0,0139 |
|
Seria II |
0,0156 |
0,0152 |
Seria III |
0,0161 |
|
Wnioski :
Metoda graficzna wyznaczania zarówno rzędu reakcji jak i stałej szybkości jest bardzo użyteczna . Przydatna jest zwłaszcza wtedy , gdy parametrem mierzony jest nie wprost stężenie ( np.: ekstynkcja ) . Główną zaleta tej metody jest jej prostota i szybkość wykonania pomiarów .
Opracowanie błędów:
Obliczam średnią arytmetyczną otrzymanych wartości stałej szybkości reakcji :
![]()
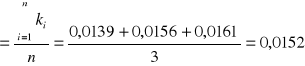
[s-1]
Obliczam odchylenie wartości ki od wartości średniej:
![]()
v1 = 0,0139 - 0,0152 = - 0,0013
v2 = 0,0156 - 0,0152 = 0,0004
v3 = 0,0161 - 0,0152 = 0,0009
Obliczam średni błąd kwadratowy Sx wartości średniej ![]()
z n niezależnych pomiarów xi (i = 1,...,n):
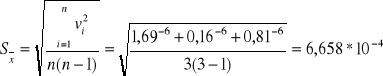
Stąd : ![]()
= ![]()
[s-1]
Wyznaczam stałą szybkości reakcji przez określenie parametrów równania metodą najmniejszych kwadratów.
lg E = - k1t/2,303 + lg E0
y = ax + b
![]()
![]()
![]()
Seria I y = -0,0320 x + 0,1659
Seria II y = -0,0359 x + 0,1972
Seria III y = -0,0370 x + 0,2127
y = ax + b
![]()
Końcowe rezultaty są następujące :
|
k [min-1] |
kśr. [min-1] |
Seria I |
0,0737 |
|
Seria II |
0,0827 |
0,0805 |
Seria III |
0,0852 |
|
Opracowanie błędów:
Obliczam średnią arytmetyczną otrzymanych wartości stałej szybkości reakcji :
![]()
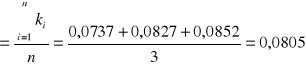
[min-1]
Obliczam odchylenie wartości ki od wartości średniej:
![]()
v1 = 0,0737 - 0,0805 = - 0,0068
v2 = 0,0827 - 0,0805 = 0,0022
v3 = 0,0852 - 0,0805 = 0,0047
Obliczam średni błąd kwadratowy Sx wartości średniej ![]()
z n niezależnych pomiarów xi (i = 1,...,n):
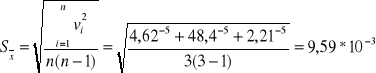
Stąd : ![]()
= ![]()
[min-1]
Wyszukiwarka
Podobne podstrony:
Wyznaczanie rzędu reakcji metodą graficzną, Studia, Politechnika
Prawo inżynierskie i ochrona własności intelektualnych. Wykład 3, Studia, Politechnika Łódzka - Pend
Testy biodegradacji, Studia, Politechnika
Chf9, Studia, Politechnika
Wyznaczanie stałej reakcji szybkości zmydlania estru, Studia, Politechnika
CH.F.L9, Studia, Politechnika
ZAKAAD CHEMI FIZYCZNEJ, Studia, Politechnika
C15, Studia, Politechnika
podstawowe informacje o ochronie prawnej wzorów przemysłowych, Studia - Politechnika Śląska, Zarządz
Sprawko spawalnictwo 1, studia, studia Politechnika Poznańska - BMiZ - Mechatronika, 2 semestr, obro
dziadek25, Studia, Politechnika
4 2 vademecum echosondy (w tym przykładzie wodnej), studia, studia Politechnika Poznańska - BMiZ - M
LABORKA7, Studia, Politechnika
Wyznaczanie stopnia asocjacji kwasu octowego w rozpuszczalni, Studia, Politechnika
deacon1, Studia, Politechnika
Destylacja wojtek, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria, Destylacja
Liczby przenoszenia jonów, Studia, Politechnika
103, Studia Politechnika Poznańska, Semestr II, I pracownia fizyczna, LABORKI WSZYSTKIE, FIZYKA 2, F
poprawione7, Studia, Politechnika
więcej podobnych podstron