Materiały do ćwiczeń laboratoryjnych z chemii - 3
Opracowali:
1. Ogniwa galwaniczne
Ogniwo galwaniczne jest to układu składający się z dwóch elektrod, których elektrolity mają elektryczny kontakt jonowy.
Jeśli obydwie elektrody ogniwa są w stanie równowagi, wówczas napięcie ogniwa (napięcie pomiędzy metalicznymi wyprowadzeniami elektrod) nazywa się siłą elektromotoryczną ogniwa, w skrócie SEM. Pomiędzy elektrodami nie płynie prąd elektryczny. Obwód zewnętrzny jest otwarty. Naruszenie stanu równowagi może nastąpić przez zmianę napięcia ogniwa.
Zamknięcie obwodu zewnętrznego ogniwa przez dowolny opór elektryczny (równoznaczne z połączeniem metali elektrod przewodnikiem elektronowym) spowoduje przepływ elektronów w tym obwodzie od ujemnego bieguna ogniwa do dodatniego i częściowe wyrównanie potencjałów elektrod, a zatem obniżenie napięcia ogniwa. Nastąpi zatem naruszenie równowagi na obydwóch elektrodach i rozpoczęcie reakcji chemicznej w kierunku odtworzenia stanu równowagowego. W procesie tym, zwanym praca ogniwa galwanicznego, energia chemiczna substancji samorzutnie reagujących w ogniwie zamienia się w energię elektryczną oddawaną w obwodzie zewnętrznym (np. przez kolejną zamianę energii elektrycznej w mechaniczną lub cieplną).
Zwiększenie napięcia ogniwa powyżej jego SEM przez odpowiednie połączenie z zewnętrznym źródłem napięcia (np. baterią ogniw) również spowoduje naruszenie równowagi na elektrodach z tą różnicą, że proces chemiczny będzie wymuszony przyłożonym napięciem i reakcja chemiczna w ogniwie będzie przebiegać w przeciwnym niż poprzednio kierunku, a energia elektryczna dostarczana do ogniwa z zewnątrz będzie zamieniana na energię chemiczną produktów reakcji. Proces taki nosi nazwę elektrolizy.
Pojęcie ogniwa zwykle kojarzy się z urządzeniami, które mogą dostarczać energię elektryczną kosztem przemian chemicznych, natomiast urządzenia służące do procesów elektrolizy noszą nazwę elektrolizerów. Należy jednak pamiętać, że np. akumulator czyli ogniwo odwracalne (w procesie elektrolizy przebiegają takie same reakcje chemiczne jak w czasie pracy ogniwa, lecz w przeciwnym kierunku) nie przestaje być akumulatorem bez względu na to czy dostarcza energię elektryczną, czy stoi nieużywany, czy wreszcie jest ładowany w procesie elektrolizy.
Ogniwa galwaniczne przetwarzające energię chemiczną na elektryczną można podzielić na:
ogniwa wzorcowe, których SEM służy jako wzorzec napięcia,
ogniwa pomiarowe, służące do pomiaru stężeń składników roztworu,
ogniwa służące do produkcji energii elektrycznej.
Z uwagi na rodzaj stosowanych elektrod i rodzaj reakcji chemicznych, które na nich zachodzą można ogniwa podzielić na ogniwa stężeniowe i ogniwa chemiczne W ogniwie stężeniowym obydwie elektrody mają taki sam skład jakościowy lecz różnią się np. stężeniem elektrolitu. W czasie pracy ogniwa na obydwu elektrodach zachodzą takie same reakcje chemiczne, lecz w przeciwnych kierunkach. Praca elektryczna powstaje wówczas w wyniku wyrównywania się stężeń elektrolitu, a nie energii chemicznej substratów. W ogniwie chemicznym na elektrodach zachodzą różne reakcje chemiczne, a praca elektryczna powstaje w wyniku reakcji chemicznej.
Ogniwa pomiarowe składają się na ogół z elektrody wskaźnikowej o potencjale zależnym od stężenia określonego składnika roztworu i elektrody porównawczej o stałym potencjale. Dla zachowania stałości potencjału elektrody porównawczej łączy się ją z roztworem elektrody wskaźnikowej (badanym) w sposób uniemożliwiający swobodne mieszanie się elektrolitów. Stosuje się w tym celu membranę z porowatego szkła, albo też klucz elektrolityczny. Ten ostatni wykonany jest zwykle z rurki szklanej w kształcie litery U wypełnionej stężonym roztworem soli o jednakowych ruchliwościach kationów i anionów (zwykle KCl) z dodatkiem obojętnego koloidalnego żelu uniemożliwiającego wypływanie elektrolitu.
Pomiary napięcia ogniw pomiarowych przeprowadza się w warunkach niewiele odbiegających od stanu równowagi, stąd konieczność stosowania czułych, wysokooporowych miliwoltomierzy.
Ogniwa pomiarowe znalazły szerokie zastosowanie nie tylko w laboratoriach analitycznych lecz także w innych dziedzinach, np. do oznaczania pH w przemyśle lub do sygnalizacji zmniejszonej zawartości tlenu w kopalniach.
2. Elektroliza
Elektroliza jest to proces zachodzący podczas przepływu prądu elektrycznego (z zewnętrznego źródła prądu) przez przewodnik jonowy. Towarzyszą temu reakcje elektrochemiczne zachodzące na granicy faz przewodnik elektronowy /przewodnik jonowy (elektroda/roztwór).
Produkty reakcji elektrochemicznych powstające na obydwu elektrodach elektrolizera - na katodzie (-) i anodzie (+) - albo pozostają w roztworze, zmieniając jego skład przy powierzchni przewodnika elektronowego, albo wydzielają się na tej powierzchni w formie metalu, związku trudno rozpuszczalnego lub gazu. Zjawiska te powodują zmiany potencjałów obu elektrod równoważąc - początkowo całkowicie, a później częściowo - przyłożone z zewnątrz napięcie.
Dla ilustracji tego procesu można rozpatrzyć układ dwóch blaszek platynowych, zanurzonych do rozcieńczonego roztworu kwasu siarkowego, do których dołączono zewnętrzne źródło energii elektrycznej o napięciu stopniowo wzrastającym poczynając od zera. Na elektrodzie ujemnej, która w tym procesie stanowi katodę, będą rozładowywać się dodatnie jony wodorowe i wydzielać się będzie gazowy wodór zgodnie z reakcją:
4H+ + 4e- ↔ 2 H2↑
Na dodatniej anodzie jony siarczanowe (VI), nie mogą się rozładowywać gdyż siarka z SO42- w rozcieńczonych roztworach wodnych nie daje się bardziej utlenić, natomiast w tych warunkach utlenia się tlen z wody według reakcji:
2H2O -4e- ↔ O2↑ + 4H+
Początkowo, przy nieznacznym napięciu, obydwa produkty będą rozpuszczać się w wodzie oraz adsorbować na powierzchni platyny, tworząc swojego rodzaju elektrody: wodorową i tlenową. Powstanie zatem ogniwo tlenowo-wodorowe o sile elektromotorycznej skierowanej przeciwnie do przyłożonego napięcia. Ze wzrostem stężenia produktów elektrolizy w roztworach obu elektrod, SEM wytworzonego ogniwa będzie rosnąć aż do zrównoważenia zewnętrznego napięcia i prąd przestanie płynąć. Przy niewielkim wzroście napięcia zjawisko powtórzy się i znowu natężenie prądu spadnie do zera. Dopiero po nasyceniu roztworów wodorem i tlenem następuje wydzielanie tych substancji w formie gazowej i zacznie się trwały proces elektrolizy. Napięcie, po przekroczeniu którego zaczyna się ten proces, nosi nazwę napięcia rozkładowego Ur. Wartość Ur można wyznaczyć graficznie przez ekstrapolację krzywej zależności I od U (rys. 1) do wartości natężenia prądu elektrolizy do I = 0. W tym przypadku jest ono równ napięciu równowagowemu nasyconego ogniwa polaryzacyjnego (tutaj - tlenowo wodorowego).
Jeśli w jednej lub obu elektrodach platynę zastąpić rtęcią, to wydzielenie fazy gazowej na gładkiej powierzchni ciekłej rtęci będzie wymagać dodatkowej energii, którą można dostarczyć przez podwyższenie napięcia. Zatem napięcie rozkładowe będzie w tym wypadku wyższe niż poprzednio. Różnica pomiędzy napięciem rozkładowym i napięciem równowagowym nasyconego ogniwa polaryzacyjnego będzie najniższą wartością nadnapięcia. Zjawisko nadnapięcia w wypadku wodoru jest szczególnie duże i występuje nie tylko na powierzchni rtęci ale i innych metali. Nadnapięcie ma duże znaczenie w procesach galwanicznych Pozwala ono na wydzielanie z roztworów wodnych wielu metali znajdujących się w szeregu napięciowym przed wodorem, np. chromu, cynku lub niklu.
Rys. 1. Znajdowanie z wykresu wartości napięcia rozkładowego
Ładunek elektryczny przepływający w ogniwie ma ścisły związek z ilością substancji reagujących na elektrodach. Ujmują to dwa prawa Faraday'a, które zostały sformułowane dla procesu elektrolizy; w równej mierze dotyczą również pracy ogniwa galwanicznego (to jest procesu samorzutnego).
I. Masa substancji m ulegającej reakcji elektrodowej jest proporcjonalna do ładunku elektrycznego Q, jaki przepłynął przez elektrodę:
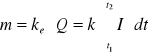
(2.1)
gdzie ke - równoważnik elektrochemiczny,
I - natężenie prądu (zmienne w czasie t1 do t2)
t - czas.
Równoważnik elektrochemiczny jest to stosunek masy molowej danej substancji M do iloczynu stałej Faraday'a F i liczby elektronów z biorących udział w reakcji redukcji lub utleniania jednej cząsteczki, jonu lub atomu tej substancji na elektrodzie (liczbowo jest równy masie substancji wytwarzanej w wyniku reakcji elektrodowej podczas przepływu ładunku elektrycznego jednego kulomba).
![]()
(2.2)
Jeśli natężenie prądu elektrycznego jest niezmienne w czasie elektrolizy, wówczas wzór (2.1) upraszcza się:
![]()
(2.3)
Jeżeli produkt elektrolizy jest gazem to po przekształcenia wzorów (2.2) i (2.3) i uwzględnieniu objętości molowej gazów v0 = 22,4 dm3 można obliczyć objętość v wydzielonego gazu z zależności:
![]()
(2.4)
II. Masy różnych substancji ulegających reakcjom elektrodowym podczas przepływu takiego samego ładunku elektrycznego są proporcjonalne do mas tych substancji odpowiadających molowi elektronów, biorących udział w reakcji elektrodowej.
![]()
![]()
(2.5)
2.1. Zastosowania elektrolizy
Katodowe i anodowe procesy elektrolityczne znalazły szerokie zastosowanie. Procesy katodowe wykorzystuje się głównie do:
produkcji wielu metali z ich rud i innych związków,
nakładania powłok galwanicznych,
otrzymywania wodoru dla przemysłu spożywczego,
otrzymywania szeregu związków organicznych i nieorganicznych na drodze redukcji w przestrzeni katodowej.
Procesy anodowe na szeroką skalę stosuje się do:
otrzymywania chloru i fluoru,
elektrochemicznego odtłuszczania, trawienia i formowania metali,
obróbki anodowo-mechanicznej,
otrzymywania wielu związków chemicznych na drodze utleniania (np. manganianu(YII) potasu).
Obydwa te procesy są jednocześnie wykorzystywane przy:
oczyszczaniu metali (elektrorafinacji),
nakładaniu powłok galwanicznych przy użyciu roztwarzalnej anody.
ładowaniu akumulatorów (ogniw wtórnych).
2.2. Powłoki galwaniczne
Elektroliza należy do najszerzej stosowanych metod nakładania powłok metalicznych na podłożu wykonanym z innego metalu. Przedmioty poddawane takiej obróbce zanurzane są w kąpieli galwanicznej (w elektrolicie zawierającym jony metalu, z którego ma powstać powłoka) i łączone z ujemnym biegunem źródła prądu stałego. Dodatni biegun tego źródła łączony jest z metalem stanowiącym wówczas wraz z elektrolitem anodę.
W procesie katodowym jony metalu z kąpieli galwanicznej redukują się na katodzie np.:
Zn2+ + 2e- = Zn0
W prawidłowo prowadzonym procesie wydzielają się w postaci litej, równomiernej powłoki. Jeśli podłoże metaliczne było źle przygotowane (źle oczyszczone) lub źle zostały dobrane parametry procesu elektrolitycznego - metal może się wydzielać w formie oddzielnych kryształów lub czarnej gąbki (np. przy zbyt dużej gęstości prądu katodowego). Przy nakładaniu powłok z takich metali jak cynk, chrom lub nikiel - oprócz jonów metalu ulegają redukcji również jony wodorowe, zatem wydajność prądowa takich procesów jest niższa od 100%. Niewielkie odchylenia od stuprocentowej wydajności mogą być też spowodowane redukcją tlenu rozpuszczonego w wodzie.
Zależnie od rodzaju kąpieli galwanicznej (elektrolitu) powierzchnia nakładanej powłoki może w różnym stopniu odwzorowywać kształt powierzchni podłoża, gdyż w różnych miejscach może mieć różną grubość. Cecha kąpieli określająca możliwość otrzymania równomiernej powłoki na przedmiotach o skomplikowanych kształtach nosi nazwę wgłębności kąpieli. Jeżeli kąpiel galwaniczna zawiera proste jony metali połączone jedynie z cząsteczkami wody, wówczas uzyskuje się zwykle powłoki o zróżnicowanych grubościach. Na kantach, narożach i wypukłościach pokrywanej powierzchni - powłoki są grubsze; natomiast we wgłębieniach i na płaszczyznach bardziej oddalonych od anody w porównaniu z innymi częściami pokrywanego przedmiotu - znacznie cieńsze. W skrajnych wypadkach powłoka może zupełnie się nie osadzać. Kąpiele, w których tworzą się takie powłoki, mają małą wgłębność np. ZnSO4. Natomiast kąpiele o odpowiednio dobranym składzie, które zwykle zawierają redukowany metal w formie kompleksowych anionów (np. [Ag(CN)2]-), zapewniają wydzielanie powłok o równomiernych grubościach, nawet na powierzchniach o bardzo zróżnicowanym kształcie.
W kąpielach galwanicznych oprócz jednego lub kilku związków nakładanego metalu znajdują się zwykle również inne składniki, które mają za zadanie poprawienie właściwości kąpieli galwanicznej (lepszą przewodność elektryczną większą wgłębność) oraz jakości powłoki. Niektóre dodatki powodują wydziel nie błyszczących powłok - są to dodatki blaskotwórcze; inne powodują utrudni nie wydzielania powłoki na występach powierzchni, wobec czego w zagłębieniach powłoka powstaje prędzej. Są to dodatki wyrównujące.
W procesie anodowym utlenianiu najczęściej ulega metal anody - taki sam jak metal nakładanej powłoki w przypadku cynkowej powłoki na anodzie Zn2+ + 2e- = Zn0.
Proces galwaniczny z roztwarzalną anodą jest dogodny z powodu niemal stałego w czasie składu elektrolitu. Niekiedy jedna anoda z nakładanego metalu nie ulega utlenieniu - wydziela się wówczas tlen. W takich procesach - z nieroztwarzalną anodą - należy systematycznie uzupełniać w kąpieli zużywany metal.
W galwanotechnice jednym z ważnych parametrów procesu jest szybkość nakładania powłoki, czyli stosunek przyrostu grubości powłoki do czasu, w którym ten przyrost nastąpił. Jeśli wydajność procesu η| wyrażona jest w procenta (to masę m wydzielonej powłoki oblicza się z wzoru:
![]()
(2.6)
w którym Q - ładunek elektryczny, który przepłynął przez katodę,
M - masa molowa osadzanego metalu,
z - stopień utlenienia osadzanego metalu w elektrolicie,
F - stała Faraday'a.
lub znając masę wydzielonej powłoki można obliczyć wydajność procesu
![]()
(2.7)
Znając masę (m) i gęstość wydzielanego metalu ρ oraz wielkość pokrywanej wierzchni S można wyrazić grubość powłoki d jako
![]()
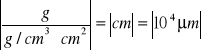
(2.8)
a po podstawieniu m ze wzoru (2.6):
![]()
(2.9)
Do najczęściej nakładanych powłok należą powłoki cynkowe, miedziane, kadmowe, oraz wielowarstwowe powłoki miedź - nikiel i miedź - nikiel - chrom. Powłoki cynkowe i kadmowe nakładane są na przedmioty stalowe głównie w celu ochrony przed korozją, natomiast wymienione powłoki dwu i trójwarstwowe mają charakter zarówno ochronny jak i dekoracyjny.
2.3. Powłoki ochronne - cynk
Cynk jest metalem nieszlachetnym, podatnym na utlenianie. Potencjał normalny elektrody cynkowej wynosi E ° = -0,763 V.| W zetknięciu z tlenem atmosferycznym powierzchnia cynku pokrywa się tlenkiem cynku ZnO. Po ok.100 godzinach ekspozycji w suchym powietrzu w temperaturze pokojowej powstała warstwa tlenku osiąga grubość 100 μm i jest niedostrzegalna gołym okiem. W środowisku wilgotnym tlenek cynku przekształca się w wodorotlenek Zn(OH)2.
W warunkach atmosferycznych związek ten jest niestabilny i reaguje z zawartym w powietrzu dwutlenkiem węgla:
(n+l)Zn(OH)2 + CO2 → Zn(COs) ∙ n Zn(OH)2 + H2O
Powstały zasadowy węglan cynku tworzy szczelne, trudno rozpuszczalne w wodzie i dobrze przyczepne do cynku warstewki o właściwościach ochronnych.
Zjawisko tworzenia się takich warstw nosi nazwę pasywacji. Spasywowana powierzchnia cynku jest matowa i przybiera szarą barwę.
W warunkach dużej wilgotności i przy jednoczesnym niedoborze dwutlenku węgla pasywacja cynku nie zachodzi.
Cynk koroduje i pokrywa się luźnymi, słabo przyczepnymi warstwami tzw. białej
rdzy. Biała rdza jest mieszaniną tlenku i wodorotlenku cynku.
Podatność cynku na korozję w środowisku wodnym jest uzależniona od odczynu
roztworu. W roztworach o odczynie kwaśnym zachodzi reakcja anodowa:
Zn → Zn2+ +2e-
którą intensyfikują reakcje katodowe:
O2 + 4 H+ + 4 e_ → 2 H2O depolaryzacja tlenowa
2 H+ + 2 e_ → H2↑ depolaryzacja wodorowa
Najmniejszą podatność na korozję posiada cynk w środowiskach o pH od 6,0 do 12,5.
Gdy pH >12,5 cynk intensywnie koroduje (jak w środowisku silnie kwaśnym) z wytworzeniem łatwo rozpuszczalnych cynkanów:
Zn + 2 OH- + 2H2O → [Zn(OH)4]2- + H2↑
Cynk dzięki pasywacji wykazuje znaczną odporność korozyjną na działanie warunków atmosferycznych. Odporność ta maleje ze wzrostem zawartości w atmosferze zanieczyszczeń gazowych (tlenki siarki i azotu) i pyłowych..
Ze względu na odporność korozyjną cynk w postaci blachy był od dawna wykorzystywany do wykonywania pokryć dachowych. Obecnie warstwy cynku o odpowiednio dobranej grubości służą do antykorozyjnego zabezpieczania wyrobów stalowych i żeliwnych.
Podczas gięcia ocynkowanych stalowych blach i drutów warstwy cynku pękają i tracą szczelność, pomimo to nie tracą swojego działania ochronnego. Gdy nieciągłość w powłoce cynkowej sięga stalowego podłoża w obecności elektrolitu (wilgoć, woda) - powstają mikroogniwa galwaniczne. W ogniwach takich anodą jest aktywny cynk a katodą mniej aktywne żelazo E° = - 0,44 V zawarte w stali. Na stali w sąsiedztwie cynku zachodzą reakcje depolaryzacji katodowej. Stal staje się katodą i jest obszarem chronionym. Cynk w ogniwie jest anodą i ulega roztwarzaniu (niszczeniu). Powłoki cynkowe na stali określa się jako powłoki anodowe.
Szybkość korozji powłok cynkowych w środowisku wodnym zachodzi wolniej w wodach o większej twardości węglanowej i zwiększa się znacznie w obecności siarczanów i chlorków.
W napowietrzonej wodzie korozja cynku przebiega szczególnie intensywnie w temp. 65 -75°C. Przy dalszym wzroście temperatury szybkość korozji maleje wskutek ograniczonej rozpuszczalności tlenu. W wodzie zawierającej węglany, azotany i rozpuszczony tlen w temperaturze ok. 60°C potencjał cynku może wzrastać i przewyższyć potencjał żelaza. Zjawisko to zwane odwróceniem biegunowości powoduje, ze na stali tworzą się obszary anodowe a na cynku katodowe. Powoduje to miejscową korozję stali określaną jako korozja wżerowa. Ten typ korozji występuje często w ocynkowanych rurach stalowych do przesyłania gorącej wody gospodarczej.
Powłoki cynkowe na stali lub żeliwie nakłada się zwykle metodami termicznymi i elektrolitycznymi
Metody termiczne polegają na zanurzaniu wyrobów na kilka minut w wannie z roztopionym cynkiem (temp. 440 - 460°C). Tak wykonane powłoki są bardzo dobrze przyczepne, bo żelazo tworzy z cynkiem przejściową warstwę stopową. Konstrukcje stalowe pokrywane są cynkiem metodą metalizacji natryskowej W metodzie tej stopiony cynk napyla się na metalizowaną powierzchnię. Powłoki otrzymane tą metodą są dobrze przyczepne ale porowate.
Metodami elektrolitycznymi nakłada się cynk redukując jego jony z roztworów wodnych przy pomocy prądu elektrycznego. W ten sposób można otrzymywać lite powłoki o kontrolowanej grubości. Przyczepność powłok (gorsza niż przy metodach termicznych) jest rezultatem wytworzenia wiązań metalicznych pomiędzy warstwą cynku a starannie oczyszczonym i przygotowanym podłożem. Odporność korozyjną elektrolitycznych powłok cynkowych podwyższa się częste przez wytworzenie na ich powierzchni warstwy związków chromu. Warstwy te o barwie żółtej lub oliwkowej mogą nawet dwukrotnie zwiększyć odporność powłoki cynkowej na korozję.
Wykonanie ćwiczenia
Przygotowanie zestawu do cynkowania elektrolitycznego.
Układ składający się z wanienki galwanizerskiej i stabilizowanego zasilacza prądu stałego połączyć w taki sposób, aby elektrody cynkowe stanowiły anodę a wolna elektroda, do której mocuje się blaszkę stalową stanowiła katodę. Wanienkę galwanizerską napełnić kąpielą do poziomu ok. 2 cm poniżej uchwytu mocującego elektrody. W skład kąpieli do cynkowania wchodzą:
ZnSO4 - dostarcza jony cynku
Na2SO4 i KAl(SO4)2 - regulują przewodność i pH
dekstryna - dodatek blaskotwórczy
Przygotowanie próbki stalowej do nakładania powłoki.
Próbkę do cynkowania przygotować w następujący sposób:
oczyścić powierzchnie papierem ściernym i wytrzeć ściereczką
zważyć próbkę na wadze elektronicznej z dokładnością do 0,001 g
odtłuścić przez zanurzenie w trichloroetylenie przez ok. 30 sekund
przemyć przez kilkakrotne zanurzenie w alkoholu metylowym (etylowym)
opłukać pod bieżącą wodą z kranu
wytrawić przez zanurzenie na ok. 15s w 15% roztworze kwasu siarkowego
opłukać bieżącą wodą i niezwłocznie zamocować w uchwycie i umieścić w wanience w połowie odległości pomiędzy elektrodami cynkowymi
UWAGA: Alkohol metylowy jest bardzo silną trucizną - zachować ostrożność. Stalową blaszkę przenosić na miedzianym druciku nad porcelanową parowniczką.
Wykonanie cynkowania.
Zanotować podane przez prowadzącego parametry cynkowania: natężenie prądu, napięcie i czas cynkowania. Po zamontowaniu blaszki stalowej w układzie włączyć zasilacz przyciskiem „sieć" i rozpocząć odliczanie czasu. Po upływie zadanego czasu wyłączyć zasilacz i wyjąć blaszkę z wanienki. Opłukać próbkę pod bieżącą wodą i osuszyć strumieniem powietrza używając suszarki do włosów. Próbkę ponownie zważyć na wadze elektronicznej - wagę zanotować. Przy pomocy suwmiarki zmierzyć łączną powierzchnię powłoki cynkowej
Obliczenia.
z różnicy masy (Δm) płytki stalowej przed i po cynkowaniu obliczyć masę wydzielonego cynku
przyjmując średnią masę właściwą cynku ρ = 7,13 g/cm3 obliczyć objętość
wydzielonego metalu:
![]()
obliczyć grubość powłoki (d) wg wzoru:
![]()
S - powierzchnia płytki (cm2)
S = (2 ∙ wys. ∙ szer.) + 2 ∙ (wys. ∙ grubość + szer. ∙ grubość)
1
Wyszukiwarka
Podobne podstrony:
chemia-cw -lab -cz -2, Chemia
Harm cwicz lab 12 BM EN
lab 7, 1.1. Cz??? teoretyczna
Cwicz-Lab-4-2013
kondensator, Politechnika Śląska - Elektrotechnika, Rok 1, Fizyka Laborki - Sprawozdania, lab cz.2,
Bodziak Krzysztof(I8E1S1) LAB cz 1
Ciereszko Katarzyna I8E1S1 Sprawozdanie LAB cz 2
I8E1S1 13 Karpiński Radosław Psy Sprawozdanie LAB cz 1
I8E1S1 17 Lemancewicz Rafal Psy Sprawozdanie LAB cz 1
I8E1S1 17 Lemancewicz Rafal Psy Sprawozdanie LAB cz 2
mmgg, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
kationy, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
chemia10, NAUKA, chemia, lab
CHEMIA 12, Chemia fizyczna AGH laborki, lab 12
chemia fizyczna lab id 112228 Nieznany
SPRAWOZ4, Chemia fizyczna AGH laborki, lab 12
więcej podobnych podstron