POLITECHNIKA SZCZECIŇÉSKA
ZAKŇĀAD CHEMII FIZYCZNEJ
Laboratorium studenckie

Sprawozdanie z ńáwiczenia laboratoryjnego nr 5:
„REFRAKTOMETRIA.”
Wykonali:
Patrycja Lejbik
Marcin Tarnowski
Wstńôp teoretyczny:
WaŇľne informacje o budowie czńÖsteczek moŇľna uzyskańá badajńÖc wzajemne oddziaŇāywanie materii obdarzonej masńÖ spoczynkowńÖ i promieniowania elektromagnetycznego, szczeg√≥lnie zjawisko zaŇāamania ŇõwiatŇāa.
Promienie Ňõwietlne rozchodzńÖce sińô w pr√≥Ňľni z prńôdkoŇõcińÖ c majńÖ w Ňõrodowisku optycznie gńôstszym mniejszńÖ prńôdkoŇõńá c`. Stosunek tych prńôdkoŇõci jest r√≥wny wsp√≥Ňāczynnikowi zaŇāamania ŇõwiatŇāa i stosunkowi sinusa kńÖta padania do sinusa kńÖta zaŇāamania ŇõwiatŇāa (zgodnie z III prawem Snelliusa)
(1)
ŇöwiatŇāo jako fala elektromagnetyczna, padajńÖc na czńÖsteczki jakiegoŇõ przeŇļroczystego ciaŇāa powoduje powstawanie, pod wpŇāywem szybkozmiennego pola, indukowanych dipoli o momencie dipolowym ÔĀ≠ tym wińôkszym, im wińôksza jest polaryzowalnoŇõńá ÔĀ°, czyli zdolnoŇõńá przemieszczania sińô Ňāadunk√≥w elektrycznych czńÖsteczki pod wpŇāywem pola elektrycznego o natńôŇľenie E:
ÔĀ≠=ÔĀ°E (2)
NatńôŇľenie pola nie jest jednak staŇāe i ulega szybkiej zmianie wraz z czńôstoŇõcińÖ drgaŇĄ fali Ňõwietlnej ÔĀģÔÄļ
E=Eocos2ÔĀįÔĀģt (3)
Z tńÖ samńÖ czńôstoŇõcińÖ drga indukowany dipol stajńÖc sińô sam Ňļr√≥dŇāem ŇõwiatŇāa o tej samej czńôstoŇõci. Promieniowanie pierwotne i wyemitowany przez naŇõwietlane czńÖsteczki nakŇāadajńÖ sińô na siebie dajńÖc falńô wypadkowńÖ rozchodzńÖcńÖ sińô z prńôdkoŇõcińÖ c` mniejszńÖ od c i dajńÖ znany efekt zaŇāamania promienia Ňõwietlnego. O jego wielkoŇõci decyduje polaryzowalnoŇõńá czńÖsteczek ÔĀ° zaleŇľna od ich struktury, a zwŇāaszcza budowy powŇāok elektronowych. Tym teŇľ moŇľna wyjaŇõnińá fakt, iŇľ badajńÖc wsp√≥Ňāczynnik zaŇāamania ŇõwiatŇāa moŇľna wycińÖgnńÖńá pewne wnioski na temat struktury czńÖsteczek.
Wsp√≥Ňāczynnik zaŇāamania ŇõwiatŇāa to termin stosowany w trzech znaczeniach:
Bezwzglńôdny wsp√≥Ňāczynnik zaŇāamania ŇõwiatŇāa - jest to stosunek prńôdkoŇõci ŇõwiatŇāa w pr√≥Ňľni c do prńôdkoŇõci ŇõwiatŇāa w danym oŇõrodku c`; n=cc` >1.
Wzglńôdny wsp√≥Ňāczynnik zaŇāamania ŇõwiatŇāa jednego oŇõrodka wzglńôdem drugiego - jest to stosunek bezwzglńôdnego wsp√≥Ňāczynnika zaŇāamania ŇõwiatŇāa jednego oŇõrodka n1 do
bezwzglńôdnego wsp√≥Ňāczynnika zaŇāamania ŇõwiatŇāa drugiego oŇõrodka n2; n12= n1 n2
Z definicji wzglńôdnego wsp√≥Ňāczynnika zaŇāamania ŇõwiatŇāa wynika mińôdzy innymi:
n12=c`1/ c`2 (c`1 i c`2 - prńôdkoŇõńá ŇõwiatŇāa w odpowiednich oŇõrodkach),
n12=1/ n12,
n12/ n13= n32.
Zespolony wsp√≥Ňāczynnik zaŇāamania ŇõwiatŇāa - wielkoŇõńá zespolona, kt√≥rńÖ wprowadza sińô przy rozpatrywaniu odbicia ŇõwiatŇāa od metalu, zdefiniowana wzorem: n n(1-iÔĀę)
gdzie n - wsp√≥Ňāczynnik zaŇāamania ŇõwiatŇāa (og√≥lnie wzglńôdny), i=
, ÔĀęÔÄĹ ÔĀ•ÔĀ¨ÔÄĮÔÄīÔĀįn
(ÔĀ• - wsp√≥Ňāczynnik absorpcji ŇõwiatŇāa, ÔĀ¨ - dŇāugoŇõńá fali ŇõwiatŇāa). CzńôŇõńá urojona zespolonego wsp√≥Ňāczynnika zaŇāamania ŇõwiatŇāa jest miarńÖ stopnia pochŇāaniania ŇõwiatŇāa przez dany oŇõrodek.
Wsp√≥Ňāczynnik zaŇāamania ŇõwiatŇāa zaleŇľy od dŇāugoŇõci fali ŇõwiatŇāa; wińÖŇľe sińô to z dyspersjńÖ ŇõwiatŇāa. Stwierdza sińô wzrost tego wsp√≥Ňāczynnika w miarńô stosowania coraz kr√≥tszych dŇāugoŇõci fal. W warunkach laboratoryjnych do pomiaru wsp√≥Ňāczynnika zaŇāamania ŇõwiatŇāa gaz√≥w, cieczy i ciaŇā staŇāych stosuje sińô najczńôŇõciej ŇõwiatŇāa o dŇāugoŇõci fali linii D= 589,3 nm widma sodowego i zaznacza sińô to symbolem nD. Ponadto w ciaŇāach optycznie anizotropowych wsp√≥Ňāczynnik zaŇāamania ŇõwiatŇāa zaleŇľy od kierunku promienia Ňõwietlnego. Zmiana wsp√≥Ňāczynnika zaŇāamania n wynikajńÖca z zastosowania ŇõwiatŇāa o r√≥Ňľnych dŇāugoŇõciach fal ÔĀ¨1 i ÔĀ¨2 dla tych samych oŇõrodk√≥w graniczńÖcych ze sobńÖ czyli nÔĀ¨ÔÄĪ ÔÄ≠ nÔĀ¨ÔÄ≤, nazywa sińô dyspersjńÖ (rozszczepieniem) ŇõwiatŇāa. ZnajomoŇõńá dyspersji ŇõwiatŇāa sŇāuŇľy w wielu przypadkach do identyfikacji skŇāadnik√≥w, o bardzo zbliŇľonych wartoŇõciach n, w mieszaninach.
Wsp√≥Ňāczynnik zaŇāamania ŇõwiatŇāa zaleŇľy od temperatury. Dla ciekŇāych zwińÖzk√≥w organicznych wzrost temperatury o 1oC wywoŇāuje na og√≥Ňā zmniejszenie wartoŇõci wsp√≥Ňāczynnika zaŇāamania n o 3,5*10-4 do 5,5*10-4. Dla niekt√≥rych cieczy obserwuje sińô w pobliŇľu temperatury wrzenia zmniejszenie wartoŇõci n dochodzńÖce do 7*10-4. Dla kaŇľdej substancji moŇľna okreŇõlińá tzw. Wsp√≥Ňāczynnik temperaturowy dn/dt. Przy podawanych wartoŇõciach dla n naleŇľy zaznaczańá u g√≥ry z prawej strony tego symbolu temperaturńô, w jakiej wykonywany byŇā pomiar, np. n
.
WpŇāyw ciŇõnienia na wartoŇõńá wsp√≥Ňāczynnika zaŇāamania n dla cieczy i substancji staŇāych jest niewielki. Wzrost ciŇõnienia o 1 atm zwińôksza wartoŇõńá n zaledwie o okoŇāo 3*10-5. ZaleŇľnoŇõńá ta ma wińôksze znaczenie dla gaz√≥w, gdzie wartoŇõńá bezwzglńôdnego wsp√≥Ňāczynnika zaŇāamania ng gaz√≥w wyraŇľona jest r√≥wnaniem:
(4)
gdzie:
ng - bezwzglńôdny wsp√≥Ňāczynnik zaŇāamania gazu w temperaturze t [oC] i pod ciŇõnieniem
p [mmHg],
ngo - bezwzglńôdny wsp√≥Ňāczynnik zaŇāamania gazu w temperaturze 0oC pod ciŇõnieniem
760 mmHg,
ÔĀ° - wsp√≥Ňāczynnik rozszerzalnoŇõci termicznej gazu, r√≥wny 1/273,16.
ZaleŇľnoŇõńá pomińôdzy wsp√≥Ňāczynnikiem zaŇāamania ŇõwiatŇāa a gńôstoŇõcińÖ i masńÖ molowńÖ okreŇõla tzw. refrakcja wŇāaŇõciwa rw i molowa RM:
(5)
(6)
gdzie: M - masa czńÖsteczkowa, d - gńôstoŇõńá.
Wsp√≥Ňāczynnik zaŇāamania ŇõwiatŇāa jest wielkoŇõcińÖ niemianowanńÖ natomiast RM wyraŇľa sińô w cm3/mol. Refrakcja molowa zwińÖzk√≥w chemicznych jest wielkoŇõcińÖ addytywnńÖ, tzn. Ňľe refrakcjńô molowńÖ zwińÖzku moŇľna otrzymańá przez zsumowania refrakcji przypisywanych poszczeg√≥lnym atomom, grupom atom√≥w i charakterystycznym typom wińÖzaŇĄ wystńôpujńÖcych w danej czńÖsteczce:
RM = ÔĀď Ri (7)
gdzie: Ri - jest refrakcjńÖ poszczeg√≥lnych atom√≥w, ugrupowaŇĄ atomowych lub wińÖzaŇĄ danej czńÖsteczki. KaŇľdy typ wińÖzania wnosi sw√≥j udziaŇā liczbowy do refrakcji molowej. Dlatego mierzńÖc refrakcjńô molowńÖ bezpoŇõrednio caŇāej czńÖsteczki i por√≥wnujńÖc otrzymany wynik z wartoŇõcińÖ, obliczonńÖ teoretycznie na podstawie danych z odpowiednich tabel, moŇľna wycińÖgnńÖńá wnioski dotyczńÖce budowy czńÖsteczki danej substancji.
Refrakcja molowa, podobnie jak parachora wykazuje pewne charakterystyczne anomalie. W zwińÖzkach, w kt√≥rych wystńôpujńÖ wińÖzania podw√≥jne sprzńôŇľone zachodzi zjawisko tzw. optycznej egzaltacji. Oznaczone doŇõwiadczalnie wartoŇõci refrakcji molowej sńÖ wińôksze od obliczonych przez sumowanie udziaŇā√≥w. Zjawisko to nie wystńôpuje w zwińÖzkach izomerycznych, w kt√≥rych nie ma wińÖzaŇĄ sprzńôŇľonych. OkreŇõlanie refrakcji jest czńôsto pomocne przy rozr√≥Ňľnianiu form ketonowych i enolowych tautomer√≥w.
ZnajomoŇõńá wartoŇõci refrakcji molowej jest czńôsto niezbńôdna przy wyznaczaniu moment√≥w dipolowych substancji. JeŇõli dwa atomy o r√≥Ňľnej elektroujemnoŇõci sńÖ poŇāńÖczone wińÖzaniem kowalencyjnym, to takie wińÖzanie jest spolaryzowane. Oznacza to, Ňľe „Ňõrodki cińôŇľkoŇõci Ňāadunk√≥w dodatnich i ujemnych w czńÖsteczce nie pokrywajńÖ sińô”. Momentem dipolowym takiego spolaryzowanego wińÖzania kowalencyjnego (ÔĀ≠) nazywamy wyraŇľenie:
ÔĀ≠ = ql (8)
gdzie: q - bezwzglńôdna wartoŇõńá r√≥Ňľnoimiennych Ňāadunk√≥w, l - odlegŇāoŇõńá mińôdzy biegunami.
Moment dipolowy wińÖzania jest zwykle traktowany jako wektor posiadajńÖcy zwrot od bieguna ujemnego do dodatniego. Suma wektorowa moment√≥w dipolowych wszystkich wińÖzaŇĄ w czńÖsteczce nazywa sińô momentem dipolowym czńÖsteczki (ÔĀ≠). Zwykle jednak m√≥wińÖc o momencie dipolowym czńÖsteczki mamy na myŇõli wartoŇõńá bezwzglńôdnńÖ tego wektora. Metody pomiaru tej wielkoŇõci sprowadzajńÖ sińô najczńôŇõciej do wyznaczenia przenikalnoŇõci elektrycznej wzglńôdnej zwanej r√≥wnieŇľ staŇāńÖ dielektrycznńÖ, gńôstoŇõci i wsp√≥Ňāczynnika zaŇāamania ŇõwiatŇāa.
JeŇľeli w polu elektrycznym umieŇõcimy dielektryk polarny, tzn. taki, kt√≥rego czńÖsteczki posiadajńÖ moment dipolowy, to na poszczeg√≥lne jego czńÖstki dziaŇāańá bńôdńÖ pary siŇā skrńôcajńÖcych. Powoduje to orientacjńô dipoli wzdŇāuŇľ linii siŇā pola. Ponadto w obrńôbie kaŇľdej czńÖsteczki wystńÖpi, pod dziaŇāaniem pola, deformacja chmur elektronowych oraz pewna zmiana we wzajemnym poŇāoŇľeniu atom√≥w. StńÖd teŇľ polaryzacja dielektryka moŇľe byńá traktowana jak suma polaryzacji orientacyjnej, elektronowej i atomowej.
Z polaryzacjńÖ elektronowńÖ zwińÖzany jest, indukowany przez pole, dodatkowy moment dipolowy czńÖsteczki (ÔĀ≠c), kt√≥rego wielkoŇõńá jest proporcjonalna do natńôŇľenia pola:
ÔĀ≠c = ÔĀ°c E (9)
Analogiczna zaleŇľnoŇõńá od natńôŇľenia pola jest sŇāuszna takŇľe dla indukowanego momentu dipolowego (ÔĀ≠a) zwińÖzanego z polaryzowalnoŇõcińÖ atomowńÖ ÔĀ°a;
ÔĀ≠a = ÔĀ°a E (10)
Wsp√≥Ňāczynnik ÔĀ°a nazywa sińô polaryzowalnoŇõcińÖ atomowńÖ. Suma (ÔĀ≠c + ÔĀ≠a) jest indukowanym przez pole momentem dipolowym (ÔĀ≠i), a sumńô ÔĀ°c + ÔĀ°a = ÔĀ°i nazywamy udziaŇāem przesunińôcia w polaryzowalnoŇõci czńÖsteczkowej. Ze wzor√≥w (9) i (10) wynika, Ňľe:
ÔĀ≠i = ÔĀ°i E (11)
Wsp√≥Ňāczynnik ÔĀ°i zwińÖzany jest ze wzglńôdnńÖ przenikalnoŇõcińÖ elektrycznńÖ dielektryka (ÔĀ•ÔÄ© wzorem Clausiusa-Mossottiego:
(12)
gdzie:
Vm - objńôtoŇõńá molowa dielektryka
NA - staŇāa Avogadro (=6,0221367*1023 mol-1)
ÔĀ•o - przenikalnoŇõńá elektryczna pr√≥Ňľni (8,85418782*10-12 F/m).
WyraŇľenie po prawej stronie wzoru (12) jest indukowanńÖ polaryzacjńÖ molowńÖ dielektryka niepolarnego. Jak wykazaŇā Debye, wz√≥r ten moŇľe byńá takŇľe zastosowany do obliczenia trwaŇāego momentu dipolowego dielektryk√≥w polarnych.
CzńÖsteczki polarne w nieobecnoŇõci zewnńôtrznego pola elektrycznego sńÖ skierowane we wszystkich moŇľliwych kierunkach. Z chwilńÖ przyŇāoŇľenia pola elektrycznego, dipole dńÖŇľńÖ do osińÖgnińôcia orientacji zgodnej z kierunkiem linii siŇā, mimo zakŇā√≥cajńÖcego wpŇāywu ruch√≥w termicznych czńÖstek. Z tego powodu polaryzacja orientacyjna jest funkcjńÖ temperatury w odr√≥Ňľnieniu od polaryzacji elektronowej i atomowej.
ZaleŇľnoŇõńá ta stanowi podstawńô jednej z metod wyznaczania trwaŇāego momentu dipolowego.
MiarńÖ polaryzacji orientacyjnej jest Ňõrednia wartoŇõńá skŇāadowej momentu dipolowego
w kierunku pola. Podobnie do wyraŇľeŇĄ (9-11) zachodzi zwińÖzek;
ÔĀ≠ = ÔĀ°or E (13)
w kt√≥rym ÔĀ°or nosi nazwńô polaryzowalnoŇõci orientacyjnej i stanowi udziaŇā orientacji w polaryzacji czńÖsteczkowej. Z teorii Debye`a wynika, Ňľe polaryzowalnoŇõńá orientacyjna:
(14)
gdzie: k - staŇāa Boltzmanna (=1,380658*10-23 J/K), T - temperatura dielektryka (K).
Wz√≥r Clausiusa-Mossottiego (12) moŇľna wińôc teraz napisańá wyraŇľajńÖc polaryzacjńô dielektryka jako sumńô polaryzacji indukowanej i orientacyjnej:
(15)
Prawa strona powyŇľszego wzoru jest caŇākowitńÖ polaryzacjńÖ dielektryka polarnego i dalej bńôdzie oznaczona literńÖ P. Polaryzacja orientacyjna wystńôpuje wyŇāńÖcznie w polach statycznych lub w polach o niewielkiej (do ok. 30 MHz). Przy wysokich czńôstoŇõciach, np. odpowiadajńÖcych promieniowaniu widzialnemu (ok. 1015 Hz) wystńôpuje wyŇāńÖcznie polaryzacja indukowana.
Z teorii Maxwella wynika, Ňľe wsp√≥Ňāczynnik zaŇāamania ŇõwiatŇāa (n) speŇānia w przybliŇľeniu dla czńôstoŇõci pola elektrycznego, odpowiadajńÖcych promieniowaniu widzialnemu, nastńôpujńÖcńÖ zaleŇľnoŇõńá:
n2=ÔĀ• (16)
Wobec tego faktu moŇľna wz√≥r (12) napisańá nastńôpujńÖco:
(17)
LewńÖ stronńô powyŇľszego r√≥wnania nazywa sińô refrakcjńÖ molowńÖ (RM). Tak wińôc wobec (15), zachodzi:
(18)
lub
(18)
Wszystkie podane wyŇľej zaleŇľnoŇõci sńÖ sŇāuszne przy zaŇāoŇľeniu, Ňľe dipole wzajemnie nie oddziaŇāywujńÖ na siebie. ZaŇāoŇľenie to jest sŇāuszne w przypadku gaz√≥w pod niewielkimi ciŇõnieniami i w rozcieŇĄczonych roztworach w niepolarnym rozpuszczalniku.
Do pomiar√≥w wsp√≥Ňāczynnika zaŇāamania ŇõwiatŇāa stosuje sińô przyrzńÖdy zwane refraktometrami. Najbardziej rozpowszechnione to: refraktometry zanurzeniowe, typu Abbego i typu Pulfricha.
WYPOSAŇĽENIE ńÜWICZENIA:
Aparatura i urzńÖdzenia:
Refraktometr
piknometr
Odczynniki (alkohole):
Metylowy
n-propylowy
izopropylowy
n-butylowy
n-amylowy
n-heksylowy
n-heptylowy
benzylowy
alkohol metylowy do przemywania pipetek
glikol etylowy
Przebieg pomiarów:
1. Dla kaŇľdego z podanego zestawu alkoholi bada sińô wsp√≥Ňāczynnik zaŇāamania ŇõwiatŇāa w temperaturze 25oC przy uŇľyciu refraktometru Abbego. Zakres pomiar√≥w wsp√≥Ňāczynnik√≥w zaŇāamania mieŇõci sińô w granicach 1,300-1,700 z dokŇāadnoŇõcińÖ 1-2*10-4 i podziaŇākńÖ skali do 0,001. Zasadniczymi czńôŇõciami refraktometru sńÖ: ogrzewana obudowa pryzmatyczna, w skŇāad kt√≥rej wchodzi pryzmat oŇõwietlajńÖcy, luneta do obserwacji linii granicznej pola jasnego i ciemnego z wbudowanym ukŇāadem pryzmat√≥w Amiciego do znoszenia barwnej linii rozdzielajńÖcej pola i pomiar√≥w dyspersji Ňõredniej oraz mikroskop odczytowy ze skalńÖ pomiarowńÖ.
Przed rozpoczńôciem ńáwiczenia naleŇľy uruchomińá ultratermostat i doprowadzińá temperaturńô pryzmat√≥w refraktometru do 25oC (wg wskazania termometru przy refraktometrze, a nie przy ultratermostacie). Kolejne pr√≥bki nanosi sińô pipetńÖ, kt√≥rńÖ naleŇľy kaŇľdorazowo po uŇľyciu przemyńá alkoholem metylowym i wysuszyńá.
2. W celu wyznaczenia wzoru strukturalnego badanej substancji organicznej o wzorze sumarycznym C4H8O2 naleŇľy okreŇõlińá jej gńôstoŇõńá metodńÖ piknometrycznńÖ oraz wsp√≥Ňāczynnik zaŇāamania ŇõwiatŇāa.
OPRACOWANIE WYNIK√ďW
1.1. Wszystkie wielkoŇõci , kt√≥re odczytaliŇõmy z „Poradnika fizykochemicznego” oraz odczytany na refraktometrze Abbego wsp√≥Ňāczynnik zaŇāamania ŇõwiatŇāa umieszczamy w tabeli:
L.p. |
Alkohole |
Wzór |
Wsp√≥Ňāczynnik zaŇāamania ŇõwiatŇāa |
Masa czńÖsteczkowa M[g/mol]
|
GńôstoŇõńá d[g/cm3] |
Refrakcja Molowa RM[cm3‚ąômol-1] |
1 |
alkohol metylowy |
CH3OH |
1,332 |
32,04 |
0,7866 |
8,356 |
2 |
alkohol izopropylowy |
C3H8O |
1,377 |
60,097 |
0,7810 |
17,698 |
3 |
alkohol n-propylowy |
C3H8O |
1,3845 |
60,097 |
0,7995 |
17,596 |
4 |
alkohol n-butylowy |
CH3(CH2)3OH |
1,3976 |
74,124 |
0,8098 |
22,072 |
5 |
alkohol n-amylowy |
C5H12O |
1,423 |
88,15 |
0,8151 |
27,538 |
6 |
alkohol n-heksylowy |
C6H13OH |
1,4168 |
102,18 |
0,8155 |
31,496 |
7 |
alkohol benzylowy |
C6H5CH2OH |
1,5383 |
108,14 |
1,042 |
32,476 |
8 |
glikol etylenowy |
C2H6O2 |
1,4219 |
62,07 |
1,110 |
14,207 |
MajńÖc dana wielkoŇõńá R oraz wzory czńÖsteczkowe alkoholi moŇľemy obliczyńá refrakcje molowa grup takich jak :
C |
2,418 |
H |
1,100 |
-CH- |
3,619 |
-CH2- |
4,647 |
Tlen w gr. -OH |
1,525 |
-O- (gr.hydroks.) |
1,643 |
C=C |
1,575 |
szeŇõcioczŇāonowy pierŇõcieŇĄ wńôglowy |
-0,15 |
KaŇľdy sw√≥j typ wińÖzania wnosi sw√≥j udziaŇā liczbowy do refrakcji molowej. Dlatego mierzńÖc refrakcjńô molowńÖ bezpoŇõrednio caŇāej czńÖsteczki i por√≥wnujńÖc otrzymany wynik z wartoŇõcińÖ obliczonńÖ teoretycznie na podstawie danych z odpowiednich tabel, moŇľna wycińÖgnńÖńá wnioski dotyczńÖce budowy czńÖsteczki danej substancji.
ŇĀatwoŇõńá oznaczenia wsp√≥Ňāczynnika zaŇāamania ŇõwiatŇāa powoduje, Ňľe refrakcje molowńÖ stosuje sińô do charakterystyki danego zwińÖzku, do oznaczania jego czystoŇõci oraz oznaczania jego stńôŇľenia w mieszaninie.
CzńÖsteczki o podw√≥jnych wińÖzaniach sprzńôŇľonych wykazujńÖ podwyŇľszonńÖ wartoŇõńá refrakcji tzw. egzaltacjńô, podwyŇľszonej polaryzowalnoŇõci zdelokalizowanych elektron√≥w. Oznaczone doŇõwiadczalnie wartoŇõci refrakcji molowej sńÖ wińôksze od obliczonych przez sumowanie udziaŇā√≥w.
PrzykŇāadowo w tabeli przedstawiliŇõmy por√≥wnanie wynik√≥w refrakcji molowych wybranych alkoholi wyznaczonych doŇõwiadczalnie oraz obliczonych przez sumowanie udziaŇā√≥w skŇāadowych atom√≥w i ich ugrupowaŇĄ:
ALKOHOLE |
WZ√ďR SUMARYCZNY |
REFRAKCJA MOLOWA OZNACZCONA DOŇöWIADCZALNIE |
REFRAKCJA MOLOWA OBLICZONA PRZEZ SUMOWANIE UDZIAŇĀ√ďW |
metylowy |
CH3OH |
8,356 |
8,343 |
n-heksylowy |
CH3CH2 CH2CH2 CH2-CH2 OH |
31,496 |
31,433 |
GńôstoŇõńá badanej substancji d obliczyliŇõmy ze wzoru:
gdzie: m- masa badanej substancji w piknometrze
mw- masa wody w piknometrze
mo- masa pr√≥Ňľnego piknometru
dw- gńôstoŇõńá wody w temperaturze pomiaru
Na podstawie wyznaczonej gńôstoŇõci i wsp√≥Ňāczynnika zaŇāamania ŇõwiatŇāa badanej substancji organicznej o wzorze sumarycznym C4H8O2 obliczyliŇõmy refrakcjńô molowńÖ z r√≥wnania:
Na podstawie danych literaturowych obliczyliŇõmy addytywnie refrakcjńô molowńÖ dla niŇľej wymienionych zwińÖzk√≥w o skŇāadzie sumarycznym:
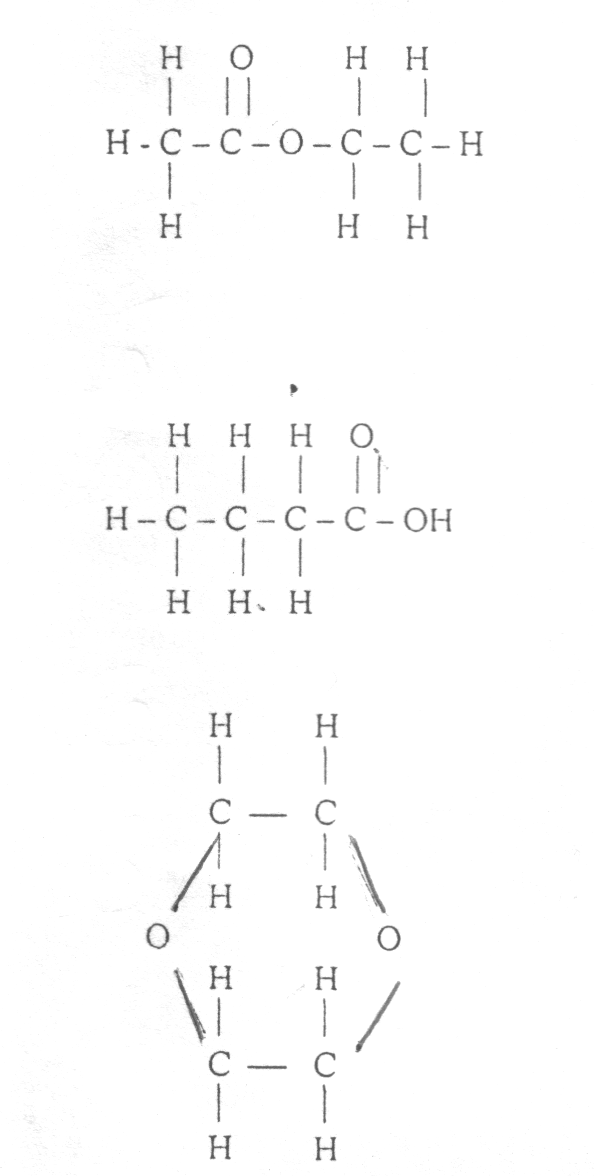
Octan etylu:
d=0,9005 g/cm3
R=4C+8H+O+O=4‚ąô2,418+8‚ąô1,100+1,643+2,11=22,225cm3/mol
Kwas masŇāowy:
d=0,9563 g/cm3
R=4C+8H+O+O=4‚ąô2,418+8‚ąô1,100+2,11+1,525=22,107cm3/mol
Dioxan:
d=1,0327 g/cm3
R=4C+8H+2O=4‚ąô2,418+8‚ąô1,100+2‚ąô1,643=21,758 cm3/mol
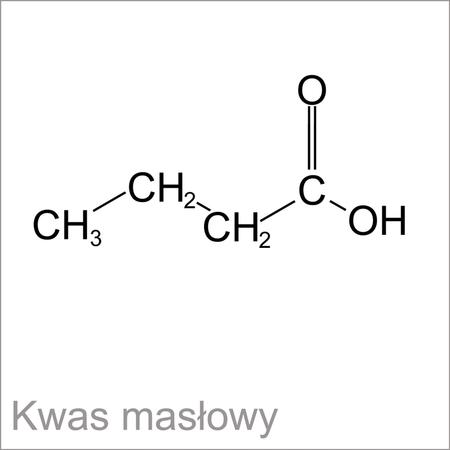
NaszńÖ badanńÖ substancja jest kwas masŇāowy
W poniŇľszej tabeli por√≥wnaliŇõmy wartoŇõńái refrakcji i gńôstoŇõci badanej substancji znalezione doŇõwiadczalnie z wartoŇõciami refrakcji obliczonymi na zasadzie addytywnoŇõci wińÖzaŇĄ i atom√≥w dla wymienionych izomer√≥w strukturalnych i gńôstoŇõci znalezionych w tablicach.
|
REFRAKCJA MOLOWA
|
GńėSTOŇöńÜ
|
OCTAN ETYLU |
22.225 |
0.9005 |
KWAS MASŇĀOWY |
22,107 |
0,9563 |
DIOXAN |
22,758 |
1,0327 |
Nasza substancja |
23,221 |
0,962 |
Wyszukiwarka
Podobne podstrony:
waŇľne informacje, budowictwo pcz (h.fresh06), II rok (sem III i sem IV), sem IV, praktyka 2013
waŇľne informacje
Wzajemne oddzialywania roslin idrobnoustrojow
kŇāopotliwe, rozw√≥d, Na jakiej podstawie moŇľna uzyskańá rozw√≥d koŇõcielny
WaŇľne informacje!!! CZYTAńÜ!!! (Genetyka)
SIECI KOMPUTEROWE, Polibuda, studia, S12, S3, waŇľne, informatyka, Stare, infasem2
ADHD waŇľne informacje, INSTYTUCJE POMOCY SPOŇĀECZNEJ MUSIELEWICZ, ZARZADZANIE UKW
WZAJEMNOŇöńÜ ODDZIAŇĀYWAŇÉ TERAPEUTYCZNYCH
Cele kursu, Semestr I, Teoretyczne podstawy wychowania, WaŇľne informacje
Wzajemne oddziaŇāywanie mińôdzy mikroorg
R√≥Ňľnice w budowie czńÖsteczek, Ňõciagi za free
wazne informacje TK
iPhone 3G Wazne informacje
iPhone 3G Wazne informacja
Informatyka odpowiedzi, Polibuda, studia, S12, S3, waŇľne, informatyka, Stare
Harmonogram, Semestr I, Teoretyczne podstawy wychowania, WaŇľne informacje
Wazne informacje - prosze przeczytac, PODRńėCZNIKI, POMOCE, SLAJDY, SUROWCE I PALIWA, Laborki
wińôcej podobnych podstron