Grupa 34 Zespół 2 |
Ćwiczenie nr 7 |
Data: 29.11.01 |
Janusz Budzowski Robert Wołoszyn Marek Budziaszek Łukasz Krężel |
Temat: Równowagi pH w układach buforowych. |
Ocena : |
Wstęp teoretyczny.
Stała dysocjacji jednozasadowego słabego kwasu RH równa jest:
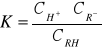
Jeżeli do roztworu dodamy określoną ilość soli tego kwasu, która ulega całkowitej dysocjacji to spełnione jest równanie:
![]()
gdzie:
Ckw - stężenie słabego kwasu,
CS - stężenie soli.
Korzystając z warunku elektroobojętności r-ru, iloczynu jonowego wody J i powyższego równania można wyprowadzić następujące wyrażenia:
![]()
![]()
Podstawiając te stężenia do wzoru na stałą dysocjacji i upraszczając otrzymane wyrażenia, gdy Ckw i CS >> CH+ i COH- otrzymujemy równanie:
![]()
Zadania do wykonania.
Wyznaczyć stałą dysocjacji słabego kwasu w roztworze buforowym.
Wyznaczyć pojemność buforową sporządzonych r-rów.
Wykonanie ćwiczenia.
Po przygotowaniu aparatu pomiarowego zgodnie z instrukcją obsługi stanowiska i sporządzeniu 12 roztworów buforowych o składzie zadanym przez prowadzącego, przystępujemy do pomiaru pH. Najpierw mierzymy pH buforu, a następnie po dodaniu 0.5 cm3 HCl o stężeniu 0.1 [mol/dm3].
Obliczenia i pomiary.
T = 293 [K]
Vr-ru = 40 [cm3]
CHCl = 0.1 [mol/dm3]
Nr r-ru |
Stos. obj. kwasu / soli |
pH r-ru |
pH r-ru po dod. HCl |
ΔpH |
CS / Ckw |
K |
|
|
CH3COOH |
CH3COONa |
|
|
|
|
|
1 |
0.5 |
9.5 |
6.14 |
5.95 |
0.19 |
19 |
1.37 ⋅ 10-5 |
2 |
1 |
9 |
5.83 |
5.71 |
0.12 |
9 |
1.33 ⋅ 10-5 |
3 |
2 |
8 |
5.43 |
5.37 |
0.06 |
4 |
1.49 ⋅ 10-5 |
4 |
3 |
7 |
5.22 |
5.17 |
0.05 |
2.3 |
1.41 ⋅ 10-5 |
5 |
4 |
6 |
4.99 |
4.94 |
0.05 |
1.5 |
1.53 ⋅ 10-5 |
6 |
5 |
5 |
4.85 |
4.81 |
0.04 |
1 |
1.41 ⋅ 10-5 |
7 |
6 |
4 |
4.70 |
4.66 |
0.04 |
0.667 |
1.33 ⋅ 10-5 |
8 |
7 |
3 |
4.49 |
4.46 |
0.03 |
0.429 |
1.39 ⋅ 10-5 |
9 |
8 |
2 |
4.32 |
4.25 |
0.07 |
0.250 |
1.20 ⋅ 10-5 |
10 |
9 |
1 |
3.99 |
3.91 |
0.08 |
0.111 |
1.14 ⋅ 10-5 |
11 |
9.5 |
0.5 |
3.80 |
3.62 |
0.18 |
0.053 |
8.34 ⋅ 10-6 |
12 |
9.75 |
0.25 |
3.50 |
3.23 |
0.27 |
0.026 |
8.11 ⋅ 10-6 |
K = 1.27 ⋅ 10-5 [mol/dm3]
Wykres
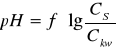
.
Wykres
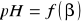
.
![]()
Gdzie ΔCHCl oznacza zmianę stężenia kwasu po dodaniu do r-ru.
CHCl = 0.1 [mol/dm3]
ΔCHCl = 1.25 ⋅ 10-6 [mol/dm3] = const
pHwody dest. = 5.72
pHwody dest. po dodaniu HCl = 3.2
ΔpH = 2.52
Nr r-ru |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
Pojemność buforowa |
2.63 |
4.17 |
8.33 |
10 |
10 |
12.5 |
12.5 |
16.7 |
7.14 |
6.25 |
2.78 |
1.85 |
Wnioski.
Podczas wykonywania ćwiczenia zauważamy, iż dodatek kwasu do buforu powoduje nieznaczne obniżenie pH. Aby dokonać porównania taką samą ilość kwasu dodajemy do próbki wody o identycznej objętości jak badany r-r i obserwujemy znaczny spadek pH. Wielkość charakteryzująca zmianę pH r-ru to pojemność buforowa. Najwyższą jej wartość otrzymujemy kiedy stosunki objętości kwasu do zasady jest porównywalny przy ich jednakowych stężeniach.
Wyszukiwarka
Podobne podstrony:
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
więcej podobnych podstron