Wyznaczanie stałych równania kinetycznego reakcji izomeryzacji D-glukozy do D-fruktozy
Cel ćwiczenia: zapoznanie się z procedurą postępowania przy wyznaczaniu stałych równania kinetycznego reakcji równowagowej
Izomeryzacja glukoza↔fruktoza
Reakcja enzymatycznej izomeryzacji D-glukozy jest przykładem reakcji równowagowej, w której enzym wykazuje powinowactwo zarówno do substratu, jak i produktu reakcji. Reakcję izomeryzacji glukozy (G) i fruktozy (F) przedstawia schemat (1), który, przy założeniu, że szybkości przekształcania kompleksów aktywnych (GE ⇔ GF) są bardzo duże upraszcza się do schematu (2).
G + E ⇔ GE ⇔ GF ⇔ F + E (1)
G + E ⇔ GE ⇔ F + E (2)
W badaniach kinetycznych szybkość reakcji w obecności różnych początkowych stężeń substratu mierzona jest zazwyczaj w bardzo wczesnym stadium reakcji, zanim stężenie produktu wzrośnie do znaczącego poziomu (stopień przereagowania substratu < 3%). Przy spełnieniu tego warunku, można wyznaczyć parametry kinetyczne reakcji zarówno w kierunku G→F, jak i F→G, stosując odpowiednie równania Michaelisa-Menten:
![]()
G→F: ![]()
![]()
![]()
(3)
F→G: ![]()
![]()
(4)
gdzie: VmaxG, VmaxF - stałe szybkości reakcji dla glukozy lub fruktozy jako substratu;
KmG, KmF - stałe Michaelisa dla glukozy lub fruktozy jako substratu
Rozpatrując przebieg procesu izomeryzacji, należy wziąć pod uwagę fakt obecności substratu i produktu reakcji w mieszaninie reakcyjnej, co m. in. pozwala oszacować kierunek przebiegu reakcji. Kierunek reakcji zależy od relacji między stosunkiem CF / CG a stosunkiem równowagowym (Keq). Np., jeżeli Keq = 1, CF = 5 mM i CG = 1 mM, to reakcja będzie przebiegać w kierunku F→G i osiągnie stan równowagi termodynamicznej dla CF* = 3 mM i CG* = 3 mM (CF*,CG* - stężenie glukozy i fruktozy w stanie równowagi termodynamicznej). Natomiast szybkość reakcji (r) dla danych wartości CF i CG nie może być policzona jako różnica szybkości reakcji r = rG - rF z równań (1) i (2), gdyż równania te oparte są na założeniu, że, odpowiednio, CF lub CG są równe zero. W takim przypadku należy zastosować równanie uwzględniające wpływ obu reagentów, tzn. w miarę postępu reakcji obniżające się wysycenie enzymu substratem i wzrastający udział reakcji w kierunku przeciwnym. Jeżeli założymy, że część enzymu nie jest dostępna dla substratu, gdyż reaguje z produktem, to możemy to zjawisko przybliżyć modelem przewidzianym dla inhibicji kompetycyjnej. Wówczas:
G→F: 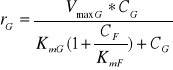
(5)
F→G: 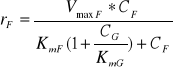
(6)
a szybkość reakcji np. w kierunku G→F: r = rG - rF (7)
Po przekształceniach algebraicznych równanie (7) przyjmuje postać:
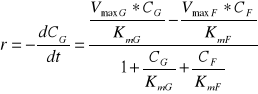
(8)
W równaniu (8) 4 stałe kinetyczne ze stałą równowagi Keq wiąże równanie Haldana:
Keq = CF* / CG* =![]()
(9)
Powyższe równanie ma bardzo duże znaczenie praktyczne. Między innymi służy do szybkiej weryfikacji poprawności wyznaczonych stałych z uproszczonych równań (3) i (4). Jeżeli dysponuje się doświadczalnie wyznaczoną wartością Keq, to można ją porównać z wartością obliczoną na podstawie równania Haldana. Różnica między wartością eksperymentalną i obliczoną ze stałych równań kinetycznych rzędu błędu analitycznego pozwala stwierdzić poprawność wyznaczonych wartości stałych.
MATERIAŁY I METODY
Materiały
immobilizowana izomeraza glukozowa (poprawnie: izomeraza ksylozowa) otrzymana nieodpłatnie z firmy Novozyme;
- objętość całkowita złoża - 25 cm3
- objętość wolna reaktora - 8.5 cm3
- temperatura procesu - 40° C
roztwory glukozy i fruktozy;
0.05 M bufor tris-HCl + 3 mmol Mg, pH 7.8 w 40 °C;
odczynniki do enzymatycznego oznaczania stężenia glukozy
Aparatura
spektrofotometr UV-VIS Shimadzu;
termostatowane reaktory kolumnowe
pompy tłokowe Prominent
Metody
Oznaczanie stężenia glukozy testem enzymatycznym.
Zasada metody. Glukoza pod wpływem oksydazy glukozowej utlenia się do kwasu glukonowego z wytworzeniem nadtlenku wodoru, który w obecności peroksydazy powoduje zmianę zabarwienia chromogenu.
Oznaczanie stężenia glukozy. Do suchych i czystych probówek wprowadzić po 1 cm3 roztworu roboczego. Przygotować również 2 probówki na standard glukozy i kontrolę. Z probówek zawierających odpowiednio rozcieńczone próbki badane oraz z próbki zawierającej standard pobrać po 10 μl roztworu i wprowadzić do roztworów roboczych. Każdorazowo kilkakrotnie przepłukać końcówkę roztworem roboczym. Całość wstawić na 5 min do łaźni wodnej o temperaturze 37 °C, a następnie zmierzyć absorbancję (500 nm) wobec próby kontrolnej.
Obliczanie stężenia glukozy. Wartość absorbancji dla standardu glukozy przyjąć jako 15 mmol/L. Z proporcji obliczyć stężenie w próbkach badanych, uwzględniając rozcieńczenie.
Rozcieńczenia. W przypadku fruktozy, jako substratu, pobranych próbek nie rozcieńczać. Stosując jako substrat glukozę, należy wykonać rozcieńczenia:
Stężenie glukozy [mM] |
Rozcieńczenie [-] |
Objętość roztworu badanego [μl] |
Objętość wody [ml] |
50 |
2x |
1000 |
1,0 |
100 |
3x |
1000 |
2,0 |
200 |
10x |
1000 |
9,0 |
400 |
20x |
500 |
9,5 |
600 |
20x |
500 |
9,5 |
800 |
40x |
250 |
9,75 |
1000 |
40x |
250 |
9,75 |
1250 |
50x |
200 |
9,8 |
1500 |
50x |
200 |
9,8 |
1750 |
100x |
100 |
9,9 |
Wyznaczanie wartości Keq reakcji izomeryzacji.
Do 5 cm3 0,05 M roztworu glukozy dodać 50 μl natywnej izomerazy glukozowej i umieścić w łaźni wodnej o temperaturze 40 °C celem osiągnięcia stanu równowagi termodynamicznej. Zadaniem każdej grupy jest pobranie próbki z wyjściowego roztworu substratu oraz z mieszaniny reakcyjnej, rozcieńczeniu próbek wodą destylowaną (podane w tabeli) oraz oznaczenie stężenie glukozy metodą enzymatyczną.
Pomiar zmiany stężeń reagentów w warunkach początkowej szybkości reakcji.
Przygotować po 500 cm3 dwóch roztworów glukozy lub fruktozy o podanych przez osobę prowadzącą stężeniach. Do termostatowanych (40°C) reaktorów kolumnowych ze złożem upakowanym dozować substrat z podanymi szybkościami przepływu (pompa „mała” - 60/120; 40/120; 20/120; 10/120 / pompa „duża” - 15/120; 7,5/120; 2,5/120; 0/120). Dla każdego przepływu zmierzyć strumień (zmierzyć czas napełnienia cylindra na 50 cm3), a następnie pobrać próbkę do analiz z wylotu z reaktora, zwracając uwagę na osiągnięcie stanu ustalonego. Należy również pobrać próbkę substratu na wejściu reaktora. Wszystkie próbki odpowiednio rozcieńczyć i oznaczyć stężenie glukozy testem enzymatycznym.
WYNIKI I ICH OMÓWIENIE
Na podstawie otrzymanych wyników obliczyć dla enzymu immobilizowanego:
VmaxG, VmaxF , KmG, KmF i przedstawić analizę otrzymanych wyników;
obliczyć stałą równowagi Keq z otrzymanych wartości stałych równania kinetycznego i porównać z wartością Keq, wyznaczoną eksperymentalnie.
Sprawozdanie winno zawierać: wstęp (np. o enzymie, jego wykorzystaniu w przemyśle, reaktorze ze złożem upakowanym), metodykę (należy pamiętać o formie bezosobowej np. dodano, zmierzono...), wyniki i dyskusję wyników.
![]()
Wyszukiwarka
Podobne podstrony:
instrukcja reaktory przepływowe-izomeraza[2011], [3] Izomeraza glukozowa
test z urologiii, Pielęgniarstwo - materiały na studia, REU
powiklania po znieczuleniu ogolnym, Pielęgniarstwo - materiały na studia, IT
FUNKCJE WYCHOWAWCZE GRUPY RÓWIEŚNICZEJ, materiały na studia, I rok studiów, Psychologia
Chemia fizyczna 24, MATERIAŁY NA STUDIA, różne cosie
stadiarozw, materiały na studia, I rok studiów, Psychologia
lista poleceń, Politechnika Lubelska, Studia, Studia, sem I - II, materialy na studia
Urazy czaszkowo-mózgowe, Pielęgniarstwo - materiały na studia, IT
mgr2, Pielęgniarstwo - materiały na studia, żywienie otyłośc
pytania - Dyplom 2008, Pielęgniarstwo - materiały na studia, Pytania
Asyryjska Lista Krolow, materiały na studia z historii
Aby nie dopuścić do nadwagi, materiały na studia, I rok studiów, Pedagogika społeczna i socjologia
sprawozdnie 5, Politechnika Lubelska, Studia, Studia, sem I - II, materialy na studia
Sprawozdanie z fizyki W3a, MATERIAŁY NA STUDIA, różne cosie
Biomateriały do Sterowanej Regeneracji Kości i Sterowanej Regeneracji Tkanek, Materiały Na Studia
referat1, materiały na studia, I rok studiów, Pedagogika społeczna i socjologia
Wnikanie ciepła, MATERIAŁY NA STUDIA, różne cosie
Statystyka pojecia, Materiały na studia, Turystyka i Rekreacja, Podstawy statystyki
więcej podobnych podstron