MONIKA POMYKAŁA
GR.LAB 7
Nr. ćwiczenia: 12 |
Tytuł ćwiczenia: OTRZYMYWANIE NITROANILINZ ACETANILIDU |
||
Data wykonania:
16.05.2003 r |
Data zaliczenia: |
Ocena:
K:
P:
S:
|
Ocena średnia: |
Przepis literaturowy:
Umieszczamy 2,7 g acetanilidu otrzymanego w poprzednim ćwiczeniu w 250 ml kolbie stożkowej upewniwszy się przed ważeniem, że związek jest suchy. W 10 ml cylindrze odmierzamy 9 ml stężonego kwasu siarkowego; mniej więcej połowę tej ilości wlewamy do kolby i mieszamy aż do prawie całkowitego rozpuszczenia (pozostała niewielka część osadu po pewnym czasie też ulegnie rozpuszczeniu). Kolbę umieszczamy w łaźni z lodem, np. w szerokiej zlewce. Odmierzamy dokładnie1,5 ml stęż kwasu azotowego i mieszamy go z pozostałym kwasem siarkowym. Kwasy mieszamy pobierając kwas pipetką z dna cylindra i opróżniając ją przy górnej krawędzi, a następnie za pomocą banieczek powietrza wypuszczanych z pipety umieszczonej przy dnie cylindra. Za pomocą pipetki z gruszką dodajemy mieszaninę kwasów małymi, ok. 0,5 ml porcjami do oziębionego roztworu acetanilidu w kwasie siarkowym i po dodaniu każdej porcji mieszamy ciec w kolbie w łaźni z lodem. Dodawanie kwasu trwa ok. 10-15 min, przy czym kolba nie powinna być ciepła w dotyku. Po 20 min od momentu rozpoczęcia dodawania mieszaniny kwasów wlewamy do kolby 25 ml wody z lodem (do pełnej probówki lodu dodajemy wody).Powstałą mieszaninę nitroacetanilidów hydrolizujemy w tej samej kolbie rozcieńczonym kwasem siarkowym. Do kolby wrzucamy porcelankę i ogrzewamy palnikiem na siatce azbestowej. Obserwujemy ciemnienie zabarwienia i rozpuszczanie się osadu. W razie pienienia lub zbyt intensywnego wrzenia zmniejszamy ogrzewanie. Zawartość ogrzewamy łagodnie do wrzenia jeszcze przez 15 min i następnie oziębiamy w łaźni z lodem, po czym łaźnię wraz z kolbą umieszczamy pod wyciągiem i dodajemy w 5 lub 6 porcjach 25 ml stężonego roztworu amoniaku, mieszając po dodaniu każdej porcji. Wytrąconą nitroanilinę odsączamy pod próżnią na lejku Büchnera, kolbę przepłukujemy trzema ml wody, przepłucz wlewamy na lejek odłączywszy na moment próżnię i odsączamy wodę. Osad wyciskamy i pozostawiamy na lejku na 2-3 min przy włączonej pompie próżniowej. Otrzymane żółte kryształki zdejmujemy z sączka, przenosimy do probówki, dodajemy 4 ml etanolu, ogrzewamy do wrzenia w łaźni wodnej aż osad ulegnie prawie całkowitemu rozpuszczeniu i oziębiamy przez 10-15 min w łaźni z lodem w celu wykrystalizowania p-nitroaniliny. Kryształy p-nitroaniliny odsączmy pod próżnią, zbierając przesącz do zważonego odbieralnika, który może być odpowiedniej wielkości probówka umieszczona w 500 ml kolbie ssawkowej. Kryształy p-nitroaniliny przenosimy na sączek prawie ilościowo używając minimalnej ilości alkoholu do spłukiwania (ok. 0,5 ml). Odsączoną p-nitroanilinę rozkładamy do wysuszenia na glansowanym papierze i zarówno kryształy jak i oleisty przesącz analizujemy metodą chromatografii cienkowarstwowej. Po wysuszeniu notujemy masę p-mitroaniliny, temperaturę topnienia i wyniki chromatografii.
Spis odczynników
Kwas siarkowy (H2SO4): masa molowa: 98,08 g.mol-1; temp. topnienia: 10,36oC; temp. wrzenia: 338oC gęstość: 1,84 g.cm-3; bezbarwna, oleista, higroskopijna ciecz, stężony kwas działa silnie żrąco
Kwas azotowy (HNO3): masa molowa: 63,02 g.mol-1; temp. topnienia: -42oC; temp. wrzenia: 83oC gęstość: 1,50 g.cm-3; bezbarwna, żrąca, trująca ciecz, nie należy wdychać par
Acetanilid (CH3CONHC6H5): masa molowa: 135,142 g.mol-1; temp. topnienia: 114,3oC; temp. wrzenia: 304oC gęstość: 1,2 g.cm-3; biały, krystaliczny amid kwasu octowego, stosowany w produkcji barwników i gumy
Schemat reakcji:
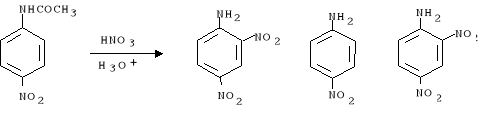
1 mol
M = 135,142 g.mol-1
m = 2,7 g
0,02 mol
1 mol
M = 139,096 g.mol-1
m = 2,76 g
0,02 mol
Przebieg ćwiczenia:
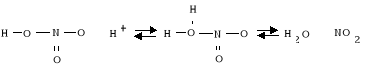
1. W kolbie stożkowej umieszczono 2,7 g acetanilidu oraz dodano 4,5 ml stężonego H2SO4 i mieszano do całkowitego rozpuszczenia się acetanilidu. Po rozpuszczeniu kolbę umieszczono w łaźni z lodem i przygotowano mieszaninę nitrującą tzn. do 15 ml stężonego HNO3 dodano ok. 4,5 ml stężonego H2SO4, zaszła reakcja:
![]()
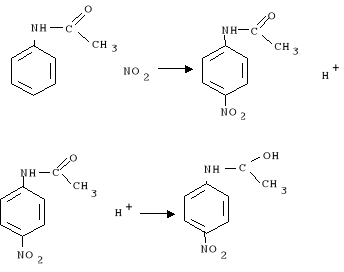
2. Mieszaninę nitrującą wlewano małymi porcjami do kolby i po dodaniu każdej porcji mieszano ciecz w łaźni z lodem. Zachodzą reakcje:
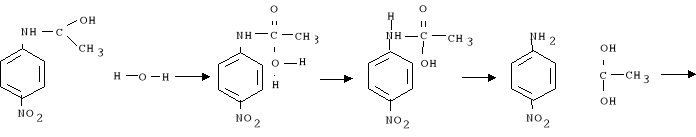
3. Następnie do powstałej mieszaniny w kolbie wlano 25 ml wody z lodem w celu jej zhydrolizowania w wyniku czego wytrącił się żółty osad i zaszła reakcja:
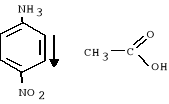
4. Następnie do kolby wrzucono porcelankę i ogrzewano palnikiem na siatce azbestowej, zaobserwowano ciemnienie zabarwienia i rozpuszczani się osadu. Po całkowitym rozpuszczeniu zaprzestano ogrzewanie i mieszaninę oziębiono w łaźni z lodem.
5. Do kolby umieszczonej w łaźni z lodem dodano 25 ml stężonego wodnego roztworu amoniaku (w kilku porcjach, mieszając po dodaniu każdej porcji) w celu rozłożenia powstałego produktu ubocznego oraz zobojętnienia obecnych w środowisku kwasów: CH3COOH, H2SO4, HNO3
H2SO4 + NH4OH ___ NH4HSO4
HNO3 + NH3 ___ NH4NO3
CH3COOH + NH3 ___ CH3COONH4
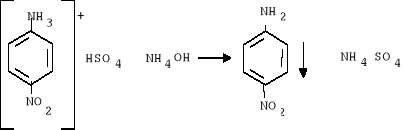
6. Powstały osad żółto-pomarańczowy odsączono na lejku Büchnera, przepłukując kolbę wodą destylowaną i pozostawiono osad do wyschnięcia. Po wysuszeniu obliczono wydajność.
Masa szalki - 75,3 g
Masa produktu - 2,2 g
![]()
Wnioski:
W wyniku reakcji otrzymaliśmy nitroanilinę z acetanilidu, jest to żółto-pomarańczowy osad o temperaturze topnienia 148oC. Wydajność reakcji jest duża, co wskazywałoby na to, że w czasie doświadczenia nie nastąpiły straty produktów, jak również to, że substraty przereagowały prawie całkowicie.
Wyszukiwarka
Podobne podstrony:
ACETANILID, technologia chemiczna, chemia organiczna 2003,2004
Estry metylowe podstawionych kwasów benzoesowych, technologia chemiczna, chemia organiczna 2003,2004
ZWIĄZKI NATURALNE, technologia chemiczna, chemia organiczna 2003,2004
SYNTEZA GRIGNARDA, technologia chemiczna, chemia organiczna 2003,2004
I POPRAWKA EGZAMINU Z CHEMII ORGANICZNEJ, Technologia chemiczna, Chemia organiczna, 4 semestr, organ
dyd tech405a, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
dyd tech412, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna
organiczna-koła, Technologia chemiczna, Chemia organiczna, 3 semestr, 1 kolokwium
dyd k3a r, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna -
Labolatoria (semestr III), Technologia chemiczna, Chemia organiczna, 4 semestr, ćwiczenia
dyd tech409 12a, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organi
dyd tech407a, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
dyd tech407b, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
pytania organiczna 1 termin 2011 sem 4, technologia chemiczna, chemia organiczna2010-2011, sem 4
dyd e2b, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna - w
dyd tech404b, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
Egz pierwszy, Technologia chemiczna, Chemia organiczna, 3 semestr, egzaminy
dyd tech406b, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
dyd tech413, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna
więcej podobnych podstron