MONIKA POMYKAŁA
GR.LAB 7
Nr. ćwiczenia: 8 |
Tytuł ćwiczenia: OTRZYMYWANIE CYKLOFENYLOMETANOLU Z CHLORKU CYKLOHEKSYLU I BENZALDEHYDU - SYNTEZA GRIGNARDA |
||
Data wykonania:
11. 04. 2003 r |
Data zaliczenia: |
Ocena:
K:
P:
S:
|
Ocena średnia: |
Przepis literaturowy:
Montujemy aparaturę w sposób następujący: w bocznej szyjce 500 ml kolby trójszyjnej umieszczamy chłodnice zwrotną, w środkowej wkraplacz, a trzecią zamykamy korkiem. Na końcu chłodnicy zwrotnej umieszczamy rurkę z chlorkiem wapnia. Kolbę chwytamy w łapę za środkową szyje i nie opieramy jej na kółku, aby móc swobodnie podstawić pod nią łaźnię lodem. Cała aparatura musi być dokładnie wysuszona. W kolbie umieszczamy wiórki magnezowe w ilości równoważnej ilości moli użytego chlorku cykloheksylu i dodajemy 20 ml bezwodnego eteru. Płaszcz chłodnicy zwrotnej wypełniamy wodą i zamykamy przepływ. Reakcję Grignarda inicjujemy dodając pipetką 2-3 ml chlorku, najlepiej zanurzając pipetkę pod powierzchnię eteru i wypuszczając chlorek bezpośrednio na powierzchnię metalu. Następnie za pomocą bagietki delikatnie rozkruszamy wiórki magnezowe w miejscu dodania chlorku i zamykamy kolbę. Ogrzewamy kolbę w łaźni z ciepłą wodą nie mieszając jej zawartości, ponieważ do zainicjowania reakcji potrzebne jest duże stężenie chlorku przy powierzchni magnezu. Jeśli po 5 min nie ma oznak, że reakcja się rozpoczyna (wydzielanie pęcherzyków gazu lub zmętnienie), należy dodać do kolby mały kryształek jodu i dodatkowo 1 ml chlorku. Jeśli mimo to przez następne 5 min nadal nie ma oznak reakcji, należy dodać małą próbkę mieszaniny reagującej otrzymanej osobno w suchej probówce z paru kawałków magnezu, 1 ml eteru i 1 ml chlorku cykloheksylu. Gdy reakcja już się rozpocznie, co można poznać po wydzieleniu się ciepła i zmętnienie, otwieramy przepływ wody w chłodnicy. Pozostały chlorek cykloheksylu rozcieńczamy bezwodnym eterem biorąc 3 ml na gram chlorku, roztwór umieszczamy we wkraplaczu i dodajemy do mieszaniny reagującej z taką prędkością, aby utrzymać łagodne wrzenie, mieszając ją od czasu do czasu. Po dodaniu całego chlorku, w celu utrzymania wrzenia, ogrzewamy roztwór na łaźni wodnej przez 20 min. Winien on wówczas przybrać ciemnoszare zabarwienie pochodzące od zdyspergowanych zanieczyszczeń magnezu i może zawierać kilka nieprzereagowanych wiórków magnezowych. Podczas ogrzewania mieszaniny reagującej odważamy aldehyd benzoesowy w ilości molowej odpowiedniej do użytego chlorku cykloheksylu, mieszamy go z trzykrotną objętością bezwodnego eteru i umieszczamy we wkraplaczu. Po zakończeniu reakcji powstawania odczynnika Grignarda mieszaninę reagującą oziębiamy do temperatury pokojowej i wkraplamy roztwór aldehydu z taką prędkością, aby utrzymać łagodne wrzenie, poruszając kolbą w celu wymieszania zawartości. W miarę przebiegu reakcji prędkość wkraplania można zwiększać, można również okresowo ochładzać kolbę w łaźni z lodem. Po zakończeniu wkraplania mieszamy zawartość kolby przez kilka minut i następnie, przepłukując eterem, przenosimy do 20 ml kolby stożkowej. Staramy się przy tym unikać przenoszenia kawałków nieprzereagowanego metalu, mogąc przeszkadzać w dalszych operacjach. Przed hydrolizą dodajemy eteru (już nie bezwodnego) uzupełniając straty powodowane przez wyparowanie oraz kilka kawałków lodu. Następnie dodajemy, porcjami po 5 ml, nasycony roztwór wodny chlorku amonu wytrząsając i chłodząc w razie potrzeby, aż do zaniku galaretowatego osadu. Ćwiczenie można w tym miejscu przerwać pozostawiając mieszaninę w zakorkowanym naczyniu. Mieszaninę przelewamy do rozdzielacza, dodajemy nieco rozcieńczonego kwasy solnego (1-2N) i wytrząsamy aż do rozpuszczenia ewentualnych części stałych. Warstwę eterową przemywamy wodą i następnie dwiema porcjami po 10 ml 30%-ego (nasyconego) roztworu wodorosiarczanu sodowego. Wytrząsamy, co najmniej przez minutę po dodaniu każdej porcji NaHSO3 i na koniec przemywamy ponownie wodą. Suszymy siarczanem magnezu, odparowujemy w zważonej probówce aż do uzyskania oleistej pozostałości, którą następnie oziębiamy w łaźni z lodem i inicjujemy krystalizację przez pocieranie ścianek bagietką. W przypadku, gdy krystalizacja nie następuje, dodajemy 1 ml pentanu. Gdy związek w całości wykrystalizuje, otrzymaną oleistą papkę przenosimy na lejek Hirscha i następnie podłączamy próżnię. Próżni nie należy włączać wcześniej, ponieważ parowanie rozpuszczalnika z przesączu może spowodować zatkanie lejka. Otrzymany surowy alkohol przekrystalizowujemy z równej wagowo ilości pentanu lub niskowrzącego eteru naftowego. Notujemy temperaturę topnienia i masę otrzymanego produktu.
Spis odczynników:
chlorek cykloheksylu: masa molowa: 118,61 g.mol-1; temperatura topnienia: -43oC; temperatura wrzenia: 142oC; gęstość: 0,9891 g.cm-3; współczynnik załamania światła: 1,4626; ciecz łatwo rozpuszcza się w alkoholu etylowym, eterze etylowym
aldehyd benzoesowy: masa molowa: 190.18 g.mol-1; temperatura topnienia: -26oC; temperatura wrzenia: 178,1oC; gęstość: 1,04 g.cm-3; współczynnik załamania światła: 1,063 żółtawa, lotna, oleista ciecz, występuje w migdałach i ma zapach migdałowy
siarczan magnezu: masa molowa: 120,37 g.mol-1; gęstość: 2,66 g.cm-3; biała substancja krystaliczna, rozkłada się w temp. 112 oC; rozpuszcza się w alkoholu etylowym i glicerynie
Schemat reakcji:
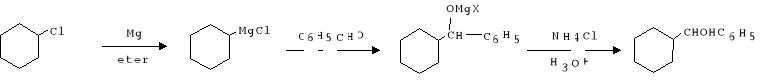
gęstość chlorku cykloheksylu: d= 0,9891 g.cm3
m = 0,9891 g.cm-3. 2,5cm3 = 2,4727g
M chlorku cykloheksylu = 118,61 g.mol-1
n= m.M-1 = 0,021 mol
190,31 g.mol-1 ________ 1 mol x _________ 0,0149 mol
x = 2,83g
liczba moli użytego aldehydu:
m = 1,5 cm3.1,063 g.cm-3 = 1,5945g
n = 0,0149 mol
równa liczba moli Mg:
Mg = 24,312 g.mol-1
mMg = 0,021 mol. 24,312 g.mol-1 = 0,5g
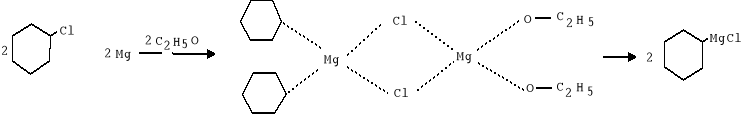
Przebieg ćwiczenia:
1. Zmontowano zestaw składający się z kolby trójszyjnej (250ml) zaopatrzonej w chłodnicę zwrotną i wkraplacz. Na końcu chłodnicy i wkraplacz umieszczono rurkę z CaCl2, który pochłania parę wodną z powietrza, zabezpieczając środowisko reakcji przed jej dostępem, co mogłoby spowodować rozkład związku Grignarda:
CaCl2 +6 H2O ___ CaCl2.6H2O
2. W kolbie umieszczono 0,5g wiórek magnezowych (ilość równoważną ilości użytego chlorku cykloheksylu) oraz dodano 20 ml bezwodnego eteru. Wrzący eter tworzy warstwę uniemożliwiającą dostęp tlenu do r-cji (zabespiecza to reakcję).

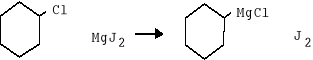
3. Przy użyciu pipety dodano 0,5g chlorku cykloheksylu bezpośrednio na powierzchnię wiórek magnezowych, ponieważ aby zainicjować r-cjępotrzebne jest duże stężenie chlorku cykloheksylu na powierzchni magnezu.
Mg2+ + J2 ___ MgJ2
Po kilku minutach r-cja rozpoczęła się, nastąpiło wydzielenie się pęcherzykówi i zaobserwowano zmętnienie produktu w kolbie.
4.Włoczono przepływ wody w chłodnicy, we wkraplaczu umieszczono 2 mol chlorku cykloheksylu i 6 ml eteru bezwodnego. Roztwór ten wkraplano powoli, ogrzewano przez ok. 40 min. Utrzymując lekkie wrzenie aż do barwy ciemnoszarej, która pochodzi od zanieczyszczeń magnezu. W kolbie zaszła reakcja:
5. W czasie ogrzewani sporządzono roztwór składadający się z 1,5 ml benzaldehydu i 4,5 ml eteru. Po ochłodzeniu otrzymanego związku do temp. pokojowej, rozpoczęto wkraplanie przygotowanego roztworu, czasami mieszając i utrzymując łagodne wrzenie, ogrzewanie prowadzono jeszcze przez 20 min. Zachodzi reakcja:
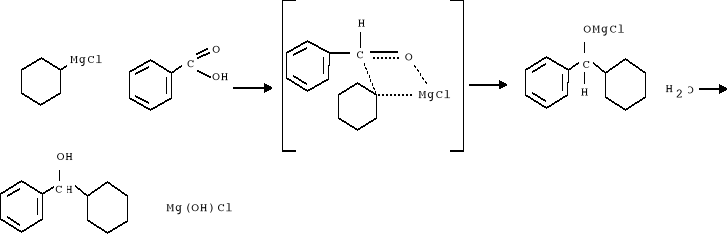
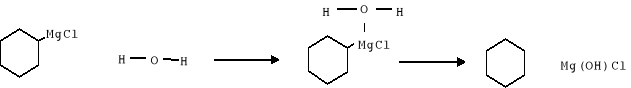
6. Po zakończeniu zawartość przeniesiono do kolby stożkowej, przepłukując eterem (uważając aby nie przenieść kawałków nieprzereagowanego metalu). Następnie dodano kilka kawałków lodu co spowodowało powstanie jasnoszarego, galaretowanego osadu Mg(OH)Cl. Następnie dodawano porcjami po 5 ml NH4Cl, aż do zaniku galaretowatego osadu
Mg(OH)Cl + NH4Cl ___ MgCl2 + NH4OH
7. Mieszaninę przeniesiono do rozdzielacza i dodano nieco rozcieńczonego kwasu solnego. Wytrząsano, aż do rozpuszczenia się części stałych Mg(OH)Cl i Mg(OH)2
Mg(OH)2 + HCl __ MgCl2 + 2 H2O
10. Warstwę eterową przemyto wodą, a następnie dwoma porcjami po 10 ml 10-proc roztworu NaHSO3. Wytrząsano przez minutę z każdą porcją, aby usunąć nadmiar aldehydu, który nie przereagował:
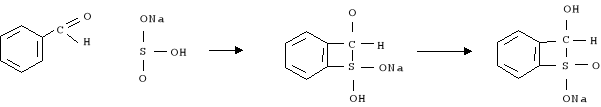
11. Po wytrząśnięciu warstwę organiczną przemyto wodą, a następnie i suszono MgSO4 (ok. 30 min)
MgSO4 + 10 H2O ___ MgSO4 . 10 H2O
12. Następnie na wyparce odparowano eter i otrzymano oleistą ciecz, którą przeniesiono na wcześniej zważoną szalkę (substancja częściowo wykrystalizowała na ściankach kolby). Całość pozostawiono do wyschnięcia.
Otrzymany produkt cykloheksylofenylometanolu jest ciałem stałym o barwie białej i temperaturze topnienia 45oC (wartość literaturowa). Oznaczono również temp. topnienia, która wynosiła: 45,9oC
masa szalki: 75,3 g
masa produktu: 1,6 g
![]()
Wnioski:
Masa otrzymanego produktu wynosi 1.6 g, a wydajność: 56,5%. Świadczy to o tym że podczas otrzymywania produktu powstały straty, które mogą wynikać z tego iż mogły zajść r-cje uboczne, jak również z niecałkowitego przereagowania substratów (pozostały w kolbie magnez). Straty mogła nastąpić podczas przemywani, rozdzielania, sączeni, a także przenoszenia produktu na szalkę z kolby okrągłodennej po destylacji, gdyż produkt zaczął krystalizować w kolbie. Oznaczona temp. topnienia nie różni się zbytnio od literaturowej temp. topnienia i świadczy to o tym, że otrzymany produkt jest czysty.
Wyszukiwarka
Podobne podstrony:
ACETANILID, technologia chemiczna, chemia organiczna 2003,2004
NITROANILINY, technologia chemiczna, chemia organiczna 2003,2004
Estry metylowe podstawionych kwasów benzoesowych, technologia chemiczna, chemia organiczna 2003,2004
ZWIĄZKI NATURALNE, technologia chemiczna, chemia organiczna 2003,2004
I POPRAWKA EGZAMINU Z CHEMII ORGANICZNEJ, Technologia chemiczna, Chemia organiczna, 4 semestr, organ
dyd tech405a, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
dyd tech412, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna
organiczna-koła, Technologia chemiczna, Chemia organiczna, 3 semestr, 1 kolokwium
dyd k3a r, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna -
Labolatoria (semestr III), Technologia chemiczna, Chemia organiczna, 4 semestr, ćwiczenia
dyd tech409 12a, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organi
dyd tech407a, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
dyd tech407b, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
pytania organiczna 1 termin 2011 sem 4, technologia chemiczna, chemia organiczna2010-2011, sem 4
dyd e2b, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna - w
dyd tech404b, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
Egz pierwszy, Technologia chemiczna, Chemia organiczna, 3 semestr, egzaminy
dyd tech406b, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
dyd tech413, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna
więcej podobnych podstron