Analiza ilościowa redoksymetryczna
Jest to grupa metod analizy objętościowej, wykorzystująca reakcje red-ox. Dzielimy je w zależności od zastosowanego titranta.
|
Nadmanganometria (manganometria)
Titrantem jest mianowany roztwór KMnO4. Jego miano nastawiamy zwykle na trójtlenek arsenu As2O3, czyste żelazo, szczawian sodowy (COONa)2 lub kwas szczawiowy (COOH)2. Można w ten sposób oznaczać m.in. żelazo, H2O2, wapń (pośrednio), mangan i chrom.
Manganometryczne oznaczanie żelaza
Próbkę należy najpierw zredukować do Fe+2 za pomocą kolumny Jonesa (amalgamowanym cynkiem) lub SnCl2 (w środowisku HCl). Nadmiar reduktora usuwamy utleniając cynę do Sn+4 za pomocą HgCl2. Przed rozpoczęciem miareczkowania trzeba dodać tzw. mieszaniny Reinharda-Zimmermanna (R-Z), aby zapobiec utlenianiu chlorków do Cl2.
Manganometryczne oznaczanie wapnia
Wapń strącamy w postaci szczawianu, który rozpuszcza się w H2SO4 i miareczkuje, utleniając jony szczawianowe do CO2.
Cerometria
Titrantem jest roztwór soli Ce+4 (zwykle siarczan).
Ce+4 jest jednym z najsilniejszych utleniaczy (E0=+1.44 V w środowisku 0.5 M H2SO4). Miano nastawia się na te same substancje, co w wypadku nadmanganianu. Oznaczać można niemal wszystkie reduktory. Środowisko reakcji musi być kwaśne, żeby zapobiec hydrolizie z wydzieleniem zasadowego siarczanu ceru.
Cerometryczne oznaczanie azotynów
Azotyny są w roztworze nietrwałe, zatem stosujemy oznaczenie odwrotne. Do próbki dodaje się znaną objętość mianowanego roztworu soli Ce+4, którego nadmiar odmiareczkowuje się mianowanym roztworem siarczanu żelazawo-amonowego (soli Mohra). Wskaźnik: ferroina (w PK pojawia się czerwone zabarwienie).
Chromianometria
Titrantem jest mianowany roztwór dwuchromianu potasowego. Środowisko kwaśne, stosuje się wskaźniki red-ox, bowiem barwa samego dwuchromianu jest zbyt słaba. Oznaczamy te same substancje co manganometrycznie.
Chromianometryczne oznaczanie żelaza prowadzi się tak samo, jak manganometrycznie. Nie trzeba dodawać mieszaniny R-Z, a tylko nieco H3PO4 pod koniec miareczkowania. Wskaźnik: difenyloamina+H2SO4.
Bromianometria
Titrantem jest roztwór KBrO3, którego miano, jeśli trzeba, nastawiamy jodometrycznie lub na As2O3 (ale KBrO3 jest substancją podstawową). Wskaźnikiem jest np. oranż metylowy - wskaźnik specyficzny, nieodwracalny - który odbarwia się wskutek reakcji nadmiaru BrO3- z jonami bromkowymi.
Bromianometryczne oznaczanie antymonu i arsenu
Przeprowadza się w środowisku 2-4 M HCl. Jest to właściwie utlenianie antymonianów(III) lub arsenianów(III) do antymonianów(V) lub arsenianów(V).
Bromianometryczne oznaczanie fenolu
Próbkę zawierającą jony bromkowe zadajemy nadmiarem mianowanego roztworu bromianu w środowisku HCl. Wydzielający się brom bromuje fenol
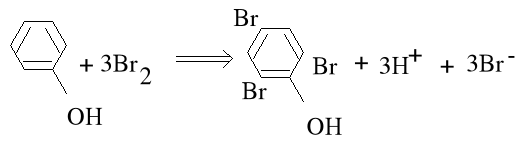
a nadmiar bromu reaguje z dodanym jodkiem : Br2 + 2I- I2 + 2Br-
dając równoważną ilość jodu, który odmiareczkowujemy mianowanym roztworem tiosiarczanu wobec skrobi. Produkt reakcji bromowania, trójbromofenol, strąca się w postaci żółtego osadu.
Jodometria
Jest to szeroko stosowany dział redoksymetrii. Titrantem jest albo roztwór I2 w wodnym roztworze KI (jodymetria) albo roztwór tiosiarczanu sodowego. Jod jest substancją podstawową, zaś miano S2O3-2 można nastawić na I2, KIO3, K2Cr2O7 i inne utleniacze.
Jodometryczne oznaczanie miedzi
W środowisku słabo kwaśnym jony jodkowe redukują Cu+2 do Cu+, przy czym wydziela się jod. Ten ostatni mozna oznaczyć tiosiarczanem. Istotna jest tu bardzo słaba rozpuszczalność CuI, co podwyższa potencjał utleniający miedzi(II) (E0Cu+2/Cu+=+0.17 V, E0I2/2I-=+0.54 V).
Wskażnikiem jest skrobia.
Tytanometria
Sole tytanu(III) są silnymi reduktorami, więc można ich używać do oznaczania utleniaczy. Reakcja redukcji jonami Ti+3 jest następująca:
Ti+3 + H2O TiO+2 + 2H+ + e-
Tytanometria ma szczególne znaczenie w analizie organicznych związków azotu (związki nitrowe, nitrozowe i azowe). Nadaje się też do oznaczania Fe+3, azotanów i nadchloranów.
Jest to metoda trudna (tlen powietrza łatwo utlenia Ti+3). Środowisko: rozcieńczony HCl.
Titrant można przygotować z komercyjnie dostępnego 15% roztworu TiCl3.
Regułą jest miareczkowanie odwrotne i odmiareczkowywanie nadmiaru Ti+3 mianowanym roztworem Fe+3 wobec jonów rodankowych.
J.Gliński, wykład 16, p. 2
Wyszukiwarka
Podobne podstrony:
pytania na kolokwium z redoksów, chemia analityczna
, chemia analityczna L, redoksy Nieznany
redoksymetria zadania, studia, ochrona środowiska UJ, chemia analityczna, wyrównawcze
Alkacy redoksy, 08. MEDYCYNA, 1.Analityka medyczna, I rok, Chemia analityczna, 1.Alkacymetria
potencjał redoks-zadania, chemia analityczna
redoksymetria, studia, ochrona środowiska UJ, chemia analityczna, wyrównawcze
Redoksymetria, farmacja I i II, chemia analityczna, ćwiczenia i seminaria
Chemia Analityczna redoksometria (zagadnienia)
Redoksymetria(1), 08. MEDYCYNA, 1.Analityka medyczna, I rok, Chemia analityczna, 7.Redoksymetria
Zadanie 4 CHEMIA ANALITYCZNA
Chemia analityczna kolos
CHEMIA ANALITYCZNA 2 TEST poprawione przez G M
analiza wody sprawozdanie chemia analityczna analiza wody teoria
chemia analityczna wyklad 11 i 12
kationy IIIgr(1), Farmacja, Farmacja, - Chemia Analityczna
Notatki chemia analityczna
chemia analityczna wyklad 02
więcej podobnych podstron