IV. TLENOWCE
Właściwości ogólne
główny stopień utlenienia -2 (H2O, H2S),
tlen poza -2 st. utlenienia występuje też na -1 (H2O2) i na +2 (OF2),
pozostałe tlenowce występują na stopniach utlenienia: +2, +4, + 6,
trwałość stopni utlenienia +4 i +6 wzrasta ze wzrostem masy atomowej tlenowca.
≤ 242 nm
metoda odkrywkowa
Struktura cząsteczek tlenu i siarki - Alotropia
|
tlen |
siarka |
selen |
tellur |
polon |
Elektroujemność wg skali Allreda-Rochowa
|
3,50
|
2,44 |
2,48 |
2,01 |
1,76 |
stan skupienia |
gaz |
ciała stałe |
|||
metaliczność |
niemetale |
półmetale |
metal |
||
elektrony walencyjne |
s2p4 |
||||
Stopnie utlenienia:
Tlenki - przeważają wiązania jonowe.
Siarczki, selenki i tellurki - do 50% wiązania jonowego.
2. Występowanie w przyrodzie
Tlen litosfera 46% mas.
hydrosfera 89% mas.
atmosfera 23% mas.
Tlen w stanie wolnym występuje w postaci: O, O2 i O3
związki chemiczne, minerały → woda, krzemiany, dwutlenek krzemu (krzemionka), minerały (sole) tlenowe.
DZIURA OZONOWA
Ozon występuje w atmosferze nad powierzchnią Ziemi w stężeniach 15-40 ppb. Jego zawartość wzrosła do 100 ppb i więcej - zanieczyszczenia wtórne. Powstaje np. w smogu.
Jak zmienia się zawartość ozonu w atmosferze?
Ozon w stratosferze
Halley Bay Halley Bay
(Antarktyda)
w DU :
X.60 - 300
X.80 - 230
X.85 - 150
X.92 - 111
X.99 - 102
DU= Dopson
Unit
Jaką rolę odgrywa ozon w stratosferze (20 - 30 km nad powierzchnią Ziemi)?
Zawartość ozonu w tej warstwie chroni powierzchnię Ziemi od nadmiernego promieniowania ultrafioletowego, tj. o dł. < 290 nm.
Powstawanie ozonu:
UV
O2 2O
O2 + O + M → O3 + M*
M - cząsteczka neutralna przejmująca nadmiar energii
Rozpadu ozonu:
UV
O3 O2 + O
λ= 240 - 320 nm
Jest to tzw. model Chapmana powstawania i rozpadu ozonu.
W rezultacie ustala się pewna równowaga pomiędzy procesami tworzenia ozonu a jego rozpadu.
Ozon pochłania promieniowanie UV. Brak lub zmniejszenie zawartości ozonu w stratosferze grozi poważnymi skutkami tak dla człowieka, zwierząt, jak i roślin.
Dlaczego zawartość ozonu maleje?
Fluorowcopochodne metanu jak np. CCl3F, CCl2F2 (freony) zmniejszają zawartość ozonu:
CCl3F → CCl2F + Cl
O3 + Cl → ClO + O2
Również tlenki azotu reagują z ozonem:
O3 + NO → NO2 + O2
Siarka
Zawartość w skorupie ziemskiej 0,026% mas. (16-te miejsce). W stanie wolnym występuje w USA, Rosji, Sycylii, Polsce (Tarnobrzeg).
Minerały siarki: FeS piryt
ZnS blenda cynkowa
PbS galena ołowiowa
CaSO4 ⋅2H2O gips
CaSO4 anhydryt
BaSO4 baryt
Selen i tellur: zawartość w skorupie ziemskiej wynosi odpowiednio: 5 ⋅ 10-6 i 1 ⋅ 10-7 %
Towarzyszą minerałom siarczkowym.
Polon - naturalny pierwiastek promieniotwórczy - występuje w rudach uranowych. (Patrz szeregi promieniotwórcze, Wykład Chemia Ogólna).
3. Otrzymywanie tlenu i siarki
Tlen
a) Elektroliza roztworów wodnych zasad i soli:
ANODA: 2OH- = H2O + 1/2O2 + 2e
b) frakcjonowana destylacja skroplonego powietrza
Efekt Jule'a - Thomsona - rozprężanie gazu powoduje jego silne oziębienie Wyjątek: wodór i hel ⇒ gazy hiperidealne |
Temperatury skraplania:
N2 = 77 K He = 4 K
c) Rozkład związków zawierających tlen:
HgO = Hg + 1/2O2
KClO3 = KCl + 3/2O2
2MnO4- + 6H+ + 5H2O2 = 2Mn2+ + 8H2O + 5O2
Są to metody laboratoryjne otrzymywania tlenu.
S
iarka
- Tarnobrzeg
b) metoda Frascha -
wytapianie siarki
przegrzaną parą wodną
c) metoda Clausa
H2S + 1/2O2 = H2O + S
d) metoda laboratoryjna
S2O32- + 2H+ = S + SO2 + H2O
|
|
tlen atomowy |
O |
|
|
tlen cząsteczkowy |
O2 |
|
|
ozon |
O3 |
Wiązania w cząsteczkach O2 i O3 ⇒ patrz teoria orbitali molekularnych (Wykład Chemia Ogólna).
Przemiany tlenu:
O2 ⇔ 2O ΔHo = +490 kJ/mol
Reakcja endotermiczna → rozkład w wysokich temperaturach:
3000 K α = 6%
3O2 ⇔ 2O3 ΔHo = +285 kJ/mol
Reakcja endotermiczna - w normalnych warunkach ozon jest nietrwały.
SIARKA w temperaturze pokojowej występuje jako siarka rombowa - złożona z cząsteczek o kształcie ośmiokąta → siarka α
- po podgrzaniu do 368,8 K przechodzi w siarkę jednoskośną → siarka β
Siarka α i β to dwie odmiany alotropowe tego pierwiastka.
Również tlen jest przykładem pierwiastka, który wykazuje alotropię (tlen (O), tlen cząsteczkowy (O2) i ozon (O3)).
5. Związki tlenowców z wodorem - wodorki
H2O |
H2S |
H2Se |
H2Te |
H2Po |
woda |
siarko - |
seleno - |
telluro - |
polono- |
|
w o d ó r |
|||
- AN |
sulfan |
selan |
tellan |
polonan |
Budowa cząsteczek H2X:
α
X O 109o
Hybry- α S 92o
dyzacja Se 91o
typu sp3 H H Te 89o
Budowa cząsteczek H2X w świetle teorii OM
H2(g) + 1/2O2(g) = H2O(g) ΔHo = -286 kJ/mol
H2(g) + S(s) = H2S(g) -21
H2(g) + Se(s) = H2Se(g) +86
H2(g) + Te(s) = H2Te(g) +154
H2O H2S H2Se H2Te
wzrost trwałości
W roztworach wodnych wodorki są słabymi kwasami:
H2O H2S H2Se H2Te
pKa1 14,0 7,0 3,7 2,6
pKa2 - 14,0 11,0 11,0
SOLE WODORKÓW
tlenki siarczki selenki tellurki
wzrost charakteru jonowego
Siarczki Przykłady siarczków:
Ag2S - siarczek srebra(I)
Me2IS MeIHS MgS - siarczek magnezu
Siarczki wodoro- Bi2S3 - siarczek bizmutu(III)
siarczki NaHS - wodorosiarczek sodu
Ca(HS)2 - wodorosiarczek wapnia
H2S ⇔ H+ + HS- (Ka1)
HS- ⇔ H+ + S2- (Ka2)
Silna hydroliza anionów siarczkowych: S2- + H2O = HS- + OH-
Większość siarczków jest bardzo trudno rozpuszczalna w wodzie,
np: PbS, HgS, CuS, ZnS
6. Wodorki typu H2Xn n > 1
Nadtlenek wodoru, H2O2
Wielosiarczki (polisulfany) S2- + (n - 1)S = Sn2-
7. Połączenia z tlenem
stopień utlenienia |
+2 |
+4 |
+6 |
Siarka Selen Tellur |
SO - TeO |
SO2 SeO2 TeO2 |
SO3 SeO3 TeO3 |
a) SO2 - ditlenek siarki (dwutlenek siarki)
Metody otrzymywania:
1o S + O2 = SO2
2o 2FeS2 + 11/2O2 = Fe2O3 + 4SO2
3o 2CaSO4 + C = 2CaO + 2SO2 + CO2
4o HSO3- + H+ = SO2 + H2O
5o Cu + SO42- + 4H+ = Cu2+ + SO2 + 2H2O
1o - 3o Metody przemysłowe
4o - 5o Metody laboratoryjne
b) SO3 - tritlenek siarki (trójtlenek siarki)
2SO2(g) + O2(g) = 2SO3(g) ΔHo = -96 kJ/mol
Od jakich czynników zależy wydajność i szybkość tej reakcji ?
|
Szybkość |
Wydajność |
1. Temperatura |
+ |
- |
2. Ciśnienie |
+ |
+ |
3. Nadmiar substratu (tlenu) |
+ |
+ |
4. Katalizator |
+ |
0 |
Optymalne warunki syntezy SO3 :
- optymalna temperatura (650-850 K),
- wysokie ciśnienie,
- nadmiar jednego z substratów, np. tlenu,
- obecność katalizatora (Pt, V2O5).
Metoda laboratoryjna otrzymywania SO3 to rozkład termiczny disiarczanu potasu: K2S2O7 = K2SO4 + SO3
c) Budowa cząsteczki SO2 - taka sama jak cząsteczki O3
Hybrydyzacja typu - sp2 ⇒ orbitale s, px, py atomu tlenu lub siarki (2)
O S
122o 119o
O O O O
(1) (3) (1) (3)
ozon dwutlenek siarki
- 2 zlokalizowane wiązania typu sigma (σ)
- zdelokalizowane trójcentrowe wiązania typu pi (π):
wiążące (πdel) , niewiążące (π0del) i antywiążące ![]()
)
O3: KKK (2s1)2 (2s3)2 (2py,1)2 (2py,3)2 (t2)2 (σ1,2)2 (σ2,3)2 (πdel)2 (πdel o )2
SO2: KLK (2s1)2 (2s3)2 (2py,1)2 (2py,3)2 (t2)2 (σ1,2)2 (σ2,3)2 (πdel)2 (πdel o )2
K = 1 s2 L = 1s2 2s2 2p6
Struktury elektronowej cząsteczki SO2 nie można przedstawić pojedynczym wzorem Lewisa. Można to przedstawić jedynie za pomocą dwóch wzorów mezomerycznych:
S S
:O: :O: :O: :O:
W ten sposób podkreśla się, że wiązanie S - O ma charakter pośredni pomiędzy wiązaniem pojedynczym a podwójnym - rzędowość tego wiązania wynosi 1,5.
d) Budowa cząsteczki SO3
O (1) Centralny atom siarki posiada hybrydyzację S typu sp2 - kąt 120o
O O
|
t1, t2, t3 |
|
|
|
||
|
|
|
|
|
||
S : |
3s 3px 3py |
3pz |
|
|
||
O (1) : |
2s |
2px |
2py |
2pz |
= |
|
O (2) : |
2s |
2px |
2py |
2pz |
|
4 zdelokalizowane wiązania typu π |
O (3) : |
2s |
2px |
2py |
2pz |
|
(czterocentrowe) |
|
= σ1, σ2, σ3 |
|
|
|
||
SO3 : 24 elektrony walencyjne (6 x 4) ⇒
LKKK (2s1)2 (2s2)2 (2s3)2 (2py1)2 (2py2)2 (2py3)2 (σ1)2 (σ2)2 (σ3)2
![]()
Uwaga: K = 1s2 L = 1s2 2s2 2p6
e) Kwaśny deszcz (Acid Rain)
Główną przyczyną kwaśnego deszczu (pH ≤ 5,5) jest dwutlenek siarki
SO2 + H2O = H2SO3
H2SO3 = H+ + HSO3-
pKa1 = 1,62
Naturalny deszcz ma pH ≈ 5,6
pKa1 = 6,35
Opad siarki [ton/km2/miesiąc] Zawartość siarki w igłach sosny
f) Tlenowe kwasy siarki
Znanych jest 10 tlenowych kwasów siarki. Ale tylko niektóre są znane w stanie czystym. Najważniejsze to :
H2O + SO2 = H2SO3 kwas siarkawy
= kwas siarkowy(IV)
H2O + SO3 = H2SO4 kwas siarkowy
= kwas siarkowy(VI)
H2SO4 + SO3 = H2S2O7 kwas dwusiarkowy
(H2S) + (SO3) = (H2S2O3) kwas tiosiarkowy
(H2O2) + (SO3) = (H2SO5) kwas nadtlenojednosiarkowy
kwas peroksosiarkowy
(H2SO5) + (SO3) = (H2S2O8) kwas nadtlenodwusiarkowy
kwas peroksodwusiarkowy
Uwaga:
Reakcje z udziałem reagentów podane w nawiasach nie zachodzą! Pokazano w ten sposób jedynie "pochodzenie" tych kwasów.
Również H2S2O3 nie istnieje, a jedynie jego sole.
Stopnie utlenienia siarki w tych kwasach:
H2SO3 + 4 st. utlenienia
H2S2O3 + 2 st. utlenienia (formalny) - faktyczne - 2 i +6
Pozostałe kwasy: +6 st. utlenienia
Wzory elektronowe wybranych kwasów tlenowych siarki
H2SO3 |
O
H - O - S - O - H
|
H2SO4 |
H - O - S - O - H
O
|
H2S2O3 |
O
H - O - S - O - H
S
|
H2S2O7 |
O O
H - O - S - O - S - O - H
O O
|
H2SO5 |
O
H - O - O - S - O - H
O
|
H2S2O8 |
O O
H - O - S - O - O - S - O - H
O O |
g) Sole tlenowych kwasów siarki
Me2ISO3 siarczyny (obojętne) = siarczany(IV)
H2SO3
MeIHSO3 wodorosiarczyny (kwaśne siarczyny)
Me2ISO4 siarczany = siarczany(VI)
H2SO4
MeIHSO4 wodorosiarczany (kwaśne siarczany)
H2S2O3 → Me2IS2O3 tiosiarczany
H2S2O8 → Me2IS2O8 nadtlenodwusiarczany
h) Kwas siarkowy
H2SO4 to bardzo mocny kwas (ze względu na pierwszy stopień dysocjacji):
H2SO4 → H+ + HSO4- pKa1 ≈ -3
Średnio mocny ze względu na drugi stopień dysocjacji:
HSO4- ⇔ H+ + SO42- pKa2 = 1,99
Jakie są stopnie dysocjacji kwasu siarkowego?
Dla ≈ 1 M H2SO4 α1 ≈ 100 %, α2 = 1 %
Stężony H2SO4 d = 1,84 kg/dm3 ⇒ 96-98% H2SO4
Rozcieńczanie kwasu (kwasów) →
reakcja silnie egzotermiczna →
wydziela się duża ilość ciepła
Jak rozcieńczać dowolny kwas?
Cienkim strumieniem wlewać stężony kwas do wody przy jednoczesnym mieszaniu
Pamiętaj Chemiku młody - wlewaj zawsze kwas (powoli) do wody! |
Otrzymywanie kwasu siarkowego:
1) Otrzymywanie SO2 z siarczków, siarki lub siarczanu wapnia
2) Utlenianie SO2 do SO3
3) Oczyszczanie SO3 od pyłów (elektrofiltry)
4) Rozpuszczanie w stężonym H2SO4
H2SO4 + SO3 = H2S2O7 (OLEUM)
5) Rozcieńczanie oleum wodą
H2S2O7 + H2O = 2H2SO4
8. Związki siarki z fluorowcami oraz związki tlenohalogenkowe
st. utl.: |
+2 |
+4 |
+6 |
|
SF2 |
SF4 SCl4 |
SF6 |
|
|
SOF2 SOCl2 |
SO2F2 SO2Cl2 |
1o SO2+ ⇒ grupa tionylowa
np. SOCl2 - chlorek tionylu
2o SO22+ ⇒ grupa sulfurylowa
np. SO2Cl2 - chlorek sulfurylu
3o HSO3Cl - kwas chlorosulfonowy
SO3 + HCl = HSO3Cl
9. Tlenowe połączenia selenu i telluru
a) Tlenki
+4 st. utlenienia:
SeO2, TeO2 - właściwości amfoteryczne z przewagą kwasowych
+6 st. utlenienia:
SeO3, TeO3 - właściwości kwasowe
b) Kwasy
+4 st. utlenienia:
H2SeO3 - kwas selenawy (selenowy(IV))
SeO2 + H2O = H2SeO3
M2 ISeO3 - obojętne seleniny
MIHSeO3 - wodoroseleniny
H2TeO3 - kwas tellurowy znany jest tylko w postaci soli, tj.
tellurynów, np. Na2TeO3
+6 st. utlenienia:
H2SeO4 - kwas selenowy
H2Se2O7 - kwas dwuselenowy
H6TeO6 - kwas ortotellurowy Koniec rozdz. IV
Władysław Walkowiak Wykład - Chemia Nieorganiczna
1/27
ChN_Wykład 4_IV. Tlenowce
średnio
w skorupie ziemskiej 50%
}
Wysokość (km)
Równanie stanu dla gazów „rzeczywistych” van der Waalsa
60 |
|
|
|
|
|
50 |
|
|
|
|
|
40 |
|
|
|
|
|
30 |
|
|
|
|
|
20 |
|
|
|
|
|
10 |
|
|
|
|
|
0 |
|
|
|
|
|
1010 1011 1012 |
|||||
O2 = 90 K
Liczba cząsteczek O3 w 1 cm3
(2)
O
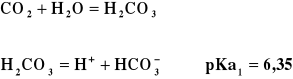
(3)
(2)
(2)
<150%
150-200%
200-250%
> 250% poziomu normalnego
• •
• •
• •
• •
• •
• •
• •
• •
Wyszukiwarka
Podobne podstrony:
Wykład 5 Azotowce CHC13005w, IV. AZOTOWCE - ChN II
Ekonomika ochrony srodowiska wyklad 18.04.05, administracja, II ROK, III Semestr, rok II, sem IV, Ek
ZAGADNIENIA NA EGZAMIN Z MECHANIKI TECHNICZNEJ II DLA SEMESTRU III, sem III, +Mechanika Techniczna I
Prawo ochrony srodowiska Wyklad 06, administracja, II ROK, III Semestr, rok II, se
Postepowanie administracyjne W 18.05, administracja, II ROK, III Semestr, rok II, sem IV, postępowan
Ekonomika Ochrony Srodowiska wyklad 28.02.05, administracja, II ROK, III Semestr, rok II, sem IV, Ek
Ekonomika srodowiska wyklad 07.03.05, administracja, II ROK, III Semestr, rok II, sem IV, Ekonomika
Ekonomika ochrony srodowiska WYKLAD14.03.05, administracja, II ROK, III Semestr, rok I
Kolokwium wykładowe kinematyka, Studia, Sem 3, III, III Semestr, Mechanika II
teoria by Godles, sem III, +Mechanika Techniczna II - Wykład.Ćwiczenia.Laboratorium
Prawo cywilne wykład 1, administracja, II ROK, III Semestr, rok II, sem III, Prawo cywilne, PC W
VIII - ORD - wykłady, studia budownictwo, organizacja ruchu drogowego I, II, III
Tlumienie dynamiczne w ukladach sprezystych, sem III, +Mechanika Techniczna II - Wykład.Ćwiczenia.La
Postępowanie administracyjne W 30, administracja, II ROK, III Semestr, rok II, sem IV, postępowanie
Prawo finansowe wyklad18.04, administracja, II ROK, III Semestr, rok II, sem IV, prawo finansowe
Postępowanie administracyjne w I 23, administracja, II ROK, III Semestr, rok II, sem IV, postępowani
Stat[1][1].DEMOG.-Wyklad III, SZKOŁA, semestr II, GWSH Statystyka
więcej podobnych podstron