Kolokwium nr 1
1. Przestrzennie narysować tripeptyd Ala-His-Cys
2.Aminokwasy proteinogenne
Są to aminokwasy budujące białka.
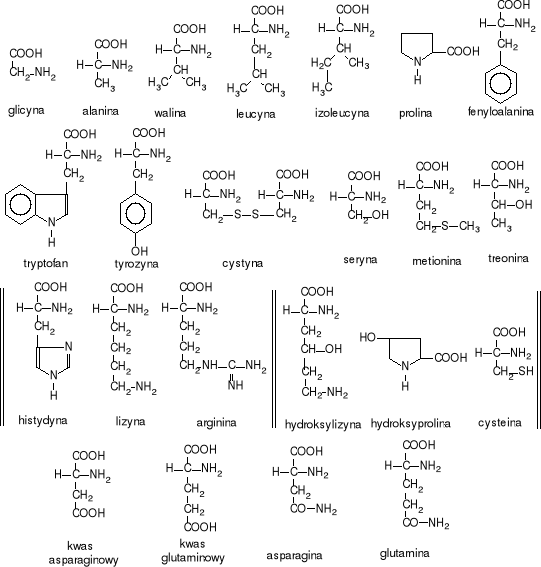
Komórka w procesie biosyntezy białek wykorzystuje 20 różnych aminokwasów (kodowanych w DNA). Poniżej podano ich wzory, a także wzory cystyny, hydroksylizyny i hydroksyproliny, które także są składnikami wielu białek, a nie posiadają kodu genetycznego.
Aminokwasy proteinogenne (spotykane w białkach)
3.Denaturacja białek
Denaturacja. Część białek natywnych należy do grupy związków bardzo delikatnych. Pod wpływem wielu czynników zarówno fizycznych, jak i chemicznych, np. wysokiej temperatury, znacznych zmian pH, promieni ultrafioletowych, rozpuszczalników organicznych itp., struktura białek ulega trudno odwracalnym lub całkowicie nieodwracalnym zmianom połączonym z utratą natywnych właściwości biologicznych (m.in. białka będące enzymami tracą swoje właściwości katalityczne). Proces ten nazywa się denaturacją.
Denaturację białka można więc zdefiniować jako utratę natywnych właściwości biologicznych lub innej indywidualnej cechy charakterystycznej tego białka spowodowaną zniszczeniem jego struktury wtórnej (przy zachowaniu struktury pierwszorzędowej). W wyniku denaturacji białka mogą wystąpić zmiany rozpuszczalności i przesunięcie punktu izoelektrycznego. Rozwinięcie łańcucha peptydowego może prowadzić do wzrostu lepkości, a także zmian absorpcji w nadfiolecie. Obserwuje się również często procesy agregacji i wytrącania, co jest związane ze zmianami stopnia hydratacji i rozpuszczalności zdenaturowanych białek
Ogólnie biorąc, mechanizm denaturacji związany jest ze zniesieniem oddziaływań czynników strukturotwórczych, które odpowiedzialne są za stabilizację struktury przestrzennej cząsteczki białka. Podczas denaturacji rozrywane mogą być wiązania wodorowe, jonowe, disulfidowe oraz niszczone oddziaływania elektrostatyczne van der Waalsa. I tak:
działanie podwyższonej temperatury doprowadza do zerwania wiązań wodorowych oraz zniesienia oddziaływań van der Waalsa, co w konsekwencji skutkuje zniszczeniem strukturII-,III- i IV-rzędowej białka,
pod wpływem roztworu mocznika (6-8 mol/dm3) lub chlorku guanidyny (4 mol/dm3 ) i innych związków chemicznych silnie polarnych zerwaniu ulegają wiązania wodorowe,
jony metali ciężkich (Hg2+, Pb2+, Cu2+, itp.) powodują zerwanie mostków disiarczkowych, a ponadto częściowo wiązań jonowych, co w niektórych przypadkach może prowadzić do wbudowania się tych jonów w cząsteczkę białka,
na skutek działania kwasów lub zasad (wartość pH poniżej 3 lub powyżej 9) zerwaniu ulegają wiązania jonowe i w pewnym stopniu wodorowe, co przede wszystkim skutkuje zniszczeniem III-rzędowej struktury białka,
promieniowanie (nadfioletowe, rentgenowskie i radioaktywne) w skrajnych przypadkach może nawet prowadzić do rozrywania wiązań kowalencyjnych,
innymi czynnikami mogącymi wywoływać denaturację białek są: intensywne mieszanie, wytrząsanie lub działanie ultradźwiękami.
4.Budowa białek globularnych
Omawiane poprzednio białka fibrylarne stanowią agregaty wielocząsteczkowe o uporządkowanej budowie. W przeciwieństwie do nich białka globularne w stanie naturalnym to pojedyncze, niezależne od siebie cząsteczki, przypominające „kłębuszki poplątanej wełny”. Łańcuch polipeptydowy białek globularnych jest z reguły nieregularne poskręcany i pofałdowany. Brak w strukturze trzeciorzędowej tych białek wyraźnej regularności i uporządkowania. Na rysunku przedstawiono schematyczny model cząsteczki białka globularnego. Wewnątrz „kłębuszka” znajduje się strefa hydrofobowa, a na zewnątrz strefa hydrofilowa, co decydująco wpływa na właściwości tych białek.
W białkach globularnych występują jedynie dwa typy struktur drugorzędowych: α-helisa i β-fałdowa. W wielu białkach globularnych fragmenty łańcucha polipeptydowego o strukturze α-helisy są poprzedzielane strukturą β-fałdową. Ponadto obie te struktury mogą oddziaływać pomiędzy sobą tworząc bardziej złożone struktury „ponad” drugorzędowe zwane motywami. Motywy strukturalne, powstają wskutek asocjacji α-helisy lub struktury β-fałdowej. Powszechnie występującym motywem β, czyli powstałym jedynie na bazie struktury β-fałdowej jest motyw „szpilki do włosów”. Ten motyw zbudowany jest z jednego łańcucha polipeptydowego, przyjmującego antyrównoległą strukturę typu harmonijki. Innym przykładem bardziej złożonej struktury opierającej się na strukturze β-fałdowej jest motyw „klucza greckiego”. Jest to bardziej rozbudowany motyw „szpilki do włosów”, gdzie jeden łańcuch polipeptydowy tworzy ze sobą cztery struktury β-fałdowe ułożone względem siebie antyrównoległe. Struktura α-helisy podobnie jak harmonijkowa tworzy własne motywy strukturalne. Najczęściej jest to motyw „helisa-pętla-helisa". Innym przykładem motywów α, są struktury tzw. „suwaków leucynowych”, zbudowanych z dwóch oplecionych ze sobą α-helis, bogatych w leucynę. Oprócz motywów β lub α, występują struktury mieszane typu α / β. Za przykład może posłużyć motyw βαβ, w którym pomiędzy dwoma ułożonymi równolegle łańcuchami struktury β-fałdowej znajduje się α-helisa. Hydrofobowa strona łańcuchów β jest ciasno upakowana i kontaktuje się z hydrofobową stroną α-helisy.
5.Wpływ pH i stężenia soli na białka (rozpuszczalność)
Wpływ pH i stężenia elektrolitu na rozpuszczalność białek globularnych. Ze względu na rozpuszczalność w wodzie białka globularne dzieli się na dwie grupy:
albuminy - rozpuszczalne w wodzie,
globuliny - rozpuszczalne w rozcieńczonych elektrolitach (np. w 0,1-1%-owych roztworach NaCl).
Białka najmniejszą rozpuszczalność posiadają w punkcie izoelektrycznym. Im pH roztworu jest bardziej oddalone od pI białka, tym lepsza jest jego rozpuszczalność. Zjawisko to można wyjaśnić następująco. W roztworach o pH różnym od pI cząsteczki białka posiadają ładunek (dodatni lub ujemny). Dwa ładunki jednoimienne odpychają się (m.in. tym silniej im większy jest ten ładunek). Nic więc dziwnego, że naładowane cząsteczki białka też się odpychają, co ułatwia ich hydratację i w efekcie zwiększa rozpuszczalność. Podobnie podczas wysalania (o czym będzie mowa poniżej) jednoimiennie naładowane cząsteczki białka znacznie trudniej ulegają agregacji i trudniej wytrącić je w postaci osadu.
Wpływ pH i stężenia elektrolitu na rozpuszczalność modelowego białek globularnych o pI = 6
6.Budowa nukleotydu
Kwasy nukleinowe stanowią około 1% składu organizmu. Są to wielkocząsteczkowe biopolimery (polinukleotydy). Elementami składowymi, czyli monomerami są nukleotydy. Z punktu widzenia chemicznego nukleotydy są estrami nukleozydów i kwas fosforowego. Zbudowane są z trzech podstawowych składników:
zasady azotowej - pirymidynowej lub purynowej,
pentozy, którą najczęściej jest D-ryboza lub 2-deoksy-D-ryboza,
reszty kwasu fosforowego.
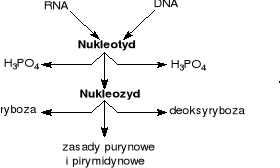
Rybonukleotydy zawierają rybozę, a deoksyrybonukleotydy zawierają deoksyrybozę. Większość nukleotydów kwas fosforowy ma przyłączony wiązaniem estrowym w pozycji 5' pentozy.
Mononukleotydy są estrami kwasu fosforowego i nukleozydów. Fosforan zastępuje najczęściej grupę -OH przy piątym atomie węgla (C5') rybozy lub deoksyrybozy. Wyłącznie takie nukleozydo-5'-fosforany są wykorzystywane w komórkach do biosyntezy kwasów nukleinowych. Ortofosforan może przyłączać się również przy trzecim atomie węgla (C3') rybozy lub deoksyrybozy. Tego typu naturalne nukleozydo-3'-fosforany są produktami rozpadu kwasów nukleinowych w organizmie.
Nazwy nukleotydów tworzy się od nazw nukleozydów, np. cytydyno-5'-monofosforan (skrót CMP lub w razie potrzeby 5'-CMP). Domyślnie przyjmuje się, że opuszczenie cyfry przed skrótem nazwy nukleotydu wskazuje na 5'-monofosforany. Ale adenozyno-3'-monofosforan ma skrót 3'-AMP. W pełnej nazwie nukleotydu zwyczajowo zamieszcza się cyfrę wskazującą na pozycję związanej grupy fosforanowej. Stosowane skróty trójliterowe nukleotydów wywodzą się od nazw angielskich (np. AMP to adenosine monophosphate). Potocznie o nukleotydach mówi się: nukleotyd adeninowy, nukleotyd cytozynowy, itp.
Nukleotydy adeninowe, guaninowe i cytozynowe istnieją zarówno w formie rybonukleotydów (odpowiednio AMP, GMP i CMP), jak i deoksyrybonukleotydów (odpowiednio dAMP, dGMP i dCMP).
Urydyno-5'-monofosforan (UMP) występuje wyłącznie w formie rybonukleotydu (w RNA). Z kolei tymidyno-5'-monofosforan występuje głównie w formie 2'-deoksyrybonukleotydu (dTMP w DNA) i wyjątkowo w formie fosforybotyminy (TMP) w cząsteczce tRNA. Fosforybotymina powstaje dopiero posttranskrypcyjnie w wyniku reakcji metylacji urydynomonofosforanu.
Nukleotyd wywodzący się od inozyny to inozyno-5'-monofosforan (IMP), będący nie tylko składnikiem kwasów rybonukleinowych, lecz także koenzymem.
W potocznym języku nukleotydy nazywane są kwasami. I tak, AMP to kwas adenylowy mięśniowy (znaleziono go, bowiem, w stanie wolnym w mięśniach), 3'-AMP to kwas adenylowy drożdżowy (uzyskano go z produktów hydrolizy RNA drożdżowego). Również pozostałe nukleotydy mają odpowiednie nazwy wywodzące się od kwasów, np. guanylowy, cytydylowy, urydylowy, itp.
Cykliczne nukleotydy
Cykliczny AMP (cAMP, czyli adenozyno-3',5'-monofosforan) jest wewnątrzkomórkowym wtórnym przekaźnikiem działania wielu hormonów. Powstaje z ATP w reakcji katalizowanej przez cyklazę adenylanową (EC 4.6.1.1.). Aktywność cyklazy adenylanowej jest regulowana przez skomplikowane oddziaływania wewnątrzkomórkowe, w których biorą udział receptory hormonów w błonie komórkowej. Hormon wydzielany do przestrzeni pozakomórkowej (np. adrenalina), oddziałując ze specyficznymi receptorami błonowymi stymuluje w komórce syntezę cAMP, poprzez aktywację cyklazy adenylanowej.
Stężenie cAMP w komórce reguluje wiele procesów metabolicznych. Proces transkrypcji mRNA kontrolowany jest stężeniem cAMP (porównaj: represja kataboliczna). cAMP aktywuje m.in. niespecyficzną serynowo/treoninową kinazę białek (porównaj: rozdział 4.2.7. - aktywacja fosforylazy b), co reguluje metabolizm komórki. cAMP odgrywa ponadto kluczową rolę w powstawaniu wrażeń węchowych.
Enzymatyczna hydroliza 3',5'-cAMP, katalizowana przez fosfodiesterazę 3',5'- cyklicznych-nukleotydów (EC 3.4.1.17) prowadzi do powstania 5'-nukleotydów. Enzym wykazuje szeroką specyficzność i działa również na inne 3',5'-cykliczne nukleotydy.
U drożdży i niektórych bakterii (np. Salmonella, Escherichia coli) w komórkach występuje również adenozyno-2',3'-monofosforan (dla odróżnienia od 3'5'-cAMP, który zapisuje się krótko - cAMP, ten drugi zawsze zapisuje się jako 2'3'-cAMP). Ponadto w komórkach występują inne cykliczne nukleotydy, np. cdAMP, cIMP, cGMP, cCMP. Te cykliczne nukleotydy działają wewnątrz komórki jako regulatory różnych procesów biochemicznych. Np. cykliczny cGMP jest pobudzającym informatorem w procesie widzenia. Powstaje pod działaniem cyklazy guanylanowej.
Di- i trifosforany nukleotydów
Mononukleotydy mogą do swojej 5'-reszty fosforanowej przyłączyć dodatkowo jedną lub dwie (niekiedy nawet więcej) cząsteczek kwasu fosforowego. Powstają wtedy di- lub trifosforany nukleotydów (np. adenozyno-5'-difosforan, czyli ADP lub adenozyno-5'-trifosforan, czyli ATP). Te nowo przyłączone reszty fosforanowe wiążą się z AMP wiązaniami wysokoenergetycznymi - szczegółowo tę problematykę omówiono w Rozdziale 4.2.2. - Koenzymy i grupy prostetyczne: Nukleozydofosforany.
ADP i ATP uczestniczą jako substrat i produkt w fosforylacjach oksydacyjnej i substratowych. ATP jest głównym wewnątrzkomórkowym źródłem wolnej energii.
GDP bierze udział w reakcji utleniania α-ketoglutaranu do sukcynylo~ScoA, w wyniku fosforylacji substratowej powstaje GTP. Jest on niezbędny do aktywacji cyklazy adenylanowej przez niektóre hormony (jest allosterycznym regulatorem). Ponadto dostarcza energii w syntezie białek na polisomach.
Pochodne nukleotydów
Nukleotydy są jednostkami budulcowymi całej grupy koenzymów (głównie AMP), m.in. koenzymu A (CoA-SH), kilku dinukleotydów (m.in. NAD, NADP, FAD, itp.). Szczegółowo ten aspekt wykorzystania AMP w komórce opisano w Rozdziale 3.2.2. - Koenzymy i grupy prostetyczne.
Pochodne uracylu, np. UDPG (UDP-glukoza) lub inny UDP-sacharyd biorą udział w biosyntezie di- i polisacharydów oraz w reakcjach epimeryzacji.
CTP w komórkach tkanek zwierzęcych jest wykorzystywany podczas biosyntezy niektórych fosfoglicerydów, a CDP-cholina uczestniczy w biosyntezie sfingozydów.
7.Represja kataboliczna
Mechanizm represji katabolicznej (zwany też "efektem glukozowym") umożliwia komórkom drobnoustrojowym zużywanie najpierw glukozy, a dopiero po jej zużyciu, laktozy. Na podobnych przesłankach oparty jest mechanizm blokowania syntezy enzymów biorących udział w katabolizmie wielu związków, w przypadku, gdy komórka posiada duży nadmiar energii zgromadzonej w postaci ATP lub innych trifosforanów nukleotydów.
Mechanizm represji katabolicznej polega na tym, że polimeraza RNA łączy się z promotorem znacznie efektywniej w obecności swoistego białka CAP (z ang. catabolite gene activator protein), 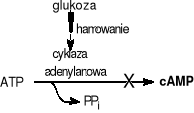
które musi być związane ze specyficznym miejscem operonu tzw. CBS (z ang. CAP binding site). Białko CAP wiąże się z tym miejscem tylko w formie kompleksu z cząsteczką cAMP. Jak już wcześniej opisano (rozdział 2.1.2. - cykliczne nukleotydy), cAMP powstaje z ATP pod działaniem cyklazy adenylanowej; enzym ten jest aktywowany niektórymi hormonami (np. adrenaliną), ale z kolei skutecznie hamowany glukozą.
Tak więc, jeżeli glukoza jest obecna w podłożu hodowlanym bakterii E.coli spada poziom cAMP, białko CAP zmienia kształt, nie wiąże się z CBS, polimeraza RNA słabiej wiąże się z promotorem i w konsekwencji biosynteza enzymów biorących udział w katabolizmie laktozy zostaje spowolniona.
Po wyczerpaniu glukozy z podłoża hodowlanego bakterii, wytwarzanie cAMP jest z powrotem przywrócone i jeżeli w podłożu jest obecna laktoza uruchomiona zostaje biosynteza enzymów odpowiedzialnych za jej katabolizm. Ponadto istnieje mechanizm, który skłania bakterie do gromadzenia cAMP w komórce, w przypadku braku łatwo przyswajalnego źródła węgla (np. glukozy, glicerolu, itp.).
Kolokwium nr 2
1. Specyficzność kierunkowa
Specyficzność kierunkowa. Określony enzym katalizuje na ogół jeden typ reakcji chemicznych (np. utlenienie, hydrolizę, syntezę, itp.). Dokonuje on niejako selekcji wśród możliwych reakcji, wybierając jedną z nich. Na przykład cząsteczka glukozo-6-fosforanu może w komórce ulec wielu różnym przemianom, w tym utlenieniu (do laktonu kwasu 6-fosfoglukonowego), izomeryzacji (do fruktozo-6-fosforanu) czy też mutarotacji (do glukozo-1-fosforanu).
Każda z tych reakcji jest katalizowana przez inny enzym: pierwszą katalizuje dehydrogenaza glukozo-6-fosforanu, drugą - izomeraza heksozofosforanowej, wreszcie trzecią - fosfoglukomutaza.
2. Koenzymy i grupy prostetyczne; kofaktory i ko substraty
Koenzymy to niskocząsteczkowe, niebiałkowe organiczne komponenty - często o nukleotydowej budowie, zawierające w swoim składzie witaminy lub ich pochodne - luźno związane z apoenzymem.
Przykładami koenzymów są: NAD i NADP - oba uczestniczą w transporcie elektronów i protonów, kwas foliowy - przenoszący grupy formylowe, metylowe lub metylenowe, koenzym A transportujący grupy acylowe lub S-adenozylometionina przenosząca grupę metylową.
Grupy prostetyczne to - w przeciwieństwie do koenzymów - silnie związane z apoenzymem (kowalencyjnie lub koordynacyjnie) specyficzne niebiałkowe składniki determinujące biochemiczną aktywność enzymów. Jak już wspomniano grupy prostetyczne występują zwykle w centrum aktywnym i są bezpośrednio zaangażowane w katalizę; podczas reakcji enzymatycznej nie opuszczają centrum aktywnego.
Grupy prostetyczne mogą mieć charakter zarówno organiczny (np. witaminy i ich pochodne, hem, kompleksy organiczne metali), jak i nieorganiczny (najczęściej jony metali).
Przykładem organicznych grup prostetycznych są związki flawinowe (FAD, FMN, itp.), hemowe, lipoamid czy molibdopteryna biorące udział w reakcjach redoks; fosforan pirydoksalu - biorący udział w transaminacji i deaminacji; biotyna - karboksylacja, itd. W przypadku organicznych grup prostetycznych, które są witaminami lub ich pochodnymi (m.in. FAD, FMN, lipoamid, biotyna, difosfotiamina, fosforan pirydoksalu i kobalamina) dopuszczalne jest nazywanie ich koenzymami.
Do nieorganicznych grup prostetycznych należą jony metali (Cu2+, Zn2+, Fe3+, itp.) - występujące w centrach aktywnych wielu enzymów; klastery żelazowo-siarkowe - występujące w białkach żelazowo-siarkowych, będących składnikami wielu enzymów oksydoredukcyjnych, w tym Kompleksów enzymatycznych.
Kofaktory reakcji enzymatycznych to związki organiczne, kompleksy organiczne metali lub jony (przeważnie jony metali), które są potrzebne enzymom do katalizowania konkretnych reakcji chemicznych (niezbędne dla osiągnięcia pełnej aktywności enzymu). Mogą nimi być koenzymy lub aktywatory enzymów (luźno związane z apoenzymem) lub grupy prostetyczne (silnie związane).
Koenzymy z reguły traktuje się jako kosubstraty reakcji enzymatycznych, ponieważ ulegają one zmianom chemicznym w trakcie działania enzymów (np. w trakcie działania dehydrogenaz sprzężonych z NAD, koenzym przyjmuje jon wodorkowy H- i ulega redukcji do NADH).
3.Centrum katalityczne enzymu
W czasie reakcji enzymatycznej cząsteczka substratu jest wiązana w określonym obszarze do cząsteczki enzymu w tzw. centrum aktywnym, przez co tworzy się kompleks enzym-substrat. Dzięki specyficznemu rozkładowi grup chemicznych w centrum, enzym oddziałuje na ugrupowania chemiczne substratu rozluźniając konkretne wiązanie chemiczne. W wyniku rozerwania tych wiązań substrat przekształca się w produkt, który uwalniany jest z kompleksu z enzymem. Enzym po powrocie do formy pierwotnej (w enzymach złożonych po przyłączeniu przenoszonych grup do innego związku) tworzy nowy kompleks z następną cząsteczką substratu itd.
Mechanizm łączenia enzymu z substratem tłumaczy się obecnie indukowanym dopasowaniem, polegającym na dopasowaniu kształtu enzymu do substratu i przekształceniu go w produkt. Przy tym enzym może zniekształcić substrat wymuszając w nim konformację podobną do stanu przejściowego. Przykładem może być wiązanie glukozy z heksokinazą.
Centrum aktywne enzymów. Centrum aktywne to określony obszar cząsteczki białka enzymatycznego, w którym podczas katalizy następuje wiązanie substratu i następnie jego przekształcenie w produkt względnie produkty reakcji. Specyficzność kierunkowa i substratowa enzymów, a także wiele ich właściwości, zdeterminowanych jest budową centrum aktywnego. Przyjmuje się, że centrum aktywne enzymów zlokalizowane jest w głębi globularnej cząsteczki białka w kieszonce kształtem przypominającej szczelinę lub rowek. Obszar centrum aktywnego w przeważającej ilości tworzą reszty aminokwasów o właściwościach hydrofobowych, a co za tym idzie, panują w tym obszarze warunki hydrofobowe. Tak więc, jest to mikrośrodowisko o małej stałej dielektrycznej, a stąd o zwielokrotnionych oddziaływaniach elektrostatycznych. Dzięki temu możliwe jest rozluźnienie określonych wiązań kowalencyjnych w cząsteczce substratu i ich przekształcenie w inne układy wiązań.
Aminokwasy wchodzące w skład centrum aktywnego - z uwagi na funkcję, jaką pełnią - dzieli się na cztery kategorie:
aminokwas lub aminokwasy bezpośrednio działające; w enzymach złożonych ich rolę pełnią koenzymy lub grupy prostetyczne,
aminokwasy wspomagające,
aminokwasy kontaktowe, zwane również wiążącymi,
aminokwasy pomocnicze.
4.Wpływ pH ma aktywność
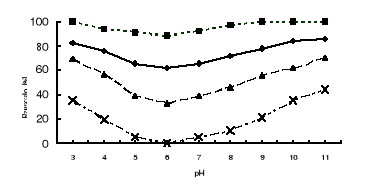
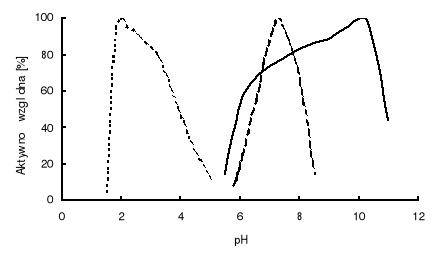
pH środowiska. Szybkość reakcji enzymatycznych w znacznym stopniu zależy od pH środowiska. Każdy enzym wykazuje charakterystyczne dla siebie optimum pH. Na poniższym rysunku przedstawiono wpływ pH na aktywność trzech endopeptydaz: pepsyny A (EC 3.4.23.1), bacillolizyny (EC 3.4.24.28) oraz subtilizyny (EC 3.4.21.62).
Wpływ pH na aktywność trzech różnych endopeptydaz
Jak widać, każda z tych endopeptydaz działa w zupełnie innym zakresie pH: pepsyna w środowisku kwaśnym (optymalne pH 1,8), bacillolizyna w obojętnym (optymalne pH 7,3), a subtilizyna w alkalicznym (optymalne pH 10,2). Związane jest to z wpływem stężenie jonów hydronowych na konformację centrum aktywnego każdej z nich. Pepsyna, której aminokwasem bezpośrednio działającym w centrum aktywnym jest kwas asparaginowy, wymaga jego formy niezdysocjowanej (czyli grupy -COOH). Grupa taka w przewadze występuje w środowisku kwaśnym. Endopeptydazy serynowe, których centrum aktywne opisano wyżej, wymagają do aktywnego działania zdysocjowanej formy kwasu asparaginowego (grupy karboksylanowej -COO-), która występuje w przewadze w środowisku alkalicznym.
Należy zwrócić uwagę na to, że o ile subtilizyna jest aktywna w szerokim zakresie pH od 6 do 11, to pozostałe dwie endopeptydazy działają w bardzo wąskim przedziale pH i niewielkie jego zmiany wykazują znaczny wpływ na wzrost lub obniżenie ich aktywności. Optymalne pH niektórych enzymów (np. aktywność subtilizyny) zmieniać się może w zależności od substratu, na który działają, choć są to wahania nie większe niż 0.5 jednostki (np. subtilizyna wobec hemoglobiny optimum pH wykazuje przy 10,2, a wobec kazeiny 10,5).
5.Klasyfikacja enzymów
Pierwotne nazewnictwo enzymów było nieuporządkowane i dopuszczało stosowanie dowolnych nazw takich, jak pepsyna, papaina, subtilizyna. W późniejszym okresie nazwę enzymu wywodzono od typu reakcji lub substratu, na który działał, przy czym za charakterystyczną dla enzymów uznano końcówkę -aza (np. reduktaza, lipaza, itp.).
Od 1964 roku Komisja Enzymowa Międzynarodowej Unii Biochemicznej zaleciła stosowanie systematycznych nazw enzymów, składających się przeważnie z dwu części. Pierwsza jest utworzona od nazwy katalizowanej reakcji i określa jej rodzaj (np. oksydoreduktaza, glukohydrolaza, itp.). Druga część nazwy enzymu składa się z nazwy substratu lub substratów biorących udział w reakcji. Np.:
maltohydrolaza 1,4-α-D-glukanu (zwana oficjalnie i zwyczajowo β-amylazą) - EC 3.2.1.2,
oksydoreduktaza alkohol:NAD (oficjalnie zwana dehydrogenazą alkoholową) - EC 1.1.1.1.
Nazwy systematyczne enzymów są długie i często bardzo skomplikowane. Z tego powodu ich stosowanie napotyka na spory opór ze strony biochemików. Ponadto do wielu enzymów przylgnęły nazwy stosowane pierwotnie. Dlatego zdecydowano, że obok nazwy systematycznej, dopuszczalne jest stosowanie nazw zwyczajowych. Od 2000 roku ExPASy (Expert Protein Analysis System) zrzeszający wiele renomowanych ośrodków naukowych na świecie zaleca stosowanie tzw. nazw oficjalnych enzymów. Oficjalna nazwa enzymu (rekomendowana, zalecana) wywodzi się często od nazwy zwyczajowej. I tak np. nazwy α-amylaza lub papaina są nazwami oficjalnymi enzymów sklasyfikowanych odpowiednio pod numerami EC 3.2.1.1 oraz EC 3.4.22.2.
Należy jeszcze uzupełnić, że pierwotne, zwyczajowe nazwy niektórych enzymów (np. sacharaza, maltaza) okazały się w świetle aktualnej wiedzy bez pokrycia i dla nich nie zaleca się ich stosowania. Ponadto zdarza się, że pod jedną i tą samą nazwą zwyczajową są znane nawet trzy różne enzymy, np. tyrozynaza. Nazwa „tyrozynaza” dla dwóch z nich oczywiście jest nazwą błędną.
W numerze 1 czasopisma "Postępy Biochemii" z 1985 roku zamieszczono słownik zalecanych i zwyczajowych nazw enzymów w języku polskim.
Wszystkie poznane enzymy zostały ujęte przez Komisję Enzymową w jednolity system klasyfikacji (EC). Każdy enzym w ramach tego systemu posiada odpowiedni numer złożony z czterech członów liczbowych oddzielonych kropkami (np. dehydrogenaza alkoholowa ma numer EC 1.1.1.1). Podanie tego numeru jednoznacznie określa konkretny enzym, co pozwala uniknąć nieporozumień i pomyłek. Zasady klasyfikacji i numeracji zbadanych enzymów oparte zostały o ich specyficzność kierunkową (rodzaj katalizowanej reakcji) i substratową. Wszystkie enzymy podzielono na sześć głównych klas:
EC.1. Oksydoreduktazy - enzymy katalizujące reakcje odłączania lub przyłączania atomów wodoru, przyłączenia atomu tlenu lub przenoszenia elektronów.
EC.2. Transferazy - enzymy przenoszące grupy funkcyjne, rodniki, fragmenty cząsteczek itp.
EC 3. Hydrolazy - enzymy katalizujące reakcje hydrolizy.
EC 4. Liazy - enzymy niehydrolitycznie rozrywające wiązania.
EC 5. Izomerazy - enzymy katalizujące przemiany wewnątrzcząsteczkowe (racemizacja, izomeryzacja, przenoszenie grup itp.).
EC 6. Ligazy - enzymy syntetyzujące, katalizujące tworzenie wiązań.
Każda klasa główna dzieli się na szereg podklas, których kolejne numery stanowią drugi człon numeru klasyfikacyjnego i wynikają, ogólnie biorąc, z uściślonej specyficzności kierunkowej. Na przykład EC.3.4. jest numerem podklasy hydrolaz peptydowych, czyli enzymów hydrolizujących wiązanie peptydowe. W obrębie podklas rozróżnia się pod-podklasy - trzeci człon numeru klasyfikacyjnego. Określa on dokładniej specyfikę katalizowanej reakcji. Dla oksydoreduktaz określa grupę funkcyjną będącą akceptorem; dla transferaz uściśla rodzaj przenoszonej grupy; dla hydrolaz - typ hydrolizowanego wiązania; dla liaz - rodzaj odszczepianej grupy; dla izomeraz - charakter przekształcenia i wreszcie dla ligaz - rodzaj powstałego związku.
Dostęp do internetowej bazy danych dotyczącej nomenklatury enzymów (Enzyme Nomenclature Database) można znaleźć pod adresem http://www.expasy.org/enzyme/. Na następnej stronie przykładowo pokazano stronę internetową ExPASy dla dehydrogenazy alkoholowej - EC 1.1.1.1.
6.ATP
Reasumując, rola ATP jako kosubstratu w reakcjach enzymatycznych jest następująca:
ATP jako donor energii swobodnej w reakcjach syntez katalizowanych przez ligazy. W większości takich przypadków ATP ulega rozkładowi do AMP + PPi. Jak już wspomniano, ilość energii swobodnej dostarczona do takiego układu jest równoważna ΔG =−58 kJ/mol, co wystarcza do przeprowadzenia rozmaitych syntez, niekiedy nawet związków wysokoenergetycznych. Za przykład niech posłuży synteza acetylo~SCoA katalizowana przez syntetazę acetylo-CoA (EC 6.2.1.1).
ATP dużo rzadziej, jako koenzym ligaz, ulega podczas reakcji rozkładowi do ADP. Tym niemniej znanych jest sporo i takich przypadków. Dla podkreślenia, że ATP rozkłada się jedynie do ADP w nazwie ligazy w nawiasie umieszcza się (ADP-tworząca). Jako przykład podana zostanie syntetaza acetylo-CoA (ADP-tworząca) - EC 6.2.1.13. Wybrano ją celowo, gdyż tylko wyjątkowo niektóre bakterie posiadają ten enzym, a z energetycznego „punktu widzenia” komórki jest on korzystniejszy od wcześniej opisanej syntetazy acetylo-CoA.
ATP jako donor ortofosforanu. Odpowiednie transferazy (kinazy) przenoszą rodnik fosforanowy na rozmaite substraty, np. na monosacharydy, glicerol, nukleozydy, itp. Za przykład posłuży synteza NADPH z NADH katalizowana przez kinazę NADH (EC 2.7.1.86).
Na marginesie omawianego zagadnienia warto zwrócić uwagę na fakt, że w wyjątkowych sytuacjach źródłem ortofosforanu może być pirofosforan. Nie powinno to budzić większego zdziwienia, bowiem energia swobodna jego hydrolizy ΔG =−27 kJ/mol. Przykładem może być kinaza octanowa (pirofosforanowa) - EC 2.7.2.12, katalizująca przeniesienie fosforanu z PPi na kwas octowy z wytworzeniem acetylofosforanu.
ATP jako donor pirofosforanu. W niektórych przypadkach konieczne jest przyłączenie do substratu rodnika pirofosforanowego. Jego donorem jest ATP, a reakcję katalizują pirofosfokinazy. Jako przykład może posłużyć synteza difosfotiaminy z tiaminy. Reakcję katalizuje pirofosfokinaza tiaminowa (EC 2.7.6.2).
ATP jako donor rodnika adenylilowego. Adenylacja to reakcja przeniesienia rodnika adenylilowego z ATP na substrat z jednoczesnym odłączeniem PPi. Reakcja ta ma podstawowe znaczenie dla syntezy dinukleotydów adenilowych i związków o podobnej budowie (choćby wspomnianego wcześniej CoASH). Reakcję katalizują adenylilotransferazy (zwane zwyczajowo pirofosforylazami). Jako przykład posłuży synteza FAD z FMN katalizowana przez adenylilotransferazę FMN (EC 2.7.7.2).
Ale enzymy z pod-podklasy EC 2.7.7. mogą również transportować inne nukleotydilowe rodniki z nukleotydotrifosforanów. Jedną z takich reakcji o podstawowym znaczeniu dla procesów biochemicznych jest synteza UDPG (urydyliloglukozy). Reakcja katalizowana jest przez urydylilotransferazę glukozo-1-fosforanową (EC 2.7.7.9).
ATP jako donor adenozyny. W pewnych szczególnych przypadkach ATP staje się donorem adenozyny. Przykładem może być synteza adenozynometioniny. Koenzym ten powstaje w reakcji metioniny z ATP, katalizowanej przez adenozynotransferazę metioninową (EC 2.5.1.6).
Kolokwium nr 3
Część 1
1.Metabolizm komórkowy +def.
Metabolizm to całokształt przemian materii i energii zachodzących w żywej komórce. Wszystkie procesy metaboliczne łączą się w komórce w całość i wzajemnie się uzupełniają. Na metabolizm składają się głównie procesy kataboliczne (szlaki kataboliczne) i anaboliczne (szlaki anaboliczne). W toku tych przemian energia uzyskana z rozkładu jednych związków organicznych, użyta zostaje do syntezy innych związków. W komórkach mogą jednak równocześnie przebiegać inne reakcje czy nawet długie szlaki o charakterze biochemicznym np.: biodegradacyjne, peryferyjne, anaplerotyczne czy amfiboliczne.
Katabolizm to ogół reakcji rozkładu złożonych związków organicznych na produkty proste, zawierające mniejszą ilość energii swobodnej aniżeli wyjściowe substraty. Uwalniana energia chemiczna, przetwarzana jest w wysokoenergetyczne związki typu ATP. Szlaki kataboliczne to ciągi reakcji enzymatycznych, w których następuje rozkład dużych i skomplikowanych związków organicznych na mniejsze.
Można przyjąć, że głównym celem przemian katabolicznych jest pozyskanie energii ze „spalenia enzymatycznego” związków organicznych, które dają się „spalić” w komórce. Przykładowo, u człowieka będzie to rozkład sacharozy lub tłuszczów, a u bakterii metylotroficznych wykorzystanie metanu lub innych n-alkanów.
Pełny katabolizm można rozpatrywać w kategorii mineralizacji: w tym układzie końcowe produkty reakcji katabolicznych są związkami nieorganicznymi (m.in. CO2, H2O, NH4+, SO42-, itp.).
Anabolizm (szlaki anaboliczne). To zespół reakcji, w których są syntetyzowane składniki budulcowe komórki o skomplikowanych strukturach, ze związków o prostej budowie, doprowadzanych do komórki z zewnątrz lub powstających podczas katabolizmu komórkowego. Reakcje syntezy wymagają energii i stąd nazywane są endoergicznymi. Przykładem reakcji anabolicznych jest: synteza enzymów, składników ściany komórkowej drobnoustrojów, itp.
Biodegradacja (szlaki biodegradacyjne). To enzymatyczny rozkład złożonych, najczęściej sztucznie wyprodukowanych przez człowieka związków organicznych, zaliczanych do kategorii ksenobiotyków (czyli substancji obcych dla środowiska naturalnego), na prostsze składniki chemiczne przez bakterie, grzyby, pierwotniaki i glony. O ile to możliwe komórki Prokaryota mineralizują ksenobiotyki z wykorzystaniem energii swobodnej w nich zawartej. Celem biodegradacji jest usunięcie tych związków ze środowiska, gdyż są potencjalnym zagrożeniem dla żywej komórki.
Niektóre z tych szlaków mogą być nawet kilkunastoetapowe (np. biodegradacja antracenu lub fenantrenu). Może się zdarzyć, że niektóre z enzymów występujących w tych szlakach są kodowane w plazmidach.
Procesem pokrewnym do biodegradacji jest detoksykacja. Mianem tym określa się procesy, w wyniku których toksyczne dla środowiska (a w zasadzie, dla żywej komórki) substancje chemiczne są przekształcane w związki nietoksyczne, które z kolei dalej są biodegradowane, mineralizowane, asymilowane lub w ostateczności odkładane poza komórką.
Szlaki amfiboliczne - wielofunkcyjne. Przebiegają one niejako w poprzek innych szlaków. Ich metabolity pośrednie występują i są wykorzystywane w innych szlakach. Można uznać, że stanowią one „skrzyżowanie wielu dróg” metabolicznych, łącząc między sobą inne szlaki (anabolityczne, katabolityczne i biodegradacyjne). Najlepszym przykładem tego typu szlaków jest cykl Krebsa (a wśród wspomnianych metabolitów pośrednich: jabłczan, α-ketoglutaran czy bursztynylo~SCoA).
Reakcje (szlaki) anaplerotyczne. W tym przypadku, poprawne jest użycie pojęcia „reakcje anaplerotyczne” (aczkolwiek w literaturze mówi się często „szlaki anaplerotyczne”). Z reguły są to jednoetapowe (rzadko dwuetapowe) reakcje enzymatyczne, których zadaniem jest uzupełnienie w komórce pewnych ważnych, dla całości metabolizmu, związków chemicznych. Reakcje te dostarczają deficytowych substratów, m.in. do cyklu Krebsa, do intradiolowego szlaku katecholowego, itp.
Szlaki peryferyjne. W zasadzie, szlaki peryferyjne można zaliczyć do kategorii szlaków anabolicznych - w efekcie ich przebiegu powstają związki chemiczne zwane w „Ekologii Biochemicznej” metabolitami wtórnymi. Jednakże szlaki te, wyróżniają się tym, że przebiegają na poboczu (peryferiach) głównych szlaków metabolicznych - niejako w ich „cieniu”. Część enzymów występujących w tych szlakach, bywa kodowana w plazmidach.
Metabolity wtórne to substancje o różnorodnej budowie chemicznej wytwarzane podczas metabolizmu komórkowego i wydzielane przez żywe organizmy do środowiska w niewielkich ilościach, nie będące dla nich źródłem energii ani składnikiem strukturalnym, a odgrywające głównie rolę nośników informacji lub regulatorów procesów ekologicznych, w tym w oddziaływaniach pomiędzy żywymi organizmami.
2.Cykl Krebsa, a cykl glioksalowy: różnice, role
3.Enzymy amylolityczne
Depolimeryzacja skrobi do glukozy: Enzymy amylolityczne
Makromolekuła taka, jak skrobia nie może być bezpośrednio wchłonięta przez komórkę. Musi ona zostać wcześniej rozłożona na mniejsze cząsteczki.
W naszym organizmie proces enzymatycznego rozkładu skrobi zapoczątkowany zostaje już w jamie ustnej podczas żucia pokarmu. Ślina zawiera enzym α-amylazę „ślinową” - zwaną w medycynie ptialiną, która rozszczepia wiązania α-1,4-glikozydowe występujące w skrobi. Dzięki jej działaniu amyloza rozkłada się nawet do maltozy i maltotriozy, a amylopektyna do α-dekstryn, związków zbudowanych z kilku do kilkunastu cząsteczek glukozy połączonych wiązaniami α-1,4 i jednym, rzadko dwoma wiązaniami α-1,6. Nazwa α-dekstryny wskazuje, że są to produkty działania α-amylazy (odpowiednio β-dekstryny są produktami działania β-amylazy). Ptialina może działać jedynie w obrębie jamy ustnej i przełyku, dlatego że jej optymalne pH wynosi 6,7 (nie działa już w żołądku, gdzie pH obniża się nawet do 1,5). Aktywatorem α-amylazy „ślinowej” są jony Cl-.
Powstałe α-dekstryny trawione są dopiero w dwunastnicy pod wpływem α-amylazy trzustkowej. Ta odmiana α-amylazy działa dużo dłużej, w porównaniu ze ślinową i w efekcie jej działania powstają: glukoza, maltoza, izomaltoza (wszystkie trzy w niewielkich ilościach) oraz α-dekstryny graniczne - krótkołańcuchowe polimery glukozy o 3-4 cząsteczkach glukozy połączonych wiązaniami α-1,4-glikozydowymi zawierające jedno wiązanie α-1,6 (z wyjątkiem maltotriozy). α-Dekstryny graniczne z chemicznego punktu widzenia są oligosacharydami. Disacharydy: maltoza i izomaltoza już w pewnym, choć niewielkim stopniu mogą być wchłaniane do krwi. Jednakże z reguły zarówno one, jak i α-dekstryny graniczne ulegają w kolejnym etapie trawienia dalszej hydrolizie do glukozy, na powierzchni komórek pokrywających jelito cienkie przy udziale glukoamylazy i glukozydazy amylopektynowej (oficjalne nazwy i numery EC tych enzymów oraz ich właściwości omówione zostaną w dalszej części tego rozdziału). W podobny sposób, jak skrobia w naszym organizmie ulega trawieniu glikogen.
Natomiast u roślin, a zwłaszcza u drobnoustrojów znaleziono dużo więcej enzymów depolimeryzujących skrobię.
Enzymy rozkładające skrobię ogólnie nazywa się je enzymami amylolitycznymi. Należą one klasy hydrolaz - EC 3., podklasy glukozylaz - EC 3.2., pod-podklasy glukozydaz - EC 3.2.1. Poniżej scharakteryzowano najważniejsze z nich. O kolejności ich omawiania zdecydowało biotechnologiczne znaczenie (przyjęte według uznania autora podręcznika). Dla niektórych enzymów, obok nazwy oficjalnej (rekomendowanej przez ExPASy), podano dla porównania nazwę systematyczną.
α-amylaza - EC 3.2.1.1. Nazwa systematyczna: glukanohydrolaza α-1,4-D-glukanu. Jest to tzw. "amylaza dekstrynująca". W sposób losowy rozszczepia wiązania α-1,4-glikozydowe wewnątrz łańcucha - jest więc endoenzymem. Nie potrafi rozszczepiać wiązania α-1,6-glikozydowego. Wiązanie α-1,4 rozszczepia jedynie wtedy, gdy obok siebie znajdują się trzy cząsteczki glukozy połączone takimi wiązaniami i jednocześnie przy środkowej cząsteczce brak jest wiązania α-1,6.
Wskutek jej działania szybko spada lepkość roztworów skrobiowych, gdyż α-amylaza może „rozpołowić” cząsteczkę amylozy lub amylopektyny, a lepkość roztworów skrobi zależy od jej stopnia spolimeryzowania (długości łańcucha). Przy dłuższym działaniu na skrobię kolejno pojawiają się amylodekstryny, erytrodekstryny, achrodekstryny i wreszcie na koniec α-dekstryny graniczne oraz pewne ilości glukozy, maltozy i izomaltozy. Grupy hydroksylowe przy 1 atomie węgla glukozy uwalniane w wyniku jej działania występują w konfiguracji α.
Atakuje skrobię, glikogen i spokrewnione poli- i oligosacharydy.
β-amylaza - EC 3.2.1.2. Nazwa systematyczna: maltohydrolaza α-1,4-D-glukanu. Jest to tzw. "amylaza cukrująca". Hydrolizuje wiązania α-1,4-glikozydowe, co drugie, od końca nieredukującego, odszczepiając maltozę - jest więc egzoenzymem. Nie rozszczepia wiązań α-1,6-glikozydowych, dlatego rozkłada ona amylopektynę tylko w 65% pozostawiając "rdzeń", tzw. β-dekstrynę graniczną, w której pozostają niezhydrolizowane wszystkie wiązanie α-1,6, czyli rozgałęzienia. Szeroko rozpowszechniona u roślin, spotykana też u niektórych gatunków bakterii z rodzaju Bacillus.
Wskutek jej działania lepkość roztworów skrobiowych obniża się bardzo powoli, (bo wolno przebiega skracanie łańcucha amylozy i amylopektyny), natomiast względnie szybko pojawiają się cukry redukujące (maltoza). Przy długim działaniu w roztworach skrobi stwierdza się jedynie obecność maltozy i β-dekstryn granicznych. Uwalniana ze skrobi maltoza występuje w konfiguracji β.
Atakuje skrobię, glikogen i spokrewnione poli- i oligosacharydy.
α-1,4-glukozydaza glukanowa - EC 3.2.1.3. Nazwa systematyczna: glukohydrolaza α-l,4-D-glukanu. Znana w biotechnologii jako glukoamylaza lub amyloglukozydaza, jeszcze dawniej nazywana γ-amylazą.
Hydrolizuje terminalne wiązanie α-1,4-glikozydowe, sukcesywnie odrywając od nieredukującego końca łańcucha cząsteczki β-D-glukozy. Większość znanych form tego enzymu może również względnie szybko hydrolitycznie rozszczepiać napotkane po drodze wiązanie α-1,6-glikozydowe, ale pod warunkiem, że następne w sekwencji jest wiązanie α-1,4-glikozydowe. W amylopektynie szybkość hydrolizy wiązania α-1,6-glikozydowego jest, tym niemniej, prawie 30 razy mniejsza od szybkości rozszczepienia wiązania α-1,4- w amylozie.
Niektóre preparaty bakteryjne tego enzymu mogą hydrolizować wiązania α-1,6- i α-1,3-D-glikozydowe również w innych polisacharydach. Enzym działa dużo szybciej na polisacharydy aniżeli na oligosacharydy.
oligo-1,6-glukozydaza - EC 3.2.1.10. Nazwa systematyczna: α-1,6-glukozydaza oligosachary- dowa. Znana też jako izomaltaza. Hydrolizuje wiązania α-1,6-glikozydowe w wielu oligosacharydach powstających podczas rozkładu skrobi i glikogenu przez α-amylazę, ale także rozszczepia wiązanie α-1,6 w izomaltozie.
Ponadto, enzym ten - podobnie jak amylo-α-1,6-glukozydaza (EC 3.2.1.33) - może hydrolizować wiązanie α-1,6-glikozydowe w krótkich łańcuchach, które mogą się pojawiać przy działaniu pullulanazy (EC 3.2.1.41) i izoamylazy (EC 3.2.1.68).
dekstrynaza graniczna - EC 3.2.1.142. Systematyczna nazwa: α-1,6-glukanohydrolaza dekstrynowa. Znana również jako glukozydaza amylopektynowa, bądź R-enzym. Hydrolizuje wiązania α-1,6-glikozydowe w α- i β-dekstrynach granicznych powstałych z amylopektyny, glikogenu oraz z pullulanu. W pełni rozkłada do glukozy α-dekstryny graniczne. Natomiast, enzym roślinny w zasadzie nie działa na glikogen.
izoamylaza - EC 3.2.1.68. Nazwa systematyczna: alfa-1,6-glukanohydrolaza glikogenowa. Hydrolitycznie rozszczepia wiązanie α-1,6-glikozydowe w glikogenie, amylopektynie i β-dekstrynach granicznych, usuwając rozgałęzienia. Różni się od dekstrynazy granicznej (EC 3.2.1.142) i pullulanazy (EC 3.2.1.41) tym, że nie jest w stanie hydrolizować pullulanu i α-dekstryn granicznych.
Obok wymienionych wyżej enzymów na amylopektynę może działać jeszcze kilka innych, np.:
α-1,6-glukozydaza glukanowa (EC 3.2.1.70) wytwarzana przez bakterie z rodzaju Streptococcus. Enzym hydrolizuje wiązanie α-1,6-D-glikozydowe w α-1,6-D-glukanach i pochodnych oligosacharydach, ale na dekstran i izomaltosacharydy działa bardzo wolno.
pullulanaza (EC 3.2.1.41). Hydrolizuje wiązanie α-1,6-D-glikozydowe w pullulanie, w amylopektynie i glikogenie a także w α- i β-deksretnach granicznych.
α-glukozydaza (EC 3.2.1.20) - została szczegółowo opisana w grupie sacharydaz.
4.II faza katabolizmu
II faza - obejmuje przemiany enzymatyczne (szlaki i cykle kataboliczne oraz biodegradacyjne), a także pojedyncze przekształcenia enzymatyczne rozmaitych metabolitów pośrednich, powstałych w I fazie katabolizmu, a także innych przyswajanych przez komórkę względnie prostych związków organicznych. Końcowym produktem II fazy katabolizmu komórkowego jest zazwyczaj acetylo~SCoA. Wyjątkowo podczas katabolizmu aminokwasów, a także u niektórych Procaryota w pewnych szlakach biodegradacyjnych mogą powstawać inne proste związki, łatwo włączane w cykl Krebsa (np. szczawiooctan, α-ketoglutaran, bursztynian, bursztynylo~SCoA, fumaran lub jabłczan).
U chemoorganotrofów eukariotycznych w tej II fazie przebiegają dobrze znane i rozpracowane szczegółowo od strony biochemicznej szlaki, cykle lub transformacje kataboliczne:
- glikoliza - przebiega w cytoplazmie: polega na wieloetapowej przemianie cząsteczki glukozy w pirogronian.
- dekarboksylacja oksydacyjna (α-ODC) - u Eucaryota przebiega w błonie mitochondrialnej, u Procaryota w cytoplazmie na styku z membraną cytoplazmatyczną: polega na przekształceniu pirogronianu do acetylo~SCoA. Pirogronian jest węzłowym metabolitem wewnątrzkomórkowym; jest ostatnim metabolitem glikolizy oraz większości przemian katabolicznych aminokwasów. Swobodnie przenika z cytoplazmy do matrixu, po drodze ulegając właśnie tam α-ODC.
- β-oksydacja - przebiega w matrixie, polega na konwersji wyższych kwasów tłuszczowych do acetylo-CoA.
- cykl pentozowy - przebiega w cytoplazmie: dostarcza NADPH wykorzystywanego do syntezy tłuszczów, cholesterolu i nukleotydów, a także dostarcza „strategicznego” składnika do syntezy RNA i DNA - rybozo-5-fosforanu. W sprzężeniu z łańcuchem oddechowym, równie dobrze może być dostarczycielem energii chemicznej dla komórki w formie ATP.
- przemiany aminokwasów: deaminacja, transaminacja, katabolizm szkieletów węglowych pozostałych po deaminacji (m.in. szlak homogentyzynianowy, szlak kinureninowo-antranilanowy, katabolizm rodników rozgałęzionych aminokwasów, itp.).
Ponadto u chemoorganotrofów prokariotycznych można znaleźć:
- szlak Entnera-Doudorffa, alternatywny szlak przemian glukozy do pirogronianu. Spotykany bywa jedynie w komórkach Procaryota;
- transformacje enzymatyczne względnie prostych związków organicznych o charakterze ksenobiotyków (np. aniliny, fenolu, toluenu, itp.) do jednego z 9-ciu głównych metabolitów pośrednich procesów biodegradacyjnych;
- szlaki rozkładu 9-ciu głównych metabolitów pośrednich procesów biodegradacyjnych (m.in. szlaki orto- i meta-katecholowe, szlaki protokatechanowe, szlak o-aminofenolowy, itp.);
- szlaki fermentacyjne.
5.Szlaki enzymatycznego spalania glukozy
pI
wsalanie
wysalanie
40%(NH4)2SO4
20%(NH4)2SO4
H2O
1%NaCl
5'
+
E
S
S
E
pepsyna
bacillolizyna
subtilizyna
Wyszukiwarka
Podobne podstrony:
kolokwium nr 1 ze statsystyki o Nieznany (3)
Kolokwium nr 3 - 111NC-A2 - 11062013-2003, astronawigacja, astro, Przykładowe kolokwia z astronawiga
Kolokwium nr 2 (2), Technologia chemiczna, Chemia fizyczna, 3 semestr, fizyczna paczi
071NI-Kol-04032009-2005, astronawigacja, astro, Przykładowe kolokwia z astronawigacji, Kolokwium nr
MR kolokwium nr 3, KN, rok I, Metodyka resocjalizacji
1-001N-T-A, astronawigacja, astro, Przykładowe kolokwia z astronawigacji, Kolokwium nr 1, Testy
Kolokwium nr 1 - teoria (poprawa2), astronawigacja, astro, Przykładowe kolokwia z astronawigacji, Ko
071N-Kol2-21012009-2005-poprawa1, astronawigacja, astro, Przykładowe kolokwia z astronawigacji, Kolo
MR kolokwium nr 5
grunty, teoria na kolokwium nr 2
Kolokwium nr 2 dwie strony
GIELDA 2012 MMIKROBIOLOGIA KOLOKWIUM NR 1 id 190706
dzisiaj teoria, astronawigacja, astro, Przykładowe kolokwia z astronawigacji, Kolokwium nr 1, Testy
081N-Kol2-19012010-2004, astronawigacja, astro, Przykładowe kolokwia z astronawigacji, Kolokwium nr
Kolokwium nr 3 - 101NC-A - Poprawa1 - 18052012 - 2005, astronawigacja, astro, Przykładowe kolokwia z
Kolokwium nr 3 - 101NC-A - 11052012 - 2003, astronawigacja, astro, Przykładowe kolokwia z astronawig
111NC-Z-11042013-1, astronawigacja, astro, Przykładowe kolokwia z astronawigacji, Kolokwium nr 1, Za
111NC-Z-07012013-2, astronawigacja, astro, Przykładowe kolokwia z astronawigacji, Kolokwium nr 1, Za
Petrologia węgla kolokwium nr. 1 ściąga, Studia, Petrologia węgla
więcej podobnych podstron