Wyznaczanie liczb przenoszenia jonów metodą Hittorfa |
|
|
Marcin Górski |
Data: |
|
Mirosław Dziergowski |
Zaliczenie: |
|
Cel ćwiczenia.
Celem ćwiczenia jest wyznaczenie liczb przenoszenia jonów K+ i OH- metodą Hittorfa.
Zasada pomiaru.
W celu wyznaczenia liczb przenoszenia jonów K+ i OH- elektrolizie poddaje się rozcieńczony roztwór KOH.
Schemat układu pomiarowego.
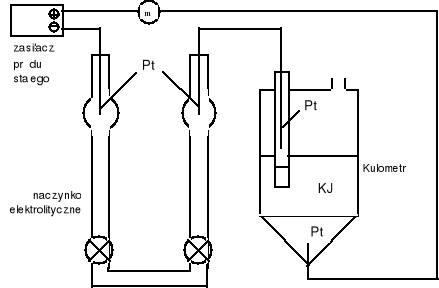
Wyniki pomiarów.
Przestrzeń katodowa przed elektrolizą
|
Przestrzeń anodowa przed elektrolizą |
||
V [KOH] [ml] |
17,2 |
V [KOH] [ml] |
19,3 |
V [HCl] [ml] |
16,7 |
V [HCl] [ml] |
18,9 |
Przestrzeń katodowa po elektrolizie
|
Przestrzeń anodowa po elektrolizie |
||
V [KOH] [ml] |
17,4 |
V [KOH] [ml] |
18,8 |
V [HCl] [ml] |
16,9 |
V [HCl] [ml] |
17,8 |
V [Na2S2O3] [ml] |
24,0 |
Roztwory:
0,1M KOH
0,1M HCl
0,01M Na2S2O3
Obliczenia.
Czas trwania elektrolizy: 2 godziny,
Natężenie prądu płynącego podczas elektrolizy: 5 mA,
Temperatura: (zał. 18oC).
Przeliczenie objętości HCl użytych do zmiareczkowania KOH (na równe objętości).
Anoda.
19,3 [ml] KOH - 18,9 [ml] HCl
18,8 [ml] KOH - x [ml] HCl
czyli, x = HCl
Katoda.
17,2 [ml] KOH - 16,7 [ml] HCl
17,4 [ml] KOH - x [ml] HCl
czyli, x = HCl
Objętości HCl [ml] |
||
|
Katoda |
Anoda |
Przed elektolizą |
16,894 |
18,410 |
Po elektrolizie |
16,900 |
17,800 |
Ilość gramorównoważników jonów OH- w przestrzeni katodowej i anodowej.
Na zobojętnienie 1 mola KOH kwasem solnym przypada 1 mol HCl. Stężenia HCl i KOH są takie same, czyli objętość HCl zużyta do zmiareczkowania KOH jest taka sama.
Ponieważ, roztwór 0,1M KOH jest jednocześnie roztworem 0,1N tzn., że ilość moli równa się ilości gramorównoważników.
,gdzie nOA nA - ilość gramorównoważników OH- przed i po elektrolizie w przestrzeni anodowej,
nOK nK - ilość gramorównoważników OH- przed i po elektrolizie w przestrzeni katodowej.
Ilość gramorównoważników jodu wydzielonego w kulometrze.
Do zmiareczkowania jodu wydzielonego w kulomerze zużyto 24[ml] 0,01M tiosiarczanu sodu.
CN = CM ⋅ wart. CN = 0,01⋅2 = 0,02 [gR/dm3].
1 gR jodu - 2 gR tiosiarczanu
x gR jodu - 0,02⋅0,024 gR tiosiarczanu
x = 2,4⋅10-4 gR jodu.
Liczba przenoszenia jonów K+ w 0,1M KOH.
Wartość średnią liczby przenoszenia jonu K+ obliczamy wg. wzoru:
czyli,
5. Liczba przenoszenia jonów OH- w 0,1M KOH.
Ponieważ, , czyli .
Wnioski.
A. W przypadku elektrolizy roztworu KOH zachodzą reakcje:
K(-) H2O + 2e → H2 + 2OH-
A(+) 2OH- - 2e → 0.5O2 + H2O
Można, więc stwierdzić, że po przepływie ładunku Q na ujemnie naładowaniej katodzie będzie przybywać (zachodzi alkalizowanie) jonów OH-, natomiast na dodatnio naładowanej anodzie będzie zachodzić utlenianie jonów OH-.
Zmianę stężeń w obydwu przestrzeniach przedstawimy na prostym przykładzie:
Jeżeli założymy, że w każdej z przestrzeni (katodowej, środkowej, anodowej) znajduje się na początku 10 gramorównoważników K+ i OH-; że ruchliwość poruszania się jonu OH- jest 3 razy większa od ruchliwości jonu K+ (w rzeczywistości ruchliwość OH- w temp. 25oC wynosi 20,5⋅10-8 [m2⋅s-1⋅V-1], a ruchliwość K+ 7,61⋅10-8 [m2⋅s-1⋅V-1]), to po przeprowadzeniu 4 faradajów elektryczności w przestrzeni katodowej przybędzie podczas reakcji elektrodowej 4 gramorównoważni-ków jonów OH-, a w przestrzeni anodowej ubędzie 4 gR tych jonów. W tym samym czasie z przestrzeni katodowej wywędrują do środkowej, a z środkowej do anodowej 3 gR jonów OH- (ich ruchliwość jest 3 razy większa od jonów K+), a z przestrzeni anodowej do środkowej, a z środkowej do katodowej zawędruje tylko 1 gR jonów K+. W rezultacie po zakończeniu elektrolizy zmiana stężeń w przestrzeni katodowej przedstawia się następująco:
Δnk = 10+4-3-10 = 1 gR jonów OH- i Δnk = 10+0+1-10 = 1 gR jonów K+
a w przestrzeni anodowej:
Δnk = 10-4+3-10 = -1 gR jonów OH- i Δnk = 10+0-1-10 = -1 gR jonów K+
a przestrzeni środkowej nie nastąpiła zmiana stężenia:
Δnk = 10+3-3-10 = 0 gR jonów OH- i Δnk = 10+1-1-10 = 0 gR jonów K+
Jak widać w każdej z przestrzeni roztwory są elektrycznie obojętne, różnią się jedynie stężeniami. Jednagrze w wyniku wyższej ruchliwości anionów, aniony poruszające się 3 razy szybciej od kationów, przeniosły 3 razy większy ładunek. Zmiana stężenia nastąpiła tylko w przestrzeniach katodowej i anodowej w wyniku dwóch procesów: reakcji elektrodowej oraz migracji jonów w polu elektrycznym. Na podstawie tych zmian można obliczyć liczby przenoszenia.
B. Reakcje elektrodowe w kulometrze.
K(-) H2O + 2e → H2 + 2OH-
A(+) 2J- - 2e → J2
C. Oszacowanie ładunku jaki przepłynął przez kulometr.
gdzie, n - ilość gramorównoważników jodu (2,4⋅10-4)
F - stała Faradaya (równa 96500 C)
2,4⋅10-4 ⋅ 96500 = 23,16 C
Liczby przenoszenia jonów OH- są zdecydowanie większe o liczb przenoszenia jonów K+. Wynika to z dużo większej ruchliwości jonu OH- niż jonu K+ w roztworach wodnych. Duża ruchliwość jonu OH- związane są z faktem, że stanowią one produkty dysocjacji rozpuszczalnika. W innych rozpuszczalnikach ruchliwość jonu OH- zbliżona byłaby do ruchliwości innych jonów.
Także może być to spowodowane asocjacją wody. W przypadku gdy jon OH- zbliża się z jednej strony do mnóstwa cząsteczek wody, inny jon z drugiej strony może zostać natychmiastowo uwolniony. Dzięki temu prędkość przenoszenia ładunku przez jony OH- znaczenie wzrasta.
Według danych literaturowych liczby przenoszenia elektrolitu KOH o stężeniu 0,1 [mol/l] w tempera-turze 18oC wynoszą:
Wyszukiwarka
Podobne podstrony:
Adsorpcja jodu na wŕglu, technologia chemiczna, chemia fizyczna, srawozdania
Korozja metali, technologia chemiczna, chemia fizyczna, srawozdania
Punkt izoelektryczny, technologia chemiczna, chemia fizyczna, srawozdania
Ciep-o spalania, technologia chemiczna, chemia fizyczna, srawozdania
Ciecz-cia-o sta-e, technologia chemiczna, chemia fizyczna, srawozdania
Szeregi Hoffmeistera, technologia chemiczna, chemia fizyczna, srawozdania
Napiŕcie powierzchniowe, technologia chemiczna, chemia fizyczna, srawozdania
Kriometria, technologia chemiczna, chemia fizyczna, srawozdania
Si-a jonowa, technologia chemiczna, chemia fizyczna, srawozdania
SEM ogniwa, technologia chemiczna, chemia fizyczna, srawozdania
Ciep-o rozpuszczania, technologia chemiczna, chemia fizyczna, srawozdania
Kolokwium nr 2 (2), Technologia chemiczna, Chemia fizyczna, 3 semestr, fizyczna paczi
SEM ogniwa1, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, SEM ogniwa
5.5L, technologia chemiczna, chemia fizyczna, sprawozdania z chemi fizycznej, 5.5
Badanie równowagi fazowej w układzie trójskładnikowym 8.3, Technologia chemiczna, Chemia fizyczna, l
elektrolityzadania st, Technologia chemiczna, Chemia fizyczna, laboratorium
Zadania sem.2, Technologia chemiczna, Chemia fizyczna, Egzamin, zadana na egzamin
więcej podobnych podstron